Онтогенез, 2020, T. 51, № 1, стр. 3-18
Зародыш цветковых растений в критическую стадию относительной автономности эмбриогенеза (на примере злаков)
Н. Н. Круглова a, *, Г. Е. Титова b, c, О. А. Сельдимирова a, А. Е. Зинатуллина a, Д. С. Веселов a
a Уфимский Институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Россия
b Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова, 2, Россия
c Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
* E-mail: kruglova@anrb.ru
Поступила в редакцию 05.07.2019
После доработки 25.09.2019
Принята к публикации 30.09.2019
Аннотация
Автономность – особое структурно-функциональное состояние зародыша, отражающее его способность к саморегуляции, независимость от окружающих тканей и проявляющееся в способности завершить нормальный эмбриогенез вне материнского организма (полная автономность). Особый интерес вызывает относительная автономность как одна из критических стадий эмбриогенеза, когда незрелый зародыш становится независимым от ряда физиологических факторов материнского организма, в частности, гормонов (главным образом, ауксинов, цитокининов, АБК). В статье на примере культурных злаков и в сравнении с представителями других семейств цветковых растений приведен обзор литературных и собственных данных по выявлению как критической стадии относительной автономности зародыша в эмбриокультуре in vitro, так и морфологического, гистологического и физиологического статуса относительно автономных зародышей. Обсуждаются перспективы исследования проблемы относительной автономности эмбриогенеза растений, а также использования автономных зародышей в биотехнологических исследованиях.
ВВЕДЕНИЕ
Многочисленными эмбриологическими исследованиями различных видов растений установлено, что развитие зародыша (эмбриогенез) представляет собой единый процесс, в результате которого из исходной клетки – зиготы – формируется зрелый зародыш, обладающий всеми морфогенетическими потенциями взрослого растения (обзоры и монографии: Поддубная-Арнольди, 1976; Raghavan, 1976, 1997; Банникова, Хведынич, 1982; Goldberg et al., 1994; Meinke, 1995; Plant Embryoge-nesis, 1995; Терёхин, 1996; Эмбриология цветковых.., 1997, 2000; Reynolds, 1997; Батыгина, Васильева, 2002; Methods in Molecular Biology.., 2008; Harada et al., 2010; Батыгина, 2014). Зародыш развивается согласно определенным паттернам клеточных делений, а выявленные эмбриогенетические законы (закон происхождения, закон чисел, закон расположения, закон экономии, по: Шамров, 1997) отражают сложность этого процесса.
В то же время, в своем морфогенезе зародыш проходит ряд взаимосвязанных стадий (или, в терминологии различных авторов, – периодов, фаз, этапов), различающихся как по морфофизиологическим процессам, функциональной нагрузке, продолжительности, так и значению для дальнейшего развития. Каждая из стадий эмбриогенеза, несмотря на все разнообразие происходящих в это время процессов, направлена на реализацию морфогенетического потенциала зародыша и онтогенетической программы развития особи в целом, а зародыш демонстрирует свойства динамичной системы с пульсирующим характером функционирования своих элементов (Batygina, 2002, 2012; Батыгина, 2014).
Стадийность эмбриогенеза тесно связана с разработкой проблемы критических периодов (этапов, фаз, стадий) в онтогенезе растений. Понятие “критический период развития” широко используется в различных областях биологии развития растений, главным образом, сельскохозяйственных культур (Светлов, 1960; Сказкин, 1971; Батыгин, 1986, 1995, 2007; Лыкова, 2009; Терлецкая, 2012 и др.), при этом предлагаются различные критерии выделения таких периодов. В частности, хорошо известен критерий выделения критических периодов в развитии растений, основанный на их повышенной чувствительности к воздействию внешних факторов, впервые сформулированный П.И. Броуновым (1897, цит. по: Светлов, 1960).
В литературе представлены различные мнения о критериях выделения критических периодов (фаз, стадий) эмбриогенеза растений. Так, В.П. Банникова с соавт. (Основы эмбриогенеза…, 1991) считают критическими те фазы эмбриогенеза злаков, которые характеризуются повышенной чувствительностью зародышей к экстремальным условиям, вплоть до блокирования их развития. Т.Б. Батыгиной и В.Е. Васильевой (1983) в основу выделения критических стадий эмбриогенеза растений положен системный подход к дифференциации зародыша с учетом морфогенетических и морфофизиологических корреляций в развитии эмбриональных структур; при этом критическими стадиями авторы называют отрезки времени, характеризующиеся сменой структурно-функциональных характеристик в развитии зародыша и окружающих тканей семени и плода.
Идеи последних авторов получили развитие в цикле работ И.И. Шамрова с соавт. (Шамров, Никитичева, 1992; Шамров, Анисимова, 1993; Шамров, 1995, 1997; Shamrov, Anisimova, 2003; Шамров, 2008), посвященным периодизации развития семязачатка и семени цветковых растений. На основании морфогенетических и морфофизиологических корреляций критическими стадиями авторы называют относительно короткие отрезки времени, связанные со структурно-функциональными перестройками семязачатка и семени и названные по основной образующейся эмбриональной структуре, тогда как более продолжительные интервалы времени с относительно постоянным характером развития этих структур авторы относят к периодам (но не критическим). Как полагают эти исследователи, при определении критических стадий немаловажное значение имеет рассмотрение гистохимических аспектов: динамики накопления белков, углеводов, танинов в отдельных тканях. Сопоставление гистохимических реакций с морфологическими изменениями позволило оценить темпы дифференциации и функциональную активность разных типов тканей, уточнить последовательность развития семязачатка и семени. Исследователи предлагают выделять как общие стадии развития семязачатков, отражающие общие принципы организации этих структур и указывающие на пространственно-временную детерминацию их основных элементов, так и специфические стадии, указывающие на принадлежность семязачатка к определенному типу; при этом одни и те же специфические стадии развития семязачатков данного типа могут отличаться у разных таксонов, а виды с различными типами семязачатка могут иметь одни и те же специфические стадии (по: Шамров, 2008).
Как полагают F. Wareing и I. Phillips (1981), в критические стадии эмбриогенеза происходит переключение программы развития зародыша растений на альтернативные пути, а те или иные его части становятся “детерминированными” в отношении их дальнейшей дифференциации. Эта точка зрения во многом согласуется с понятием эмбриональной индукции у животных – взаимодействием эмбриональных закладок, ведущем к формообразовательному эффекту посредством ткани-мишени, которая становится детерминированной к определенному типу развития; затем детерминированное состояние ткани реализуется в процессе дифференциации (по: Корочкин, 2002). С этих позиций, автономность (независимость от материнского организма) может рассматриваться как одна из критических стадий эмбриогенеза растений, в ходе которой закрепляется жесткая детерминация пути развития зародыша как нового организма (по: Батыгина, 1987).
Проблема автономности зародыша и прогрессивной автономизации развития хорошо изучена И.И. Шмальгаузеном (1968) у позвоночных животных на значительном сравнительно-эмбриологическом и экспериментальном материале. Исследователь пришел к выводу, что “гомеостазис” (способность к саморегуляции, автономность) – одна из наиболее ярких характеристик живого, а автономизация онтогенеза – один из направленных процессов эволюции органического мира. Согласно автору, “… Развитие регуляторных систем и прогрессивная автономизация развития означают полную перестройку онтогенеза со всеми его факторами. Основное значение имеет при этом прогрессивное усложнение системы морфогенетических корреляций, создаваемых за счет элементарных выражений плейотропизма и постепенно приобретающих все более выраженный регуляторный характер. При этом достигается максимальная эволюционная пластичность организма, как за счет большого скрытого резерва изменчивости и связанной с нею мобильности, так и за счет индивидуальной приспособляемости и возможности быстрого фиксирования ее важнейших результатов. Это обеспечивает максимальные темпы эволюции высших животных с их большой индивидуальной приспособляемостью и автономным развитием, при высоко развитой системе регуляций.” (Шмальгаузен, 1968: с. 357).
Понятие “автономность зародыша” по отношению к растениям разработано в меньшей степени, хотя вопрос о самостоятельности зародыша и его независимости от материнского организма ставился в литературе, например, в связи с вопросами систематики и филогении цветковых растений (Тахтаджян, 1966), физиологической способности семян к автотрофному существованию и преждевременному прорастанию (Цингер, 1958; Raghavan, 1976; Батыгин, 1986, 1995; Терёхин, 1996; Обручева, Антипова, 1997; Николаева и др., 1999; Обручева, 2012, 2014).
Большой вклад в разработку проблемы автономности зародыша растений как биологического феномена внесли Т.Б. Батыгина и В.Е. Васильева (Батыгина, Васильева, 1983, 1987, 2002; Батыгина, 1987; Batygina, Vasilyeva, 1987, 1988; Васильева, Батыгина, 1997; Vasilyeva, Batygina, 2006). Эти авторы расценивают автономность как особое структурно-функциональное состояние развивающегося зародыша, отражающее его способность к саморегуляции, независимость от окружающих тканей и проявляющееся в способности завершить нормальный эмбриогенез вне материнского организма. Автономность зародыша, развивающегося в семени в естественных условиях, рассматривается ими как важный критический этап автономизации онтогенеза растений, характеризующийся комплексом видоспецифичных морфофизиологических показателей; с этапа автономизации зародыш (новый спорофит) переходит на относительно самостоятельный путь развития. Соглашаясь с идеей И.И. Шмальгаузена о прогрессивной автономизации эмбриогенеза как направленного процесса эволюции живых систем, авторы предлагают различать полную и относительную автономность зародыша растений. Полная автономность достигается по завершении прорастания семени и образования проростка (т.е. нового организма), когда прекращаются все структурные и функциональные связи зародыша с материнским организмом (плодом, семенем). У различных видов растений эта связь прекращается в разное время, что обусловлено конкретным строением семени и плода. Относительную автономность зародыш приобретает, когда становится независимым от физиологических и биохимических факторов материнского организма. Учитывая, что становление автономности – сложный длительный процесс, авторы полагают, что следует ввести и понятие “степень автономности” как количественное и временное выражение зависимости зародыша от материнского организма.
Выделение понятия относительной автономности, на наш взгляд, методологически весьма перспективно в теоретическом и особенно практическом отношениях. Действительно, относительная автономность эмбриогенеза во многом обусловлена структурными особенностями зародыша, и тем самым выявление этой критической стадии может способствовать решению ряда проблем теоретической морфологии и эволюции высших растений. Особенно это касается злаков, зрелый зародыш которых выделяется среди зародышей покрытосеменных растений своими специфическими органами и Graminad-типом эмбриогенеза (Батыгина, 1968а, 1968б, 1974, 1987, 1997б; Поддубная-Арнольди, 1978, 1982; Сравнительная эмбриология…, 1990; Основы эмбриогенеза злаков, 1991; Батыгина, 1997а; Батыгина, Васильева, 2002; Круглова и др., 2019б).
В последние годы возрастает и практический интерес к эмбриогенезу злаков при разработке различных проблем эмбриокультуры in vitro (обзоры: Raghavan, 2003; Elhiti, Stasolla, 2011; Plant Embryo Culture…, 2011; Hussain et al., 2012) как способа биотехнологических исследований представителей этого семейства (Круглова, Катасонова, 2009; Игнатова, 2011; Круглова, Сельдимирова, 2011; Круглова, 2012а; Rostami et al., 2013; Slesak et al., 2013; Delporte et al., 2014; Zhang et al., 2015; Huang et al., 2016; Сельдимирова и др., 2017б и др.). На наш взгляд, данные об относительной автономности зародыша могут иметь определенное значение в оптимизации биотехнологических исследований злаков как коммерчески ценной группы растений. В этой связи важно выявить физиологическую готовность относительно автономных зародышей злаков к дальнейшему нормальному развитию и прорастанию, главным образом содержание и локализацию в них эндогенных фитогормонов.
Цель данной работы – на примере злаков, в сравнении с представителями других семейств цветковых растений, провести анализ литературных и собственных данных, посвященных как выявлению критической стадии относительной автономности, во время которой зародыши становится независимым от гормонов материнского организма, так и оценке морфологического, гистологического и физиологического статуса относительно автономных зародышей.
ВЫЯВЛЕНИЕ КРИТИЧЕСКОЙ СТАДИИ ОТНОСИТЕЛЬНОЙ АВТОНОМНОСТИ ЗАРОДЫША ЗЛАКОВ
Критическая стадия относительной автономности зародыша у представителей разных таксонов цветковых растений различна, поскольку определяется сложившимися в ходе эволюции таксона морфогенетическими и морфофизиологическими корреляциями в развитии зародыша и окружающих тканей материнского организм. На уровне особи степень структурной и функциональной дифференциации относительно автономного зародыша обусловлена генотипом не только зародыша (тип эмбриогенеза, специфика развития), но и генотипом материнского организма (условия внутри развивающегося семени, опосредованно связанного с материнским организмом в целом) (по: Васильева, Батыгина, 1997; Батыгина, Васильева, 2002).
Предложен экспериментальный способ выявления критической стадии относительной автономности зародыша, состоящий в использовании метода эмбриокультуры in vitro, – по способности разновозрастных изолированных зародышей завершить эмбриогенез и дать нормальный проросток на безгормональной питательной среде (Батыгина, Васильева, 1987). Такой подход вполне оправдан. Действительно, с одной стороны, именно культура in vitro позволяет создать условия для наиболее полной реализации морфогенетических программ (в том числе потенциальных) развития зародыша, а значит, и особи в целом, поскольку зародыш обладает всеми потенциями взрослого организма. С другой стороны, именно в культуре in vitro экспериментатор может моделировать условия материнского организма и выявить ту стадию эмбриогенеза in vivo, когда незрелый зародыш способен к дальнейшей дифференциации и прорастанию в нормальное растение при отсутствии экзогенных гормонов питательной среды. Предложено (Круглова, Катасонова, 2009) уточнение этого экспериментального способа: давать оценку стадии относительной автономности зародыша не только по признаку формирования нормального проростка на безгормональной питательной среде in vitro, но и по формированию из такого проростка полноценного растения далее, в условиях ex vitro.
Для выявления относительной автономности необходимо знать, на какой стадии (фазе, периоде, этапе) эмбриогенеза находится инокулируемый незрелый зародыш. Ситуация со злаками усложнена тем, что для представителей этого семейства не разработана единая периодизация эмбриогенеза. Причина этого, на наш взгляд, состоит в особенностях как процесса эмбриогенеза, так и строения зрелого зародыша злаков. Своеобразный дорсовентральный способ развития начиная с зиготы, специфика органогенеза и уникальное строение высокодифференцированных органов зрелого зародыша (щиток, колеоптиль, эпибласт, колеориза, мезокотиль, эпикотиль с плюмулой, лигула) дали основание выделить особый тип эмбриогенеза – Graminad (Батыгина, 1968а, 1974, 1987, 1997б). Правомочность выделения Graminad-типа эмбриогенеза подтверждается исследованиями эмбриогенеза различных видов злаков (обзор: Круглова и др., 2019б).
Предложено несколько периодизаций развития зародыша злаков. Наибольшей теоретической обоснованностью отличается периодизация, разработанная Т.Б. Батыгиной (1987, 1997а). Исследователь выделяет в развитии зародыша злаков две фазы – бластомеризацию, или фазу первичной дифференциации зародыша (начинается с формирования зиготы, продолжается образованием многоклеточного зародыша, заканчивается обособлением эмбриодермы) и органогенез (начинается с дифференциации гистогенов в многоклеточном зародыше, продолжается обособлением зачатков органов и заканчивается тканевой дифференциацией органов). Во всех сложных преобразованиях, происходящих в ходе эмбриогенеза, определяющую роль, по мнению автора, играют последовательные изменения ритма митотической активности и ориентация клеточных делений в разных областях (кластерах) зародыша, что и обусловливает как дорсовентральность строения, так и формирование специфических органов зрелого зародыша злаков.
В работе “Основы эмбриогенеза злаков” (1991) выделены пять фаз эмбриогенеза представителей этого семейства: зигота, двуклеточный зародыш, глобулярный зародыш, видимая морфологическая дифференциация и инициальный органогенез, созревающий зародыш. Авторы анализируют происходящие во время каждой фазы процессы морфологической, биохимической, физиологической и ультраструктурной реорганизации клеток, становление полярности и специализации органов зародыша, а также дают оценку значения каждой фазы для всего хода эмбриогенеза злаков.
Однако, несмотря на представленные в литературе периодизации эмбриогенеза злаков, в практике биотехнологических исследований с применением эмбриокультуры in vitro, за редким исключением (Zuraida et al., 2011; Голева и др., 2014), абсолютное большинство исследователей не сообщают, на какой именно стадии (фазе, периоде, этапе) развития находится инокулируемый незрелый зародыш злаков. Как правило, указывается время, прошедшее от опыления до инокуляции, или длина инокулируемого зародыша (Митич и др., 2009; Slesak et al., 2013; Никитина, Хлебова, 2014; Спивак и др., 2014; Zhang et al., 2015; Бычкова, 2016; Noga et al., 2016 и др.); в ряде публикаций в качестве экспланта указывается “незрелый зародыш”, без детализации (Григорьева, Шлецер, 2006; Carciofi et al., 2012). Подход к определению стадии развития инокулируемого зародыша по времени после опыления применяется и при других исследованиях злаков, например, протеомном анализе зародышей риса (Xu et al., 2011). Причина такого подхода, по-видимому, заключается в отсутствии морфологических критериев временных границ стадий (фаз, периодов, этапов) эмбриогенеза злаков, удобных в биотехнологических исследованиях, особенно при массовой сезонной работе. Решить эту проблему предназначена периодизация эмбриогенеза пшеницы (Круглова, 2012в; Kruglova, 2013). Автор предлагает оценивать стадии развития зародышей пшеницы согласно временным (сутки после искусственного опыления) и морфологическим критериям (в частности, длина зародыша), выделяя при этом в эмбриогенезе этап недифференцированного зародыша (стадии: зигота, двуклеточный зародыш, четырехклеточный зародыш, многоклеточный зародыш), этап морфологической дифференциации зародыша (стадия органогенеза в трех подстадиях) и этап дифференцированного зародыша (стадии сформированного зародыша и зрелого зародыша).
Установлено, что для успешного культивирования in vitro незрелых изолированных зародышей злаков на самых ранних стадиях (зигота, дву- и четырехклеточный зародыш) необходимо их сокультивирование с микроспорами в качестве клеток-“нянек” (Bakos et al., 2003) или использование факторов кондиционирования (Zhang et al., 2015), однако это придает биотехнологическим экспериментам дополнительные затраты. Поэтому для оптимизации биотехнологических исследований злаков так важно выявить стадию относительной автономности, начиная с которой изолированные незрелые зародыши разовьются в нормальные проростки и растения в условиях как in vitro, так и ex vitro.
Выявление стадии относительной автономности развивающихся зародышей злаков детально проведено на примере ячменя и пшеницы. Исследование незрелых зародышей культурных форм ячменя Hordeum vulgare L. согласно критерию формирования из таких зародышей нормальных проростков в культуре in vitro на безгормональной среде (по: Батыгина, Васильева, 1987) показало, что зародыши этого злака становятся относительно автономными на 10–12 сут (Игнатова, 2011) или, у других генотипов, на 13–14 сут (Лукьянюк, Игнатова, 1980) после опыления. Исследованиями этой критической стадии эмбриогенеза у обширной коллекции сортов и гибридных комбинаций яровой мягкой пшеницы Triticum aestivum L. на основе более жесткого критерия – формирования зародышами полноценных регенерантов в условиях ex vitro (Круглова, Катасонова, 2009) – выявлена их относительная автономность, в зависимости от генотипа, на 12–15 сут после опыления (Круглова, Катасонова, 2009; Круглова, Сельдимирова, 2011; Круглова, 2012а, 2012б, 2013, 2014; Круглова и др., 2018б, 2018г).
Такое некоторое несоответствие временных показателей становления относительной автономности зародышей ячменя и пшеницы можно объяснить климатическими условиями зон произрастания донорных растений (ячмень – Одесская область, юг Украины, пшеница – Уфимский район, Южный Урал) и погодными условиями вегетационного сезона, что не могло не сказаться в темпах развития зародышей. Однако главную причину различия сроков наступления стадии относительной автономности зародышей этих злаков мы видим в таксоноспецифичности этой критической стадии, которая характеризуется комплексом морфогенетических и физиолого-биохимических признаков зародыша у представителей конкретного таксона (в данном случае – вида). Аналогичный таксоноспецифичный “разброс” проявления стадии относительной автономности демонстрируют и исследованные в этом отношении зиготические/соматические зародыши двудольных. Так, согласно сводке, приведенной в работе В.Е. Васильевой, Т.Б. Батыгиной (1997), у зиготических зародышей видов сем. Brassicaceae это сердечковидная стадия (Arabidopsis thaliana, Capsella bursa-pastoris) и стадия дифференциации апекса побега (Raphanus sativus); у зиготических зародышей видов сем. Fabaceae – сердечковидная (Phaseolus coccineus), торпедовидная (Vicia faba) и стадия дифференциации семядолей (Glycine max); у соматических зародышей вивипарных видов рода Bryophyllum (сем. Crassulaceae) – торпедовидная стадия со сформированными семядолями и почечкой c двумя примордиями листьев (B. daigremontianum) и торпедовидная стадия при выходе корней из тканей материнского листа (B. calycinum).
Важно отметить, что использование биологического феномена критической стадии автономности легло в основу успешной разработки биотехнологического приема embryo resque (“спасение зародыша”) (обзор: Kumari et al., 2018) по отношению к гаплоидным зародышам, полученным с помощью так называемого метода “bulbosum” при межвидовом скрещивании культурных форм ячменя Hordeum vulgare L. с гаплопродюсером – многолетней самостерильной луковичной формой ячменя Hordeum bulbosum 2x (по: Devaux, 2003). Такие гаплоидные зародыши, обычно дегенерировавшие в гибридных зерновках из-за раннего прекращения развития эндосперма, нормально развивались на содержащих гормоны средах, имитирующих эндосперм, будучи изолированными на 8–12 сут после опыления, хотя, строго говоря, не проявляли при этом относительную автономность согласно критерию прорастания на безгормональной среде в условиях in vitro. Метод “bulbosum” позволил получить жизнеспособные гибридные гаплоидные регенеранты ячменя, которые после диплоидизации активно использовались в генетических и селекционных программах в качестве гомозиготных линий (Лукьянюк, Игнатова, 1980; Лукьянюк, 1983; Игнатова, 2011). Интересно, что успехи, достигнутые в биотехнологических исследованиях ячменя этим методом, положили начало поиску эффективных гаплопродюсеров для получения гаплоидов пшеницы. Проводились эксперименты по скрещиванию пшеницы и Hordeum bulbosum 4х (Snape et al., 1979 и др.), пшеницы и кукурузы (Laurie, Bennet, 1986 и др.), однако гаплоидные зародыши гибли на самых ранних стадиях развития. Такие результаты лишний раз свидетельствуют о важности выявления стадии относительной автономности в биотехнологических исследованиях как каждого вида злаков, так и их гибридов.
СТАТУС ЗАРОДЫША ЗЛАКОВ В КРИТИЧЕСКОЙ СТАДИИ ОТНОСИТЕЛЬНОЙ АВТОНОМНОСТИ
Несмотря на важность проблемы, статус зародыша растений именно в критической стадии относительной автономности изучен крайне недостаточно. Большой интерес в этом плане вызывают единственные пока детальные цитофизиологические и биохимические исследования постепенного становления относительной автономности зародыша в семени лотоса Nelumbo nucifera (сем. Nelumbonaceae). Исследователи выявили морфогенетические (размер и степень дифференциации зародыша, соотношение размеров зародыша и окружающих тканей, относительную скорость роста по сухой массе и длине зародыша), биохимические (активность определенных ферментов, содержание растворимых сахаров и стадиеспецифичных белков, появление крахмальных зерен в семядолях) и морфологические (позеленение почечки) показатели зародыша лотоса в стадии относительной автономности – торпедовидной стадии с хорошо развитой почечкой (Васильева, Батыгина, 1981; Vasilyeva et al., 1987).
Специальных исследований, посвященных оценке гистологического статуса зародышей злаков в критической стадии относительной автономности, в литературе представлено также немного. В сводке, приведенной в работе В.Е. Васильевой, Т.Б. Батыгиной (1997) со ссылкой на работы по пшенице (Калинин, 1956; Sharma, Gill, 1982; Symons et al., 1983), рису (Давоян, Сметанин, 1979) и ячменю (Лукьянюк, Игнатова, 1980; Лукьянюк, 1983), в качестве таковой указана стадия дифференциации щитка и апекса побега. Отметим, что стадия дифференциации щитка и апекса побега зародыша злаков относится к более общей фазе органогенеза (по периодизации: Батыгина, 1987, 1997а) или этапу морфологической дифференциации зародыша (по периодизации: Круглова, 2012в; Kruglova, 2013).
Выше были проанализированы работы по детальному выявлению стадии относительной автономности зародышей ячменя и пшеницы по времени после опыления: у ячменя – на 10–14 сут, у пшеницы – на 12–15 сут. В своей монографии С.А. Игнатова (2011) не указывает, на какой стадии развития находятся относительно автономные зародыши ячменя. Тем не менее, на приведенном в этой монографии рисунке можно видеть, что в таком зародыше уже заложились щиток, апекс побега, колеоптиль, которые находятся в процессе активного формирования, а также обособлена меристема зародышевого корня. У зародыша пшеницы в стадии относительной автономности на 12–15 сут после опыления помимо формирующихся щитка, апекса побега, колеоптиля и обособленной меристемы зародышевого корня дифференцирован также и эпибласт (рис. 1а, 1б). В целом, сравнение гистологических показателей зародышей ячменя и пшеницы в критическую стадию относительной автономности свидетельствует об их принципиальном сходстве.
Рис. 1.
Зародыш пшеницы в стадию относительной автономности по данным сканирующей электронной (а) и световой (б) микроскопии. Условные обозначения: АП – апекс побега, Кл – колеоптиль, МЗКр – меристема зародышевого корня, С – суспензор, Щ – щиток, Эб – эпибласт, Эн – эндосперм. Шкала: 200 мкм. (а) – по: Сельдимирова и др., 2016; (б) – ориг. данные.

Отметим, что инокуляция незрелых зародышей пшеницы на немного более ранней стадии развития (7–9 сут после опыления, начало дифференциации органов) не приводила к формированию нормальных проростков на безгормональной среде in vitro, однако такие зародыши давали начало морфогенным каллусам на гормон-содержащих средах (Круглова, 2019; Круглова и др., 2019а).
В целом, уточненные гистологические данные дают основание полагать, что критической стадией относительной автономности зародышей злаков следует считать стадию не только дифференциации щитка, апекса побега, но и ряда других органов (каких именно – зависит от вида злака). В общем виде такую стадию мы предлагаем называть стадией дифференциации всех органов, свойственных зародышу злаков.
В работе О.А. Сельдимировой и др. (2017б) приведены данные ультраструктурных исследований клеток формирующегося зародыша пшеницы на 15–17 сут после опыления (частично соответствует стадии относительной автономности. – Авт.). Выявлено, что клетки щитка такого зародыша содержат липидные капли и крупные амилопласты, аккумулирующие крахмал (рис. 2а). В клетках апекса побега имеются митохондрии и единичные хорошо развитые хлоропласты (рис. 2б).
Рис. 2.
Клетки щитка (а) и апекса побега (б) зародыша пшеницы в стадию относительной автономности по данным трансмиссионной электронной микроскопии. Условные обозначения: Ам – амилопласт, Гр – граны хлоропластов, КЗ – крахмальное зерно, Л – липидные капли, M – митохондрия, Х – хлоропласт, Я – ядро. Шкала: (а) – 500 нм, (б) – 200 нм. По: Сельдимирова и др., 2017б.
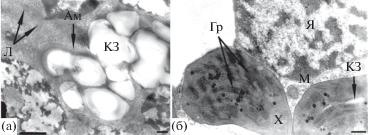
Представленные в этой работе данные о наличии липидных капель и об аккумуляции крахмала в клетках щитка зародыша пшеницы свидетельствуют о синтезе в этих клетках конституционных веществ, а в целом об их высокой метаболической активности. Это подтверждается и наличием в клетках апекса побега такого зародыша хорошо развитых митохондрий и пластид в виде хлоропластов.
Данные о впервые выявленных хорошо развитых хлоропластах в клетках апексов побегов зародышей пшеницы на 15–17 сут после опыления вызывают большой интерес. По-видимому, эти хлоропласты, как и все пластиды растительных клеток, берут начало от пропластид меристематических клеток (по: Кузнецов, 2018), в данном случае – клеток меристемы апекса побега. Представленные результаты позволяют охарактеризовать такие зародыши пшеницы как обладающие свойством хлорофиллоносности, а пшеницу отнести к группе хлороэмбриофитов (Жукова, 1997а; Puthur et al., 2013). Можно полагать, что выявленные ультраструктурные показатели “эмбрионального фотосинтеза” в клетках апексов побегов зародышей пшеницы связаны с началом формирования фотосинтетической системы будущего проростка.
Безусловно, важно охарактеризовать структуры, окружающие относительно автономный зародыш злаков. Из рис. 1а видно, что зародыш пшеницы своим щитком входит в контакт с хорошо развитым эндоспермом – гетерогенной тканью, согласно классическому пониманию служащей источником питания для развивающегося зародыша и резервуаром запасных веществ, необходимых для прорастания зародыша (по: Жукова, 1997б). Заметим, что в условиях культуры in vitro эндосперм заменяется специально подобранными питательными средами, способствующими дальнейшему нормальному развитию незрелых зародышей, изолированных и инокулированных на стадии относительной автономности.
В целом, зародыш злаков, находящийся в критической стадии относительной автономности, по своему морфологическому и гистологическому статусу готов к самостоятельному (автономному) развитию, независимо от материнского организма. Готовность таких зародышей к самостоятельному развитию характеризуется и рядом физиологических признаков, главным образом наличием в них эндогенных гормонов (независимость от экзогенных гормонов подтверждается успешным культивированием относительно автономных зародышей in vitro на безгормональной среде).
Известно, что собственная гормональная система растений формируется постепенно в ходе эмбриогенеза и активно участвует в регуляции процессов роста и развития зародышей. Этот важный вопрос изучается главным образом при анализе последовательных стадий эмбриогенеза двудольных (особенно у модельного растения – Arabidopsis thaliana) путем выявления содержания в зародышах ауксинов и цитокининов – ведущих гормонов морфогенеза растений, а также “гормона стресса” – абсцизовой кислоты (АБК) (обзоры: Jenik, Barton, 2005; Muller, Sheen, 2008; Möller, Weijers, 2009; Finkelstein, 2010; Miransaria, Smithc, 2014; Robert et al., 2015). Установлено, например, что градиент ауксинов способствует формированию апикально-базальной оси в зародыше (Hamann, 2001; Friml et al., 2003) и влияет на спецификацию апикальных меристем зародышевого побега и корня (De Smet et al., 2010). Порядок и поддержание локальной аккумуляции ауксинов и цитокининов и их взаимодействие обеспечивает не только ход эмбриогенеза (Sauer, Friml, 2008; Rademacher et al., 2012; Cheng et al., 2013), но и постэмбриональное развитие растений (обзоры: Su et al., 2011; Schaller et al., 2015). Повышенное содержание АБК совпадает преимущественно с поздними стадиями развития зародышей (обзор: Finkelstein, 2010), покоем и прорастанием семян (обзоры: Nambara et al., 2010; Chaumont, Tyerman, 2014).
Большое внимание уделяется выявлению генов, контролирующих гормональную регуляцию эмбриогенеза Arabidopsis thaliana (обзоры: Wendrich et al., 2015; Творогова, Лутова, 2018). Установлено, например, что гены MONOPTEROS и BODENLOS (Hamann et al., 2002; De Smet et al., 2010), а также гены семейства PIN (Friml et al., 2003) отвечают за ауксиновый сигналинг на ранних стадиях эмбриогенеза, тогда как гены LONELY GUY и DOF2.1 опосредуют синтез активных форм цитокинина для формирования сосудистой системы на поздних стадиях развития зародыша этого растения (De Rybel et al., 2014; Smet et al., 2019).
В результате многочисленных исследований установлена стимулирующая роль эндогенных гормонов и в соматическом эмбриогенезе in vitro двудольных, включая экспрессию генов при этом (обзоры: Jimenez, 2005; Harada et al., 2010; Rai et al., 2011; Mahdavi-Darvari et al., 2015; Altamura et al., 2016; Horstman et al., 2017; Круглова и др., 2018а, 2018в).
Отметим, что практически все указанные работы не связаны с выявлением роли эндогенных гормонов в становлении автономности зародыша двудольных, как относительной, так и полной. Исключение составляет проанализированная выше работа, посвященная комплексному исследованию зародыша лотоса в стадии относительной автономности – торпедовидной стадии с хорошо развитой почечкой. Помимо морфогенетических, биохимических, морфологических характеристик, авторы выявили и гормональные показатели зародышей этой стадии – появление в них АБК (Васильева, Батыгина, 1981; Vasilyeva et al., 1987).
Можно косвенно дать оценку роли эндогенных гормонов в становлении относительной автономности зародыша двудольных на примере Arabidopsis thaliana на основе выборочного анализа литературных источников, посвященных исследованию гормонов в развивающихся зародышах этого растения. При этом необходимо учитывать, что относительной автономности зародыша A. thaliana соответствует сердечковидная стадия (по: Meinke, 1994). Сам автор не использует понятие “автономность зародыша”, однако отмечает, что сердечковидные зародыши A. thaliana характеризуются способностью прорастать на безгормональной среде in vitro. Как свидетельствует такой выборочный анализ литературных данных, в сердечковидную стадию сайты формирования примордиев семядолей в зародышах A. thaliana маркируются ауксиновыми максимумами, которые создаются главным образом с помощью транспортера PIN1 (Benkova et al., 2003; Sieburth et al., 2006) при участии гиббереллинов (Willige et al., 2011).
Что касается исследований гормональной системы зародышей злаков на разных стадиях эмбриогенеза, то они не так многочисленны, как у двудольных, достаточно отрывочны и отражены в единичных обзорах (например, Круглова и др., 2019б). Кроме того, в литературе представлены результаты сравнительно немногочисленных исследований эндогенных гормонов в целых завязях (Гусаковская и др., 2008) и зерновках (Rusmussen et al., 1997; Banowetz et al., 1999; Hess et al., 2002; Сельдимирова и др., 2018б) злаков.
Данные по выявлению генов, контролирующих гормональную регуляцию эмбриогенеза злаков, также немногочисленны в сравнении с аналогичными исследованиями двудольных. Так, у пшеницы (Zhao et al., 2014) и Aegilops tauschii (Zhao et al., 2015) изолированы и охарактеризованы гены семейства WOX, играющие роль координаторов транскрипции в ходе раннего эмбриогенеза этих злаков. В позднем эмбриогенезе у кукурузы выявлена индуцируемая АБК экспрессия генов глобулина GLB1 и GLB2 (Paiva, Kriz, 1994), у риса – экспрессия гена OSGH3-2 из семейства GH3, модулирующего уровни ауксинов и АБК (Du et al., 2012).
У злаков, так же как и у двудольных, установлена зависимость формирования и развития зародышей от ключевых гормонов морфогенеза растений – ауксинов и цитокининов, а также участие АБК в процессах сравнительно позднего эмбриогенеза.
Эндогенный ауксин индолил-3-уксусная кислота (ИУК) выявлен на всех последовательных стадиях эмбриогенеза пшеницы (Hess et al., 2002; Wilson et al., 2005; Fan et al., 2007; Сельдимирова и др., 2017а) и кукурузы (Jimenez, Bangerth, 2001). Установлено, например, равномерное распределение свободной ИУК в клетках проэмбрио кукурузы (Forestan et al., 2010); показана роль направленного полярного транспорта этого ауксина в становлении билатеральной симметрии, клеточной дифференциации и органогенезе зародышей пшеницы (Fischer, Neuhaus, 1996; Fischer et al., 1997; Fischer-Iglesias et al., 2001) и кукурузы (Forestan et al., 2010); выявлено участие ИУК в формировании прокамбиального тяжа щитка на поздних стадиях эмбриогенеза пшеницы (Сельдимирова и др., 2017а). Аналогичные данные получены при оценке гормонального статуса зародышей при прямом/непрямом соматическом эмбриогенезе in vitro ряда злаков (Zhao et al., 2000; Przetakiewicz et al., 2003; Bouamama et al., 2011; Huang et al., 2012; Титова и др., 2016; Seldimirova et al., 2016; Сельдимирова и др., 2019). Выявление ИУК на всех последовательных стадиях эмбриогенеза подтверждается данными иммуногистохимической локализации этого гормона в клетках развивающихся и зрелых зародышей пшеницы (Сельдимирова и др., 2017а) и ячменя (Сельдимирова и др., 2018б).
Цитокинины также выявлены в процессе всего зиготического эмбриогенеза злаков, например, ячменя (Сельдимирова и др., 2018б), на всех стадиях развития зерновки пшеницы (Hess et al., 2002) и ячменя (Сельдимирова и др. 2018б), а также при прямом/непрямом соматическом эмбриогенезе in vitro пшеницы (Seldimirova et al., 2016; Галин и др., 2018). Однако данные по исследованию цитокининов в развивающихся зародышах злаков не так многочисленны, в сравнении с аналогичными данными по ауксинам.
В целом, анализ литературных данных подтверждает определяющую роль ауксинов и цитокининов в развитии зародышей злаков – как зиготических in vivo, так и соматических in vitro. Можно полагать, что ключевые гормоны морфогенеза – ауксины, влияющие на рост клеток, и цитокинины, влияющие на клеточные деления (по: Медведев, Шарова, 2011; Schaller et al., 2015), присутствуют и на стадии относительной автономности зародыша злаков (около 10–15 сут после опыления), хотя специальных исследований не проводилось. Действительно, стадия относительной автономности характеризуется быстрым ростом и активными клеточными делениями дифференцированных органов и апекса побега развивающегося зародыша, а значит, и несомненным участием ауксинов и цитокининов в этих процессах. Такое предположение подтверждается, например, результатами гормональных исследований сухой массы развивающихся зерновок пшеницы: на 12 сут после опыления в них отмечено резкое увеличение содержания ИУК и цитокининов, соответствующее быстрому увеличению размера зерновки (Hess et al., 2002), а также максимальным показателем содержания цитокининов в зерновках ячменя на 14 сут после опыления (Сельдимирова и др., 2018б). Кроме того, интенсивное окрашивание на ИУК отмечено в клетках апикальной части зародыша и в клетках развивающихся органов зародыша пшеницы в фазу органогенеза (Сельдимирова и др., 2017а), включающую стадию дифференциации апекса побега и органов (по периодизации: Батыгина, 1987, 1997а).
Что касается АБК, то у злаков, как и двудольных, повышенное содержание этого гормона также выявлено преимущественно в зародышах на поздних стадиях эмбриогенеза и в зрелых зерновках (Belefant-Miller et al., 1994; Paiva, Kriz, 1994; Zocchi, de Nisi, 1996; Kawakami et al., 1997; Suzuki et al., 2000; White et al., 2000; Hess et al., 2002; Fan et al., 2007; An, Lin, 2011; Wu et al., 2011). Так, резкий скачок содержания АБК отмечен в зрелых зерновках ячменя на 35 сут после опыления (Сельдимирова и др., 2018б). Такие данные можно объяснить тем, что этот гормон предотвращает преждевременное прорастание семян (обзор: Miransaria, Smithc, 2014), а также индуцирует синтез дегидринов – белков, участвующих в обезвоживании семян (обзоры: Аллагулова и др., 2003; Finkelstein, 2010). Кроме того, АБК активирует ферменты, катализирующие распад цитокининов, и ингибирует экспрессию генов биосинтеза цитокининов, что, в свою очередь, приводит к снижению активности клеточных делений и торможению ростовых процессов (обзор: Веселов и др., 2017).
Иммуногистохимическими исследованиями подтверждено, что эндогенная АБК откладывается в клетках зародыша пшеницы (Сельдимирова и др., 2017а) и ячменя (Сельдимирова и др., 2018а, 2018б) преимущественно на поздних стадиях эмбриогенеза, уже в сформированных органах; при этом окрашивание на АБК отмечается во всех клетках зародыша, но наиболее интенсивно – в клетках колеоризы (корневого влагалища) и нижней части щитка, прилегающей к оси зародыша. Выявлено, что на поздних стадиях эмбриогенеза ячменя в колеоризе инициируются молекулярные изменения, связанные с метаболизмом АБК, что приводит к разрушению колеоризы и прорастанию зародышевого корня (Barrero et al., 2009). Высказано мнение (Сельдимирова и др., 2018а), что АБК в позднем эмбриогенезе злаков участвует в синтезе активных форм кислорода, разрыхляющих клетки колеоризы, тем самым способствуя прорастанию зародышевого корня/корней, как это показано для клеток микропилярной части эндосперма у некоторых двудольных (Müller et al., 2006).
Важно подчеркнуть, что максимальный уровень эндогенной АБК отмечен также в зрелых соматических зародышах риса (Jiang et al., 2006; Huang et al., 2012) и ячменя (Bouamama et al., 2011) в условиях in vitro.
В целом, полученные данные подтверждают важную роль АБК в созревании зародышей злаков и переходе семян к покою, однако, согласно проанализированным литературным данным, этот гормон не проявляет высокой активности в стадии относительной автономности зародышей злаков.
ЗАКЛЮЧЕНИЕ
Программа развития, характеризующаяся поливариантной детерминированностью процессов роста и развития, заложена уже на самых ранних этапах онтогенеза растений, в зиготе. Примером поливариантности полагают потенциальную способность зародыша к прорастанию, проявляющуюся не только в его нормальном прорастании и так называемом преждевременном прорастании, но и в автономности зародыша (полной и относительной. – Авт.) (по: Васильева, Батыгина, 1997).
На определенной таксоноспецифичной критической стадии эмбриогенеза незрелый зародыш растений становится относительно автономным, не зависимым от материнского организма. Выявление этой критической стадии у злаков согласно критерию развития изолированных зародышей на безгормональной питательной среде in vitro с формированием нормальных проростков (Батыгина, Васильева, 1987) показало, что у пшеницы (Калинин, 1956; Sharma, Gill, 1982; Symons et al., 1983), риса (Давоян, Сметанин, 1979) и ячменя (Лукьянюк, Игнатова, 1980; Лукьянюк, 1983) в таких зародышах дифференцированы щиток и апекс побега. В зародышах некоторых генотипов ячменя кроме щитка и апекса побега дифференцирован также колеоптиль и обособлена меристема зародышевого корня (Игнатова, 2011), а в зародышах ряда генотипов пшеницы дифференцирован и эпибласт (оригинальные данные). Таким образом, в относительно автономных зародышах злаков наличествуют органы, необходимые и достаточные для их дальнейшего нормального развития вне материнского организма: щиток – семядоля, колеоптиль, защищающий конус нарастания побега, и эпибласт, поставляющий воду развивающемуся зародышу (по: Батыгина, 1997а), а также обособлены апекс побега и меристема зародышевого корня.
Готовность относительно автономных зародышей злаков к самостоятельному развитию подтверждается ультраструктурными характеристиками клеток их органов, например, наличием липидных капель и крахмальных зерен в клетках щитка, а также хорошо развитых хлоропластов в клетках апекса побега (Сельдимирова и др., 2017б).
Относительно автономные зародыши злаков характеризуются и наличием эндогенной гормональной системы, представленной главным образом ауксинами и цитокининами как ключевыми гормонами морфогенеза. Независимость от экзогенных гормонов материнского организма подтверждается успешным культивированием таких зародышей in vitro на безгормональной среде, с формированием из них нормальных проростков в условиях in vitro и полноценных растений в условиях ex vitro.
В целом, относительно автономные незрелые зародыши злаков по своему морфологическому, гистологическому и физиологическому статусу готовы к не зависимому от материнского организма нормальному развитию и дальнейшему формированию растений. Иначе говоря, с этой критической стадии онтогенеза начинается переход зародыша (нового спорофита) на относительно самостоятельный путь развития, т.е. происходит автономизация онтогенеза (Батыгина, 1987; Васильева, Батыгина, 1997).
Использование таких незрелых зародышей имеет несомненное практическое значение, поскольку может способствовать ускорению прямого получения регенерантов биотехнологическим методом эмбриокультуры in vitro. В данном случае, согласно собственным данным, за счет инокуляции незрелого зародыша достигается выигрыш во времени не менее чем в 20 сут, в сравнении с использованием зрелых зародышей. Кроме того, при этом можно миновать использования дорогостоящего и трудоемкого этапа формирования каллусов. Всe это особенно важно, когда цель биотехнологии состоит в минимизации сомаклональной изменчивости и образовании на конечном этапе ex vitro полноценных фертильных растений-регенерантов.
В то же время, несмотря на известную степень теоретической изученности проблемы автономности зародышей растений и практическое использование автономных зародышей в биотехнологических исследованиях, вопрос о механизмах становления этого биологического феномена до конца не решен. Далеки от окончательного решения и заслуживающие внимания эмбриологов вопросы, поставленные Т.Б. Батыгиной и В.Е. Васильевой еще в 2002 г.: как связана поливариантная способность зародыша к прорастанию с эволюционным процессом; почему автономность зародыша возникает раньше его естественного созревания; какие гены экспрессируются на стадии автономности (добавим: особенно – относительной автономности. – Авт.).
К этим важным вопросам следует добавить и вопрос о функциональном взаимодействии эндогенных гормонов на стадии относительной автономности зародыша. Действительно, способность гормонов влиять друг друга – одна из важных особенностей гормональной системы растений (Plant Hormones…, 2010). Хотя эта закономерность не вызывает сомнений, информация о влиянии одних гормонов на другие в развивающихся зародышах довольно противоречива. Особенно важно, на наш взгляд, проанализировать данные об одновременном накоплении и распределении эндогенных гормонов в относительно автономных зародышах, когда дочерний организм гормонально уже не зависит от материнского.
Способствовать решению этих и других важных вопросов, связанных с полной и относительной автономностью зародыша растений, могут дальнейшие цитофизиологические и молекулярно-генетические исследования последовательных стадий зиготического эмбриогенеза in vivo, особенно в сравнении с аналогичными исследованиями соматического эмбриогенеза в модельных условиях культуры in vitro. Несомненный интерес представляет дальнейшее изучение относительной автономности зародышей злаков в экспериментальных условиях эмбриокультуры in vitro, сравнение стадий развития зиготического и соматического зародыша (эмбриоида) выявление общих закономерностей и специфических черт этих процессов.
Работа выполнена в рамках договора о творческом сотрудничестве между УИБ УФИЦ РАН и БИН РАН на 2018–2023 гг. по темам № АААА-А18-118022190099-6 (лаборатория физиологии растений УИБ УФИЦ РАН, государственное задание Минобрнауки России № 075-00326-19-00) и № АААА-А18-118051590112-8 (лаборатория эмбриологии и репродуктивной биологии БИН РАН, а также частично поддержана грантом РФФИ № 17-04-01477).
Список литературы
Аллагулова Ч.Р., Гималов Ф.Р., Шакирова Ф.М., Вахитов В.А. Дегидрины растений: их структура и предполагаемые функции // Биохимия. 2003. Т. 68. № 9. С. 1157–1165.
Банникова В.П., Хведынич О.А. Основы эмбриологии растений. Киев: Наукова думка, 1982. 164 с.
Батыгин Н.Ф. Онтогенез высших растений. М.: Агропромиздат, 1986. 100 с.
Батыгин Н.Ф. Физиология онтогенеза // Физиологические основы селекции растений / Под ред. Удовенко Г.В., Шевелухи В.П. СПб.: Изд-во ВИР, 1995. С. 14–92.
Батыгин Н.Ф. Системный подход в биологии и агрономии // Николай Федорович Батыгин: жизнь и творчество / Под ред. Батыгиной Т.Б. СПб.: Профессионал, 2007. С. 151–196.
Батыгина Т.Б. О возможности выделения нового типа эмбриогенеза Angiospermae // Доклады Академии наук СССР. 1968а. Т. 186. № 6. С. 1499–1502.
Батыгина Т.Б. Эмбриогенез в роде Triticum (в связи с вопросами однодольности и отдаленной гибридизации у злаков) // Ботан. журн. 1968б. Т. 53. № 4. С. 480–490.
Батыгина Т.Б. Эмбриология пшеницы. Л.: Колос, 1974. 206 с.
Батыгина Т.Б. Хлебное зерно. Л.: Наука, 1987. 103 с.
Батыгина Т.Б. Эмбриогенез злаков // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997а. С. 528–538.
Батыгина Т.Б. Graminad-тип эмбриогенеза // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Cемя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997б. С. 520–526.
Батыгина Т.Б. Биология развития растений. Симфония жизни. СПб.: ДЕАН, 2014. 764 с.
Батыгина Т.Б., Васильева В.Е. Целесообразность системного подхода к проблеме дифференциации зародыша покрытосеменных растений // Онтогенез. 1983. Т. 14. № 3. С. 304–311.
Батыгина Т.Б., Васильева В.Е. Прикладные аспекты эмбриологии. Автономность зародыша и эмбриокультура цветковых растений // Ботан. журн. 1987. Т. 72. № 2. С. 155–161.
Батыгина Т.Б., Васильева В.Е. Размножение растений. СПб.: Изд-во Санкт-Петербургского ун-та, 2002. 232 с.
Бычкова О.В. Оценка эффективности морфогенеза и регенерации яровой твердой пшеницы в культуре in vitro // Acta Biol. Sib. 2016. № 2(1). С. 139–149.
Васильева В.Е., Батыгина Т.Б. Культивирование in vitro зародышей и семяпочек лотоса, изолированных на разных стадиях развития // Физиол. раст. 1981. Т. 28. № 2. С. 319–327.
Васильева В.Е., Батыгина Т.Б. Автономность зародыша // Эмбриология цветковых растений. Терминология и концепции. Т. 2. Семя / Ред. Батыгина Т.Б. СПб: Мир и семья, 1997. С. 579–588.
Веселов Д.С., Кудоярова Г.Р., Кудрякова Н.В., Кузнецов В.В. Роль цитокининов в стресс-устойчивости растений // Физиол. раст. 2017. Т. 64. № 1. С. 19–32.
Галин И.Р., Зайцев Д.Ю., Сельдимирова О.А., Круглова Н.Н. Участие цитокининов в начальных этапах эмбриоидогенеза in vitro в зародышевых каллусах пшеницы // Биомика. 2018. Т. 10. № 2. С. 141–145.
Голева Г.Г., Батлук Ю.А., Ващенко Т.Г., Черкасова Н.Н., Голев А.Д. Получение растений-регенерантов озимой мягкой пшеницы (Triticum aestivum L.) в культуре in vitro // Вестник Воронежского гос. агр. ун-та. Сельскохоз. науки. 2014. № 3(42). С. 17–22.
Григорьева Л.П., Шлецер И.А. Скрининг сортов пшеницы по способности к морфогенезу в культуре незрелых зародышей in vitro // Изв. Алтайского гос. ун-та. Биология. 2006. № 3(41). С. 64–66.
Гусаковская М.А., Блинцов А.Н., Лебедева А.Ф. Сравнительный анализ пространственно-временного распределения эндогенных гормонов в завязях пшеницы и одуванчика в период активности яйцеклетки // Вестник Московского ун-та. Серия 16: Биология. 2008. № 3. С. 12–20.
Давоян Э.И., Сметанин А.П. Получение каллуса и регенерация растений риса // Физиол. раст. 1979. Т. 26. № 2. С. 323–328.
Жукова Г.Я. Хлорофиллоносность зародыша как признак классификации цветковых растений // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997а. С. 461–470.
Жукова Г.Я. Эндосперм // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997б. С. 212–218.
Игнатова С.А. Клеточные технологии в растениеводстве, генетике и селекции возделываемых растений: задачи, возможности, разработки систем in vitro. Одесса: Астропринт, 2011. 224 с.
Калинин Ф.Л. Физиолого-биохимические особенности эмбрионаьного развития растений; Автореф. … д-ра биол. наук. М., 1956. 30 с.
Корочкин Л.И. Биология индивидуального развития (генетический аспект). М.: Изд-во МГУ, 2002. 264 с.
Круглова Н.Н. Оптимизация биотехнологии получения растений пшеницы в культуре in vitro // Известия Уфимского НЦ РАН. 2012а. № 3. С. 57–61.
Круглова Н.Н. Оценка коллекции генотипов яровой мягкой пшеницы по устойчивости автономных зародышей на селективных средах in vitro, имитирующих засуху // Известия Самарского НЦ РАН. 2012б. Т. 14. № 1(9). С. 2243–2245.
Круглова Н.Н. Периодизация развития зародыша пшеницы как методологический аспект биотехнологических разработок // Известия Уфимского НЦ РАН. 2012в. № 2. С. 21–24.
Круглова Н.Н. Выявление критической стадии автономности зародыша пшеницы в культуре in vitro // Известия Уфимского НЦ РАН. 2013. № 1. С. 42–45.
Круглова Н.Н. Выявление автономности зародыша пшеницы как этап разработки экспресс-диагностической биотехнологии получения засухоустойчивых образцов // Пермский аграрный вестник. 2014. № 1(5). С. 38–43.
Круглова Н.Н. Органогенез злаков на ранних этапах онтогенеза in vivo как структурная основа экспериментальных исследований in vitro // Экобиотех. 2019. Т. 2. № 1. С. 36–50.
Круглова Н.Н., Катасонова А.А. Незрелый зародыш пшеницы как морфогенетически компетентный эксплант // Физиол. биохим. культ. раст. 2009. Т. 41. № 2. С. 124–131.
Круглова Н.Н., Сельдимирова О.А. Регенерация пшеницы in vitro и ex vitro. Уфа: Гилем, 2011. 124 с.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е. Гистологический статус зародыша пшеницы в стадии органогенеза in vivo, оптимальной для получения морфогенного каллуса in vitro // Известия Уфимского НЦ РАН. 2019а. № 1. С. 25–29.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е. Структурные особенности и гормональная регуляция зиготического эмбриогенеза злаков // Успехи соврем. биологии. 2019б. Т. 139. № 4. С. 326–337.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Веселов Д.С. Абсцизовая кислота в системах культуры in vitro эксплантов // Известия Уфимского НЦ РАН. 2018а. № 2. С. 55–60.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Веселов Д.С. Критическая стадия автономности зародыша пшеницы in planta // Биомика. 2018б. Т. 10. № 1. С. 1–6.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Веселов Д.С. Участие абсцизовой кислоты в стимулировании соматического эмбриогенеза растений // Успехи соврем. биологии. 2018в. Т. 138. № 5. С. 516–528.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Никонов В.И. Выявление относительной автономности in planta зиготических зародышей яровой мягкой пшеницы для оптимизации биотехнологических исследований // Известия Уфимского НЦ РАН. 2018г. № 3. С. 28–33.
Кузнецов В.В. Хлоропласты. Структура и экспрессия пластидного генома // Физиол. раст. 2018. Т. 65. № 4. С. 243–255.
Лукьянюк С.Ф. Разработка приемов in vitro для получения гаплоидов ячменя и тритикале: Автореф. дис. … канд. биол. наук. М., 1983. 18 с.
Лукьянюк С.Ф., Игнатова С.А. Методы культуры тканей и органов в селекции растений. Одесса, 1980. 21 с.
Лыкова Н.А. Эффект превегетации: экологические последствия. СПб.: Наука, 2009. 311 с.
Медведев С.С., Шарова Е.И. Биология развития растений. В 2-х т. Т. 1. Начала биологии развития растений. Фитогормоны. СПб.: Изд-во С.-Петерб. ун-та, 2011. 253 с.
Митич Н., Додиг Д., Николич Р., Никонович С., Винтерхалтер Д., Винтерхалтер Б. Влияние условий выращивания донорных растений на культуру незрелых зародышей, выделенных из широко распространенных генотипов пшеницы // Физиол. раст. 2009. Т. 56. № 4. С. 596–602.
Никитина Е.Д., Хлебова Л.П. Влияние температуры и освещения на прямое прорастание незрелых зародышей Triticum aestivum L. в культуре in vitro // Изв. Алтайского гос. ун-та. Биол. науки. 2014. Т. 3. № 1(83). С. 46–50.
Николаева М.Г., Лянгузова И.В., Поздова Л.М. Биология семян. СПб., 1999. 233 с.
Обручева Н.В. Переход от гормональной к негормональной регуляции на примере выхода семян из покоя и запуска прорастания // Физиол. раст. 2012. Т. 59. № 4. С. 591–600.
Обручева Н.В. Гормональная регуляция в онтогенезе плодов у растений // Онтогенез. 2014. Т. 45. № 1. С. 14–27.
Обручева Н.В., Антипова О.В. Морфология и физиология прорастания семян // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997. С. 667–680.
Основы эмбриогенеза злаков / Ред. Банникова В.П., Хведынич О.А., Кравец Е.А., Тарасенко Л.В., Шулаев В.К., Ильченко К.В., Майстров П.Д., Барабанова Е.А. Киев: Наукова думка, 1991. 176 с.
Поддубная-Арнольди В.А. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М.: Наука, 1976. 508 с.
Поддубная-Арнольди В.А. Цитоэмбриологическая характеристика семейства злаковых // Бюлл. Гл. Ботан. сада АН СССР. 1978. № 109. С. 57–60.
Поддубная-Арнольди В.А. Характеристика семейств покрытосеменных растений по цитоэмбриологическим признакам. М.: Наука, 1982. 351 с.
Светлов П.Г. Теория критических периодов развития и ее значение для понимания принципов действия среды на онтогенез // Вопросы цитологии и общей физиологии. М.; Л.: АН СССР, 1960. С. 263–285.
Сельдимирова О.А., Галин И.Р., Круглова Н.Н., Веселов Д.С. Распределение ИУК и АБК в развивающихся зародышах пшеницы in vivo // Известия Уфимского НЦ РАН. 2017а. № 3(1). С. 114–118.
Сельдимирова О.А., Круглова Н.Н., Титова Г.Е., Батыгина Т.Б. Сравнительный ультраструктурный анализ формирующихся микроспориальных эмбриоидов in vitro и зиготических зародышей in vivo пшеницы как основа понимания цитофизиологических аспектов их развития // Онтогенез. 2017б. Т. 48. № 3. С. 220–233.
Сельдимирова О.А., Галин И.Р., Кудоярова Г.Р., Круглова Н.Н., Веселов Д.С. Влияние АБК на созревание зародышей ячменя in vivo: результаты изучения дефицитного по АБК мутанта AZ34 // Экобиотех. 2018а. Т. 1. № 4. С. 203–211.
Сельдимирова О.А., Круглова Н.Н., Галин И.Р., Веселов Д.С. Сравнительная оценка уровня ИУК, АБК и цитокининов в эмбриогенезе in vivo ячменя сорта Steptoe и его АБК-дефицитного мутанта AZ34 // Экобиотех. 2018б. Т. 1. № 3. С. 134–142.
Сельдимирова О.А., Кудоярова Г.Р., Круглова Н.Н., Галин И.Р., Веселов Д.С. Способность к соматическому эмбриогенезу in vitro в каллусах пшеницы и ячменя определяется балансом содержания в них ИУК и АБК // Онтогенез. 2019. Т. 50. № 3. С. 181–193.
Сельдимирова О.А., Титова Г.Е, Круглова Н.Н. Комплексный морфолого-гистологический подход к изучению морфогенных структур в культуре in vitro пыльников пшеницы // Известия РАН. Серия биол. 2016. № 2. С. 155–161.
Сказкин Ф.Д. Критический период у растений по отношению к недостатку воды в почве. Л.: Наука, 1971. 120 с.
Спивак В.А., Минликаева К.И., Евсеева Н.В., Ткаченко О.В., Лобачев Ю.В. Особенности морфогенеза структурных элементов незрелых зародышей линий пшеницы, культивируемых in vitro // Бюлл. Бот. сада Саратовского ун-та. 2014. Вып. 12. С. 188–197.
Сравнительная эмбриология цветковых растений. Однодольные: Butomaceae – Lemnaceae / Отв. ред. Батыгина Т.Б., Яковлев М.С. Л.: Наука, 1990. 332 с.
Тахтаджян А.Л. Система и филогения цветковых растений. М.-Л.: Наука, 1966. 610 с.
Творогова В.Е., Лутова Л.А. Генетическая регуляция зиготического эмбриогенеза у покрытосеменных растений // Физиол. раст. 2018. Т. 65. № 1. С. 3–17.
Терёхин Э.С. Семя и семенное размножение. СПб.: Мир и семья, 1996. 376 с.
Терлецкая Н.В. Неспецифические реакции зерновых злаков на абиотические стрессы in vivo и in vitro. Алматы: ИББР КН МОН РК, 2012. 208 с.
Титова Г.Е., Сельдимирова О.А., Круглова Н.Н., Галин И.Р., Батыгина Т.Б. Феномен “сиамских зародышей” у злаков in vivo и in vitro: кливажная полиэмбриония и фасциации // Онтогенез. 2016. Т. 47. № 3. С. 152–169.
Цингер Н.В. Семя, его развитие и физиологические свойства. М.: Изд-во АН СССР, 1958. 285 с.
Шамров И.И. Семязачаток цветковых растений. Принципы организации и типизация: Дис. … д-ра биол. наук. СПБ.: БИН РАН, 1995. 479 с.
Шамров И.И. Эмбриогения // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997. С. 297–307.
Шамров И.И. Семязачаток цветковых растений: строение, функции, происхождение / Под ред. Батыгиной Т.Б. М.: Товарищество научных изданий КМК, 2008. 350 с.
Шамров И.И., Анисимова Г.М. Особенности преобразования семязачатка в семя у Luzula pedemontana (Juncaceae) // Ботан. журн. 1993. Т. 78. № 12. С. 24–44.
Шамров И.И., Никитичева З.И. Морфогенез семяпочки и семени у Gymnadenia conopsea (Orchidaceae): структурное и гистохимическое исследование // Ботан. журн. 1992. Т. 77. № 4. С. 45–60.
Шмальгаузен И.И. Факторы эволюции (теория стабилизирующего отбора) / Ред. колл. Берг Р.Л., Махотин А.А., Яблоков А.В. Изд. второе, перераб. и доп. М.: Наука, 1968. 451 с.
Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997. 824 с.
Эмбриология цветковых растений. Терминология и концепции. Т. 3: Системы репродукции / Ред. Батыгина Т.Б. СПб.: Мир и семья, 2000. 652 с.
Altamura M.M., Della Rovere F., Fattorini L., D’Angeli S., Falaska G. Recent advances on genetic and physiological bases of in vitro somatic embryo formation // In vitro Embryogenesis in Higher Plants / Eds. Germana M.A., Lambardi M. Springer, N.Y., 2016. P. 47–85.
An Y.-Q., Lin L. Transcriptional regulatory programs underlying barley germination and regulatory functions of gibberellin and abscisic acid // BMC Plant Biol. 2011. V. 11. 24 p. https://doi.org/10.1186/1471-2229-11-105
Bakos F., Darko E., Ponya Z., Barnabas B. Regeneration of fertile wheat plants from isolated zygotes using wheat microspore culture as nurse cells // Plant Cell Tiss. Organ Cult. 2003. V. 74. P. 243–247.
Banowetz G.M., Ammar K., Chen D.D. Temperature effects on cytokinin accumulation and kernel mass in a dwarf wheat // Ann. Bot. 1999. V. 83. P. 303–307.
Barrero J.M., Talbot M.J., White R.G., Jacobsen J.V., Gubler F. Anatomical and transcriptomic studies of the coleorhiza reveal the importance of this tissue in regulating dormancy in barley // Plant Physiol. 2009. V. 150. P. 1006–1021.
Batygina T.B. Critical periods used to embryonal structures // XVII Congr. on Sexual Plant Reproduction: Abstr. Lublin, 2002. P. 33.
Batygina T.B. Integrity and reliability system in ontogenesis and evolution // Intern. J. Plant Reprod. Biol. 2012. V. 4. P. 107–120.
Batygina T.B., Vasilyeva V.E. Some aspects of embryo-culture (autonomy of embryo) of flowering plants // Phytomorphology. 1987. V. 37. P. 283–288.
Batygina T.B., Vasilyeva V.E. Some aspects of autonomy of embryo in flowering plants // Phytomorphology. 1988. V. 38. P. 293–297.
Belefant-Miller H., Fong F., Smith D. Abscisic acid biosynthesis during corn embryos development // Planta. 1994. V. 195. P. 17–21.
Benkova E., Michniewicz M., Sauer M., Tichmann T., Seifertova D., Jurgens G., Friml J. Local, efflux-dependent auxin gradients as a common module for plant organ formation // Cell. 2003. V. 115. P. 591–602.
Bouamama B., Salem A.B., Youssef F.B., Chaieb S., Jaafoura M.-H., Mliki A., Ghorbel A. Somatic embryogenesis and organogenesis from mature caryopses of North African barley accession “Kerkena” (Hordeum vulgare L.) // In Vitro Cell. Dev. Biol. Plant. 2011. V. 47. P. 321–327.
Capron A., Chatfield S., Provart N., Berleth T. Embryogenesis: pattern formation from a single cell // The Arabidopsis Book. Rockville, MD: The American Society of Plant Biologists, 2009. P. 1–28.
Carciofi M., Blennow A., Nielsen M.M., Holm P.B., Hebelstrup K.H. Barley callus: a model system for bioengineering of starch in cereals // Plant Methods. 2012. V. 8. 10 p. https://doi.org/10.1186/1746-4811-8-36
Chaumont F., Tyerman S.D. Aquaporins: highly regulated channels controlling plant water relations // Plant Physiol. 2014. V. 164. P. 1600–1618.
Cheng Z.J., Wang L., Sun W. et al. Pattern of auxin and cytokinin responses for shoot meristem induction results from the regulation of cytokinin biosynthesis by AUXIN RESPONSE FACTOR3 // Plant Physiol. 2013. V. 161. P. 240–251.
De Rybel B., Abidi M., Breda A., Wendrich J., Smit M., Novak O., Yamaguchi N., Yoshida S., Isterdael G., Palovaara J., Nijsse B., Boekschoten M.V., Hooiveld G., Beeckman T., Wagner D., Ljunq K., Fleck C., Weijers D. Plant development. Integration of growth and pattering during vascular tissue formation in Arabidopsis // Science. 2014. V. 345. P. 1255215. https://doi.org/10.1126/science.1255215
De Smet I., Lau S., Mayer U., Jurgens G. Embryogenesis – the humble beginnings of plant life // Plan J. 2010. V. 61. P. 959–970.
Delporte F., Pretova A., du Jardin P., Watillon B. Morpho-histology and genotype dependence of in vitro morphogenesis in mature embryo cultures of wheat // Protoplasma. 2014. V. 251. P. 1455–1470.
Devaux P. The Hordeum bulbosum (L.) method // Doubled Haploid Production in Crop Plants / Eds. Maluszynski M., Kasha K.J., Foster B.P., Szareiko I. Jan: Springer Science+Business Media, LLC, 2003. P. 15–19.
Du H., Wu N., Fu J., Wang S., Li X., Xiao J., Xiong L. A GH3 family member, OsGH3-2, modulates auxin and abscisic acid levels and differentially affects drought and cold tolerance in rice // J. Exp. Bot. 2012. V. 63. P. 6467–6480.
Elhiti M., Stasolla C. The use of zygotic embryos as explants for in vitro propagation: An overview // Plant Embryo Culture: Methods in Molecular Biology (Methods and Protocols) / Eds. Thorpe T.A., Yeung E.C. N.Y.: Humana Press, 2011. V. 170. P. 229–255.
Fan G.-Q., Liu F., Shao Q.-Q., Ren W.-J. Relations among wheat (Triticum aestivum L.) protein, starch contents and endogenous hormone contents during kernel development // Plant Physiol. Comm. 2007. V. 43. P. 36–40.
Finkelstein R.R. The role of hormones during seed development and germination // Plant Hormones Biosynthesis, Signal Transduction, Action / Ed. Davies P.J. Dordrecht; Heidelberg; London; N.Y.: Springer, 2010. P. 549–573.
Fischer C., Neuhaus G. Influence of auxin on the establishment of bilateral symmetry in monocots // Plant J. 1996. V. 9. P. 659–669.
Fischer C., Speth V., Fleig-Eberenz S., Neuhaus G. Induction of zygotic polyembryos in wheat: Influence of auxin polar transport // Plant Cell. 1997. V. 9. P. 1767–1780.
Fischer-Iglesias C., Sundberg B., Neuhaus G., Jones A.M. Auxin distribution and transport during embryonic pattern formation in wheat // Plant J. 2001. V. 26. P. 115–129.
Forestan C., Meda S., Varotto S. ZmPIN1-Mediated auxin transport is related to cellular differentiation during maize embryogenesis and endosperm development // Plant Physiol. 2010. V. 152. P. 1373–1390.
Friml J., Vieten A., Sauer M., Weijers D., Schwartz H., Hamann T., Offringa R., Jurgens G. Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis // Nature. 2003. V. 426. P. 147–153.
Goldberg R., de Paiva G., Yadegari R. Plant embryogenesis: Zygote to seed // Science. 1994. V. 266. P. 605–614.
Hamann T. The role of auxin in apical-basal pattern formation during Arabidopsis embryogenesis // Plant Growth Regul. 2001. V. 20. P. 292–299.
Hamann T., Benkova E., Baurle I., Kientz M., Jurgens G. The Arabidopsis BODENLOS gene encodes an auxin response protein inhibiting MONOPTEROS-mediated embryo pattering // Genes Dev. 2002. V. 16. P. 1610–1615.
Harada J.J., Belmonte M.F., Kwong R.W. Plant Embryogenesis (Zygotic and Somatic) // LS. John Wiley & Sons Ltd., Chichester, 2010. https://doi.org/10.1002/9780470015902.a0002042.pub2
Hess J.R., Carman J.G., Banowetz G.M. Hormones in wheat kernels during embryony // Plant Physiol. 2002. V. 159. P. 379–386.
Horstman A., Bemer M., Boutilier K. A transcriptional view on somatic embryogenesis // Regeneration. 2017. V. 4. P. 201–216.
Huang W.-L., Lee Ch.-H., Chen Y.-R. Levels of endogenous abscisic acid and indole-3-acetic acid influence shoot organogenesis in callus cultures of rice subjected to osmotic stress // Plant. Cell, Tiss. Org. Cult. 2012. V. 108. P. 257–263.
Hussain A., Qarshi I.A., Nazir H., Ullah I. Plant tissue culture: current status and opportunities // Recent Advances in Plant in vitro Culture. Intech., 2012. P. 1–21. https://doi.org/10.5772/50568
Jenik P.D., Barton M.K. Surge and destroy: the role of auxin in plant embryogenesis // Development. 2005. V. 132. P. 3577–3585.
Jiang H., Chen J., Gao X.L., Wan J., Wang P.R., Wang X.D., Xu Z.J. Effect of ABA on rice callus and development of somatic embryo and plant regeneration // Acta Agron. Sin. 2006. V. 32. P. 1379–1383.
Jimenez V.M. Involvement of plant hormones and plant growth regulators on in vitro somatic embryogenesis // Plant Growth Regul. 2005. V. 47. P. 91–110.
Jimenez V.M., Bangerth F. Hormonal status of maize initial explants and the embryogenic and non-embryogenic callus cultures derived from them as related to morphogenesis in vitro // Plant Sci. 2001. V. 160. P. 247–257.
Kawakami N., Miyake Y., Noda K. ABA insensitivity and low ABA levels during seed development of non-dormant wheat mutants // J. Exp. Bot. 1997. V. 48. P. 1415–1421.
Kruglova N.N. Periodization of wheat embryo structure development on the basis of anatomical and morphological criteria // Modern Phytomorphology. 2013. V. 4. P. 181–183.
Kumari P., Thaneshwari Rahul. Embryo resque in horticular crops // Int. J. Curr. Microbiol. Appl. Sci. 2018. V. 7. P. 3350–3358.
Laurie D.A., Bennet M.D. Wheat × maize hybridization // Can. J. Genet. Cytol. 1986. V. 28. P. 313–316.
Mahdavi-Darvari F., Noor N., Ismanizan I. Epigenetic regulation and gene markers as signals of early somatic embryogenesis // Plant Cell Tiss. Org. Cult. 2015. V. 120. P. 407–422.
Meinke D.W. Seed development in Arabidopsis thaliana // Arabidopsis / Eds. Meyerowith E.M., Somerwille C.R. Cold Spring Harber, N.Y.: Cold Spring Harber Laboratory Press, 1994. P. 253–295.
Meinke D.W. Molecular genetics of plant embryogenesis // Ann. Rev. Plant Physiol. Plant Molec. Biol. 1995. V. 46. P. 369–394.
Methods in Molecular Biology. V. 427: Plant Embryogenesis / Eds. Suarez M.E., Bozhkov P.V. Totowa; N.Y.: Humana Press, 2008. 184 p.
Miransaria M., Smithc D.L. Plant hormones and seed germination // Env. Exp. Bot. 2014. V. 99. P. 110–121.
Möller B., Weijers D. Auxin control of embryo patterning // Cold Spring Harb. Perspect. Biol. 2009. V. 1. https://doi.org/10.1101/cshperspect.a001545
Muller B., Sheen J. Cytokinin and auxin interaction in root stem-cell specification during early embryogenesis // Nature. 2008. V. 453. P. 1094–1097.
Müller K., Tintelnot S., Leubner-Metzger G. Endosperm limited Brassicaceae seed germination: abscisic acid inhibits embryo-induced endosperm weakening of Lepidium sativum (cress) and endosperm rupture of cress and Arabidopsis thaliana // Plant Cell Physiol. 2006. V. 47. P. 864–877.
Nambara E., Okamoto M., Tatematsu K., Yano R., Seo M., Kamiya Y. Abscisic acid and the control of seed dormancy and germination // Seed Sci. Res. 2010. V. 20. P. 55–67.
Noga A., Skrzypek E., Warchoł M., Czyczylo-Mysza I., Dziurka K., Marcinska I., Juzon K., Warzecha T., Sutkowska A., Nita Z., Werwinska K. Conversion of oat (Avena sativa L.) haploid embryos into plants in relation to embryo developmental stage and regeneration media // In Vitro Cell Dev. Biol. Plant. 2016. V. 52. P. 590–597.
Paiva R., Kriz A.L. Effect of abscisic acid on embryo-specific gene expression during normal and precocious germination in normal and viviparous maize (Zea mays) embryos // Planta. 1994. V. 192. P. 332–339.
Plant Embryo Culture: Methods and Protocols / Eds. Thorpe T.A., Yeung E.C. N.Y.; London; Dordrecht; Heidelberg: Springer, 2011. 377 p.
Plant Embryogenesis / Ed. Thorpe T.A. Dordrecht: Kluwer Acad. Publ., 1995. 344 p.
Plant Hormones: Biosynthesis, Signal Transduction, Action / Ed. Davies P.J. Dordrecht; Heidelberg; London; N.Y.: Springer, 2010. 802 p.
Przetakiewicz A., Orczyk W., Nadolska-Orczyk A. The effect of auxin on plant regeneration of wheat, barley and triticale // Plant Cell, Tissue and Organ Cult. 2003. V. 73. P. 245–256.
Puthur J.T., Shackira A.M., Saradhi P.P., Bartels D. Chloroembryos: a unique photosynthesis system // J. Plant Physiol. 2013. V. 170. P. 1131–1138.
Rademacher E.H., Lokerse A.S., Schlereth A., Llavata-Peris C.I., Bayer M., Kientz M., Rios A.F., Borst J.W., Lukowitz W., Jurgens G. Different auxin response machineries control distinct cell fates in the early plant embryo // Dev. Cell. 2012. V. 22. P. 211–222.
Raghavan V. Experimental Emryogenesis in Vascular Plants. London: Acad. Press, 1976. 603 p.
Raghavan V. Molecular Embryology of Flowering Plants. Cambridge: Cambridge Univ. Press, 1997. 609 p.
Raghavan V. One hundred years of zygotic embryo culture investigations // In Vitro Cell Dev. Biol. Plant. 2003. V. 39. P. 437–442.
Rai M.K., Shekhawat N.S., Gupta A.K. et al. The role of abscisic acid in plant tissue culture: a review of recent progress // Plant Cell Tiss. Org. Cult. 2011. V. 106. P. 179–190.
Reynolds Th. Plant embryogenesis // Plant Mol. Biol. 1997. V. 33. P. 1–10.
Robert Boisivon H., Crhak Khaitova L., Mroue S., Frimova E. The importance of localized auxin production for morphogenesis of reproductive organs and embryos in Arabidopsis // J. Exp. Bot. 2015. V. 66. P. 5029–5042.
Rostami H., Giri A., Nejad A.S.M., Moslem A. Optimization of multiple shoot induction and plant regeneration in Indian barley (Hordeum vulgare) cultivars using mature embryos // Saudi J. Biol. Sci. 2013. V. 20. P. 251–255.
Rusmussen R.D., Hole D., Carman J.G. Wheat kernel dormancy and +abscisic acid level following exposure to fluridone // J. Plant Physiol. 1997. V. 150. P. 440–445.
Sauer M., Friml J. Visualization of auxin gradients in embryogenesis // Methods Mol. Biol. 2008. V. 427. P. 137–144.
Schaller G.E., Bishopp A., Kieberc J.J. The Yin-Yang of hormones: cytokinin and auxin interactions in plant deve-lopment // The Plant Cell. 2015. V. 27. P. 44–63.
Seldimirova O.A., Kudoyarova G.R., Kruglova N.N., Zaytsev D.Yu., Veselov S.Yu. Changes in distribution of cytokinins and auxins in cell during callus induction and organogenesis in vitro in immature embryo culture of wheat // In Vitro Cell Dev. Biol. Plant. 2016. V. 52. P. 251–264.
Shamrov I.I., Anisimova G.M. Critical stages of ovule and seed development // Acta Biol. Cracov. Ser. Bot. 2003. V. 45. P. 167–172.
Sharma H.C., Gill B.C. Effect of embryo age and culture media on plant growth and vernalization response in winter wheat // Euphytica. 1982. V. 31. P. 629–634.
Slesak H., Goralski G., Pawłowska H., Skucińska B., Po-pielarska-Konieczna M., Joachimiak A.J. The effect of genotype on a barley scutella culture. Histological aspects // Cent. Eur. J. Biol. 2013. V. 8. P. 30–37.
Sieburth L., Muday G., King E., Benton G., Kim S., Metcalf K., Meyers L., Seamen E., Norman J. SCARFACE encodes an ARF-GAP that is required for normal auxin efflux and vein pattering in Arabidopsis // Plant Cell. 2006. V. 18. P. 1396–1411.
Smet W., Sevilem I., de Luis Balaguer M.A., Wybouw B., Mor E., Miyashima S., Blob B., Roszak P., Jacobs T.B., Boekschoten M., Hooiveld G., Sozzani R., Helariutta Y., de Rybel B. DOF2.1 controls cytokinin-dependent vascular cell proliferation downstream of TMO5/LHW // Curr. Biol. 2019. V. 29. P. 520–529.
Snape J.W., Chapman V., Moss L., Blanchard C.F., Miller T.E. The crossabilities of wheat varieties with Hordeum bulbosum // Heredity. 1979. V. 42. P. 291–298.
Suzuki T., Matsuura T., Kawakami N., Noda K. Accumulation and leakage of abscisic acid during embryo development and seed dormancy in wheat // Plant Growth Regul. 2000. V. 30. P. 253–260.
Symons S.J., Angold R.E., Black M.A., Chapman J.M. Changes in the growth capacity of the developing wheat embryo // J. Exp. Bot. 1983. V. 34. P. 1541–1550.
Vasilyeva V.E., Batygina T.B. Autonomy of the embryo // Embryology of Flowering Plants. Terminology and Concepts. V. 2. Seed / Ed. Batygina T.B. Science Publishers, Inc. Enfield, NH, USA, 2006. P. 375–382.
Vasilyeva V.E., Batygina T.B., Titova G.E. Morpho-physiological correlations in the development of the reproductive structures of Nelumbo nucifera Gaertn. // Phytomorphology. 1987. V. 37. P. 349–358.
Wareing F.P., Phillips I.D.J. Growth and Differentiation in Plants. Oxford: Pergamon press, 1981. 343 p.
Wendrich J.R., Möller B.K., Uddin B., Radoeva T., Lokerse A.S., Rybel B.D., Weijer D. A set of domain-specific markers in the Arabidopsis embryo // Plant Reprod. 2015. V. 28. P. 153–160.
White C. N., Proebsting W.M., Hedden P., Rivin C.J. Gibberellins and seed development in maize. I. Evidence that gibberellin/abscisic acid balance governs germination versus maturation pathways // Plant Physiol. 2000. V. 122. P. 1081–1088.
Willige B.C., Isono E., Richter R., Zourelidou M., Schwechheimer C. Gibberellin regulates PIN-FORMED abundance and is required for auxin-transport growth and development in Arabidopsis thaliana // Plant Cell. 2011. Online publ. 12 p. https://doi.org/10.1105/tpc.111.086355
Wilson I., Barker G., Lu C., Coghill J., Beswick R., Lenton J., Edwards K. Alteration of the embryo transcriptome of hexaploid winter wheat (Triticum aestivum cv. Mercia) during maturation and germination // Funct. Integr. Genomics. 2005. V. 5. P. 144–154.
Wu K., Wang J., Kong Z., Ma Z.-Q. Characterization of a single recessive yield trait mutant with elevated endogenous ABA concentration and deformed grains, spikelets and leaves // Plant Sci. 2011. V. 180. P. 306–312.
Xu Y., Zhang W., Gao Y., Zhao Y., Guo L., Wang J. Proteomic analysis of embryo development in rice (Oryza sativa) // Planta. 2011. Online publ. https://doi.org/10.1007/s00425-011-1535-4
Zhang W., Wang X., Fan R., Yin G., Wang K., Du L., Xiao L., Ye X. Effects of inter-culture, arabinogalactan proteins, and hydrogen peroxide on the plant regeneration of wheat immature embryos // J. Integr. Agricult. 2015. V. 14. P. 11–19.
Zhao J., Zhou C., Yang H.Y. Isolation and in vitro culture of zygotes and central cells of Oryza sativa L. // Plant Cell Repts. 2000. V. 19. P. 321–326.
Zhao S., Jiang Q., Ma J. et al. Characterization and expression analysis of WOX5 genes from wheat and its relatives // Gene. 2014. V. 537. P. 63–69.
Zhao S., Jiang Q.-T., Ma J., Wang J.-R., Liu Y.-X., Chen G.-Y., Qi P.-F., Pu Z.-E., Lu Z.-X., Zheng Y.-L., Wei Y.-M. Characterization and expression analysis of WOX2 homeodomain transcription factor in Aegilops tauschii // Genet. Mol. Biol. 2015. V. 38. P. 79–85.
Zocchi G., de Nisi P. Physiological and biochemical mechanisms involved in the response to abscisic acid in maize coleoptiles // Plant Cell Physiol. 1996. V. 37. P. 840–846.
Zuraida A.R., Naziah B., Zamri Z., Sreeramanan S. Efficient plant regeneration of Malaysian indica rice MR 219 and 232 via somatic embryogenesis system // Acta Physiol. Plant. 2011. V. 33. P. 1913–1921.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


