Онтогенез, 2020, T. 51, № 1, стр. 19-34
Роль редокс-системы в инициации регенерационного ответа нейральных тканей глаза позвоночных
Ю. В. Маркитантова a, *, В. Н. Симирский a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: yuliya.mark@gmail.com
Поступила в редакцию 29.05.2019
После доработки 05.07.2019
Принята к публикации 16.07.2019
Аннотация
В обзоре рассматривается роль окислительного стресса (ОС) в первичном ответе клеток нейральных тканей глаза на повреждение и дегенеративные процессы. В основе развития ОС лежит нарушение равновесия (гомеостаза) редокс-системы в сторону окислительных процессов. ОС может использоваться как часть защитного механизма, инициирующего процессы заживления и регенерации поврежденных тканей. Нарушение редокс-гомеостаза и развитие ОС запускает в сетчатке воспалительную реакцию и иммунный ответ. Основные реакции на стресс – высвобождение АТФ, ионов кальция и активных форм кислорода (АФК) во внеклеточное пространство, привлечение экзогенных иммунных клеток, активация эндогенных макро- и микроглии, апоптоз нейронов – универсальны и консервативны у всех позвоночных. Тем не менее, при сходстве некоторых звеньев клеточных и молекулярных процессов, существуют эволюционно закрепленные функциональные различия регенерационного ответа клеток сетчатки, и финальный результат у разных видов позвоночных не равнозначен. Это определяет выбор стратегий регенерации: активация эндогенных стволовых/прогениторных клеток и/или репрограммирование дифференцированных клеток (пигментный эпителий сетчатки, глия Мюллера). Выявление ключевых сигнальных путей, через которые реализуется влияние ОС на регенерационные ответы при повреждении и патологии нейральных тканей глаза позвоночных, будет способствовать выбору оптимальных стратегий клеточной и/или генной терапии для активации внутреннего регенерационного потенциала нейральных тканей сетчатки у человека.
В норме в клетках поддерживается баланс между окислительными и восстановительными процессами (окислительно-восстановительный баланс, редокс-баланс или редокс-гомеостаз), которые активно изучаются на протяжении многих лет в связи с ролью окислительного стресса (ОС) и антиоксидантной защиты в регуляции метаболизма клеток и канцерогенеза. Эти процессы обеспечивают реализацию основных функций клеток (пролиферация, миграция, дифференцировка, апоптоз), а также поддерживают их жизнеспособность (Trachootham et al., 2008; Moldogazieva et al., 2018; Borquez et al., 2016). На молекулярном уровне редокс-система регулирует синтез ДНК, экспрессию целого ряда генов, активность ферментов и сигнальных белков, проницаемость мембранных каналов и многие другие процессы (Ray et al., 2012; Bindoli, Rigobello, 2013; Sies et al., 2017). Редокс-система обеспечивает поддержание равновесной концентрации АФК и антиоксидантов и, соответственно, состоит из двух основных частей: прооксидантной и антиоксидантной. Прооксидантная система представлена низкомолекулярными АФК (гидроксильный радикал OH•, синглетный кислород 1O2, супероксид ${\text{O}}_{{\text{2}}}^{ - },$ перекись водорода, оксид азота NO и др.), которые генерируются в качестве побочных продуктов в дыхательной цепи митохондрий или синтезируются специализированными ферментами (НАДФ-оксидаза, синтаза оксида азота) (Bindoli, Rigobello, 2013; Emanuele et al., 2018). Молекулярные пути регуляторного действия АФК все еще недостаточно изучены, однако показана их ведущая роль во многих физиологических процессах. АФК и взаимодействующие с ними антиоксиданты рассматривают как функционально связанные редокс-активные молекулы, которые являются ключевыми компонентами окислительно-восстановительных процессов (Черенкевич и др., 2009; Moldogazieva et al., 2018). Антиоксидантная система включает низкомолекулярные антиоксиданты (витамин C, глутатион, таурин, мочевая кислота, цистеин, бета-каротин и др.) и ферментные системы, которые нейтрализуют АФК (супероксиддисмутаза, каталаза, пероксиредоксины) или восстанавливают окисленные белки и липиды (например, глутатионовая система ферментов) (Tokarz et al., 2013). Нарушение равновесия в сторону окислительных процессов ведет к ОС, в сторону восстановительных – к восстановительному стрессу (Perez-Torres et al., 2017). В основе ОС лежит накопление АФК, ведущее к преобладанию прооксидантов (окислителей) над антиоксидантами (восстановителями). АФК неустойчивы, но влияют на активность ряда ферментов (протеиназы, фосфатазы, фосфолипазы) и модулируют экспрессию факторов транскрипции, обеспечивая тем самым глобальные устойчивые изменения активности генов и клеточного метаболизма. Низкие концентрации АФК индуцируют экспрессию антиоксидантных ферментов и оказывают стимулирующее действие на пролиферацию и жизнеспособность клеток, средние – стимулируют воспалительные реакции, а высокие – вызывают разрушение мембран митохондрий и приводят к активации апоптоза и гибели клеток (Lushchak, 2011). Деструктивная активность АФК заключается в окислении белков, липидов и ДНК (Sies et al., 2017). Окисленные формы белков при избыточном накоплении могут агрегировать и вызывать дополнительный эндоплазматический стресс и реакцию на неструктурированный белок (Unfolded Protein Response, UPR) (Zhang et al., 2014).
Известно, что различные органы и ткани демонстрируют различную устойчивость к действию компонентов ОС. Считается, что это связано именно с особенностями работы антиоксидантных систем и метаболизма тканей, характером экспрессии общих ключевых ферментов защиты клеток и особенностями метаболизма тканей. В свою очередь, особенности метаболизма различных типов клеток связаны с устойчивостью к ОС через поддержание внутриклеточного редокс-потенциала (Kortuem et al., 2000; Isenmann et al., 2003).
Важное место редокс-система занимает в нормальном функционировании сетчатки глаза. Эта ткань, являясь производной частью нервной системы, высокочувствительна к развитию свободно-радикальных реакций. Сетчатка обладает повышенной метаболической активностью, подвержена постоянному воздействию света, характеризуется высоким уровнем полиненасыщенных жирных кислот на фоне низкой активности антиоксидантных ферментов, что обуславливает ее предрасположенность к постоянной генерации активных форм кислорода (Leveillard, Sahel, 2017).
Сетчатка имеет у разных представителей животного царства свои морфофункциональные особенности, однако общий план строения схож у всех позвоночных животных и человека (Kolb 2012; Lamb, 2013). Эта высокоорганизованная ткань, которая у позвоночных включает шесть основных типов нейронов (фоторецепторы, биполярные клетки, горизонтальные клетки, амакриновые клетки, гаглиозные клетки, интерплексиформные нейроны) и четыре типа клеток радиальной глии (клетки Мюллера, астроциты, микроглия, олигодендроциты), выстилающих дно и боковую поверхность глазного бокала в виде радиальных слоев (Tsukamoto, 2018, Hoon et al., 2014) (рис. 1). Различают три ядерных слоя, состоящих из различных типов сенсорных нейронов, и двух сетчатых слоев, наружного и внутреннего, представляющих собой синаптические связи между нейронами сетчатки пограничных ядерных слоев. Наружный ядерный слой сетчатки состоит из светочувствительных клеток – палочек и колбочек фоторецепторов, участвующих в фототрансдукции. Наружные сегменты фоторецепторов находятся в тесном контакте с ретинальным пигментным эпителием (РПЭ) – однорядным слоем интенсивно пигментированных эпителиальных клеток. Клетки РПЭ находятся между фоторецепторами и сосудистой оболочкой и выполняют ряд физиологических функций – участвуют в защите фоторецепторов от избытка света, трансдукции зрительного сигнала, гомеостазе сетчатки (секреция факторов роста, регуляция баланса ионов в субретинальном пространстве), фагоцитозе слущивающихся дисков наружных сегментов фоторецепторов (Strauss, 2005; Mazzolini et al., 2015). РПЭ подстилает мембрана Бруха, которая состоит из компонентов эндотелия сосудистой оболочки, богатой капиллярами, и уплотненного фибриллярного слоя собственно базальной пластинки РПЭ (Amram et al., 2017).
Рис. 1.
Строение сетчатки глаза позвоночных (модифицировано по Newman, 2015). ИП нейрон – интерплексиформный нейрон, НСС – наружный сетчатый слой, НЯС – наружный ядерный слой, ВСС – внутренний сетчатый слой, ВЯС – внутренний ядерный слой.

Второй ядерный слой сетчатки – внутренний – сформирован интернейронами (биполяры, амакриновые и горизонтальные клетки). Благодаря биполярам осуществляется передача зрительного сигнала от фоторецепторов в слой ганглиозных клеток. Горизонтальные и амакриновые клетки, осуществляют горизонтальную связь между всеми клеточными элементами сетчатки (Tsukamoto, 2018; Kolb, 2013). Ядра ганглиозных клеток – нейроны второго порядка, образуют третий ядерный слой – ганглиозный, а их аксоны участвуют в формировании зрительного нерва (Sanes, Masland, 2015).
В наружном сетчатом слое осуществляются синаптические контакты между палочками и колбочками и вертикально ориентированными биполярными нейронами, во внутреннем сетчатом слое сигнал трансдукции переключается с биполяров на ганглиозные и амакриновые нейроны, в вертикальном и горизонтальном направлении. Наружный сетчатый слой образован синаптическими контактами между палочками/колбочками и биполярными клетками, а внутренний сетчатый слой осуществляет связь между биполярными и ганглиозные нейронами, а также горизонтальную связь между амакриновыми и горизонтальными нейронами (Kolb, 2007a, 2007b).
Во внутреннем ядерном слое сетчатки локализуются тела клеток глии Мюллера, которая пронизывает всю сетчатку, от наружной до внутренней пограничных базальных мембран (сформированных отростками этих клеток), локализованных на границе сетчатых слоев ткани. Глия Мюллера относится к макроглии сетчатки, осуществляет контакты со всеми типами составляющих нейронов, выполняя структурную и нейротрофическую функции (Subirada et al., 2018). В сетчатке различают и другие элементы макроглии, такие как астроциты, основные функции которых связаны с поддержанием структуры и метаболической активности нейронов сетчатки. В ответ на нейральную активность, астроциты способны выделять вазоактивные вещества (оксид азота, простагландины), которые регулируют тонус сосудов сетчатки (Kimelberg, 2010). В сетчатке присутствует также микроглия, которая представлена резидентной популяцией иммунокомпетентных клеток (Genini et al., 2014).
Кровоснабжение сетчатки осуществляется из центральной артерии сетчатки, питающей ее внутренние клеточные слои, и хориокапиллярами, обеспечивающими кровоснабжение наружных слоев (слой фоторецепторов, наружный ядерный и наружный сетчатый слои) (Selvam et al., 2018). Нейроны сетчатки, макроглия и микроглия, а также клетки стенок микрососудов (эндотелиоциты и перициты) взаимодействуют между собой и формируют гематоретинальный барьер, который регулирует поступление кислорода и трофических факторов к нейронам сетчатки и участвует в рециркуляции нейротрансмиттеров и продуктов метаболизма (Cunha-Vaz et al., 2011; Diaz-Coranguez et al., 2017; Trost et al., 2019).
Сетчатка чувствительна к ОС из-за высокого уровня потребления кислорода и воздействия света. В литературе накоплено немало данных о том, что ОС является одним из основных звеньев в развитии возрастной макулярной дегенерации (ВМД) и нейродегенерации при глаукоме, являясь причиной первичного повреждения клеток РПЭ и повреждения ганглиозных клеток, соответственно (Beatty et al., 2000). Наиболее чувствительными к изменению редокс-потенциала являются РПЭ и фоторецепторы. АФК в фоторецепторах возникают в результате активности митохондрий (как побочный продукт цепи окислительного фосфорилирования) и в процессе фототрансдукции при действии света на светочувствительные пигменты палочек и колбочек (Masutomi et al., 2012; Roehlecke et al., 2013). В свою очередь, под действием АФК происходит перекисное окисление полиненасыщенных липидов (докозагексаеновая кислота и др.), которыми обогащены плазматические мембраны дисков фоторецепторов (Simon et al., 2016). Антиоксидантная система РПЭ представлена низкомолекулярными антиоксидантами (альфа-токоферол, ретинол, аскорбиновая кислота, глутатион) и ферментами (супероксиддисмутаза, глутатион-пероксидаза) (Strauss, 2005). Антиоксидантная система фоторецепторов представлена каротиноидами, лютеином и зеаксантином, которые поглощают часть световых лучей и частично нейтрализуют АФК (Tokarz et al., 2013), а также рядом ферментов (глутатионпероксидаза, супероксиддисмутаза и др.) (Usui et al., 2011; Ueta et al., 2012) (рис. 2).
Рис. 2.
Факторы генерации активных форм кислорода (АФК) и основные внутриклеточные последствия окислительного стресса (модифицировано по Tokarz et al., 2013). ГТП – глутатионпероксидаза; РПЭ – ретинальный пигментный эпителий, СОД – супероксиддисмутаза. Фиолетовые метки – прооксидантные факторы, зеленые метки – антиоксидантные факторы.
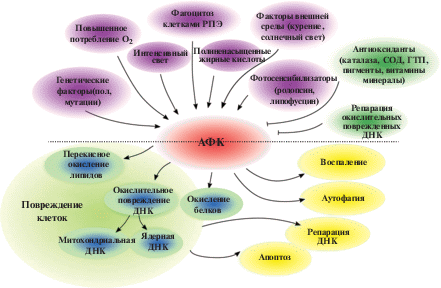
РПЭ также подвержен воздействию света, который вызывает окисление (обесцвечивание) меланина (Zareba et al., 2007), принимающего активное участие в “нейтрализации” АФК (прежде всего синглетного кислорода) (Seagle et al., 2005; Wang et al., 2006). Кроме того, РПЭ фагоцитирует диски фоторецепторов, обогащенные АФК и липофусцином (основной продукт окисления полиненасыщенных липидов) (Hunter et al., 2012). Таким образом, высокий уровень продукции АФК в клетках РПЭ и фоторецепторах, наряду с постоянным воздействием агрессивных экзогенных факторов (кислород, свет), определяют повышенный риск этих клеток к развитию ОС (Seagle et al., 2005; Wang et al., 2006). Активация реакций свободнорадикального окисления вызывает повреждение липидов биологических мембран, белков и нуклеиновых кислот, в результате чего накапливаются специфические маркеры окисления, такие как малоновый диальдегид, 4-гидроксиноненаль, конечные продукты гликолиза, что приводит к патологической активации иммунной системы (Tate et al., 1995; Sun et al., 2006; Jacobs, Marnett, 2010; Keeling et al., 2018). Развитие этих процессов нарушает взаимодействие между фоторецепторами и РПЭ, ведет к накоплению продуктов распада клеток и липофусциновых гранул и образованию многочисленных друз и атипичных утолщений в мембране Бруха, что снижает центральное зрение (Blasiak et al., 2014).
На сегодняшний день выделяют несколько механизмов, которые могут привести к нейродегенеративному процессу в сетчатке: накопление внеклеточного глутамата, ОС, снижение уровня нейропротекторных факторов, которые синтезируются сетчаткой (Simo, Hernandez, 2014). В свете современных представлений о патогенезе нейродегенеративных заболеваний повреждение нейральных клеток протекает в виде каскада внутриклеточных реакций, включающих глутаматную эксайтотоксичность; повышение внутриклеточного уровня кальция и, соответственно, активацию кальций-зависимых ферментов; повышение продукции АФК, локальную воспалительную реакцию, и, в конечном итоге, развитие ОС. Окисление глутамата приводит к усиленному образованию супероксида в митохондриях (Fukui, Zhu, 2010), что имеет большое значение для генерации АФК в преимущественно глутаматергических нейральных сигнальных путях сетчатки (Williams, Dexter, 2014). На ранних этапах развития патологий сетчатки (дисплазия, ретинопатия) связанных с нарушением функций клеток, изменения в сетчатке еще носят обратимый характер. Поздние этапы характеризуются полной дегенерацией сетчатки, связанной с массовой гибелью специализированных нейронов и/или глии.
Интенсивные исследования последних лет убедительно продемонстрировали, что ОС нельзя однозначно рассматривать как негативный процесс для клеток, тканей и организма в целом. Напротив, он используется как часть защитного механизма, который, в частности, инициирует процессы заживления и регенерации поврежденных тканей (Roy, Levesque, 2006; Kozakowska et al., 2015; Galluzzi et al., 2016; Wan, Goldman, 2016). Повреждение сетчатки может быть следствием действия различных внешних и внутриклеточных факторов, которые могут затрагивать отдельные типы клеток и отдельные области сетчатки (такие как макула). Различают такие типы повреждения сетчатки как: 1) дегенерация клеток сетчатки из-за наследственных мутаций (Kumaramanickavel, 2016); 2) механическое повреждение (Zhao et al., 2014); 3) отслоение сетчатки (разобщение слоя РПЭ с фоторецепторами) (Nakazawa et al., 2006; Fisher et al., 2007); 4) повреждение сетчатки (прежде всего фоторецепторов и РПЭ) под воздействием света (ультрафиолетовое излучение, лазер) (Nakanishi-Ueda et al., 2013); 5) повреждение зрительного нерва (Sharma et al., 2014; Sato et al., 2018); 6) повреждение сетчатки как следствие системных заболеваний (диабет, гипертензия, болезнь Альцгеймера и др.) (Iqbal et al., 2014; 2019; Werdich et al., 2014). В результате перечисленных воздействий нарушается тканевой гомеостаз, и клетки испытывают стресс.
В процессе регенерации ткани можно выделить три основных этапа (модуля): 1) первичный ответ ткани на повреждение (заживление раны); 2) индукция регенерационного ответа и формирование бластемы; 3) восстановление структуры ткани за счет дифференцировки клеток бластемы (Galliot, Chera, 2010; Galliot, Ghila, 2010) (рис. 3). На первом этапе в ответ на стрессовую ситуацию наблюдается активная миграция в поврежденную ткань фагоцитов, активация эндогенных микро- и/или макроглии (глия Мюллера), нарушение гематоретинального барьера и дегенеративные изменения в фоторецепторах и ганглиозных клетках (Wan et al., 2012; Langhe et al., 2017). На втором этапе происходит активация эндогенных стволовых/прогениторных плюрипотентных клеток и/или репрограммирование дифференцированных клеток с их последующей пролиферацией и формированием бластемы (Chiba, Mitashov, 2007; Chiba, 2014). На последнем этапе в недифференцированных клетках бластемы происходит активация программ дифференцировки, в большей или меньшей степени сходных с аналогичными эмбриональными программами, и восстанавливается (полностью или частично) нормальная структура ткани (Inami et al., 2016). В настоящем обзоре мы остановимся на первых двух этапах, которые в совокупности и обеспечивают инициацию регенерационного ответа ткани.
Рис. 3.
Этапы (модули) регенерационного ответа сетчатки на повреждение (модифицировано по Meda et al., 2018). АФК – активные формы кислорода; РПЭ – ретинальный пигментный эпителий.
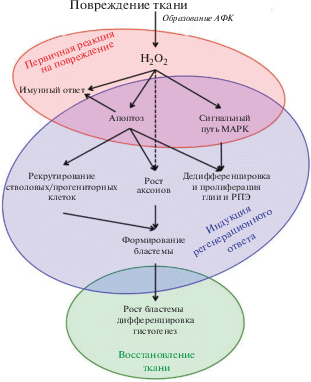
На первом этапе, независимо от рода повреждающего воздействия, повреждение и гибель клеток (прежде всего, фоторецепторов и ганглиозных клеток) запускает в сетчатке воспалительную реакцию и иммунный ответ, которые способствуют восстановлению тканевого гомеостаза и заживлению раны. В зоне повреждения запускается каскад защитных реакций, медиаторами которых выступают ионы кальция, АТФ и АФК, высвобождающиеся в межклеточное пространство из поврежденных клеток (Mitchell et al., 2008; Cordeiro, Jacinto, 2013). АТФ стимулирует увеличение концентрации внутриклеточного кальция и перекиси водорода посредством пуринергических рецепторов P2X7 (Mitchell et al., 2008). Противоположным эффектом обладает аденозин, который возникает при гидролизе АТФ под действием экзонуклеозидаз. Аденозин действует на A3-аденозиновые рецепторы и останавливает возрастание внутриклеточной концентрации кальция (Zhang et al., 2006). Внеклеточный кальций активирует окислительные ферменты (Duox, НАДФH-оксидазы) и стимулирует быстрый выброс перекиси водорода (Vriz et al., 2014). АФК, в основном относительно стабильная перекись водорода, диффундируют в соседние участки сетчатки. В результате создается градиент концентрации перекиси водорода, который выступает в качестве паракринного сигнала (Cordeiro, Jacinto, 2013). Усиление продукции внутриклеточных АФК ведет к интенсификации свободнорадикального окисления и развитию ОС (Suzuki, Mittler, 2012; Nakanishi-Ueda et al., 2013).
Повреждение нейральных тканей, сопровождаемое ОС, в совокупности с факторами воспаления, активирует ряд регуляторных факторов (Erler, Monaghan, 2015). На генном уровне после травмы тканей наблюдается активация вовлеченных в иммунный ответ генов и протоонкогенов (Zacks et al., 2006; Zacks, 2009). Повреждение сетчатки приводит к активации эндогенной микроглии, которая представляет популяцию первичных иммунокомпетентных клеток сетчатки (Akhtar-Schafer et al., 2018), и одновременно, вследствие нарушения проницаемости гематоретинального барьера, ведет к инфильтрации сетчатки иммунными клетками крови (моноциты/макрофаги) (Ma et al., 2017). Макрофаги продуцируют большие количества перекиси водорода, которая обеспечивает неспецифическую защиту за счет антисептического эффекта и модулирующего влияния на иммунные реакции в области повреждения ткани (Winterbourn, Kettle, 2013). Кроме того, перекись водорода привлекает в область повреждения дополнительные макрофаги, являясь для них хемоаттрактантом (Wang et al., 2015), а также вызывает апоптоз и гибель перицитов (Amano et al., 2005), тем самым еще больше разрушая гематоретинальный барьер. РПЭ играет при этом двоякую роль: с одной стороны, он секретирует экзосомы, которые содержат ангиогенный фактор VEGFR (Atienzar-Aroca et al., 2016) с другой стороны, в его клетках формируются инфламмасомы, принимающие участие в иммунной защите сетчатки (Akhtar-Schafer et al., 2018). Наиболее стабильные АФК (перекись водорода, оксид азота) служат посредниками в межклеточной передаче сигнала (van der Vliet, Janssen-Heininger, 2014; Reczek, Chandel, 2015). Очевидно, что согласованная работа молекулярных факторов, усиленно продуцирующихся в клетках при повреждении, направлена на восстановление клеточного и метаболического гомеостаза сетчатки (Cuenca et al., 2014). В результате ОС часть клеток поврежденной сетчатки подвергается апоптозу, даже если в последствие происходит инициация пролиферации и репрограммирование клеток. Однако существует точка зрения, согласно которой продукция и ингибирование продукции АФК являются процессами, задействованными для стимуляции нейрогенеза (Hameed et al., 2015), и могут быть использованы для активации программы замещения утраченных нейронов.
АФК оказывают свое влияние на общий метаболизм клеток и, в частности, через обратимое окисление остатков цистеина в ключевых регуляторных белках, активируют сигнальные пути, специфичные для ОС, такие как JNK и MAPK, а также вызывают гибель клеток путем апоптоза (Zacks et al., 2006; Zacks, 2009; Vriz et al., 2014). Повреждение сетчатки (особенно при воздействии интенсивного света или токсинов) сопровождается массовой гибелью клеток в результате апоптоза и/или некроза (Nakanishi et al., 2013). Для успешной регенерации необходимо удалить остатки клеток, поэтому важную роль на начальных этапах регенерации играют процессы фагоцитоза. Утилизация апоптотических фрагментов клеток – одна из основных функций макрофагов, а также эндогенной микроглии, активированной под действием АФК. В условиях ОС микроглия мигрирует во внешние слои сетчатки, где участвует в утилизации фрагментов фоторецепторов и РПЭ (Cuenca et al., 2014). Следует отметить, что мигроглия способна фагоцитировать и нефрагментированные палочки, в случае пигментного ретинита (Zhao et al., 2015). Фагоцитарной активностью обладают и клетки РПЭ, которые утилизируют “отработанные” диски фоторецепторов в интактной сетчатке, а в условиях ОС активность клеток РПЭ возрастает, что проявляется в фагоцитозе апоптотических фрагментов других типов клеток (Sun et al., 2006).
Первичная реакция сетчатки на повреждение сменяется этапом репарации ткани, в результате которого происходит фиброзное заживление или полноценная регенерация ткани. Анализ репарации повреждений сетчатки у разных видов животных позволяет сделать вывод, что основные реакции (высвобождение АТФ, ионов кальция и АФК во внеклеточное пространство, привлечение иммунных клеток, активация макро- и микроглии, апоптоз нейронов) универсальны и консервативны у всех позвоночных (Bely, Nyberg, 2010; Ferretti, 2011; Neves et al., 2016). Однако в одних случаях они способствуют успешной регенерации (у рыб и амфибий), а в других (у млекопитающих) – ведут к массированной гибели клеток и фиброзному перерождению сетчатки (Murawala et al., 2012; Erler, Monaghan, 2015). Совокупность данных, полученных на разных моделях, свидетельствует о том, что независимо от характера и степени повреждения сетчатки, основной реакцией составляющих ее клеток является развитие ОС. Все остальные процессы (фагоцитоз, апоптоз, аутофагия, глиоз), которые происходят в сетчатке и в норме, резко усиливаются на фоне ОС. В то же время факторы (клетки, регуляторные белки, сигнальные пути), которые обеспечивают переход от заживления раны к регенерации ткани, остаются до конца невыясненными (Galliot et al., 2017). Предполагается участие врожденной иммунной системы, в частности, Толл-подобных рецепторов (Toll-like receptors, TLR) и АФК в репрограммировании и трансдифференцировке клеток при заживлении раны (Anders, Schaefer, 2014; Zhou et al., 2016).
Какой вклад вносит в процесс регенерации первичный ответ ткани на повреждение? Элиминация экзогенных макрофагов не влияет на регенерацию сетчатки рыб после ее повреждения, тогда как элиминация микроглии приводит к подавлению регенерации (Conedera et al., 2019). Очевидно, микроглия не только участвует в утилизации отмерших клеток, но и оказывает стимулирующее действие на процесс регенерации. Дополнительным активирующим фактором является гибель части клеток сетчатки в результате апоптоза, который запускается под действием перекиси водорода (Kaneko et al., 1999). Предполагают, что каспазы, активация которых ведет к апоптозу, одновременно усиливают секрецию факторов роста и простагландинов отмирающими клетками (Li et al., 2010) и в итоге активируют компенсационную пролиферацию оставшихся клеток и регенерацию ткани (так называемый “путь возрождения феникса”, “Phoenix Rising” pathway). С другой стороны, в результате апоптоза могут быть элиминированы клетки, которые поддерживают клеточный гомеостаз ткани путем ограничения пролиферации (Vriz et al., 2014). Таким образом, существует несколько типов критических воздействий на клетки сетчатки, которые могут стимулировать как чрезмерную пролиферативную активность клеток глии, так и приводить к гибели нейронов и дегенерации ткани.
Ранние молекулярно-генетические и клеточные процессы при повреждении или отслойке сетчатки позвоночных направлены, прежде всего, на защиту клеток от стресса, воспаления и дегенеративных изменений, но приводит у разных видов к разному финальному результату (Chiba, 2014). Реакция на повреждение сетчатки, разобщение межклеточных связей собственно нейральной сетчатки и РПЭ, при существовании сходства в некоторых звеньях клеточных процессов, проявляется в разном регенеративном ответе клеток у разных позвоночных. Разобщение связи РПЭ с сетчаткой и утрата межклеточных связей РПЭ с мембраной Бруха у некоторых хвостатых амфибий, как известно, активирует цепь молекулярных и клеточных событий, приводящих к инициации процесса регенерации и полноценному восстановлению сетчатки (Grigoryan, 2012; Grigoryan, Markitantova, 2016). В основе процесса регенерации сетчатки у этих животных лежит явление трансдифференцировки (естественного репрограммирования) специализированных клеток РПЭ, которое проходит через этапы дедифференцировки клеток, их конверсии в нейробласты, пролиферации и возникновения клеток-предшественников, восполняющих все типы нейронов и глии, присущие полноценной сетчатке (Mitashov, 1996, 1997). У млекопитающих и человека при нарушении связи РПЭ с нейральной сетчаткой происходит активация пролиферации и конверсия клеток РПЭ по пути эпителиально-мезенхимной дифференцировки, что приводит к дегенеративным процессам в нейральной части сетчатки (Kirchhoff, Sorgente, 1989; Chiba, 2014). В этом существенное отличие поведения клеток РПЭ млекопитающих, которое лежит в основе развития патологий сетчатки и РПЭ человека in vivo, от естественного репрограммирования клеток РПЭ тритона по нейральному пути дифференцировки, приводящего к полноценному восстановлению сетчатки (Salero et al., 2012; Chiba, 2014). Помимо этого, в отличие от низших позвоночных, для сетчатки млекопитающих типично явление реактивного глиоза, проявляющегося в усиленной пролиферации клеток глии Мюллера и увеличении числа их отростков, как в ответ на повреждение, так и при ряде патологических состояний (Bringmann et al., 2009; de Hoz et al., 2016).
Потенциальными клеточными источниками для регенерации сетчатки у позвоночных могут служить резидентные стволовые/прогениторные клетки или дифференцированные клетки, такие как РПЭ и глия Мюллера (Bi et al., 2009; Barbosa-Sabanero et al., 2012; Ail, Perron, 2017). В первом случае происходит активация пролиферации недифференцированных клеток с их последующей дифференцировкой. Во втором случае, когда источником регенерации служат РПЭ или глия Мюллера, пролиферации предшествует этап дедифференцировки – потеря клетками специализированных внутриклеточных структур и приобретение ими плюрипотентности (Wan et al., 2012; Reichenbach, Bringmann, 2013; Islam et al., 2014; Sifuentes et al., 2016). Дедифференцировка, пролиферация и приобретение плюрипотентности являются ключевыми процессами, обеспечивающими второй этап – инициацию регенерации сетчатки, тогда как успешное ее завершение (третий этап) требует наличия дополнительных факторов, обеспечивающих программирование (в случае стволовых/прогениторных клеток) или репрограммирование (в случае дифференцированных клеток) пролиферирующих клеток и их дифференцировку с восстановлением нормальной морфологической структуры сетчатки.
В процессе дедифференцировки клеток активно участвуют макрофаги и микроглия, а также задействованы внутриклеточные процессы аутофагии и митофагии. Погибшие клетки высвобождают во внеклеточную среду АТФ и АФК, а макрофаги дополнительно секретируют провоспалительные цитокины – фактор некроза опухоли альфа (TNF-alpha) и интерлейкин IL-1beta. Эти факторы способны стимулировать активность эндогенной микроглии сетчатки. TNF-alpha обеспечивает дальнейшее усиление ОС, запуская экспрессию индуцибельной синтазы оксида азота (iNOS) и НАДФН-оксидазы в микроглие и глие Мюллера (Stevenson et al., 2010). Активированная микроглия сетчатки, в свою очередь, также секретирует провоспалительные цитокины, которые вызывают гибель ганглиозных клеток (Dvoriantchikova, Ivanov, 2014). Предполагается, что в норме в ткани поддерживается равновесие между провоспалительной/прооксидантной и антивоспалительной/антиоксидантной системами, которое нарушается в сторону первой при повреждении ткани (Fischer, Maier, 2015).
На молекулярном уровне прослеживается сходство ответа клеток сетчатки на стресс, возникающий у хвостатых амфибий и млекопитающих при разных типах повреждений, вызванных отслоением сетчатки или повреждением зрительного нерва. Это сходство проявляется в ремоделировании внеклеточного матрикса (Nabeshima et al., 2013; Lenkowski, Raymond, 2014), активации генов воспаления и клеточного стресса (Jarrett, Boulton, 2005; Haynes et al., 2013), усилении экспрессии белков теплового шока (HSPs) (Nagashima et al., 2011), активации протоонкогенов с-fos, c-myc, c-jun и AP-1 комплекса, вовлеченных в иммунный ответ (Isenmann et al., 2003; Lu et al., 2003; Delyfer et al., 2011; Belin et al., 2015; Mitra et al., 2019). Как у амфибий, так и у млекопитающих, в РПЭ происходит раннее блокирование экспрессии генов-маркеров зрительного цикла (Rpe65, Lrat, Rdh5, Rdh10, Rbp1) под действием провоспалительных цитокинов TNFα и IL-1β (Chiba et al., 2006; Nakazawa et al., 2006; Kang et al., 2018).
Среди сигнальных белков, опосредующих ранний клеточный ответ на повреждение (пролиферация, фенотипические изменения) – продуцируемые клетками сосудистой сети и РПЭ факторы роста FGF2, PEDF и VEGF, соотношение которых важно для нормального функционирования сосудистой сети, регуляции дифференцировки РПЭ, поддержания пролиферации клеток-предшественников при регенерации сетчатки амфибий, а также поддержания дифференцировки клеток РПЭ млекопитающих. У последних, вскоре после отслойки нейральной части сетчатки от РПЭ, также усиливается экспрессия гена FGF2 и соответствующих рецепторов FGFR (Geller et al., 2001; Nakazawa et al., 2006). Известна роль сигнальных путей IGF-1, CNTF и TGFβ в процессе репрограммирования клеток РПЭ у Urodela. IGF-1, как и FGF2, ускоряет пролиферацию и проявление пронейральной дифференцировки в клетках РПЭ (Bringmann et al., 2009). В то же время TGFβ выполняет функцию запрещающего фактора в отношении репрограммирования клеток РПЭ, а также ингибирует пролиферацию РПЭ после отслойки сетчатки у человека (Dieudonne et al., 2004).
Перечисленные регуляторные факторы в большей или меньшей степени зависят от состояния редокс-системы клеток, а, следовательно, чувствительны к ОС. В частности, показано, что в условиях стресса FGF2 перемещается в цитоплазму и ядра клеток, что, по-видимому, обеспечивает их защиту от апоптоза (Kostas et al., 2018). Миграцию белка FGF2 в цитоплазму и ядра клеток наблюдали также на ранних стадиях регенерации сетчатки у хвостатых амфибий P. waltl (Маркитантова и др., 2016). В условиях гипоксии и сопутствующего ей ОС секреция клетками РПЭ ангиогенного фактора VEGF-A увеличивается при одновременном снижении секреции ангиогенного ингибитора PEDF, что ведет, в частности, к неоваскуляризации при ВМД (Schlingemann, 2004; Solberg et al., 2013). Перекись водорода индуцирует секрецию TGFbeta в РПЭ и вызывает старение этих клеток (Yu et al., 2009).
Помимо сходства в работе ряда сигнальных путей, действие которых направленно на защиту клетки от стресса, существуют эволюционно закрепленные функциональные различия стратегий клеточных процессов и морфогенеза у отдаленных видов позвоночных, объясняемые различиями в генетических программах регуляции дифференцировки клеток сетчатки на уровне транскриптома, генома, эпигенома и метаболома (см.: Bely, Nyberg, 2010; Cvekl, Mitton, 2010; Fuhrmann, 2010; Solberg et al., 2013; Chung, 2016; Sato et al., 2018; Dvoriantchikova et al., 2019). С помощью технологии Cre-lox показано, что при регенерации сетчатки у взрослого тритона активация фактора транскрипции Pax6 определяет выбор клетками РПЭ нейрального пути дифференцировки с формированием полноценной сетчатки. В то же время, выключение гена Pax6 в РПЭ тритона является причиной нарушений регенерации сетчатки и возникновения структур мезенхимного типа, аналогичных тем, которые наблюдаются при повреждении сетчатки и последующем развитии витреопролиферативной патологии у человека in vivo (Casco-Robles, 2016). Существующие различия связаны не только с особенностями регуляции дифференцировки клеток, но, прежде всего, находят объяснение в особенностях структурной организации генома у позвоночных (Abdullayev et al., 2013; Nakamura et al., 2014; Bennis et al., 2015; Inami et al., 2016; Elewa et al., 2017; Nowoshilow et al., 2018).
Процесс регенерации регулируется как на локальном (тканевом, внутриклеточном, генетическом), так и на системном (органном, организменном) уровне (Бабаева, 1999; Aurora et al., 2014). Таким образом, в одних случаях (рыбы, амфибии), молекулярно-генетические и клеточные процессы при повреждении или отслойке сетчатки способствуют успешной регенерации, в других (млекопитающие) – ведут к массовой гибели клеток и фиброзному перерождению тканей (Chiba, 2014; Lenkowski, Raymond, 2014). Изучение механизмов эндогенного контроля регенерации сетчатки и регенерационных ответов при ее повреждении и патологиях нейральных тканей глаза у разных позвоночных, а также дальнейшее накопление информации о ключевых регуляторах, звеньях и генах-мишенях в системах регуляции, имеет фундаментальное значение. Понимание механизмов восстановительных процессов в сетчатке способствует развитию оптимальных стратегий прикладного характера применительно к возможностям регенерации этой ткани у человека. Основные направления исследований возможностей регенерации сетчатки позвоночных состоят в поиске экзогенных и эндогенных клеточных источников для восполнения пула клеток и разработке фармакологических препаратов для лечения/восстановления сетчатки, в тех ситуациях, когда это может быть осуществимо. Использование клеточных технологий заключается в попытках экспериментального репрограммирования клеток-источников (малодифференцированных клеток, эмбриональных стволовых, эмбриональных прогениторных клеток сетчатки, индуцированных плюрипотентных (iPS) клеток), получения на их основе органоидов и разработки способов трансплантаций (Chen et al., 2016; DiStefano et al., 2018; Llonch et al., 2018; Singh et al., 2018). Различные экспериментальные подходы к регуляции пролиферации и активации программы нейрогенеза в клетках глии Мюллера основаны на стимуляции пролиферации экзогенными факторами из числа сигнальных белков Wnt, Notch, Hedgehog (Hamon et al., 2016), использовании стратегий редактирования генома с помощью CRISPR/Cas9 или за счет активации внутриклеточных факторов транскрипции (Boda et al., 2017; Campbell, Hyde, 2017). Клетки глии Мюллера сетчатки взрослого человека, также как РПЭ, проявляют свойства латентных нейральных прогениторных клеток и в системе in vitro характеризуются активностью факторов транскрипции – маркеров характерных для ретинальных прогениторных клеток PAX6, SOX2, CHX10, NOTCH и белка цитоскелета нестина (Bhatia et al., 2010). Pax6 участвует в процессе нейродегенерации, оказывая прямое влияние на сигнальные пути p53 и TGFbeta и косвенное – на редокс-чувствительные сигнальные пути. Нокаут гена Pax6 приводит к усилению экспрессии антиоксидантных ферментов каталазы и супероксиддисмутазы (Mishra et al., 2015). В качестве факторов, поддерживающих регенерацию, рассматриваются некоторые ростовые факторы, как например, CNTF (Leaver et al., 2006), фактор пигментного эпителия (PEDF) (Vigneswara et al., 2015), фактор роста гепатоцитов (HGF) (Tonges et al., 2011), фактор гипоксии (HIF-1α) (Cho et al., 2015), или их комбинации (Logan et al., 2006). В сетчатке взрослых рыб в ответ на повреждение наблюдается усиление экспрессии ряда факторов роста – CNTF, EGF, FGF, Notch-Delta, WNT (Hamon et al., 2016). Показана возможность активации процесса регенерации сетчатки у эмбрионов кур в результате перепрограммирования клеток РПЭ, под влиянием комплемента C3a, действующего через STAT3 путь. В свою очередь, в ответ на повреждение и воспаление под действием сигналов STAT3 в сетчатке запускается цепь молекулярных событий, включающая возрастание экспрессии генов немедленного реагирования IL-6, IL-8 и Tnf, генов сигнального пути Wnt2b, факторов транскрипции Six3 и Sox2, повышенная активность которых свойственна стволовым и прогениторных клеткам (Haynes et al., 2013). Среди основных факторов, инициирующих пролиферацию и репрограммирование клеток глии Мюллера в нейральном направлении: рассматриваются интерлейкины (IL-6), TNF, металлопротеазы внеклеточного матрикса (MMPs) (Hamon, 2016). В сетчатке мышей, поврежденной в результате действия нейротоксина, удается стимулировать деление клеток глии Мюллера и нейрогенез в результате гиперэкспрессии гена Ascl1 (Jorstad et al., 2017). Данные о гипометилированном статусе ДНК в нативных высокоспециализированных клетках глии Мюллера рыб свидетельствуют о возможности изменения фенотипа этих клеток под действием внутренних и внешних факторов, а также о роли эпигенетических механизмов перепрограммирования клеток и регенеративных ответов клеток-источников тканей глаза (Powell et al., 2013).
Сигнальные пути FGF2, WNT, Delta-Notch вовлечены в сеть взаимодействий, регулирующих поведение клеток глии Мюллера в зависимости от характера повреждения ткани сетчатки и возраста позвоночных (Das et al., 2006; Lenkowski, Raymond, 2014). Известно действие FGF2 в стимулировании пролиферации и фенотипических изменений клеток глии Мюллера у эмбриона кур (Fischer, Reh, 2002). Активация сигнального пути ретиноевой кислоты стимулирует регенерационные ответы (пластичность и пролиферацию) клеток глии Мюллера и клеток краевой области сетчатки глаза у птиц (Todd et al., 2018). Добавление ингибитора WNT-рецепторов Frizzled-1 (CRD, богатого цистеином домена) приводит к снятию митогенного эффекта WNT3a на пролиферирующие клетки глии Мюллера в эксплантатах сетчатки взрослой крысы (Osakada et al., 2007). Применение блокатора сигнального пути Notch – DAPT позволяет ингибировать изменения клеточного фенотипа после повреждения сетчатки (Nakamura, Chiba, 2007). При использовании агонистов ретиноевой кислоты в клетках глии Мюллера наблюдается возрастание уровня экспрессии ряда маркерных для малодифференцированных клеток генов транскрипционных факторов (Pax6, Klf4, c-Fos), а при использовании соответствующих антагонистов уровень экспрессии этих генов снижается. В другой работе, на моделе повреждения фоторецепторов сетчатки у рыб Danio rerio показано, что снижение уровня в сетчатке gamma-аминомасляной кислоты (ГАМК) – главного тормозного нейромедиатора центральной нервной системы, – с помощью антагониста ГАМКа-рецепторов габазина является одним из пусковых звеньев в инициации пролиферации клеток глии Мюллера (Rao et al., 2017). Дедифференцировка и индукция плюрипотентности клеток глии Мюллера in vitro при их инкубации с внеклеточными везикулами, полученными от эмбриональных стволовых клеток, позволяют предполагать возможность их активации для восстановления сетчатки и в условиях in vivo (Katsman et al., 2012).
Другая стратегия, заключающаяся главным образом в нейропротекции, основана на активации потенциальных эндогенных механизмов, за счет использования нейротрансмиттеров, их антагонистов, таргеттинга соответствующих рецепторов (Williams, Dexter, 2014). Так, антагонисты пуринэргических P2X рецепторов и агонисты рецепторов аденозина A3R используются в качестве нейропротекторов и регуляторов регенерации сетчатки (Zhang et al., 2006). В основе такого подхода лежит блокирование поступления кальция в клетки (Reichenbach, Bringmann, 2016), поскольку избыток (дисбаланс) внутриклеточного кальция является одной из причин усиленного образования АФК. Стимуляция клеток РПЭ агонистом никотиновых ацетилхолиновых рецепторов активирует пролиферацию глии Мюллера и ее нейральную дифференцировку у взрослых мышей (Webster et al., 2019).
Роль редокс-системы (и в частности, роль АФК) в инициации процесса регенерации сетчатки не охарактеризована, а имеющиеся данные по тканям глаза далеко не полны (Slack et al., 2004; Love et al., 2013). Анализ транскриптома на начальных стадиях регенерации хрусталика у тритона выявил повышение уровня экспрессии генов, вовлеченных в регуляцию окислительно-восстановительного баланса – hmox1, fam213a, irg1, serpin-b10 (Sousounis et al., 2013, 2014). На модели повреждения зрительного нерва мыши обнаружено, что введение “перехватчика” свободных радикалов спермидина снижает уровень апоптоза и активность микроглии в зоне повреждения, способствуя поддержанию регенерации нерва (Noro et al., 2015).
Проблемы использования для регенерации сетчатки у млекопитающих, в том числе человека, латентных экзогенных клеток со свойствами “стволовости” все еще далеки от разрешения, что обусловлено, во-первых, сложностью высокоорганизованной структуры сетчатки, во-вторых, устойчивой тенденцией к формированию рубцовой ткани (как, например, в случае пролиферативной витреоретинопатии). Подходы, связанные с трансплантацией клеток и рядом фармакологических воздействий, способны в течение какого-то времени после повреждения сетчатки поддержать жизнеспособность клеток у реципиента, тем самым отсрочив гибель, но не позволяют восстановить структуру сетчатки у взрослых млекопитающих и человека in vivo (Llonch et al., 2018; Singh et al., 2018; Gasparini et al., 2019). Существующие стратегии использования фармакологических антиоксидантов при патологиях нейральных тканей направлены на активацию собственного регенеративного потенциала и антиоксидантных систем клеток, поддержание нейрогенеза. Использование эндогенного регенерационного потенциала представляется наиболее перспективным для регенеративной медицины. В связи с этим особого внимания для регенерации и нейропротекции сетчатки позвоночных заслуживают исследования роли эндогенных редокс-систем. В исследованиях этого направления модель совершенной регенерации de novo сетчатки у хвостатых амфибий является также одной из наиболее удачных для выяснения роли эндогенных систем ОС и антиоксидантной защиты в активации процессов репрограммирования и поддержания регенерации нейральной ткани.
При наличии видовых особенностей в стратегиях регенерации у разных позвоночных, консерватизм ключевых сигнальных молекул, поддерживающих жизнеспособность клеток и баланс между их гибелью и пролиферацией, а также активирующих репрограммирование клеток-источников, позволяет предполагать общность ключевых звеньев регенерационного ответа. Однако стоит еще раз подчеркнуть существование возможных различий в генетической регуляции сигнальных путей, задействованных в активации/блокировании ответов клеток нейральных тканей глаза на стресс у разных видов позвоночных. Так, показано существование глобальных различий в экспрессии большого числа генов в РПЭ млекопитающих при моделировании ВМД сетчатки и при ее развитии у человека, что обуславливает различия в работе сигнальных путей, вовлеченных в патогенез этого заболевания (Bennis et al., 2015). Это подчеркивает актуальность сравнительных исследований влияния эндогенных систем ОС и антиоксидантной защиты на процессы репрограммирования клеток-источников, на их поведение и пластичность, на поддержание жизнеспособности и регенерации нейральных тканей глаза у объектов, с неравноценными регенеративными способностями (хвостатые амфибии, млекопитающие). Развитие этого направления будет способствовать выявлению факторов успешной регенерации сетчатки у хвостатых амфибий и использованию полученных данных в разработке эффективных биомедицинских подходов для активации эндогенных регенерационных ресурсов сетчатки у высших позвоночных (млекопитающих).
Работа выполнена при финансовой поддержке Программы Президиума РАН “Биоразнообразие природных систем” в рамках темы НИР № ИНГЗ 0108-2018-0005 и гранта РФФИ № 16-04-01114.
Список литературы
Черенкевич С.Н., Мартинович Г.Г., Мартинович И.В. и др. Редокс-гомеостаз биологических систем: теория и практика // Журн. ГрГМУ. 2009. № 2. С. 9–11.
Бабаева А.Г. Репаративные процессы и иммунитет // Изв. АН. Сер. биол. 1999. № 6. С. 261–269.
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Специфическая активность фактора роста фибробластов 2 и нуклеостемина в формирующейся сетчатке глаза позвоночных // Науч. конф. с международ. участием “Актуальные вопросы морфогенеза в норме и патологии” / 6–7 апреля 2016 Москва. Сб. науч. трудов 6–7 апреля 2016. М.: Группа МДВ, 2016. 228 с. С. 107–108.
Abdullayev I., Kirkham M., Bjorklund A.K. et al. A reference transcriptome and inferred proteome for the salamander Notophthalmus viridescens // Exp. Cell Res. 2013. V. 319. № 8. P. 1187–1197.
Ail D., Perron M. Retinal degeneration and regeneration-lessons from fishes and amphibians // Curr. Pathobiol Rep. 2017. V. 5. № 1. P. 67–78.
Akhtar-Schafer I., Wang L., Krohne T.U. et al. Modulation of three key innate immune pathways for the most common retinal degenerative diseases // EMBO Mol. Med. 2018. V. 10. № 10. e8259. P. 1–27.
Amano S., Yamagishi S., Inagaki Y. et al. Pigment epithelium-derived factor inhibits oxidative stress-induced apoptosis and dysfunction of cultured retinal pericytes // Microvasc. Res. 2005. V. 69. № 1–2. P. 45–55.
Amram B., Cohen-Tayar Y., David A. et al. The retinal pigmented epithelium – from basic developmental biology research to translational approaches // Int. J. Dev. Biol. 2017. V. 61. № 3-4-5. P. 225–234.
Anders H.J., Schaefer L. Beyond tissue injury-damage-associated molecular patterns, toll-like receptors, and inflammasomes also drive regeneration and fibrosis // J. Am. Soc. Nephrol. 2014. V. 25. № 7. P. 1387–1400.
Atienzar-Aroca S., Flores-Bellver M., Serrano-Heras G. et al. Oxidative stress in retinal pigment epithelium cells increases exosome secretion and promotes angiogenesis in endothelial cells // J. Cell Mol. Med. 2016. V. 20. № 8. P. 1457–1466.
Aurora A.B., Porrello E.R., Tan W., Mahmoud A.I., Hill J.A., Bassel-Duby R., Sadek H.A., Olson E.N. Macrophages are required for neonatal heart regeneration // J. Clin. Invest. 2014. V. 124(3). P. 1382–1392.
Barbosa-Sabanero K., Hoffmann A., Judge C. et al. Lens and retina regeneration: new perspectives from model organisms // Biochem. J. 2012. V. 447. № 3. P. 321–334.
Beatty S., Koh H., Phil M. et al. The role of oxidative stress in the pathogenesis of age-related macular degeneration // Surv. Ophthalmol. 2000. V. 45. № 2. P. 115–134.
Belin S., Nawabi H., Wang C. et al. Injury-induced decline of intrinsic regenerative ability revealed by quantitative proteomics // Neuron. 2015. V. 86. № 4. P. 1000–1014.
Bely A.E., Nyberg K.G. Evolution of animal regeneration: re-emergence of a field // Trends Ecol. Evol. 2010. V. 25. № 3. P. 161–170.
Bennis A., Gorgels T.G., Ten Brink J.B. et al. Comparison of mouse and human retinal pigment epithelium gene expression profiles: potential implications for age-related macular degeneration // PLoS One. 2015. V. 10. № 10. e0141597.
Bhatia B., Singhal S., Jayaram H. et al. Adult retinal stem cells revisited // Open Ophthalmol. J. 2010. V. 4. P. 30–38.
Bi Y.Y., Feng D.F., Pan D.C. Stem/progenitor cells: a potential source of retina-specific cells for retinal repair // Neurosci. Res. 2009. V. 65. № 3. P. 215–221.
Bindoli A., Rigobello M.P. Principles in redox signaling: from chemistry to functional significance // Antioxid. Redox Signal. 2013. V. 18. № 13. P. 1557–1593.
Blasiak J., Petrovski G., Vereb Z. et al. Oxidative stress, hypoxia, and autophagy in the neovascular processes of age-related macular degeneration // Biomed. Res. Int. 2014. V. 2014. 768026.
Boda E., Nato G., Buffo A. Emerging pharmacological approaches to promote neurogenesis from endogenous glial cells // Biochem. Pharmacol. 2017. V. 141. P. 23–41.
Borquez D.A., Urrutia P.J., Wilson C. et al. Dissecting the role of redox signaling in neuronal development // J. Neurochem. 2016. V. 137. № 4. P. 506–517.
Bringmann A., Iandiev I., Pannicke T. et al. Cellular signaling and factors involved in Muller cell gliosis: neuroprotective and detrimental effects // Prog. Retin. Eye Res. 2009. V. 28. № 6. P. 423–451.
Campbell L.J., Hyde D.R. Opportunities for CRISPR/Cas9 gene editing in retinal regeneration research // Front Cell Dev. Biol. 2017. V. 5. Article 99. P. 1–8.
Casco-Robles M.M., Islam M.R., Inami W. et al. Turning the fate of reprogramming cells from retinal disorder to regeneration by Pax6 in newts // Sci. Rep. 2016. V. 6. 33761.
Chen H.Y., Kaya K.D., Dong L. et al. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation // Mol. Vis. 2016. V. 22. P. 1077–1094.
Chiba C. The retinal pigment epithelium: An important player of retinal disorders and regeneration // Exp. Eye Res. 2014. V. 123. P. 107–114.
Chiba C., Mitashov V.I. Cellular and molecular events in the adult newt retinal regeneration // The Strategies for Retinal Tissue Repair and Regeneration in Vertebrates: From Fish to Human / Ed. Chiba C. Kerala, India: Res. Signpost., 2007. P. 15–33.
Chiba C., Hoshino A., Nakamura K. et al. Visual cycle protein RPE65 persists in new retinal cells during retinal regeneration of adult newt // J. Comp. Neurol. 2006. V. 495. № 4. P. 391–407.
Cho Y., Shin J.E., Ewan E.E. et al. Activating injury-responsive genes with hypoxia enhances axon regeneration through neuronal HIF-1α // Neuron. 2015. V. 88. № 4. P. 720–734.
Chung J.W. Spot the difference: Solving the puzzle of hidden pictures in the lizard genome for identification of regeneration factors // BMB Rep. 2016. V. 49. № 5. P. 249–254.
Conedera F.M., Pousa A.M.Q., Mercader N. et al. Retinal microglia signaling affects Müller cell behavior in the zebrafish following laser injury induction // Glia. 2019. V. 67. № 6. P. 1150–1166.
Cordeiro J.V., Jacinto A. The role of transcription-independent damage signals in the initiation of epithelial wound healing // Nat. Rev. Mol. Cell Biol. 2013. V. 14. № 4. P. 249–262.
Cuenca N., Fernandez-Sanchez L., Campello L. et al. Cellular responses following retinal injuries and therapeutic approaches for neurodegenerative diseases // Prog. Retin. Eye Res. 2014. V. 43. P. 17–75.
Cunha-Vaz J., Bernardes R., Lobo C. Blood-retinal barrier // Eur. J. Ophthalmol. 2011. V. 21. Suppl. 6. P. 3–9.
Cvekl A., Mitton K.P. Epigenetic regulatory mechanisms in vertebrate eye development and disease // Heredity (Edinb). 2010. V. 105. № 1. P. 135–151.
Das A.V., Mallya K.B., Zhao X. et al. Neural stem cell properties of Müller glia in the mammalian retina: regulation by Notch and Wnt signaling // Dev. Biol. 2006. V. 299. № 1. P. 283–302.
de Hoz R., Rojas B., Ramírez A.I. et al. Retinal macroglial responses in health and disease // Biomed. Res. Int. 2016. V. 2016. Article ID 2954721. P. 1–13.
Delyfer M.N., Raffelsberger W., Mercier D. Transcriptomic analysis of human retinal detachment reveals both inflammatory response and photoreceptor death // PLoS One. 2011. V. 6. № 12. e28791.
Diaz-Coranguez M., Ramos C., Antonetti D.A. The inner blood-retinal barrier: Cellular basis and development // Vision Res. 2017. V. 139. P. 123–137.
Dieudonne S.C., La Heij E.C., Diederen R. et al. High TGF-beta2 levels during primary retinal detachment may protect against proliferative vitreoretinopathy // Invest. Ophthalmol. Vis. Sci. 2004. V. 45. № 11. P. 4113–4118.
DiStefano T., Chen H.Y., Panebianco C. et al. Accelerated and improved differentiation of retinal organoids from pluripotent stem cells in rotating-wall vessel bioreactors // Stem Cell Reports. 2018. V. 10. № 1. P. 300–313.
Dvoriantchikova G., Ivanov D. Tumor necrosis factor-alpha mediates activation of NF-κB and JNK signaling cascades in retinal ganglion cells and astrocytes in opposite ways // Eur. J. Neurosci. 2014. V. 40. № 8. P. 3171–3178.
Dvoriantchikova G., Seemungal R.J., Ivanov D. The epigenetic basis for the impaired ability of adult murine retinal pigment epithelium cells to regenerate retinal tissue // Sci. Rep. 2019. V. 9. № 1. 3860. P. 1–13.
Elewa A., Wang H., Talavera-Lopez C. Reading and editing the Pleurodeles waltl genome reveals novel features of tetrapod regeneration // Nat. Commun. 2017. V. 8. № 1. 2286. P. 1–9.
Emanuele S., D’Anneo A., Calvaruso G. et al. The double-edged sword profile of redox signaling: Oxidative events as molecular switches in the balance between cell physiology and cancer // Chem. Res. Toxicol. 2018. V. 31. № 4. P. 201–210.
Erler P., Monaghan J.R. The link between injury-induced stress and regenerative phenomena: A cellular and genetic synopsis // Biochim. Biophys. Acta. 2015. V. 1849. № 4. P. 454–461.
Ferretti P. Is there a relationship between adult neurogenesis and neuron generation following injury across evolution? // Eur. J. Neurosci. 2011. V. 34. № 6. P. 951–962.
Fischer R., Maier O. Interrelation of oxidative stress and inflammation in neurodegenerative disease: role of TNF // Oxid. Med. Cell. Longev. 2015. V. 2015. Article ID 610813. P. 1–18.
Fisher S.K., Lewis G.P., Linberg K.A. et al. Cellular remodeling in mammalian retina induced by retinal detachment // Eds. Kolb H., Fernandez E., Nelson R. Webvision: The Organization of the Retina and Visual System [Internet]. University of Utah Health Sciences Center, Salt Lake City, UT, USA, 2007. P. 1–51.
Fischer A.J., Reh T.A. Exogenous growth factors stimulate the regeneration of ganglion cells in the chicken retina // Dev. Biol. 2002. V. 251. № 2. P. 367–379.
Fuhrmann S. Eye morphogenesis and patterning of the optic vesicle // Curr. Top. Dev. Biol. 2010. V. 93. P. 61–84.
Fukui M., Zhu B.T. Mitochondrial superoxide dismutase SOD2, but not cytosolic SOD1, plays a critical role in protection against glutamate-induced oxidative stress and cell death in HT22 neuronal cells // Free Radic. Biol. Med. 2010. V. 48. № 6. P. 821–830.
Galliot B., Chera S. The Hydra model: disclosing an apoptosis-driven generator of Wnt-based regeneration // Trends Cell Biol. 2010. V. 20. № 9. P. 514–523.
Galliot B., Crescenzi M., Jacinto A. et al. Trends in tissue repair and regeneration // Development. 2017. V. 144. № 3. P. 357–364.
Galliot B., Ghila L. Cell plasticity in homeostasis and regeneration // Mol. Reprod. Dev. 2010. V. 77. № 10. P. 837–855.
Galluzzi L., Bravo-San Pedro J.M., Kepp O. et al. Regulated cell death and adaptive stress responses // Cell. Mol. Life Sci. 2016. V. 73. № 11–12. P. 2405–2410.
Gasparini S.J., Llonch S., Borsch O. et al. Transplantation of photoreceptors into the degenerative retina: Current state and future perspectives // Prog. Retin. Eye Res. 2019. V. 69. P. 1–37.
Geller S.F., Lewis G.P., Fisher S.K. FGFR1, signaling, and AP-1 expression after retinal detachment: reactive Muller and RPE cells // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. P. 1363–1369.
Genini S., Beltran W.A., Stein V.M. et al. Isolation and ex vivo characterization of the immunophenotype and function of microglia/macrophage populations in normal dog retina // Adv. Exp. Med. Biol. 2014. V. 801. P. 339–345.
Grigoryan E.N. Shared triggering mechanisms of retinal regeneration in lower vertebrates and retinal rescue in higher ones // Tissue Regeneration – From Basic Biology to Clinical Application / Ed. Davies J. In Tech. Croatia. 2012. P. 145–164.
Grigoryan E.N., Markitantova Y.V. Cellular and molecular preconditions for retinal pigment epithelium (RPE) natural reprogramming during retinal regeneration in Urodela // Biomedicines. 2016. V. 4. № 4. pii: E28. P. 1–18.
Hameed L.S., Berg D.A., Belnoue L. et al. Environmental changes in oxygen tension reveal ROS-dependent neurogenesis and regeneration in the adult newt brain // Elife. 2015. V. 20. № 4. pii: e08422. P. 1–16.
Haynes T., Luz-Madrigal A., Reis E.S. et al. Complement anaphylatoxin C3a is a potent inducer of embryonic chick retina regeneration // Nat. Commun. 2013. V. 4. 2312.
Hamon A., Roger J.E., Yang X.J. et al. Muller glial cell-dependent regeneration of the neural retina: An overview across vertebrate model systems // Dev. Dyn. 2016. V. 245. № 7. P. 727–738.
Hoon M., Okawa H., Della Santina L. et al. Functional architecture of the retina: development and disease // Prog. Retin. Eye Res. 2014. V. 42. P. 44–84.
Hunter J.J., Morgan J.I., Merigan W.H. et al. The susceptibility of the retina to photochemical damage from visible light // Prog. Retin. Eye Res. 2012. V. 31. № 1. P. 28–42.
Inami W., Islam M.R., Nakamura K. et al. Expression of two classes of Pax6 Transcripts in reprogramming retinal pigment epithelium cells of the adult newt // Zoolog Sci. 2016. V. 33. № 1. P. 21–30.
Isenmann S., Kretz A., Cellerino A. Molecular determinants of retinal ganglion cell development, survival, and regeneration // Prog. Retin. Eye Res. 2003. V. 22. № 4. P. 483–543.
Islam M.R., Nakamura K., Casco-Robles M.M. et al. The newt reprograms mature RPE cells into a unique multipotent state for retinal regeneration // Sci. Rep. 2014. V. 4. 6043. P. 1–8.
Iqbal J., Zhang K., Jin N. et al. Alzheimer’s disease is responsible for progressive age-dependent differential expression of various protein cascades in retina of mice // ACS Chem. Neurosci. 2019. Feb. 13. [Epub ahead of print]https://doi.org/10.1021/acschemneuro.8b00710
Jacobs A.T., Marnett L.J. Systems analysis of protein modification and cellular responses induced by electrophile stress // Acc. Chem. Res. 2010. V. 43. № 5. P. 673–683.
Jarrett S.G., Boulton M.E. Antioxidant up-regulation and increased nuclear DNA protection play key roles in adaptation to oxidative stress in epithelial cells // Free Radic. Biol. Med. 2005. V. 38. № 10. P. 1382–1391.
Jorstad N.L., Wilken M.S., Grimes W.N. et al. Stimulation of functional neuronal regeneration from Müller glia in adult mice // Nature. 2017. V. 548. № 7665. P. 103–107.
Kaneko Y., Matsumoto G., Hanyu Y. et al. The occurrence of apoptosis during retinal regeneration in adult newts // Brain Res. Dev. Brain Res. 1999. V. 117. № 2. P. 225–228.
Kang M.K., Lee E.J., Kim Y.H. et al. Chrysin ameliorates malfunction of retinoid visual cycle through blocking activation of AGE-RAGE-ER stress in glucose-stimulated retinal pigment epithelial cells and diabetic eyes // Nutrients. 2018. V. 10. № 8. pii: E1046.
Katsman D., Stackpole E.J., Domin D.R. et al. Embryonic stem cell-derived microvesicles induce gene expression changes in Muller cells of the retina // PLoS One. 2012. V. 7. № 11. e50417.
Keeling E., Lotery A.J., Tumbarello D.A. et al. Impaired cargo clearance in the retinal pigment epithelium (RPE) underlies irreversible blinding diseases // Cells. 2018. V. 7. № 2. pii: E16.
Kimelberg H.K. Functions of mature mammalian astrocytes: a current view // Neuroscientist. 2010. V. 16. № 1. P. 79–106.
Kirchhof B., Sorgente N. Pathogenesis of proliferative vitreoretinopathy. Modulation of retinal pigment epithelial cell functions by vitreous and macrophages // Dev. Ophthalmol. 1989. V. 16. P. 1–53.
Kolb H. Outer Plexiform layer / Eds. Kolb H., Fernandez E., Nelson R. Webvision: The Organization of the Retina and Visual System [Internet]. University of Utah Health Sciences Center, Salt Lake City, UT, USA, 2007a.
Kolb H. Inner Plexiform Layer / Eds. Kolb H., Fernandez E., Nelson R. Webvision: The Organization of the Retina and Visual System [Internet]. University of Utah Health Sciences Center, Salt Lake City, UT, USA, 2007b.
Kolb H. Simple Anatomy of the retina / Eds. Kolb H., Fernandez E., Nelson R. Webvision: The Organization of the Retina and Visual System [Internet]. University of Utah Health Sciences Center, Salt Lake City, UT, USA, 2012.
Kortuem K., Geiger L.K., Levin L.A. Differential susceptibility of retinal ganglion cells to reactive oxygen species // Invest. Ophthalmol. Vis. Sci. 2000. V. 41. № 10. P. 3176–3182.
Kostas M., Lampart A., Bober J. et al. Translocation of exogenous FGF1 and FGF2 protects the cell against apoptosis independently of receptor activation // J. Mol. Biol. 2018. V. 430. № 21. P. 4087–4101.
Kozakowska M., Pietraszek-Gremplewicz K., Jozkowicz A. et al. The role of oxidative stress in skeletal muscle injury and regeneration: focus on antioxidant enzymes // J. Muscle Res. Cell Motil. 2015. V. 36. № 6. P. 377–393.
Kumaramanickavel G. Age-related macular degeneration: Genetics and biology // Asia Pac. J. Ophthalmol. (Phila). 2016. V. 5. № 4. P. 229–235.
Lamb T.D. Evolution of phototransduction, vertebrate photoreceptors and retina // Prog. Retin. Eye Res. 2013. V. 36. P. 52–119.
Langhe R., Chesneau A., Colozza G. et al. Muller glial cell reactivation in Xenopus models of retinal degeneration // Glia. 2017. V. 65. № 8. P. 1333–1349.
Leaver S.G., Cui Q., Plant G.W. et al. AAV-mediated expression of CNTF promotes long-term survival and regeneration of adult rat retinal ganglion cells // Gene Ther. 2006. V. 13. № 18. P. 1328–1341.
Lenkowski J.R., Raymond P.A. Muller glia: Stem cells for generation and regeneration of retinal neurons in teleost fish // Prog. Retin. Eye Res. 2014. V. 40. P. 94–123.
Leveillard T., Sahel J.A. Metabolic and redox signaling in the retina // Cell Mol. Life Sci. 2017. V. 74. № 20. P. 3649–3665.
Li F., Huang Q., Chen J. et al. Apoptotic cells activate the “phoenix rising” pathway to promote wound healing and tissue regeneration // Sci. Signal. 2010. V. 3. № 110. ra13. P. 1–20.
Llonch S., Carido M., Ader M. Organoid technology for retinal repair // Dev. Biol. 2018. V. 433. № 2. P. 132–143.
Logan A., Ahmed Z., Baird A. et al. Neurotrophic factor synergy is required for neuronal survival and disinhibited axon regeneration after CNS injury // Brain. 2006. V. 129. Pt 2. P. 490–502.
Love N.R., Chen Y., Ishibashi S. et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration // Nat. Cell Biol. 2013. V. 15. № 2. P. 222–228.
Lu Q., Cui Q., Yip H.K. et al. c-Jun expression in surviving and regenerating retinal ganglion cells: effects of intravitreal neurotrophic supply // Invest. Ophthalmol. Vis. Sci. 2003. V. 44. № 12. P. 5342–5348.
Lushchak V.I. Adaptive response to oxidative stress: Bacteria, fungi, plants and animals // Comp. Biochem. Physiol. C. Toxicol. Pharmacol. 2011. V. 153. № 2. P. 175–190.
Ma W., Zhang Y., Gao C. et al. Monocyte infiltration and proliferation reestablish myeloid cell homeostasis in the mouse retina following retinal pigment epithelial cell injury // Sci. Rep. 2017. V. 7. № 1. 8433. P. 1–18.
Masutomi K., Chen C., Nakatani K. et al. All-trans retinal mediates light-induced oxidation in single living rod photoreceptors // Photochem. Photobiol. 2012. V. 88. № 6. P. 1356–1361.
Mazzolini M., Facchetti G., Andolfi L. et al. The phototransduction machinery in the rod outer segment has a strong efficacy gradient // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 20. E2715-24.
Meda F., Rampon C., Dupont E. et al. Nerves, H2O2 and Shh: Three players in the game of regeneration // Semin. Cell Dev. Biol. 2018. V. 80. P. 65–73.
Mishra S., Maurya Sh.K., Srivastava K., Shukla S., Mishra R. Pax6 influences expression patterns of genes involved in neuro-degeneration // Ann. Neurosci. 2015. V. 22. № 4. P. 226–231. https://doi.org/10.5214/ans.0972.7531.220407
Mitashov V.I. Mechanisms of retina regeneration in urodeles // Int. J. Dev. Biol. 1996. V. 40. № 4. P. 833–844.
Mitashov V.I. Retinal regeneration in amphibians // Int. J. Dev. Biol. 1997. V. 41. № 6. P. 893–905.
Mitchell C.H., Lu W., Hu H. et al. The P2X(7) receptor in retinal ganglion cells: A neuronal model of pressure-induced damage and protection by a shifting purinergic balance // Purinergic Signal. 2008. V. 4. № 4. P. 313–321.
Mitra S., Sharma P., Kaur S. et al. Dual regulation of lin28a by Myc is necessary during zebrafish retina regeneration // J. Cell Biol. 2019. V. 218. № 2. P. 489–507.
Moldogazieva N.T., Mokhosoev I.M., Feldman N.B. et al. ROS and RNS signalling: adaptive redox switches through oxidative/nitrosative protein modifications // Free Radic. Res. 2018. V. 52. № 5. P. 507–543.
Murawala P., Tanaka E.M., Currie J.D. Regeneration: the ultimate example of wound healing // Semin. Cell Dev. Biol. 2012. V. 23. № 9. P. 954–962.
Nabeshima A., Nishibayashi C., Ueda Y. et al. Loss of cell-extracellular matrix interaction triggers retinal regeneration accompanied by Rax and Pax6 activation // Genesis. 2013. V. 51. № 6. P. 410–419.
Nagashima M., Fujikawa C., Mawatari K. et al. HSP70, the earliest-induced gene in the zebrafish retina during optic nerve regeneration: its role in cell survival // Neurochem. Int. 2011. V. 58. № 8. P. 888–895.
Nakamura K., Chiba C. Evidence for Notch signaling involvement in retinal regeneration of adult newt // Brain Res. 2007. V. 1136. № 1. P. 28–42.
Nakamura K., Islam M.R., Takayanagi M. et al. A transcriptome for the study of early processes of retinal regeneration in the adult newt, Cynops pyrrhogaster // PLoS One. 2014. V. 9. № 10. e109831. P. 1–12.
Nakanishi T., Shimazawa M., Sugitani S. et al. Role of endoplasmic reticulum stress in light-induced photoreceptor degeneration in mice // J. Neurochem. 2013. V. 125. № 1. P. 111–124.
Nakanishi-Ueda T., Majima H.J., Watanabe K. et al. Blue LED light exposure develops intracellular reactive oxygen species, lipid peroxidation, and subsequent cellular injuries in cultured bovine retinal pigment epithelial cells // Free Radic. Res. 2013. V. 47. № 10. P. 774–780.
Nakazawa T., Matsubara A., Noda K. et al. Characterization of cytokine responses to retinal detachment in rats // Mol. Vis. 2006. V. 12. P. 867–878.
Neves J., Zhu J., Sousa-Victor P. et al. Immune modulation by MANF promotes tissue repair and regenerative success in the retina // Science. 2016. V. 353. № 6294. aaf3646.
Newman E.A. Glial cell regulation of neuronal activity and blood flow in the retina by release of gliotransmitters // Philos. Trans. R. Soc. Lond. Ser. B. Biol. Sci. 2015. V. 370 (1672).
Noro T., Namekata K., Kimura A. et al. Spermidine promotes retinal ganglion cell survival and optic nerve regeneration in adult mice following optic nerve injury // Cell Death Dis. 2015. V. 6. e1720.
Nowoshilow S., Schloissnig S., Fei J.F. et al. The axolotl genome and the evolution of key tissue formation regulators // Nature. 2018. V. 554. № 7690. P. 50–55.
Osakada F., Ooto S., Akagi T. et al. Wnt signaling promotes regeneration in the retina of adult mammals // J. Neurosci. 2007. V. 27. № 15. P. 4210–4219.
Perez-Torres I., Guarner-Lans V., Rubio-Ruiz M.E. Reductive stress in inflammation-associated diseases and the pro-oxidant effect of antioxidant agents // Int. J. Mol. Sci. 2017. V. 18. № 10. pii: E2098. P. 1–26.
Powell C., Grant A.R., Cornblath E. et al. Analysis of DNA methylation reveals a partial reprogramming of the Müller glia genome during retina regeneration // Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 49. P. 19814–19819.
Rao M.B., Didiano D., Patton J.G. Neurotransmitter-regulated regeneration in the zebrafish retina // Stem Cell Reports. 2017. V. 8. № 4. P. 831–842.
Ray P.D., Huang B.W., Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling // Cell Signal. 2012. V. 24. № 5. P. 981–990.
Reczek C.R., Chandel N.S. ROS-dependent signal transduction // Curr. Opin. Cell Biol. 2015. V. 33. P. 8–13.
Reichenbach A., Bringmann A. Role of purines in Müller glia // J. Ocul. Pharmacol. Ther. 2016. V. 32. № 8. P. 518–533.
Reichenbach A., Bringmann A. New functions of Muller cells // Glia. 2013. V. 61. № 5. P. 651–678.
Roehlecke C., Schumann U., Ader M. et al. Stress reaction in outer segments of photoreceptors after blue light irradiation // PLoS One. 2013. V. 8. № 9. e71570. P. 1–12.
Roy S., Levesque M. Limb regeneration in axolotl: is it superhealing? // Sci. World J. 2006. V. 6. Suppl. 1. P. 12–25.
Salero E., Blenkinsop T.A., Corneo B. et al. Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives // Cell Stem Cell. 2012. V. 10. № 1. P. 88–95.
Sanes J.R., Masland R.H. The types of retinal ganglion cells: current status and implications for neuronal classification // Annu. Rev. Neurosci. 2015. V. 38. P. 221–246.
Sato K., Saigusa D., Saito R. et al. Metabolomic changes in the mouse retina after optic nerve injury // Sci. Rep. 2018. V. 8. № 1. 11930.
Schlingemann R.O. Role of growth factors and the wound healing response in age-related macular degeneration // Graefes Arch. Clin. Exp. Ophthalmol. 2004. V. 242. № 1. V. 91–101.
Seagle B.L., Rezai K.A., Gasyna E.M. et al. Time-resolved detection of melanin free radicals quenching reactive oxygen species // J. Am. Chem. Soc. 2005. V. 127. № 32. P. 11220–11221.
Selvam S., Kumar T., Fruttiger M. Retinal vasculature development in health and disease // Prog. Retin. Eye Res. 2018. V. 63. P. 1–19.
Sharma T.P., McDowell C.M., Liu Y. et al. Optic nerve crush induces spatial and temporal gene expression patterns in retina and optic nerve of BALB/cJ mice // Mol. Neurodegener. 2014. V. 9. № 14. P. 1–19.
Sies H., Berndt C., Jones D.P. Oxidative stress // Annu. Rev. Biochem. 2017. V. 86. P. 715–748.
Sifuentes C.J., Kim J.W., Swaroop A. et al. Rapid, dynamic activation of Müller glial stem cell responses in zebrafish // Invest. Ophthalmol. Vis. Sci. 2016. V. 57. № 13. P. 5148–5160.
Simo R., Hernandez C. European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR) Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives // Trends Endocrinol. Metabol. 2014. V. 25. № 1. P. 23–33.
Simon M.V., Agnolazza D.L., German O.L. et al. Synthesis of docosahexaenoic acid from eicosapentaenoic acid in retina neurons protects photoreceptors from oxidative stress // J. Neurochem. 2016. V. 136. № 5. P. 931–946.
Singh R., Cuzzani O., Binette F. et al. Pluripotent stem cells for retinal tissue engineering: Current status and future prospects // Stem Cell Rev. 2018. V. 14. № 4. P. 463–483.
Slack J.M., Beck C.W., Gargioli C. et al. Cellular and molecular mechanisms of regeneration in Xenopus // Philos. Trans. R Soc. Lond. B Biol. Sci. 2004. V. 359. № 1445. P. 745–751.
Solberg R., Escobar J., Arduini A. et al. Metabolomic analysis of the effect of postnatal hypoxia on the retina in a newly born piglet model // PLoS One. 2013. V. 8. № 6. e66540.
Sousounis K., Bhavsar R., Looso M. et al. Molecular signatures that correlate with induction of lens regeneration in newts: lessons from proteomic analysis // Hum. Genomics. 2014. V. 8. 22. P. 1–16.
Sousounis K., Looso M., Maki N. et al. Transcriptome analysis of newt lens regeneration reveals distinct gradients in gene expression patterns // PLoS One. 2013. № 4. P. 8. e61445.
Stevenson L., Matesanz N., Colhoun L. et al. Reduced nitro-oxidative stress and neural cell death suggests a protective role for microglial cells in TNFalpha–/– mice in ischemic retinopathy // Invest. Ophthalmol. Vis. Sci. 2010. V. 51. № 6. P. 3291–3299.
Strauss O. The retinal pigment epithelium in visual function // Physiol. Rev. 2005. V. 85. № 3. P. 845–881.
Subirada P.V., Paz M.C., Ridano M.E. et al. A journey into the retina: Müller glia commanding survival and death // Eur. J. Neurosci. 2018. V. 47. № 12. P. 1429–1443.
Sun M., Finnemann S.C., Febbraio M. et al. Light-induced oxidation of photoreceptor outer segment phospholipids generates ligands for CD36-mediated phagocytosis by retinal pigment epithelium: a potential mechanism for modulating outer segment phagocytosis under oxidant stress conditions // J. Biol. Chem. 2006. V. 281. № 7. P. 4222–4230.
Suzuki N., Mittler R. Reactive oxygen species-dependent wound responses in animals and plants // Free Radic. Biol. Med. 2012. V. 53. № 12. P. 2269–2276.
Tate D.J., Jr., Miceli M.V., Newsome D.A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells // Invest. Ophthalmol. Vis. Sci. 1995. V. 36. № 7. P. 1271–1279.
Todd L., Suarez L., Quinn C. et al. Retinoic acid-signaling regulates the proliferative and neurogenic capacity of muller glia-derived progenitor cells in the avian retina // Stem Cells. 2018. V. 36. № 3. P. 392–405.
Tokarz P., Kaarniranta K., Blasiak J. Role of antioxidant enzymes and small molecular weight antioxidants in the pathogenesis of age-related macular degeneration (AMD) // Biogerontology. 2013. V. 14. № 5. P. 461–482.
Tonges L., Ostendorf T., Lamballe F. et al. Hepatocyte growth factor protects retinal ganglion cells by increasing neuronal survival and axonal regeneration in vitro and in vivo // J. Neurochem. 2011. V. 117. № 5. P. 892–903.
Trachootham D., Lu W., Ogasawara M.A. et al. Redox regulation of cell survival // Antioxid. Redox Signal. 2008. V. 10. № 8. P. 1343–1374.
Trost A., Bruckner D., Rivera F.J. et al. Pericytes in the retina // Adv. Exp. Med. Biol. 2019. V. 1122. P. 1–26.
Tsukamoto Y. Morphological survey from neurons to circuits of the mouse retina // Meth. Mol. Biol. 2018. V. 1753. P. 3–25.
Ueta T., Inoue T., Furukawa T. et al. Glutathione peroxidase 4 is required for maturation of photoreceptor cells // J. Biol. Chem. 2012. V. 287. № 10. P. 7675–7682.
Usui S., Oveson B.C., Iwase T. et al. Overexpression of SOD in retina: need for increase in H2O2-detoxifying enzyme in same cellular compartment // Free Radic. Biol. Med. 2011. V. 51. № 7. P. 1347–1354.
van der Vliet A., Janssen-Heininger Y.M. Hydrogen peroxide as a damage signal in tissue injury and inflammation: murderer, mediator, or messenger? // J. Cell. Biochem. 2014. V. 115. № 3. P. 427–435.
Vigneswara V., Esmaeili M., Deer L. et al. Eye drop delivery of pigment epithelium-derived factor-34 promotes retinal ganglion cell neuroprotection and axon regeneration // Mol. Cell. Neurosci. 2015. V. 68. P. 212–221.
Vriz S., Reiter S., Galliot B. Cell death: a program to regenerate // Curr. Top. Dev. Biol. 2014. V. 108. P. 121–151.
Wan J., Goldman D. Retina regeneration in zebrafish // Curr. Opin. Genet. Dev. 2016. V. 40. P. 41–47.
Wan J., Ramachandran R., Goldman D. HB-EGF is necessary and sufficient for Muller glia dedifferentiation and retina regeneration // Dev. Cell. 2012. V. 22. № 2. P. 334–347.
Wang Z., Dillon J., Gaillard E.R. Antioxidant properties of melanin in retinal pigment epithelial cells // Photochem. Photobiol. 2006. V. 82. № 2. P. 474–479.
Wang S., Chu C.H., Stewart T. et al. α-Synuclein, a chemoattractant, directs microglial migration via H2O2-dependent Lyn phosphorylation // Proc. Natl. Acad. Sci. USA. 2015. V. 112. № 15. E1926–1935.
Webster M.K., Barnett B.J., Stanchfield M.L. et al. Stimulation of retinal pigment epithelium with an α7 nAChR agonist leads to Müller glia dependent neurogenesis in the adult mammalian retina // Invest. Ophthalmol. Vis. Sci. 2019. V. 60. № 2. P. 570–579.
Werdich X.Q., Place E.M., Pierce E.A. Systemic diseases associated with retinal dystrophies // Semin. Ophthalmol. 2014. V. 29. № 5–6. P. 319–328.
Winterbourn C.C., Kettle A.J. Redox reactions and microbial killing in the neutrophil phagosome // Antioxid. Redox Signal. 2013. V. 18. № 6. P. 642–660.
Williams C.J., Dexter D.T. Neuroprotective and symptomatic effects of targeting group III mGlu receptors in neurodegenerative disease // J. Neurochem. 2014. V. 129. № 1. P. 4–20.
Yu A.L., Fuchshofer R., Kook D. et al. Subtoxic oxidative stress induces senescence in retinal pigment epithelial cells via TGF-beta release // Invest. Ophthalmol. Vis. Sci. 2009. V. 50. № 2. P. 926–935.
Zacks D.N. Gene transcription profile of the detached retina (An AOS Thesis) // Trans. Am. Ophthalmol. Soc. 2009. V. 107. P. 343–382.
Zacks D.N., Han Y., Zeng Y. et al. Activation of signaling pathways and stress-response genes in an experimental model of retinal detachment // Invest. Ophthalmol. Vis. Sci. 2006. V. 47. № 4. P. 1691–1695.
Zareba M., Sarna T., Szewczyk G. Photobleaching of melanosomes from retinal pigment epithelium: II. Effects on the response of living cells to photic stress // Photochem. Photobiol. 2007. V. 83. № 4. P. 925–930.
Zhang X., Zhang M., Laties A.M. et al. Balance of purines may determine life or death of retinal ganglion cells as A3 adenosine receptors prevent loss following P2X7 receptor stimulation // J. Neurochem. 2006. V. 98. № 2. P. 566–575.
Zhang S.X., Sanders E., Fliesler S.J. et al. Endoplasmic reticulum stress and the unfolded protein responses in retinal degeneration // Exp. Eye. Res. 2014. V. 125. P. 30–40.
Zhao X.F., Wan J., Powell C. et al. Leptin and IL-6 family cytokines synergize to stimulate Müller glia reprogramming and retina regeneration // Cell Rep. 2014. V. 9. № 1. P. 272–284.
Zhao L., Zabel M.K., Wang X. et al. Microglial phagocytosis of living photoreceptors contributes to inherited retinal degeneration // EMBO Mol. Med. 2015. V. 7. № 9. P. 1179–1197.
Zhou G., Meng S., Li Y. et al. Optimal ROS signaling is critical for nuclear reprogramming // Cell Rep. 2016. V. 15. № 5. P. 919–925.
Дополнительные материалы отсутствуют.


