Онтогенез, 2020, T. 51, № 1, стр. 35-50
Органотипическое культивирование как способ изучения восстановительных возможностей сетчатки глаза позвоночных животных и человека
Ю. П. Новикова a, *, В. А. Поплинская a, Э. Н. Григорян a, **
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: info@idbras.ru
** E-mail: leonore@mail.ru
Поступила в редакцию 12.02.2019
После доработки 17.06.2019
Принята к публикации 30.06.2019
Аннотация
В обзоре, с использованием литературных и собственных данных, приведена информация о проведенных в разное время экспериментах с применением органотипического культивирования сетчатки позвоночных животных и человека. Метод позволяет сохранять структуру и жизнеспособность сетчатки, моделировать ряд ее патологических состояний, наблюдать за процессами развития, регенерации и реконструкции, гибелью и ростом отростков нейронов. Помимо этого, органотипическое культивирование дает возможность воздействовать на все указанные процессы различными регулирующими факторами, а также защитными/повреждающими агентами в строго заданных концентрациях и при контролируемых условиях. Особое внимание уделено поведению клеток ретинального пигментного эпителия, фоторецепторных клеток, глиальных клеток Мюллера, ганглиозных клеток и их аксонов, то есть тем клеточным популяциям, которые чаще всего затрагиваются в случаях различных патологических состояний и заболеваний сетчатки. Отдельный раздел посвящен активно развиваемым сегодня производству и культивированию так называемых органоидов сетчатки. Направление сулит возможности для трансплантации клеток сетчатки, проведения экспериментов по генотерапии, а также тестированию офтальмологических фармакологических препаратов.
ВВЕДЕНИЕ
Клеточные культуры in vitro являются важным инструментом в исследованиях отдельно взятых клеточных популяций в условиях их изоляции, и существенным дополнением к экспериментам, проводимым in vivo. Клеточные культуры позволяют изучать жизнеспособность, морфологию, поведение, функцию клеток и их популяций, а также влияние на эти процессы различных субстанций, обладающих токсическим, защитным или регуляторным действием. Помимо этого, клеточное культивирование – незаменимый инструмент в изучении молекулярных факторов регуляции пролиферации и дифференцировки клеток, изменений или конверсий клеточного фенотипа. Ну и, наконец, культивирование клеток in vitro – инструмент производства и накопления популяций стволовых или малодифференцированных клеток для самых различных нужд современной биомедицины.
Несмотря на все преимущества клеточного культивирования, изолированные, высаженные in vitro клетки, лишены привычного окружения и влияний со стороны прилежащих тканей. Это, как известно, является определенным препятствием для экстраполяции получаемых сведений на ситуацию in situ. В этой связи в последние два десятилетия большое внимание уделяется органотипическому культивированию, являющемуся более адекватным для симуляции условий целого организма, поэтому часто в литературе эта технология расценивается как “in vivo-like in vitro technology” (Schutgens et al., 2016), а культивируемая ткань как “in vivo-like in vitro model” (Cho et al., 2018). В значительной степени это касается нейральной ткани, при изучении которой очень важно сохранение существующей исходно сложной структурной и синаптической организации (Humpel, 2015).
Сетчатка глаза позвоночных животных является сложным сенсорным органом, в обеспечении функции которого принимают участие различные типы нейронов, глиальные клетки, а также ретинальный пигментный эпителий (РПЭ) (Hoon et al., 2014). Основные типы клеток сетчатки имеют широкий ряд подтипов, организованных в сложный, формирующийся в развитии клеточный ансамбль, где взаимодействие осуществляется благодаря большому числу нейральных и межклеточных связей (Amini et al., 2018). Это обстоятельство требует от исследователей использования в работе ткани сетчатки целиком (“wholemount”), без клеточного разобщения и разрушения ее нативной структуры. Этому условию соответствует органотипическое культивирование сетчатки, привлекающее в настоящее время большое внимание.
МЕТОД ОРГАНОТИПИЧЕСКОГО КУЛЬТИВИРОВАНИЯ СЕТЧАТКИ ГЛАЗА
Термин “органотипический” впервые был использован в 1954 г. при описании дифференцировки развивающейся сетчатки глаза цыпленка in vitro (Reinbold, 1954). В ходе развития метода помимо стационарной культуры целой сетчатки или ее срезов стали использовать технику ротационного органотипического культивирования во вращающихся трубках или культуральных флаконах (Gähwiler, 1988; Braschler et al., 1989; Gähwiler et al., 1997, 2001; Victorov et al., 2001). Такой способ, благодаря перманентному поступлению при вращении свежей порции среды к ткани, обеспечивал большую ее сохранность, а также увеличение сроков культивирования (рис. 1).
Рис. 1.
Этапы органотипического ротационного культивирования сетчатки глаза. 1 – микрохирургическое выделение сетчатки: а – изоляция переднего сектора глаза, б – сетчатка в составе задней стенки глаза и ее изоляция (стрелка); 2 – помещение образцов в холодную среду культивирования; 3 – экспозиция изолированных сетчаток в среде при постоянном вращении; 4 – замкнутая сфера сетчатки крысы по окончании экспозиции.

Органотипическое культивирование является незаменимым инструментом в исследованиях механизмов развития, регенерации сетчатки и составляющих их процессов – клеточной пролиферации, миграции, дифференцировки, а также морфогенеза (Amini et al., 2018). В ходе исследований оказалось возможным культивировать целиком глазные бокалы 2–5-ти дневных куриных и перепелиных эмбрионов в течение двух суток (Halfter, Deiss, 1986). На протяжении шести суток культивировали сетчатки 5–6-ти дневных эмбрионов кур вместе с РПЭ и без него (Liu et al., 1988). Сетчатку неонатальных кроликов культивировали на протяжении двух недель (Germer et al., 1997; Pinzon-Duarte et al., 2000), а эксплантаты сетчатки неонатальных мышей, помещенные в бессывороточную среду – четыре недели (Caffe et al., 1993; Ogilvie et al., 1999). Часто применяли культивирование радиальных срезов сетчатки различной толщины, полученных как от высших, так и низших позвоночных животных (Mack, Fernald, 1991; Feigenspan et al., 1993; Sassoe-Pognetto et al., 1996).
Сегодня органотипическое культивирование сетчатки wholemount широко используется для самых различных целей, в том числе для морфологических, биохимических и фармакологических исследований этой ткани (см. обзор Li et al., 2018). Условия органотипического культивирования применяют для проведения генно-инженерных манипуляций (Moritoh et al., 2010), в частности переноса генов, способных транзитно экспрессироваться в клетках культивируемой сетчатки (Moritoh et al., 2013). И, наконец, органотипическое культивирование позволяет проводить многочисленные фармакологические испытания, в ходе которых можно строго контролировать условия тестирования препаратов, обладающих протекторным, либо токсическим эффектом.
Здесь следует напомнить, что офтальмологические препараты чаще всего тестируются in vivo на кроликах, кошках, собаках, свиньях и обезьянах (Shafaie et al., 2016). Органотипические культуры являются незаменимой альтернативой этим экспериментам, экономичны в отношении объемов тестируемых веществ, позволяют значительно снизить число используемых в эксперименте животных. В экспериментах на сетчатке позвоночных удалось выявить эффективность различных факторов в увеличении жизнеспособности и снижении риска повреждения нейронов. Среди таких веществ отмечены ростовые факторы, нейротрофины, цитокины (LaVail et al., 1998), белки клеточной адгезии (Rattner et al., 2001), а также антиокисиданты (Grigoryan et al., 2012).
Как указано выше, во многих работах на сетчатке позвоночных был использован материал, полученный от развивающихся животных, формирование сетчатки глаза у которых еще не завершено. В экспериментах, проведенных с помощью органотипического ротационного культивирования, мы использовали изолированную сетчатку wholemount взрослых животных, c целью изучения ее способности к регенерации и/или реконструкции (Новикова и др., 2010; Grigoryan et al., 2016), а также факторов, потенциально способных увеличивать клеточную жизнеспособность (Новикова, 2010; Grigoryan et al., 2012, 2013).
СТРОЕНИЕ СЕТЧАТКИ И КЛЕТКИ ИСТОЧНИКИ ЕЕ ВОССТАНОВЛЕНИЯ
В контексте данной статьи необходимо коротко остановится на строении сетчатки глаза. Сетчатка является частью ЦНС, обеспечивает получение, обработку зрительной информации и передачу ее в соответствующую область мозга (Dowling, 2012). Для выполнения подобных функций сетчатка высоко организована. У позвоночных она инвертирована: свет должен пройти через все слои сетчатки для того чтобы достичь фоторецепторов – основных акцепторов света. В эволюционном ряду позвоночных животных сетчатка имеет общий и универсальный план строения. Схематично послойная организация сетчатки выглядит следующим образом (рис. 2). Снаружи она выстлана слоем пигментированных эпителиальных клеток – РПЭ, взаимодействующих с фоторецепторами сетчатки и обеспечивающих совместно с ними восприятие света и его обработку для передачи по зрительному каскаду. Каскад, в свою очередь, обеспечивается клетками ядерных (наружный и внутренний, НЯС и ВЯС) и сетчатых (наружный и внутренний, НСС и ВСС) слоев, а также ганглиозными клетками, отсылающими свои отростки (аксоны) в зрительный нерв. НЯС представлен телами фоторецепторных клеток, а ВЯС – телами интернейронов – биполярами и амакриновыми клетками, а также рядом горизонтальных клеток. НСС содержит отростки фоторецепторов, взаимодействующие с отростками интернейронов, а ВЯС состоит из отростков интернейронов во взаимодействии с отростками ганглиозных клеток.
Рис. 2.
Строение сетчатки на гистологическом срезе (а) и в схематическом изображении основных клеточных типов (б). Из: Gramage, Hitchcock, 2014 (с модификациями).

Мюллеровская глия является единственной популяцией макроглиальных клеток в составе сетчатки. Клетки Мюллера пронизывают толщу сетчатки, обеспечивают механическую ее поддержку, посылая свои длинные отростки наружу и вовнутрь, участвуют в формировании наружной и внутренней пограничных мембран сетчатки (MacDonald et al., 2015). Помимо этого, клетки Мюллера обеспечивают трофическую поддержку всех без исключения ретинальных нейронов (Reichenbach, Bringmann, 2013) и служат световосприятию (Franze et al., 2007).
Отдельно необходимо остановиться на клетках – источниках восстановления сетчатки. Вопрос – существенный в аспекте наших исследований с использованием органотипического культивирования, однако слишком широкий для подробного изложения в данной статье. Спектр эндогенных клеток источников восстановления сетчатки описан в литературе последних лет (Jeon, Oh, 2015; Chohan et al., 2017; Григорян, 2018, 2019). В сетчатке глаза к категории клеток, которые в зависимости от вида и возраста животных потенциально могут или реально участвуют в восстановлении сетчатки, относят клетки цилиарной области глаза. У низших позвоночных животных это – цилиарная маргинальная зона – ЦМЗ, а у высших – область края сетчатки и цилиарного тела. Помимо этого, регенерационный ресурс представляют РПЭ и клетки Мюллера. Последние расцениваются как наиболее перспективные для регенерации сетчатки высших позвоночных и человека (см. обзор: Григорян, 2019). Еще одним важным механизмом восстановления сетчатки является рост нейральных отростков и восстановление синаптических связей между различными типами нейронов в поврежденной сетчатке. Изучению этого механизма также значительно способствует метод органотипического культивирования сетчатки (Al-Ali et al., 2017).
ОРГАНОТИПИЧЕСКОЕ КУЛЬТИВИРОВАНИЕ СЕТЧАТКИ НИЗШИХ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
В исследованиях, применявших органотипическое культивирование сетчаток низших позвоночных, в качестве объектов использовали рыб, хвостатых и бесхвостых амфибий. Работ таких немного, что, по-видимому, обусловлено легкой доступностью этих животных для исследований in vivo. Тем не менее, как мы увидим ниже, и они вносят свой существенный вклад в изучение восстановительных возможностей сетчатки.
Культивирование срезов сетчатки взрослых костистых рыб в течение 5 дней позволило обнаружить, что in vitro сохраняются не только основные морфологические свойства ткани, в частности стратификация, но и присущие нормальной сетчатке основные, выявляемые иммунохимически, клеточные типы. Более того, были обнаружены признаки регенерации сетчатки – рост клеток ЦМЗ с периферии, а также пополнение фоторецепторного слоя за счет клеток предшественников, локализующихся во ВЯС. Динамика пролиферации клеток ЦМЗ по результатам тимидиновой радиоавтографии оказалась сходной с наблюдаемой in vivo, также, как и появление в НЯС имеющих фоторецепторный иммунофенотип новых клеток. Они были потомками клеточного источника, локализующегося в ВЯС (Mack, Fernald, 1991, 1992). Позже, органотипическое культивирование изолированной сетчатки рыб Danio rerio позволило изучить некоторые детали восстановления сетчатки за счет глиальных клеток Мюллера (Lahne et al., 2017). Регенерация поврежденной ярким светом сетчатки происходила благодаря входу клеток Мюллера в клеточный цикл, производству ими клеток-потомков и их последующей дифференцировке в утерянные при облучении светом фоторецепторы. При этом имела место интеркинетическая миграция клеток-потомков Мюллеровских клеток из ВЯС в НЯС. Проследить за этим интересным процессом, являющимся важным, но до последнего времени малопонятным этапом регенерации, удалось благодаря предварительному мечению клеток флуоресцентной меткой (Tg[gfap:nGFP]), а также использованию мультифотонной прижизненной микроскопии. В этом же эксперименте на основании полученных данных прижизненной регистрации миграции клеток Мюллера была оценена динамика их движения вдоль наружной и внутренней ограничивающих мембран сетчатки (Lahne et al., 2017). На эксплантатах сетчатки золотой рыбки (Carassius auratus), находящихся in vitro в течение 5 сут, протестировано действие на рост аксонов ганглиозных клеток таурина и серотонина. Отметим, что рост аксонов – один из важных, постоянно исследуемых механизмов восстановления сетчатки. Результаты показали увеличение скорости процесса при добавлении таурина и снижение в присутствии в среде культивирования серотонина (Matus et al., 1997).
Примеров органотипического культивирования сетчатки бесхвостых амфибий немного. При использовании в культуре сетчатки шпорцевой лягушки Xenopus laevis, удалось установить, что после разобщения нейральной сетчатки и РПЭ в течение 3 часов происходит возвращение утраченных при выделении ткани взаимодействий фоторецепторных и клеток РПЭ. Это происходило благодаря быстрому восстановлению, имеющих место in situ нативных свойств РПЭ, в частности адгезивных, ключевых при взаимодействии апикальных отростков РПЭ с наружными сегментами фоторецепторов (Defoe, Easterling, 1994). Органотипическое культивирование сетчатки Xenopus laevis в составе задней стенки глаза, т.е. вместе с подстилающими сетчатку РПЭ, хороидальной и склеральной оболочками, позволило подтвердить пригодность этой модели для анализа процесса восстановления взаимодействия клеток РПЭ и фоторецепторов. В результате были оценены не только жизнеспособность клеток наружной сетчатки, но и поведение белков светотрансдукции аррестина и трансдуцина (Reidel et al., 2006).
Мы проводили органотипическое роллерное культивирование сетчатки тритона Pleurodeles waltl (Urodela) (Новикова и др., 2010). Исследование было направлено на выяснение способов регенерации и участие в ней внутренних источников сетчатки у этих животных в отсутствие РПЭ. Последний при этом хорошо известен как основной источник клеток сетчатки для восстановления у тритонов после ее удаления, перерезки зрительного нерва и отслойки сетчатки in vivo (Keefe, 1973; Mitashov, 1996, 1997, Grigoryan, 2012). Оказалось, что выбранные условия длительного культивирования (в пределах одного месяца) индуцируют активацию, пролиферацию и миграцию клеток – внутренних источников регенерации нейральной сетчатки, а также рост нейральных отростков жизнеспособных нейронов. Поскольку сетчатку выделяли без РПЭ, восстановление могло происходить только за счет собственного клеточного ресурса нейральной сетчатки – клеток ЦМЗ, биполяро-подобных клеток и, возможно, клеток Мюллера (Григорян, 2019). Детали выделения нейральной сетчатки и длительного процесса культивирования как такового описаны в статьях (Новикова и др., 2010; Grigoryan et al., 2016).
При ротационном органотипическом культивировании in vitro вначале в результате смыкания краев (периферии) сетчатки тритона формировались замкнутые структуры – сфероиды с обращенным наружу фоторецепторным слоем (рис. 3). Через 2 недели, несмотря на гибель отдельных фоторецепторов и клеток внутренней сетчатки, в образованных сфероидах сохранялась послойная организация. Вблизи зоны смыкания сфероида в НЯС и ВЯС обнаруживались многочисленные митозы. В НЯС митотические клетки располагались среди тел фоторецепторов, а в ВЯС – часто вблизи длинного отростка клеток Мюллера (Новикова и др., 2010; Grigoryan et al., 2016).
Рис. 3.
Сетчатка тритона, экспонированная в условиях ротационного органотипического культивирования. Общий вид через две (а) и четыре (б) недели культивирования. Стрелки указывают на область смыкания сфероида и область выхода зрительного нерва (а), масштабный отрезок: 500 мкм; в – митозы во внутреннем ядерном слое сетчатки (стрелки), масштабный отрезок – 20 мкм; г – клетки, имеющие фенотип нейробластов, среди исходных нейронов внутренней части сетчатки (стрелки), масштабный отрезок – 10 мкм.

На полутонких срезах была очевидной гипертрофия клеток Мюллера, выражающаяся в значительном увеличении размеров ядер, числа ядрышек и толщины длинных отростков этих клеток. В этой популяции отдельные клетки также находились в митотической фазе. Через 2 нед. культивирования в центральной области сетчатки, далекой от периферии, были видны потоки мигрирующих из ВЯС в НЯС клеток, и также многочисленные митозы. Все это явилось свидетельством активного участия внутреннего резерва регенерации сетчатки тритона – клеток ЦМЗ, а также, возможно, локализующихся в ВЯС потомков клеток Мюллера и биполяро-подобных клеток (Новикова и др., 2010).
Через 4 нед. культивирования сетчатки тритона происходило смешение ВЯС и НЯС, прорастание нейральных отростков клеток в полость сфероида. Клетки в митотической фазе встречались чаще, чем через 2 нед. В результате значительная часть клеток в таких сфероидах, проанализированных на сериях полутонких срезах, имела характерные признаки нейробластов (рис. 3г).
Таким образом, в процессе длительного органотипического культивирования in vitro, неизбежно сопровождающегося ограниченной клеточной гибелью, в частности в популяции фоторецепторных клеток, имеют место восстановительные процессы и реконструкция взрослой нейральной сетчатки (вне РПЭ), использующая у тритона внутренние клеточные источники и механизмы для восстановления.
Исследование сетчатки тритона в ходе органотипического культивирования с помощью молекулярных методов подтвердило полученные нами морфологические сведения. О наличии значительного числа малодифференцированных клеток в культивируемой в течение 4-х нед. сетчатке тритона свидетельствовали данные исследования, выполненного с помощью ПЦР. Была обнаружена высокая экспрессия генов, кодирующих ßII тубулин (ßII-tub) и нуклеостемин (Ns) (белков – маркеров низкого уровня дифференцировки). Параллельно были выявлены транскрипты регуляторного фактора Fgf2, ответственного за клеточную дедифференцировку и пролиферацию (Новикова, 2010; Маркитантова и др., 2014).
На данной модели было проведено также определение эффективности митохондриального антиоксиданта SkQ1 в поддержании жизнеспособности, пролиферативной активности и способности к изменению фенотипа клеток. Отличия от контроля (без внесения фактора в среду) выражались не только в увеличении численности жизнеспособных клеток, но и общем уровне пролиферативной активности, и дедифференцировки клеток культивируемых сетчаток. Через 30 дней культивирования число дедифференцированных клеток, в присутствии SkQ1 в среде, в некоторых случаях достигало 80% от общего числа клеток (Новикова, 2010).
С использованием органотипического культивирования изучен еще один аспект регенерации сетчатки у тритонов (Cynops pyrrhogaster), а именно роли взаимодействия РПЭ с подлежащими тканями – хороидальной и склеральной оболочками, входящими с состав задней стенки глаза, в регенерации нейральной сетчатки не из собственного внутреннего резерва, а из клеток РПЭ (Mitsuda et al., 2005). Обнаружено, что хороидальная (сосудистая) оболочка необходима для осуществления процесса регенерации. Изолированный от хороида РПЭ не пролиферировал, но в присутствии сосудистой оболочки, даже будучи отделенным от нее мембранным фильтром, мог проявить свои регенераторные возможности – пролиферацию и трансдифференцировку в клетки сетчатки. Исследование роли ростовых факторов, источником которых мог быть хороид – Fgf2 и Igf1, указало на ведущую роль Fgf2, а Igf1 мог воздействовать на инициацию и прогресс регенерации сетчатки из РПЭ только совместно с Fgf2. По данным ПЦР в реальном времени, имело место увеличение экспрессии в тканях задней стенки глаза генов, кодирующих оба этих фактора, вскоре после удаления сетчатки. Это подтверждало предположение о роли хороида, как источника факторов, в регенерации сетчатки у тритона за счет клеток РПЭ (Mitsuda et al., 2005).
КУЛЬТИВИРОВАНИЕ СЕТЧАТКИ ПТИЦ
Модели культивированной сетчатки птиц в основном применяли для решения вопросов, связанных с развитием этой ткани. При этом часто использовали срезы и реагрегационные (формирующиеся из клеточной суспензии) культуры сетчатки эмбрионов цыпленка. Так, работа на срезах эмбриональной сетчатки цыпленка в условиях ротационного культивирования определила, что модель полностью удовлетворяет задачам исследования – изучению дифференцировки нейронов и глиальных клеток сетчатки. Более того на модели было успешно изучено дозо-зависимое действие на ретиногенез блокатора Na+ каналов, мексилетина, подтверждающее пригодность модели также для токсикологических исследований (Hoff et al., 1999). Изолированную сетчатку цыпленка (Е6) культивировали органотипически при постоянном вращении, что обеспечило хорошую ее жизнеспособность и позволило провести дробную фиксацию образцов в течение трех недель для иммунохимического изучения хода развития. Интересным наблюдением явилось развитие фоторецепторов в отсутствие РПЭ. С помощью электронной микроскопии был обнаружен рост наружных отростков фоторецепторных клеток вне контакта с пигментированным эпителием сетчатки (Thangaraj et al., 2011).
Прицельное исследование роли ростовых факторов в развитии сетчатки цыпленка было проведено с помощью использования блокатора их действия сурамина (suramin) (Cirillo et al., 2001). Культивирование эмбриональной сетчатки цыпленка в течение суток в присутствии сурамина (50–200 мкM) приводило к подавлению пролиферации, клеточной дезинтеграции и нарушению формирования наружной пограничной мембраны. Проявление эффекта сурамина оказалось дозозависимым и могло быть нивелировано присутствием в среде FGF-2, что подтверждало ведущую роль этого ростового фактора в развитии сетчатки позвоночных.
Широкая серия работ проведена на реагрегационных культурах сетчатки цыпленка с целью выявления закономерностей развития и восстановления сетчатки, а также влияния на этот процесс различных факторов (Layer, Willbold, 1989; Wolburg et al., 1991, Willbold, Layer, 1992). При таком подходе реагрегационные культуры могли быть получены, элиминируя (или напротив, сохраняя), те или иные области сетчатки при ее выделении (брались только центральная область сетчатки, сетчатка с краевой (ЦМЗ) зоной, сетчатка вне и с РПЭ). Так, при сохранении при выделении сетчатки ЦМЗ вместе с прилежащими пигментированными клетками, в формирующихся ретинотипических стратифицированных сфероидах при реагрегации клеток сетчатки цыпленка стадии Е9 были обнаружены скрытые регенерационные возможности этой ростовой области глаза. В течение длительного времени наблюдалась пролиферация и дифференцировка клеток ЦМЗ, тогда как процесс пополнения сетчатки за счет этого источника in vivo подавляется уже на стадии Е4 (Willbold, Layer, 1992). При этом клетки ЦМЗ в пролиферативной фазе с образованием нейронов сетчатки de novo находились долго. Этот период сопровождался присутствием в ЦМЗ бутирилхолинэстеразы – фермента, экспрессия которого находится в корреляции с фазой перехода клеток от пролиферации к дифференцировке. В результате был сделан важный вывод, что потенции клеток ЦМЗ к пролиферации и пополнению клеточного состава сетчатки цыпленка сохраняются как минимум до стадии Е9 (Willbold, Layer, 1992). Роль периферической части РПЭ в гистогенезе ретинотипических стратифициованных сфероидов была исследована в работе (Wolburg et al., 1991). Авторам удалось выяснить, что корректная, сопоставимая с нормальной in vivo послойная организация, а также рост отростков клеток глиальных клеток Мюллера и формирование при их участии ограничивающих наружной и внутренней мембран, зависят от наличия в реагрегационных культурах клеток РПЭ.
Так же как это было показано в отношении роли хороидальной оболочки в регенерации сетчатки из клеток РПЭ у тритона, существенная роль этой структуры была установлена в стимуляции роста отростков нейральных клеток при культивировании диссоциированных клеток эксплантатов сетчатки цыпленка. Действие экстракта хороида глаза цыпленка (Е18) сравнивали с действием хорошо известного нейротрофического фактора CNTF. Для обоих факторов был обнаружен как стимулирующий эффект, так и дозовая зависимость роста аксонов от концентраций факторов в среде (Carri et al., 1994). Это дало основание предполагать, что сосудистая оболочка обладает широким набором факторов, имеющих сигнальное и трофическое значение при регенерации и развитии сетчатки глаза амфибий и птиц.
ОРГАНОТИПИЧЕСКОЕ КУЛЬТИВИРОВАНИЕ СЕТЧАТКИ МЛЕКОПИТАЮЩИХ
Для млекопитающих инструмент органотипического культивирования оказался не менее эффективным для решения многих вопросов, связанных с развитием и регенерацией сетчатки. Было показано (Pinzón-Duarte, 2000), что сетчатка неонатальных, рождающихся слепыми мышей, находится в состоянии гистотипического развития, не только успешно переживает условия эксплантации и культивирования, но и демонстрирует завершение формирования слоев и клеточных типов, аналогично сформированным in vivo. Интересно, что для развития фоторецепторов и наружной пограничной мембраны оказался необходим РПЭ, который, однако, не требовался для правильного развития внутренней сетчатки, дифференцировки ее клеток, роста отростков нейронов и синаптогенеза (Pinzón-Duarte, 2000). Известны также наблюдения, свидетельствующие о том, что развитие сетчатки неонатальных мышей может успешно происходить и в бессывороточной среде (Caffe et al., 2001).
Что касается культивирования сетчатки постнатальных мышей, то в этом случае в среде без сыворотки не только сохраняется ее, уже в основном сформированная структура, но и наблюдается продолжающийся рост нейральных отростков, хотя и обнаруживаются потери в популяции клеток НЯС (Caffe et al., 2001). В работе (Bandyopadhyay, Rohrer, 2010) органотипическое культивирования сетчаток постнатальных мышей также не препятствовало нормальному развитию ткани, в частности формированию фоторецепторов. Ткань сетчатки была помещена в условия органного культивирования на стадии Р7, когда ВЯС был сформирован, но предшественники палочек еще не завершили активную миграцию в сторону НЯС, в слой, полное формирование которого завершается на стадиях Р10–Р12. In vivo в дальнейшем происходит рост наружных отростков фоторецепторов и становление сетчатых слоев. После 11 дней культивирования in vitro сравнение проводилось с тканью сетчатки при нормальном развитии in vivo на стадии Р18, когда в целом гистогенез сетчатки мыши завершается. Сравнение продемонстрировало не только сохранение структуры сетчатки, сформированной до срока помещения ткани в культуру, но и дальнейшее корректное формирование НЯС. В дополнение к этим результатам была выявлена продукция 11-цис ретиналя клетками РПЭ, обеспечивающего поддержку развития колбочек и сигнальную фототрансмиссию (Bandyopadhyay, Rohrer, 2010).
В течение 10 дней были культивированы эксплантаты сетчаток развивающихся (стадии P3 и P10) и взрослых (P60) мышей. Была выявлена лучшая жизнеспособность нейронов сетчатки, полученной от развивающихся мышей по сравнению с сетчаткой взрослых животных. Методы цитофлуориметрии и иммуноцитохимии помогли установить уровень клеточной гибели, а также ее связь с объемами и распределением в сетчатке клеток микроглии/макрофагов – популяции, представляющей систему фагоцитов, объемы которой могут свидетельствовать об уровне дегенерации сетчатки (Ferrer-Martin et al., 2014).
Органотипическое длительное (до 2–3-х нед.) культивирования развивающейся сетчатки грызунов представляется в настоящее время удобной моделью для проведения ретровирусной трансфекции. Главным направлением этих исследований являются попытки переноса генов в ретинальные прогениторы для понимания роли тех или иных регуляторных транскрипционных факторов в дифференцировке и последовательности созревания определенных специфических клеточных типов сетчатки (Hatakeyama, Kageyama, 2002; Zhang et al., 2002).
Существуют примеры успешного органотипического культивирования сетчаток не только эмбрионов или постнатальных мышей, но и полученных от взрослых особей. Так в работе (Müller et al., 2017), проведенной с использованием иммунохимии и ПЦР анализа, удалось показать, что условия in vitro способны поддерживать ткань минимум в течение 10 дней. Обнаружилось также, что в первые 4 дня имеют место характерные изменения, в частности активация клеток Мюллера, изменения фоторецепторных отростков, а также сети нейритов биполярных клеток.
Мы предприняли попытку ротационного органотипического культивирования изолированной целой (без РПЭ) сетчатки взрослой (2 мес.) крысы в течение 10 сут. Подробно процедуры выделения, культивирования и последующего анализа описаны в статье (Новикова и др., 2010). К концу культивирования сетчатка крысы сохраняла жизнеспособность, но претерпевала значительные морфологические изменения. Сетчатки крысы in vitro образовывали сфероиды разной степени закрытия. Последнее определяло жизнеспособность клеток. В открытых сфероидах при сохранении послойной организации клеточная гибель была высокой, отсутствовали признаки пролиферации не нейрональных клеток, а резидентные макрофаги активно заселяли запустевающий в результате гибели клеток ганглиозный слой. Резидентные макрофаги в сетчатке крысы входят в относительно большую гетерогенную популяцию микроглиальных клеток и макрофагов, различающихся в зависимости от состояния сетчатки распределением по ее толще, по экспрессии некоторых антигенов, а также морфологически (Chang et al., 2005). Мы опирались на морфологические характеристики, значительно отличающие эти клетки от других клеток сетчатки (крупные размеры, округлая или амебоидная форма клеток).
В случае полного закрытия сфероида сетчатки крысы инициировались реорганизация в ткани и клеточные ответы, свидетельствующие о реконструкции (рис. 4). Тела обращенных наружу фоторецепторных клеток теряли отростки, частично гибли и смещались во внутреннюю часть сфероида, в результате чего клетки ВЯС оказывались в наружной его части, вблизи наружной пограничной мембраны. Такое поведение клеток наблюдается у крыс и при иллюминации ярким светом (Grigoryan et al., 2016). Клетки ганглиозного слоя сохраняли при этом прежнюю локализацию. Тела клеток в толще сфероида, обладали высокой жизнеспособностью, а некоторые (не нейрональные) клетки и митотической активностью: на каждом из серийных срезов таких сфероидов мы обнаруживали 1–3 картины митотических делений. Изучение клеток в фазе М и их локализации свидетельствовало о том, что пролиферативной активностью обладают две клеточные популяции: крупные макрофагальные клетки и отдельные мелкие клетки, принадлежащие ВЯС (рис. 4в, 4г). Последние представляли собой с высокой вероятностью активированные клетки Мюллера, популяции – потенциального источника регенерации клеток сетчатки, в частности, фоторецепторов у мышей (Jorstad et al., 2017).
Рис. 4.
Сетчатка крысы, экспонированная 10 дней в условиях ротационного органотипического культивирования. (а, б) – общий вид при завершении культивирования, НЯС – наружный ядерный слой, ВЯС – внутренний ядерный слой, масштабные отрезки: (a) – 500 мкм, (б) – 100 мкм; (в, г) – митозы ненейральных клеток во внутренней части сетчатки (стрелки), масштабные отрезки – 10 мкм.
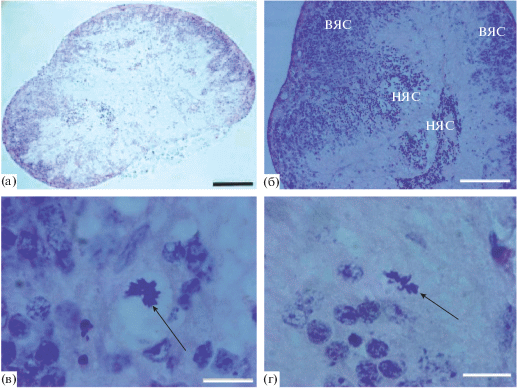
Таким образом, данные полученные с помощью органотипического культивирования сетчатки взрослых крыс, свидетельствуют о возможности структурных изменений и активации регенерационных ответов в переживающей in vitro ткани сетчатки. Механизмы, используемые при этом – транслокация клеток ВЯС наружу на фоне частичной гибели в НЯС, смещение тел фоторецепторов вовнутрь, реакция со стороны макроглии, а также относительная устойчивость послойной организации и ограниченная пролиферация не нейрональных клеток (Новикова и др., 2010, Grigoryan et al., 2016).
С использованием органотипического культивирования изучали действие на клетки сетчатки крысы токсина и одного из факторов, обладающих нейропротекторным действием. Особое внимание было обращено на уязвимые при различных патологиях сетчатки клетки ганглиозного слоя и их отростки. Для этого предварительно, до эксплантации сетчатки, еще in vivo в зону окончания зрительного нерва у области зрительного анализатора в мозге с помощью внутричерепного введения была доставлена флуоресцентная метка (FluoroGold), которая, распределяясь по волокнам нерва, позволяла окрасить как тела, так и отростки ганглиозных клеток. После чего такие сетчатки выделяли и культивировали в присутствии гентамицина, добавленного в среду в токсических концентрациях (Smedowski et al., 2018). Вызванный гентамицином оксидативный стресс приводил к значительному повреждению клеток, разрушению их отростков, сопровождающихся быстрым выбросом фермента лактатдегидрогеназы – маркера клеточного разрушения. Добавление цилиарного нейротрофического фактора (CNTF) приводило к значительному (хоть и неполному) устранению данных негативных показателей в популяции ганглиозных клеток и формирующих зрительный нерв их отростков в ответ на действие токсина (Smedowski et al., 2018).
Мы в качестве эффективного антиоксиданта и нейропротектора для предотвращения клеточной гибели сетчатки крысы, культивированной in vitro в составе задней стенки глаза, использовали SkQ1. Добавление 20 нM этого эффективного, защищающего митохондрии клеток, препарата приводило к значительному сокращению клеточных потерь в ганглиозном слое на 7 сут и предотвращению гибели и дезинтеграции клеток ВЯС на 14 сут ротационного органотипического культивирования (Grigoryan et al., 2013).
Работа по изучению действия оксислительного стресса на ретинальные клетки проведена также на сетчатке свиньи, как известно, очень близкой по строению к сетчатке человека (Hurst et al., 2017). В качестве агента, индуцирующего стресс, использовали перекись водорода (H2O2) в концентрациях 100, 300 и 500 мкМ. Была проведена оценка снижения количества жизнеспособных клеток ганглиозного слоя, экспрессии генетических маркеров оксидативного стресса, белка теплового шока Hsp70, маркеров воспаления, увеличение популяции микроглии, а также активации макроглиальных клеток. Эта работа позволила предложить модель для тестирования не только факторов защиты сетчатки от оксидативного стресса, но и других протекторов сетчатки, а также для исследования молекулярных механизмов гибели ретинальных клеток (Hurst et al., 2017).
При культивировании сетчатки свиньи (Kaempf et al., 2008) выяснилось, что РПЭ ответственен за степень проявления реактивного глиоза – реакции глиальных клеток Мюллера на структурные и метаболитические нарушения в сетчатке (deHoz et al., 2016). Активация клеток Мюллера, выражающаяся в гипертрофии, увеличении белков промежуточных филаментов (глиального фибриллярного белка (Gfap) и виментина (Vimentin), оказалась значительно снижена при сохранении взаимосвязи нейральной сетчатки и РПЭ. Наряду с этим была снижена клеточная гибель в НЯС, ВЯС и ганглиозном слоях сетчатки (Kaempf et al., 2008). В другом исследовании на модели сетчатки свиньи (комплекс: хороид-РПЭ-нейральная сетчатка) были созданы условия для постоянной перфузии свежей порции среды, и сохранения тем самым комплекса wholemount и проведения дробной фиксации образцов в течение 10 дней (Kobuch et al., 2008). Для оценки состояния сетчатки иммуногистохимически анализировали широкий ряд параметров – клеточные пролиферацию, жизнеспособность, рост отростков, а также иммунофенотипы фоторецепторных и глиальных клеток. Это позволило убедительно показать, что модель может быть применена для тестирования офтальмологических препаратов, что позволяет сократить число исследований на животных in vivo.
ОРГАНОТИПИЧЕСКОЕ КУЛЬТИВИРОВАНИЕ СЕТЧАТКИ ЧЕЛОВЕКА
Органотипическое культивирование эксплантированной сетчатки человека выглядит хорошим инструментом для проведения самых разнообразных исследований биомедицинского направления – моделирования заболеваний и патологий сетчатки, для доклинических испытаний препаратов и токсикологических тестов. Однако в литературе существует только малое число работ, проведенных с использованием эксплантатов сетчатки человека. В ранних работах был описан рост отростков нейральных клеток сетчатки человека in vitro, а также дано описание отличий по этому параметру регенерации у разных доноров, в зависимости от субстрата и присутствия стимуляторов, в частности наличия Шванновских клеток в среде, способствующих росту нейральных отростков (Thanos, Thiel, 1990; Hopkins, Bunge, 1991). Позднее в работе (Osborne et al., 2016) была сделана попытка моделирования хронической, последовательной дегенерации ганглиозных клеток, которые вне зависимости от донора и времени забора материала (в границах 24 ч после смерти), были успешно маркированы с помощью антител к нейрональному ядерному антигену (NeuN), βIII тубулину (βIII-tub), и антигену поверхности С90 (Thy-1). Параллельное изучение экспрессии этих маркерных молекул, а также апоптоза, позволило оценить динамику гибели ганглиозных клеток по пространству сетчатки, в частности в области макулы, высокочувствительной ее области фовеа и вблизи нее (Osborne et al., 2016). Недавно на той же модели проведено тестирование некоторых перспективных нейропротекторов сетчатки человека. Среди них в отношении защиты ганглиозных клеток сетчатки была выявлена эффективность мезенхимных стволовых клеток человека и производимых ими нейропротекторных факторов, а также PDGF (выделенного из тромбоцитов ростового фактора) (Osborne et al., 2018).
Эксплантаты сетчатки человека in vitro были использованы и в исследованиях ее регенерационных потенций. Выяснено (Mayer et al., 2005), что клетки – потенциальные источники восстановления, называемые авторами нейральными предшественниками, (присутствие которых в сетчатке предполагается и широко обсуждается, Григорян, 2019), способны в сетчатке человека in vitro менять свой фенотип и затем дифференцироваться в различные типы нейронов. В работе Майер с соавторами использовали эксплантаты фрагментов сетчатки, взятых из разных ее областей, а также отдельно краевой области pars plana. Эксплантаты были получены от взрослых доноров (15–87 лет) сразу после смерти и культивированы в присутствии широкого набора ростовых факторов, включая FGF-2. В клетках, выселяющихся и мигрирующих in vitro из таких эксплантатов, были обнаружены отдельные признаки нейральных прогениторов: пролиферация, экспрессия нестина, а также способность этих клеток формировать нейросферы. Авторы, к сожалению, не дают ответа на вопрос о происхождении таких клеток во взрослой сетчатке человека, но предлагают модель для дальнейшего исследования регенерационных возможностей зрелой сетчатки человека в условиях органотипического культивирования для терапевтических целей (Mayer et al., 2005).
Обнаружено также, что предшественники фоторецепторных клеток в ретинальных эксплантатах плода человека, а также мыши, дифференцируются быстрее в присутствии как сетчатки человека, так и РПЭ, полученного из эмбриональных стволовых клеток (ЭСК) человека (Yanai et al., 2015). На культурах сетчатки человека с перспективой в дальнейшем генетической терапии было сделано несколько попыток переноса генов с помощью вирусной трансфекции. Успешной оказалась попытка с помощью этой технологии реактивировать фоторецепторные клетки в отсутствие у них наружного сегмента, (а потому и фоточувствительности), а также восстановить активность ганглиозных клеток эксплантированной сетчатки человека, используя лентивирусные и аденовирусные векторы (Sengupta et al., 2011).
Накопленный опыт культивирования сетчатки человека ex vivo недавно представлен в обзоре Мурали и соавторов (Murali et al., 2018). Там, в частности, указывается на то, что, несмотря на всю привлекательность модели эксплантированной сетчатки человека и ее культивирования для исследований развития и регенерации, моделирования патологий, а также токсикологических тестов и доклинических исследований, для широкого использования модели существует большое число ограничений. Прежде всего, это – сложность в получении постмортального материала сетчатки доноров, отсутствии информации о состоянии сетчатки – наличия у донора тех или иных заболеваний, способных затронуть сетчатку глаза. Следует отметить также, что при выделении сетчатки неизбежна отмеченная выше аксотомия, которая сопровождается ретроградной гибелью отростков, а затем и тел ганглиозных клеток. При выделении имеет место также клеточный стресс, а также метаболитические изменения, которые в ходе культивирования в условиях изоляции сетчатки от окружающих ее тканей глаза только усиливаются. При этом по понятной причине невозможно и получение контролей – нормальной функционирующей ткани здоровой сетчатки человека (Murali et al., 2018).
Приведенные выше работы, выполненные при использовании органотипического культивирования сетчатки эмбрионов и взрослых животных разных классов и видов позвоночных, а также на сетчатке человека, на фоне постоянно совершенствующейся техники культивирования и достижений в исследовании стволовых клеток, заложили основу для использования метода органотипического культивирования при получении так называемых органоидов сетчатки.
ОРГАНОИДЫ СЕТЧАТКИ – ПЕРСПЕКТИВА ПРИМЕНЕНИЯ МЕТОДА ОРГАНОТИПИЧЕСКОГО КУЛЬТИВИРОВАНИЯ
Как мы неоднократно упоминали выше, жизнеспособность ткани сетчатки значительно увеличивается в обновляющейся среде культивирования, позволяющей лучшую доставку веществ, а также элиминацию продуктов метаболизма. В настоящее время помимо органотипического ротационного и стационарного культивирования с этой целью используют так называемые биореакторы, значительно увеличивающие время культивирования, а также позволяющие анализировать биологические и биохимические процессы в сетчатке под строгим мониторингом условий in vitro, таких как температура, рН, уровень кислорода и т.д. (Martin et al., 2004; Antoni et al., 2015).
Особое значение эти новые технологические возможности имеют для разработки техники получения так называемых органоидов сетчатки с целью их дальнейшего применения для трансплантации в случаях клеточных потерь при заболеваниях или повреждениях сетчатки млекопитающих и человека (Ader, Tanaka, 2014; Llonch et al., 2018; DiStefano et al., 2018). Использование биореакторов (Ovando-Roche et al., 2018) и технология получения органоидов сетчатки для 3D культивирования постоянно совершенствуются (Reichman et al., 2017; DiStefano et al., 2018; Capowski et al., 2019). Отмечается, что эти достижения имеют хорошие перспективы для получения дифференцированных (в разной степени от предшественников до зрелых нейронов) клеток сетчатки для трансплантации, в частности наиболее часто погибающих фоторецепторов, клеток РПЭ, а также для тестирования различных препаратов и проведения процедур геномодификации. Особое значение очень медленно развивающиеся органоиды сетчатки имеют и для изучения дифференцировки клеточных типов сетчатки и молекулярных регуляторов этого процесса.
Материалом для получения и формирования in vitro органоидов сетчатки служат эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК) мышей и человека (рис. 5). Ранее было показано, что при формировании и развитии ретинальных органоидов имеет место спонтанное воспроизведение процессов, сопоставимых с таковыми при ретиногенезе in vivo (Eiraku et al., 2011, Nakano et al., 2012). При соблюдении адекватных условий in vitro культивируемые стволовые клетки начинают развиваться в нейроэпителиальном направлении, после чего образовавшийся нейроэпителий инвагинирует таким же образом как это происходит при развитии глазного бокала in vivo. В дальнейшем в результате самоорганизации эта структура претерпевает дифференцировку клеточных типов и морфогенез, формируя стратифицированную ткань, содержащую дифференцированные интернейроны и фоторецепторные клетки (Eiraku et al., 2011, Nakano et al., 2012). Интересно, что процесс созревания сетчаточных органоидов происходит быстрее в условиях гипоксии, симулирующих условия развития сетчатки в эмбриогенезе in vivo (Chen et al., 2016).
Рис. 5.
Этапы получения органоидов сетчатки. 1 – выделение стволовых клеток (ЭСК и ИПСК), 2 – культивирование стволовых клеток и перенесение во вращающиеся биореакторы, 3 – формирующиеся органоиды, 4 – внутренняя структура органоида.

Более того, помимо структурного сходства с сетчаткой, в культивируемых органоидах можно добиться и рекапитуляции существующих in vivo, биологических и метаболитических ее параметров (Yin et al., 2016; Browne et al., 2017). Однако есть и пока не преодоленные недостатки полученных in vitro сетчаточных органоидов. Отмечается, что они плохо доступны для проникновения различных факторов, а также не имеют необходимого для той же цели кровоснабжения (McMurtrey, 2016). Помимо этого отмечено отсутствие формирования сетчатых синаптических слоев (НСС и ВСС), а также слоя ганглиозных клеток. Подробная информация о способах культивирования органоидов сетчатки, полученных из ИПСК человека с целью получения клеточного материала для трансплантаций, представлена недавно в обзоре Лонч и соавторов (Llonch et al., 2018).
Особым направлением, получившим свое развитие совсем недавно, является применение органоидов сетчатки, полученных из ИПСК пациентов (patient-specific organoids), страдающих тем или иным генетическим заболеванием сетчатки (Foltz, Clegg, 2019). Пока используются модели патологий сетчатки, для которых уже хорошо известны генетические мутации и их клеточные и функциональные последствия. Одна из немногочисленных таких работ посвящена коррекции последствий пигментного ретинита (PR) – распространенного генетического заболевания сетчатки, приводящего к слепоте. Денг и соавторы (Deng et al., 2018) при использовании техники CRISPR-Cas9 на клетках органоидов, полученных из ИПСК пациентов, страдающих этим заболеванием, провели коррекцию несущего мутацию гена RPGR – регулятора ГТФазы, одного из основных генов, ответственных за развитие PR. Это позволило предотвратить нарушение строения фоторецепторов и РПЭ, вернуть клеткам их электрофизиологические свойства, а также восстановить генетическую экспрессию RPGR в фоторецепторных клетках до уровня контрольного. Можно предвидеть, что с развитием способов получения органоидов, в том числе персонифицированных, с дальнейшим совершенствованием способов органотипического культивирования, а также методов коррекционной геномодификации, это направление в ближайшие годы получит особое развитие, открывающее перспективы генетической терапии наследственных, пока неизлечимых заболеваний сетчатки глаза.
Работа выполнена в рамках раздела Государственного задания ИБР РАН, № ГЗ 0108-2018-0005.
Список литературы
Григорян Э.Н. Молекулярные факторы поддержания и активации “молодого” фенотипа клеток-источников регенерации тканей глаза // Биохимия. Т. 83. № 11. С. 1629–1644. (Grigoryan E.N. Molecular factors of the maintenance and activation of the juvenile phenotype of cellular sources for eye tissue regeneration // Biochemistry (Moscow). 2018. V. 83. № 11. P. 1318–1331).
Григорян Э.Н. Эндогенные клеточные источники для регенерации сетчатки у позвоночных животных и человека // Онтогенез. 2019. Т. 50. № 1. С. 12–26. (Grigoryan E.N. Endogenous cell sources for eye retina regeneration in vertebrate animals and humans // Russian Journal of Developmental Biology (Ontogenez). 2018. V. 49. № 6. P. 1–13).
Маркитантова Ю.В., Авдонин П.П., Григорян Э.Н. Компоненты FGF сигнального пути в тканях заднего сектора глаза взрослого тритона Pleurodeles waltl // Известия РАН. Сер. биол. 2014. № 4. С. 325–333. (Markitantova Y.V., Avdonin P.P., Grigoryan E.N. FGF2 signaling pathway components in tissues of the posterior eye sector in the adult newt Pleurodeles waltl // Biol. Bull. (Moscow). 2014. V. 41. P. 297–305).
Новикова Ю.П. Выявление и активация in vitro скрытых регенерационных потенций сетчатки глаза позвоночных животных. Дис. ... канд. биол. наук. М.: ИБР РАН, 2010.
Новикова Ю.П., Алейникова К.С., Краснов М.С., Поплинская В.А., Григорян Э.Н. Сетчатка глаза взрослых тритона и крысы в условиях органотипического культивирования in vitro // Известия РАН. Сер. биол. 2010. № 4. С. 389–402. (Novikova Yu.P., Aleynikova K.S., Krasnov M.S., Poplinskaya V.A., Grigoryan E.N. In vitro organotypic cultivation of adult newt and rat retinas // Biology Bulletin (Izvestiya RAN). 2010. V. 37. № 4. P. 327–338).
Ader M., Tanaka E.M. Modeling human development in 3D culture // Curr. Opin. Cell Biol. 2014. V. 31. P. 23–28.
Al-Ali H., Beckerman S.R., Bixby J.L. Lemmon V.P. In vitro models of axon regeneration // Exp. Neurol. 2017. V. 287. P. 423–434.
Amini R., Rocha-Martins M., Norden C. Neuronal migration and lamination in the vertebrate retina // Front. Neurosci. 2018. V. 11. P. 742.
Antoni D., Burckel H., Josset E., Noel J. Three-dimensional cell culture: a breakthrough in vivo // Int. J. Mol. Sci. 2015. V. 16. P. 5517–5527.
Bandyopadhyay M., Rohrer B. Photoreceptor structure and function is maintained in organotypic cultures of mouse retinas // Mol. Vis. 2010. V. 16. P. 1178–1185.
Boyd W.H. A chamber for organotypic culture adapted for growing large volumes of tissue // Stain. Technol. 1971. V. 46. P. 85–87.
Braschler U.F., Iannone A., Spenger C., Streit J., Lüscher H.R. A modified roller tube technique for organotypic cocultures of embryonic rat spinal cord, sensory ganglia and skeletal muscle // J. Neurosci. Methods. 1989. V. 29. P. 121–129.
Browne A.W., Arnesano C., Harutyunyan N., Khuu T., Martinez J.C., Pollack H.A., Koos D.S., Lee T.C., Fraser S.E., Moats R.A., Aparicio J.G., Cobrinik D. Structural and functional characterization of human stem-cell-derived retinal organoids by live imaging // Invest. Ophthalmol. Vis. Sci. 2017. V. 58. P. 3311–3318.
Caffé A.R., Söderpalm A., van Veen T. Photoreceptor-specific protein expression of mouse retina in organ culture and retardation of rd degeneration in vitro by a combination of basic fibroblast and nerve growth factors // Curr. Eye Res. 1993. V. 12. P. 719–726.
Caffé A.R., Ahuja P., Holmqvist B., Azadi S., Forsell J., Holmqvist I., Söderpalm A.K., van Veen T. Mouse retina explants after long-term culture in serum free medium // J. Chem. Neuroanat. 2001. V. 22. № 4. P. 263–273.
Capowski E.E., Samimi K., Mayerl S.J., Phillips M.J, Pinilla I., Howden S.E., Saha J., Jansen A. D., Edwards K.L., Jager L.D., Barlow K., Valiauga R., Erlichman Z., Hagstrom A., Sinha D., Sluch V.M., Chamling X., Zack D.J., Skala M.C., Gamm D.M. Reproducibility and staging of 3D human retinal organoids across multiple pluripotent stem cell lines // Development. 2019. V. 146. № 1: dev171686.
Carri N.G., Richardson P., Ebendal T. Choroid coat extract and ciliary neurotrophic factor strongly promote neurite outgrowth in the embryonic chick retina // Int. J. Dev. Neurosci. 1994. V. 12. P. 567–578.
Chen H.Y., Kaya K. D., Dong L., Swaroop A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation // Mol. Vis. 2016. V. 22. P. 1077–1094.
Cho H.J., Verbridge S.S., Davalos R.V., Lee Y.W. Development of an in vitro 3D brain tissue model mimicking in vivo-like pro-inflammatory and pro-oxidative responses // Ann. Biomed. Eng. 2018. V. 46. P. 877–887.
Chohan A., Singh U., Kumar A., Kaur J. Müller stem cell dependent retinal regeneration // Clinica Chimica Acta. 2017. V. 464. P. 160–164.
Cirillo A., Chifflet S., Villar B. Neural retina of chick embryo in organ culture: effects of blockade of growth factors by suramin // Cell Tissue Res. 2001. V. 304. № 3. P. 323–331.
Defoe D.M., Easterling K.C. Reattachment of retinas to cultured pigment epithelial monolayers from Xenopus laevis // Invest. Ophthalmol. Vis. Sci. 1994. V. 35. P. 2466–2476.
Deng W.-L., Gao M.-L., Lei X.-L., Lv J.-N., Zhao H., He Kai-Wen., Xia X.-X., Li L.-Y., Chen Y.-C., Li Y.P., Pan D., Xue T., Jin Z.-B. Gene correction reverses ciliopathy and photoreceptor loss in iPSC-derived retinal organoids from retinitis pigmentosa patients // Stem Cell Reports. 2018. V. 10. P. 1267–1281.
DiStefano T., Chen H.Y., Panebianco C., Kaya K.D., Brooks M.J., Gieser L., Morgan N.Y., Pohida T., Swaroop A. Accelerated and improved differentiation of retinal organoids from pluripotent stem cells in rotating-wall vessel bioreactors // Stem Cell Reports. 2018. V. 10. P. 300–313.
Dowling J.E. The Retina. An Approachable Part of the Brain. Revised Edition. Belknap-Harvard Univ. Press, 2012. 384 p.
Eiraku M., Takata N., Ishibashi H., Kawada M., Sakakura E., Okuda S., Sekiguchi K., Adachi T., Sasai Y. Self-organizing optic-cup morphogenesis in three-dimensional culture // Nature. 2011. V. 472. P. 51–56.
Ferrer-Martín R.M., Martín-Oliva D., Sierra A., Carrasco M.-C., Martín-Estebané M., Calvente R., Marín-Teva J.L., Navascués J., Cuadros M.A. Microglial cells in organotypic cultures of developing and adult mouse retina and their relationship with cell death // Exp. Eye Res. 2014. V. 121. P. 42–57.
Feigenspan A., Bormann J., Wässle H. Organotypic slice culture of the mammalian retina // Vis. Neurosci. 1993. V. 10. P. 203–217.
Foltz L.P., Clegg D.O. Patient-derived induced pluripotent stem cells for modeling genetic retinal dystrophies // Prog. Ret. Eye Res. 2019. V. 68. P. 54–66.
Franze K., Grosche J., Skatchkov S.N., Schinkinger S., Foja C., Schild D., Uckermann O., Travis K., Reichenbach A., Guck J. Muller cells are living optical fibers in the vertebrate retina // Natl. Acad. Sci. U.S.A. 2007. V. 104. P. 8287–8292.
Gähwiler B.H. Organotypic cultures of neural tissue // Trends Neurosci. 1988. V. 11. P. 484–489.
Gähwiler B.H., Capogna M., Debanne D., McKinney R.A., Thompson S.M. Organotypic slice cultures: a technique has come of age // Trends Neurosci. 1997. V. 20. P. 471–477.
Gähwiler B.H., Thompson S.M., Muller D. Preparation and maintenance of organotypic slice cultures of CNS tissue // Curr. Protoc. Neurosci. 2001. Chapter 6: Unit 6.11.
Germer A., Jahnke C., Mack A., Enzmann V., Reichenbach A. Modification of glutamine synthetase expression by mammalian Müller (glial) cells in retinal organ cultures // Neuroreport. 1997. V. 8. P. 3067–3072.
Gramage E., Li J., Hitchcock P. The expression and function of midkine in the vertebrate retina // Br. J. Pharmacol. 2014. V. 171. P. 913–923.
Grigoryan E.N., Novikova Y.P., Gancharova O.S., Kilina O.V., Philippov P.P. New antioxidant SkQ1 is an effective protector of rat eye retinal pigment epithelium and choroid under conditions of long-term organotypic cultivation // Adv. Aging Res. 2012. V. 1. P. 31–37.
Grigoryan E. N., Novikova Y. P., Kilina O. V., Philippov P.P. New antioxidant SkQ1 is an effective protector of rat neural retina under conditions of long-term organotypic cultivation // Adv. Aging Res. 2013. V. 2. P. 65–71.
Grigoryan E. Shared triggering mechanisms of retinal regeneration in lower vertebrates and retinal rescue in higher ones // Tissue Regeneration – From Basic Biology to Clinical Application. Croatia. In Tech. 2012. P. 145–164.
Grigoryan E.N., Poplinskaya V.A., Novikova Y.P. Retinal remodeling under conditions of organotypic 3D culturing in vitro and after damage in vivo in lower and higher vertebrates // New Front. Ophthalmol. 2016. V. 2. P. 66–76.
Halfter W., Deiss S. Axonal pathfinding in organ-cultured embryonic avian retinae // Dev. Biol. 1986. V. 114. P. 296–310.
Hatakeyama J., Kageyama R. Retrovirus-mediated gene transfer to retinal explants // Methods. 2002. V. 28. P. 387–395.
Hoff A., Hämmerle H., Schlosshauer B. Organotypic culture system of chicken retina // Brain Res. Brain Res. Protoc. 1999. V. 4. P. 237–248.
Hoon M., Okawa H., Della Santina L., Wong R.O. Functional architecture of the retina: development and disease // Prog. Retin. Eye Res. 2014. V. 42. P. 44–84.
Hopkins J.M., Bunge R.P. Regeneration of axons from adult human retina in vitro // Exp. Neurol. 1991. V. 112. P. 243–251.
de Hoz R., Rojas B., Ramirez A.I., Salazar J.J., Gallego B.I., Triviño A., Ramírez J.M. Retinal macroglial responses in health and disease // Biomed. Res. Int. 2016. V. 2016: 2954721.
Humpel C. Organotypic brain slice cultures: a review // Neuroscience. 2015. V. 305. P. 86–98.
Hurst J., Kuehn S., Jashari A., Tsai T., Bartz-Schmidt K.U., Schnichels S., Joachim S.C. A novel porcine ex vivo retina culture model for oxidative stress induced by H2O2 // Altern. Lab. Anim. 2017. V. 45. V. 11–25.
Jeon S., Oh I.H. Regeneration of the retina: toward stem cell therapy for degenerative retinal diseases // BMB Rep. 2015. V. 48. P. 193–199.
Jorstad N.L., Wilken M.S., Grimes W.N., Wohl S.G., Vanden Bosch L.S., Yoshimatsu T., Wong R. O., Rieke F., Reh T.A. Stimulation of functional neuronal regeneration from Müller glia in adult mice // Nature. 2017. V. 548. P. 103–107.
Kaempf S., Walter P., Salz A.-K., Thumann G. Novel organotypic culture model of adult mammalian neurosensory retina in co-culture with retinal pigment epithelium // J. Neurosci. Meth. 2008. V. 173. P. 47–58.
Keefe J.R. An analysis of urodelian retinal regeneration // J. Exp. Zool. 1973. V. 184. P. 185–257.
Kobuch K., Herrmann W.A., Framme C., Sachs H.G., Gabel V.P., Hillenkamp J. Maintenance of adult porcine retina and retinal pigment epithelium in perfusion culture: characterization of an organotypic in vitro model // Exp. Eye Res. 2008. V. 86. P. 661–668.
Lahne M., Gorsuch R.A., Nelson C.M., Hyde D.R. Culture of adult transgenic zebrafish retinal explants for live-cell imaging by multiphoton microscopy // J. Vis. Exp. 2017. V. 120. P. 55335.
LaVail M.M., Yasumura D., Matthes M.T., Lau-Villacorta C., Unoki K., Sung C.H., Steinberg R.H. Protection of mouse photoreceptors by survival factors in retinal degenerations // Invest. Ophthalmol. Vis Sci. 1998. V. 39. P. 592–602.
Layer P.G., Willbold E. Embryonic chicken retinal cells can regenerate all cell layers in vitro, but ciliary pigmented cells induce their correct polarity // Cell Tissue Res. 1989. V. 258. P. 233–242.
Llonch S., Carido M., Ader M. Organoid technology for retinal repair // Dev. Biol. 2018. V. 433. P. 132–143.
Li Y., Zhang Y., Qi S., Su G. Retinal organotypic culture – a candidate for research on retinas // Tissue Cell. 2018. V. 51. P. 1–17.
Liu L., Cheng S.H., Jiang L.Z., Hansmann G., Layer P.G. 1988. The pigmented epithelium sustains cell growth and tissue differentiation of chicken retinal explants in vitro // Exp. Eye Res. 1988. V. 46. P. 801–812.
MacDonald R.B., Randlett O., Oswald J., Yoshimatsu T., Franze K., Harris W.A. Müller glia provide essential tensile strength to the developing retina // J. Cell Biol. 2015. V. 210. P. 1075–1083.
McMurtrey R.J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids // Tissue Eng. Part C. Methods. 2016. V. 22. P. 221–249.
Mack A.F., Fernald R.D. Thin slices of teleost retina continue to grow in culture // J. Neurosci. Methods. 1991. V. 36. P. 195–202.
Mack A.F., Fernald R.D. Control of vertebrate retinal cell production // Exp. Neurol. 1992. V. 115. P. 65–68.
Martin I., Wendt D., Heberer M. The role of bioreactors in tissue engineering // Trends Biotechnol. 2004. V. 22. P. 80–86.
Matus P., Cubillos S., Lima L. Differential effect of taurine and serotonin on the outgrowth from explants or isolated cells of the retina // Int. J. Dev. Neurosci. 1997. V. 15. P. 785–793.
Mayer E.J., Carter D.A., Ren Y., Hughes E.H., Rice C.M., Halfpenny C.A., Scolding N.J., Dick A.D. Neural progenitor cells from postmortem adult human retina // Br. J. Ophthalmol. 2005. V. 89. P. 102–106.
Mitashov V.I. Mechanisms of retina regeneration in Urodele // Int. J. Dev. Biol. 1996. V. 40. P. 833–844.
Mitashov V.I. Retinal regeneration in amphibians // Int. J. Dev. Biol. 1997. V. 41. P. 893–905.
Mitsuda S., Yoshii C., Ikegami Y., Araki M. Tissue interaction between the retinal pigment epithelium and the choroid triggers retinal regeneration of the newt Cynops pyrrhogaster // Dev. Biol. 2005. V. 280. P. 122–132.
Moritoh S., Komatsu Y., Yamamori T., Koizumi A. Diversity of retinal ganglion cells identified by transient GFP transfection in organotypic tissue culture of adult marmoset monkey retina // PLoS One. 2013. V. 8: e54667.
Moritoh S., Tanaka K.F., Jouhou H., Ikenaka K., Koizumi A. Organotypic tissue culture of adult rodent retina followed by particle-mediated acute gene transfer in vitro // PLoS One. 2010. V. 5: e12917.
Müller B., Wagner F., Lorenz B., Stieger K. Organotypic cultures of adult mouse retina: morphologic changes and gene expression // Invest. Ophthalmol. Vis. Sci. 2017. V. 58. P. 1930–1940.
Murali A., Ramlogan-Steel C. A., Andrzejewski S., Steel J.C., Layton C.J. Retinal explant culture: A platform to investigate human neuro-retina // Clin. Exp. Ophthalmol. 2018. [Epub ahead of print]https://doi.org/10.1111/ceo.13434
Nakano T., Ando S., Takata N., Kawada M., Muguruma K., Sekiguchi K., Saito K., Yonemura S., Eiraku M., Sasai Y. Self-formation of optic cups and storable stratified neural retina from human ESCs // Cell Stem Cell. 2012. V. 10. P. 771–785.
Ogilvie J.M., Speck J.D., Lett J.M., Fleming T.T. A reliable method for organ culture of neonatal mouse retina with long-term survival // J. Neurosci. Methods. 1999. V. 87. P. 57–65.
Osborne A., Hopes M., Wright P., Broadway D.C., Sanderson J. Human organotypic retinal cultures (HORCs) as a chronic experimental model for investigation of retinal ganglion cell degeneration // Exp. Eye Res. 2016. V. 143. P. 28–38.
Osborne A., Sanderson J., Martin K.R. Neuroprotective effects of human mesenchymal stem cells and platelet-derived growth factor on human retinal ganglion cells // Stem Cells (Dayton, Ohio). 2018. V. 36. P. 65–78.
Ovando-Roche P., West E.L., Branch M.J., Sampson R.D., Fernando M., Munro P., Georgiadis A., Rizzi M., Kloc M., Naeem A., Ribeiro J., Smith A. J., Gonzalez-Cordero A., Ali R.R. Use of bioreactors for culturing human retinal organoids improves photoreceptor yields // Stem Cell Res. Ther. 2018. V. 9. P. 156.
Pinzón-Duarte G., Kohler K., Arango-González B., Guenther E. Cell differentiation, synaptogenesis, and influence of the retinal pigment epithelium in a rat neonatal organotypic retina culture // Vision Res. 2000. V. 40. P. 3455–3465.
Rattner A., Smallwood P.M., Williams J., Cooke C., Savchenko A., Lyubarsky A., Pugh E.N., Nathans J. A photoreceptor-specific cadherin is essential for the structural integrity of the outer segment and for photoreceptor survival // Neuron. 2001. V. 32. P. 775–786.
Reichman S., Slembrouck A., Gagliardi G., Chaffiol A., Terray A., Nanteau C., Potey A., Belle M., Rabesandratana O., Duebel J., Orieux G., Nandrot E.F., Sahel J.A., Goureau O. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human iPS cells in xeno-free and feeder-free conditions // Stem Cells. 2017. V. 35. P. 1176–1188.
Reichenbach A., Bringmann A. New functions of Muller cells // Glia. 2013. V. 61. P. 651–678.
Reidel B., Orisme W., Goldmann T., Smith W. C., Wolfrum U. Photoreceptor vitality in organotypic cultures of mature vertebrate retinas validated by light-dependent molecular movements // Vision Res. 2006. V. 46. P. 4464–4471.
Reinbold R. Organotypic differentiation of the eye of the chick embryo in vitro // C. R. Seances Soc. Biol. Fil. 1954. V. 148. P. 1493–1495.
Sassoè-Pognetto M., Feigenspan A., Bormann J., Wässle H. Synaptic organization of an organotypic slice culture of the mammalian retina // Vis. Neurosci. 1996. V. 13. P. 759–771.
Schutgens F., Verhaar M.C., Rookmaaker M.B. Pluripotent stem cell-derived kidney organoids: An in vivo-like in vitro technology // Eur. J. Pharmacol. 2016. V. 790. P. 12–20.
Sengupta A., Chaffiol A., Mace E., Caplette R., Desrosiers M., Lampic M., Forster V., Marre O., Lin J.Y., Sahel J.A., Picaud S., Dalkara D., Duebel J. Red-shifted channel rhodopsin stimulation restores light responses in blind mice, macaque retina, and human retina // EMBO Mol. Med. 2016. V. 8. P. 1248–1264.
Shafaie S., Hutter V., Cook M.T., Brown M.B., Chau D.Y.S. In vitro cell models for ophthalmic drug development applications // Biores. Open Access. 2016. V. 5. P. 94–108.
Smedowski A., Pietrucha-Dutczak M., Maniar R., Ajeleti M., Matuszek I., Lewin-Kowalik J. FluoroGold-labeled organotypic retinal explant culture for neurotoxicity screening studies // Oxid. Med. Cell Longev. 2018. V. 13. P. 2487473.
Thanos S., Thiel H.J. Regenerative and proliferative capacity of adult human retinal cells in vitro // Graefes Arch. Clin. Exp. Ophthalmol. 1990. V. 228. P. 369–376.
Thangaraj G., Greif A., Layer P.G. Simple explant culture of the embryonic chicken retina with long-term preservation of photoreceptors // Exp. Eye Res. 2011. V. 93. P. 556–564.
Victorov I.V., Lyjin A.A., Aleksandrova O.P. A modified roller method for organotypic brain cultures: free-floating slices of postnatal rat hippocampus // Brain Res. Brain Res. Protoc. 2001. V. 7. P. 30–37.
Willbold E., Layer P.G. A hidden retinal regenerative capacity from the chick ciliary margin is reactivated in vitro, that is accompanied by down-regulation of butyrylcholinesterase // Eur. J. Neurosci. 1992. V. 4. P. 210–220.
Wolburg H., Willbold E., Layer P.G. Müller glia endfeet, a basal lamina and the polarity of retinal layers form properly in vitro only in the presence of marginal pigmented epithelium // Cell Tissue Res. 1991. V. 264. P. 437–451.
Yin X., Mead B.E., Safaee H., Langer R., Karp J.M., Levy O. Engineering stem cell organoids // Cell Stem Cell. 2016. V. 18. P. 25–38.
Yanai A., Laver C.R., Gregory-Evans C.Y., Liu R.R., Gregory-Evans K. Enhanced functional integration of human photoreceptor precursors into human and rodent retina in an ex vivo retinal explant model system // Tissue Eng. Part A. 2015. V. 21. P. 1763–1771.
Zhang S.S., Fu X.Y., Barnstable C.J. Tissue culture studies of retinal development // Methods. 2002. V. 28. P. 439–447.
Zhang C., Lam T.T., Tso M.O. Heterogeneous populations of microglia/macrophages in the retina and their activation after retinal ischemia and reperfusion injury // Exp. Eye Res. 2005. V. 81. № 6. P. 700–709.
Дополнительные материалы отсутствуют.


