Онтогенез, 2020, T. 51, № 2, стр. 113-120
Пептиды семакс и HLDF-6, введенные крысам разного возраста, регулируют ритм синтеза белка в гепатоцитах, исправляя нарушения при старении
В. Я. Бродский a, *, Ю. А. Золотарев b, Л. А. Мальченко a, Л. А. Андреева b, Д. С. Лазарев c, Н. Н. Буторина a, В. С. Козик b, Н. Ф. Мясоедов b
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Институт молекулярной генетики РАН
123182 Москва, пл. Академика Курчатова, 2, Россия
c Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава РФ
117513 Москва, ул. Островитянова, 1, Россия
* E-mail: brodsky.idb@bk.ru
Поступила в редакцию 04.06.2019
После доработки 01.10.2019
Принята к публикации 10.10.2019
Аннотация
Для уточнения организующего действия пептидов семакс и HLDF-6 на кинетику синтеза белка в гепатоцитах, в дополнение к исследованию in vitro (Бродский и др., 2019) изучили эффекты этих пептидов in vivo после внутрибрюшинной их инъекции крысам разного возраста. Исследовали околочасовой (ультрадианный) ритм синтеза белка, маркер прямых межклеточных отношений. Молодым, половозрелым или старым крысам внутрибрюшинно вводили пептиды – в дозах 50–100 мкг/кг. Выделяли гепатоциты и ставили редкие или плотные культуры. У молодых крыс, получивших тот или иной пептид, в их редких суточных культурах обнаружили ритм синтеза белка; у крыс того же возраста, которым инъецировали физраствор, ритма в таких культурах не было. В плотных культурах старых крыс после введения пептида амплитуды ритма синтеза белка не отличались от ритма молодых крыс; после инъекции физраствора амплитуды ритма были вдвое ниже. Инъекция пептида взрослым крысам, получившим до этого дофамин, обнаружила нормальный для крыс этого возраста ритм синтеза белка; инъекция только дофамина ликвидировала ритм. Регуляторный эффект пептидов сохранялся по меньшей мере 2 дня после однократного их введения крысе. Рекомендуется использование семакса или HLDF-6 для улучшения состояния старых людей, компенсации нарушений кинетики синтеза белка при старении и патологии.
ВВЕДЕНИЕ
Ранее, вводя в среду с культурами гепатоцитов крысы пептид семакс или другой регуляторный пептид HLDF6, мы обнаружили изменения кинетики синтеза белка, благоприятные для клеток, выделенных от старых животных (Бродский и др., 2019). Определяли околочасовой ритм синтеза белка. Ритм, характеризующий синхронизацию клеток путем прямых межклеточных взаимодействий, находят в плотных культурах крыс любого возраста. Но в культурах старых животных амплитуды ритма значительно ниже, чем у молодых. Добавление пептидов в среду с такими культурами повышало амплитуды ритма почти вдвое, до уровня ритма культур, выделенных от молодых животных. Для того чтобы рекомендовать исследуемые пептиды для улучшения состояния старых людей, следовало определить их эффекты in vivo, при введении их животным. Доходят ли лекарства до печени с кровью и, если поступают в межклеточную среду, действуют ли как в культуре при прямом их действии на клетки? Можно ли также рекомендовать пептиды для компенсации действия веществ, нарушающих кинетику синтеза белка, блокирующих активность соответствующих рецепторов? При положительных ответах следовало выяснить, как долго сохраняется благотворное для кинетики синтеза белка действие пептидов?
МАТЕРИАЛЫ И МЕТОДЫ
Опыты поставлены на старых (2–2.5 года, вес 480–600 г) и молодых, половозрелых (3–4 мес., вес 200–300 г) крысах самцах Вистар. Крысам внутрибрюшинно вводили пептид – семакс или HLDF6 в дозах 60–100 мкг/кг для семакса или 50–60 мкг/кг для HLDF6. Предварительно исследовали эффекты меньших и больших доз. Через 60 мин из печени выделяли гепатоциты, ставили плотные или редкие культуры и через сутки исследовали кинетику синтеза белка. В некоторых опытах крысы получали пептид с кормом. Контроли: физиологический раствор, а для семакса – смесь аминокислот, составляющих этот гептапептид.
Методы выделения гепатоцитов, их культивирования и исследования кинетики синтеза белка многократно рассмотрены ранее, а также в недавней статье в журнале “Онтогенез” (Бродский и др., 2019). Коротко, делали следующее. Гепатоциты выделяли из печени при помощи перфузии. Для культивирования гепатоцитов использовали среду 199 без сыворотки (“ПанЭко”, Россия): к среде добавляли 0.2 мг/мл альбумина для клеточных культур (“Sigma”, США) и 0.5 мкг/мл инсулина (“Sigma”, США); газовая смесь – 10% СО2 и 90% воздуха. Для получения плотных культур, суспензию, содержавшую ~1 × 106/мл гепатоцитов, наливали в чашки Петри со стеклами, покрытыми коллагеном. Редкие культуры получали из той же суспензии гепатоцитов при разведении ее примерно в 10 раз. Через 2 ч cтекла культуры (каждая на отдельном стекле) отмывали от не прикрепившихся клеток и их обломков. Через 24 ч среду меняли на нормальную, свежую среду и через 20 мин в течение 2 ч каждые 10 мин последовательно отбирали пробы по три культуры (три стекла) каждая и инкубировали их с 3H-лейцином.
Культуры каждой пробы инкубировали одновременно в течение 10 мин при 37°C в среде 199 без лейцина (“ПанЭко”, Россия) с внесенным в нее меченым 3Н-лейцином (ИМГ РАН, 25–30 мкКи/мл, специфическая молярная активность 70–100 Ки/ммоль). Затем культуры промывали холодным физиологическим раствором с избытком немеченого лейцина и обрабатывали 5%-ной хлорной кислотой в течение 60 мин, после чего промывали спиртом, белки растворяли гиамином (бензетониум хлорид; “Sigma”, США). Включение 3Н-лейцина в белки и радиоактивность свободного лейцина (кислоторастворимая фракция) измеряли на сцинтилляционном счетчике Tri-Carb 2810TR (“Perkin Elmer”, США). Для каждой культуры рассчитывали относительное к кислоторастворимой фракции включение лейцина в белки Icorr. Такие относительные величины нормализуют культуры по числу клеток, а также по небольшой вариабельности температуры в течение опыта.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поскольку любой популяционный околочасовой ритм организуется в клеточной культуре только путем прямых межклеточных взаимодействий (обзоры: Бродский, 2014, 2018), каждое обнаружение ритма – однозначный показатель таких взаимодействий. Отсутствие ритма также определенно говорит о том, что клетки не взаимодействуют. Опыты, примеры которых даются на рис. 1–7, повторяли, но значимы и единичные результаты. Амплитуды ритма характеризуют выраженность прямых межклеточных взаимодействий, кооперации клеток в организации ритма.
Рис. 1.
Суточные редкие культуры гепатоцитов молодых крыс, внутрибрюшинные инъекции. а – крысе весом 280 г ввели физраствор, через 1 ч выделили гепатоциты и поставили культуры, через сутки исследовали кинетику синтеза белка; б – крысе весом 310 г ввели семакс – 100 мкг/кг, далее как а; в – крысе весом 320 г ввели HLDF-6 – 60 мкг/кг, далее как а. Здесь и далее: каждая точка – среднее для пробы из трех культур в данное время ± ошибка этой средней; сплошная прямая линия средний уровень синтеза белка (средняя арифметическая) (cpm) для всех культур варианта опыта, в данном случае 36 культур, каждая на отдельном стекле; пунктирные прямые линии выше и ниже средней ± ошибка этой общей средней.
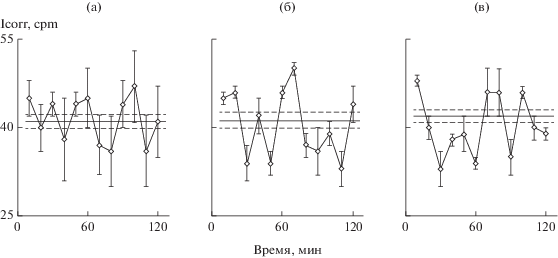
Рис. 2.
Суточные плотные культуры гепатоцитов старых крыс, внутрибрюшинные инъекции. а – крысе весом 520 г ввели физраствор, через 1 ч выделили гепатоциты и поставили культуры, через сутки исследовали кинетику синтеза белка; б – крысе весом 550 г ввели семакс – 100 мкг/кг, далее как а; в – крысе весом 480 г ввели HLDF-6 – 60 мкг/кг, далее как а.
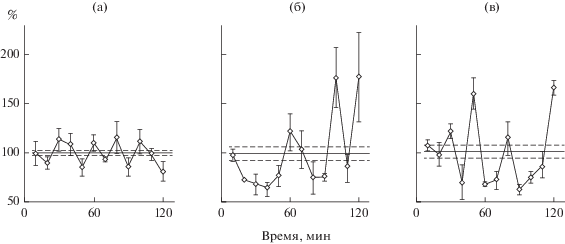
Рис. 3.
Суточные плотные культуры гепатоцитов старых крыс, пероральное введение. а – крысу весом 590 г после суток голодания накормили комбикормом, смоченным физраствором, далее как рис. 1 и рис. 2а; б – крысу весом 550 г накормили комбикормом, смоченным семаксом из расчета 100 мкг/кг, далее как рис. 1 и 2.
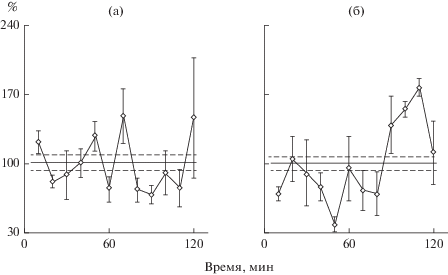
Рис. 4.
Суточные редкие культуры молодых крыс, пероральное введение. а – крысу весом 350 г после суток голодания накормили комбикормом, смоченным раствором смеси аминокислот (из состава семакса) из расчета 100 мкг/кг, далее как рис. 1–3; б – крысу весом 330 г таким же способом накормили комбикормом, смоченным семаксом из расчета 100 мкг/кг.
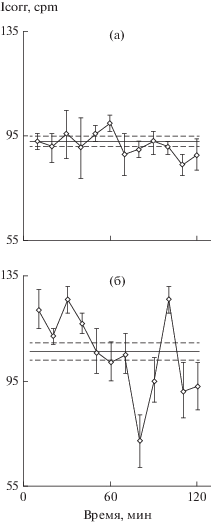
Рис. 5.
Суточные плотные культуры молодых крыс, внутрибрюшинные инъекции. а – крысе весом 280 г ввели физраствор, через 120 мин выделили гепатоциты и поставили плотные культуры, дальнейшие процедуры см. предыдущие рисунки; б – крысе весом 300 г ввели 15 мкг/кг дофамина, через 120 мин выделили гепатоциты и оставили плотные культуры, далее как а; в – крысе весом 310 г ввели 15 мкг/кг дофамина и через 60 мин семакс 100 мкг/кг еще на 60 мин, после чего выделили гепатоциты и поставили плотные культуры, далее как раньше.
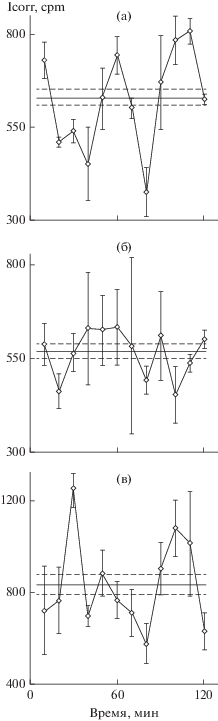
Рис. 6.
Плотные культуры старых крыс, внутрибрюшинная инъекция пептида. Сохранение эффекта пептидов. а – крысе весом 500 г ввели физраствор, через 60 мин выделили гепатоциты и поставили плотные культуры, далее как раньше; б – крысе весом 480 г ввели 60 мкг/кг HLDF-6, через 60 мин выделили гепатоциты и поставили плотные культуры, через сутки исследовали синтез белка; в – крысе весом 350 г ввели HLDF-6, через сутки выделили гепатоциты и поставили плотные культуры, еще через сутки исследовали синтез белка.
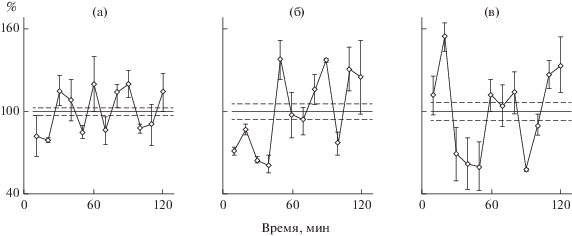
Рис. 7.
Опыт, аналогичный рис. 6, но исследовали редкие культуры молодых крыс. а – крысе весом 300 г внутрибрюшинно ввели физраствор, поставили редкие культуры и через сутки исследовали синтез белка; б – крысе весом 260 г ввели 100 мкг/кг семакса, далее как а; в – крысе весом 290 г ввели семакс, через сутки поставили культуры.
Некоторые другие предварительные замечания. Возраст крысы, как известно, характеризует ее вес (Гамбарян, Дукельская, 1955). Крысы растут всю свою жизнь – до 2–3 лет. Масса тела молодых половозрелых крыс – 180–300 г, вес старых 2-летних крыс около 500 г и более. Второе: гепатоциты молодой половозрелой крысы чрезвычайно слабо пролиферирующая клеточная популяция; в пробах изученных нами культур не было делящихся клеток. Третье: культуры исследовали в бессывороточной среде, предложенной В.В. Терских и тестированной на синтез белка (Бродский и др., 1996).
На рис. 1 приведен пример исследования редких культур у молодых крыс. В таких суточных культурах, как многократно показано нами ранее, сразу после отмывания и переноса в свежую среду, ритм синтеза белка не обнаруживается. Введение крысе физиологического раствора NaCl, выделение через час гепатоцитов и постановка редких культур подтвердила этот вывод. Второй крысе примерно такого же возраста и веса ввели внутрибрюшинно семакс. После такой же, как у первой крысы, обработки в редких культурах нашли четкий околочасовой ритм синтеза белка с высокодостоверными максимумами и минимумами. У третьей крысы, которой ввели пептид HLDF-6, также выявлен ритм с тремя периодами в течение 2 ч.
Следующий опыт поставлен на плотных культурах гепатоцитов старых крыс. Как показано ранее (обзор Бродский, 2014), в клетках старых крыс амплитуда ритма синтеза белка значительно ниже, чем у молодых животных, что говорит о нарушениях кооперации клеток в организации кинетики синтеза белка. На рис. 2 этот вывод подтвержден у контрольной старой крысы. После введения второй старой крысе семакса или третьей крысе пептида HLDF-6 наблюдали ритм с высокими амплитудами.
Попутно выяснилось, что эффект семакса проявляется не только после его инъекции, но также после кормления крыс семаксом (рис. 3). В культурах гепатоцитов старых крыс, которым с кормом дали семакс или физиологический раствор (комбикорм смочили растворами соответствующей концентрации) значительно отличались амплитуды ритмов. В редких культурах молодых крыс, накормленных семаксом, нашли ритм синтеза белка (рис. 4); в контроле в редких культурах молодой крысы ритма нет (рис. 1 и многократно ранее). Считалось, что в кишечнике пептид распадается до аминокислот. Мы предположили, что колебания синтеза белка синхронизируются при пероральном введении пептида одной из его аминокислот. Такая смесь аминокислот, составляющая семакс, была собрана: метионин, глутаминовая кислота, гистидин, фенилаланин, пролин, глицин, пролин. После кормления молодой крысы раствором смеси аминокислот в разных концентрациях ритм синтеза белка не нашли (рис. 4). Эти опыты позволяют рекомендовать использование семакса, как лекарства, в таблетках после испытаний таблеток для нейропротекторного действия семакса, обоснованного во многих работах.
Околочасовой ритм синтеза белка определили у бактерий, изученных одноклеточных эукариот, а у млекопитающих – в гепатоцитах и кератиноцитах, клетках околоушной и поджелудочной желез, в разных нейронах (обзор, Бродский, 2014). Как и другие фракталы, околочасовые ритмы и, в частности, ритм синтеза белка крайне нерегулярны. Такие ритмы могут быть основой функциональных и метаболических адаптаций, выбора оптимальных частот, что на разных примерах обосновано экспериментально и наблюдали в клинике (обзор, Бродский, 2018). Гепатоциты лишь модель для таких исследований, а ритм в нашем случае использован как маркер межклеточных взаимодействий (см. также стр. 3). Чем сильнее клетки взаимодействуют друг с другом, синхронизируя индивидуальные колебания, тем больше амплитуды популяционного ритма синтеза белка. Ранее в культурах гепатоцитов, полученных от крыс разного возраста, мы обнаружили значительное уменьшение амплитуд ритма в культурах старых крыс сравнительно с молодыми; пептиды, введенные в среду с такими культурами, увеличили амплитуды ритма (Бродский и др., 2019). В настоящей работе пептиды – семакс или HLDF-6 – вводили крысам. Эффект подтвердился in vivo: пептиды компенсируют старческие изменения межклеточных взаимодействий. Известно, что нарушения связей между клетками – одна из причин нейродегенеративных заболеваний (лит. Угрюмов, 2014), в основном, присущим старым людям. Усиление межклеточных взаимодействий пептидами – ранее неизвестное их свойство. Поэтому наряду с уже обоснованными нейропротекторными их эффектами, пептиды семакса и HLDF-6 могут быть рекомендованы для широкой профилактики в старости.
Исследование эффектов пептидов in vivo при инъекции их крысам обосновали вывод работы на клеточной культуре о возможности компенсации отрицательного влияния некоторых лекарств на межклеточные взаимодействия. Так, дофамин, широко используемый при сосудисто-сердечной недостаточности, ликвидирует ритм синтеза белка в печени и, судя по рецепторам, также в поджелудочной железе и почках (Brodsky et al., 2012). Инъекция семакса или HLDF-6 после дофамина восстанавливает ритм синтеза белка (например, рис. 5). Опыт поставлен на плотных культурах молодых крыс. В контроле (инъекция физраствора), как всегда, четкий ритм синтеза белка. Инъекция крысе близкого веса и возраста дофамина ликвидировало ритм. Третьей крысе через час после инъекции дофамина ввели семакс. Ритм восстановился. Можно рекомендовать после необходимого введения дофамина человеку, через несколько часов инъецировать один из пептидов.
Как долго сохраняется эффект семакса или HLDF-6? Исследовали плотные культуры старых крыс. Результаты аналогичны для двух пептидов. На рис. 6 пример для HLDF-6. Одной крысе ввели физраствор, через 60 мин выделили плотные культуры и через сутки исследовали синтез белка. Второй крысе ввели HLDF-6 и в те же сроки исследовали синтез белка. У третьей крысы гепатоциты выделили через сутки после инъекции HLDF-6. У такой крысы, как и у второй, был четкий ритм синтеза белка в течение двух дней после инъекции HLDF-6. В опыте с семаксом (рис. 7) исследовали редкие культуры молодых крыс. Постановка опытов была такой же как со старыми. В контроле в редких культурах ритма синтеза белка не было. Семакс организовал ритм. Эффект сохранялся по меньшей мере 2 дня.
Итак, пептиды семакс и HLDF-6 после введения их крысе регулируют кинетику синтеза белка в клетках печени. Семакс – фармацевтический препарат, обладающий ноотропной и нейропротекторной активностью (Мясоедов, Гривенников, 2004; Левицкая и др., 2008, 2010; Dmitrieva et al., 2010). Семакс влияет на процессы, связанные с формированием памяти, усиливает избирательное внимание при обучении и анализе информации, улучшает адаптацию организма к гипоксии, церебральной ишемии, наркозу и другим повреждающим воздействиям. Его особенно рекомендуют после инсультов и других нарушениях функций и метаболизма мозга. Для нейропротекторного пептида HLDF-6, в рамках создания фармацевтического препарата для лечения болезни Альцгеймера и ишемического инсульта, были выполнены в полном объеме доклинические исследования (Золотарев и др., 2014; Bodachouk et al., 2016; Zolotarev et al., 2016). Была установлена высокая нейропротекторная активность пептида HLDF-6, его применение приводит к практически полному восстановлению памяти при этих нейродегенеративных патологиях. Пептид HLDF-6 предохраняет нейроны гиппокампа (орган, повреждающийся при болезни Альцгеймера) от токсического действия бета-амилоида. При этом HLDF-6 абсолютно нетоксичен, и даже тысячекратное превышение терапевтической дозы не приводит к патологическим изменениям. Для сравнения можно сказать, что все препараты, используемые в терапии нейродегенеративных заболеваний, обладают высокой токсичностью уже при превышении лечебной дозы в несколько раз.
Нами показано влияние этих двух пептидов на синтез белка в клетках печени, ранее при прямом действии на гепатоциты после введения пептида в культуральную среду, теперь после инъекции крысе. Особенно значимо наблюдение влияния семакса и HLDF-6 на кинетику синтеза белка гепатоцитов старых крыс. Как уже отмечалось, гепатоциты в этом случае, модель для изучения межклеточных взаимодействий. Ранее сходные отношения определены в разных клетках, включая нервные (обзор, Бродский, 2018). Опыты in vivo позволяют рекомендовать каждый пептид как профилактическое и компенсаторное средство для улучшения состояния старых людей.
Список литературы
Бродский В.Я. Околочасовые метаболические ритмы // Биохимия. 2014. Т. 79. № 6. С. 621–634.
Бродский В.Я. Биохимия прямых межклеточных взаимодействий. Сигнальные факторы организации клеточных популяций // Биохимия. 2018. Т. 83. № 8. С. 1130–1147.
Бродский В.Я., Золотарев Ю.А., Мальченко Л.А., Андреева Л.А., Лазарев Д.С., Буторина Н.Н., Козик В.С., Мясоедов Н.Ф. Нейропротекторные пептиды регулируют кинетику синтеза белка в гепатоцитах крыс разного возраста // Онтогенез. 2019. Т. 50. № 5.
Бродский В.Я., Нечаева Н.В., Терских В.В., Новикова Т.Е., Гвазава И.Г., Фатеева В.И. Бeccывороточная среда, сохраняющая нормальную морфологию и высокий уровень синтеза белка в гепатоцитах in vitro // Известия РАН. Сер. биол. 1996. № 4. С. 398–401.
Васильева Е.В., Золотарев Ю.А., Ковалев Г.И. Влияние ноотропных препаратов на метаботропные глутаматные рецепторы мозга мышей BALB/c и C57BL/6 // Нейрохимия. 2013. Т. 30. № 2. С. 135–148.
Гамбарян П.П., Дукельская Н.М. Крыса. М.: Советская наука, 1955.
Золотарев Ю.А., Ковалёв Г.И., Дадаян А.К., Козик В.С., Кондрахин Е.А., Васильева Е.В., Липкин В.М. Исследование фармакокинетики и фармакодинамики амидной формы нейропротекторного пептида HLDF-6 с использованием равномерно меченных изотопами водорода соединений // Нейродегенеративные заболевания: от генома до целостного организма / Под ред. Угрюмова М.В. М.: Научный мир, 2014. С. 763–777.
Левицкая Н.Г., Глазова Н.Ю., Себенцова Е.А., Манченко Д.М., Виленский Д.А., Андреева Л.А., Каменский А.А., Мясоедов Н.Ф. Исследование спектра физиологической активности аналога АКТГ4-10 гептапептида семакс // Нейрохимия. 2008. Т. 25. № 1. С. 111–118.
Левицкая Н.Г., Виленский Д.А., Себенцова Е.А., Андреева Л.А., Каменский А.А., Мясоедов Н.Ф. Влияние семакса на эмоциональное состояние белых крыс в норме и на фоне действия холецистокинина-тетрапептида // Известия РАН. Сер. биол. 2010. № 2. С. 231–237.
Мясоедов Н.Ф., Гривенников И.А. Нейропептиды и их аналоги в регуляции функций нервной системы млекопитающих, включая человека. От синтеза и изучения механизмов их действия до создания лекарственных средств нового поколения // Проблемы и перспективы молекулярной генетики. М.: Наука, 2004. Т. 2. С. 195–236
Нейродегенеративные заболевания: от генома до целостного организма / Под ред. Угрюмова М.В. М.: Научный мир. 2014.
Bogachouk A.P., Storozheva Z.I., Solovjeva O.A., Sherstnev V.V., Zolotarev Y.A., Azev V.N., Rodionov I.L., Surina E.A., Lipkin V.M. Comparative study of the neuroprotective and nootropic activities of the carboxylate and amide forms of the HLDF-6 peptide in animal models of Alzheimer’s disease // Psychopharmacol. 2016. V. 30. № 1. P. 78–92.
Brodsky V.Y., Konchenko D.S., Zvezdina N.D., Malchenko L.A., Dubovaja T.K. Unlike norepinephrine and serotonin, dopamine disorganizes direct cell-cell communication in hepatocyte cultures // J. Cell and Tissue Res. 2012. V. 12. P. 3265–3271.
Dmitrieva V.G., Povarova O.V., Skvortsova V.I., Limborska S.A., Myasoedov N.F., Dergunova L.V. Semax and Pro-Gly-Pro activate the transcription of neurotrophins and their receptor genes after cerebral Ischemia // Cell Mol. Neurobiol. 2010. V. 30. № 1. P. 71–79.
Zolotarev Y.A., Kovalev G.I., Kost N.V., Voevodina M.E., Sokolov O.Y., Dadayan A.K., Kondrakhin E.A., Vasileva E.V., Bogachuk A.P., Azev V.N., Lipkin V.M., Myasoedov N.F. Anxiolytic activity of the neuroprotective peptide HLDF-6 and its effects on brain neurotransmitter systems in BALB/c and C57BL/6 mice // J. Psychopharmacol. 2016. V. 30. № 9. P. 922–935.
Дополнительные материалы отсутствуют.


