Онтогенез, 2020, T. 51, № 2, стр. 121-131
Жизненный цикл Nitzschia palea (Kützing) W. Smith (Bacillariophyta)
В. Б. Багмет a, Ш. Р. Абдуллин a, *, С. Е. Мазина b, c, А. Ю. Никулин a, В. Ю. Никулин a, А. А. Гончаров a
a Федеральное государственное бюджетное учреждение науки Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, пр. 100-летия Владивостока, 159, Россия
b Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
c Российский университет дружбы народов, экологический факультет
117198 Москва, ул. Миклухо-Маклая, 6, Россия
* E-mail: crplant@mail.ru
Поступила в редакцию 30.10.2019
После доработки 26.11.2019
Принята к публикации 30.11.2019
Аннотация
Диатомея Nitzschia palea – широко распространенная эврибионтная водоросль, обитающая в бентосе пресноводных водоемов и водотоков, почвах и пещерах. Этот вид имеет биотехнологический потенциал, поэтому данные о его биологии представляют практический интерес. Хотя он изучается давно, полной информации о жизненном цикле N. palea, включая данные по кардинальным точкам, по-прежнему недостаточно. В этой статье, основанной на наших собственных исследованиях и данных литературы, мы дополняем и обобщаем имеющуюся информацию о жизненном цикле вида, включая данные о морфологии, морфометрии, тератологических структурах створок и кардинальных точках. Также впервые для N. palea показано, что потомки наследуют участок митохондриального гена cox1 только от родителя одного пола. Полученные данные будут важны при исследовании филогеографии вида, а также обеспечат фундаментальную основу технологии длительного поддержания N. palea в культуре.
ВВЕДЕНИЕ
Представители Bacillariophyta все чаще становятся объектами промышленного культивирования с целью получения полезных веществ, поскольку они способны синтезировать жиры, жирные кислоты, полисахариды, пигменты, наноразмерные кремнистые структуры и т.д. (Davidovich et al., 2015; Hess et al., 2018; Jin et al., 2018; Zhang et al., 2018). Однако длительное поддержание большинства клонов диатомовых водорослей в жизнеспособном состоянии проблематично из-за особенностей их жизненного цикла, в результате которого происходит уменьшение размера клеток во время вегетативного размножения (правило Макдональда-Пфитцера; Рощин, 1994; Edlund, Stoermer, 1997). При отсутствии полового воспроизведения восстановление размера клеток не происходит, и клон погибает. Но клон также “умрет” (потеряет генетическую идентичность) из-за рекомбинации при половом воспроизведении. Следовательно, гетероталличные виды, как правило, невозможно поддерживать в качестве клонов в течение длительного времени, поскольку при отсутствии совместимых типов спаривания половое воспроизведение не происходит. Таким образом, через несколько месяцев или лет (в зависимости от скорости роста культуры и уменьшения размера особей) клетки достигнут минимального жизнеспособного размера и, затем, погибнут. Технологии поддержания культур необходимо разрабатывать для каждого вида, основываясь на знании ключевых особенностей его жизненного цикла (Chepurnov et al., 2004). Следовательно, исследования жизненных циклов диатомей, включая половое воспроизведение, при котором восстанавливаются размеры клеток, актуальны и важны.
Жизненные циклы диатомовых ранее были описаны многими авторами (Drebes, 1977; Mann, 1993; Рощин, 1994; Davidovich, 2002; Chepurnov et al., 2004; Amato et al., 2005; Trobajo et al., 2005; Fuchs et al., 2013). Различают несколько фаз жизненного цикла диатомей: дорепродуктивную – воспроизведение клеток только вегетативным способом с уменьшением их размера; репродуктивную (половое воспроизведение, рост зиготы (ауксоспоры), преобразование ауксоспоры в инициальную клетку); пострепродуктивную – вегетативный рост после прекращения полового воспроизведения (Drebes, 1977; Рощин, 1994). Л. Гайтлер (Geitler, 1932) выделил кардинальные точки вида – максимальные и минимальные размеры клеток, соответствующие верхней и нижней границам диапазона ауксоспорообразования (полового воспроизведения), имея в виду их устойчивое постоянство при незначительных колебаниях. Этим кардинальным точкам, вероятно, соответствуют пороговые уровни метаболической активности ядра, обусловливающие предел размеров клеток вида в процессе ауксоспосрообразования, границы диапазона половозрелости и предел уменьшения клеток (Geitler, 1932; Рощин, 1994). Фактически кардинальные точки можно соотнести с критическими периодами онтогенеза, которые характеризуются наибольшей скоростью развития организма, и в результате детерминации он вступает в новый период жизненного цикла (Голиченков, 1991). Поэтому информация о кардинальных точках может быть важна для разработки методов поддержания диатомовых водорослей в культуре.
Способ наследования генетической информации – одна из важных характеристик жизненного цикла. Наследование митохондриальной ДНК и митохондрий у большинства многоклеточных организмов, в том числе и человека, происходит по материнской линии (Barr et al., 2005). У диатомовых водорослей подобный способ унипарентального (однородительского) наследования митохондрий по линии одного из полов был установлен лишь недавно для единственного вида – Haslea ostrearia (Gaillon) Simonsen. Знание способа наследования ДНК органелл открывает возможности для исследований в области филогеографии и реконструкции расселения раздельнополых диатомовых (Gastineau et al., 2013).
Диатомея Nitzschia palea – широко распространенная эврибионтная водоросль, которая обычно обитает в бентосе пресноводных водоемов и водотоков, почвах и пещерах (Trobajo et al., 2009, 2010; Abdullin, 2009; Abdullin, Bagmet, 2015, 2016). Спектр липидов у представителей этого вида позволяет рассматривать Nitzschia palea как многообещающий источник сырья для производства биодизеля (Abdel-Hamid et al., 2013; Hassan et al., 2013). Этот организм также характеризуется антибактериальной (Binea et al., 2009) и фунгицидной активностью (Abdullin et al., 2014), способен к гетеротрофному питанию (Abdullin, Bagmet, 2015). Несмотря на то, что Nitzschia palea изучена достаточно полно, исчерпывающая информация о ее жизненном цикле, включая сведения о кардинальных точках, по-прежнему отсутствует. В этой статье, основанной на наших собственных исследованиях и данных литературы, мы дополняем и обобщаем имеющуюся информацию о жизненном цикле вида, включая данные о морфологии, морфометрии, тератологических структурах створок, кардинальных точках и способе наследования митохондрий.
МАТЕРИАЛЫ И МЕТОДЫ
Были исследованы тринадцать клонов Nitzschia palea. Из них девять были выделены из различных местообитаний в западной части Российской Федерации (рис. 1), четыре наиболее репрезентативных модельных клона – их потомки, полученные в лаборатории с использованием полового воспроизведения (табл. 1). Все клоны были получены методом микропипетирования (Andersen, 2005) и культивировались в среде DM (Mann, Chepurnov, 2004) в люминостате с интенсивностью света 2500–3000 лк (17.9–21.4 мкмоль фотонов м–2 с–1) с периодом 16 : 8 ч (свет : темнота) и температуре от 20 до 22°C.
Рис. 1.
Происхождение 9 природных клонов Nitzschia palea (Google Maps, 2019). 1 – Pk10; 2 – Pk9; 3 – Sv30; 4 – Sv26; 5 – Che70; 6 – ChH23; 7 – Br; 8 – Sht18; 9 – Ch3ch.
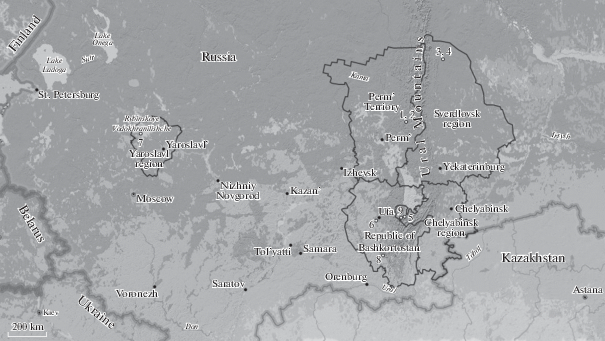
Таблица 1.
Происхождение и регистрационный номер в базе данных GenBank изученных клонов Nitzschia palea
| № | Клон | Местообитание и расположение | Дата выделения | Регистрационный номер в базе данных GenBank |
|---|---|---|---|---|
| 1. | Pk10 | Донные отложения из ручья Наклонный, пещера Геологов-2, Пермский край | 27.09.2013 | MK887232 |
| 2. | Pk9 | Донные отложения из ручья Марсианский, пещера Геологов-2, Пермский край | 04.10.2013 | MK887233 |
| 3. | Sv30 | Донные отложения из ручья, пещера Северная, Свердловская область | 17.07.2013 | MK887234 |
| 4. | Sv26 | Соскоб со стены, пещера Северная, Свердловская область | 15.07.2013 | MK887235 |
| 5. | Che70 | Отложения возле озера, пещера Аленушка, Челябинская область | 05.07.2011 | MK887236 |
| 6. | ChH23 | Грунт, пещера Под висячим камнем, Республика Башкортостан | 06.10.2012 | MK887237 |
| 7. | Br | Донные отложения, Рыбинское водохранилище, Ярославская область | 15.09.2014 | MK887238 |
| 8. | Sht18 | Донные отложения, ручей Харала, Республика Башкортостан | 11.08.2014 | MK887239 |
| 9. | Ch3ch | Грунт, Игнатьевская пещера, Челябинская область | 15.09.2011 | KJ729150 |
| 10. | ShtS | Потомок клонов Sht18 и Sv26 | 27.09.2014 | MK887240 |
| 11. | PkB | Потомок клонов Pk10 и Br | 20.09.2014 | MK887241 |
| 12. | SvSh | Потомок клонов Sv30 и Sht18 | 27.09.2014 | MK887242 |
| 13. | CheP | Потомок клонов Che70 и Pk10 | 10.10.2014 | MK887243 |
Клетки изучали с использованием световой (Микмед-1, ЛОМО, Россия; Levenhuk 320, USA) и сканирующей электронной микроскопии (CamScan S2, Oxford, United Kingdom). Для морфологических исследований створки очищали путем кипячения в перекиси водорода, несколько раз промывали дистиллированной водой и помещали в среду Эльяшева (Эльяшев, 1957) с показателем преломления 1.67–1.68. Для сканирующей электронной микроскопии (СЭМ) на очищенный и высушенный материал напыляли 20 нм сплава золота с палладием (Au 95%, Pd 5%). Полученные морфометрические данные обрабатывали с использованием программного пакета Statistica 8.0 и Microsoft Office Excel 2007.
Пары клонов в фазе экспоненциального роста инокулировали в чашки Петри и инкубировали при 18°С при естественном освещении в среде DM. Чтобы стимулировать половое воспроизведение, в минеральную среду добавляли морскую соль в концентрации 2 мг/л (Drebes, 1977; Bagmet et al., 2017). После того, как клетки образовали парные гаметангии, культуры переносили в дистиллированную воду. Обозначения типа спаривания были сделаны a posteriori на основе результатов экспериментальных скрещиваний и согласно рекомендациям В.А. Чепурнова с соавт. (Chepurnov et al., 2005).
Для анализа ДНК культуры N. palea отбирали во время экспоненциальной фазы роста и концентрировали центрифугированием. Общая геномная ДНК была выделена согласно Ц.С. Эхту с соавт. (Echt et al., 1992) с некоторыми модификациями К.В. Киселева с соавт. (Kiselev et al., 2015). ПЦР-амплификацию кодируемой пластидой области rbcL проводили согласно А. Амато с соавт. (Amato et al., 2007) с использованием праймеров rbcLI1F, rbcLI1R, участка гена cox1 – с использованием праймеров GazF2 и KEdtmR (Evans et al., 2007) в амплификаторе T100 Thermal Cycler (Bio-Rad Laboratories, Inc., USA) с набором ПЦР Encyclo Plus (Евроген, Москва, Россия). Продукты ПЦР очищали реагентом для очистки продуктов ПЦР ExoSAP-IT (Affymetrix Inc., USA) и секвенировали в обоих направлениях в Центре коллективного пользования “Биотехнология и генетическая инженерия” ФНЦ Биоразнообразия ДВО РАН с использованием генетического анализатора ABI 3500 (Applied Biosystems, USA) с набором для секвенирования BigDye Terminator v. 3.1 (Applied Biosystems, Maryland, USA) и теми же праймерами, которые использовались для ПЦР. Последовательности были собраны с помощью пакета Staden v. 1.4 (Bonfield et al., 1995) и выровнены вручную в программе SeaView (Galtier et al., 1996). Все вновь полученные последовательности были помещены в GenBank под регистрационными номерами MK887232–MK887243 (табл. 1) и сравнены с другими клонами Nitzschia palea, доступными с помощью поиска BLAST (https://blast.ncbi. nlm.nih.gov/Blast.cgi).
РЕЗУЛЬТАТЫ
Секвенирование участка митохондриального гена cox1 у 12 из 13 проанализированных клонов выявило наличие двух генотипов, отличающихся друг от друга, по меньшей мере, 73 заменами. Первый генотип с фрагментом участка гена cox1 длиной 695 пар нуклеотидов был обнаружен у семи природных клонов (Pk10, Pk9, Sv30, Sv26, Che70, ChH23, Br) и двух их потомков (PkB и CheP) (табл. 1). Результаты поиска BLAST показали сродство этого генотипа к клонам Nitzschia palea SriLanka2 (FN557063) и India (FN557056) с идентичностью последовательностей 92.03 и 92.61% соответственно. Второй генотип с фрагментом участка гена cox1 длиной 679 пар нуклеотидов характеризовал природный клон Sht18 и два его потомка ShtS и SvSh (табл. 1) и был сходен с клоном Japan C (FN557054; Trobajo et al., 2009) и клоном N. palea TCC570 (KC736651; Kermarrec et al., 2013) с идентичностью последовательностей 94.99 и 94.83% соответственно. Согласно результатам генотипирования cox1, родители лабораторных клонов (табл. 1) представляли разные генотипы, но у их потомков был выявлен только один генотип, что подтверждает наблюдение Р. Гастино с соавт. (Gastineau et al., 2013) об унипарентальной передаче митохондриальной ДНК, отмеченное у Haslea ostrearia. Для клона Ch3ch был секвенирован участок пластидного гена rbcL. Фрагмент длиной 365 пар нуклеотидов показал близкое сродство к изоляту N. palea TCC 480 (KJ542465; Rimet et al., 2014) и клону New Scot2 (HF675128; Rovira et al., 2015) с идентичностью последовательностей 99.73 и 99.18% соответственно. Идентичность последовательностей cox1 и rbcL наших образцов с представителями других видов Nitzschia была значительно ниже (≤84 и ≤98% соответственно).
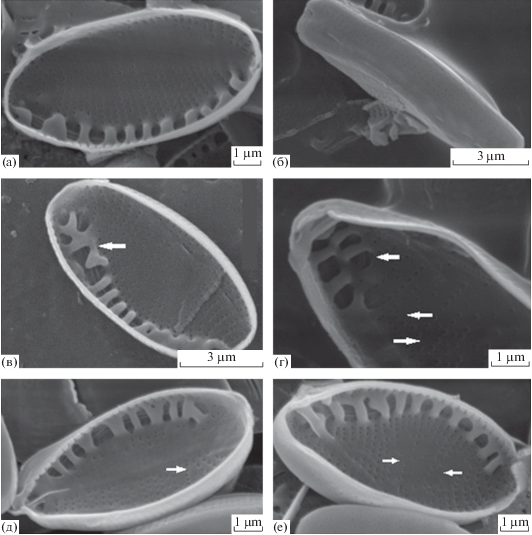
Общая морфология клеток и ультраструктура створок клонов, исследованных как в световой, так и в сканирующей электронной микроскопии, соответствуют описаниям, приведенным для Nitzschia palea различными авторами (Krammer, Lange-Bertalot, 1988; Trobajo et al., 2009; Hofmann et al., 2011). Размеры створок, плотности фибул и штрихов наших клонов приведены в табл. 2. Среди измеренных створок средняя плотность фибул варьировала от 10.53 до 12.76 в 10 мкм, а средняя плотность штрихов – от 31.57 до 33.84 в 10 мкм. Средняя ширина створок изменялась от 3.03 до 4.46 мкм. Значительнее всего варьировала средняя длина створок (от 10.48 до 50.74 мкм), что было связано с уменьшением размера в течение жизненного цикла. У всех изученных клонов из всех показателей статистически значимо различалась (р ≤ 0.05) только длина. При этом все клоны показали прогрессивное уменьшение длины клеток с течением времени. У всех клонов створки были линейно-ланцетными (табл. 2, рис. 2, 1–5 ) или ланцетными (табл. 2, рис. 2, 6–12 ) с клювовидными (табл. 2, рис. 2, 1–5 ) или оттянуто-клювовидными (табл. 2, рис. 2, 6–12 ) концами. Только створки клона Ch3ch были широко эллиптическими (табл. 2, рис. 2, 13 ), с широко закругленными концами (табл. 2, рис. 2, 13 ). Длина створок этого клона также была наименьшей среди всех исследованных (табл. 2, рис. 2). Кроме того, у Ch3ch появлялись тератологические структуры створок при уменьшении длины клеток до 9–10 мкм (рис. 3), хотя при более крупных размерах они не отмечались. Наблюдалось образование второго ряда фибул (рис. 3в, 3г), дугообразное расположение штрихов (рис. 3д), а также полная редукция некоторых ареол (рис. 3е).
Таблица 2.
Морфометрические и биологические характеристики 13 клонов Nitzschia palea
| Клон | Длина, мкм | Ширина, мкм | Фибулы/ 10 мкм | Штрихи/ 10 мкм | Форма створки | Форма концов | Способность к половому воспроиз-ведению |
|---|---|---|---|---|---|---|---|
| min–max (X ± s) | |||||||
| Pk10 | 16.94–24.05
(21.07 ± 0.18) (n = 73) |
2.67–3.64
(3.03 ± 0.03) (n = 73) |
9.86–12.39
(10.98 ± 0.10) (n = 43) |
29.95–35.60
(33.53 ± 0.19) (n = 47) |
Ланцетная | Оттянуто-клювовидные | + |
| Pk9 | 26.85–32.26
(29.89 ± 0.17) (n = 55) |
2.78–3.66
(3.29 ± 0.03) (n = 55) |
9.65–13.77
(11.03 ± 0.12) (n = 46) |
31.49–35.13
(33.53 ± 0.13) (n = 46) |
Линейно-ланцетная | Клювовидные | ± |
| Sv30 | 17.08–25.76
(20.97 ± 0.22) (n = 79) |
2.94–3.64
(3.30 ± 0.02) (n = 79) |
10.02–13.84
(11.53 ± 0.12) (n = 59) |
29.99–35.34
(32.92 ± 0.22) (n = 46) |
Ланцетная | Клювовидные | + |
| Sv26 | 20.04–27.08
(24.69 ± 0.25) (n = 64) |
2.96–3.62
(3.36 ± 0.02) (n = 64) |
10.47–15.03
(12.21 ± 0.16) (n = 52) |
30.49–35.08
(33.73 ± 0.16) (n = 45) |
Линейно-ланцетная | Клювовидные | + |
| Che70 | 12.44–17.91
(15.15 ± 0.24) (n = 38) |
2.88–4.30
(3.49 ± 0.05) (n = 38) |
10.10–14.90
(12.63 ± 0.22) (n = 38) |
31.72–36.13
(33.84 ± 0.22) (n = 41) |
Ланцетная | Клювовидные | + |
| ChH23 | 11.35–16.84
(15.57 ± 0.20) (n = 47) |
2.86–3.58
(3.17 ± 0.02) (n = 47) |
10.68–14.82
(12.63 ± 0.16) (n = 47) |
30.44–35.07
(33.13 ± 0.14) (n = 42) |
Ланцетная | Клювовидные | + |
| Br | 23.10–26.47
(24.85 ± 0.05) (n = 177) |
2.68–3.69
(3.21 ± 0.02) (n = 177) |
9.73–13.83
(11.28 ± 0.11) (n = 68) |
29.94–35.25
(32.78 ± 0.18) (n = 75) |
Ланцетная | Оттянуто-клювовидные | + |
| Sht18 | 17.62–27.74
(23.28 ± 0.18) (n = 97) |
2.88–3.69
(3.27 ± 0.02) (n = 97) |
9.80–13.94
(11.45 ± 0.11) (n = 58) |
30.13–34.65
(32.95 ± 0.18) (n = 49) |
Ланцетная | Оттянуто-клювовидные | + |
| Ch3ch | 8.92–12.41
(10.48 ± 0.07) (n = 159) |
3.57–5.06
(4.46 ± 0.02) (n = 159) |
10.11–14.82
(12.76 ± 0.18) (n = 46) |
30.55–34.98
(33.02 ± 0.19) (n = 38) |
Широко эллиптическая | Широко закругленные | – |
| ShtS | 46.81–51.89
(50.74 ± 0.13) (n = 45) |
2.87–3.65
(3.12 ± 0.02) (n = 45) |
10.17–12.52
(11.04 ± 0.07) (n = 45) |
30.18–35.21
(32.02 ± 0.16) (n = 45) |
Линейно-ланцетная | Клювовидные | – |
| PkB | 48.49–53.45
(50.61 ± 0.13) (n = 76) |
3.03–3.69
(3.35 ± 0.02) (n = 76) |
9.49–12.84
(10.95 ± 0.15) (n = 36) |
31.51–35.35
(32.94 ± 0.18) (n = 36) |
Линейно-ланцетная | Клювовидные | – |
| SvSh | 40.92–46.0
(44.28 ± 0.14) (n = 70) |
2.87–3.70
(3.32 ± 0.03) (n = 70) |
9.70–11.46
(10.53 ± 0.08) (n = 43) |
31.14–34.60
(32.68 ± 0.15) (n = 43) |
Линейно-ланцетная | Клювовидные | – |
| CheP | 36.24–42.55 (40.00 ± 0.15) (n = 102) |
2.84–3.70 (3.34 ± 0.02) (n = 102) |
10.16–13.01 (11.69 ± 0.12) (n = 46) |
30.22–33.76 (31.57 ± 0.15) (n = 41) |
Линейно-ланцетная | Клювовидные | – |
Рис. 2.
Морфология створок 13 клонов Nitzschia palea. 1 – ShtS; 2 – PkB; 3 – SvSh; 4 – CheP; 5 – Pk9; 6 – Br; 7 – Sv26; 8 – Sht18; 9 – Sv30; 10 – Pk10; 11 – Che70; 12 – ChH23; 13 – Ch3ch. Различные фазы жизненного цикла: а – дорепродуктивная; б – репродуктивная; в – пострепродуктивная.

Рис. 3.
Тератологические структуры створок у клона Ch3ch. а, б – общий вид створок; в, г – образование второго ряда фибул; д – дугообразное расположение штрихов; е – полная редукция некоторых ареол.
Ни один из клонов N. palea не обнаруживал каких-либо признаков полового воспроизведения в моноклональных культурах. Поэтому мы провели гетероталлическое тестирование путем смешивания клонов попарно, что в некоторых случаях вызывало половое воспроизведение (табл. 3). Клоны Sv30, Sv26 и Pk10 принадлежали к одному типу спаривания (пола), который мы обозначаем “a”, и этот тип был совместим с противоположным типом спаривания (пола) “b”, представленным клонами Che70, Sht18, Br и ChH23 (табл. 3). Отсутствие репродуктивной изоляции между этими клонами может свидетельствовать об их принадлежности к одному виду согласно биологической концепции вида. Клон Pk9 (тип спаривания “а”) успешно спаривался только с Br (“b”), с другими клонами типа спаривания “b” половое воспроизведение не наблюдалось (табл. 3). Клон Ch3ch не показал признаков половой активности с остальными клонами. Мы полагаем, что это связано с тем, что длина его створок была наименьшей среди всех исследованных (табл. 2), и, вероятнее всего, он уже был вне диапазона скрещивания. Ни один из клонов, полученных в лаборатории (ShtS, PkB, SvSh, CheP), не обнаруживал каких-либо признаков полового воспроизведения, как с природными клонами, так и друг с другом.
Таблица 3.
Результаты экспериментов по скрещиванию между природными клонами Nitzschia palea
| Sv30 (а) | Sv26 (а) | Pk10 (а) | Pk9 (а) | Che70 (b) | Sht18 (b) | Br (b) | ChH23 (b) | Ch3ch | |
|---|---|---|---|---|---|---|---|---|---|
| Sv30 (а) | 0 | ||||||||
| Sv26 (а) | – | 0 | |||||||
| Pk10 (а) | – | – | 0 | ||||||
| Pk9 (а) | – | – | – | 0 | |||||
| Che70 (b) | + | + | CheP | – | 0 | ||||
| Sht18 (b) | SvSh | ShtS | + | – | – | 0 | |||
| Br (b) | + | + | PkB | + | – | – | 0 | ||
| ChH23 (b) | + | + | + | – | – | – | – | 0 | |
| Ch3ch | – | – | – | – | – | – | – | – | 0 |
ОБСУЖДЕНИЕ
Некоторые фазы жизненного цикла Nitzschia palea частично были описаны Р. Тробахо с соавт. (Trobajo et al., 2009), ниже мы дополняем и обобщаем все эти данные.
Было обнаружено, что морфология створок, их длина и способность к половому воспроизведению всех 13 исследованных клонов Nitzschia palea варьировали в зависимости от фазы их жизненного цикла (рис. 2, табл. 2).
Дорепродуктивная фаза. Все четыре наших клона (ShtS, PkB, SvSh и CheP), полученные в результате лабораторного скрещивания, находились на этой фазе жизненного цикла, поскольку длина их створок была наибольшей среди изученных клонов, и они воспроизводились только путем вегетативного деления клеток (табл. 2). Створки этих клонов характеризовались средней длиной от 50.74 до 40.00 мкм и створками линейно-ланцетной формы с клювовидными концами (табл. 2, рис. 2). Сходные данные были получены и Р. Тробахо с соавт. (Trobajo et al., 2009).
Репродуктивная фаза. Согласно Р. Тробахо с соавт. (Trobajo et al., 2009), две клетки противоположного типа спаривания соединяются сбоку и образовывают две гаметы в каждой. Затем гаметы мигрируют через две короткие копуляционные трубки и сливаются с образованием двух зигот, которые изначально эллипсоидальные или удлиненные и лежат внутри гаметангиев. Поведение гаметангиума и гамет является, по-видимому, одинаковым у обоих типов спаривания (или противоположного пола). Каждый гаметангиум противоположного типа спаривания в любой группе спаривания производит одну активную гамету и одну пассивную гамету (транс-тип физиологической анизогамии), в отличие от полового размножения в близком роде Pseudo-nitzschia, где гаметангии являются либо мужскими, либо женскими (цис-тип физиологической анизогамии) (Chepurnov et al., 2005; Amato et al., 2007). Затем зиготы расширяются (в виде ауксоспор) параллельно апикальным осям гаметангия и образовывают инициальные клетки, появляется следующее поколение (Trobajo et al., 2009). В нашем исследовании весной, летом и осенью парные гаметангии формировались на 2-й день от начала эксперимента, ауксоспоры – на 3-й, инициальные клетки – на 5-й день. Зимой, однако, парные гаметангии формировались на 3-й день от начала эксперимента по спариванию, ауксоспоры – на 4-й день и инициальные клетки – на 7‑й день. Возможно, это было связано с уменьшением интенсивности освещения зимой. Аналогичная картина была отмечена у некоторых других видов диатомовых (Drebes, 1977; Mann, 1993; Рощин, 1994; Davidovich, 2002; Chepurnov et al., 2004).
Эксперименты по скрещиванию показали, что восемь клонов (Pk10, Pk9, Sv30, Sv26, Che70, ChH23, Br и Sht18) находились на репродуктивной фазе. Средняя длина створок на этой фазе варьировала от 29.89 до 15.15 мкм (табл. 2), форма створок изменялась от линейно-ланцетных к ланцетным с клювовидными или оттянуто-клювовидными концами (рис. 2). В целом это соответствует данным, приведенным Р. Тробахо с соавт. (Trobajo et al., 2009). На этой фазе сохраняется типичная морфология створок, но существует тенденция к уменьшению их длины при сохранении ширины и расширении концов.
Пострепродуктивная фаза. На этой фазе жизненного цикла находился только клон Ch3ch, поскольку он не был способен к половому размножению и имел значительно более короткие створки, чем было выявлено для створок на репродуктивной фазе (средняя длина составляла 10.48 мкм; табл. 2). Уменьшение длины створок, но не их ширины, привело к изменению их внешнего вида и переходу к широко эллиптическим створкам с широко закругленными концами. На этой фазе появились тератологические структуры створок, которые ранее не наблюдались нами в течение жизненного цикла N. palea. Основными факторами, вызывающими формирование тератологии, являются загрязнение тяжелыми металлами и длительное культивирование, связанное с малым размером клеток (длиной) (Генкал, Елизарова, 1989; Estes, Dute, 1994; Falasco et al., 2009). В нашем случае загрязнение тяжелыми металлами может быть исключено, и мы можем предположить, что к образованию тератологических структур у клона Ch3ch привело длительное его культивирование (с 2011 года) и значительное уменьшение длины его клеток. Клон Che70 также культивируется с 2011 года, но средняя длина его клеток была больше, чем у клона Ch3ch. Р. Тробахо с соавт. (Trobajo et al., 2009) также сообщали о сходной морфологии и размерах створок (средняя длина от 13.44 до 11.97 мкм) у двух клонов (Japan A1 и Japan E), но какие-либо аномалии створок у этих клонов не наблюдались.
Кардинальные точки. На основании проведенных наблюдений и данных литературы можно сделать вывод, что Nitzschia palea способна к половому воспроизведения при средней длине створок в диапазоне 29.89–15.15 мкм. Было отмечено, что клон Pk9 успешно спаривался только с Br, но не с другими клонами (табл. 3). Возможно, что способность к половому воспроизведению снижается к нижней границе этого диапазона. Таким образом, для этого вида диатомей верхняя кардинальная точка составляет около 30 мкм; нижняя кардинальная точка – около 15 мкм.
Известно, что у диатомовых водорослей размер клеток, находящихся в верхней кардинальной точке, определяющей переход от дорепродуктивной фазы к репродуктивной, составляет примерно 50% от максимального видоспецифического размера (Davidovich, 2000). В случае с Nitzschia palea это соотношение составляло около 47%, что подтверждает ранее выявленную закономерность.
ЗАКЛЮЧЕНИЕ
Таким образом, на основе наших исследований и данных литературы, описан жизненный цикл широко распространенной эврибионтной диатомовой водоросли Nitzschia palea, включающий дорепродуктивную, репродуктивную и пострепродуктивную фазы с описанием морфологии и морфометрии створок на каждой фазе. Впервые для данного вида выявлены кардинальные точки, связь тератологических структур створок с пострепродуктивной фазой развития, а также унипарентальный способ наследования митохондрий. Полученные данные важны для изучения филогеографии данного организма, а также обеспечат фундаментальную основу технологии длительного поддержания Nitzschia palea в культуре.
Список литературы
Генкал С.И., Елизарова В.А. Новые данные по изменению водоросли Diatoma elongatum Ag. в культуре // Биология внутренних вод. 1989. № 81. С. 32–36.
Голиченков В.А. Биология развития. М.: Изд-во МГУ, 1991. 144 с.
Рощин А.М. Жизненные циклы диатомовых водорослей. Киев: Наукова думка, 1994. 171 с.
Эльяшев А.А. О простом способе приготовления высокопреломляющей среды для диатомового анализа // Труды НИИ геологии Арктики. 1957. № 4. С. 74–76.
Abdel-Hamid I.M., El-Refaay A.D., Abdel-Mogib M. et al. Studies on biomass and lipid production of seven diatom species with special emphasis on lipid composition of Nitzschia palea (Bacillariophyceae) as reliable biodiesel feedstock // Algological Studies. 2013. V. 143. P. 65–87.
Abdullin Sh.R. Cyanobacterial-algal cenoses of the Shulgan-Tash cave, Southern Urals // Russian J. Ecology. 2009. V. 40. № 4. P. 301–303.
Abdullin Sh.R., Bagmet V.B. Experimental analysis for the possibility of heterotrophy in algae: the example of some strains from the Propashchaya Yama Cave // Russian J. Ecology. 2015. V. 46. № 5. P. 481–482.
Abdullin Sh.R., Bagmet V.B. Myxotrophy of cyanobacteria and algae inhabiting caves // Zhurnal Obshchei Biologii. 2016. V. 77. № 1. P. 54–62.
Abdullin Sh.R., Urazbakhtina D., Bagmet V.B. Preliminary study of fungicidal and fungistatic activity of some cave microalgae // Abstracts of BIT’s 3rd Annual International Congress of Algae-2014 (Dalian, 16–18, October, 2014. China). Dalian, 2014. P. 203.
Amato A., Orsini L., D’Alelio D. et al. Life cycle, size reduction patterns, and ultrastructure of the pennate planktonic diatom Pseudo-nitzschia delicatissima (Bacillariophyceae) // J. Phycology. 2005. V. 41. № 3. P. 542–556.
Amato A., Kooistra W.H.C.F., Ghiron J.H.L. et al. Reproductive isolation among sympatric cryptic species in marine diatoms // Protist. 2007. V. 158. № 2. P. 193–207.
Andersen R.A. Algal Culturing Techniques. N.Y.: Elsevier Academic Press, 2005. 578 p.
Bagmet V.B., Abdullin Sh.R., Kuluev B.R. et al. The effect of salinity on the reproduction rate of Nitzschia palea (Kützing) W. Smith (Bacillariophyta) clones // Russian Journal of Ecology. 2017. V. 48. № 3. P. 287–289.
Barr C.M., Neiman M., Taylor D.R. Inheritance and recombination of mitochondrial genomes in plants, fungi and animals // New Phytol. 2005. V. 168. P. 39–50.
Binea H.K., Kassim T.I., Binea A.K. Antibacterial activity of diatom Nitzschia palea (Kutz.) W. Sm. extract // Iraqi J. Biotechnology. 2009. V. 8. № 2. P. 562–566.
BLAST (Basic Local Alignment Search Tool), National Center for Biotechnology Information, U.S. National Library of Medicine [online]. Website https://blast.ncbi.nlm.nih.gov/Blast.cgi [accessed 14.03.2019].
Bonfield J.K., Smith K.F., Staden R. A new DNA sequence assembly program // Nucleic Acids Research. 1995. V. 23. P. 4992–4999.
Chepurnov V.A., Mann D.G., Sabbe K. et al. Experimental studies on sexual reproduction in diatoms // International Review of Cytology. 2004. V. 237. P. 91–154.
Chepurnov V.A., Mann D.G., Sabbe K. et al. Sexual reproduction, mating system, chloroplast dynamics and abrupt cell size reduction in Pseudo-nitzschia pungens from the North Sea (Bacillariophyta) // European J. Phycology. 2005. V. 40. P. 379–395.
Davidovich N.A. Species specific sizes and size range of sexual reproduction in diatoms // Proc. 16th Int. Diatom Symp. (Athens and Aegean Islands, Aug. 25–Sept. 1, 2000). Athens: Univ. Athens, 2001. P. 191–196.
Davidovich N.A. Photoregulation of sexual reproduction in Bacillariophyta (review) // International J. Algae. 2002. V. 4. № 2. P. 56–71.
Davidovich N.A., Davidovich O.I., Podunai Yu.A. et al. Reproductive properties of diatoms significant for their cultivation and biotechnology // Russian J. Plant Physiology. 2015. V. 62. № 2. P. 153–160.
Drebes G. Sexuality // The Biology of Diatoms: Botanical Monographs / Eds. Werner D. Oxford: Blackwell Scientific Publications, 1977. P. 250–283.
Echt C.S., Erdahl L.A., McCoy T.J. Genetic segregation of random amplified polymorphic DNA in diploid cultivated alfalfa // Genome. 1992. V. 35. № 1. P. 84–87.
Edlund M.B., Stoermer E.F. Evolutionary, and systematic significance of diatom life histories // J. Phycology. 1997. V. 33. № 6. P. 897–918.
Estes A.M., Dute R.R. Valve abnormalities in diatom clones maintained in long-term culture // Diatom Research. 1994. V. 9. № 2. P. 249–258.
Evans K.M., Wortley A.H., Mann D.G. An assessment of potential diatom “barcode” genes (cox1, rbcL, 18S and ITS rDNA) and their effectiveness in determining relationships in Sellaphora (Bacillariophyta) // Protist. 2007. V. 158. № 3. P. 349–364.
Falasco E., Bona F., Ginepro M. et al. Morphological abnormalities of diatom silica walls in relation to heavy metal contamination and artificial growth conditions // Water SA. 2009. V. 35. № 5. P. 595–606.
Fuchs N., Scalco E., Kooistra W.H.C.F. et al. Genetic characterization and life cycle of the diatom Fragilariopsis kerguelensis // European J. Phycology. 2013. V. 48. № 4. P. 411–426.
Gastineau R., Leignel V., Jacquette B. et al. Inheritance of mitochondrial DNA in the pennate diatom Haslea ostrearia (Naviculaceae) during auxosporulation suggests a uniparental transmission // Protist. 2013. V. 164. № 3. P. 340–351.
Galtier N., Gouy M., Gautier C. Seaview and phylo_win: two graphic tools for sequence alignment and molecular phylogeny // Computer Applications in the Biosciences. 1996. V. 12. № 6. P. 543–548.
Geitler L. Der Formwechsel der pennaten Diatomeen (Kieselalgen) // Archiv fur Protistenkunde. 1932. V. 78. P. 1–226.
Google Maps [online]. Website https://www.google.com/ maps/ [accessed 27.05.2019].
Hassan F.M., Aljbory I.F., Kassim T.I. An attempt to stimulate lipids for biodiesel production from locally isolated microalgae in Iraq // Baghdad Science J. 2013. V. 10. № 1. P. 97–108.
Hess S.K., Lepetit B., Kroth P.G. et al. Production of chemicals from microalgae lipids – status and perspectives // European J. Lipid Science and Technology. 2018. V. 120. № 1. P. 1–26.
Hofmann G., Werum M., Lange-Bertalot H. Diatomeen im Süßwasser-Benthos von Mitteluropa. Bestimmungsflora Kieselalgen für die ökologische Praxis. Rugell: A.R.G. Gantner Verlag K.G., 2011. 908 p.
Jin C., Yu Zh., Peng Sh. et al. The characterization and comparison of exopolysaccharides from two benthic diatoms with different biofilm formation abilities // Anais da Academia Brasileira de Ciências. 2018. V. 90. № 2. P. 1503–1519.
Kermarrec L., Franc A., Rimet F. et al. Next generation sequencing to inventory taxonomic diversity in eukaryotic communities: a test for freshwater diatoms // Molecular Ecology Resources. 2013. V. 13. № 4. P. 607–619.
Kiselev K.V., Dubrovina A.S., Tyunin A.P. The methylation status of plant genomic DNA influences PCR efficiency // J. Plant Physiology. 2015. V. 175. P. 59–67.
Krammer K., Lange-Bertalot H. Bacillariophyceae. 2 Teil: Bacillariaceae, Epithemiaceae, Surirellaceae // Süßwasserflora von Mitteleuropa. Band 2/2 / Eds. Ettl H., Gerloff J., Heynig H., Mollenhauer D.; Jena: Gustav Fischer Verlag, 1988. P. 1–596.
Mann D.G. Patterns of sexual reproduction in diatoms // Hydrobiologia. 1993. V. 269. P. 11–20.
Mann D.G., Chepurnov V.A. What have the Romans ever done for us? The past and future contribution of culture studies to diatom systematic // Nova Hedwigia. 2004. V. 79. № 1–2. P. 237–291.
Rimet F., Trobajo R., Mann D.G. et al. When is sampling complete? The effects of geographical range and marker choice on perceived diversity in Nitzschia palea (Bacillariophyta) // Protist. 2014. V. 165. № 3. P. 245–259.
Rovira L., Trobajo R., Sato S. et al. Genetic and physiological diversity in the diatom Nitzschia inconspicua // J. Eukaryotic Microbiology. 2015. V. 62. № 6. P. 815–832.
Trobajo R., Mann D.G., Cox E.J. Sexual reproduction in Nitzschia fonticola: the importance of studying the entire life cycle in diatoms // Phycologia. 2005. V. 44. № 4. P. 103.
Trobajo R., Clavero E., Chepurnov V.A. et al. Morphological, genetic and mating diversity within the widespread bioindicator Nitzschia palea (Bacillariophyceae) // Phycologia. 2009. V. 48. № 6. P. 443–459.
Trobajo R., Mann D.G., Clavero E. et al. The use of partial cox1, rbcL and LSU rDNA sequences for phylogenetics and species identification within the Nitzschia palea species complex (Bacillariophyceae) // European J. Phycology. 2010. V. 45. № 4. P. 413–425.
Zhang W., Wang F., Gao B. et al. An integrated biorefinery process: Stepwise extraction of fucoxanthin, eicosapentaenoic acid and chrysolaminarin from the same Phaeodactylum tricornutum biomass // Algal Research-Biomass Biofuels and Bioproducts. 2018. V. 32. P. 193–200.
Дополнительные материалы отсутствуют.


