Онтогенез, 2020, T. 51, № 2, стр. 143-153
Суточная динамика липидов и жирных кислот и активность ферментов энергетического и углеводного обмена у молоди лептоклинуса пятнистого Leptoclinus maculatus (Fries, 1838) разных стадий развития в условиях полярной ночи
С. А. Мурзина a, *, С. Н. Пеккоева a, М. В. Чурова a, З. А. Нефедова a, К. А. Филиппова a, С. Фальк-Петерсен b, c, Н. Н. Немова a
a Институт биологии – обособленное подразделение Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук”
185910 Петрозаводск, ул. Пушкинская 11, Россия
b Akvaplan-niva AS, Fram Centre
N-9296 Tromsø, Norway
c UiT The Arctic University of Norway, Department of Arctic and Marine Biology
N-9037 Tromsø, Norway
* E-mail: murzina.svetlana@gmail.com
Поступила в редакцию 01.10.2019
После доработки 02.01.2020
Принята к публикации 09.01.2020
Аннотация
Впервые проведено сравнительное исследование суточной динамики липидного и жирнокислотного профиля, уровня энергетического обмена у молоди пятнистого лептоклинуса L2, L3, L4, L4*, L5 стадий развития, являющихся звеньями пелагической (L2, L3, L4) и бентосной (L4, L4*, L5) пищевой цепи из залива Конгс-фьорд в условиях полярной ночи. Суточная динамика липидных компонентов и активности ферментов анаэробного обмена может рассматриваться как один из механизмов генетически детерминированной онтогенетической и экологически ориентированной фенотипической разнокачественности жизненной стратегии вида, направленной на поддержание его существования в конкретных условиях среды и адаптацию к ним на разных уровнях организации живого.
ВВЕДЕНИЕ
Рыбы семейства Стихеевых (Stichaeidae) большую часть жизни проводят на дне прибрежных акваторий континентального шельфа морских экосистем, глубина их обитания сильно варьирует, некоторые из видов обитают в зоне приливно-отливных течений. Специфические условия обитания и широкий диапазон варьирования экологических факторов для рыб этого семейства определяют высокую степень адаптивности и пластичности.
Следует заметить, что информация о биологии данных видов семейства Стихеевые немногочисленна (Ochiai, Fuji, 1980; Miki et al., 1987; Keats et al., 1993; Smith, Wootton, 1999; Kolpakov, Klimkin, 2004; Rose, 2005; Murzina et al., 2008). Пятнистый лептоклинус (Leptoclinus maculatus (Fries, 1838)) – морской донный вид, относящийся к арктическо-борельной (Долгов, Бензик, 2012; Мухина, Долгов, 2012) зоогеографической группе. Известно, что репродуктивная функция и последующее развитие организма этих рыб протекает в условиях низких температур, икрометание лептоклинуса приходится на зимний сезон или зимне-весенний (Murzina et al., 2012) и тесно связано с температурой среды, а также трофикой, особенно, принимая во внимание тот факт, что личинки являются пелагическими (Андрияшев, 1954; Пеккоева и др., 2014, 2017a, 2017б, 2018). Молодь лептоклинуса характеризуется длительным развитием в пелагиали и относительно недавно установленной многостадийностью) и в предложенной системе (Meyer Ottesen et al., 2011, 2014; Пеккоева, 2018) стадии обозначаются латинской буквой и цифрой: стадии ранжированы от L1 до L5, из которых L2, L3 обитают в пелагиали, L4, L4* – имеют переходный образ жизни от пелагиали к донному, а L5 – донное обитание. Стадии развития молоди различаются по морфофизиологическим характеристикам, а также разделяются по принадлежности к экологическим группам (пелагической, “переходной”, донной) (Meyer Ottesen et al., 2011, 2014; Пеккоева и др., 2017a, 2018). В работе С.Н. Пеккоевой (Пеккоева, 2018) впервые представлены данные о липидном и жирнокислотном составе молоди L. maculatus в процессе постэмбрионального роста и развития в зимний период, приведены сведения по изменению длины и состояния особого провизорного образования тела – “липидного мешка” в процессе развития личинки. Формирование липидного мешка с началом экзогенного питания у личинок рассматривается как пример физиолого-биохимической адаптации к обитанию рыб в пелагиали, способствующей их успешному росту (Мурзина, 2010; Пеккоева, 2018). Полученные ранее результаты о закономерностях роста и смене питания по мере развития молоди лептоклинуса (Пеккоева и др., 2018; Пеккоева, 2018) свидетельствуют в пользу гипотезы об особенностях функционирования морской экосистемы в условиях полярной ночи. Несмотря на специфический фотопериод зимой, компоненты экосистемы активно, согласно сезону, взаимодействуют друг с другом, фито- и зоопланктон продолжают составлять определенную долю в структуре пелагических сообществ, обеспечивая пищей пелагических рыб (Berge et al., 2015). Ранее считалось, что в полярную ночь высокоширотные экосистемы характеризуются отсутствием выраженных миграций, суточных или ежемесячных, в частности у зоопланктона (р. Calanus, преимущественно), который рассматривается основным компонентом пищевых цепей Арктики. Результаты недавних научных исследований (Berge et al., 2015; Last et al., 2016), демонстрируют неопровержимые доказательства адаптаций, морфологических, поведенческих, как на уровне популяции, так и на экосистемном. Показано, что, вертикальные миграции зоопланктона и их интенсивность являются компенсаторной реакцией не только на солнечное излучение летом, но и регулируются фазами Луны и ее положением над горизонтом – “лунная вертикальная миграция”/“lunar vertical migration” (Last et al., 2016). Влияние лунного света в полярную ночь на структуру и функционирование морских экосистем имеет глубоко эволюционное значение, в результате чего даже в зимнее время осуществляется перенос углерода и осуществляется взаимодействие в системе “хищник-хозяин” как внутри отдельных водных слоев, так и между ними.
В настоящей работе впервые провели сравнительное исследование суточной динамики липидов и жирных кислот, а также активности ферментов энергетического и углеводного обмена (цитохром c оксидазы, лактатдегидрогеназы, альдолазы) у лептоклинуса пятнистого (Leptoclinus maculatus, Fries, 1838) постэмбрионального периода L2, L3, L4, L4* и L5 стадии развития из акватории арх. Шпицберген (залив Конгс-фьорд) в полярную ночь.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор проб пелагической молоди и донных особей лептоклинуса пятнистого проводились с использованием пелагического и донного тралов на борту НИС “Хельмер Ханссен” (R/V Helmer Hanssen, the Arctic University of Norway, UiT) в январе в акватории залива Конгс-фьорд (78°57′′ c.ш. 11°56′′ в.д.) в рамках международного рейса Marine Night field campaign 2014. Для исследования суточной динамики липидного профиля молоди в зимний период были исследованы мышцы молоди лептоклинуса пятнистого L2, L3, L4, L4* и L5 стадий развития (рис. 1), а также липидный мешок L3, L4, L4* стадий развития.
В полевых условиях, на борту судна, как можно быстрее после разбора улова и сортировки стадий молоди исследуемой рыбы проводили извлечение липидного мешка и мышц. В условиях лаборатории проводили фиксацию проб в хлороформ : метаноле (2 : 1, по объему). До проведения экстракции, индивидуальные пробы тканей хранились в смеси хлороформ : метанол (2 : 1, по объему) в стеклянных пробирках надлежащего объема. Общие липиды экстрагировали по методу Фолча (Folch et al., 1957), затем концентрировали с помощью роторно-вакуумной установки Hei-VAP Advantage HL/G3 (Heidolph, Germany).
Разделение классов липидов проводили методом тонкослойной хроматографии на пластинках “Merck” (“Merck”, Германия). Все анализируемые пробы наносили на пластинку с помощью шприца в объеме 15 мкл (360 мкг липида), в двух–трех повторностях. Фракционирование общих липидов проб проводили элюированием в системе растворителей: петролейный эфир–диэтиловый эфир–уксусная кислота (90 : 10 : 1 по объему) в хроматографической камере при комнатной температуре (Шталь, 1965). Для количественного определения общих фосфолипидов (ФЛ), триацилглицеринов (ТАГ), эфиров холестерина со следами восков (ЭХС + В) использовали гидроксаматный метод, принцип которого заключается в образовании темно-коричневых комплексов между ионами трехвалентного железа и гидроксамовыми кислотами, которые образуются при взаимодействии сложноэфирных связей липидов с гидроксиламином (Walsh et al., 1965; Сидоров и др., 1972). Далее проводили измерение оптической плотности каждой пробы на спектрофотометре СФ-2000 (ОКБ “Спектр”, Россия) при длине волны 540 нм. Количественное определение холестерина (ХС) проводили по методу Ф. Энгельбрехта (Engelbrecht et al., 1974) с использованием трихлоруксусного железа, растворенного в хлорной кислоте. Интенсивность образовавшейся окраски измеряли на спектрофотометре СФ-2000 (ОКБ “Спектр”, Россия) при длине волны 550 нм.
Для анализа жирнокислотного состава ОЛ проводили метанолиз жирных кислот (ЖК) общих липидов (Новак, 1978). Разделение метиловых эфиров ЖК проводили на газовом хроматографе “Кристалл 5000.2” (ЗАО “ХРОМАТЭК”, Йошкар-Ола, Россия) с капиллярными колонками Zebron ZB-FFAP (Phenomenex, USA), используя в качестве внутреннего стандарта бегеновую кислоту (22:0) (Sigma Aldrich, USA). Обработку хроматограмм проводили с помощью компьютерной программы “Хроматэк Аналитик” (ЗАО “ХРОМАТЭК”, Йошкар-Ола, Россия). В качестве стандартов метиловых эфиров ЖК использованы наборы Supelco 37 Component FAME Mix, Bacterial acid methyl ester (BAME) mix, PUFA No. 1 (Supelco, USA).
Для исследования активности ферментов энергетического и углеводного обмена молоди в зимний период были исследованы мышцы молоди лептоклинуса пятнистого L2, L3, L4, L4* и L5 стадий развития. Ткань рыбы хранились до анализа при температуре –80°С. Активность цитохром с оксидазы (ЦО, КФ 1.9.3.1.) определяли по методу Л. Смита (Smith, 1995) измеряя увеличение количества окисленного цитохрома с. Общую активность лактатдегидрогеназы (ЛДГ, 1.1.1.27) определяли, измеряя количества восстановленных НАД+ и НАДФ+ по общепринятой методике (Кочетов, 1980). Активность альдолазы (КФ 4.1.2.13) определяли по методике Beck в модификации Ананьева и Обуховой (Колб, Камышников, 1976). Активность ферментов выражали в мкмоль/мин/г ткани.
Статистический анализ полученных результатов производили с помощью критерия Краскела–Уоллиса с последующим сравнением выборок с использованием критерия Манна–Уитни. Различия считали достоверными при р ≤ 0.05.
Исследования выполнены на базе лаборатории экологической биохимии с использованием оборудования Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Динамика липидов и жирных кислот
Исследована динамика липидов и их ЖК-компонентов у разновозрастной молоди Leptoclinus maculatus, обитающей в заливе Конгс-фьорд в ответ на суточный цикл (“дневной” трал и “ночной” трал) в полярную ночь зимой (январь) (табл. 1–4).
Таблица 1.
Содержание липидов (% сухой массы) в мышцах молоди лептоклинуса пятнистого Leptoclinus maculatus (Fries, 1838), выловленного в разное время суток в акватории арх. Шпицберген (залив Конгс-фьорд) в зимний период (январь)
| Стадия развития | L2 | L3 | L4 | L4* | L5 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время запуска трала | день | ночь | день | ночь | день | ночь | день | ночь | день | ночь |
| Кол-во проб | 15 | 15 | 20 | 20 | 15 | 15 | 6 | 6 | 8 | 9 |
| Общие липиды | 13.7 ± 0.6 | 14.6 ± 0.7 | 14.9 ± 0.9 | 13.0 ± 0.5 | 16.0 ± 0.7 | 17.9 ± 0.9 | 24.4 ± 0.8 | 21.3 ± 1.3 | 20.3 ± 3.4 | 22.3 ± 2.3 |
| Фосфолипиды | 7.6 ± 0.3 | 8.2 ± 0.4 | 7.4 ± 0.5 | 7.0 ± 0.4 | 7.8 ± 0.3 | 6.5 ± 0.4^ | 5.7 ± 0.5 | 6.4 ± 0.4 | 4.3 ± 0.3 | 4.9 ± 0.3 |
| Триацилглицерины | 2.9 ± 0.4 | 3.2 ± 0.6 | 2.6 ± 0.3 | 2.1 ± 0.2 | 4.5 ± 0.6 | 8.0 ± 1.0^ | 14.4 ± 1.1 | 11.2 ± 1.4 | 13.3 ± 3.5 | 13.5 ± 2.1 |
| Эфиры холестерина + воска | 1.5 ± 0.1 | 0.9 ± 0.1^ | 1.1 ± 0.2 | 0.7 ± 0.5 | 1.3 ± 0.1 | 1.2 ± 0.1 | 2.6 ± 0.3 | 1.3 ± 0.4^ | 0.9 ± 0.2 | 1.5 ± 0.3^ |
| Холестерин | 1.8 ± 0.2 | 2.3 ± 0.1^ | 3.8 ± 0.2 | 3.2 ± 0.3 | 2.4 ± 0.3 | 2.2 ± 0.2 | 1.7 ± 0.2 | 2.4 ± 0.2^ | 1.7 ± 0.9 | 2.5 ± 0.3 |
Таблица 2.
Содержание липидных компонентов (% сухой массы) в липидном мешке молоди лептоклинуса пятнистого Leptoclinus maculatus (Fries, 1838), выловленного в разное время суток в акватории арх. Шпицберген (залив Конгс-фьорд) в зимний период (январь)
| Стадии развития | L3 | L4 | L4* | |||
|---|---|---|---|---|---|---|
| Время запуска трала | день | ночь | день | ночь | день | ночь |
| Кол-во проб | 6 | 15 | 3 | 4 | 5 | 2 |
| Общие липиды | 90.9 ± 15.0 | 75.0 ± 5.6 | 84.1 ± 3.2 | 85.1 ± 2.8 | 91.9 ± 1.1 | 93.4 ± 1.1 |
| Фосфолипиды | 0.8 ± 0.5 | 1.4 ± 0.9 | 17.0 ± 8.7 | 10.2 ± 5.9 | 25.4 ± 5.7 | 45.0 ± 0.2 |
| Триацилглицерины | 81.5 ± 1.9 | 67.7 ± 15.1 | 49.7 ± 4.2 | 59.3 ± 8.0^ | 61.7 ± 6.5 | 42.1 ± 0.0 |
| Эфиры холестерина + воска | 4.4 ± 1.0 | 1.9 ± 2.6 | 6.1 ± 1.3 | 4.3 ± 1.7 | 0 | 0 |
| Холестерин | 4.3 ± 0.4 | 4.1 ± 0.4 | 11.2 ± 1.9 | 11.4 ± 2.2 | 4.1 ± 1.3 | 4.4 ± 0.1 |
Таблица 3.
Жирнокислотный спектр (% суммы ЖК) мышц молоди лептоклинуса пятнистого Leptoclinus maculatus (Fries, 1838), выловленного в разное время суток в акватории арх. Шпицберген (зал. Конгс-фьорд) в зимнее время (январь). Обозначения: НЖК – насыщенные жирные кислоты, МНЖК – мононенасыщенные жирные кислоты, ПНЖК – полиненасыщенные жирные кислоты
| Стадии развития | L2 | L3 | L4 | L4* | L5 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Время запуска трала | день | ночь | день | ночь | день | ночь | день | ночь | день | ночь |
| Кол-во проб | 15 | 15 | 20 | 20 | 15 | 15 | 6 | 6 | 8 | 9 |
| 14:0 | 3.54 ± 0.21 | 3.48 ± 0.16 | 2.75 ± 0.09 | 2.86 ± 0.11 | 3.04 ± 0.11 | 3.48 ± 0.12 | 3.84 ± 0.08 | 3.91 ± 0.15 | 3.46 ± 0.40 | 3.67 ± 0.28 |
| 16:0 | 11.41 ± 0.40 | 11.66 ± 0.45 | 12.34 ± 0.25 | 12.15 ± 0.15 | 11.12 ± 0.26 | 10.12 ± 0.25 | 9.10 ± 0.15 | 9.25 ± 0.17 | 8.73 ± 0.53 | 9.14 ± 0.52 |
| 18:0 | 2.09 ± 0.12 | 2.32 ± 0.14 | 2.47 ± 0.11 | 2.27 ± 0.07 | 2.19 ± 0.06 | 2.08 ± 0.09 | 1.77 ± 0.07 | 1.78 ± 0.03 | 2.04 ± 0.34 | 1.93 ± 0.28 |
| ∑НЖК | 19.43 ± 0.59 | 19.95 ± 0.60 | 19.76 ± 0.34 | 19.43 ± 0.25 | 17.93 ± 0.28 | 17.54 ± 0.45 | 16.12 ± 0.17 | 16.36 ± 0.14 | 15.83 ± 0.66 | 16.33 ± 0.62 |
| 16:1(n-7) | 3.79 ± 0.32 | 3.70 ± 0.28 | 3.73 ± 0.14 | 3.84 ± 0.19 | 3.52 ± 0.12 | 4.99 ± 0.27^ | 5.41 ± 0.13 | 4.91 ± 0.50 | 5.07 ± 0.39 | 5.35 ± 0.32 |
| 18:1(n-9) | 6.71 ± 0.20 | 6.85 ± 0.27 | 7.40 ± 0.16 | 7.53 ± 0.12 | 6.87 ± 0.18 | 6.32 ± 0.15 | 5.87 ± 0.12 | 5.91 ± 0.20 | 5.72 ± 0.56 | 5.92 ± 0.33 |
| 18:1(n-7) | 1.67 ± 0.04 | 1.68 ± 0.04 | 1.83 ± 0.06 | 1.91 ± 0.04 | 1.67 ± 0.05 | 1.77 ± 0.04 | 1.72 ± 0.04 | 1.60 ± 0.14 | 2.13 ± 0.37 | 1.98 ± 0.37 |
| 18:1(n-5) | 0.40 ± 0.02 | 0.42 ± 0.02 | 0.47 ± 0.01 | 0.44 ± 0.01 | 0.48 ± 0.03 | 0.50 ± 0.01 | 0.51 ± 0.01 | 0.54 ± 0.03 | 0.35 ± 0.02 | 0.45 ± 0.03 |
| 20:1(n-9) | 13.40 ± 0.93 | 13.02 ± 0.99 | 11.83 ± 0.52 | 12.56 ± 0.43 | 13.96 ± 0.64 | 17.11 ± 0.71^ | 21.29 ± 0.45 | 19.61 ± 0.89 | 17.20 ± 2.14 | 18.93 ± 1.83 |
| 22:1(n-11) | 12.31 ± 0.78 | 11.50 ± 0.82 | 7.75 ± 0.52 | 8.36 ± 0.42 | 10.30 ± 0.94 | 13.14 ± 0.78 | 16.15 ± 0.51 | 16.57 ± 0.79 | 17.61 ± 2.71 | 16.25 ± 0.95 |
| 22:1(n-9) | 1.11 ± 0.08 | 1.17 ± 0.11 | 0.84 ± 0.06 | 0.81 ± 0.06 | 1.02 ± 0.1 | 1.46 ± 0.09 | 1.74 ± 0.04 | 1.79 ± 0.07 | 1.93 ± 0.31 | 1.72 ± 1.20 |
| ∑МНЖК | 40.29 ± 1.76 | 39.24 ± 1.81 | 34.62 ± 1.02 | 36.20 ± 0.99 | 38.86 ± 1.45 | 46.52 ± 1.67^ | 54.01 ± 0.69 | 52.16 ± 1.30 | 51.65 ± 4.36 | 52.07 ± 3.38 |
| 18:2(n-6) | 1.77 ± 0.05 | 1.68 ± 0.04 | 1.71 ± 0.04 | 1.81 ± 0.05 | 1.89 ± 0.08 | 1.68 ± 0.04 | 1.56 ± 0.06 | 1.95 ± 0.18 | 1.31 ± 0.08 | 1.58 ± 0.08 |
| 20:4(n-6) | 0.54 ± 0.03 | 0.59 ± 0.05 | 0.59 ± 0.02 | 0.58 ± 0.02 | 0.54 ± 0.02 | 0.41 ± 0.03^ | 0.29 ± 0.41 | 0.34 ± 0.03 | 0.94 ± 0.43 | 0.68 ± 0.40 |
| ∑(n-6) ПНЖК | 3.39 ± 0.10 | 3.50 ± 0.15 | 4.09 ± 0.25 | 4.22 ± 0.39 | 3.64 ± 0.10 | 3.34 ± 0.15 | 3.17 ± 0.08 | 3.69 ± 0.22 | 4.07 ± 0.76 | 3.50 ± 0.51 |
| 18:3(n-3) | 0.73 ± 0.03 | 0.69 ± 0.03 | 0.80 ± 0.02 | 0.80 ± 0.03 | 0.86 ± 0.03 | 0.78 ± 0.02 | 0.77 ± 0.05 | 0.82 ± 0.04 | 0.58 ± 0.06 | 0.75 ± 0.06 |
| 20:5(n-3) | 10.37 ± 0.40 | 10.67 ± 0.45 | 11.54 ± 0.33 | 11.40 ± 0.37 | 10.04 ± 0.51 | 8.63 ± 0.36^ | 7.22 ± 0.39 | 6.91 ± 0.31 | 8.63 ± 1.39 | 7.80 ± 1.17 |
| 22:5(n-3) | 5.01 ± 0.26 | 4.69 ± 0.25 | 6.06 ± 0.19 | 5.16 ± 0.19^ | 0.88 ± 0.03 | 0.75 ± 0.02 | 0.70 ± 0.03 | 0.71 ± 0.03 | 1.01 ± 0.14 | 0.94 ± 0.18 |
| 22:6(n-3) | 15.36 ± 0.85 | 15.93 ± 0.88 | 16.19 ± 0.50 | 16.23 ± 0.53 | 14.98 ± 0.65 | 11.93 ± 0.59^ | 9.47 ± 0.30 | 10.14 ± 0.33 | 10.92 ± 1.86 | 10.36 ± 1.24 |
| ∑(n-3) ПНЖК | 34.20 ± 1.41 | 34.65 ± 1.26 | 38.47 ± 0.79 | 37.33 ± 0.88 | 31.17 ± 0.98 | 27.08 ± 0.82^ | 23.62 ± 0.61 | 23.93 ± 0.48 | 25.83 ± 2.91 | 24.88 ± 2.12 |
| ∑ПНЖК | 40.28 ± 1.50 | 40.81 ± 1.34 | 45.62 ± 0.84 | 44.38 ± 1.05 | 43.21 ± 1.25 | 35.94 ± 1.48^ | 29.87 ± 0.62 | 31.47 ± 1.20 | 32.52 ± 3.72 | 31.60 ± 2.76 |
| 16:0/18:1(n-9) | 1.70 ± 0.04 | 1.71 ± 0.04 | 1.67 ± 0.02 | 1.64 ± 0.03 | 1.62 ± 0.02 | 1.60 ± 0.02 | 1.55 ± 0.03 | 1.57 ± 0.06 | 1.56 ± 0.05 | 1.55 ± 0.04 |
| ∑22:1/∑20:1 | 0.99 ± 0.03 | 0.96 ± 0.04 | 0.71 ± 0.03 | 0.72 ± 0.02 | 0.79 ± 0.05 | 0.84 ± 0.02 | 1.08 ± 0.09 | 0.92 ± 0.05 | 1.08 ± 0.09 | 0.92 ± 0.05 |
Таблица 4.
Жирнокислотный спектр (% суммы ЖК) липидного мешка молоди лептоклинуса пятнистого Leptoclinus maculatus (Fries, 1838), выловленного в разное время суток в акватории арх. Шпицберген (Конгс-фьорд) в зимний период. Обозначения: НЖК – насыщенные жирные кислоты, МНЖК – мононенасыщенные жирные кислоты, ПНЖК – полиненасыщенные жирные кислоты
| Стадии развития | L3 | L4 | L4* | |||
|---|---|---|---|---|---|---|
| Время запуска трала | день | ночь | день | ночь | день | ночь |
| Кол-во проб | 6 | 15 | 3 | 4 | 5 | 2 |
| 14:0 | 6.37 ± 0.29 | 5.85 ± 0.12 | 6.76 ± 0.75 | 6.29 ± 0.50 | 5.66 ± 0.17 | 6.26 ± 0.05* |
| 16:0 | 6.87 ± 0.26 | 6.86 ± 0.14 | 7.15 ± 0.28 | 6.93 ± 0.51 | 6.54 ± 0.15 | 7.31 ± 0.15* |
| 18:0 | 0.70 ± 0.03 | 0.73 ± 0.02 | 0.75 ± 0.08 | 0.75 ± 0.04 | 0.67 ± 0.02 | 0.82 ± 0.02* |
| ∑НЖК | 15.39 ± 0.59 | 14.84 ± 0.27 | 15.99 ± 0.79 | 15.50 ± 0.99 | 14.10 ± 0.39 | 15.87 ± 0.08* |
| 16:1(n-7) | 6.12 ± 0.33 | 5.95 ± 0.33 | 6.0 ± 0.95 | 6.29 ± 0.35 | 7.04 ± 0.09 | 6.56 ± 0.69 |
| 18:1(n-9) | 4.88 ± 0.14 | 4.92 ± 0.07 | 4.55 ± 0.08 | 4.37 ± 0.35 | 3.98 ± 0.04 | 4.39 ± 0.06* |
| 18:1(n-7) | 1.17 ± 0.04 | 1.24 ± 0.03 | 1.11 ± 0.06 | 1.15 ± 0.06 | 1.26 ± 0.009 | 1.28 ± 0.09 |
| 18:1(n-5) | 0.21 ± 0.01 | 0.22 ± 0.01 | 0.23 ± 0.04 | 0.22 ± 0.02 | 0.23 ± 0.01 | 0.28 ± 0.003 |
| 20:1(n-9) | 26.67 ± 0.54 | 27.17 ± 0.54 | 27.12 ± 0.27 | 27.55 ± 0.57 | 28.18 ± 0.40 | 30.17 ± 0.74 |
| 22:1(n-11) | 25.22 ± 1.30 | 25.69 ± 0.66 | 28.01 ± 1.25 | 27.11 ± 0.76 | 26.91 ± 0.76 | 28.71 ± 1.15 |
| 22:1(n-9) | 2.17 ± 0.16 | 2.18 ± 0.11 | 2.45 ± 0.21 | 2.40 ± 0.05 | 2.47 ± 0.17 | 2.69 ± 0.13 |
| ∑МНЖК | 67.62 ± 1.50 | 68.48 ± 0.59 | 70.82 ± 0.61 | 70.46 ± 0.69 | 71.63 ± 1.33 | 75.55 ± 0.32* |
| 18:2(n-6) | 2.14 ± 0.04 | 2.13 ± 0.07 | 1.93 ± 0.22 | 1.75 ± 0.12 | 1.63 ± 0.09 | 1.56 ± 0.12 |
| 20:4(n-6) | 0.11 ± 0.03 | 0.10 ± 0.01 | 0.09 ± 0.00 | 0.07 ± 0.01 | 0.07 ± 0.01 | 0.03 ± 0.002* |
| ∑(n-6) ПНЖК | 3.11 ± 0.28 | 2.89 ± 0.10 | 2.76 ± 0.24 | 2.54 ± 0.13 | 2.42 ± 0.13 | 2.16 ± 0.14 |
| 18:3(n-3) | 1.24 ± 0.04 | 1.18 ± 0.05 | 0.98 ± 0.14 | 0.90 ± 0.08 | 0.75 ± 0.07 | 0.54 ± 0.03* |
| 20:5(n-3) | 2.61 ± 0.13 | 2.84 ± 0.14 | 1.55 ± 0.28 | 1.96 ± 0.38 | 2.15 ± 0.42 | 0.78 ± 0.00* |
| 22:5(n-3) | 0.38 ± 0.02 | 0.38 ± 0.01 | 0.30 ± 0.07 | 0.38 ± 0.09 | 0.42 ± 0.07 | 0.18 ± 0.05* |
| 22:6(n-3) | 3.05 ± 0.13 | 3.34 ± 0.17 | 2.36 ± 0.39 | 2.59 ± 0.32 | 2.60 ± 0.41 | 1.18 ± 0.09* |
| ∑(n-3) ПНЖК | 12.17 ± 0.49 | 12.35 ± 0.33 | 8.98 ± 1.29 | 9.94 ± 1.48 | 10.28 ± 1.51 | 5.11 ± 0.28* |
| ∑ПНЖК | 16.99 ± 0.96 | 16.69 ± 0.42 | 13.19 ± 1.38 | 14.04 ± 1.62 | 14.27 ± 1.67 | 8.58 ± 0.40* |
| 16:0/18:1(n-9) | 1.41 ± 0.02 | 1.40 ± 0.02 | 1.57 ± 0.06 | 1.59 ± 0.05 | 1.64 ± 0.03 | 1.66 ± 0.01 |
| ∑22:1/∑20:1 | 1.01 ± 0.00 | 1.05 ± 0.03 | 1.11 ± 0.06 | 1.06 ± 0.04 | 1.03 ± 0.02 | 1.03 ± 0.07 |
Не установлено изменений в содержании липидов и ЖК в мышцах и липидном мешке наиболее адаптированной к обитанию в пелагической среде молоди L3 стадии развития в ответ на суточный цикл в полярную ночь зимой (табл. 1–4). При этом, для пелагической молоди L2 стадии и переходной L4 стадии показано достоверное снижение минорного класса энергетических липидов ЭХС и восков, а также структурных липидов в форме ХС (табл. 1) в ночные часы по сравнению с таковым в дневные часы сбора проб. Показано, что в мышцах молоди L2, L3, L4* и L5 стадий развития ЖК-состав ОЛ в ответ на суточный цикл достоверно не изменялся. Однако, в мышцах молоди лептоклинуса пятнистого L4 стадии происходит снижение содержания ФЛ и существенное повышение ТАГ от “дневных” к “ночным” часам в зимний период (7.8, 6.5 и 4.5 и 8.0% сухой массы, соответственно) (табл. 1), а также снижение содержания ПНЖК (за счет незаменимой докозагексаеновой, 22:6(n-3), ЖК). Содержание МНЖК за счет 20:1(n-9) ЖК, имеющей пищевое происхождение, в мышцах молоди L4 стадии развития было выше в ночной время по сравнению с таковым в дневное время сбора проб (38.86 и 13.96 против 46.52 и 17.11% суммы ЖК соответственно) (табл. 3).
Активность ферментов энергетического и углеводного обмена
Установлены различия в активности ферментов у лептоклинуса разных стадий развития. Активность ЦО у молоди L2–L4 стадий развития уменьшается, а на стадиях L4*–L5 увеличивается. Показано, что вне зависимости от времени суток активность ЛДГ увеличивается и наиболее высокая у молоди старших возрастных групп (рис. 2).
Рис. 2.
Активность ферментов ЦО (а), ЛДГ (б), альдолазы (в) (мкмоль/мин/г) в мышцах пятнистого лептоклинуса разных стадий развития в дневное и ночное время. a – различия достоверны в сравнении со стадией L2 в соответствии с временем суток (p < 0.05), b – различия достоверны в сравнении со стадией L3 в соответствии с временем суток, c – различия достоверны в сравнении со стадией L4 в соответствии с временем суток, d – различия достоверны в сравнении со стадией L4*, * – различия достоверны в сравнении со значениями, полученными в дневное время.
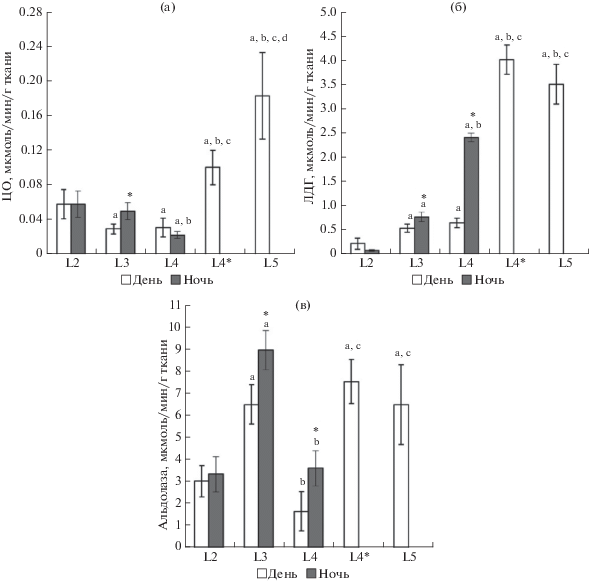
Сравнительный анализ активности ферментов у пятнистого лептоклинуса стадий развития L2, L3, L4 в ночное и дневное время показывает, что активность ферментов углеводного обмена ЛДГ и альдолазы выше в ночное время на стадии L3 и L4 (рис. 2). На стадии L3 активность ЦО так же выше в ночное время (рис. 2).
ОБСУЖДЕНИЕ
Стабильность показателей липидного статуса мышц и липидного мешка молоди L3 стадии в ответ на суточные флуктуации экологических условий (особенно качественного и количественного состава кормовых объектов) указывает на высокую устойчивость данной молоди и ее адаптированность к условиям пелагиали. Наибольшая динамика липидов показана для молоди L. maculatus L4 стадии развития, ведущей переходный образ жизни, которая связана, скорее всего, с усилением функциональной нагрузки на мышцы (снижение ФЛ), вызванной, вероятно, суточными вертикальными миграциями молоди в определенном диапазоне глубин, связанной с питанием и поиском кормовых объектов в ночное время (увеличение содержания ТАГ). В пользу данного предположения (об увеличении функциональной нагрузки мышц в ночное время) указывает и снижение уровня ПНЖК, за счет 22:6(n-3) ЖК, вариации которого, в том числе, связаны с поддержанием метаболических процессов двигательной активности. При этом уровень МНЖК, за счет 20:1(n-9), синтезируемой de novo копеподами, возрастал в мышцах молоди L4 стадии именно в ночное время (38.86 и 13.96 против 46.52 и 17.11% суммы ЖК соответственно). Известно, что значительную долю в спектре кормовых объектов у молоди L4 стадии развития составляют копеподы (Пеккоева и др., 2017а). Кроме того, согласно последним исследованиям особенностей функционирования арктической биоты в условиях специфического фотопериода, показаны суточные вертикальные миграции зоопланктона в ответ на интенсивность лунного света, которые имеют консервативный характер и затрагивают функциональные процессы в морских экосистемах во всем арктическом домене, сформировались в ходе адаптации животных к обитанию в условиях специфического фотопериода в Арктике (Last et al., 2016). Обнаружено, что в полярную ночь, в ночные часы зоопланктон опускается на глубину около 50 м, избегая лунного света, а в дневные часы снова поднимается, возвращается в зону эпипелагиали (Last et al., 2016). Кроме того, нами показано, что в зимнее время в пелагическом слое воды могут находиться копеподиты веслоногих рачков, которые не уходят в состояние диапаузы ввиду недостатка нужного количества липидов в их липидном мешке, такие копеподы могут продолжать питаться (Немова и др., 2014).
Отсутствие различий по содержанию ЖК в ОЛ мышц молоди L2, L3, L4* и L5 стадий развития в ответ на суточный цикл свидетельствует об адаптированности молоди к жизнедеятельности на определенной глубине, которую на соответствующем этапе развития населяет молодь лептоклинуса. При этом суточная динамика отдельных липидных классов и ЖК общих липидов мышц молоди L4 стадии указывает на их переходный образ жизни, который обеспечивается высоким темпом липидного метаболизма. Индикаторами этого процесса является изменение ТАГ и некоторых ЖК пищевого происхождения, которые обеспечивают поддержание плавательной функции мышц молоди в течение суток, а также свидетельствуют об их активности, связанной, по-видимому, с вертикальными миграциями.
В пользу различий двигательной активности у исследованной молоди лептоклинуса свидетельствует динамика активности ферментов энергетического и углеводного обмена. На ранних стадиях развития (L2) молоди уровень аэробного обмена, определяемого по активности ЦО, выше по сравнению с таковым у рыб L3 и L4 стадий развития. Увеличение уровня аэробного обмена у рыб L5 стадии развития может быть связано с переходом на другие объекты питания при перемещении в толще воды (с пелагиали ко дну). При этом продемонстрировано, что вне зависимости от времени суток активность ЛДГ увеличивается и наиболее высокая у рыб старших возрастных групп. Это указывает на то, что уровень анаэробного обмена и использование углеводов в гликолизе увеличивается у рыб с возрастом, что связно с повышенными потребностями в энергии для осуществления активности у более крупных рыб. Согласно результатам исследований, проведенных на атлантической треске (Couture et al., 1998; Koedijk et al., 2010), молоди сайды (Mathers et al., 1992), пятнистой зубатке (Imsland et al., 2006), радужной форели (Чурова и др., 2010) и мальках лосося (Чурова и др., 2015), активность ЛДГ в мышцах белых рыб положительно коррелирует с их массой и длиной тела, а также с темпом их роста.
Относительно суточной динамики активности ферментов обнаружено, что уровень активности ферментов углеводного обмена ЛДГ и альдолазы у рыб L3 и L4 стадий выше в ночное время, что указывает на увеличение уровня анаэробного обмена в данный период суток, связанное с пищевой активностью. На стадии L3 возрастание анаэробного обмена в ночное время суток происходит наряду с аэробным. Таким образом, повышение уровня использования углеводов у особей на стадии L3 связано c их расходом в процессах аэробного и анаэробного синтеза АТФ. Следует отметить, что различия по активности ЛДГ и альдолазы более выражены у особей на стадии L4 (в 3 и 2 раза соответственно), что согласуется с данными липидного анализа и выделяет эту стадию среди других по энергетическому статусу.
Ранее было показано, что активность некоторых ферментов различается у рыб разных экологических групп по местообитанию – пелагических, демерсальных или глубоководных, что связывают с различиями в локомоторной активности и уровнем аэробного обмена (Sullivan, Somero, 1980; Somero, Childress, 1990; Drazen, Seibel, 2007). Более того установлено, что образ жизни определяет скорость энергетического обмена, его возрастание в ряду от медленно плавающих рыб до пелагических, стайных и активных рыб: Pleuronectes platessa – Gryptocephalus cynoglossus – Anarhichas lupus – Gadus morhua. Тем самым, высокие энергетические затраты у активных рыб, обусловленные экологическими особенностями обитания вида, экологические особенности обитания вида, связаны с высокой скоростью энергетического обмена (Винберг, 1976; Карамушко, 2007).
Таким образом, обнаруженная динамика ОЛ и их липидных классов в мышцах молоди демонстрирует их важную роль в развитии метаболических адаптаций, соответствующих стадии развития, а также косвенно свидетельствует о генетической детерминированности молоди в ответ на суточный цикл (ночное и дневное время), сопряженной с особенностями функционирования биоты и трофическими взаимодействиями у молоди лептоклинуса в условиях полярной ночи зимой. Адаптивные изменения липидов затрагивают пелагическую стадию развития L2, а к переходной стадии L4 эти различия уже четко выражены. Установленные различия в активности ферментов энергетического обмена в дневное и ночное время связаны с динамикой пищевой активности. Это свидетельствует о том, что, постепенный переход с эндогенного типа питания на экзогенный, и смена образа жизни молоди лептоклинуса сопровождаются началом ее активного взаимодействия со средой обитания, в частности, с формированием суточных ритмов в обмене веществ, связанных со световым режимом, питанием и двигательной активностью. Установлено, что ЖК-спектр напрямую отражает возрастные и сезонные особенности питания молоди лептоклинуса пятнистого. Суточная динамика липидных компонентов и различия в активности ферментов анаэробного обмена могут рассматриваться как один из механизмов генетически детерминированной онтогенетической и экологически ориентированной фенотипической разнокачественности жизненной стратегии вида, направленной на поддержание его существования в конкретных условиях среды и адаптацию к ним на разных уровнях организации живого.
Список литературы
Андрияшев А.П. Рыбы северных морей СССР. М., Л.: Изд-во АН СССР, 1954. 566 с.
Винберг Г.Г. Зависимость энергетического обмена от массы тела у водных пойкилотермных животных // Журн. общ. биол. 1976. Т. 37. № 1. С. 56–69.
Долгов А.В., Бензик А.Н. Пищевые рационы и потребление пищи у черного палтуса Баренцева моря // Вестник Мурманского государственного технического университета. 2012. Т. 15. № 3. С. 509–516.
Карамушко Л.И. Биоэнергетика рыб северных морей. М.: Наука, 2007. 256 с.
Колб В.Г., Камышников В.С. Клиническая биохимия. Пособие для врачей-лаборантов. Минск, Беларусь, 1976. 312 с.
Кочетов Г.А. Практическое руководство по энзимологии. М.: Высш. шк., 1980. 272 с.
Мурзина С.А. Роль липидов и их жирнокислотных компонентов в биохимических адаптациях люмпена пятнистого Leptoclinus maculatus F. северо-западного побережья о. Шпицберген: Дис. … канд. биол. наук. Петрозаводск, 2010. 184 с.
Мухина Н.В., Долгов А.В. Состав и структура ихтиоценоза Баренцева моря на ранних стадиях онтогенеза по данным российских ихтиопланктонных съемок 1959–1993 годов // Вестник Мурманского государственного университета. 2012. С. 818–826.
Немова Н.Н., Мурзина С.А., Нефедова З.А. и др. Липидный статус двух массовых видов веслоногих рачков рода Calanus архипелага Земля Франца-Иосифа // Сборник статей “Поисковые фундаментальные научные исследования в интересах развития Арктической зоны Российской Федерации”. 2014. С. 1–10.
Новак И. Количественный анализ методом газовой хроматографии. М.: Мир, 1978. 180 с.
Пеккоева С.Н. Изменение липидного состава мышц и липидного мешка представителя арктической ихтиофауны люмпена пятнистого Leptoclinus maculatus в постэмбриональном развитии: Дис. … канд. биол. наук. СПб., 2018. 164 с.
Пеккоева С.Н., Мурзина С.А., Иешко Е.П. и др. Экологические группы арктическо-бореального вида люмпена пятнистого Leptoclinus maculatus (Fries, 1838) в процессах роста и раннего развития // Экология. 2018. № 3. С. 225–233.
Пеккоева С.Н., Мурзина С.А., Нефедова З.А. и др. Экологическая роль липидов и жирных кислот в раннем постэмбриональном развитии люмпена пятнистого Leptoclinus maculatus (Fries, 1838) из Конгсфьорда (о. Западный Шпицберген) в зимний период // Экология. 2017а. № 3. С. 186–191.
Пеккоева С.Н., Мурзина С.А., Нефедова З.А. и др. Роль фосфолипидов в развитии молоди арктическо-бореального вида Leptoclinus maculatus (Stichaeidae) // Вопросы ихтиологии. 2017б. Т. 57. № 4. С. 467–471.
Пеккоева С.Н., Мурзина С.А., Нефедова З.А. и др. Липидный статус беломорской сельди Clupea pallasii marisalbi Berg Двинского залива Белого моря в осенний сезон // Труды Карельского научного центра РАН. Экспериментальная биология. 2014. № 5. С. 86–94.
Сидоров В.С., Лизенко Е.И., Болгова О.М. и др. Липиды рыб. 1. Методы анализа. Тканевая специфичность ряпушки Coregonus albula L. // Лососевые (Salmonidae) Карелии. Петрозаводск: Карел. Фил. АН СССР, 1972. Вып. 1. С. 152–163.
Чурова М.В., Мещерякова О.В., Немова Н.Н. и др. Соотношение роста и некоторых биохимических показателей рыб на примере микижи (Parasalmo mykiss Walb.) // Известия РАН. Сер. Биол. 2010. № 3. С. 289–299.
Чурова М.В., Мещерякова О.В., Веселов А.Е. и др. Активность ферментов энергетического и углеводного обмена и уровень некоторых молекулярно-генетических показателей у молоди лосося (Salmo salar L.) различающейся возрастом и массой // Онтогенез. 2015. Т. 46. № 5. С. 304–312.
Шталь Э. Хроматография в тонких слоях. М.: Мир, 1965. 508 с.
Berge J., Renaud P.E., Darnis G. et al. In the dark: A review of ecosystem processes during the Arctic polar night // Progress in Oceanography. 2015. V. 139. P. 258–271.
Couture P., Dutil J.D., Guderley H. Biochemical correlates of growth and condition in juvenile Atlantic cod (Gadus morhua) from Newfoundland // Canadian J. Fisheries and Aquatic Sciences. 1998. V. 55(7) P. 1591–1598.
Drazen J.C., Seibel B.A. Depth-related trends in metabolism of benthic and benthopelagic deep-sea fishes // Limnol. Oceanogr. 2007. V. 52. P. 2306–2316.
Engelbrecht F.M., Mari F., Anderson J.T. Cholesterol determination in serum. A rapid direction method // S.A. Med. J. 1974. V. 48. № 7. P. 250–356.
Folch J., Lees M., Sloan-Stanley G.H. A simple method for the isolation and purification of total lipids animal tissue (for brain, liver and muscle) // J. Biol. Chem. 1957. V. 226. P. 497–509.
Imsland A.K., Le Francois N.R., Lammare S.G. et al. Myosin expression levels and enzyme activity in juvenile spotted wolfish (Anarhichas minor) muscle: a method for monitoring growth rates // Can J. Fish Aquat. Sci. 2006. V. 63. P. 1959–1967.
Keats D.W., Steele D.H., Green J.M. et al. Diet and population size of the Arctic shanny, Stichaeus punctatus (Pisces: Stichaeidae), at sites in eastern Newfoundland and the eastern Arctic // Environ Biol Fish. 1993. V. 37. P. 173–180.
Koedijk R.M., Le François N.R., Blier P.U. et al. Ontogenetic effects of diet during early development on growth performance, myosin mRNA expression and metabolic enzyme activity in Atlantic cod juveniles reared at different salinities // Comparative Biochemistry and Physiology Part A: Mole-cular & Integrative Physiology. 2010. 156(1): 102–109. https://doi.org/10.1016/j.cbpa.2010.01.007
Kolpakov N.V., Klimkin A.F. Specific features of biology of shannies Stichaeus grigorjewi and S. nozawae (Stichaeidae) in waters of Northern Primorye // J. Ichthyology. 2004. V. 44. № 8. P. 592–599.
Last K., Hobbs L., Berge J. et al. Moonlight drives ocean-scale mass migration of zooplankton during the Arctic winter // Current Biology. 2016. V. 26. № 2. P. 244–251.
Mathers E.M., Houlihan D.F., Cunningham M.J. Nucleic acid concentrations and enzyme activities as correlates of growth rate of the saithe Pollachiusvirens: growth-rate estimates of open-sea fish // Marine Biology. 1992. V. 112. P. 363–369.
Meyer Ottesen C.A., Haakon H., Falk-Petersen S. et al. Growth of daubed shanny (Teleostei: Leptoclinus maculatus) in Svalbard waters // Polar Biology. 2014. V. 37. P. 809–815.
Meyer Ottesen C.A., Haakon H., Schou Christiansen J. et al. Early life history of the daubed shanny (Teleostei: Lepticlinus maculatus) in Svalbard waters // Marine Biodiversity. 2011. V. 41. № 3. P. 383–394.
Miki T., Yoshida H., Amaoka K. Rare stichaeid fish, Pseudoalectrias tarasovi (Popov), from Japan and its larvae and juveniles // Bull. Fish Sci. Hokkaido Univ. 1987. V. 38. P. 1–13.
Murzina S.A., Falk-Petersen S., Nemova N.N. Lipids in the arctic fish, Leptoclinus maculatus larvae // Chemistry and Physics of Lipids. 2008. V. 154. № S. P. S26.
Murzina S.A., Meyer Ottesen C.A., Falk-Petersen S. et al. Oogenesis and lipids in gonad and liver of daubed shanny (Leptoclinus maculatus) females from Svalbard waters // Fish Physiology and Biochemistry. 2012. V. 38. № 5. P. 1393–1407.
Ochiai T., Fuji A. Energy Transformations by a Blenny (Opisthocentrus ocellatus) population of Usu Bay, Southern Hokkaido // Bulletin of the Faculty of Fisheries Hokkaido University. 1980. V. 31. № 4. P. 314–326.
Smith C., Wootton R.J. Parental energy expenditure of the male three-spined stickleback // J. Fish Biology. 1999. V. 54. P. 1132–1136.
Somero G.N., Childress J.J. Scaling of ATP-supplying enzymes, myofibrillar proteins and buffering capacity in fish muscle: relationship to locomotory habit // J. Exp. Biol. 1990. V. 149. P. 319–333.
Somero G.N., Childress J.J. A violation of the metabolism-size scaling paradigm: activities of glycolytic enzymes in muscle increase in larger size fish // Physiol. Zool. 1980. V. 53. P. 322–337. https://doi.org/10.1086/physzool.53.3.30155794
Sullivan K.M., Somero G.N. Enzyme activities of fish skeletal muscle and brain as influenced by depth of occurrence and habits of feeding and locomotion // Marine Biology. 1980. V. 60. P. 91–99.
Walsh D.E., Banasik O.J., Gilles K.A. Thin-layer chromatographic separation and colorimetric analysis of barley or malt lipid classes and their fatty acids // Chromatography. 1965. V. 17. № 2. P. 78–85.
Дополнительные материалы отсутствуют.



