Онтогенез, 2020, T. 51, № 3, стр. 163-176
Программируемая клеточная гибель при формировании зародышевого мешка и семени
Т. В. Доронина a, *, Е. В. Шеваль a, b, Е. М. Лазарева a
a Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, ул. Ленинские Горы, 1, стр. 12, Россия
b НИИ физико-химической биологии им. А.Н. Белозерского МГУ им. М.В. Ломоносова
119234 Москва, Ленинские Горы, 1, стр. 40, Россия
* E-mail: matveevatatiana.94@yandex.ru
Поступила в редакцию 24.06.2019
После доработки 16.01.2020
Принята к публикации 20.01.2020
Аннотация
Программируемая клеточная гибель вовлечена в реализацию программы онтогенеза любого растения. При формировании и созревании тканей семени программируемая клеточная гибель является ключевым фактором элиминации клеток, позволяющим развиваться новым структурам. В обзоре обсуждаются данные о морфологических и биохимических особенностях программируемой клеточной гибели в ходе онтогенеза зародышевого мешка и семени.
ВВЕДЕНИЕ
Важную роль в процессах формирования и обновления тканей многоклеточных организмов, ответе на проникновение патогенов и стрессорные воздействия и т.п. играют процессы программируемой клеточной гибели (ПКГ). ПКГ, обеспечивая элиминацию клеток и тканей, выполнивших свою функцию, является ключевым инструментом многих морфогенезов. У растений значимую роль ПКГ играет при формировании зародышевого мешка и семени. В ходе развития семени происходит большое количество перестроек тканей, при этом часть клеток элиминируется, что обеспечивается ПКГ. Погибает часть образовавшихся при мейозе мегаспор, при оплодотворении происходит гибель синергид, до или вскоре после оплодотворения погибают антиподальные клетки. В процессе развития семени погибает часть клеток подвеска, нуцеллуса, эндосперма и интегументов (Van Hautegem et al., 2015; Hunt, McCabe, 2017). Без ПКГ невозможно правильное формирование тканей полноценного зародышевого мешка и семени у всех без исключения покрытосеменных растений. Семя необходимо любому растению для размножения, расселения, а, следовательно, и для сохранения биологических видов растений.
У растений, как и у животных, выявлены различные типы ПКГ (Van Doorn et al., 2011), однако биохимические механизмы, лежащие в их основе, и связанные с ними морфологические изменения клеток и тканей изучены слабо. В отличие от аналогичных обзоров (Van Hautegem et al., 2015), где сделан акцент на молекулярных аспектах ПКГ, данный обзор является попыткой систематизировать и морфологические особенности гибели клеток тканей женского гаметофита (зародышевого мешка) и формирующегося семени, и молекулярные механизмы регуляции этих процессов.
КЛАССИФИКАЦИЯ ПКГ РАСТЕНИЙ
Если классификация ПКГ у животных постоянно пересматривается и уточняется (Galluzzi et al., 2018), то общепринятой классификации ПКГ растений в настоящее время не существует. Варианты ПКГ у растений могут быть классифицированы на основании причин, которые их вызывают. Первый вариант – ПКГ при дифференцировке тканей и процессе старения (developmental-induced programmed cell death (dPCD)) ПКГ необходима для правильного формирования половины важнейших тканей растений – ксилемы, феллемы, отчасти флоэмы, склеренхимы, нуцеллуса, тапетума, подвеска, интегументов и др. (Daneva et al., 2016). Второй вариант – ПКГ, индуцируемая действием различных стрессовых факторов (environmental-induced programmed cell death (ePCD)) (Maizel, 2015). В результате анализа транскриптомов растений было показано, что в случае dPCD или ePCD экспрессируются разные гены (Olvera-Carrillo et al., 2015), следовательно, эти варианты ПКГ имеют существенные различия в молекулярных механизмах протекания.
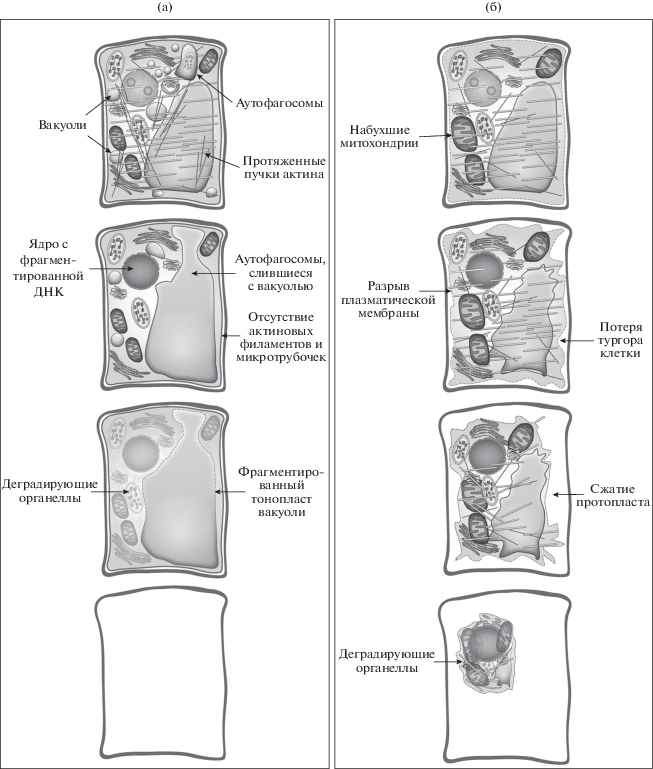
В 2011 году было предложено выделять два варианта ПКГ у растений – “вакуолярную клеточную гибель” и “программируемый некроз” (Van Doorn et al., 2011). Эти виды клеточной смерти были выделены на основании их морфологии, в отличие от вышеописанной функциональной классификации. В первую группу попали варианты ПКГ, при которых наблюдался лизис клетки вследствие разрыва тонопласта, во вторую группу – варианты, где лизиса не наблюдалось (рис. 1). Позднее Van Doorn назвал эти варианты “автолитической” и “неавтолитической” гибелью (Van Doorn, 2011). Некоторые варианты сочетают в себе черты “автолитической” и “неавтолитической” гибели (Van Doorn et al., 2011).
Рис. 1.
Строение клеток растений в процессе программируемой клеточной гибели. (а) – вакуолярная клеточная гибель (Van Doorn et al., 2011) или автолитическая клеточная гибель (Van Doorn, 2011). В клетках наблюдается интенсивная вакуолизация цитоплазмы, формирование аутофагосом, сливающихся с литической вакуолью, формирование длинных тяжей актиновых филаментов. Затем микротрубочки и актиновые филаменты деполимеризуются, происходит фрагментация ДНК, разрыв тонопласта вакуоли приводит к деградации органелл. (б) – программируемый некроз (Van Doorn et al., 2011), или неавтолитическая клеточная гибель (Van Doorn, 2011), или апоптоз-подобная гибель (Reape, McCabe, 2013). В клетках происходит набухание митохондрий, разрыв плазматической мембраны, фрагментация ДНК. Клетка теряет тургор, протопласт отходит от клеточной стенки и сжимается, органеллы деградируют.
Частью физиологических процессов здорового организма у растений, как и у животных, является формирование аутофагосом для селективной деградации органелл. Аутофагосомы формируются и в ходе вакуолярной клеточной гибели у растений (Üstün et al., 2017; Wang et al., 2018). Была описана митофагия – деградация митохондрий; хлорофагия – деградация хлоропластов или частей хлоропластов (РУБИСКО – рибулозобисфосфаткарбоксилаза-содержащих телец); пексофагия – деградация пероксисом; ретикулофагия – деградация фрагментов эндоплазматического ретикулума (ЭПР); протеафагия – деградация протеасом, агрефагия – деградация убиквитинированных агрегатов белков и ксенофагия – деградация вирусных частиц (Üstün et al., 2017). При макроаутофагии происходит формирование мембраны аутофагосомы, которая окружает клеточный материал, обреченный на деградацию. Предполагается, источником мембран для аутофагосом является ЭПР (Zhuang et al., 2017). Аутофагосома траспортируется к литической вакуоли и сливается с ней, и там происходит окончательная деградация клеточного материала (Hofius et al., 2011). Как и у животных, у растений в регуляцию аутофагии вовлечены ATG-гены (autophagy-related genes) (Hofius et al., 2011). При индукции вакуолярной клеточной гибели происходит формирование большого количества аутофагосом, впоследствии сливающихся с вакуолью (Minina et al., 2013). На финальных этапах происходит разрыв тонопласта и деградация всего протопласта с органеллами, а иногда и клеточной стенки (Van Doorn et al., 2011). Необходимо отметить, что у животных аутофагия выделена в отдельный вид клеточной гибели (Galluzzi et al., 2018). Некоторые авторы называют вакуолярную клеточную гибель у растений аутофагической. Термин “вакуолярная клеточная гибель” употребляется значительно чаще, чем “аутофагическая гибель”, однако нельзя исключить, что этот вариант гибели (или какая-то часть случаев, относимых сейчас к этому варианту ПКГ) являются аналогом аутофагической гибели у животных.
При неавтолитической клеточной гибели (“программируемом некрозе” по классификации Van Doorn (Van Doorn et al., 2011)) плазматическая мембрана разрывается и отходит от клеточной стенки, протопласт сжимается (Reape, McCabe, 2008; Kacprzyk et al., 2011). При этом происходит значительная конденсация хроматина, фрагментация ДНК, расширение цистерн ЭПР и выход цитохрома с из митохондрий (Reape, McCabe, 2008). Reape и McCabe выступили с критикой предложенного Van Doorn термина “программируемый некроз”. По их мнению, некроз кроме разрыва мембран сопровождается набуханием органелл и клетки, вакуолизацией цитоплазмы, а вариант гибели, описанный Van Doorn, характеризуется, напротив, сжатием протопласта и его отхождением от клеточной стенки, а также выходом цитохрома с из митохондрий, что роднит этот тип гибели с апоптозом. Поэтому ими был предложен термин “апоптоз-подобная гибель” вместо термина “программируемый некроз” (Reape, McCabe, 2013).
Общепринятой классификации ПКГ растений в настоящее время не создано. В этой ситуации многие авторы даже не пытаются отнести конкретные варианты к определенному типу ПКГ, ограничиваясь описанием и анализом происходящих морфологических и биохимических событий.
ФОРМИРОВАНИЕ ЗАРОДЫШЕВОГО МЕШКА И СЕМЕНИ
Морфология клеток при формировании зародышевого мешка изучена очень подробно (Johri et al., 2013). Описаны несколько типов развития зародышевого мешка, наиболее распространено развитие по типу Polygonum (рис. 2а). Так развиваются, например, зародышевые мешки злаков и Arabidopsis. В результате мейотического деления мегаспороцита формируются четыре мегаспоры, три из которых погибают, а оставшаяся мегаспора делится митотически, формируя ценоцит зародышевого мешка, содержащий восемь ядер. После целлюляризации формируются семь клеток: яйцеклетка и две синергиды, составляющие яйцевой аппарат, три антиподальные клетки и двуядерная центральная клетка (Yadegaria, Drews, 2004).
Рис. 2.
Начальные этапы эмбриогенеза семени у Arabidopsis thaliana и злаков. (а) – этапы формирования зародышевого мешка. Мегаспороцит делится мейотически, из образовавшихся четырех мегаспор три гибнут. Оставшаяся мегаспора в результате митотических делений дает начало восьми ядрам зародышевого мешка. В ходе целлюляризации формируется семь клеток – яйцеклетка, две синергиды, центральная клетка с двумя полярными ядрами и три антиподальные клетки. (б) – двойное оплодотворение. Пыльцевая трубка подходит к синергиде. Один из спермиев сливается с яйцеклеткой, давая начало зиготе, а другой – с центральной клеткой зародышевого мешка, формируя эндосперм. (в) – схема строения семяпочки.
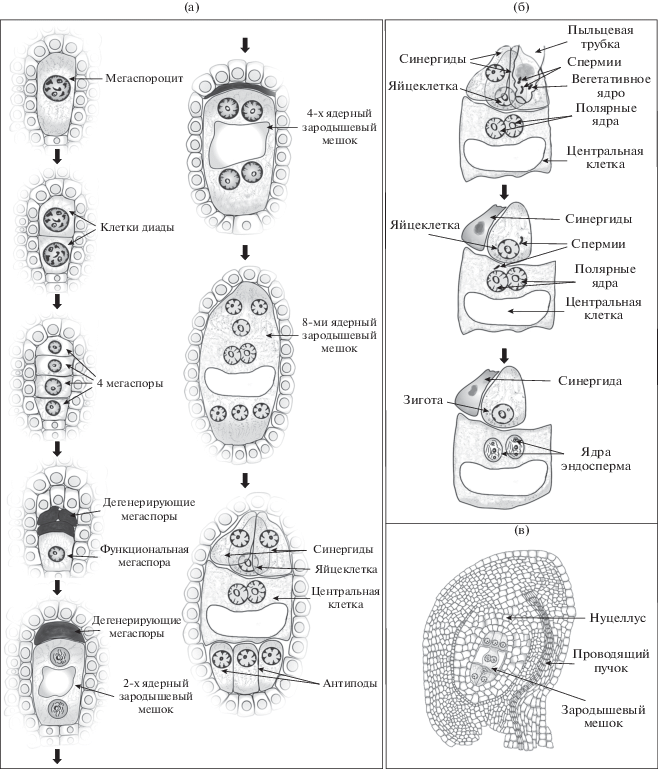
В ходе оплодотворения содержимое пыльцевой трубки, внутри которой находится два спермия, попадает в зародышевый мешок (Hamamura et al., 2012). Один из спермиев сливается с ядром яйцеклетки, другой – с ядром центральной клетки. В результате делений зиготы формируется зародыш, в результате деления оплодотворенной центральной клетки – эндосперм (рис. 2б). Таким образом, после оплодотворения семязачаток содержит ткани различной плоидности – диплоидный зародыш, интегументы, нуцеллус, триплоидный эндосперм и иногда (например, у злаков) гаплоидные антиподальные клетки (рис. 2в).
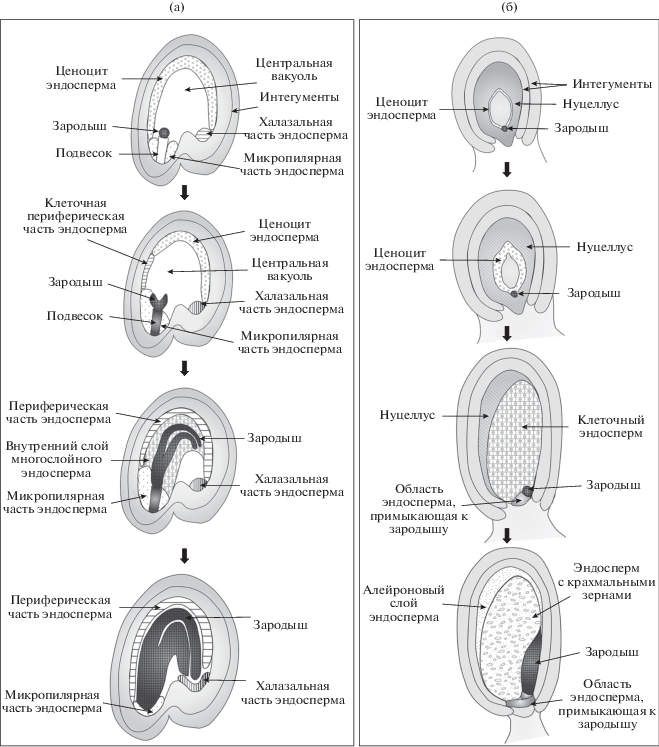
Хорошо изучено строение тканей семяпочки у Arabidopsis и злаков (рис. 3). При делении зиготы одна из клеток дает начало зародышу, другая – подвеску. Подвесок выполняет трофическую функцию, и связывает зародыш с тканями формирующегося семени (Peng, Sun, 2018). Зародыш в развитии проходит несколько стадий. Данные о дифференцировке ценоцита эндосперма у злаков и Arabidopsis обобщены в обзоре Olsen (Olsen, 2004). После двойного оплодотворения ядро первичной клетки эндосперма ядра злаков (рис. 3б) делится без цитокинеза, затем начинается процесс целлюляризации. Позднее в части клеток многослойного эндосперма накапливаются крахмальные зерна, другие клетки дифференцируются в алейроновый слой. У Arabidopsis (рис. 3а) ценоцитный эндосперм также претерпевает процесс целлюляризации, впоследствии большая часть эндосперма абсорбируется растущим зародышем и сохраняется три области – однослойная периферическая область, область, окружающая зародыш, и халазальная область (Olsen, 2004; Locascio et al., 2014).
Рис. 3.
Развитие семени Arabidopsis thaliana и Zea mays. На схеме представлены последовательные стадии дифференцировки тканей формирующегося семени. (а) – формирование семени Arabidopsis thaliana. По мере роста зародыша большая часть эндосперма подвергается ПКГ и абсорбируется, остаются три области – периферическая, микропилярная и халазальная. (б) – формирование семени Zea mays. В процессе развития семени эндосперм разрастается и дифференцируется на центральную область и алейроновый слой. Позднее, при прорастании, клетки алейронового слоя эндосперма выделяют гидролазы, которые делают вещества крахмального эндосперма доступными для зародыша.
ГИБЕЛЬ МЕГАСПОР
При развитии восьмиядерного двухполюсного зародышевого мешка в микропилярной области нуцеллуса выделяется мегаспороцит, из которого в результате мейоза формируются четыре мегаспоры. Три из четырех мегаспор погибают, оставшаяся дает начало клеткам зародышевого мешка (Yadegaria, Drews, 2004).
ПКГ нефункциональных мегаспор Zea mays сопровождается агрегацией гетерохроматина на периферии ядра, отхождением плазмалеммы от клеточной стенки, образованием вакуолей, сливающихся с плазмалеммой (Russell, 1979). Позднее разрушается плазмалемма, ядерная оболочка и тонопласт. Перед окончательной деградацией в цитоплазме выявляются липидные тела и осмиофильные массы (Russell, 1979). При гибели мегаспор Tillandsia aeranthos и Tillandsia meridionalis происходит формирование аутофагосом и значительная вакуолизация цитоплазмы, в ядре выявляются многочисленные блоки гетерохроматина, происходит фрагментация ДНК, выявляемая методом TUNEL, ЭПР набухает, в цитоплазме присутствуют липидные тела (Papini et al., 2011). По мнению авторов, клеточная гибель мегаспор у Tillandsia сочетает в себе признаки аутофагической (формирование большого количества вакуолей и аутофагосом), некротической (набухание эндоплазматического ретикулума) и апоптотической (фрагментация ДНК) (Papini et al., 2011).
Мало изучены причины, определяющие судьбу мегаспор. Имеются косвенные гистохимические данные об участии Сa2+ в регуляции гибели нефункциональных мегаспор Lactuca sativa (Qiu et al., 2008). В клеточных стенках гибнущих мегаспор Zea mays, Tillandsia, Arabidopsis при выборе функциональной мегаспоры каллозная оболочка вокруг нее растворяется в первую очередь и дольше сохраняется у нефункциональных мегаспор (Russell, 1979; Papini et al., 2011; Demesa-Arevalo, Vielle-Calzada, 2013). Предполагается, что арабиногалактанный белок AGP18 (arabinogalactan protein) Arabidopsis может определять судьбу мегаспор, т.к. повышение экспрессии гена AGP18 в трансформированных растениях ведет к выживанию всех четырех мегаспор (Cao et al., 2018). Кроме того, на экспрессирующих ICK4-YFP растениях Arabidopsis было показано, что в дегенерирующих мегаспорах выявляется ингибитор циклин-зависимых киназ ICK4/KRP (inhibitor of cyclin kinases/Kip-related proteins), который отсутствует в функциональной мегаспоре, давая ей развиваться дальше (Demesa-Arevalo, Vielle-Calzada, 2013). В настоящее время не получено данных об участии протеаз и гормонов в ПКГ мегаспор.
ПКГ избыточных мегаспор позволяет направить все ресурсы растения на поддержание жизнедеятельности одной мегаспоры, которая впоследствии сформирует зародышевый мешок.
ГИБЕЛЬ СИНЕРГИД
Синергиды погибают в ходе двойного оплодотворения. Между синергидами и пыльцевой трубкой существуют сложные молекулярные взаимодействия. Cинергиды выделяют аттрактанты для пыльцевой трубки и определяют необходимое направление роста пыльцевой трубки (Higashiyama, Takeuchi 2015; Dresselhaus et al., 2016). В свою очередь, наличие пыльцевой трубки вызывает гибель синергид. У разных видов растений гибель рецептивной синергиды наступает в разное время. У многих видов растений гибель синергиды наступает без контакта с пыльцевой трубкой (Christensen et al., 1997). У Arabidopsis thaliana гибель синергиды происходит после того, как пыльцевая трубка достигла зародышевого мешка и вступила в контакт с синергидой (Leydon et al., 2015). При отсутствии пыльцевой трубки гибель синергид Arabidopsis не наступает (Christensen et al., 1997). После слияния спермия и яйцеклетки начинается дегенерация второй синергиды.
Описаны различные морфологические картины, сопровождающие ПКГ у синергид: вакуолизация цитоплазмы у Nicotiana tabacum (Tian, Russell, 1997), разрыв вакуоли у Proboscidea louisianica (Mogensenl, 1978), Penniseturn glaueum (Chaubal, Reger, 1993), Nicotiana tabacum (Huang, Russell, 1994), Helleborus bocconei (Bartoli et al., 2017), деформация ядра, конденсация хроматина у Triticum aestivum (An, You, 2004), фрагментация ДНК (TUNEL-позитивная реакция ядер) Helleborus bocconei (Bartoli et al., 2017). В ходе ПКГ синергид Torenia fournieri и Nicotiana tabacum агрегаты актина выявлялись в виде электронно-плотных комплексов, называемых “коронами”, в области деградирующей синергиды (Huang, Russell, 1994; Fu et al., 2000). Один из агрегатов актина был локализован со стороны яйцеклетки, другой располагался на халазальном конце денегерирующей синергиды. Авторы предполагают, что актиновые “короны” определяют место вхождения спермиев в яйцеклетку (Huang, Russell, 1994).
В цитоплазме гибнущих синергид Triticum aestivum и Penniseturn glaueum (Chaubal, Reger, 1992a, 1992b; Chaubal, Reger, 1993), Nicotiana tabacum (Tian, Russell, 1997), Arabidopsis (Ngo et al., 2014) выявлено повышение содержания Ca2+. Остановка роста пыльцевой трубки и разрыв ее кончика у Arabidopsis регулируется кальций-опосредованным сигнальным путем, контролируемым киназой FERONIA, что было показано на мутантных растениях по гену FER (Kessler et al., 2010). Предполагается, что FERONIA и трансмембранный белок NORTIA кроме проникновения пыльцевой трубки контролируют и клеточную гибель синергид (Kessler et al., 2010). Арабиногалактанный белок 4 AGP4 (arabinogalactan protein), JAGGER, предотвращает прорастание множественных пыльцевых трубок у Arabidopsis thaliana и может быть вовлечен в регуляцию гибели синергид, т.к. у нокаутных мутантов по гену AGP4, кодирующему белок JAGGER синергиды выживают (Pereira et al., 2016). ПКГ синергид Arabidopsis сопровождается активацией белка J-domain-containing protein GFA2, выполняющего роль шаперона в матриксе митохондрий (Christensen, 2002). Показано, что после оплодотворения запускается этилен-зависимый сигнальный путь, регулируемый транскрипционными факторами EIN3 и EIN2 (ethylene insensitive) и необходимый для ПКГ синергид у Arabidopsis. Инъекция эндогенного предшественника этилена (ACC, 1-aminocyclopropane-1-carboxylic acid) вызывает преждевременную гибель синергид (Völz et al., 2013). Данных об участии протеаз в ПКГ синергид нет.
ГИБЕЛЬ АНТИПОД
У большинства видов растений антиподы существуют недолго и дегенерируют вскоре после оплодотворения. До оплодотворения дегенерируют все три антиподальные клетки у Arabidopsis thaliana (Yadegaria, Drews, 2004). Антиподальные клетки злаков многократно делятся и образуют многоклеточную эфемерную ткань до оплодотворения. Для некоторых видов растений, особенно злаков, характерно формирование политенных хромосом в ядрах антиподальных клеток (Zhimulev, 1996). Точные функции антипод не ясны, но, поскольку при нарушении развития антипод эндосперм формируется неправильно, предполагается, что у злаков они могут выполнять трофическую и защитную функцию, обеспечивая эндосперм необходимыми веществами на неклеточной стадии развития (Engell, 1994; Chaban et al., 2011; Доронина, 2019).
Морфология антиподальных клеток злаков при ПКГ мало изучена. Так, у Hordeum vulgare и Orysa sativa при гибели ядерная мембрана формирует инвагинации, хроматин агрегирует (Engell, 1994; Maeda, Miyake, 1996). У гибнущих антипод пшеницы наблюдается уплотнение хроматина, уплощение ядер, разрывы в ДНК, выявляемые методом TUNEL (Chaban et al., 2011). Предполагается, что индуктором ПКГ антиподальных клеток злаков является целлюляризация ценоцита эндосперма (Chaban et al., 2011). Однако в современной литературе отсутствуют какие-либо биохимические характеристики ПКГ антиподальных клеток злаков.
Выяснены некоторые аспекты регуляции гибели антиподальных клеток Arabidopsis, которые погибают до опыления (Heydlauff, Groß-Hardt, 2014). Показано, что у нокаутных мутантов по генам факторов факторов сплайсинга м-РНК LACHESIS, CLOTHO и ATROPOS антиподальные клетки Arabidopsis локализованы в центре зародышевого мешка, их мембраны и ядра объединены, образовавшаяся клетка сходна с центральной клеткой (Heydlauff, Groß-Hardt, 2014). Предполагается, что белок GCD1 (GAMETE CELL DEFECTIVE 1) и тРНК-синтаза SYCO ARATH (кодируемая геном FIONA) митохондрий центральной клетки способствуют созреванию яйцеклетки и гибели антипод, т.к. у мутантов по генам FIONA и GCD1 антиподальные клетки выживают (Kagi et al., 2010). Экспрессия митохондриального белка aac2A199D в яйцеклетке вызывает гибель антипод, а его экспрессия в центральной клетке предотвращает их гибель (Wu et al., 2012). Показано, что у трасгенных растений Arabidopsis с повышенной экспрессией гена биосинтеза ауксина YUC ПКГ антиподальных клеток не наступает. Поэтому предполагается, что синтез ауксинов препятствует гибели антиподальных клеток у Arabidopsis (Pagnussat et al., 2009). До сих пор не показано участие протеаз в ПКГ антипод.
ГИБЕЛЬ ПОДВЕСКА
Подвесок – специализированная структура, удерживающая зародыш в семени и участвующая в поддержании его жизнедеятельности, обеспечивая питательными и ростовыми веществами (Kawashima, Goldberg, 2010). В ядрах клеток подвеска Phaseolus формируются политенные хромосомы, что свидетельствует об их высоком уровне метаболической активности (D’Amato, 2011).
Гибель клеток подвеска у голосеменных растений изучалась у Picea abies (Filonova et al., 2000; Smertenko et al., 2003; Bozhkov et al., 2005; Minina et al., 2013). Показано, что она сопровождается фрагментацией ДНК (Filonova et al., 2000; Bozhkov et al., 2005). В ходе ПКГ в цитоплазме выявляются короткие пучки микротрубочек и агрегаты тубулина, которые впоследствии деградируют, микрофиламенты формируют толстые протяженные пучки (Smertenko et al., 2003), было показано формирование аутофагосом (Minina et al., 2013). В процесс ПКГ подвеска у Picea abies вовлечена протеаза, активность которой выявляется по расщеплению модельного пептида Val-Glu-Ile-Asp (VEIDase activity), а также метакаспаза mcII-Pa, которая выявлена в цитоплазме и ядрах, содержащих разрывы ДНК (Bozhkov et al., 2005). Предполагается, что при гибели подвеска Picea abies mcII-Pa транспортируется в ядро и участвует в деградации ДНК. Активация метакаспазы mcII-Pa Picea abies ведет к активации аутофагии и ATG-генов, при этом формируются многочисленные аутофагосомы, впоследствии сливающиеся с вакуолью. В трасформированных растениях с подавленными генами mcII-Pa или ATG5 и ATG6, гибель происходит по механизму некроза (Minina et al., 2013).
В ходе ПКГ хроматин ядер клеток подвеска у Phaseolus и Tropaeolum пикнотизируется (Nagl, 1974), ядро теряет округлую форму, может происходить разрушение ядерной оболочки (Zhao et al., 2013). С использованием метода TUNEL была детектирована фрагментация ДНК при гибели клеток подвеска Zea mays (Giuliani et al., 2002), Vicia faba (Wredle et al., 2001), Phaseolus coccineus (Lombardi et al., 2007), Nicotiana tabacum (Zhao et al., 2013), Chenopodium quinoa (López-Fernández, Maldonado, 2013). У Chenopodium quinoa в ходе гибели клеток подвеска принимают участие рициносомы – специфические микротельца, которые происходят от ЭПР и содержат протеазу CysEP (Greenwood et al., 2005; López-Fernández, Maldonado, 2013). В клетках подвеска Phaseolus и Tropaeolum (Nagl, 1977; Gartner, Nagl, 1980), Vicia faba (Giuliani et al., 2002), Nicotiana tabacum (Zhao et al., 2013) в ходе ПКГ формируются аутофагосомы, сливающиеся с вакуолью. На финальных этапах происходит разрыв тонопласта вакуоли и деградация органелл.
В ходе гибели подвеска Nicotiana tabacum aктивируются катепсин-подобные протеазы, а также протеазы с субстратной специфичностью каспаз 1, 3 и 6, что было показано на основании расщепления ими синтетических пептидных субстратов (Zhao et al., 2013). ПКГ подвеска табака Nicotiana tabacum зависит от взаимодействия двух белков – цистатина NtCYS, являющегося ингибитором протеаз и его мишени, катепсин H-подобной протеазы NtCP14. NtCYS экспрессируется в подвеске вплоть до достижения зародышем стадии 32 клеток, после чего происходит активация катепсин H-подобной протеазы NtCP14 и наступает ПКГ (Zhao et al., 2013). Предполагается, что индуктором ПКГ клеток подвеска служат клетки растущего зародыша. Показано, что у мутантов по генам, регулирующим развитие Zea mays с неразвитым зародышем, но нормальным эндоспермом гибель клеток подвеска не наступает (Consonni et al., 2003). В пользу гипотезы о том, что индуктором ПКГ подвеска является зародыш, также свидетельствуют наблюдения о том, что у Phaseolus и Tropaeolum первыми погибают клетки базальной части подвеска, которые располагаются в непосредственной близости к зародышу (Nagl, 1974). Предполагается, что лизированный материал подвеска может использоваться клетками зародыша (Nagl, 1974).
Гибель клеток подвеска наступает после выполнения им своих функций, когда разросшийся зародыш уже заякорен в семяпочке.
ГИБЕЛЬ КЛЕТОК НУЦЕЛЛУСА
Нуцеллус – это мегаспорангий семенных растений, главная задача которого – образование мегаспор. У некоторых растений, например, у злаков и киноа, он опосредованно выполняет покровную и защитную функции. Не у всех растений нуцеллус разрушается целиком, например, у кувшинки и гречихи из него формируется перисперм, запасающая ткань, которая компенсирует слабое развитие эндосперма (Lu, Magnani, 2018).
Клеточная гибель большинства клеток нуцеллуса у Pinus densiflora сопровождается конденсацией хроматина, фрагментацией ДНК, сжатием протопласта, отошедшего от клеточной стенки, оставшиеся клетки образуют нуцеллярный колпачок (Hiratsuka et al., 2002).
У Arabidopsis гибнущие дистальные клетки нуцеллуса имеют разрушенную мембрану и сжатые протопласты, в клетках проксимальной области наблюдается накопление аутофагосом (Xu et al., 2016). При ПКГ нуцеллуса пшеницы Triticum aestivum (Dominguez et al., 2001) происходит фрагментация ДНК, выявляемая методом TUNEL. При этом увеличивается содержание гетерохроматина в ядре, внешняя ядерная мембрана фрагментируется. В цитоплазме выявляются многочисленные вакуоли с нарушенным тонопластом. Плотность матрикса митохондрий увеличивается, в матриксе наблюдаются агрегаты электронно-плотного материала, которые, по мнению авторов являются результатом деградации липидов внутренней мембраны. Цистерны ЭПР расширены, диктиосомы аппарата Гольджи долго сохраняют свою интактную структуру (Dominguez et al., 2001).
Lombardi с соавторами выделяли три области ассиметричного нуцеллуса у Sechium edule – проксимальную часть, непосредственно окружающую эндосперм, субдистальную и дистальную, располагающиеся над халазальной областью проксимального района и не граничащие с эндоспермом. Первыми гибнут клетки проксимального района нуцеллуса, непосредственно окружающих эндосперм, что позволило предположить, что индуктором клеточной гибели клеток нуцеллуса является эндосперм (Lombardi et al., 2012). Эндосперм выделяет NO и индолилуксусную кислоту (IAA), которые усиливают синтез этилена, вызывающего гибель клеток нуцеллуса. При удалении эндосперма из семязачатка ПКГ нуцеллуса не наступает. При добавлении экзогенного этилена к ткани нуцеллуса блок гибели частично снимается (Lombardi et al., 2012). Наряду с влиянием гормонов была показана активность каспаза-1- и каспаза-3-подобных протеаз, выявленных с помощью специфических субстратов в проксимальной и субпроксимальной области нуцеллуса и каспаза-6-подобной протеазы в проксимальном районе нуцеллуса (Lombardi et al., 2007). В результате протеомного анализа тканей нуцеллуса Ricinus communis выявлены многочисленные протеазы, принадлежащие к классам цистеиновых, сериновых, аспартатных и металлопротеаз (Nogueira et al., 2012). Среди них стоит особо отметить протеазу XSP I (xylem serine protease), принимающую участие в гибели клеток ксилемы (Buhtz et al., 2004) и VPE (vacuolar processing enzyme), принимающий участие в ПКГ разнообразных тканей растений (Hatsugai et al., 2015). При ПКГ нуцеллуса было показано повышение экспрессии генов некоторых гидролитических ферментов: например, аспартатной протеазы нуцеллина (Chen, Foolad, 1997), α-aмилазы AMY 4 (Radchuk et al., 2009), вакуолярного фермента нуцеллалина (Linnestad et al., 2009) у ячменя, катепсин-В-подобной протеазы (Domínguez, Cejudo, 1998) у пшеницы.
В ПКГ нуцеллуса Ricinus communis ключевую роль играют рициносомы, содержащие протеазу CysEP, имеющую терминальный KDEL мотив (Yang et al., 2012). Содержимое рициносом выбрасывается в цитоплазму, где активная протеаза CysEP участвует в разрушении содержимого клетки. В течение гибели наблюдается интенсивная вакуолизация цитоплазмы, фрагментация ДНК. На финальных стадиях гибели происходит разрыв тонопласта вакуоли, митохондрии и пластиды набухают, протопласт отходит от клеточной стенки (Greenwood et al., 2005).
На Arabidopsis было показано, что гибель клеток нуцеллуса связана с оплодотворением центральной клетки (Xu et al., 2016). У мутантов по гену KPL, содержащих только эндосперм, клетки нуцеллуса погибали, в отличие от мутантов, содержащих только зародыш. В неоплодотворенных семяпочках дегенерация нуцеллуса заблокирована Polycomb белками. При оплодотворении активируется транскрипционный фактор AGL62 (AGAMOUS-LIKE62), который снимает этот блок и активирует белки TT16 (TRANSPARENT TESTA 16) и GOA (GORDITA), которые вызывают гибель нуцеллуса (Xu et al., 2016). Белок MADS29 индуцирует гибель клеток нуцеллуса у Oryza sativa (Wan et al., 2002).
ПКГ нуцеллуса необходима для освобождения места для развивающегося эндосперма (Lu, Magnani, 2018).
ПКГ ПРИ ФОРМИРОВАНИИ СЕМЕННОЙ КОЖУРЫ
В клеточную гибель внутреннего интегумента семени у Brassica napus (Wan et al., 2002), и Jatropha curcas (Rocha et al., 2013; Shah et al., 2016; Rocha et al., 2018) и интегументов Arabidopsis (Ondzighi et al., 2008) вовлечены цистеиновые протеазы. PDI5 (protein disulfide isomerase), находясь в вакуолях клеток эндотелия Arabidopsis, ингибирует активность цистеиновой протеазы RD21. Со временем содержание PDI5 снижается, что способствует высвобождению протеаз и индукции гибели (Ondzighi et al., 2008).
У Arabidopsis первыми деградируют два слоя внутреннего интегумента, их гибель сопровождается плазмолизом и активацией цистеиновой протеазы VPE (Nakaune et al., 2005). Пока зародыш находится на ранних стадиях развития большую часть клеток внутреннего эпидермиса внутреннего интегумента Arabidopsis занимают вакуоли с белковым содержимым, в которых содержатся цистеиновые протеазы. Клеточная гибель сопровождается разрывом белковых вакуолей, выходом и активацией протеаз и деградацией клетки (Ondzighi et al., 2008). Гибель клеток внутреннего слоя интегумента Brassica napus сопровождается фрагментацией ДНК, вакуолизацией цитоплазмы (Bethke, Jones, 2001).
ГИБЕЛЬ ЭНДОСПЕРМА
Триплоидный эндосперм, как и зародыш, формируется в результате двойного оплодотворения. Эндосперм – главная запасающая ткань семени, накапливающая крахмал, масла и белки для питания зародыша. Эндосперм расходуется у всех растений, но в семенах с запасающим эндоспермом это происходит при прорастании семени, а в семенах с запасающим зародышем – при формировании семени.
В качестве модельных объектов для изучения ПКГ эндосперма, питательные вещества которого мобилизуются при прорастании, изучаются клетки эндосперма клещевины Ricinus communis и злаков.
У Ricinus communis в гибели клеток эндосперма участвуют рициносомы (Gietl et al., 2001; Schmid et al., 2001). В ходе гибели клеток эндосперма происходит фрагментация ДНК, разрыв тонопласта вакуоли, деградация митохондрий и пластид. На финальной стадии гибели из рициносом высвобождается цистеиновая протеаза CysEP, и, в закисленной за счет содержимого вакуолей цитоплазме происходит созревание CysEP. Активная протеаза CysEP вызывает окончательную деградацию клетки (Greenwood et al., 2005).
Развитие эндосперма в семенах злаков включает этапы пролиферации, накопления питательных веществ (прежде всего, крахмала) и программируемой клеточной гибели, происходящей на поздних этапах формирования семени (Domínguez, Cejudo, 2014). ПКГ клеток эндосперма с крахмалом у Triticum aestivum и Oryza sativa сопровождается деформацией ядра, конденсацией хроматина, распадом ядерной оболочки и вакуолизацией цитоплазмы (Chen et al., 2012). Одновременно в клетках повышается количество активных форм кислорода (АФК), и активируются антиоксидантные ферменты (каталаза, суперооксидодисмутаза, пероксидаза), которые не в состоянии справиться с нарастающим количеством АФК (Young et al., 2002; Cheng et al., 2016). После дегенерации ядра и фрагментации ДНК в клетках продолжают работать ферменты AGPP (ADP-glucose pyrophosphorylase), SSS (soluble starch synthase), GBSS (granule-bound starch synthase), SBE (Starch branching enzyme), отвечающие за синтез запасающих веществ (Chen et al., 2012).
Предполагается, что индуктором клеточной гибели эндосперма является этилен. Ингибиторы синтеза этилена (2-aminoethoxyvinyl glycine 1-methylcyclopropene) препятствуют гибели клеток эндосперма. Абсцизовая кислота, предотвращает наступление клеточной гибели эндосперма, когда вступает в антагонистические отношения с этиленом (Young et al., 2002). Гибберелиновая кислота увеличивает число гибнущих клеток эндосперма пшеницы (Kuo, 1996). Регуляторами клеточной гибели эндосперма Arabidopsis thaliana выступают факторы ZOU/RGE1 (bHLH TFs ZHOUPI/ RETARDED GROWTHOF EMBRYO 1) и ICE1 (INDUCER OF CBP EXPRESSION 1) (Denay et al., 2014).
В отличие от эндосперма, который подвергается процессу ПКГ на поздних стадиях развития семени, алейроновый слой вместе с зародышем остается живым в зрелом семени. После прорастания алейроновый слой участвует в синтезе гидролитических ферментов, необходимых для мобилизации питательных веществ из эндосперма. После выполнения этой функции запускается процесс ПКГ алейронового слоя (Domínguez, Cejudo, 2014). Гибель клеток алейронового слоя эндосперма Hordeum vulgare (Wang et al., 1996; Bethke, Jones, 2001; Bethke et al., 2007) и Triticum aestivum (Domínguez et al., 2001) сопровождается фрагментацией ДНК. Индуктором клеточной гибели алейронового слоя Triticum aestivum (Domínguez et al., 2001) выступает гибберелин, клеток культуры Hordeum vulgare – гибберелиновая кислота (Bethke, Jones, 2001). Абсцизовая кислота препятствует гибели клеток алейронового слоя эндосперма ячменя, что было показано при обработке абсцизовой кислотой протопластов, изолированных из интактного зерна (Wang et al., 1996).
Разрушение клеток крахмального эндосперма завершает процесс накопления питательных веществ зерна, и обеспечивает их последующую доступность в прорастающем семени.
ЗАКЛЮЧЕНИЕ
Каждый этап формирования тканей зародышевого мешка и семени сопровождается процессами ПКГ и имеет свои структурно-функциональные особенности. Причины разнообразия вариантов ПКГ этих тканей до конца не выяснены. Вероятно, пути ПКГ связаны с морфогенезами тканей формирующегося семени. Процессы клеточной гибели тканей при морфогенезе семени имеют общие черты либо с вакуолярной клеточной гибелью (вакуолизация цитоплазмы, формирование аутофагосом, разрыв тонопласта вакуоли), либо с некротической (апоптотической) (фрагментация ДНК, выход цитохрома с из митохондрий) (Van Doorn et al., 2011; Van Doorn, 2011; Reape, McCabe, 2013), либо им присущи особенности обоих путей.
В процессе формирования семени клетки, структуры и ткани последовательно сменяют друг друга, при этом одни обеспечивают функционирование других. Например, у растений с хорошо развитым подвеском он осуществляет поддержку и питание зародыша, антиподальные клетки злаков обеспечивают существование и правильное формирование эндосперма, который аккумулирует питательные вещества для последующего развития зародыша. При созревании семени ПКГ является инструментом удаления ненужных клеток и тканей, освобождая пространство и, вероятно, обеспечивая доступность питательных вещества для формирования новых тканей. Биохимические характеристики гибели антиподальных клеток культурных злаков, подвеска и эндосперма большинства покрытосеменных растений необходимы для понимания механизмов формирования семени.
К сожалению, многие аспекты ПКГ клеточных типов зародышевого мешка и семени до сих пор остаются неизученными. Недостаточно изучены молекулярные механизмы ПКГ. Выявлены отдельные белки-регуляторы процессов ПКГ, однако сигнальные каскады, участниками которых являются эти белки, остаются неизвестными.
Отрывочны данные о функционировании протеаз, регулирующих ПКГ. Не известно, участвуют ли протеазы в ПКГ мегаспор, синергид и антипод. Сигнальные каскады, приводящие к активации изученных протеаз, до сих не выяснены. Известна субстратная специфичность протеаз, принимающих участие в ПКГ, тем не менее в большинстве случаев деградомы (природные субстраты) метакаспаз, фитаспаз и других протеаз растений до сих не определены.
Исследования, посвященные ПКГ растений, не позволяют составить полную картину процессов, сопровождающих ПКГ. В связи с появлением данных о секвенировании геномов многих покрытосеменных растений и внедрением биохимических методов в рутинную практику изучения растительных объектов, в том числе таких сложных, как зародышевый мешок, возможен прорыв именно в области изучения молекулярных механизмов протекания и регуляции ПКГ.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что какой-либо конфликт интересов отсутствует.
Список литературы
Доронина Т.В., Чабан И.А., Лазарева Е.М. Структурно-функциональные особенности клеток антиподального комплекса зародышевого мешка пшеницы на стадии дифференцировки // Онтогенез. 2019. Т. 50. № 4. С. 1–17.
An L.H., You R.L. Studies on nuclear degeneration during programmed cell death of synergid and antipodal cells in Triticum aestivum // Sex. Plant Reprod. 2004. V. 17. № 4. P. 195–201.
Bartoli G., Felici C., Castiglione M.R. Female gametophyte and embryo development in Helleborus bocconei Ten. (Ranunculaceae) // Protoplasma. 2017. V. 254. № 1. P. 491–504.
Bethke P.C. et al. Hormonally regulated programmed cell death in barley aleurone cells // The Plant Cell. 1999. V. 11. № 6. P. 1033–1045.
Bethke P.C., Jones R.L. Cell death of barley aleurone protoplasts is mediated by reactive oxygen species // Plant J. 2001. V. 25. № 1. P. 19–29.
Bozhkov P.V. et al. Cysteine protease mcII-Pa executes programmed cell death during plant embryogenesis // Proc. Natl. Acad. Sci. USA. 2005. V. 102. № 40. P. 14463–14468.
Buhtz A. et al. Xylem sap protein composition is conserved among different plant species // Planta. 2004. V. 219. № 4. P. 610–618.
Cao L. et al. Arabidopsis ICK/KRP cyclin-dependent kinase inhibitors function to ensure the formation of one megaspore mother cell and one functional megaspore per ovule // PLoS Genet. 2018. V. 14. № 3. P. 1–30.
Chaban I.A. et al. Antipodal complex development in the embryo sac of wheat // Russ. J. Dev. Biol. 2011. V. 42. № 2. P. 79–91.
Chaubal R., Reger B.J. Calcium in the synergid cells and other regions of pearl millet ovaries // Sex. Plant Reprod. 1992. V. 5. № 1. P. 34–46.
Chaubal R., Reger B.J. Prepollination degeneration in mature synergids of pearl millet: an examination using antimonate fixation to localize calcium // Sex. Plant Reprod. 1993. V. 6. № 4. P. 225–238.
Chaubal R., Reger B.J. The dynamics of calcium distribution in the synergid cells of wheat after pollination // Sex. Plant Reprod. 1992. V. 5. № 3. P. 206–213.
Chen F., Foolad M.R. Molecular organization of a gene in barley which encodes a protein similar to aspartic protease and its specific expression in nucellar cells during degeneration // Plant Mol. Biol. 1997. V. 35. № 6. P. 821–831.
Chen Y. et al. Programmed cell death in wheat starchy endosperm during kernel development // African J. Agric. Res. 2012. V. 7. № 49. P. 6533–6540.
Cheng X.X. et al. Reactive oxygen species regulate programmed cell death progress of endosperm in winter wheat (Triticum aestivum L.) under waterlogging // Protoplasma. 2016. V. 253. № 2. P. 311–327.
Christensen C.A. et al. Megagametogenesis in Arabidopsis wild type and the Gf mutant // Sex. Plant Reprod. 1997. V. 10. № 1. P. 49–64.
Christensen C.A. et al. Mitochondrial GFA2 is required for synergid cell death in Arabidopsis // The Plant Cell. 2002. V. 14. № 9. P. 2215–2232.
Consonni G. et al. Analysis of four maize mutants arrested in early embryogenesis reveals an irregular pattern of cell division // Sex. Plant Reprod. 2003. V. 15. № 6. P. 281–290.
D’Amato F. Role of polyploidy in reproductive organs and tissues // Embryology of Angiosperms. Springer, Berlin, Heidelberg, 1984. P. 519–566.
Daneva A. et al. Functions and regulation of programmed cell death in plant development // Annu. Rev. Cell Dev. Biol. 2016. V. 32. P. 441–468.
Demesa-Arévalo E., Vielle-Calzada J.P. The classical arabinogalactan protein AGP18 mediates megaspore selection in Arabidopsis // The Plant Cell. 2013. V. 25. № 4. P. 1274–1287.
Denay G. et al. Endosperm breakdown in Arabidopsis requires heterodimers of the basic helix-loop-helix proteins ZHOUPI and INDUCER OF CBP EXPRESSION 1 // Development. 2014. V. 141. № 6. P. 1222–1227.
Domínguez F., Cejudo F.J. Germination-related genes encoding proteolytic enzymes are expressed in the nucellus of developing wheat grains // Plant J. 1998. V. 15. № 4. P. 569–574.
Domínguez F., Cejudo F.J. Programmed cell death (PCD): an essential process of cereal seed development and germination // Frontiers in Plant Science. 2014. V. 5. P. 366.
Domínguez F., Moreno J., Cejudo F.J. A gibberellin-induced nuclease is localized in the nucleus of wheat aleurone cells undergoing programmed cell death // J. Biol. Chem. 2004. V. 279. № 12. P. 11530–11536.
Dominguez F., Moreno J., Cejudo F.J. The nucellus degenerates by a process of programmed cell death during the early stages of wheat grain development // Planta. 2001. V. 213. № 3. P. 352–360.
Dresselhaus T., Sprunck S., Wessel G.M. Fertilization mechanisms in flowering plants // Current Biology. 2016. V. 26. № 3. P. R125–R139.
Engell K. Embryology of barley. IV. Ultrastructure of the antipodal cells of Hordeum vulgare L. cv. Bomi before and after fertilization of the egg cell // Sex. Plant Reprod. 1994. V. 7. № 6. P. 333–346.
Filonova L.H. et al. Two waves of programmed cell death occur during formation and development of somatic embryos in the gymnosperm, Norway spruce // J. Cell Sci. 2000. V. 113. № 24. P. 4399–4411.
Fu Y. et al. Changes in actin organization in the living egg apparatus of Torenia fournieri during fertilization // Sex. Plant Reprod. 2000. V. 12. № 6. P. 315–322.
Galluzzi L. et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018 // Cell Death Differ. 2018. V. 25. № 3. P. 486–541.
Gärtner P.J., Nagl W. Acid phosphatase activity in plastids (plastolysomes) of senescing embryo-suspensor cells // Planta. 1980. V. 149. № 4. P. 341–349.
Gietl C., Schmid M. Ricinosomes: an organelle for developmentally regulated programmed cell death in senescing plant tissues // Naturwissenschaften. 2001. V. 88. № 2. P. 49–58.
Giuliani C. et al. Programmed cell death during embryogenesis in maize // Ann. Bot. 2002. V. 90. № 2. P. 287–292.
Greenwood J.S., Helm M., Gietl C. Ricinosomes and endosperm transfer cell structure in programmed cell death of the nucellus during Ricinus seed development // Proc. Natl. Acad. Sci. USA. 2005. V. 102. № 6. P. 2238–2243.
Hamamura Y., Nagahara S., Higashiyama T. Double fertilization on the move // Curr. Opin. Plant Biol. 2012. V. 15. № 1. P. 70–77.
Hatsugai N. et al. Vacuolar processing enzyme in plant programmed cell death // Front. Plant Sci. 2015. V. 6. P. 234.
Heydlauff J., Groß-Hardt R. Love is a battlefield: programmed cell death during fertilization // J. Exp. Bot. 2014. V. 65. № 5. P. 1323–1330.
Higashiyama T., Takeuchi H. The mechanism and key molecules involved in pollen tube guidance // Annual Review of Plant Biology. 2015. V. 66. P. 393–413.
Hiratsuka R., Yamada Y., Terasaka O. Programmed cell death of Pinus nucellus in response to pollen tube penetration // J. Plant Research. 2002. V. 115. № 2. P. 0141–0148.
Hofius D. et al. Role of autophagy in disease resistance and hypersensitive response-associated cell death // Cell Death Differ. 2011. V. 18. № 8. P. 1257–1262.
Huang B.Q., Russell S.D. Fertilization in Nicotiana tabacum: cytoskeletal modifications in the embryo sac during synergid degeneration // Planta. 1994. V. 194. № 2. P. 200–214.
Hunt D.J.L., McCabe P.F. Death and rebirth: programmed cell death during plant sexual reproduction // Molecular Cell Biology of the Growth and Differentiation of Plant Cells. 2017. P. 340–361.
Johri B.M., Ambegaokar K.B., Srivastava P.S. Comparative Embryology of Angiosperms. Springer Science & Business Media, 2013. V. 1.
Kacprzyk J., Daly C.T., McCabe P.F. The botanical dance of death: programmed cell death in plants // Adv. Bot. Res. Academic Press, 2011. V. 60. P. 169–261.
Kägi C. et al. The gametic central cell of Arabidopsis determines the lifespan of adjacent accessory cells // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 51. P. 22350–22355.
Kawashima T., Goldberg R.B. The suspensor: not just suspending the embryo // Trends Plant Sci. 2010. V. 15. № 1. P. 23–30.
Kessler S.A. et al. Conserved molecular components for pollen tube reception and fungal invasion // Science. 2010. V. 330. № 6006. P. 968–971.
Kuo A. et al. Okadaic acid, a protein phosphatase inhibitor, blocks calcium changes, gene expression, and cell death induced by gibberellin in wheat aleurone cells // The Plant Cell. 1996. V. 8. № 2. P. 259–269.
Leydon A.R. et al. Pollen tube discharge completes the process of synergid degeneration that is initiated by pollen tube-synergid interaction in Arabidopsis // Plant Physiol. 2015. V. 169. № 1. P. 485–496.
Linnestad C. et al. Nucellain, a barley homolog of the dicot vacuolar-processing protease, is localized in nucellar cell walls // Plant Physiol. 1998. V. 118. № 4. P. 1169–1180.
Locascio A. et al. Current perspectives on the hormonal control of seed development in Arabidopsis and maize: a focus on auxin // Front. Plant Sci. 2014. V. 5. P. 412.
Lombardi L. et al. DNA degradation during programmed cell death in Phaseolus coccineus suspensor // Plant Physiol and Biochemistry. 2007. V. 45. № 3–4. P. 221–227.
Lombardi L. et al. Ethylene produced by the endosperm is involved in the regulation of nucellus programmed cell death in Sechium edule Sw // Plant Sci. 2012. V. 187. P. 31–38.
Lombardi L. et al. Programmed cell death of the nucellus during Sechium edule Sw. seed development is associated with activation of caspase-like proteases // J. Exp. Bot. 2007. V. 58. № 11. P. 2949–2958.
López-Fernández M.P., Maldonado S. Ricinosomes provide an early indicator of suspensor and endosperm cells destined to die during late seed development in quinoa (Chenopodium quinoa) // Ann. Bot. 2013. V. 112. № 7. P. 1253–1262.
Lu J., Magnani E. Seed tissue and nutrient partitioning, a case for the nucellus // Plant Reproduction. 2018. V. 31. № 3. P. 309–317.
Maeda E., Miyake H. Ultrastructure of antipodal cells of rice (Oryza sativa) after anthesis, as related to nutrient transport in embryo sac // Japanese J. Crop Sci. 1996. V. 65. № 2. P. 340–351.
Maizel A. A view to a kill: markers for developmentally regulated cell death in plants // Plant Physiol. 2015. V. 169. № 4. P. 2341–2341.
Minina E.A. et al. Autophagy and metacaspase determine the mode of cell death in plants // J. Cell Biol. 2013. V. 203. № 6. P. 917–927.
Mogensen H.L. Pollen tube-synergid interactions in Proboscidea louisianica (Martineaceae) // Am. J. Bot. 1978. V. 65. № 9. P. 953–964.
Nagl W. “Plastolysomes”–plastids involved in the autolysis of the embryo-suspensor in phaseolus // Zeitschrift für Pflanzenphysiologie. 1977. V. 85. № 1. P. 45–51.
Nagl W. The phaseolus suspensor and its polytene chromosomes // Zeitschrift für Pflanzenphysiologie. 1974. V. 73. № 1. P. 1–44.
Nakaune S. et al. A vacuolar processing enzyme, δVPE, is involved in seed coat formation at the early stage of seed development // The Plant Cell. 2005. V. 17. № 3. P. 876–887.
Ngo Q.A. et al. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery // Dev. Cell. 2014. V. 29. № 4. P. 491–500.
Nogueira F.C.S. et al. Proteomic profile of the nucellus of castor bean (Ricinus communis L.) seeds during development // J. Proteomics. 2012. V. 75. № 6. P. 1933–1939.
Olvera-Carrillo Y. et al. A conserved core of programmed cell death indicator genes discriminates developmentally and environmentally induced programmed cell death in plants // Plant Physiol. 2015. V. 169. № 4. P. 2684–2699.
Ondzighi C.A. et al. Arabidopsis protein disulfide isomerase-5 inhibits cysteine proteases during trafficking to vacuoles before programmed cell death of the endothelium in developing seeds // The Plant Cell. 2008. V. 20. № 8. P. 2205–2220.
Papini A. et al. Megasporogenesis and programmed cell death in Tillandsia (Bromeliaceae) // Protoplasma. 2011. V. 248. № 4. P. 651–662.
Peng X., Sun M.X. The suspensor as a model system to study the mechanism of cell fate specification during early embryogenesis // Plant Reprod. 2018. V. 31. № 1. P. 59–65.
Olsen O.A. Nuclear endosperm development in cereals and Arabidopsis thaliana // The Plant Cell. 2004. V. 16. P. S214–S227.
Pereira A.M. et al. “Love is strong, and you’re so sweet”: JAGGER is essential for persistent synergid degeneration and polytubey block in Arabidopsis thaliana // Mol. Plant. 2016. V. 9. № 4. P. 601–614.
Petrussa E. et al. Mitochondrial bioenergetics linked to the manifestation of programmed cell death during somatic embryogenesis of Abies alba // Planta. 2009. V. 231. № 1. P. 93–107.
Qiu Y.L. et al. Calcium changes during megasporogenesis and megaspore degeneration in lettuce (Lactuca sativa L.) // Sex. Plant Reprod. 2008. V. 21. № 3. P. 197–204.
Radchuk V.V. et al. Spatiotemporal profiling of starch biosynthesis and degradation in the developing barley grain // Plant Physiol. 2009. V. 150. № 1. P. 190–204.
Reape T.J., McCabe P.F. Apoptotic-like programmed cell death in plants // New Phytologist. 2008. V. 180. № 1. P. 13–26.
Reape T.J., McCabe P.F. Commentary: the cellular condensation of dying plant cells: programmed retraction or necrotic collapse? // Plant Sci. 2013. V. 207. P. 135–139.
Rocha A.J. et al. Differential expression of cysteine peptidase genes in the inner integument and endosperm of developing seeds of Jatropha curcas L. (Euphorbiaceae) // Plant Sci. 2013. V. 213. P. 30–37.
Rocha A.J., Pohl S., Fonteles C.S.R. Cloning and gene expression analysis of two cDNA of cysteine proteinase genes involved in programmed cell death in the inner integument from developing seeds of Jatropha curcas L. // Gene Expr. Patterns. 2018. V. 27. P. 122–127.
Russell S.D. Fine structure of megagametophyte development in Zea mays // Can. J. Bot. 1979. V. 57. № 10. P. 1093–1110.
Schmid M. et al. The ricinosomes of senescing plant tissue bud from the endoplasmic reticulum // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 9. P. 5353–5358.
Schmid M., Simpson D., Gietl C. Programmed cell death in castor bean endosperm is associated with the accumulation and release of a cysteine endopeptidase from ricinosomes // Proc. Natl. Acad. Sci. USA. 1999. V. 96. № 24. P. 14159–14164.
Shah M. et al. Deep proteome analysis of gerontoplasts from the inner integument of developing seeds of Jatropha curcas // J. Proteomics. 2016. V. 143. P. 346–352.
Smertenko A.P. et al. Re-organisation of the cytoskeleton during developmental programmed cell death in Picea abies embryos // Plant J. 2003. V. 33. № 5. P. 813–824.
Tian H.Q., Russell S.D. Calcium distribution in fertilized and unfertilized ovules and embryo sacs of Nicotiana tabacum L. // Planta. 1997. V. 202. № 1. P. 93–105.
Üstün S., Hafren A., Hofius D. Autophagy as a mediator of life and death in plants // Curr. Opin. Plant Biol. 2017. V. 40. P. 122–130.
Van Doorn W.G. Classes of programmed cell death in plants, compared to those in animals // J. Exp. Bot. 2011. V. 62. № 14. P. 4749–4761.
Van Doorn W.G. et al. Morphological classification of plant cell deaths // Cell Death Differ. 2011. V. 18. № 8. P. 1241–1246.
Van Hautegem T. et al. Only in dying, life: programmed cell death during plant development // Trends Plant Sci. 2015. V. 20. № 2. P. 102–113.
Völz R. et al. Ethylene signaling is required for synergid degeneration and the establishment of a pollen tube block // Dev. Cell. 2013. V. 25. № 3. P. 310–316.
Wan L. et al. Early stages of seed development in Brassica napus: a seed coat-specific cysteine proteinase associated with programmed cell death of the inner integument // Plant J. 2002. V. 30. № 1. P. 1–10.
Wang M. et al. Apoptosis in barley aleurone during germination and its inhibition by abscisic acid // Plant Mol. Biol. 1996. V. 32. № 6. P. 1125–1134.
Wang P., Mugume Y., Bassham D.C. New advances in autophagy in plants: regulation, selectivity and function // Seminars in Cell & Developmental Biology. Academic Press, 2018. V. 80. P. 113–122.
Wredle U., Walles B., Hakman I. DNA fragmentation and nuclear degradation during programmed cell death in the suspensor and endosperm of Vicia faba // International J. Plant Scis. 2001. V. 162. № 5. P. 1053–1063.
Wu J.J. et al. Mitochondrial GCD1 dysfunction reveals reciprocal cell-to-cell signaling during the maturation of Arabidopsis female gametes // Dev. Cell. 2012. V. 23. № 5. P. 1043–1058.
Xu W. et al. Endosperm and nucellus develop antagonistically in Arabidopsis seeds // The Plant Cell. 2016. V. 28. № 6. P. 1343–1360.
Yadegari R., Drews G.N. Female gametophyte development // The Plant Cell. 2004. V. 16. P. 133–141.
Yang X. et al. Live and let die-the Bsister MADS-box gene OsMADS29 controls the degeneration of cells in maternal tissues during seed development of rice (Oryza sativa) // PLoS One. 2012. V. 7. № 12. P. e51435.
Young T.E., Gallie D.R. Programmed cell death during endosperm development // Programmed Cell Death in Higher Plants. Springer, Dordrecht, 2000. P. 39–57.
Zhao P. et al. A bipartite molecular module controls cell death activation in the basal cell lineage of plant embryos // PLoS Biology. 2013. V. 11. № 9. P. e1001655.
Zhimulëv I.F. Morphology and structure of polytene chromosomes // Advances in Genetics. Academic Press, 1996. V. 34. P. 1–490.
Zhuang X. et al. ATG9 regulates autophagosome progression from the endoplasmic reticulum in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 3. P. E426–E435.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


