Онтогенез, 2020, T. 51, № 3, стр. 177-192
Регенерация у аннелид: клеточные источники, тканевые перестройки и дифференциальная экспрессия генов
Д. Д. Никанорова a, Е. Е. Купряшова a, Р. П. Костюченко a, *
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб. 7/9, Россия
* E-mail: r.kostyuchenko@spbu.ru
Поступила в редакцию 21.01.2020
После доработки 28.01.2020
Принята к публикации 31.01.2020
Аннотация
Недавние работы показали, что, несмотря на стереотипное дробление, аннелиды демонстрируют способность к эмбриональным регуляциям, в том числе при формировании линии половых клеток. Вместе с тем наиболее широко процессы регуляции представлены в ходе постларвального развития аннелид. Способность к регенерации, являющейся, вероятно, анцестральным признаком, проявляется по-разному среди этих животных. Некоторые виды не способны регенерировать утраченные сегменты. Однако большинство видов восстанавливают задние части тела, многие способны восстанавливать головные сегменты и структуры, а некоторые развивают все тело de novo даже на основе одного-двух сегментов. Большая часть восстанавливаемых структур формируется за счет набора недифференцированных клеток, возникающих при делении дедифференцированных и/или стволовых клеток. При этом процесс регенерации часто приводит к перестройке старых фрагментов тела, и может, таким образом, быть связанным не только с локальными изменениями, но и требовать реакции на уровне всего организма. В этом обзоре мы обобщаем многие современные исследования относительно молекулярных и клеточных механизмов регенерации у аннелид. Особое внимание уделено восстановлению пищеварительной и нервной систем, покровов, а также участию стволовых и недифференцированных клеток в развитии бластемы и в восстановлении гонад. Накопление и анализ современных знаний о разнообразии клеточных источников и механизмов регенерации аннелид могут пролить свет на наиболее эволюционно консервативные программы поддержания способности к регенерации и на процессы, ведущие к потере (ограничению) одного из анцестральных свойств животных.
ВВЕДЕНИЕ
Регенерация – процесс восстановления утраченных клеток, тканей, органов и частей тела и их функций – является фундаментальным свойством живых систем. Даже животные, для которых характерно постоянство клеточного состава (эутелия), способны к ограниченной физиологической регенерации (Короткова, 1997; Stocum, 2012). Вместе с тем, вопрос о том, почему у одних видов наблюдаются почти безграничные возможности к восстановлению утраченных частей, а у их ближайших родственников – нет, остается наиболее интригующим и далеким от решения.
Существует немало модельных объектов, с использованием которых активно ведется поиск решения проблем регенерации. Это такие простые животные как гидры и планарии, или более сложно устроенные аннелиды, иглокожие, асцидии и позвоночные, включая человека (Короткова, 1997; Stocum, 2012; Костюченко, Козин, 2020). Современные технологии позволяют проводить исследования на клеточных культурах, что значительно облегчает создание контролируемых условий. Однако очевидно, что полноценное решение фундаментальных и практических проблем регенерации возможно только на организменном уровне (Stocum, 2012; Новикова и др., 2020).
Несмотря на пристальное внимание исследователей к феномену регенерации, многие механизмы этого процесса до сих пор не раскрыты. Среди них – природа клеточных источников, вносящих вклад в формирование регенерата. Основываясь на данных по регенерации многих модельных объектов, можно предположить, что наиболее часто встречаются четыре механизма восстановления тканей: повторный рост клеточных частей, таких как нервные аксоны; пролиферация дифференцированных клеток, претерпевающих или не претерпевающих дедифференцировку; трансдифференцировка и активация взрослых стволовых клеток. Вместе с тем эпиморфная регенерация, для которой характерна высокая пролиферативная активность различных клеток, сопровождается признаками морфаллаксиса. Морфаллаксис, процесс восстановления утерянных частей за счет перестройки старых тканей без активной пролиферации клеток, может быть выражен в разной степени. В некоторых случаях регенерация может осуществляться исключительно по типу морфаллаксиса (Stocum, 2012; Костюченко, Козин, 2020). Очевидно, что сочетание дедифференцировки, активации стволовых клеток, пролиферации и реорганизации остатка (ткани, органа и т.д.) существенно увеличивает сложность механизмов инициации и регуляции процессов регенерации. Вне всякого сомнения, использование различных моделей животных позволит получить максимально полное представление о процессах регенерации и использовать эти знания в практических целях.
В настоящем обзоре мы обобщаем многие данные о молекулярных и клеточных механизмах регенерации у аннелид, одной из ключевых для эволюционной биологии развития групп билатеральных животных. Аннелиды, как и другие спиральные животные, демонстрируют стереотипное эмбриональное развитие, хотя и с элементами регуляции (Костюченко, Дондуа, 2006, 2017; Nakamoto et al., 2010; Козин и др., 2013; Wanninger, 2015; Kozin et al., 2016; Lanza, Seaver, 2018). Однако взрослые животные, заметно различающиеся по строению, жизненному циклу и экологическим условиям обитания, как правило, восстанавливают утраченные ткани и части тела, демонстрируя в ряде случаев почти неограниченные способности к регенерации, в том числе и при бесполом размножении (Короткова, 1997; Харин и др., 2006; Bely, Sikes, 2010; Zattara, Bely, 2011; Костюченко и др., 2016; de Jong, Seaver, 2018; Костюченко, Козин, 2020). Все это делает аннелид перспективной моделью для изучения как молекулярных и клеточных механизмов регенерации и бесполого размножения, так и эволюции программ развития.
БЛАСТЕМА: КЛЕТОЧНЫЕ ИСТОЧНИКИ И СПЕЦИФИЧНАЯ ЭКСПРЕССИЯ ГЕНОВ
Посттравматическая регенерация большинства аннелид происходит по типу эпиморфоза, то есть с формированием регенерационной почки, состоящей из активно пролиферирующих, недифференцированных клеток. Общепринято, что клетки, входящие в состав всех трех зародышевых листков, участвуют в восстановлении утраченных участков тела (Paulus, Müller, 2006; Bely, 2014; Костюченко и др., 2016). Большинство работ подтверждает идею о независимых клеточных источниках экто-, мезо- и энтодермальных структур во время регенерации, поэтому имеет смысл рассмотреть их по отдельности. Восстановление производных мезодермы (целомический эпителий, гонады, кровеносные сосуды, метанефридии) и эктодермы (нервная система, покровы тела) тесным образом связано с формированием регенерационной почки.
В состав регенерационной почки входит бластема (масса внутренних недифференцированных клеток) и покрывающий ее эпителий. Неоднократно было показано, что раневой эпителий формируется за счет реаранжировки клеток покровного эпителия, а не за счет их пролиферации. Этот факт был подтвержден как с использованием гистологических методов (Turner, 1934; Fontés et al., 1983; Dupin et al., 1991), так и методом включения BrdU и EdU (Zattara, Bely, 2011; Planques et al., 2019). Кроме того, ингибирование пролиферации цитостатическим препаратом гидроксикарбамидом не приводило к нарушению формирования раневого эпителия (Planques et al., 2019). Тем не менее, пролиферация клеток покровного эпителия может происходить на более поздних стадиях.
Напротив, клетки бластемы активно делятся. Пролиферация внутренних клеток регенерационной почки подтверждается включением предшественников ДНК: EdU или BrdU (Zattara, Bely, 2011; Sugio et al., 2012; Kozin, Kostyuchenko, 2015; de Jong, Seaver, 2018; Planques et al., 2019). В недавнем исследовании активное деление клеток бластемы было показано с использованием молекулярных маркеров. CyclinB1, cyclinB3 и pcna – гены, белковые продукты которых участвуют в процессе репликации ДНК, и могут служить надежными маркерами пролиферирующих клеток. В дополнение к этому был проведен и функциональный анализ: инкубация червей в ингибиторе пролиферации гидроксикарбамиде привела к нарушению формирования задней зоны роста и восстановлению утраченных сегментов (Planques et al., 2019). Таким образом, пролиферация клеток бластемы является необходимым событием для регенерации.
Выяснение происхождения клеток, формирующих бластему, необходимо для понимания источников восстановления структур мезо- и эктодермальной природы. С одной стороны, большинство исследований поддерживает идею о дедифференцировке клеток с последующей редифференцировкой. С другой стороны, многие авторы предполагают наличие специализированной линии соматических стволовых клеток. И в том и в другом случае клетки могут либо мигрировать из отдаленных сегментов, либо изначально находиться в сегменте рядом с раной. Таким образом, есть всего четыре гипотетические возможности происхождения клеток бластемы: миграция удаленных стволовых элементов, миграция дедифференцированных клеток, локальная дедифференцировка, локальное происхождение стволовых клеток (Planques et al., 2019). Однако их комбинирование в различных сочетаниях может значительно менять условия взаимодействия между клетками, в том числе на уровне ниши стволовых клеток. Отличительной особенностью стволовых клеток является их пролиферация до начала регенерации, в то время как дедифференцировка клеток происходит в ответ на ампутацию. Как известно, надежными маркерами недифференцированного состояния клеток у беспозвоночных являются продукты генов программы поддержания половых и мультипотентных клеток (Germline/Multipotency Program genes) (Juliano et al., 2010). Экспрессия de novo этих генов в составе регенерационной бластемы будет говорить о локальном происхождении клеток бластемы, тогда как обнаружение клеток с подобным профилем экспрессии в интактных сегментах может свидетельствовать в пользу миграции. Таким образом, изучение пролиферативной активности и анализ паттерна экспрессии генов GMP позволят отличить дедифференцировку от участия стволовых клеток и миграцию от локальной активации пролиферативной активности.
Использование этих двух методов позволило утверждать о превалирующей роли процессов дедифференцировки клеток, расположенных рядом с раной в ходе задней регенерации Platynereis dumerilii (Planques et al., 2019). Авторы инкубировали червей в растворе EdU до проведения операции по удалению сегментов, с целью выявления стволовых клеток, постоянно находящихся в клеточном цикле. Подавляющее большинство клеток бластемы было свободно от метки, что говорит о незначительном вкладе миграции в формирование бластемы. Однако, схема этого эксперимента не позволяет выявить стволовые клетки, находящиеся в фазе покоя до момента ампутации. Проведение эксперимента по модифицированной схеме (с предварительной ампутацией, призванной стимулировать покоящиеся стволовые элементы к делению) позволило подтвердить, что бластема формируется в основном из клеток прилегающего к ране сегмента, без миграции отдаленных элементов (Planques et al., 2019). В пользу дедифференцировки клеток свидетельствует обнаружение de novo экспрессии генов GMP (Pdum-piwiA, Pdum-piwiB, Pdum-vasa, Pdum-nanos, Pdum-pl10, Pdum-myc) во внутренних клетках бластемы (Planques et al., 2019) (рис. 1).
Рис. 1.
Дифференциальная экспрессия генов в ходе регенерации аннелид на основе данных гибридизации in situ. На схеме передний конец тела направлен налево, задний – направо. Схема составлена на основе следующих источников: Bely, Wray, 2001; de Rosa et al., 2005; Tadokoro et al., 2006; Paulus, Müller, 2006; Dill, Seaver, 2008; Takeo et al., 2008, 2010; Giani et al., 2011; Pfeifer et al., 2012; Novikova et al., 2013; Gazave et al., 2013; Kozin, Kostyuchenko, 2015; Özpolat, Bely, 2015; de Jong, Seaver, 2016, 2018; Planques et al., 2019; Kostyuchenko et al., 2019. Небольшой набор генов, эксперссирующихся при замещении недостающего головного конца, отражает лишь слабую изученность моделей с передней регенерацией методом гибридизации in situ. Дополнительную информацию см. в разделе “Перспективы: молекулярные подходы”.
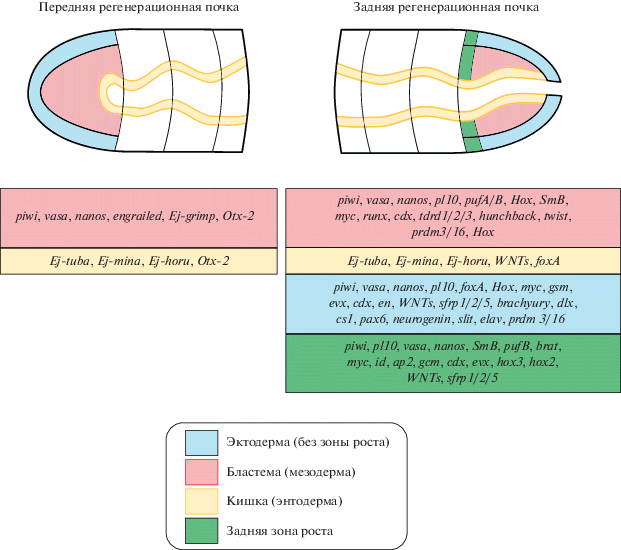
Для большинства других полихет также была показана главенствующая роль процессов дедифференцировки клеток, расположенных рядом с раной (Paulus, Müller, 2006; Kozin, Kostyuchenko, 2015). Недавняя работа на полихете Alitta virens убедительно продемонстрировала, что в ходе задней регенерации происходит de novo экспрессия генов-маркеров стволовых и мультипотентных клеток vasa, piwi и pl10, ассоциированная с покровным эпителием и внутренними клетками регенерата. Авторы указывают на отсутствие миграции клеток с подобным профилем экспрессии, что согласуется с идеей о дедифференцировке. Сопоставляя данные гибридизации in situ и картины включения клетками BrdU, авторы отмечают некоторое несовпадение меток. В частности, в эпителии обнаруживаются делящиеся клетки, не экспрессирующие гены GMP, а в бластеме напротив – обнаружены GMP-позитивные клетки, не находящиеся в фазе митоза. Таким образом, активация экспрессии изученных генов из числа GMP не является необходимой для поддержания пролиферативной активности клеток (Kozin, Kostyuchenko, 2015). Следует, однако, отметить, что методы анализа функций различных генов у аннелид начали развиваться лишь в последнее время. Обнаруженный у E. japonensis ген grimp является единственным, чья роль в формировании бластемы подтверждена функционально: использование двуцепочечной РНК этого гена в ходе РНК-интерференции привело к подавлению процесса формирования бластемы (Takeo et al., 2010).
На более поздних стадиях регенерации экспрессия генов GMP наблюдается в клетках вновь образованной задней зоны роста. Молекулярный профиль задней зоны роста варьирует у разных видов аннелид. Для полихеты Capitella teleta показана экспрессия гомологов piwi, vasa и nanos в задней зоне роста ювенильных червей (Dill, Seaver, 2008). В ходе регенерации клетки задней зоны роста накапливают транскрипты piwi (Giani et al., 2011). Platynereis dumerilii демонстрирует экспрессию гомологов piwi, vasa, pl10 и nanos в задней зоне роста ювенильных и регенерирующих червей (Planques et al., 2019). Клетки задней зоны роста олигохеты E. japonensis накапливают транскрипты vasa в ходе нормального роста и регенерации (Tadokoro et al., 2006). Напротив, экспрессия vasa отсутствует в задней зоне роста олигохеты Tubifex tubifex (Oyama, Shimizu, 2007). Вероятно, функцию отсутствующего белка Vasa выполняет родственная ей РНК-хеликаза p68 (Oyama et al., 2008).
В геномах большинства изученных аннелид обнаружено по два гомолога гена piwi. Филогенетический анализ показывает, что они образовались в результате дупликации на заре эволюции билатерий (Giani et al., 2011). Дупликация гена и последующая дивергенция копий обычно связаны с разделением функций. Действительно, паттерн экспрессии паралогов piwi1 и piwi2 различается в регенерационной почке A. virens. Avi-piwi1 экспрессируется на ранних стадиях в клетках раневого эпителия и во внутренних клетках бластемы, а также маркирует вновь сформированную заднюю зону роста. Транскрипты Avi-piwi2 обнаружены исключительно во внутренних клетках бластемы, но не в клетках задней зоны роста (Kozin, Kostyuchenko, 2015). С другой стороны, несмотря на давнюю дивергенцию, паралоги piwi1 и piwi2 у C. teleta транскрибируются в одних и тех же структурах в ходе всего жизненного цикла и регенерации (Giani et al., 2011). Таким образом, несмотря на высокий уровень гомологии между ортологами piwi, они могут специализироваться на выполнении разных функций у разных видов. В целом, вариации в наборе генов GMP, вовлеченных в процесс восстановления задней зоны роста и утраченных сегментов у разных аннелид, могут говорить о тонких различиях в регуляции возмещения утраченных задних структур.
Еще до обособления зоны роста клетки задней части бластемы P. dumerilii экспрессируют тканеспецифичные гены, например Pdum-twist, ответственный за дифференцировку в мышечные клетки (Planques et al., 2019). После формирования зоны роста twist+ клетки обнаружены в передней части бластемы, что говорит о будущей их дифференцировке в мышечные элементы нового сегмента. Экспрессия Pdum-prdm3/16 в клетках бластемы позволяет предположить их коммитирование в сторону предшественников кровеносных сосудов. Начало закладки специализированных конечностей полихет – параподий – знаменуется экспрессией Pdum-dlx. Наконец, о формировании новых элементов нервной системы можно судить по экспрессии генов Pdum-pax6 и Pdum-neurogenin. Таким образом, клетки бластемы коммитированы к приобретению определенной клеточной судьбы еще на самых ранних стадиях регенерации. Столь ранняя спецификация клеток бластемы может свидетельствовать в пользу сохранения дедифференцированными клетками бластемы принадлежности к определенному зародышевому листку. Это также может свидетельствовать о мультипотентном, а не плюрипотентном статусе клеток бластемы.
Идея о транс- или дедифференцировке локальных клеточных элементов была не раз подтверждена и с помощью классических методов биологии развития. Восстановление мышечных клеток происходит, согласно гистологическому исследованию задней регенерации полихеты Owenia fusiformis, благодаря дедифференцировке, активному делению и последующей редифференцировке миоцитов (Dupin et al., 1991). Эпителиоциты на вентральной стороне бластемы у Limnodrilus hoffmeisteri, Ophidonais serpentina и Lumbriculus inconstans способны мигрировать внутрь и участвовать в закладке нервных ганглиев (Turner, 1934; Bilello, Potswald, 1974; Cornec et al., 1987). Более того, в ряде ранних работ описано формирование мезодермальных производных исключительно за счет структур эктодермальной природы (Hepke, 1897; Michel, 1898; Abel, 1902; Wagner, 1906, цитировано по Bilello, Potswald, 1974). На основе данных, полученных в нашей лаборатории, было предположено вероятное выселение клеток дедифференцированного покровного эпителия и образование ими материала бластемы в ходе бесполого размножения у олигохет Pristina longiseta и Nais communis (Харин и др., 2006). Клетки покровного эпителия не только имеют сходное с клетками бластемы тонкое строение, но, как и последние, экспрессируют гены vasa, pl10 и piwi. Таким образом, бластема при бесполом размножении у олигохет, может быть сформирована, как минимум частично, за счет дедифференцированных клеток покровного эпителия (Костюченко и др., 2016).
Несмотря на то, что для полихет в основном показано участие дедифференцированных клеток старых тканей в формировании регенерата, исследование, проведенное на Capitella teleta с использованием двух разных предшественников ДНК (EdU и BrdU), демонстрирует активную миграцию клеток в ходе задней регенерации (de Jong, Seaver, 2018). Авторы показали, что возможным источником мигрирующих vasa-позитивных клеток является кластер мультипотентных стволовых клеток (MPC), расположенный в пятом сегменте червя. С использованием дополнительных молекулярных маркеров была показана гетерогенность кластера MPC. Все его клетки экспрессируют гомологи vasa, piwi, nanos, однако лишь небольшая субпопуляция клеток оказывается myc-позитивной. Авторы характеризуют кластер как гетерогенную популяцию мультипотентных стволовых клеток, которая может вносить вклад в формирование задней регенерационной бластемы. При отрезании пяти передних сегментов (то есть, включая MPC) черви утрачивали способность восстановить задние сегменты. При отсечении четырех передних сегментов так, что MPC оставался в составе регенерирующего фрагмента, особи восстанавливали от одного до трех утраченных сегментов. Контрольные животные, имеющие все головные сегменты, регенерировали до 12-ти задних сегментов. В обеих экспериментальных группах не наблюдалось восстановление задней зоны роста, что авторы объясняют неспособностью червей питаться. Анализируя эти результаты, авторы делают вывод о том, что сохранение MPC способствует восстановлению некоторого количества задних сегментов, компенсируя отсутствие зоны роста (de Jong, Seaver, 2018). Так как процесс задней регенерации был нарушен в обоих случаях ампутации передних сегментов (с или без кластера MPC), встает вопрос о роли головных структур в восстановлении задней зоны роста. Известно, что развитие заднего регенерата у полихеты Alitta virens и олигохеты Tubifex tubifex не происходит в отсутствие головного мозга (Короткова, 1997; Bely, 2014). Возможно, и в случае C. teleta критическую роль в обеспечении полноценной регенерации играет не обнаруженный авторами кластер, а некий неизвестный сигнал, источником которого являются головные сегменты.
В отличие от полихет, для поясковых аннелид (Clitellata) неоднократно были описаны клетки мезодермальной природы, ассоциированные с септами, которые мигрируют к раневой поверхности и вносят вклад в формирование внутренней части бластемы (Randolph, 1892; Turner, 1934; Bilello, Potswald, 1974; Cornec et al., 1987; Sugio et al., 2012). Хэрриет Рэндольф, автор первого описания таких клеток у Lumbriculus, назвала их “необластами”, подразумевая присущие им стволовые потенции (Randolph, 1892). В настоящее время этот термин применяется, главным образом, в отношении линии плюрипотентных стволовых клеток у планарий (Newmark, Alvarado, 2001). Тем не менее, многие авторы сохраняют исходное значение данного термина и активно продвигают идею наличия у олигохет специализированной линии активно пролиферирующих и мигрирующих клеток (Костюченко и др., 2016).
Спустя почти век после открытия “необластов” у Lumbriculus, у олигохеты Limnodrilus hoffmeisteri была также описана миграция клеток, ассоциированных с септами, из предшествующих ране сегментов (Cornec et al., 1987). Судя по гистологическому описанию этих клеток, они имеют признаки недифференцированных клеточных элементов: веретеновидную форму, высокое ядерно-цитоплазматическое соотношение, крупное ядро, интенсивно окрашивающуюся цитоплазму. Многие авторы предполагают, что миграция клеток линии необластов происходит по брюшной нервной цепочке (Bilello, Potswald, 1974; Cornec et al., 1987).
Ингибирование клеточной миграции имело разные последствия для передней и задней регенерации Lumbriculus variegatus. Оказалось, что небольшая бластема формируется на передней раневой поверхности, тогда как задняя регенерация полностью подавляется. Таким образом, авторы делают вывод о том, что в процессе передней регенерации происходит как миграция клеток, так и локальная дедифференцировка, тогда как задняя регенерация полностью обеспечивается миграцией (Tweeten, Anderson, 2008).
Недавние работы японских исследователей демонстрируют наличие у олигохеты E. japonensis “необластов”, экспрессирующих vasa (Sugio et al., 2008; Sugio et al., 2012). С использованием гистологических методов совместно с методом включения BrdU, авторы убедительно показали, что эти клетки располагаются на задней поверхности септы брюшных сегментов, активно делятся в ответ на ампутацию и мигрируют внутри целомической полости к месту ранения, формируя значительную часть бластемы (Tadokoro et al., 2006; Yoshida-noro, Tochinai, 2010). Миграция, однако, происходит не по брюшной нервной цепочке, а внутри целомической полости, что противоречит ранним работам. Более того, клетки линии “необластов” располагаются у E. japonensis не только на вентральной стороне, но и на латеральных и дорсальной частях септы. Кроме очевидного по мнению авторов вклада “необластов”, они отмечают, что в регенерационной почке происходит деление клеток в покровном эпителии, а также в стенке кишки. Из этого они заключают, что восстановление утраченных частей тела происходит за счет клеток, входящих в состав производных всех трех зародышевых листков, при этом мезодермальные производные восстанавливаются только за счет “необластов”. Несмотря на столь прозрачный вывод, незаменимая роль “необластов” была недавно опровергнута у родственного вида.
Было произведено сравнение регенеративных способностей E. japonensis, размножающегося фрагментацией и E. buchholzi, практикующего половое развитие и не имеющего клеток типа “необластов” (Myohara, 2012). Оказалось, что особи вида E. buchholzi способны к восстановлению полноценного заднего конца тела и гипоморфного переднего конца. Было установлено, что эффективность передней регенерации зависит от места проведения ампутации: количество восстановленных сегментов уменьшается по мере продвижения вдоль переднезадней оси. У E. japonensis, напротив, при отрезании любого количества брюшных сегментов всегда происходит восстановление семи головных сегментов. Однако при разрезании червя на уровне головных сегментов, в составе которых нет “необластов”, на передней раневой поверхности восстанавливаются лишь утраченные передние сегменты. В то же время, на задней раневой поверхности происходит восстановление либо хвостовых сегментов, либо нескольких головных, что приводит к формированию двухголовой особи. Таким образом, даже не содержащие “необластов” головные сегменты E. japonensis способны восстановить утраченные передний и задний концы тела, а значит, используют другие клеточные источники. Анализируя результаты, авторы приходят к выводу, что “необласты” нужны скорее для тонкой настройки процесса регенерации, обусловливая формирование всех семи головных сегментов. Такая настройка происходит, по мнению авторов, посредством того, что “необласты” придают сегментам тела позиционное значение восьмого сегмента. Соответственно, при ампутации на уровне любого туловищного сегмента, согласно полученной позиционной информации, бластема всегда будет формировать семь головных сегментов. Остается непонятным в таком случае, чем обусловлена разница между передней и задней раневой поверхностью, которая обеспечивает сохранение переднезадней оси в ходе регенерации (Короткова, 1997).
Для выяснения возможной причины, почему особи E. buchholzi способны восстановить лишь гипоморфный головной конец, авторы сравнили пролиферативную активность клеток в ходе передней регенерации у E. buchholzi и E. japonensis (Myohara, 2012). Используя BrdU, авторы показали, что делящиеся клетки появляются в большом количестве лишь на 4-й день регенерации у E. buchholzi, тогда как E. japonensis формирует крупную бластему уже на первый день. В результате было высказано предположение о влиянии “необластов” на пролиферативную активность клеток бластемы. Итак, обнаружив новые возможные функции “необластов”, авторы оставляют открытым вопрос о клеточных источниках, формирующих внутреннюю часть бластемы.
Таким образом, несмотря на большое количество подробных исследований процесса регенерации, вопрос о клеточных источниках восстановления мезодермальных производных остается открытым. Многие авторы приписывают основную роль клеткам линии аннелидных необластов, однако, некоторые из них описывают эти клетки в ассоциации с брюшной нервной цепочкой (Randolph, 1892; Turner, 1934; Bilello, Potswald, 1974), тогда как другие наблюдают их миграцию в целомической полости. Вполне возможно, что, используя один и тот же термин “необласт”, авторы описывают разные клеточные популяции.
ВОССТАНОВЛЕНИЕ КИШКИ В ХОДЕ РЕГЕНЕРАЦИИ У АННЕЛИД
Кишка кольчатых червей состоит из переднего, среднего и заднего отделов. Передняя и задняя кишка формируются в эмбриогенезе из эктодермы, тогда как средняя часть кишки имеет энтодермальное происхождение. Эмбриональное происхождение отделов кишечника определяет уровень пластичности кишки в ходе регенерации аннелид. В целом, для полихет показано восстановление энтодермальной кишки за счет интактной части кишечника, а эктодермальная глотка восстанавливается обычно посредством инвагинации покровного эпителия в бластему (Berrill, 1952).
Во время задней регенерации терминальный участок кишки обычно входит в состав регенерационной почки. Сразу после ампутации происходит резкое сокращение мышц в прилежащем к ране сегменте, что обеспечивает закрытие раны. У полихеты A. virens непосредственно после сокращения мышечных волокон происходит некоторое выпадение кишки. Перерезанные края кишечного и покровного эпителиев смыкаются друг с другом, таким образом, что целомическая полость предшествующего ране сегмента оказывается изолированной от внешней среды. В то же время связь кишечника с внешней средой не утрачивается (Козин и др., 2017). По такому же механизму происходит закрытие раны на заднем конце тела у олигохеты E. japonensis (Myohara et al., 1999). Такой тип заживления раны называют “открытым”. Закрытый тип является более распространенным и представляет собой опосредованное мышечным сокращением стягивание краев раны к центру, что приводит к смыканию отдельно покровного и кишечного эпителия. В результате кишечная трубка оказывается слепо замкнутой (Короткова, 1997). Некий промежуточный вариант с выпадением части кишки, но последующим ее втягиванием и смыканием краев покровного эпителия над ней описан для Dorvillea bermudensis (Paulus, Müller, 2006).
Процесс закрытия раны может быть ассоциирован с морфаллактическими перестройками, как это было показано для полихет P. dumerilii и A. virens. Транскрипты foxA (гена, кодирующего специфичный для развития кишки транскрипционный фактор) были показаны на стадии закрытия раны в клетках терминального, слегка выпадающего участка кишечного эпителия. Столь ранняя экспрессия в интактных тканях свидетельствует о морфаллактических перестройках. Основываясь на результатах исследования, авторы предполагают возможную сигнальную роль терминального участка кишки. В дальнейшем экспрессия foxA сопровождает восстановление пищеварительной системы у обоих исследованных видов (Kostyuchenko et al., 2019).
Последующее восстановление кишки в составе заднего регенерата связано в первую очередь с пролиферацией стволовых элементов кишечного эпителия. С целью выявления клеток стволовой линии, была проведена предварительная инкубация червей P. dumerilii в растворе EdU. Выявление сигнала на пятый день регенерации привело к неожиданным результатам. Оказалось, что почти все клетки вновь сформированного кишечного эпителия содержали метку EdU. Эти результаты подтверждают идею о том, что в кишечном эпителии имеются стволовые клетки, в норме необходимые для физиологической регенерации кишечного эпителия (Planques et al., 2019). Вероятно, эти клетки могут участвовать в посттравматической регенерации кишки в ответ на ампутацию части сегментов. Активное размножение клеток интактного кишечника в ответ на ампутацию было неоднократно доказано методами авторадиографии и гистологии (Hill, 1970).
Наличие определенного отдела кишки в составе регенерирующей особи может иметь критическое значение для процесса задней регенерации. Например, для таких видов полихет, как Autolitus pictus, Procerastea halleziana и Syllis sp. показана необходимость присутствия в составе регенерирующего фрагмента энтодермальной (средней) кишки. Головные сегменты, содержащие только глотку, имеющую эктодермальное происхождение, не могут регенерировать задние сегменты, в состав которых входит кишка энтодермальной природы (Berrill, 1952).
Восстановление кишки во время передней регенерации имеет ряд особенностей, связанных с тем, что заживление раны в большинстве случаев происходит по “закрытому” типу, то есть обрезанный край кишки становится слепо замкнутым. Более того, активно пролиферирующие клетки бластемы занимают все пространство между интактной кишкой и покровным эпителием, поэтому ротовое отверстие формируется de novo (Hill, 1970). Полихеты Syllis gracilis и Procerastea halleziana восстанавливают ротовое отверстие, глотку и преджелудок посредством инвагинации покровного эпителия внутрь бластемы. Растущий внутрь зачаток новой кишки вскоре соединяется с интактным кишечником (Berrill, 1952). Оба вида способны к полноценной передней регенерации: они восстанавливают все утраченные передние сегменты даже из небольшого фрагмента тела. Большинство же полихет обладает ограниченной способностью к передней регенерации. Многочисленные полихеты семейства Syllidae восстанавливают не более четырех головных сегментов. При этом не происходит инвагинации стомодеума и восстановления глотки, а ротовое отверстие формируется за счет слияния старой кишки с покровным эпителием, либо кишка не восстанавливается вовсе. Тем не менее, формирование кишки даже в пределах всего лишь четырех сегментов предполагает увеличение количества клеток. Действительно, клетки интактного кишечного эпителия Sabella melanostigma включают радиоактивную метку Н3-тимидина, что говорит об их пролиферативной активности (Hill, 1970). Формирование глотки посредством инвагинации эпителия может происходить в соответствии с переднезадним градиентом тела. Некоторые виды, например Autolytus pictus, оказываются способны к восстановлению только при ампутации небольшого числа передних сегментов. Таким образом, формирование глотки путем инвагинации является критическим моментом передней регенерации полихет и может определять количество восстановленных сегментов (Okada, 1929).
На основании этих данных Беррилл (Berrill, 1952) делает следующие выводы о восстановлении кишки в ходе регенерации полихет. Во-первых, эктодермальная передняя кишка (ротовая полость и глотка) может быть восстановлена только путем инвагинации покровного эпителия внутрь бластемы. Интактная кишка энтодермальной природы не может обеспечить формирование глотки. Во-вторых, в ходе задней регенерации энтодермальная кишка не может быть восстановлена за счет клеток эктодермальных структур (в т.ч. глотки). Согласно автору, энтодермальная кишка способна удлиняться только в заднем направлении (Berrill, 1952). Этим, по-видимому, отчасти объясняются различия передней и задней регенерации полихет.
По сравнению с полихетами, кишка олигохет обладает большей пластичностью в ходе регенерации (Короткова, 1997). В частности, для Eisenia foetida, Tubifex rivulorum, Lumbriculus variegatus и некоторых других представителей семейства Lumbricidae показано восстановление глотки за счет старой кишки энтодермальной природы. При этом ротовое отверстие и ротовая полость формируются за счет покровного эпителия (Berrill, 1952). Сходным образом происходит восстановление кишки и у почвенной олигохеты E. japonensis (Takeo et al., 2008).
У Lumbriculus inconstans передние отделы кишечной трубки восстанавливаются за счет инвагинации покровов, однако, интактный кишечный эпителий растет в переднем направлении – навстречу зачатку глотки. Тщательный гистологический анализ показал, что удлинение кишки в переднем направлении происходит за счет пролиферации главных клеток кишки (principal cells). В ходе нормальной жизнедеятельности эти клетки обеспечивают внеклеточное пищеварение и всасывание питательных веществ. В ответ на ампутацию они утрачивают ресничный аппарат, теряют контакт с базальной мембраной и приступают к активным митотическим делениям. Автор специально подчеркивает, что базальные клетки (basal cells), отвечающие за физиологическую регенерацию клеток кишечного эпителия, не принимают участия в ходе посттравматической регенерации (Turner, 1934). Таким образом, в ходе регенерации Lumbriculus inconstans происходит дедифференцировка клеток кишечного эпителия, их активное размножение и последующая редифференцировка.
Исследование близкородственного Lumbriculus variegatus показало, что основную роль в регенерации передних отделов кишки играет миграция дифференцированных клеток кишки. Прижизненное наблюдение за перемещением энтодермальных клеток в ходе регенерации было осуществлено с использованием флуоресцентной метки к сериновым протеазам. Оказалось, что эти клетки остаются дифференцированными, производят сериновые протеазы в мембрано-связанной форме, перемещаются в составе единого клеточного пласта и формируют глотку. Использование ингибитора сериновых протеаз привело к полному угнетению передней и задней регенерации. Авторы предполагают, что сериновые протеазы могут осуществлять перестройку и локальное разрушение внеклеточного матрикса, что обеспечивает миграцию клеток в бластему, а также прорастание нервных окончаний. Суммируя полученные результаты, авторы описывают восстановление глотки как морфаллактический процесс (Tweeten, Reiner, 2012).
У Pristina leidyi формирование кишки начинается с появления передних ее отделов в центральной части бластемы. При этом ротовое отверстие формируется путем инвагинации покровного эпителия (Zattara, Bely, 2011). Независимое восстановление глотки и ротовой полости в ходе регенерации было подтверждено с использованием молекулярного маркера Otx (Bely, Wray, 2001).
Таким образом, восстановление кишки в ходе задней регенерации происходит в целом сходным образом у разных представителей аннелид и обеспечивается клетками интактного кишечного эпителия. Передняя регенерация, напротив, отличается большой вариабельностью (рис. 2). При этом очевидно, что производные энтодермы могут восстанавливаться за счет разных клеточных источников даже в пределах одной особи, обладающей способностью и к передней, и к задней регенерации. Так, например, в ходе передней регенерации P. leidyi кишка восстанавливается за счет клеток бластемы, а в ходе задней – за счет пролиферации клеток интактной кишки (Zattara, Bely, 2011). Это указывает на фундаментальные различия в механизмах передней и задней регенерации аннелид. Такие различия действительно были выявлены с использованием РНК-секвенирования и последующего анализа дифференциальной экспрессии генов (Ribeiro et al., 2019).
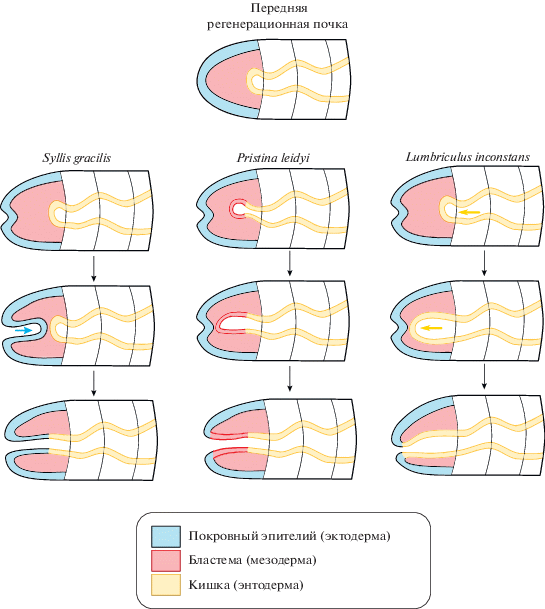
Рис. 2.
Способы восстановления кишки в ходе передней регенерации аннелид. На схеме передний конец тела направлен налево. По вертикали схематично изображены этапы восстановления кишки в ходе регенерации Syllis gracilis (Errantia), Pristina leidyi (Sedentaria, Clitellata), Lumbriculus inconstans (Sedentaria, Clitellata). Для всех аннелид общим признаком является восстановление ротового отверстия посредством инвагинации эпителия. У полихет (S. gracilis) глотка также восстанавливается за счет инвагинации эктодермального покровного эпителия. Для большинства олигохет характерно восстановление глотки за счет энтодермальной средней кишки (L. inconstans). Для P. leidyi описано восстановление глотки за счет клеток бластемы, без уточнения их происхождения. Схема составлена на основе данных Berrill (1952) (S. gracilis); Bely, Wray (2001) и Zattara, Bely (2011) (P. leidyi); и Turner (1934) (L. inconstans).
ВОССТАНОВЛЕНИЕ ПРОИЗВОДНЫХ ЭКТОДЕРМЫ (НЕРВНОЙ СИСТЕМЫ И ПОКРОВОВ)
Активно пролиферирующие клетки покровного эпителия около раны являются источником формирования новых покровов (Bely, 2014; Костюченко и др., 2016). Нервная система восстанавливается как за счет клеток покровного эпителия, так и за счет клеток интактной нервной системы.
В ходе регенерации олигохеты P. leidyi элементы нервной системы регенерата имеют разное происхождение: нервные ганглии формируются из клеток бластемы, тогда как нервные волокна формируются из выростов интактной нервной цепочки (Zattara, Bely, 2011). В ходе регенерации у олигохеты E. japonensis было показано, что еще до проявления всех остальных регенеративных процессов, бластему охватывает сеть нервных волокон (Yoshida-noro et al., 2000). Авторы соотносят эти данные с уже существующей гипотезой об активирующем влиянии нейронов на процесс дедифференцировки клеток, которые, размножаясь, формируют бластему (Thouveny, 1998). Подобное явление отмечено и в ходе регенерации у олигохеты Stylaria lacustris и полихеты A. virens (Müller, 2004; Козин и др., 2017). Прямая зависимость между наличием аксональных выростов и пролиферативной активностью клеток бластемы была отмечена при изучении задней регенерации у полихеты С. teleta (de Jong, Seaver, 2018). Авторы отмечают две вероятные функции нервных волокон в бластеме. Во-первых, нейроны могут выделять некие трофические факторы, стимулирующие клетки к делениям. Во-вторых, по аксонам может происходить миграция клеток, формирующих бластемные массы. О формировании новых элементов нервной системы из клеток бластемы можно судить по экспрессии генов pax6 и neurogenin (Planques et al., 2019). Появление нервных окончаний на поверхности раны у A. virens может быть свидетельством того, что в брюшной нервной цепочке новые границы тела устанавливаются уже на первый день регенерации (Козин и др., 2017). Таким образом, роль нервной системы может состоять и в обеспечении глобального паттернирования вдоль переднезадней оси.
В многочисленных исследованиях отмечена регулятивная роль интактной брюшной нервной цепочки в ходе регенерации. Известно, что брюшная нервная цепочка может определять место закладки регенерационной бластемы (Bely, 2014). Было показано, что при отведении нервного тяжа к латеральной стороне тела полихеты Spirographis spallanzanii, происходит формирование эктопического головного или хвостового отдела, с сохранением полярности (Короткова, 1997). Паттернирование бластемы вдоль дорсовентральной оси может быть обеспечено сигналами брюшной нервной цепочки, так как при нарушении контакта нервного тяжа с местом ранения, бластема состоит из дорсальных тканей (Boilly et al., 2017).
КЛЕТОЧНЫЕ ИСТОЧНИКИ ФОРМИРОВАНИЯ ГОНАД В ХОДЕ РЕГЕНЕРАЦИИ И БЕСПОЛОГО РАЗМНОЖЕНИЯ
Некоторые аннелиды способны восстановить гонады в ходе регенерации и бесполого размножения. Для E. japonensis, размножающегося фрагментацией, показано, что этот процесс обусловлен миграцией по брюшной нервной цепочке клеток, экспрессирующих гомолог piwi (Tadokoro et al., 2006). Эти клетки имеют морфологию недифференцированных клеточных элементов и внешне похожи на необласты. В интактном животном они располагаются на вентральной стороне тела вдоль нервного тяжа. Авторы работы показали, что piwi-позитивные клетки не вносят вклад в формирование бластемы, а мигрируют в состав переднего регенерата на более поздней стадии. Попадая в новообразованные 6-й и 7-й сегмент, они делятся и образуют зачатки гонад. Недавно было показано, что линии необластов, piwi-позитивных предшественников первично половых клеток и клеток, входящих в состав зоны роста, разделяются сразу после эмбрионального развития E. japonensis (Sugio et al., 2008).
Восстановление гонад было показано также в ходе бесполого размножения олигохеты Pristina leidyi (Özpolat, Bely, 2015). Механизм этого процесса сходен с таковым у E. japonensis и так же обусловлен миграцией piwi-позитивных клеток.
Кроме того, формирование гонад в новообразованных задних сегментах показано у полихеты Capitella teleta, которая размножается исключительно половым путем (Giani et al., 2011). В отличие от E. japonensis, у Capitella teleta piwi-позитивные клетки в большом количестве присутствуют в бластеме, начиная с самых ранних стадий ее закладки.
Стоит отметить, что из приведенных примеров только у E. japonensis была показана возможность становления гонад de novo в регенерирующем фрагменте, не содержащем семенников и яичников. В случае P. leidyi половые органы входили в состав материнской особи, а у C. teleta ампутировали не все сегменты, несущие гонады.
Интересно, что, несмотря на стереотипный характер эмбрионального развития, для некоторых полихет показана способность к эмбриональной регуляции. В недавнем исследовании (Dannenberg, Seaver, 2018) продемонстрировано восстановление линии половых клеток после удаления их предшественников на стадии ранних зародышей C. teleta. Неожиданно, удаление соответствующих клеток квадранта D приводило к эктопической экспрессии генов CapI-vasa и CapI-nanos в других тканях личинок. Более того, через две недели после метаморфоза все животные, развившиеся из прооперированных зародышей, имели сформированные кластеры мультипотентных клеток, и почти все, достигнув взрослого состояния, приступали к половому размножению. Таким образом, компенсация предшественников такой особой клеточной популяции как первично половые клетки возможна в результате эмбриональной регуляции – разновидности регенерации.
МОРФАЛЛАКСИС КАК ЭЛЕМЕНТ РЕГЕНЕРАТИВНОГО ПРОЦЕССА
Несмотря на значительную роль пролиферации клеток в ходе регенерации аннелид, многими авторами описан процесс морфаллаксиса. В ходе морфаллаксиса активных клеточных делений не происходит, бластема не образуется, а восстановление утраченных участков тела происходит путем реорганизации уже имеющихся структур (Короткова, 1997). В большинстве случаев наблюдается сочетание эпиморфоза и морфаллактических перестроек, поэтому некоторые авторы отмечают условность такого разделения восстановительных процессов (Короткова, 1997). Морфаллаксис может происходить на разных уровнях (молекулярном, тканевом, органном или на уровне целых участков тела) и, вероятно, является необходимым условием полноценной регенерации (Костюченко, Козин, 2020).
Морфаллаксис на молекулярном уровне обеспечивает два важных события: восстановление позиционной информации после проведения ампутации и, соответственно, запуск адекватного повреждению регенерационного ответа; интеграция сформированного регенерата в существующую систему координат.
Вероятными участниками процесса поддержания и восстановления позиционной информации после ампутации являются Hox-гены (Novikova et al., 2013). Во время роста ювенильных червей A. virens координированный паттерн экспрессии Hox-генов не приводит к спецификации сегментов (так как тело A. virens не имеет тагм), а обеспечивает позиционную информацию вдоль переднезадней оси (Kulakova et al., 2007). Во время задней регенерации транскрипция Hox-генов происходит в два этапа. Во время ранней фазы (начиная с 48-ми часов до стадии дифференцировки бластемы) происходит реорганизация существующего Hox-кода в соответствии с новой задней границей тела. Вторая фаза экспрессии связана с паттернированием бластемы и формирующихся сегментов. Авторы также предлагают механизм запуска молекулярно-клеточных событий в ответ на ампутацию. Тканевым событием, инициирующим процесс регенерации, по их предположению является контакт кишечного (энтодермального) и покровного (эктодермального) эпителиев, происходящий во время заживления раны. Место контакта двух клеточных пластов становится своего рода организатором, посылающим морфогенетический сигнал. Этот сигнал индуцирует реорганизацию позиционной информации, что запускает клеточный ответ регенерации (дедифференцировка клеток, их пролиферация, восстановление зоны роста и недостающих сегментов). Авторы предполагают, что гомолог гена caudal является позиционным маркером, чувствительным к сигналу организатора и инициирующим перестройку разметки тела вдоль переднезадней оси (Novikova et al., 2013). Такой сценарий согласуется с данными о важности взаимодействия кишечного и покровного эпителиев для репаттернирования тела в ходе регенерации, полученными в экспериментах на аннелидах и других животных (Короткова, 1997).
Результаты, полученные Е.Л. Новиковой и коллегами (Novikova et al., 2013), отчасти подтверждаются аналогичным исследованием, проведенном на родственной полихете P. dumerilii (Pfeifer et al., 2012). Авторы этой работы проанализировали паттерн экспрессии Hox-генов только во вновь сформированных тканях. Они предполагают, что ансамбль генов Hox-кластера в тканях регенерата P. dumerilii обеспечивает паттернирование нервной системы новых сегментов.
Тем не менее, механизм восстановления позиционной информации посредством генов Hox-кластера не является универсальным. Ампутация задних сегментов полихеты C. teleta не приводит к сдвигу границ экспрессии большинства Hox-генов в интактных сегментах. Передние границы экспрессии только трех генов (CapI-lox2, CapI-lox4 и CapI-Post2) сдвигаются на один сегмент вперед. По-видимому, разметка тела C. teleta остается стабильной в ходе задней регенерации (de Jong, Seaver, 2016).
Значительные морфаллактические перестройки кишки в ходе передней и задней регенерации обнаружены у олигохеты E. japonensis. С использованием молекулярных маркеров tuba, mino и horu авторы показали, что после регенерации утраченных сегментов по типу эпиморфоза, происходит восстановление исходных пропорций кишечного тракта всего животного, то есть морфаллаксис. Таким образом, регенерат оказывается интегрирован в единую систему организма (Takeo et al., 2008). В тоже время, у олигохет из рода Pristina только часть кишки, расположенная в двух ближайших к ране старых сегментах, претерпевает трансформацию в новый желудок в ходе передней регенерации (Zattara, Bely, 2011; Костюченко и др., 2016).
Морфаллаксис может затрагивать не только системы, но и отдельные метамерные органы в ходе регенерации. Например, в двух интактных сегментах тела олигохеты P. leidyi, прилежащих к восстановленным головным сегментам, происходит деградация метанефридиев. Вероятно, это связано с приобретением этими сегментами нового позиционного значения (Zattara, Bely, 2011).
Существуют, однако, и примеры значительных перестроек сегментов в ходе регенерации. Восстановление передних сегментов Sabella melanostigma протекает с образованием регенерационной бластемы, из которой формируются простомиум, перистомиум и два передних грудных сегмента. Остальные грудные сегменты восстанавливаются за счет перестройки брюшных сегментов. Процесс морфаллаксиса в данном случае можно описать как смену дорсовентральной полярности сегментов. Эта трансформация затрагивает производные всех трех зародышевых листков: кишечник трансформируется в желудок, параподиальные структуры перестраиваются в соответствии со сменой дорсовентральной оси, а кроме того, появляются свойственные грудным сегментам метанефридии. При этом восстановление сегментов в ходе задней регенерации происходит по типу эпиморфоза, без явных признаков морфаллаксиса. После ампутации на уровне грудных сегментов сначала восстанавливаются недостающие грудные сегменты, а затем – брюшные. Учитывая антипараллельность дорсовентральной оси грудных и брюшных сегментов, естественно предположить уникальный для сабеллид механизм инверсии задней зоны роста в ходе регенерации (Berrill, 1978).
ПЕРСПЕКТИВЫ: МОЛЕКУЛЯРНЫЕ ПОДХОДЫ
Несмотря на значительный прогресс в обнаружении молекулярных участников, поиск последних производится, как правило, методами иммуноцитохимии или гибридизации in situ, что не позволяет получать массивные данные. Одной из самых ранних работ, имевших целью получение информации о большом количестве генов, экспрессирующихся в ходе регенерации у E. japonensis, было исследование Миохара с коллегами (Myohara et al., 2006). На основе кДНК ими было клонировано большое количество генов. Среди этих 165 генов оказалось немало ферментов, однако почти для половины генов не были найдены ортологи.
Очевидно, переход к новым технологиям, например, к сравнительной трансриптомике, может существенно ускорить наше понимание основ регенерации. Так в недавно опубликованной работе (Ribeiro et al., 2019) показана дифференциальная экспрессия генов при регенерации двух вдов аннелид: Sphaerosyllis hystrix (4771 генов) и Syllis gracilis (1997), способных к ограниченной и полноценной передней регенерации, соответственно. Для обоих видов сравнительный транскриптомный анализ показал сходство экспрессии генов во время задней регенерации и регулярного роста, тогда как передняя регенерация характеризовалась активацией нескольких иных генов. Прицельный поиск был проведен по 71 гену, экспрессия которых была ранее показана при регенерации других аннелид (см. выше). Большинство из этих генов были идентифицированы в транскриптомах (57 для S. hystrix и 54 для S. gracilis). Кроме того, были обнаружены множественные изоформы генов, например, paics и slit для S. hystrix или even-skipped, FGFR, gcs1a, glutamine synthetase, hedgehog, JNK, Msx, piwi1, Sfrp1/2/5 и Wnt для S. gracilis, что может свидетельствовать о наличии нескольких гомологов. JNK, rup2 и paics у S. hystrix, а также β-catenin, cycB3, glutamine synthetase, paics, PL10, brat, elav, FGFR, gcs1a, slit, Hox7, Lox2 у S. gracilis оказались среди генов, дифференциально экспрессирующихся в ходе передней регенерации. Таким образом, в ходе передней регенерации у двух представителей Syllidae показано участие целого набора генов, ответственных за клеточную пролиферацию, поддержание стволового и мультипотентного статуса клеток, развитие нервной системы и формирование позиционной информации.
Интересно, что в обоих транскриптомах были идентифицированы гомологи Ej-rup 1–5 (гены, регулирующие регенерацию E. japonensis (Myohara et al., 2006)). Однако только у S. hystrix один из них (Shy-rup2) экспрессировался на более высоком уровне в ходе передней регенерации (в сравнении с нормальным ростом). Функция этого гена не ясна, но Ej-rup2 был обнаружен в эпидермальных клетках бластемы во время передней регенерации и может быть геном, специфичным для регенерации (Myohara et al., 2006; Ribeiro et al., 2019).
В другой работе на олигохете Eisenia fetida было показано, что менее чем сто генов демонстрировали существенную дифференциальную экспрессию в ходе всего периода задней регенерации. Однако при этом, в сравнении с интактными тканями, в тканях регенерата значительное количество генов прекращали экспрессироваться. По мнению авторов, такое сокращение набора активных генов связано с недифференцированным состоянием большинства клеток регенерационной почки (Bhambri et al., 2018). Транскриптомный анализ показал не только существенный уровень транскриптов, кодирующих SOX4, Brachyury, Even-skipped, участников сигнальных путей (FGF, BMP2, WNT), факторы цилиогенеза, развития нервной системы и роста аксонов, но и некодирующих РНК, включая микроРНК (Bhambri et al., 2018).
Итак, согласно приведенным из литературы сведениям, аннелиды в большинстве своем обладают выраженными регенеративными способностями. Однако механизмы восстановления утраченных частей тела могут существенно отличаться даже у близкородственных видов. Несмотря на большое количество подробных исследований процесса регенерации, вопрос о клеточных источниках восстановления мезодермальных производных остается открытым. Очевидно, что для полного раскрытия механизмов регенерации с учетом всего разнообразия биологических процессов, способствующих как сохранению, так и ограничению способностей регенерировать различные ткани, органы и части тела, требуются комплексные исследования. Технические условия для реализации таких проектов уже созданы. Привлечение современных методов морфологического анализа, в том числе на основе трансгенных моделей, методов геномики, транскриптомики, секвенирования отдельных клеток и различных способов функционального анализа могут позволить уже в ближайшем будущем ответить на многие вопросы относительно регенерации.
Исследования проведены при финансовой поддержке грантов РФФИ 19-04-01111-а и 18-34-00962-мол-а.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что какой-либо конфликт интересов отсутствует.
Список литературы
Козин В.В., Бабаханова Р.А., Костюченко Р.П. Участие МАР-киназного сигналинга в спецификации клеточных линий и дорсовентральной оси у примитивной гастроподы Testudinalia testudinalis (Patellogastropoda, Mollusca) // Онтогенез. 2013. Т. 44. № 1. С. 42–56.
Козин В.В., Филиппова Н.А., Костюченко Р.П. Восстановление нервной и мышечной системы в ходе регенерации полихеты Alitta virens (Annelida: Nereididae) // Онтогенез. 2017. Т. 48. № 3. С. 234–247.
Короткова Г.П. Регенерация животных. С-Пб.: изд-во С.-Петерб. ун-та, 1997. 480 с.
Костюченко Р.П., Дондуа А.К. Закономерности формирования прототроха в эмбриональном развитии полихеты Nereis virens // Онтогенез. 2006. Т. 37. № 2. С. 91–99.
Костюченко Р.П., Дондуа А.К. Особенности развития изолированных бластомеров полихеты Alitta virens // Онтогенез. 2017. Т. 48. № 3. С. 275–280.
Костюченко Р.П., Козин В.В. Морфаллаксис versus эпиморфоз? Клеточные и молекулярные аспекты регенерации и бесполого размножения у аннелид // Изв. РАН. Сер. биол. 2020. Т. 47. № 3. (в печати).https://doi.org/10.31857/S0002332920030042
Костюченко Р.П., Козин В.В., Купряшова Е.Е. Регенерация и бесполое размножение у аннелид: клетки, гены и эволюция // Изв. РАН. Сер. биол. 2016. V. 43. № 3. P. 231–241.
Новикова Ю.П., Поплинская В.А., Григорян Э.Н. Органотипическое культивирование как способ изучения восстановительных возможностей сетчатки глаза позвоночных животных и человека // Онтогенез. 2020. Т. 51. № 1. С. 35–50.
Харин А.В., Загайнова И.В., Костюченко Р.П. Формирование зоны паратомии у пресноводных олигохет // Онтогенез. 2006. Т. 37. № 6. С. 424–437.
Bely A.E. Early events in annelid regeneration: a cellular perspective // Integr. Comp. Biol. 2014. V. 54. № 4. P. 688–699.
Bely A.E., Sikes J.M. Latent regeneration abilities persist following recent evolutionary loss in asexual annelids // Proc. Natl Acad. Sci. USA. 2010. V. 107. P. 1464–1469.
Bely A.E., Wray G.A. Evolution of regeneration and fission in annelids: insights from engrailed- and orthodenticle-class gene expression // Development. 2001. V. 128. № 14. P. 2781–2791.
Berrill N.J. Regeneraton and budding in worms // Biol. Rev. 1952. V. 27. № 4. P. 401–438.
Berrill N.J. Induced segmental reorganization in sabellid worms // J. Embryol. Exp. Morphol. 1978. V. 47. P. 85–96.
Bhambri A., Dhaunta N., Patel S.S., Hardikar M. et al. Large scale changes in the transcriptome of Eisenia fetida during regeneration // PLoS One. 2018. V. 13. № 9. e0204234.
Bilello A.A., Potswald H.E. A cytological and quantitative study of neoblasts in the naid Ophidonais serpentina (Oligochaeta) // Wilhelm Roux. Arch. Entwickl. Mech. Org. 1974. V. 174. № 3. P. 234–249.
Boilly B., Boilly-marer Y., Bely A.E. Regulation of dorso-ventral polarity by the nerve cord during annelid regeneration: A review of experimental evidence // Regeneration. 2017. V. 4. № 2. P. 54–68.
Cornec J.-P., Cresp J., Delye P., Hoarau F., Reynaud G. Tissue responses and organogenesis during regeneration in the oligochete Limnodrilus hoffmeisteri (Clap.) // Can. J. Zool. 1987. V. 65. № 2. P. 403–414.
Dannenberg L.C., Seaver E.C. Regeneration of the germline in the annelid Capitella teleta // Dev. Biol. 2018. V. 435. P. 26–40.
de Jong D.M., Seaver E.C. Investigation into the cellular origins of posterior regeneration in the annelid Capitella teleta // Regeneration. 2018. V. 5. № 1. P. 61–77.
de Jong D.M., Seaver E.C. A Stable thoracic Hox code and epimorphosis characterize posterior regeneration in Capitella teleta // PLoS One. 2016. V. 11. № 2. e0149724.
de Rosa R., Prud’homme B., Balavoine G. caudal and even-skipped in the annelid Platynereis dumerilii and the ancestry of posterior growth // Evol. Dev. 2005. V. 7. № 6. P. 574–587.
Dill K.K., Seaver E.C. Vasa and nanos are coexpressed in somatic and germ line tissue from early embryonic cleavage stages through adulthood in the polychaete Capitella sp. I // Dev. Genes Evol. 2008. V. 218. № 9. P. 453–463.
Dupin F., Coulon J., Parco Y. Le, Fontes M., Thouveny Y. Formation of the extracellular matrix during the epimorphic anterior regeneration of Owenia fusiformis: autoradiographical and in situ hybridization studies // Int. J. Dev. Biol. 1991. V. 35. № 2. P. 109–119.
Fontés M., Coulon J., Delgrossi M.H., Thouveny Y. Muscle dedifferentiation and contractile protein synthesis during post-traumatic regeneration by Owenia fusiformis (polychaeta annelid) // Cell Differ. 1983. V. 13. № 4. P. 267–282.
Gazave E., Behague J., Laplane L., Guillou A., Preau L., Demilly A., Balavoine G., Vervoort M. Posterior elongation in the annelid Platynereis dumerilii involves stem cells molecularly related to primordial germ cells // Dev. Biol. 2013. V. 382. P. 246–267.
Giani V.C., Yamaguchi E., Boyle M.J., Seaver E.C. Somatic and germline expression of piwi during development and regeneration in the marine polychaete annelid Capitella teleta // Evodevo. 2011. V. 2. № 10. P. 1–18.
Hill S.D. Origin of the regeneration blastema in polychaete annelids // Integr. Comp. Biol. 1970. V. 10. № 2. P. 101–112.
Juliano C.E., Swartz S.Z., Wessel G.M. A conserved germline multipotency program // Development. 2010. V. 137. № 24. P. 4113–4126.
Kostyuchenko R.P., Kozin V.V., Filippova N.A., Sorokina E.V. FoxA expression pattern in two polychaete species, Alitta virens and Platynereis dumerilii: Examination of the conserved key regulator of the gut development from cleavage through larval life, postlarval growth, and regeneration // Dev. Dyn. 2019. V. 248. № 8. P. 728–743.
Kozin V.V., Filimonova D.A., Kupriashova E.E., Kostyuchenko R.P. Mesoderm patterning and morphogenesis in the polychaete Alitta virens (Spiralia, Annelida): Expression of mesodermal markers Twist, Mox, Evx and functional role for MAP kinase signaling // Mech. Dev. 2016. V. 140. P. 1–11.
Kozin V.V., Kostyuchenko R.P. Vasa, PL10, and Piwi gene expression during caudal regeneration of the polychaete annelid Alitta virens // Dev. Genes Evol. 2015. V. 225. № 3. P. 129–138.
Kulakova M., Bakalenko N., Novikova E., Cook C.E., Eliseeva E., Steinmetz P.R.H., Kostyuchenko R.P., Dondua A., Arendt D., Akam M., Andreeva T. Hox gene expression in larval development of the polychaetes Nereis virens and Platynereis dumerilii (Annelida, Lophotrochozoa) // Dev. Genes Evol. 2007. V. 217. № 1. P. 39–54.
Lanza A.R, Seaver E.C. An organizing role for the TGF-β signaling pathway in axes formation of the annelid Capitella teleta // Dev. Biol. 2018. V. 435. P. 26–40.
Müller M.C.M. Nerve development, growth and differentiation during regeneration in Enchytraeus fragmentosus and Stylaria lacustris (Oligochaeta) // Dev. Growth Differ. 2004. V. 46. № 5. P. 471–478.
Myohara M. What role do annelid neoblasts play? A comparison of the regeneration patterns in a neoblast-bearing and a neoblast-lacking Enchytraeid Oligochaete // PLoS One. 2012. V. 7. № 5. e37319.
Myohara M., Niva C.C., Lee J.M. Molecular approach to annelid regeneration: cDNA subtraction cloning reveals various novel genes that are upregulated during the large-scale regeneration of the oligochaete, Enchytraeus japonensis // Dev. Dyn. 2006. V. 235. P. 2051–2070.
Myohara M., Yoshida-noro C., Kobari F. Fragmenting oligochaete Enchytraeus japonensis: A new material for regeneration study // Dev. Growth Differ. 1999. V. 41. № 5. P. 549–555.
Nakamoto A., Nagy L.M., Shimizu T. Secondary embryonic axis formation by transplantation of D quadrant micromeres in an oligochaete annelid // Development. 2010. V. 138. P. 283–290.
Newmark P.A., Alvarado A.S. Regeneration in Planaria // eLS. 2001. P. 1–7.
Novikova E.L., Bakalenko N.I., Nesterenko A.Y., Kulakova M.A. Expression of Hox genes during regeneration of nereid polychaete Alitta (Nereis) virens (Annelida, Lophotrochozoa) // Evodevo. 2013. V. 4. № 14.
Okada Y.K. Regeneration and fragmentation in the Syllidian Polychaetes // W. Roux’ Archiv f. Entwicklungsmechanik. 1929. V. 115. № 3. P. 542–600.
Oyama A., Shimizu T. Transient occurrence of vasa-expressing cells in nongenital segments during embryonic development in the oligochaete annelid Tubifex tubifex // Dev. Genes Evol. 2007. V. 217. № 10. P. 675–690.
Oyama A., Yoshida H., Shimizu T. Embryonic expression of p68, a DEAD-box RNA helicase, in the oligochaete annelid Tubifex tubifex // Gene Expr. Patterns. 2008. V. 8. № 6. P. 464–470.
Özpolat B.D., Bely A.E. Gonad establishment during asexual reproduction in the annelid Pristina leidyi // Dev. Biol. 2015. V. 405. № 1. P. 123–136.
Paulus T., Müller M.C.M. Cell proliferation dynamics and morphological differentiation during regeneration in Dorvillea bermudensis (Polychaeta, Dorvilleidae) // J. Morphol. 2006. V. 267. № 4. P. 393–403.
Pfeifer K., Dorresteijn A.W.C., Fröbius A.C. Activation of Hox genes during caudal regeneration of the polychaete annelid Platynereis dumerilii // Dev. Genes Evol. 2012. V. 222. № 3. P. 165–179.
Planques A., Malem J., Parapar J., Vervoort M., Gazave E. Morphological, cellular and molecular characterization of posterior regeneration in the marine annelid Platynereis dumerilii // Dev. Biol. 2019. V. 445. № 2. P. 189–210.
Randolph H. The regeneration of the tail in Lumbriculus // J. Morphol. 1892. V. 7. № 3. P. 317–344.
Ribeiro R.P., Ponz-Segrelles G., Bleidorn C., Aguado M.T. Comparative transcriptomics in Syllidae (Annelida) indicates that posterior regeneration and regular growth are comparable, while anterior regeneration is a distinct process // BMC Genomics. 2019. V. 20. № 1. P. 1–13.
Stocum D.L. Regenerative Biology and Medicine. 2 ed. Amsterdam: Elsevier Science Publ. Co. Inc., 2012. 474 p.
Sugio M., Takeuchi K., Kutsuna J., Tadokoro R., Takahashi Y., Yoshida-noro C., Tochinai S. Exploration of embryonic origins of germline stem cells and neoblasts in Enchytraeus japonensis (Oligochaeta, Annelida) // Gene Expr. Patterns. 2008. V. 8. № 4. P. 227–236.
Sugio M., Yoshida-noro C., Ozawa K., Tochinai S. Stem cells in asexual reproduction of Enchytraeus japonensis (Oligochaeta, Annelid): Proliferation and migration of neoblasts // Dev. Growth Differ. 2012. V. 54. № 4. P. 439–450.
Tadokoro R., Sugio M., Kutsuna J., Tochinai S. Early segregation of germ and somatic lineages during gonadal regeneration in the annelid Enchytraeus japonensis // Curr. Biol. 2006. V. 16. № 10. P. 1012–1017.
Takeo M., Yoshida-noro C., Tochinai S. Morphallactic regeneration as revealed by region-specific gene expression in the digestive tract of Enchytraeus japonensis (Oligochaeta, Annelida) // Dev. Dyn. 2008. V. 237. № 5. P. 1284–1294.
Takeo M., Yoshida-noro C., Tochinai S. Functional analysis of grimp, a novel gene required for mesodermal cell proliferation at an initial stage of regeneration in Enchytraeus japonensis (Enchytraeidae, Oligochaete) // Int. J. Dev. Biol. 2010. V. 160. P. 151–160.
Thouveny Y. Regeneration through phylogenesis // Cell. Mol. Basis Regen. 1998. P. 9–44.
Turner C.D. The effects of X-rays on posterior regeneration in Lumbriculus inconstans // J. Exp. Zool. 1934. V. 68. № 1. P. 95–119.
Tweeten K.A., Anderson A. Analysis of cell proliferation and migration during regeneration in Lumbriculus variegatus (Clitellata: Lumbriculidae) // Bios. 2008. V. 79. № 4. P. 183–190.
Tweeten K.A., Reiner A. Characterization of serine proteases of Lumbriculus variegatus and their role in regeneration // Invertebr. Biol. 2012. V. 131. № 4. P. 322–332.
Wanninger A. (Ed.) Evolutionary Developmental Biology of Invertebrates 2: Lophotrochozoa (Spiralia). Vienna: Springer Vienna, 2015. 289 p.
Yoshida-noro C., Myohara M., Kobari F., Tochinai S. Nervous system dynamics during fragmentation and regeneration in Enchytraeus japonensis (Oligochaeta, Annelida) // Dev. Genes Evol. 2000. V. 210. № 6. P. 311–319.
Yoshida-noro C., Tochinai S. Stem cell system in asexual and sexual reproduction of Enchytraeus japonensis (Oligochaeta, Annelida) // Dev. Growth Differ. 2010. V. 52. № 1. P. 43–55.
Zattara E.E., Bely A.E. Evolution of a novel developmental trajectory: fission is distinct from regeneration in the annelid Pristina leidyi // Evol. Dev. 2011. V. 13. № 1. P. 80–95.
Дополнительные материалы отсутствуют.


