Онтогенез, 2020, T. 51, № 3, стр. 218-224
Влияние этилметилгидроксипиридин сукцината (“Мексидол”) на мейотическое созревание ооцитов, интегральную целостность генома, а также изменение экспрессии генов в кумулюсных клетках мышей в условиях системного иммунокомплексного повреждения
Е. А. Кондрацкая a, *, Н. Г. Грушка a, Т. Ю. Вознесенская a, Р. И. Янчий a
a Институт физиологии им. А.А. Богомольца НАН Украины
01024 Киев, ул. Академика Богомольца 4, Украина
* E-mail: elena-shepel@ukr.net
Поступила в редакцию 20.12.2019
После доработки 27.01.2020
Принята к публикации 31.01.2020
Аннотация
На модели экспериментального системного иммунокомплексного повреждения (индуцированного длительной иммунизацией мышей линии СВА бычьим сывороточным альбумином (БСА)) нами исследовано влияние этилметилгидроксипиридин сукцината (ГС, препарат “Мексидол”) на мейотическое созревание ооцитов, степень повреждения ДНК, а также экспрессию в кумулюсных клетках генов гремлина 1 (Grem1), гиалуронансинтазы 2 (HAS2) и циклооксигеназы 2 (COX2), которые, согласно современным данным, играют критически важную роль в оогенезе и могут характеризовать качество ооцитов. Использование ГС оказывало протективный эффект на морфо-функциональное состояние клеток яичников. Введение ГС ослабляло генотоксический стресс, индуцированный БСА, что проявлялось в уменьшении числа кумулюсных клеток с сильным повреждением ДНК. Отмечено усиление экспрессии исследованных генов: увеличение количества мРНК COX2 – в 1.61 раз и Grem1 – в 1.47 раз. Выявлено также увеличение содержания транскриптов гена HAS2 в 1.38 раз, однако эти значения не были статистически достоверными. Данные изменения положительно сказывались на мейотическом созревании ооцитов: наблюдалось существенное увеличение их количества на стадиях метафазы I и II. Таким образом, мы полагаем, что ГС может быть использован с терапевтической целью при заболеваниях иммунокомплексного генеза.
ВВЕДЕНИЕ
Повреждения, опосредованные иммунными комплексами (ИК) являются важной составной частью многокомпонентного патологического процесса при аутоиммунных, аллергических, воспалительных и инфекционных заболеваниях. Нами показано (Shepel et al., 2016), что интенсивное воздействие антигенного стимула при иммунизации мышей бычьим сывороточным альбумином (БСА) вызывает в организме системный патологический процесс иммунокомплексного генеза, который сопровождается активацией клеточного и гуморального звеньев иммунной системы, увеличением уровня ИК в сыворотке крови и усилением их фиксации в поврежденных тканях. При этом выявлено расстройство функций яичников, повреждение морфо-функционального состояния овариальных клеток (Shepel et al., 2016). Известно, что ИК являются сильными активаторами клеток эффекторов, которые вырабатывают большое количество провоспалительных факторов, в том числе и активных форм азота и кислорода (АФК) (Шмагель, Черешнев, 2009; Bosques, Manning, 2016; Mahajan et al., 2016). Нами установлено, что в условиях иммунокомплексной патологии усиливалась генерация АФК, таких как супероксид радикал (Sribna et al., 2016). Чрезмерная активация клеток-эффекторов воспаления, увеличение продукции биологически активных веществ (включая АФК) на фоне недостаточной антиоксидантной защиты клеток является одним из важных патогенетических механизмов повреждения тканей (Jancar, 2005; Шмагель, Черешнев, 2009; Bosques, Manning, 2016; Mahajan et al., 2016), который также может быть задействован в развитие овариальной дисфункции в условиях иммунокомплексной патологии.
Ранее показано, что использование препаратов, проявляющих антиоксидантные свойства, к которым относится “Мексидол” (этилметилгидроксипиридин сукцинат, ГС), оказывает положительный эффект на функциональное состояние миометрия матки мышей на фоне иммунизации БСА (Lytvynenko et al., 2014). Учитывая вышесказанное, является актуальным дальнейшее исследование влияния ГС в условиях системной патологии иммунокомплексного генеза для возможной коррекции овариальной дисфункции, сопровождающейся нарушением оогенеза и, как следствие, ухудшением качества ооцитов. В связи с этим целью нашей работы было: используя модель экспериментального системного иммунокомплексного повреждения, изучить действие ГС на мейотическое созревание ооцитов мышей, оценить целостность генома (степень повреждения ДНК), а также изменение экспрессии генов гремлина 1 (Grem1), гиалуронансинтазы 2 (HAS2) и циклооксигеназы (COX2) в кумулюсных клетках. Согласно современным данным исследуемые гены играют важную роль во время оогенеза и могут характеризовать качество ооцитов (McKenzie et al., 2004; Shepel et al., 2016; Scarica et al., 2019).
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на половозрелых самках мышей линии СВА (6–8 недель, массой 18–20 г) вивария Института физиологии им. А.А. Богомольца НАН Украины. Модель системного хронического патологического процесса иммунокомплексного генеза воспроизводили с помощью иммунизации мышей БСА (“Sigma-Aldrich”, США) в течение 6 недель внутривенно раз в неделю по схеме: 1-я неделя введения 150 мг БСА/кг; 2-я – 175 мг/кг; 3-я – 200 мг/кг; 4-я – 225 мг/кг; 5-я – 250 мг/кг; 6-я – 275 мг/кг массы мыши. Введение ГС (препарат “Мексидол”, “Фармасофт”, Россия) иммунизированным мышам в дозе 100 мг/кг проводили внутрибрюшинно раз в неделю согласно схемы иммунизации. Контрольным мышам вводили физиологический раствор. На 7-е сут после последней иммунизации животных подвергали эфирному наркозу и выделяли яичники для дальнейших исследований.
Для оценки мейотического созревания ооцитов из яичников стерильно выделяли зрелые фолликулы и подсчитывали их количество. Кумулюсно-ооцитарные клеточные комплексы культивировали в термостате при 37°С в течение 20 ч в среде ДМЕ с добавлением 5% эмбриональной телячьей сыворотки. После 4 ч культивирования подсчитывали количество ооцитов (в % от общего числа), которые пребывали на стадии метафазы I (растворение зародышевого пузырька), а после 20 ч – на стадии метафазы II (формирование первого полярного тельца).
Степень повреждения ДНК в кумулюсных клетках мышей определяли методом щелочного гель-электрофореза изолированных клеток (метод ДНК-комет – “DNA comet assay”) как описано ранее (Shepel et al., 2018). Суть метода заключается в том, что при электрофорезе клеток в агарозном геле петли и фрагменты поврежденной ДНК в электрическом поле вытягиваются по направлению к аноду, что придает им вид комет. Размеры хвоста ДНК-кометы положительно коррелируют со степенью повреждения ДНК (Heaton et al., 2002; Sorochinska, Mikhailenko, 2008; Collins et al., 2014). Электрофорез препаратов (после их стабилизации в течение 20 мин в щелочном электрофоретическом буфере) проводили с помощью прибора Multiphor II (“LKB”, Швеция) при напряжении 24 В и силе тока 100 мА в течение 30 мин. Анализ ДНК-комет на электрофореграммах, окрашенных флуоресцентным красителем DAPI (4',6-диамидин-2 фенилиндол; “Sigma-Aldrich”, США) осуществляли визуально, используя люминесцентный микроскоп ЛЮМАМ И-1 (Россия) и видеосистему передачи изображения на компьютер при использовании водно-иммерсионного объектива (×85). Применяли полуколичественный метод оценки интенсивности окраски и длины хвостов комет, на каждом микропрепарате анализировали не менее 100 отдельно расположенных ДНК-комет. Их разделяли по общепризнанной классификации на 5 классов с соответствующим числовым значением от 0 до 4, в зависимости от соотношения ДНК в “голове” и “хвосте” кометы (Collins, 2004). Степень повреждения ДНК при этом определяли как индекс “ДНК-комет” (Ідк), который вычисляли по формуле: Ідк = (0n0 + 1n1 + 2n2 + 3n3 + 4n4)/∑, где n0–n4 – число ДНК-комет каждого типа, Σ – сумма подсчитанных ДНК-комет (Sorochinska, Mikhai-lenko, 2008).
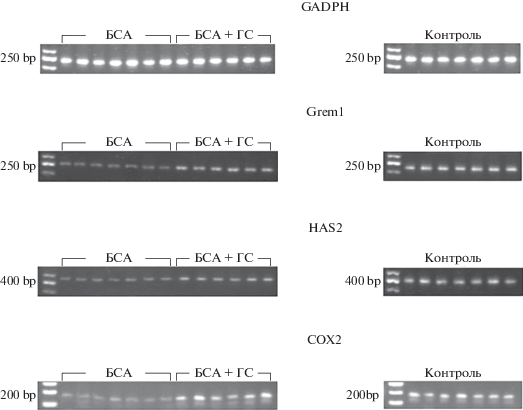
Определение экспрессии мРНК проводили методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Тотальную мРНК получали из кумулюсных клеток с помощью набора Trizol RNA-prep (“Isogen”, Россия). Для обратной транскрипции использовали FirstStrand cDNA Synthesis Kit (“Fermentas”, Литва). Полученную одноцепочечную кодирующую ДНК кумулюсных клеток использовали для проведения ПЦР с применением специфических праймеров (табл. 1). ПЦР проводили с использованием термоциклера GeneAmp PCR Systems 2700 (“Applied Biosystems”, США). Полученные ПЦР-продукты затем были оценены с помощью электрофореза в 2.5% агарозном геле, содержащем этидиум бромид. Визуализация и оценка яркости были выполнены с применением трансиллюминатора и программного обеспечения ViTran (“Биоком”, Россия).
Таблица 1.
Список праймеров, использованных для проведения ПЦР, и размер амплификата
| Ген | Последовательность праймеров (прямой, обратный) | Размер амплификата, bp |
|---|---|---|
| Grem1 | Прямой 5'-AAGGCACTTCCTGTTACTCTGC-3' Обратный 5'-TACGACTGAGATGTCAGGGAGA-3' |
256 |
| HAS2 | Прямой 5'-CCTCCAGTTAGTGTCTGGGTTC-3' Обратный 5'-CTGTGCAGCTATTCCTGTGTTC-3' |
409 |
| COX2 | Прямой 5'-GAAGGAACTCAGCACTGCATC-3' Обратный 5'-CAGTCCGGGTACAGTCACACT-3' |
213 |
| GAPDH | Прямой 5'-GGGTGTGAACCACGAGAAATATGA-3' Обратный 5'-AGCACCAGTGGATGCAGGGATGAT-3' |
240 |
Для статистического анализа использовали программу GraphPad Prism version 5.0 for Windows (GraphPad Software, San Diego, California, USA). После проверки распределения полученных результатов на нормальность по тесту Колмогорова–Смирнова осуществляли однофакторный дисперсионный анализ трех групп данных (не менее 6 мышей в каждой), используя one-way ANOVA тест с дальнейшим множественным сравнением с помощью критерия Ньюмена Кейлса. Результаты выражали как M ± m (среднее ± стандартная ошибка). Отличия считали статистически достоверными при р < 0.05.
РЕЗУЛЬТАТЫ
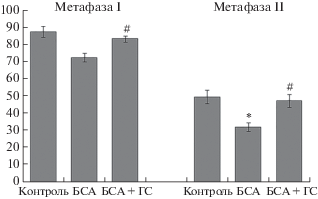
Ранее нами показано, что иммунизация мышей БСА вызывала повреждение оогенеза (Shepel et al., 2016). Наблюдалось уменьшение процента ооцитов возобновивших мейоз (метафаза I) и сформировавших первое полярное тельце (метафаза II). Введение ГС на фоне иммунизации БСА положительно влияло на мейотическое созревание ооцитов (рис. 1). Количество клеток на стадии метафазы I увеличивалось от 72.0 ± 2.5% (иммунизация БСА) до 82.7 ± 1.6% (введение ГС) по сравнению с 86.9 ± 3.2% в контроле. Процент ооцитов на стадии метафазы II возрастал от 31.9 ± ± 2.6% (в группе животных с БСА) до 47.0 ± 3.8% (при действии ГС) по сравнению с 49.2 ± 3.9% в контроле.
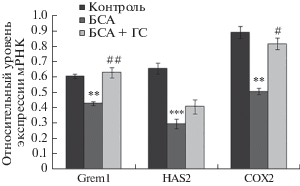
Рис. 1.
Мейотическое созревание ооцитов, выделенных из яичников: 1) контрольных мышей; 2) мышей, иммунизированных БСА и 3) при введении ГС иммунизированным животным. По оси ординат – количество ооцитов на стадии метафазы I и II (в % от общего количества культивированных ооцитов). * – р < 0.05 по отношению к контролю; # – р < 0.05 по отношению к иммунизации БСА.
Хорошо известно, что развитие ооцитов тесно связано с функциональным состоянием их фолликулярного окружения, поэтому мы исследовали целостность ДНК в кумулюсных клетках яичников мышей, иммунизированных БСА, а также животных, у которых иммунизация сопровождалась введением ГС. Согласно данным метода ДНК-комет в кумулюсных клетках фолликулов увеличивалась степень повреждения ДНК. Введение чужеродного белка приводило к увеличению количества разрывов молекулы ДНК, формирующих в электрическом поле “хвост кометы”. Большинство комет относилась к 4-му классу, который характеризует максимальное повреждение ДНК. При этом цитотоксический индекс (Ідк – общепринятый интегральный показатель, учитывающий изменения количества всех типов комет с разной интенсивностью свечения, то есть степенью повреждения ДНК) увеличивался в 4.8 раз, что свидетельствует о развитии сильного генотоксического стресса. Введение ГС иммунизированным мышам значительно снижало генотоксический стресс, способствуя уменьшению количества фолликулярных клеток с высоким уровнем повреждения ДНК (от 55.9 ± 1.2% в группе БСА до 21.4 ± 1.4% при введении ГС, в контроле было 5.4 ± 1.4%; р < 0.001), что подтверждалось снижением Ідк в 1.75 раз (рис. 2).
Рис. 2.
Микрофотографии ДНК-комет, выполненные с помощью люминесцентного микроскопа ЛЮМАМ И-1 (Россия) и видеосистемы передачи изображения на компьютер при использовании водно-иммерсионного объектива (×85). Окрашивание красителем DAPI. (а) контроль: кумулюсные клетки мышей с неповрежденной ДНК (классы 0–1). (б) введение БСА: клетки с сильным повреждением ДНК (классы 3–4). (в) введение ГС животным, иммунизированным БСА (ДНК-кометы класса 0–1).

Как показано в предыдущих исследованиях (Shepel et al., 2016), введение мышам БСА приводило к снижению в кумулюсных клетках экспрессии генов Grem1, HAS2 и COX2. По сравнению с контрольными животными количество мРНК HAS2 у иммунизированных было уменьшено в 2.21 раз, COX2 – в 1.76 и Grem1 – в 1.41 раз. В данной работе установлено, что после введения ГС наблюдалось увеличение уровня мРНК COX2 – в 1.61 раз и Grem1 – в 1.47 раз (рис. 3, 4). Отмечено также усиление экспрессии мРНК HAS2 в 1.38 раза, однако эти значения не были статистически достоверными.
ОБСУЖДЕНИЕ
Нами установлено, что иммунизация БСА вызывала повреждение оогенеза, о чем свидетельствовало уменьшение количества ооцитов, достигающих стадии метафазы І и ІІ. Одной из причин угнетения мейотического созревания являлось нарушение морфо-функционального состояния фолликулярного аппарата, которое характеризовалось значительным повреждением ДНК кумулюсных клеток, развитием в них сильного генотоксического стресса. Как известно, сильное повреждение ДНК приводит к гибели клеток, включая некроз, который, в свою очередь, может усиливать воспалительный ответ и повреждение органа. Кроме того, под влиянием БСА (Shepel et al., 2016) происходило значительное снижение уровней мРНК Grem1, HAS2 и COX2. Исследуемые гены играют критически важную роль в фолликуло- и оогенезе, в частности, участвуют в механизме формирования внеклеточного матрикса, необходимого для процесса кумулюсного расширения, и, таким образом, способствуют созреванию ооцита (McKenzie et al., 2004; Assou et al., 2010). Известно, что HAS2 представляет собой фермент, ответственный за синтез гиалуроновой кислоты, которая является главной структурной основой кумулюсного внеклеточного матрикса (Assou et al., 2010). СОХ2 способствует кумулюсному расширению через индукцию продукции простагландина Е2 (PGE2). Мыши, лишенные функциональной СОХ2, имеют дефекты в овуляции, оплодотворении, имплантации и децидуализации (McKenzie et al., 2004). GREM1 селективно ингибирует сигнализацию костного морфогенетического белка 15 (BMP 15) и предотвращает преждевременную лютеинизацию муральных гранулярных клеток, способствуя кумулюсному расширению (Pangas et al., 2004). Кроме того, экспрессия исследуемых генов находится под контролем паракринного ростового фактора дифференцировки 9 (GDF9), который секретируется ооцитом и играет многофункциональную роль в коммуникациях между клетками гранулезы и ооцитами (Kim et al., 2019), в регуляции дифференцировки и функции фолликулярных клеток. Таким образом, уровень транскриптов данных генов-мишеней GDF9 в кумулюсных клетках может отражать активность GDF9 и, как итог, прогнозировать состояние ооцита (McKenzie et al., 2004).
Используемый в данной работе ГС оказывал протективное влияние на клетки фолликулярного окружения ооцитов иммунизированных мышей. Введение ГС значительно снижало степень повреждения ДНК кумулюсных клеток, на что указывало уменьшение Ідк и количества клеток с сильно поврежденной ДНК. Анализ уровня экспрессии генов показал увеличение количества мРНК HAS2, СОХ2 и Grem1 в клетках кумулюса. Подобные изменения сопровождались улучшением мейотического созревания ооцитов, как на стадии метафазы І, так и метафазы II.
Положительный эффект ГС на морфо-функциональное состояние клеток яичников мышей может быть связан с его стимулирующим влиянием на энергосинтезирующую функцию митохондрий. Согласно литературным данным существует положительная корреляция между уровнем АТФ в клетках кумулюса и числом ооцитов, достигших метафазы II (Hsu et al., 2015). Наличие такой корреляции позволяет предположить, что уровень АТФ в кумулюсных клетках может быть индикатором общего состояния здоровья связанных с ними ооцитов. В исследованиях с использованием фармакологических ингибиторов показано влияние соответствующего уровня метаболизма жирных кислот и АТФ в клетках кумулюса на качество ооцита и последующее развитие здорового эмбриона. Липидный обмен обеспечивает мощный источник энергии, и его важность во время созревания ооцитов становится все более очевидной (Dunning et al., 2014).
Протективный эффект ГС может быть также обусловлен его антиоксидантным и мембраностабилизирующим действиями. БСА вызывает активацию клеток врожденного иммунитета, продукцию ими провоспалительных цитокинов, а также реактивных молекул, которые ведут к развитию оксидативного стресса, нарушению биологических свойств мембран, повреждению ДНК и клеточной функции. ГС ингибирует свободнорадикальные процессы, активированные в условиях иммунокомплексной патологии, нормализуя, таким образом, баланс между продукцией свободных радикалов и системой их обезвреживания. Однако для подтверждения данных предположений необходимы дальнейшие исследования.
Таким образом, полученные данные свидетельствуют о том, что ГС в использованной нами схеме и дозе введения оказывает значительный протективный эффект на морфо-функциональное состояние овариальных клеток и является перспективным для терапевтического использования при иммунокомплексных заболеваниях.
Список литературы
Шмагель К.В., Черешнев B.A. Молекулярные основы иммунокомплексной патологии // Биохимия. 2009. Т. 74. № 5. С. 581–592.
Assou S., Haouzi D., De Vos J. et al. Human cumulus cells as biomarkers for embryo and pregnancy outcomes // Mol. Hum. Reprod. 2010. V. 16. № 8. P. 531–538. https://doi.org/10.1093/molehr/gaq032
Bosques C.J., Manning A.M. Fc-gamma receptors: Attractive targets for autoimmune drug discovery searching for intelligent therapeutic designs // Autoimmun. Rev. 2016. pii: S1568-9972(16)30180-X. https://doi.org/10.1016/j.autrev.2016.07.035
Collins A.R. The comet assay for DNA damage and repair: principles, applications, and limitations // Mol. Biotechnol. 2004. V. 26. № 3. P. 249–261.
Collins A.R., El Yamani N., Lorenzo Y. et al. Controlling variation in the comet assay // Front. Genet. 2014. № 5. P. 359. https://doi.org/10.3389/fgene.2014.00359
Dunning K.R., Russell D.L., Robker R.L. Lipids and oocyte developmental competence: the role of fatty acids and β-oxidation // Reproduction. 2014. V. 148. № 1. P. R15–R27. https://doi.org/10.1530/REP-13-0251
Heaton P.R., Ransley R., Charlton C.J. et al. Application of single-cell gel electrophoresis (comet) assay for assessing levels of DNA damage in canine and feline leukocytes // J. Nutr. 2002. V. 132 (6). Suppl. 2. P. 1598–1603. https://doi.org/10.1093/jn/132.6.1598S
Hsu A.L., Townsend P.M., Oehninger S. et al. Endometriosis may be associated with mitochondrial dysfunction in cumulus cells from subjects undergoing in vitro fertilization-intracytoplasmic sperm injection, as reflected by decreased adenosine triphosphate production // Fertil. Steril. 2015. V. 103. № 2. P. 347–352.e1. https://doi.org/10.1016/j.fertnstert.2014.11.002
Jancar S., Crespo M.S. Immune complex-mediated tissue injury: a multistep paradigm // Trends Immunol. 2005. V. 26. № 1. P. 48–55.
Kim W.J., Lee S.E., Park Y.G. et al. Antioxidant hesperetin improves the quality of porcine oocytes during aging in vitro // Mol. Reprod. Dev. 2019. V. 86. № 1. P. 32–41. https://doi.org/10.1002/mrd.23079
Lytvynenko A.P., Shepel O.A., Kaleinikova O.M. “Mexidol” effects on myometrium contractility in mice uterus cervical parts // Achiev. Biol. Med. 2014. № 1(23). P. 21–24.
Mahajan A., Herrmann M., Muñoz L.E. Clearance deficiency and cell death pathways: a model for the pathogenesis of SLE // Front. Immunol. 2016. V. 7. P. 35. https://doi.org/10.3389/fimmu.2016.00035
McKenzie L.J., Pangas S.A., Carson S.A. et al. Human cumulus granulosa cell gene expression: a predictor of fertilization and embryo selection in women undergoing IVF // Hum. Reprod. 2004. V. 19. № 12. P. 2869–2874.
Pangas S.A., Jorgez C.J., Matzuk M.M. Growth differentiation factor 9 regulates expression of the bone morphogenetic protein antagonist gremlin // J. Biol. Chem. 2004. V. 279. № 31. P. 32281–32286.
Pavlovych S.I., Lytvynenko A.P., Makogon N.V. et al. Immunomorphological characterization of mouse model of a systemic immune complexes mediated pathology // Rep. Morph. 2014. V. 8. № 2. P. 496–500.
Scarica C., Cimadomo D., Dovere L. et al. An integrated investigation of oocyte developmental competence: expression of key genes in human cumulus cells, morphokinetics of early divisions, blastulation, and euploidy // J. Assist. Reprod. Genet. 2019. V. 36. № 5. P. 875–887. https://doi.org/10.1007/s10815-019-01410-3
Shepel E., Grushka N., Makogon N. et al. Inhibition of poly (ADP-ribose) polymerase (PARP) protects against experimental immune complex-induced ovarian failure in mice // Int. J. Health Sci. Res. 2016. V. 6. № 11. P. 103–108.
Shepel E., Grushka N., Makogon N. et al. Changes in DNA integrity and gene expression in ovarian follicular cells of lipopolysaccharide-treated female mice // Pharmacol. Rep. 2018. V. 70. № 6. P. 1146–1149. https://doi.org/10.1016/j.pharep.2018.06.005
Shepel E.A., Voznesenskaya T.Y., Blashkiv T.V., Yanchii R.I. Cumulus cell genes as potential biomarkers of oocyte and embryo developmental competence // Fiziol. Zh. 2016. V. 62. № 1. P. 107–113.
Sorochinska J., Mikhailenko V. Application of the comet assay for the DNA damage assessment caused by different inveronmental agents // Oncology. 2008. V. 10. № 3. P. 303–308.
Sribna V.O., Grushka N.G., Martynova T.V. et al. Functional activity of innate immunity cells under poly(ADP-ribose) polymerase inhibition in conditions of experimental immune complex-mediated pathology // Exp. Clin. Med. 2016. V. 2. № 71. P. 189–193.
Дополнительные материалы отсутствуют.