Онтогенез, 2020, T. 51, № 3, стр. 225-234
Микроглия и танициты области инфундибулярного углубления головного мозга крысы в раннем постнатальном онтогенезе и при старении
Д. А. Суфиева a, *, В. А. Разенкова a, М. В. Антипова a, b, Д. Э. Коржевский a
a ФГБНУ “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, 12, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
* E-mail: dinobrione@gmail.com
Поступила в редакцию 18.01.2020
После доработки 09.02.2020
Принята к публикации 12.02.2020
Аннотация
Цель работы состояла в изучении структуры и пространственных взаимоотношений микроглии и таницитов в медиабазальном гипоталамусе в раннем постнатальном онтогенезе и при старении. С применением иммуногистохимических методов были исследованы срезы головного мозга крыс линии Вистар на следующих сроках: постнатальные 7, 14 и 30 сутки развития, взрослые (4–5 мес.) и старые (20 мес.) животные (n = 3 для каждого срока). Были выделены различные типы микроглии, которые отличались локализацией в области инфундибулярного углубления, морфо-функциональными признаками, а также пространственными взаимоотношениями с таницитами. Была показана возрастная динамика активности микроглии в изучаемой области. Полученные результаты будут способствовать установлению роли микроглии и таницитов в формировании барьерных структур в медиабазальном углублении и возрастных особенностей центральной нейроиммуноэндокринной регуляции.
ВВЕДЕНИЕ
Область инфундибулярного углубления (область воронки гипофиза) располагается в нижней части третьего желудочка мозга (детальную схему строения инфундибулярного углубления см. на рис. 4б). Эта область относится к медиабазальному гипоталамусу и включает в себя вентромедиальное и аркуатное ядра гипоталамуса, а также срединное возвышение, которое является одним из циркумвентрикулярных органов (ЦВО) головного мозга. ЦВО характеризуются наличием капилляров фенестрированного типа (то есть, они лишены гематоэнцефалического барьера (ГЭБ)) (Schulz, Engelhardt, 2005; Joly et al., 2007). Выстилка области инфундибулярного углубления сформирована таницитами, высокоспециализированными биполярными клетками с длинным базальным отростком. Эти клетки оплетают концами своих отростков кровеносные сосуды подлежащей нервной ткани, в том числе фенестрированные капилляры портальной системы гипофиза в срединном возвышении. Они могут транспортировать различные молекулы из крови к нейронам ядер гипоталамуса, а также регулируют высвобождение рилизинг-факторов нейросекреторными клетками гипоталамуса в кровеносное русло. Таким образом, танициты являются одними из ключевых игроков в регуляторной нейроэндокринной системе медиабазального гипоталамуса (Gao et al., 2014; Prevot et al., 2018; Rodriguez et al., 2019). Сегодня в литературных источниках появляется все больше данных о роли микроглии наряду с таницитами в регулировании энергетического баланса в организме (Bobbo et al., 2019). Клетки микроглии представляют собой резидентные макрофаги ЦНС и формируют собственную иммунную систему головного и спинного мозга. Микроглиоциты выполняют ряд важных функций: в ответ на инфекцию или повреждение микроглия переходит в активированное состояние и начинает секретировать про- или противовоспалительные цитокины, фагоцитирует поврежденные клетки, участвует в ремоделировании синапсов (Lannes et al., 2017). Было показано, что в гипоталамусе их избыточная провоспалительная активация может привести к нарушению обмена веществ в организме, в частности, к ожирению (Valdearcos et al., 2017; Mendes et al., 2018). Микроглия и танициты формируют первую линию защиты в срединном возвышении, в связи с чем изучение пространственных взаимоотношений этих двух клеточных популяций в медиабазальном гипоталамусе представляет особый интерес. Целью данного исследования было изучить структурно-функциональные взаимоотношения между микроглией и таницитами в области инфундибулярного углубления в раннем постнатальном онтогенезе и при старении.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования послужил головной мозг крыс-самцов линии Вистар на различных сроках постнатального онтогенеза: постнатальные 7 (Р7), 14 (Р14) и 30 (Р30) сутки развития, взрослые (4–5 мес.) и старые (20 мес.) животные (n = 3 для каждого срока). При содержании и умерщвлении животных соблюдали международные правила Хельсинкской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Головной мозг фиксировали в цинк-этанол-формальдегиде (Korzhevskii et al., 2015). Обезвоженные объекты заливали в парафин по общепринятой методике. Изготавливали фронтальные срезы толщиной 5 мкм на уровне от –3.24 до –4.44 мм по отношению к брегме (Paxinos, Watson, 2007). Исследовали фронтальные срезы промежуточного мозга на уровне аркуатного ядра гипоталамуса. После стандартной процедуры депарафинирования и регидратации срезы подвергали тепловому демаскированию в модифицированном цитратном буфере S1700 (Agilent, США) с последующим блокированием эндогенной пероксидазы. Для выявления клеток микроглии использовали поликлональные кроличьи антитела к Iba-1 (Biocare medical, США) в разведении 1 : 900. В качестве вторичного реагента был использован набор Reveal Rabbit Specific HRP-DAB Detection System (Spring Bioscience, США). Для визуализации продукта реакции применяли хромоген 3'3-диаминобензидин из набора DAB+ (Agilent, США). После проведения реакции часть срезов подкрашивали квасцовым гематоксилином. Полученные препараты анализировали с помощью светового микроскопа Leica DM750 (Германия) и фотографировали с помощью фотокамеры ICC50 (Leica, Германия). Для обработки изображений использовали программу LAS EZ (Leica, Германия).
Для изучения пространственной организации таницитов и микроглии была поставлена двойная иммуногистохимическая реакция на белок промежуточных филаментов III типа – виментин, который является маркером таницитов, и Iba-1, который является маркером микроглии. В качестве первичных реагентов использовали моноклональные мышиные антитела к виментину (клон V-9, Agilent, США, в разведении 1 : 100) и поликлональные кроличьи антитела к Iba-1 (Biocare medical, США, в разведении 1 : 500). В качестве вторичных реагентов применяли Fab-фрагмент антимышиного иммуноглобулина осла, меченный биотином-SP (Jackson ImmunoResearch, США) и моновалетный Fab-фрагмент антикроличьего иммуноглобулина осла, конъюгированный с флуорохромом Rhodamine Red™-X (RRX, Jackson ImmunoReaserch, США), а также конъюгат стрептавидина с флуорохромом Cy2 (Jackson ImmunoResearch, США). Полученные препараты исследовали при помощи конфокального лазерного микроскопа Zeiss LSM 800 (Zeiss, Германия). Для возбуждения флуоресценции Cy2 применяли лазер с длинной волны 488 нм, для RRX – 561 нм. Анализ полученных изображений проводили при помощи компьютерных программ Zen-2012 и LSM Image Browser (Zeiss, Германия). Для оценки возрастных изменений в количестве микроглиоцитов во всей изучаемой области инфундибулярного углубления подсчет производился по трем полям зрения (в каждом поле использовалась рамка размером 175 × × 198 мкм) на увеличении ×40 для каждого случая. Количество микроглии определяли на единицу площади (1 мм2). Данные представлены в виде средней ± ошибки средней. Статистический анализ был произведен в программе Prism GraphPad 8. Применяли однофакторный дисперсионный анализ (one-way ANOVA), с последующим сравнением групп с помощью post-hoc-критерия Тьюки.
РЕЗУЛЬТАТЫ
При иммуногистохимическом выявлении Iba-1 было установлено, что на P7 и P14 сутки развития микроглиоциты в инфундибулярном углублении характеризуется округлой формой, короткими и утолщенными отростками, что указывает на активированное состояние этих клеток (рис. 1а). При анализе пространственного взаимоотношения микроглиоцитов с клетками выстилки (таницитами) можно выделить несколько типов микроглии в зависимости от их локализации, которые отличаются по ряду морфологических признаков. Непосредственно под телами клеток, которые формируют выстилку инфундибулярного углубления, локализуются субэпендимные микроглиоциты (рис. 1а, 1б). Это веретеновидные, как правило, биполярные клетки. Главные их отростки отходят от разных полюсов клетки и направлены вдоль эпендимного пласта, которые затем могут ветвиться на отростки более мелкого порядка. Некоторые из них проникают через эпендимный пласт и контактируют с СМЖ (рис. 1б). В области перехода эпендимоцитов в танициты выстилка формирует двурядную структуру, и когда танициты полностью замещают эпендимоциты, выстилка снова становится однорядной. Интересно, что в области перехода микроглиоциты всегда локализуются между двумя рядами клеток выстилок и морфологически напоминают субэпендимные микроглиоциты (рис. 2а). Помимо субэпендимных микроглиоцитов встречаются и супраэпендимные макрофаги, которые локализуются непосредственно в полости желудочка на апикальной поверхности клеток выстилки (рис. 1а). Эти клетки имеют округлую или овальную форму и не имеют отростков. Иногда встречаются клетки веретеновидной формы с двумя полярно отходящими неветвящимися отростками. В нервной ткани микроглия на этих сроках развития характеризуется переходным состоянием между амебоидной и рамифицированной (отростчатой) формами. Это клетки с округлой сомой и короткими утолщенными слабоветвящимися отростками (рис. 1а). В срединном возвышении локализуются амебоидные микроглиоциты – клетки с округлой сомой либо без отростков, либо с очень короткими неветвящимися отростками. Рядом с фенестрированными сосудами наблюдаются микроглиоциты с округлой сомой, отростки которых находятся в тесном контакте с кровеносными сосудами.
Рис. 1.
Инфундибулярное углубление дна третьего желудочка. Иммуногистохимическая реакция на Iba-1, подкраска ядер квасцовым гематоксилином. а – 7 сутки постнатального развития, область α1 таницитов. б – старое животное, субэпендимная микроглия, контактирующая с СМЖ; в – взрослое животное, периваскулярные микроглиоциты в срединном возвышении. Стрелка указывает на субэпедимные (а, б) и периваскулярные (в) микроглиоциты, двойная стрелка – супраэпендимные микроглиоциты.
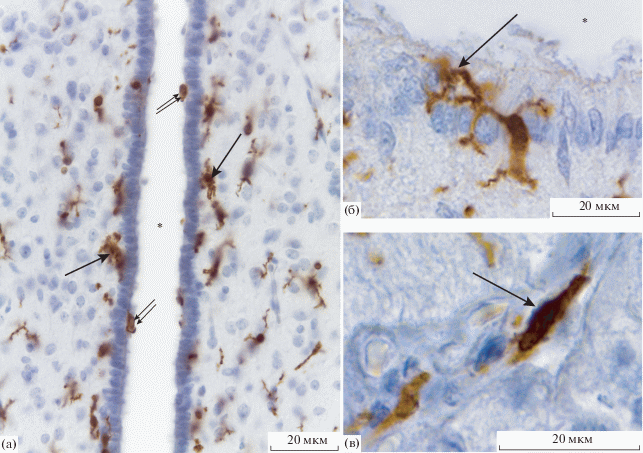
Рис. 2.
Микроглия дна третьего желудочка. Иммуногистохимическая реакция на Iba-1, подкраска квасцовым гематоксилином. а – 30 сутки постнатального развития, область α1 таницитов; б – старое животное, область аркуатного ядра гипоталамуса; в – взрослое животное, zona externa срединного возвышения; г – старое животное, zona interna срединного возвышения. Стрелка указывает на микроглию, двойная стрелка – супраэпендимная микроглия, головка стрелки – переходная зона, звездочка – полость третьего желудочка.
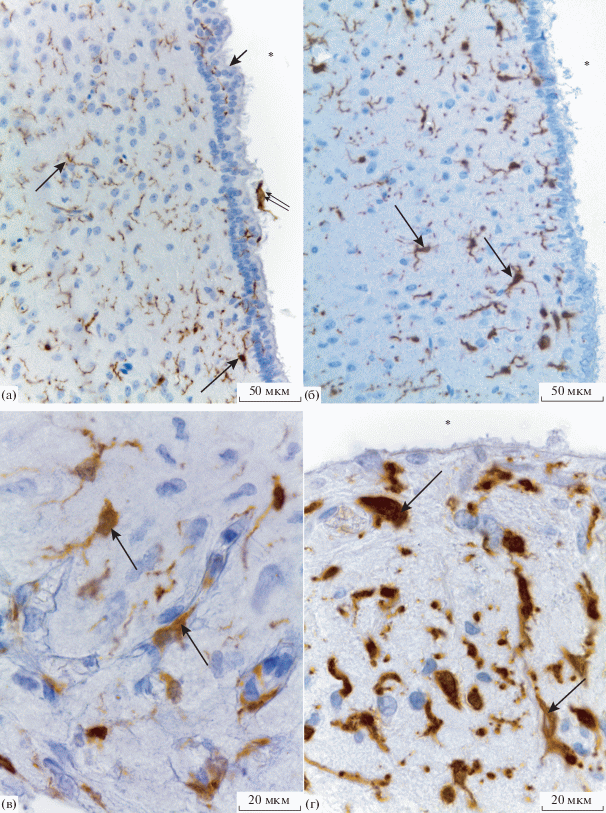
На 30 сутки постнатального развития в инфундибулярном углублении микроглия представлена рамифицированной формой. Они характеризуются небольшой сомой и длинными тонкими ветвящимися отростками, однако встречаются отдельные микроглиоциты переходной формы (рис. 2а). Для P30 суток развития характерно присутствие субэпендимной микроглии, но их число значительно меньше по сравнению с более ранними сроками развития. Кроме того, наблюдались единичные супраэпендимные макрофаги (рис. 2а). В области срединного возвышения микроглия, также как и у молодых животных, была представлена амебоидным, либо реже переходным типами. Также отчетливо можно выделить еще один тип микроглии – типичные периваскулярные микроглиоциты, которые располагались вдоль фенестрированных капилляров портальной системы гипофиза (zona externa). Это мелкие клетки, распластанные вдоль базальной мембраны сосуда. Они, как правило, не имеют отростков (рис. 1в).
Для взрослых интактных животных характерна отростчатая микроглия, которая диффузно распределена в нервной ткани. Вдоль эпендимного пласта супраэпендимные макрофаги у взрослых животных не наблюдалась, встречались лишь единичные субэпендимные микроглиоциты. В срединном возвышении микроглия представлена активными формами – амебоидной и переходной формами, и периваскулярными микроглиоцитами в zona externa (рис. 2в).
У старых крыс в нервной ткани наблюдалась активированная микроглия – амебоидного и переходного типов (рис. 2б). Присутствовали все типы микроглии описанные для молодых животных, а именно, субэпендимная микроглия (рис. 1б) и супраэпендимные макрофаги. В срединном возвышении локализовалась амебоидная микроглия и периваскулярные микроглиоциты, при этом микроглиоциты переходной формы практически отсутствовали (рис. 2г).
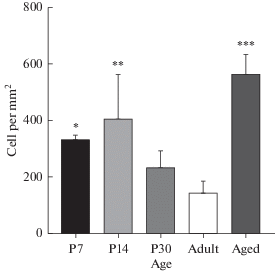
Количество клеток микроглии в области инфундибулярного углубления изменялось в процессе постнатального развития и при старении. Число клеток нарастало и достигало своего максимума на 14-й день постнатального онтогенеза. В дальнейшем их количество уменьшалось и снова увеличивалось (почти в 4 раза) при старении (рис. 3). При подсчете количества супраэпендимных и субэпендимных микроглиоцитов в инфундибулярном углублении было установлено, что число супраэпендимных макрофагов максимально на P7 и P14 сутки развития (p < 0.01). С развитием это число снижалось, и у одномесячных и старых крыс встречались лишь единичные супраэпендимные макрофаги, в то время как у взрослых интактных крыс этот тип клеток в исследуемой области отсутствовал. В процессе онтогенеза также изменялось и число субэпендимных микроглиоцитов. Было установлено, что популяция субэпендимной микроглии максимальна на 7 сутки постнатального развития и у старых крыс (15 ± 4.2 и 14 ± 0.0 соответственно). На других исследованных сроках среднее число субэпендимных микроглиоцитов варьировало в пределах от 5 ± 1.2 на P14 сутки до 5.8 ± 2 у 30-дневных и взрослых животных. Однако при проведении однофакторного дисперсионного анализа статистически значимых различий между исследованными группами не обнаружилось.
Рис. 3.
Динамика изменения числа микроглиоцитов области инфундибулярного углубления в ходе постнатального онтогенеза и при старении. P7, P14, P30 – 7, 14, 30 сутки постнатального развития соответственно; Adult – взрослое животное (4–6 месяцев), Aged – старые животные (20 мес.). P-value: * – <0.05; ** – <0.01; *** – <0.001.
ОБСУЖДЕНИЕ
На сегодняшний день одним из приоритетных направлений в изучении ЦНС является исследования клеток микроглии, их пространственных взаимоотношений с другими клетками нервной ткани, клеточных сигнальных путей, задействованных в иммунном ответе, функциональной роли в норме и при патологии. Микроглия происходит из эритромиелодных предшественников желточного мешка, заселяя мозг в раннем эмбриогенезе (на E10–12 день у крыс) еще до формирования гематоэнцефалического барьера, и представляют собой самоподдерживающуюся и долгоживущую клеточную популяцию. В ответ на различные повреждающие факторы микроглиоциты переходят из рамифицированной (или покоящейся) в амебоидную (активированную) форму (Alekseeva et al., 2019). В последнее время помимо изучения роли микроглии как медиатора воспаления и одного из ключевых игроков при повреждении и нейродегенерации, все больше исследований посвящены изучению микроглии в норме. Сегодня среди исследователей не вызывает сомнения, что микроглия не является единообразной популяцией клеток, а представлена разными ее подтипами в различных структурах головного мозга, а также на разных этапах онтогенеза (Stratoulias et al., 2019; Tan et al., 2019).
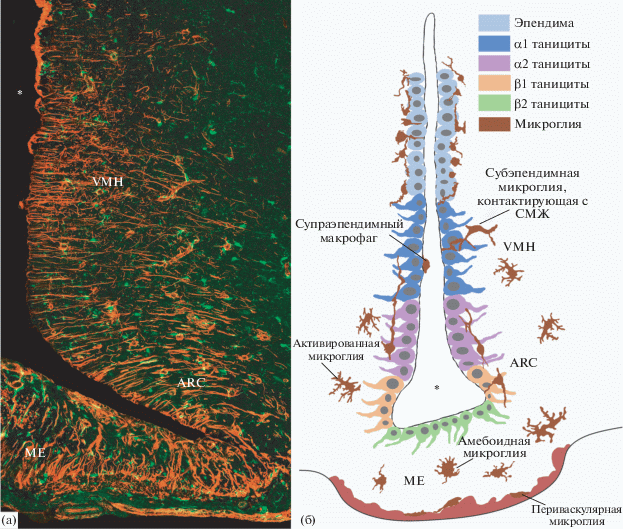
В настоящем исследовании при изучении микроглии в ходе постнатального онтогенеза и при старении нами также были определены различные типы микроглии, которые отличались локализацией в области инфундибулярного углубления и пространственными взаимоотношениями с таницитами, а также морфологическими и функциональными признаками (рис. 4).
Рис. 4.
Различные типы микроглии в инфундибулярном углублении. (а) – двойная иммуногистохимическая реакция на виментин (маркер таницитов, красный цвет) и Iba-1 (маркер микроглии, зеленый цвет). Конфокальная лазерная микроскопия, единичный оптический срез. (б) – схема различных типов микроглии в инфундибулярном углублении. ME – срединное возвышение; ARC – аркуатное ядро, VMH – вентромедиальное ядро гипоталамуса. Звездочка – полость третьего желудочка.
Было установлено, что в первые две недели развития микроглия в этой области активирована, а число этих клеток возрастает. После активность и количество микроглиоцитов идет на спад, и к первому месяцу постнатального развития микроглия характеризуется, как и у взрослых, отростчатой формой. Полученные результаты согласуются и дополняют литературные данные, где было показано, что у крыс число микроглиоцитов возрастает в течение эмбриогенеза и первых двух недель постнатального развития, и клетки переходят из активированной формы в рамифицированную (Lenz, Nelson, 2018). Высокую активность микроглии в этот период связывают с одной из важных функций микроглии, а именно в созревании и ремоделировании синапсов, а также элиминации ненужных синаптических связей. Микроглия может регулировать количество нейронов в развивающемся головном мозге путем фагоцитоза мертвых или умирающих клеток и обеспечивать трофическую поддержку нервных клеток-предшественников для их пролиферации и созревания. Было также предложено, что микроглиальные клетки в развивающейся ЦНС регулируют васкуляризацию и влияют на миелинизацию (Kaur et al., 2017; Lenz, Nelson, 2018).
Наше исследование показало, что у взрослых животных помимо типичных отростчатых микроглиоцитов, локализовавшихся в нервной ткани в области аркуатного и вентромедиального ядер гипоталамуса, была выделена популяция субэпендимных микроглиоцитов (Кирик и др., 2014), которые локализовались непосредственно под телами таницитов. Их отростки были всегда направлены вдоль выстилки, а у некоторых из этих клеток отростки проникали через эпендимный пласт и контактировали с СМЖ. Такой тесный контакт микроглии с СМЖ может указывать на контроль этими клетками состава СМЖ и на возможность секреции активных молекул (цитокинов) в СМЖ для паракринной регуляции функциональной активности таницитов. Так было установлено, что на таницитах (в основном β таницитах) присутствуют рецепторы интерлейкина-6α (IL-6Rα). Было показано, что интрацеребровентрикулярное введение IL-6 посредством связывания с IL-6Rα, расположенном на телах таницитов, задействовано в регуляции метаболических процессов, усиливая расход энергии и термогенез (Anesten et al., 2017). Следовательно, микроглия, синтезируя цитокины (например, IL-6) в СМЖ, опосредовано через танициты может быть задействована в регуляции энергетического гомеостаза организма.
В отдельный тип стоит выделить микроглию срединного возвышения. В данной работе было установлено, что на всех исследованных сроках микроглия в срединном возвышении чрезвычайно активна. На сегодняшний день в литературе существуют единичные данные о распределении и функциональном статусе микроглии в данной области, а микроглия срединного возвышения в возрастном аспекте ранее не изучалась. Нами было показано, что у взрослых животных в срединном возвышении микроглия активирована, несмотря на отсутствие патологии. Полученные данные согласуются с исследованием Takagi et al. (Takagi et al., 2019). Авторы показали, что микроглия у контрольных животных в ЦВО характеризовалась амебоидной формой и находилась в тесном контакте с фенестрированными капиллярами. Кроме того, экспрессия маркеров характерных как для M1 (CD16/32 и CD86), так и для M2 (CD206 и Ym1) типов в микроглии ЦВО была значительно выше, чем в других областях мозга. Авторы предполагают, что амебоидная микроглия в этих органах вовлечена в регуляцию проницаемости кровеносных сосудов и/или ангиогенеза. Кроме того, активированное состояние микроглии может указывать на фагоцитоз этими клетками нейротоксичных молекул или клеток, которые поступают с кровотоком. Таким образом, микроглия задействована в поддержании гомеостаза нервной ткани (Takagi et al., 2019). В другой работе с помощью метода электронной микроскопии было установлено, что в срединном возвышении у контрольных животных микроглия характеризуется фенотипом, который авторы назвали “темная микроглия” (“dark microglia”). Такое название обусловлено тем, что на ультраструктурном уровне эти клетки выглядят темными за счет конденсации в них цитоплазмы, а также характеризуются признаками окислительного стресса. Было показано, что этот тип микроглии характеризуется высокой активностью и в других областях мозга характерен для патологических состояний, таких как хронический стресс, старение, болезнь Альцгеймера. Это указывает на высокую активность микроглиоцитов в области срединного возвышения, несмотря на отсутствие патологического состояния (Bisht et al., 2016). Таким образом, нами впервые была изучена микроглия срединного возвышения в постнатальном онтогенезе и при старении, и было установлено, что на всех исследованных сроках микроглия в этой области характеризуется амебоидным типом и находится в тесном контакте с фенестрированными капиллярами, и, вероятно, является чрезвычайно активированной на протяжении всего постнатального онтогенеза.
Мы показали, что на определенных этапах онтогенеза, а именно в первый месяц постнатального развития и у старых животных, в области инфундибулярного углубления встречались супраэпендимные макрофаги. Ранее супраэпендимные клетки дна третьего желудочка были описаны с использованием метода электронной микроскопии у мышей (Bleier, 1977) и крыс (Mestres, Breipohl, 1976; Mestres, 1976). Было показано, что эти клетки локализуются в инфундибулярном углублении на апикальной поверхности клеток выстилки, лишенных ресничек – таницитах, и их число варьирует в зависимости от фазы эструса у самок, в то время как у самцов это число остается постоянным. Авторы предполагают, что эти клетки обладают фагоцитарной активностью, то есть являются макрофагами, и выполняют те же функции, что и клетки Колмера в сосудистом сплетении, а именно утилизируют клеточный дебрис, нейротоксичные вещества и патогенны СМЖ, являясь важными компонентами ликворо-энцефалического барьера (Lu et al., 1993). Кроме того, вероятно, эти клетки могут фагоцитировать фрагменты цитоплазмы эпендимных клеток, в которых накапливаются поврежденные органеллы. Увеличение или уменьшение числа супраэпендимных макрофагов у самок авторы связывают с возможной ролью этих клеток в регулировании на поверхности эпендимных клеток числа и размеров микроворсинок, которые, как показали авторы, различаются у самок в разные фазы эструса (Bleier, 1977). В настоящем исследовании нами не были обнаружены супраэпендимные макрофаги у взрослых животных. Возможно, что-либо у самцов эти клетки являются единичными и при исследовании не попали на изучаемые срезы, либо у взрослых крыс эти клетки являются Iba-1 иммунонегативными. Тем не менее, супраэпендимные макрофаги встречались у молодых и старых животных. Вероятно, увеличенное количество этих клеток в полости желудочка указывает на высокую активность этих клеток на данных этапах онтогенеза, что необходимо для активного удаления лишних клеточных элементов из СМЖ.
В данном исследовании было показано, что в ходе нормального старения в области инфундибулярного углубления число микроглиоцитов резко возрастает по сравнению со взрослыми животными и переходит в амебоидной тип, что указывает на чрезвычайно активное состояние этих клеток. Установлено, что старение в ЦНС характеризуется высоким уровнем окислительного стресса и перекисного окисления липидов. Предполагается, что накопление с возрастом свободных радикалов приводит к развитию нейровоспаления (Norden, Godbout, 2013). Было также показано, что с возрастом происходит нарушение проницаемости гематоэнцефалического и ликвороэнцефалического барьеров (Erickson, Banks, 2019), а в таницитах, формирующих барьерные структуры, происходит дезорганизация отростков, что приводит к невозможности нормального функционирования этих клеток (Koopman et al., 2017; Суфиева и др., 2019). Кроме того, с возрастом уменьшается уровень половых гормонов и IGF-1 (инсулиноподобный фактор роста 1) (в транспорт которых также вовлечены танициты), которые в гипоталамусе активируют нейропротекторные и противовоспалительные сигнальные пути, в частности, подавляя NFκB-сигнальный путь. Падение уровня этих гормонов и ростовых факторов способствует развитию системного нейровоспаления и дисфункции медиабазального гипоталамуса. Это, в частности, отражается в развитии диабета 2-го типа, гипергликемии, инсулинорезистетности, сердечно-сосудистых заболеваний (Chowen, Garcia-Segura, 2019).
Таким образом, в ходе настоящего исследования была показана возрастная динамика активности микроглиоцитов, впервые были определены разные их типы в области инфундибулярного углубления на разных этапах постнатального онтогенеза, были проанализированы пространственные и функциональные взаимоотношения микроглии и таницитов. Полученные данные будут способствовать дальнейшему пониманию роли этих клеток в формировании и возрастной динамике состояния барьерных структур инфундибулярного углубления и возрастных особенностей центральной нейроиммуноэндокринной регуляции.
ФИНАНСИРОВАНИЕ РАБОТЫ
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-315-00134).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
При содержании и умерщвлении животных соблюдали международные правила Хельсинкской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.).
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что какой-либо конфликт интересов отсутствует.
ИНФОРМАЦИЯ О ВКЛАДЕ АВТОРОВ
Д.А. Суфиева – взятие материала, проводка и заливка в парафиновые блоки, покраска препаратов, фотографирование и анализ препаратов, написание текста статьи.
В.А. Разенкова – фотографирование препаратов, подсчет клеток, статистический анализ полученных препаратов, работа с рисунками.
М.В. Антипова – нарезка материала, подсчет клеток.
Д.Э. Коржевский – дизайн эксперимента и редактирование рукописи статьи.
Список литературы
Кирик О.В., Сухорукова Е.Г., Алексеева О.С. и др. Субэпендимные микроглиоциты III желудочка головного мозга // Морфология. 2014. Т. 145. № 2. С. 67–69.
Суфиева Д.А., Кирик О.В., Коржевский Д.Э. Астроцитарные маркеры в таницитах дна третьего желудочка головного мозга крысы в постнатальном онтогенезе и при старении // Онтогенез. 2019. Т. 50. № 3. С. 205–214.
Alekseeva O.S., Kirik O.V., Gilerovich E.G. et al. Microglia of the brain: origin, structure, functions // J. Evol. Biochem. Phys. 2019. V. 55. № 4. P. 257–268.
Anesten F., Santos C., Gidestrand E. et al. Functional interleukin-6 receptor-α is located in tanycytes at the base of the third ventricle // J. Neuroendocrinol. 2017. V. 29. № 12. P. e12546.
Bisht K., Sharma K.P., Lecours C. et al. Dark microglia: A new phenotype predominantly associated with pathological states // Glia. 2016. V. 64. № 5. P. 826–839.
Bleier R. Ultrastructure of supraependymal cells and ependymal of hypothalamic third ventricleof mouse // J. Comp. Neurol. 1977. V. 174. № 2. P. 359–376.
Bobbo V.C.D., Jara C.P., Mendes N.F. et al. Interleukin-6 expression by hypothalamic microglia in multiple inflammatory contexts: a systematic review // Biomed. Res. Int. 2019. P. 1365210.
Chowen J.A., Garcia-Segura L.M. Microglia, neurodegeneration and loss of neuroendocrine control // Prog. Neurobiol. 2019. P. 101720.
Erickson M.A., Banks W.A. Age-associated changes in the immune system and blood–brain barrier functions // Int. J. Mol. Sci. 2019. V. 20. № 7. P. 1632.
Gao Y., Tschöp M.H., Luquet S. Hypothalamic tanycytes: gatekeepers to metabolic control // Cell. Metab. 2014. V. 19. № 2. P. 173–175.
Joly J.S., Osório J., Alunni A. et al. Windows of the brain: towards a developmental biology of circumventricular and other neurohemal organs // Semin. Cell. Dev. Biol. 2007. V. 18. № 4. P. 512–524.
Kaur C., Rathnasamy G., Ling E.A. Biology of microglia in the developing brain // J. Neuropathol. Exp. Neurol. 2017. V. 76. № 9. P. 736–753.
Koopman A.C.M., Taziaux M., Bakker J. Age-related changes in the morphology of tanycytes in the human female infundibular nucleus/median eminence // J. Neuroendocrinol. 2017. V. 29. P. 1–9.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V. et al. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde // Eur. J. Histochem. 2015. V. 59. № 3. P. 2530.
Lannes N., Eppler E., Etemad S. et al. Microglia at center stage: a comprehensive review about the versatile and unique residential macrophages of the central nervous system // Oncotarget. 2017. V. 8. № 69. P. 114393–114413.
Lenz K.M., Nelson L.H. Microglia and beyond: Innate immune cells as regulators of brain development and behavioral function // Frontiers in Immunology. 2018. V. 9. P. 698.
Lu J., Kaur C., Ling E.A. Intraventricular macrophages in the lateral ventricles with special reference to epiplexus cells: a quantitative analysis and their uptake of fluorescent tracer injected intraperitoneally in rats of different ages // J. Anat. 1993. V. 183 (Pt 2). P. 405–414.
Mendes N.F., Kim Y., Velloso L.A. et al. Hypothalamical microglial activation in obesity: a mini-review // Frontiers of Neuroscience. 2018. V. 12. P. 846.
Mesters P. The supraependymal cells of the rat hypothalamus: changes in their morphology and cell number during the ovarian cycle // Experientia. 1976. V. 32. № 10. P. 1329–1331.
Mestres P., Breipohl W. Morphology and distribution of supraependymal cells in the third ventricle of the albino rat // Cell Tissue Res. 1976. V. 168. № 3. P. 303–314.
Norden D.M., Godbout J.P. Microglia of the aged brain: primed to be activated and resistant to regulation // Neuropathol. Appl. Neurobiol. 2013. V. 39. № 1. P. 19–34.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates, 6th ed. N.Y.: Elsevier/Academic Press, 2007. 456 p.
Prevot V., Dehouck B., Sharif A. et al. The versatile tanycyte: a hypothalamic integrator of reproduction and energy metabolism // Endocr. Rev. 2018. V. 39. № 3. P. 333–368.
Rodríguez E., Guerra M., Peruzzo B. et al. Tanycytes: A rich morphological history to underpin future molecular and physiological investigations // J. Neuroendocrinol. 2019. V. 31. № 3. P. 1–29.
Schulz M., Engelhardt B. The circumventricular organs participate in the immunopathogenesis of experimental autoimmune encephalomyelitis // Cerebrospinal Fluid Res. 2005. V. 2. № 8. P. 1–14.
Takagi S., Furube E., Nakano Y. et al. Microglia continuously activated in circumventricular organs of mouse brain // J. Neuroimmunology. 2019. V. 331. P. 74–79.
Tan Y.L., Yuan Y., Tian L. Microglial regional heterogeneity and its role in the brain // Mol. Psychiatry. 2019. P. 1–17.
Valdearcos M., Douglass J.D., Robblee M.M. et al. Microglial inflammatory signaling orchestrates the hypothalamic immune response to dietary excess and mediates obesity susceptibility // Cell. Metab. 2018. V. 26. P. 185–197.
Дополнительные материалы отсутствуют.


