Онтогенез, 2020, T. 51, № 3, стр. 193-209
Генетические механизмы раннего развития конечного мозга, как отражение истории появления и эволюции этого уникального отдела центральной нервной системы позвоночных
А. В. Байрамов a, *, Г. В. Ермакова a, А. Г. Зарайский a
a Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, д. 16/10, Россия
* E-mail: andrbayr@gmail.com
Поступила в редакцию 06.02.2020
После доработки 18.02.2020
Принята к публикации 21.02.2020
Аннотация
Одним из важнейших ароморфозов в эволюции позвоночных стало появление сложноструктурированного конечного мозга или теленцефалона – отдела переднего мозга, который, развиваясь и совершенствуясь, обеспечил возможность реализации высших форм нервной деятельности, наблюдаемых у животных и человека. Закладка конечного мозга происходит на самых ранних этапах онтогенеза позвоночных, когда передняя часть нервной трубки дифференцируется на три мозговых пузыря: прозенцефалон, как зачаток будущего переднего мозга, мезенцефалон – будущий средний мозг и ромбэнцефалон – будущий задний мозг. Передний мозг в дальнейшем дифференцируется, формируя конечный мозг (теленцефалон) и промежуточный мозг (диэнцефалон). Развитие структур и отделов мозга модулируется экспрессией соответствующих регуляторных генов, кодирующих транскрипционные факторы и сигнальные молекулы. Вопросы появления в эволюции и онтогенеза конечного мозга, являясь на сегодняшний день одними из центральных в современной биологии развития, на молекулярном уровне остаются до сих пор слабо изученными. В последнее время при изучении эволюционных механизмов, обеспечивших появление у позвоночных конечного мозга большое внимание уделяется наиболее эволюционно древним группам позвоночных, таким как круглоротые (миноги и миксины) и ближайшим родственникам позвоночных – оболочникам и бесчерепным (ланцетникам). Особый интерес в этих исследованиях представляют круглоротые, поскольку именно у представителей этой группы конечный мозг впервые в эволюции появляется в виде отдельной морфологической структуры и есть основания полагать, что у них могли сохраниться паттерны экспрессии и регуляторные механизмы, характерные для предков позвоночных. В данной обзорной статье мы суммируем и анализируем накопленные в последние годы данные исследований генетических механизмов раннего развития конечного мозга у позвоночных и результаты поиска гомологов этой структуры у родственных позвоночным групп хордовых – бесчерепных и оболочников.
ВВЕДЕНИЕ
Работы, посвященные исследованию конечного мозга позвоночных, как правило, затрагивают один из следующих аспектов этой проблемы:
1. Исследование деталей строения и молекулярных механизмов развития конечного мозга, у наиболее эволюционно продвинутых групп позвоночных, таких как млекопитающие и, в первую очередь, человек.
2. Исследование индукционных механизмов, лежащих в основе дифференцировки конечного мозга в онтогенезе позвоночных.
3. Исследование эволюционных предпосылок появления конечного мозга, как уникальной структуры позвоночных и прослеживание путей развития этой структуры у разных групп позвоночных.
Безусловно, исследования механизмов развития и дифференцировки конечного мозга млекопитающих имеют очевидную важность как с фундаментальной, так и с практической точек зрения, и это направление находится в фокусе внимания многих исследовательских групп. Современное положение дел по этой теме очень подробно и обстоятельно освещено в ряде обзоров – Nord et al., 2015; Nomura et al., 2014; Medina, Abellan, 2009; Takahashi, Liu, 2006.
Не пытаясь объять необьятное, в настоящем обзоре, мы, кратко рассмотрев актуальные данные о молекулярных механизмах первичной диференцировки зачатка конечного мозга, как части центральной нервной системы (ЦНС) позвоночных, сконцентрируемся преимущественно на вопросах появления и развития конечного мозга позвоночных на ранних этапах их эволюционного пути. Один из вопросов, неизбежно возникающих в этом контексте состоит в том, чтобы понять на каком этапе эволюции конечный мозг впервые появляется. Естественным путем в решении этого вопроса видится исследование особенностей строения конечного мозга у современных представителей наиболее эволюционно древних групп позвоночных, таких как бесчелюстные, а также поиск гомологий в строении отделов ЦНС у родственных позвоночным представителей типа хордовых – бесчерепных и оболочников. Многие данные по этим группам получены в буквальном смысле в последние годы, что делает актуальной попытку их суммирования и анализа накопленных результатов.
ДИФФЕРЕНЦИРОВКА ЗАЧАТКА КОНЕЧНОГО МОЗГА В РАННЕМ ОНТОГЕНЕЗЕ ПОЗВОНОЧНЫХ
По ходу эволюционного развития разных групп позвоночных, строение их головного мозга менялось под воздействием факторов окружающей среды, обеспечивая приспособленность животных к меняющимся экологическим обстоятельствам. В результате, конечный мозг стал центром мультимодальной сенсорной организации, контролирующим богатый поведенческий репертуар животных и человека.
Дифференцировка зачатка ЦНС у позвоночных начинается на ранних этапах онтогенеза в ходе нейральной индукции. Исследования показывают, что нейроэктодермальная пластинка, представляющая собой первичный зачаток будущей ЦНС уже стратифицирована на молекулярном уровне по передне-задней оси. Согласно просомерической модели, описывающей дифференцировку головного отдела нервной трубки по передне-задней оси, первичный план морфологического строения включает подразделение зачатка будущего мозга на передний, средний и задний отделы, с примыкающим к ним каудально спинным отделом (Puelles, Rubenstein, 2015). В дальнейшем эти отделы подразделяются на более мелкие подотделы под воздействием сигналов так называемых “вторичных организаторов”. В качестве таких организаторов выступают расположенные вентральней нервной пластинки мезодермальные нотохорд и прехордальная пластинка, передний край нервной пластинки, ограниченная внутриталамическая зона (zona limitans intrathalamica, ZLI), расположенная между таламусом и преталамусом и перешеек или истмус-организатор (isthmic organizer, IsO), на границе среднего и заднего отделов мозга (mid-hindbrain border, MHB) (рис. 1). В результате первичный задний отдел подразделяется на метэнцефалон, включающий мозжечок и мост и миеленцефалон (medulla oblongata), средний отдел остается единым, а передний домен разделяется на промежуточный и конечный отделы мозга. Дорсо-вентрально промежуточный мозг в свою очередь подразделяется на таламус и гипоталамус, а конечный мозг – на кору и подкорковую зону (Yamamoto et al., 2017).
Рис. 1.
a – нейральная индукция нервной пластинки, ее последующее сворачивание в нервную трубку и дорсо-вентральная дифференцировка (поперечое сечение). н – нотохорд, нп – нервная пластинка. б – схема расположения организационных центров (“вторичных организаторов”) в зачатке головного мозга позвоночных. ANR – передний край нейрального зачатка (anterior neural ridge), ZLI – zona limitans interthalamica, IsO – isthmus organizer перешеек или истмусовый организатор, бнп – базальная часть нервной пластинки, кнп – крыша нервной пластинки (roof plate), н – нотохорд, пп – прехордальная пластинка. в – расположение отделов мозга на сагиттальном срезе головного отдела зародыша европейской речной миноги (Lampetra fluviatilis) на стадии 27 (по Tahara, 1988), км – конечный мозг, пм – промежуточный мозг, см – средний мозг.
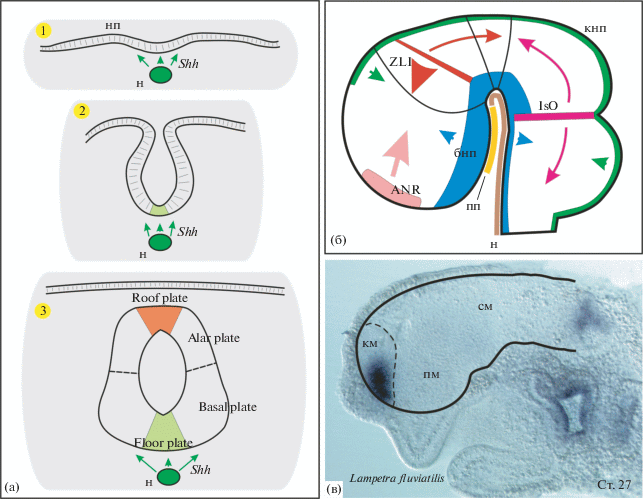
В качестве морфогенов вторичных организаторов выступают такие факторы как Shh и Fgf8/Wnt1, вовлеченные в дифференцировку переднего, промежуточного, среднего и части нейромеров заднего отделов (Viera et al., 2010; Danesin, Houart, 2012). В поперечном сечении в нервной трубке как правило выделяют четыре сегмента – крыша (roof plate), дорсальный сегмент (alar plate), вентральный сегмент (basal plate) и дно (floor plate) (рис. 1). Дорсо-вентральная дифференцировка зачатка нервной системы происходит рано, уже на стадии нервной пластинки, и до его сворачивания в нервную трубку выглядит как стратификация пластинки в медиолатеральной плоскости.
Конечный мозг морфологически впервые обособляется в качестве выроста прозенцефалона (зачатка переднего мозга позвоночных) на переднем конце нервной трубки. На этот момент, морфологически будущий конечный мозг представляет собой тонкий, по всей видимости, единообразный пласт нейроэпителиальных стволовых клеток, который, в ходе последующих делений дает начало нейронам и глиальным элементам коры больших полушарий (Taverna et al., 2014). Строение конечного мозга у позвоночных консервативно и у представителей всех классов он включает в себя два отдела: дорсальный (кора или паллиум) и вентральный (подкорковая зона или субпаллиум). Кора состоит из четырех отделов: медиальный паллиум (будущий гиппокамп), дорсальный паллиум (образующий кору), латеральный паллиум (будущая обонятельная кора и часть миндалины) и вентральный паллиум (будущая ограда мозга и часть миндалины). Подкорковая зона состоит из telencephalic stalk, латерального и медиального бугорка, которые дают начало базальным ганглиям стриатуму и паллидуму (Bachy et al., 2002).
Базальные ганглии, продуцирующие ингибиторные ГАМК-эргические нейроны – это высококонсервативные структуры, которые по данным комплексных исследований, включающих анализ клеточной морфологии и экспрессии нейротрансмиттеров генов раннего развития, были описаны у всех ныне живущих позвоночных. Клетки зачатка дорсального отдела – коры – являются источником активаторных глутаматэргических нейронов. При этом, в отличие от консервативных стриатума и паллидума, структуры коры значительно более эволюционно лабильны у разных групп позвоночных (Briscoe, Ragsdale, 2019).
Пространственная дифференцировка конечного мозга регулируется организационными центрами и транскрипционными факторами, которые наиболее полно исследованы у млекопитающих (Hebert, Fishell, 2008; Kiecker, Lumsdem, 2012).
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ДИФФЕРЕНЦИРОВКИ КОНЕЧНОГО МОЗГА
Принятая на сегодняшний день модель индукции конечного мозга включает в себя следующие постулаты:
– Нервная пластинка формируется из наивной эктодермы путем индукции, для которой требуется ингибирование BMP и TGF-beta сигнальных каскадов.
– Индуцированная нервная ткань изначально ориентирована на дифференцировку по переднему (антериорному) пути (так называемая модель индукции “по умолчанию”).
– Поддержание возможности дифференцировки клеток по антериорному типу зависит от активности антагонистов задних сигналов, которые, в свою очередь, направляют дифференцировку по постериорному типу (Andoniadou, Martinez-Barbera, 2013).
Классическая модель нейральной индукции, включая понятие “организатора” берет свое начало с экспериментов Г. Шпеманна и Х. Мангольд по индукции дополнительного комплекса осевых структур при пересадке дорсальной губы бластопора одного зародыша в вентральную область другого зародыша амфибий (Spemann, Mangold, 1924). Организатор здесь представляет собой группу клеток, способную индуцировать у реципиента развитие полной оси тела, включая нервную пластинку, а также стимулировать конвергенцию и вытягивание прилегающих групп клеток (Harland, Gerhard, 1997; Ariaz, Stevenson, 2018). Молекулярный анализ Шпеманновского организатора (дорсальной губы бластопора) у зародышей шпорцевой лягушки показал, что он выступает в качестве источника сигнальных факторов и его индуктивный потенциал отражает активность этих факторов. Этими сигнальными факторами являются ингибиторы BMP, Nodal и Wnt сигнальных каскадов (De Robertis et al., 2001). Структуры, обладающие индуктивным потенциалом, напоминающим организатор амфибий были обнаружены и у других позвоночных – гензеновский узелок у птиц, эмбриональный щиток у рыб, узелок у млекопитающих. Однако в ходе экспериментов, оказалось, что не все организаторы обладают полным спектром индукционных активностей, как в случае организатора у амфибой. Так, пересадка зародышевого узелка у мышей может индуцировать лишь развитие неполной оси, без конечного мозга (Beddington, 1994). Было выяснено, что для индукции полноценной оси требуется присутствие передней висцеральной эндодермы (ПВЭ) (Thomas, Beddington, 1996). Оказалось, что ПВЭ содержит группу клеток, дифференцирующихся еще до формирования первичной полоски и экспрессирующих гены, необходимые для индукции переднеголовных структур, такие как Otx2, Lhx1, Foxa2, Cer1, Lefty1, Dkk1 (Andoniadou, Martinez-Barbera, 2013). Аналогом ПВЭ у птиц является гипобласт, у рыб – дорсальный синцитиальный слой, у амфибий – желточные клетки вегетативного полюса, что указывает на вероятную консервативность роли этих структур в зародышах. На сегодняшний день точка зрения о важной роли ПВЭ в дифференцировке передней части нервной пластинки является общепринятой (Wilson, Houart, 2004; Andoniadou, Martinez-Barbera, 2013). При этом, сигналы ПВЭ взаимодействуют с другими сигнальными центрами, такими как вышеописанные гаструляционные организаторы и осевая мезодерма, вентрально примыкающая к нервной пластинке. Совокупная активность этих сигнальных центров защищает переднюю часть нервной пластинки от воздействия постериоризующих факторов.
Показано, что для нейральной дифференцировки по переднему типу требуется подавление BMP, TGF-beta Wnt/beta-catenin сигнальных каскадов (Watanabe et al., 2005). Эта точка зрения нашла свое подтверждение в исследованиях особенностей экспрессии генов и экспериментах по модуляции их активности полученных на представителях рыб, птиц, млекопитающих и, в первую очередь, амфибий. Было показано, что клетки анимальной эктодермы амфибий, в отсутствие внешних сигналов дифференцируются в переднюю нейральную эктодерму (Grunz, Tacke, 1989), что и было названо “индукцией по-умолчанию”. Однако, при обработке таких клеток факторами BMP, происходила их дифференцировка по эпидермальному пути (Wilson, Hemmati-Brivanlou, 1995), что подтверждало важность подавления BMP антагонистами, экспрессирующимися в шпеманновском организаторе (факторы Noggin и Chordin), для нейральной индукции. Открытие белка Cerberus, обладающего способностью с одной стороны ингибировать сигнальные пути BMP, TGF-beta Wnt/beta-catenin, а с другой – индуцировать полноценные осевые структуры (Piccolo et al., 1999) показало, что ингибирование этих трех сигнальных путей важно для нормальной переднеголовной дифференцировки.
Было показано, что молекулы Wnt оказывают постериоризующее влияние на нейральную ткань. Так, у амфибий наблюдается градиент уровня активности Wnt каскада с минимумом в головной части зародыша (Kiecker, Niehrs, 2001), что согласуется с данными на млекопитающих, где такие мишени Wnt/beta catenin каскада, как гены Axin2 и Sp5, экспрессиируются в задней и отсутствуют в передней части нервной пластинки (Andoniadou et al., 2007). У рыб повышенный уровень активности Wnt каскада приводит к дифференцировке зачатка будущего конечного мозга и тканей глаза по пути промежуточного отдела мозга (Heisenberg et al., 2001).
В качестве антагонистов Wnt каскада были описаны два ранних переднеголовных гена – Anf/Hesx1 и Six3, подавление экспрессии которых приводит к редукции структур конечного мозга (Zaraisky et al., 1992; Dattani et al., 1998; Lagutin et al., 2003).
Другими факторами, обладающими постериоризующей активностью являются ретиноевая кислота (Maden 1999) и факторы семейства FGF (Mason, 2007).
При этом важно отметить, что ряд исследований указывает на необходимость FGF и Wnt сигналов для самых ранних этапов нейральной индукции еще на стадии гаструлы, а последующее ингибирование BMP сигнала закрепляет уже состоявшуюся нейральную дифференцировку (Streit et al., 2000; Linker, Stern, 2004; Wilson et al., 2001; Wilson, Houart, 2004).
Различия индуктивных механизмов у представителей разных классов позвоночных встречаются и в отдельных аспектах нейральной дифференцировки. Так, согласно традиционной модели, нотохорд, в качестве первичного индуктора, посредством активности секретируемого транскрипционного фактора Shh, запускает формирование дна будущей нервной трубки а затем и ее дорсо-вентральную стратификацию. Однако было показано, что у птиц экспрессия Shh в зачатке дна нервной трубке обнаруживается раньше, чем в нотохорде, что требует уточнения и, возможно, пересмотра существующей индукционной модели (Kremnyov et al., 2018).
Подобные различия фундаментальных онтогенетических процессов у представителей разных классов позвоночных делают актуальными попытки исследований базовых регуляторных механизмов у представителей эволюционно древних групп, у которых с большой долей вероятности мозгли сохраниться паттерны, присущие предковым формам.
ПОДХОДЫ К ВОССТАНОВЛЕНИЮ ЭВОЛЮЦИОННОЙ ИСТОРИИ КОНЕЧНОГО МОЗГА
Эволюционное происхождение структур конечного мозга позвоночных долгое время оставалось неясным (Pani et al., 2012).
Морфологические отличия позвоночных от беспозвоночных велики, и у последних не обнаружено структур, очевидно гомологичных головному мозгу позвоночных (Briscoe, Ragsdale, 2019). У многих беспозвоночных нет централизованной нервной системы, а проведенный широкоформатный сравнительный анализ показал, что централизация нервной системы у кольчатых червей и членистоногих с одной стороны и позвоночных с другой происходили независимо (Martin-Duran et al., 2018).
Исторически, основным методом реконструкции предковых форм традиционно являлась сравнительная морфология. Она дополнилась сравнением особенностей экспрессии регуляторных генов и механизмов развития (evo-devo), а также такими усовершенствованными морфологическими подходами, как анализ серий срезов на электронном микроскопе (serial transmission electron microscopy, TEM) с последующим восстановлением объемной структуры и конфокальная микроскопия меченых специфическими антителами образцов.
Еще один из появившихся в последнее время подходов – филостратиграфия, исследующая эволюционное происхождение генов, экспрессирующихся в той или иной структуре мозга позвоночных (Domazet-Loso, et al., 2007; Sestak et al., 2015). Полученные методами сравнительной геномики данные позволяют оценить на каком этапе эволюции был сформированы генетическая предпосылки для появления определенной структуры. В частности, когда такой подход был пременен к анализу генов, экспрессирующихся в отделах и структурах мозга позвоночных, было установлено, что пик появления новых генов для мозга в целом (включая передний средний и задний отделы) наблюдается у ланцетника. В то же время, если детализировать анализ генов конечного мозга, разделив их на дорсальный и вентральный отделы, то гены вентрального теленцефалона в основном появились у ланцетника, хотя дополнительные пики наблюдаются и позже – у бесчелюстных и костных рыб. Гены дорсального отдела конечного мозга активно появились уже у позвоночных. На основании такого анализа можно следать вывод, что большинство генов, вовлеченных в развитие мозга позвоночных появились у общего предка бесчерепных и позвоночных. Исключение составляют лишь гены дорсального отдела конечного мозга, многие из которых появились уже у позвоночных (Holland, 2015).
Передне-задняя и дорсо-вентральная морфологическая дифференцировка ЦНС у каждого из модельных объектов уже на ранних этапах развития характеризуется особенностями экспресcии специфических генов-маркеров, что привело к появлению концепции геноархитектуры (Puelles, Ferran, 2012). Эта разметка на молекулярном уровне отмечает границы нейромеров, часто совпадающие с сегментацией на анатомическом уровне. Высокая степень консерватизма сегментации головного мозга у разных групп позвоночных как на морфологическом и молекулярном уровне указывает на то, что план строения и его генетическая основа этой структуры сформировались у общего предка группы.
Одним из основных путей при реконструкции эволюционно базового плана строения отдельной структуры является исследование особенностей экспрессии ортологов ключевых генов маркеров этой структуры у разных групп позвоночных и их ближайших родственников. Наиболее близкими группами к позвоночным являются такие представители хордовых как бесчерепные (ланцетники) и оболочники. В последние годы появилось много новых данных об особенностях экспрессии регуляторных генов в раннем развитии этих групп, которые мы и рассмотрим ниже.
ПОИСК ГОМОЛОГОВ КОНЕЧНОГО МОЗГА У БЕСЧЕРЕПНЫХ И ОБОЛОЧНИКОВ
Тип хордовых включает в себя три подтипа – бесчерепных (Cephalochordata), оболочников (Tunicata) и позвоночных (Vertebrata).
Всех представителей типа хордовых объединяет наличие мезодермального тяжа – нотохорда, хвостового (постанального) отдела тела и дорсально расположенной нервной трубки. Эволюционная дивергенция трех групп хородовых произошла около 550 млн лет назад (Putnam et al., 2008).
Подтип бесчерепных или ланцетников включает 23 вида морских животных. Внешне ланцетники похожи на рыб, но не имеют конечностей, челюстей и парных сенсорных органов, характерных для позвоночных, по типу питания – фильтраторы.
Секвенирование генома флоридского ланцетника Branchiostoma floridae показало высокий уровень его синтении с геномами позвоночных. Проведенное сравнение также подтвердило идею, впервые высказанную в 1970 г. Ohno о двух раундах полногеномной дупликации, произошедшей у позвоночных. Часть дополнительных копий генов, появившихся при этой дупликации были впоследствии утрачены, но гены, участвующие в развитии и кодирующие сигнальные белки в массе своей сохранились, и, вполне вероятно, послужили генетическим фундаментом обеспечившим появление и последующее развитие сложноструктурированного мозга позвоночных.
Отсутствие геномной дупликации и медленная скорость эволюции позволяют рассматривать бесчерепных как группу, близкую по строению к предковым формам хордовых (Holland, 2015). Дополнительной поддержкой такого взгляда выступают ископаемые формы, такие как Haikouella, в значительной мере сходные с ланцетником, но обладавшие парными глазами и сравнительно большими размерами мозга (Morris, Caron, 2014).
На переднем крае нервной трубки ланцетника располагается утолщение – мозговой пузырь, который морфологически имеет не так много общих черт с отделами головного мозга позвоночных. Однако при анализе паттернов экспрессии консервативных регуляторных генов было показано, что определенные гомологичные черты с мозгом позвоночных имеются. Это задний отдел, промежуточный мозг с гомологом пинеального органа, и, возможно, маленький по размеру средний мозг, который получает сигналы от фронтального глаза (Toresson et al., 1998).
Анатомически ЦНС ланцетника не имеет выраженной сегментации, за исключением задней границы мозгового пузыря и передне-задняя маркировка обычно производится по сомитам, которые тянутся до самого переднего края тела. Доказательством наличия у ланцетника гомолога заднего отдела мозга является обнаруженная экспрессия Hox генов (Shubert et al., 2006). Анализ паттернов экспрессии регуляторных генов показал, что у ланцетника присутствуют, по крайней мере частично, генетические механизмы, детерминирующие три основных организационных центра (вторичных организатора) мозга позвоночных – передний нервный валик (anterior neural ridge, ANR), zona limitans intrathalamica (ZLI) и граница между задним и средним мозгом (MHB). Передний край ЦНС у ланцетника, как и у позвоночных, экспрессирует Dlx5, FoxG1, Fgf8 (Holland et al., 1996; Bertrand et al., 2011).
На основе проведенного исследования особенностей экспрессии 48 маркерных генов ланцетника, гомологичных описанным регуляторам развития головных структур позвоночных была предложена схема разделения зачатка его нервной системы на 2 региона – передний Otx-положительный (ARCH, archencephalic prototagma) и задний, экспресирующий Gbx (DUE, deuteroencephalic prototagma). У позвоночных граница между областями экспрессии этих генов отмечает один из важных вторичных организаторов – границу среднего и заднего отделов мозга (MHB). Передний (Otx+) домен при этом может быть в свою очередь подразделен на основе экспрессии генов Fezf и Irx. Как и у позвоночных, у ланцетника экспрессия Fezf обнаруживается в самой передней части нервной трубки на ранних стадиях ее формирования. Сзади к этому домену, примерно посередине мозгового пузыря прилегает область экспрессии Irx. Исследования, проведенные на позвоночных, показали, что граница областей экспрессии Fezf и Irx дает начало важному организационному центру на границе преталамуса и таламуса – ZLI (Scholpp et al., 2007; Rodriguez-Seguel et al., 2009). При этом гомология этой области у ланцетника и позвоночных не является полной, поскольку экспрессирующийся в этой области у ланцетника ген engrailed у позвоночных обнаруживается на границе среднего и заднего отделов (Castro et al., 2006).
По результатам анализа геноархитектуры передней части мозгового пузыря ланцетника на стадии нейрулы (7 сомитов) Albuixech-Crespo и соавторы называют Fezf положительную область гипоталамо-преталамическим зачатком (HyPTh), а прилегающий к ней сзади Irx-положительный домен – диэнцефало-мезенцефалическим зачатком (DiMes). В свою очередь, передний из доменов (HyPTh) дополнительно подразделяется на три зоны по передне-задней оси. Авторы приходят к выводу, что наиболее передний из отделов мозгового пузыря ланцетника соответствует зачатку переднего отдела промежуточного мозга позвоночных (Albuixech-Crespo et al., 2017). Этот вывод согласуется с доминирующей на сегодняшний день точкой зрения, согласно которой, у современных бесчерепных (и, с большой долей вероятности у предковых форм хордовых) в качестве переднего отдела ЦНС выступает гомолог промежуточного отдела мозга позвоночных, а конечный отдел мозга появляется в эволюции позже, только у позвоночных. Также отмечается, что промежуточный и средний отделы мозгового пузыря ланцетника, гомологичные соответствующим отделам мозга позвоночных развиты слабо, состоят лишь из двух рядов клеток, экспрессирующих Pax4/6. Это может свидетельствовать об эволюционном единстве гомологичных этому сегменту отделов мозга позвоночных – таламуса, претектума и среднего мозга (Albuixech-Crespo et al., 2017).
Поскольку дифференцировка нервной системы у ланцетника, как и у позвоночных, происходит на ранних этапах онтогенеза, в качестве объектов исследований при изучении особенностей строения отдельных структур и поисках гомологий с другими группами животных выступают обычно ранние стадии развития. В то же время, проведенный анализ экспрессии переднеголовных генов-маркеров у взрослых особей ланцетника принес неожиданные результаты. После метаморфоза в мозговом пузыре взрослого ланцетника был обнаружен домен, близкий по своей геноархитектуре нейроэпителию развивающихся коры и подкорковой области позвоночных (Benito Gutierrez et al., 2018). В нем обнаруживалась обширная область экспрессии гена FoxG1, простирающаяся от глаза, до переднего края инфундибулярного органа. На личиночной стадии экспрессия FoxG1 обнаруживалась только в отдельных клетках передней части тела. Кроме FoxG1 в дорсальной части мозгового пузыря была обнаружена экспрессия генов EmxA и EmxB, не описанные ранее на личиночной стадии и гены Lhx2 и Lhx9. Дорсо-вентральная компартментализация конечного мозга позвоночных, состоящего из коры и подкорковый зоны, может быть охарактеризована областями экспрессии генов Pax6 и Nkx2.1 (Hebert, Fishell, 2009). Оказалось, что паттерн экспрессии гена Pax4/6 у взрослого ланцетника сильно отличается от личиночной стадии, больше напоминая паттерн ортолога Pax6 позвоночных. Так, у взрослых особей ген Pax4/6 обнаруживается только в дорсальной части мозгового пузыря, частично перекрываясь с доменами экспресии Emx и Lhx2/9. Паттерн экспрессии Nkx2.1, наблюдаемый на личиночной стадии в задне-вентральной части мозгового пузыря, на взрослой стадии дополняется доменом, достигающим передней части мозгового пузыря, частично перекрывающегося с областью экспрессии FoxG1. Домен экспрессии в мозговом пузыре был обнаружен на взрослой стадии и у гена Hedgehog (Shh, Hh), активность которого в передней части нервной пластинки у позвночных необходима для формирования конечного мозга (Retaux, Kano, 2010). Поздняя активация экспрессии Hh в мозговом пузыре индуцирует дифференцировку обширной области, экспрессирующей FoxG1, которая в дальнейшем подразделяется на дорсальный Emx-Lhx2/9-Pax4/6 положительный и вентральный Hh-Nkx2.1-положительный домены.
В совокупности с данными об обнаружении у ланцетника дорсальной популяции глутаматэргических и холинэргических нейронов это исследование показывает, что у ланцетника, по всей вероятности, дифференцировка структур мозга происходит в два этапа: на личиночной стадии формируются вентральные структуры, а после метаморфоза – дорсальные (Benito Gutierrez et al., 2018). На наш взгляд, эти новые данные интересны также с точки зрения общего понимания механизмов появления новых структур. Наблюдаемая у ланцетника выраженная гетерохрония экспрессии генов-маркеров конечного мозга ярко иллюстрирует предпочтительную вероятность появления эволюционно новой структуры на сравнительно поздних стадиях онтогенеза.
У оболочников, в отличие от ланцетников, на позвоночных внешне похожа лишь свободно плавающая личинка, которая после метаморфоза превращается во взрослую особь, ведущую прикрепленный образ жизни. Наиболее изученным представителем этой группы является асцидия Ciona intestinalis, взрослая особь коорой имеет мешковидное тело и два отверстия – вводящий и выводящий сифоны (Nieuwenhuys, 2002). При этом, анализ геномных данных показал, что, несмотря на большие морфологические различия, оболочники являются более близкими родственниками позвоночных, чем бесчерепные (Delsuc et al., 2006). В то же время, отмечается, что оболочники эволюционировали сравнительно быстро и их геном сильно редуцировался, утратив многие регуляторные гены. Личинка же состоит из сравнительно небольшого числа клеток. Эти обстоятельства сильно осложняют попытки воссоздания общего предка позвоночных и оболочников (Holland, 2015).
Характерные признаки хордовых – нотохорд и дорсально расположенная центральная цервная система обнаруживаются у асцидии только на личиночной стадии и при метаморфозе эти структуры ресорбируются. ЦНС личинки включает расширенную тонкостенную переднюю часть, веретенообразный промежуточный и длинный хвостовой отделы. Передний отдел обычно называют сенсорным пузырем и включающую вентральный отолит, группу вентро-каудальных клеток, предположительно выполняющих роль сенсора давления и движения и относительно крупный фоторецепторный орган.
В сенсорном пузыре личинки асцидии была обнаружена экспрессия гена Hroth – единственного гомолога гена Otx позвоночных. Характер экспрессии обнаруженного гена HrPax2/5/8 отличался от гомологичных ему генов Pax2, Pax5 и Pax8 позвоночных. Были также обнаружены три Hox гена, гомологичные генам Hoxb1, Hox3, Hox5 (Wada et al., 1998).
Полученные данные показывают, что сегментация нервной системы на основные отделы – передний (прозенцефалон + средний мозг), средний (продолговатый мозг) и задний (спинной мозг) отделы наблюдаются у всех хордовых что, по всей видимости, является отражением появления такой дифференцировки еще до эволюционного разделения бесчерепных, оболочников и позвоночных.
КОНЕЧНЫЙ МОЗГ У БЕСЧЕЛЮСТНЫХ, КАК ДРЕВНЕЙШИХ ПРЕДСТАВИТЕЛЕЙ ПОЗВОНОЧНЫХ
В контексте изучения механизмов раннего развития нервной системы позвоночных, бесчелюстные (круглоротые) являются уникальной группой животных. Поскольку их предки отделились от общего ствола позвоночных на самых ранних этапах их эволюции, у генов этой группы, с большой вероятностью, мог сохраниться древний тип экспрессионных паттернов, характерный для предков позвоночных.
Согласно литературным данным, разделение ветвей бесчелюстных и челюстноротых произошло на самых ранних этапах эволюции позвоночных в палеозое. По ряду оценок, это разделение могло произойти еще в кембрийском периоде, то есть около 535–462 млн лет назад (Janvier, 2006; Kuraki, Kuratani, 2006; Feinberg, Mallatt, 2013). Наиболее древним из обнаруженных на сегодняшний день видов миног является Priscomyzon riniensis, описанный в 2006 г. (Gess et al., 2006). Авторы отмечают, что у этого девонского представителя миног уже присутствовали характерные морфологические признаки группы, такие как, круглая воронка с зубами и жаберный аппарат. Возраст этого ископаемого из Южной Африки составляет около 360 млн лет.
Современные бесчелюстные включают в себя представителей двух классов – миног и миксин. Большинство исследователей на сегодняшний день сходятся во мнении, что круглоротые являются монофилетической группой и разделение миног и миксин ориентировочно датируется 470–390 млн лет (Kuraki, Kuratani, 2006; Osorio, Retaux, 2007).
По сравнению с миксинами, миноги более доступны в качестве лабораторного объекта, поэтому исторически основная часть работ была посвящена исследованию именно этой группы. Интерес к миногам, как к не вполне традиционному, но перспективному объекту для лабораторных исследований, неуклонно возрастает (Green et al., 2014; McCauley et al., 2015; Yang et al., 2016).
На сегодяшний день описано около 40 видов миног, живущих в умеренных широтах обоих полушарий (Renaud, 2011). Представители всех видов миног размножаются лишь один раз в жизни. Инкубация икры в естественных условиях происходит на галечниковых грунтах при температуре воды 11–18°C. Продолжительность инкубации и скорость эмбрионального развития зависят от температуры воды. Через несколько дней после вылупления личинки миног – пескоройки покидают гнезда и расселяются по речной системе (Павлов и др., 2014), где проводят по разным данным от трех до пяти лет.
С точки зрения строения тела миноги имеют ряд общих с челюстноротыми признаков, такие как головной и спинной мозг, хорду, череп, глоточные арки, производные сомитов. В то же время у них есть ряд существенных отличий – рот-присоска, формирующийся в ходе метаморфоза, отрытый пинеальный орган, два полукружных канала во внутреннем ухе, иное строение глотки, отсутствуют челюсти и парные конечности (Kuratani et al., 2001; Osorio, Retaux, 2007).
Генетической основой ряда ароморфозов и возникновения новых структур позвоночных могли стать дупликации геномов. Вопрос о том, в какой момент в эволюции они происходили активно обсуждался в последнее время и важную роль тут играл анализ кластеров Hox-генов у разных групп животных. Большинство челюстноротых содержат четыре локуса Hox и ParaHox генов, тогда как ланцетник, наиболее примитивный представитель хордовых, содержит всего по одному локусу этих генов. Происхождение четырех локусов у челюстноротых объяснялось двумя раундами полногеномой дупликации на ранних этапах эволюции (Putnam et al., 2008). Как было показано, в геноме миног, в отличие от челюстноротых, содержится, по меньшей мере, шесть локусов гена Hox (Mehta et al., 2013), что может указывать на дополнительный раунд дупликации этих генов у миног. Однако, при этом, у миног было обнаружено только два локуса ParaHox генов (Gsx, Pdx, и Cdx). Эти данные, в свою очередь, говорят о том, что дупликация Hox генов у миног, вероятно, являлась результатом не полногеномной дупликации, а скорее частичной, произошла уже после разделения эволюционных линий миног и челюстноротых (Zhang et al., 2017). Таким образом, согласно этой точке зрения, общим у бесчелюстных и челюстноротых был один раунд полногеномной дупликации, а в дальнейшем дупликации происходили в этих группах независимо.
Поскольку появление конечного мозга стало одним из важнейших ароморфозов позвоночных, большое внимание исследователей привлекает строение головного мозга миног, и особенно конечного мозга, который морфологически впервые появляется именно у этой группы животных (рис. 1в).
Морфологически головной мозг миног похож на мозг костистых рыб, за исключением ряда особенностей, таких как хорошо развитый эпифиз, расположенный под назальным отверстием, и очень слабо развитый мозжечок (Sugahara et al., 2017). При исследовании геноархитектуры конечного мозга миног, в его дорсальной части была обнаружена экспрессия генов Pax6 (Murakami et al., 2001) и Emx (Tank et al., 2009), а в вентральной – генов Dlx (Miojin et al., 2001; Murakami et al., 2001; Neidert et al., 2002). Обнаружение зон экспрессии Pax6 и Dlx и стало на ранних этапах исследований основным свидетельcтвом наличия у миног структур, гомологичных конечному мозгу челюстноротых. При этом отмечалось, что кора и гипоталамус у миног развиты еще слабо (Murakami et al., 2005). Долгое время у миног считались отсутствующими структуры медиального ганглионарного бугорка (компонента базальных ядер конечного мозга) и ромбической губы – зачатка будущего мозжечка, что склоняло исследователей ко мнению о возникновении этих структур у челюстноротых уже после их отделения в эволюции от бесчелюстных (Sugahara et al., 2017).
Поиск консервативных для позвоночных переднеголовных генов у миног, в сочетании с исследованиями на миксинах, привели к тому, что в последние годы у миног был обнаружен ряд новых для них генов, что внесло коррективы в сложившуюся ранее картину геноархитектуры передних отделов мозга. Были найдены два ортолога гена Nkx2.1 – гены Nkx2.1/2.4B и Nkx2.1/2.4C, экспрессия которых наблюдается в вентральной зоне подкорковой области конечного мозга. Поскольку у позвоночных ген Nkx2.1 описан в качестве маркера медиального ганглионарного бугорка (Sussell et al., 1999), эта находка указывает на наличие у миног структур, гомологичных медиальному ганглионарному бугорку челюстноротых, из которого, как уже отмечалось, развивается двигательный центр паллидум, ранее считавшийся отсутствующим у бесчелюстных (Sugahara et al., 2016). Также у миног были обнаружены три ортолога гена Pax6. Все они экспрессируются в формирующихся глазных структурах и мозге, что соответствует экспрессии гена Pax6 у челюстноротых, у которых этот ген является ключевым регулятором развития глаз и ЦНС (Osumi et al., 2008; Klimova, Kozmik, 2014). При этом паттерн экспрессии генов Pax6 миног в других структурах различается. Экспрессия Pax6a обнаруживается в печени, указывая на то, что у предков позвоночных ген Pax6, по всей видимости, участвовал в формировании этого органа (Ravi et al., 2019).
В области заднего мозга у миног были обнаружены гомологи генов, участвующих в развитии ромбической губы и мозжечка челюстноротых – гены Atoh1, Wnt1 и Ptf1a (Wullimann et al., 2011). Это указывает на то, что генетические основы формирования этой структуры мозга, морфологически отсутствующей у бесчелюстных, могли сформироваться еще до эволюционного разделения бесчелюстных и челюстноротых. В нотохорде наблюдается экспрессия гена Shh (рис. 2).
Рис. 2.
Области экспрессии регуляторных генов на ранних стадиях развития европейской речной миноги (Lampetra fluviatilis) показанные методом гибридизации in situ. а, б – паттерн экспрессии гена Hedhehog (Hh). ZLI – zona limitans interthalamica. в–з – экспрессия генов зачатка конечного мозга. в, г – экспрессия гена Lanf. д, е – экспрессия гена NogginB. ж, з – экспрессия гена FoxG1. км – конечный мозг, уп – ушной пузырек.
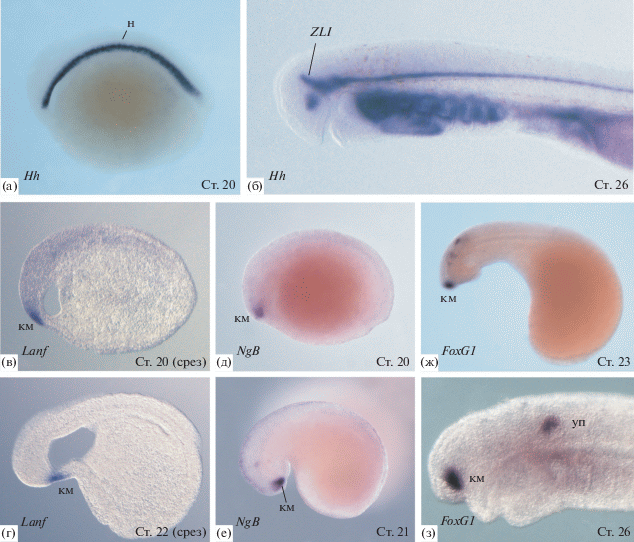
Экспрессия раннего регулятора развития мозга – гена Otx у миног, начинается на самых ранних этапах онтогенеза, в районе спинной губы бластопора, а у личинки наблюдается в области переднего и среднего отделов мозга, до границы между средним и задним мозгом (Tomsa, Langeland, 1999; Suda et al., 2009).
Ингибитором экспрессии гена Otx у позвоночных и одним из ключевых регулятоорв ранней дифференцировки переднего мозга позвоночных являются гомеобоксные гены класса Anf/Hesx1 (далее Anf) (Zaraisky et al., 1992). В серии работ на амфибиях было показано, что в клетках зачатка переднего мозга белок Anf играет роль специфического репрессора транскрипции, подавляя экспрессию генов, индуцирующих дифференцировку задних отделов мозга (Ermakova et al., 1999, 2007; Eroshkin et al., 2002; Martynova et al., 2004; Bayramov et al., 2004). Исходя из этого, была выдвинута гипотеза о том, что репрессорная активность Anf в передней части зачатка центральной нервной системы у предков позвоночных обеспечила образование в этом регионе особой зоны, клетки которой оказались свободны от инструктирующего влияния генов, определяющих судьбу более задних регионов нервной системы. В результате, эта передняя зона нейрального зачатка, экспрессирующая Anf, получила свободу эволюционировать в новом направлении, что и привело, в конце концов, к образованию переднего мозга. Эта гипотеза получила важное подтверждение после того, как у трех видов миног Lethenteron сamtschaticum, Lampetra fluviatilis и Petromyzon marinus был обнаружен ген Anf (Bayramov et al., 2016, Байрамов и др., 2017, рис. 2).
Функциональные исследования показали, что ген Anf миног по своим свойствам сходен с генами Anf челюстноротых, обладает ингибиторной активностью, подавляя экспрессию гена Otx и усиливая экспрессию ключевого регулятора развития конечного мозга – гена FoxG1. Это указывает на то, что появление генов класса Anf было существенным, если не ключевым, фактором в возникновении у позвоночных структур конечного мозга (Bayramov et al., 2016).
Белок, кодируемый неоднократно упоминавшийся выше геном FoxG1, относится к семейству Forkhead-связывающих транскрипционных факторов и играет ключевую роль в индукции и пространственной организации развития конечного мозга у позвоночных. Экспрессия FoxG1 в переднем отделе мозга достаточно консервативна у разных групп позвоночных и, поэтому этот ген часто применяется в качестве маркера данного отдела мозга (Kumamoto, Hanashima, 2017). У всех исследованных позвоночных FoxG1 (ранее также известный как BF-1), является одним из первых транскрипционных факторов, экспрессирующихся в передней части нервной пластинки – области будущего конечного мозга и в дальнейшем его экспрессия сохраняется до зрелых стадий (Danesin, Houart, 2012). Было показано, что ген FoxG1 имеет важное значение для многих аспектов развития конечного мозга и выживания нейронов в коре головного мозга у взрослых организмов. Блокирование трансляции FoxG1 у рыб и мышей приводит к редукции вентральной области конечного мозга, что отражается в вентральной экспансии маркеров дорсальной части конечного мозга (Martynoga et al., 2005; Danesin et al., 2009). У человека мутации гена FOXG1 приводят к нарушениям развития, таким как синдром Ретта, эпилепсия, постнатальная микроцефалия, тяжелая умственная отсталость, нарушения речи, дискинезия и гипогенез мозолистого тела (Kortum et al., 2011; Danesin, Houart, 2012).
Пространственный паттерн экспрессии FoxG1 у миног в целом соответствует паттернам экспрессии FoxG1 у других позвоночных, в том числе у шпорцевой лягушки (Ermakova et al., 2019). В тоже время имеется и ряд отличий. Так, экспрессия FoxG1 у миноги впервые в развитии детектируется в формирующихся ушных плакодах и вентаральной части теленцефалона (рис. 2). При этом у миноги FoxG1 совсем не экспрессируется в дорсальной части теленцефалона, тогда как у других позвоночных экспрессия этого гена в теленцефалоне носит градиентный характер, с возрастаниеми интенсивности от дорсальной части к вентральной (Danesin, Houart, 2012). Также у миноги в отличие от других позвоночных экспреcсия FoxG1 не обнаруживается в формирующихся глазных структурах, что может объясняться особенностью развития этих структур у миног. В отличие от челюстноротых у миног наблюдается двухступенчатое развитие глаза и зрительного нерва. На эмбриональной стадии глаз покрыт толстой непрозрачной кожей, хрусталик незрелый что, возможно, указывает на примитивное состояние зрительной системы позвоночных (Melendez-Ferro et al., 2002; Suzuki et al., 2015). В этот период образуется небольшое количество волокон зрительного нерва. Позже в онтогенезе формируются новые оптические волокна, и после метаморфоза у взрослых миног развиваются полноценные глазные камеры.
При анализе особенностей динамики экспрессии генов Anf и FoxG1 у миног было показано, что у этих генов миног наблюдается гетерохрония экспрессии по сравнению с их гомологами у более эволюционно продвинутых позвоночных – амфибий (Ермакова и др., 2020). У шпорцевой лягушки возрастание экспрессии Anf наблюдается еще до начала нейруляции, на стадии поздней гаструлы, в то время как у миноги этот ген начинает активно экспрессироваться только начиная со стадии поздней нейрулы (ст. 20 по Tahara, 1988). Ген FoxG1 у шпорцевой лягушки начинает экспрессироваться уже в конце гаструляции – начале нейруляции в клетках зачатка конечного мозга, в то время как у миног экспрессия FoxG1 обнаруживается в области конечного мозга на стадии головного выроста, т.е. уже после окончания нейруляции (стадия 22 по Tahara, 1988).
Такая гетерохрония экспрессии генов конечного мозга соответствует гипотезе о том, что этот отдел мозга, являясь наиболее эволюционно молодым отделом центральной нервной системы, мог появиться у предков позвоночных в качестве надстройки на поздних стадиях их эмбрионального развития (Ермакова и др., 2020).
Еще одним регулятором раннего развития структур переднего мозга позвоночных являются гены семейства Noggin. Открытие гена Noggin можно по праву отнести к одним из важнейших событий в истории молекулярной биологии развития. Noggin стал первым известным фактором, в норме секретирующимся в области Шпеманновского организатора, для которого была показана способность вызывать формирование дополнительных осей тела в случаях его экспериментальной эктопической экспрессии на вентральной стороне зародыша амфибий (Dale, Slack, 1987; Smith, Harland, 1992; Lamb et al, 1993; Smith et al., 1993; Slack, Tannahill, 1993). Впоследствии была также показана ключевая роль гена Noggin в широком спектре онтогенетических процессов, в частности, в дифференцировке и установлении паттерна зачатка нервной системы и мезодермы сомитов (Knecht, Harland, 1997; McMahon et al., 1998), в развитии суставов и черепных швов (Brunet et al., 1998; Warren et al., 2003), дифференцировке волосяных луковиц (Botchkarev et al., 1999). Также показано, что Noggin может подавлять развитие кровеносных сосудов (Reese et al., 2004).
В последствии были описаны два гомолога гена Noggin – Noggin2 и Noggin4 (Fletcher et al., 2004; Eroshkin et al., 2006). На модели шпорцевой лягушки было показано, что паттерн экспрессии гена Noggin2 в целом напоминает описанный ранее паттерн экспрессии гена Noggin1. В частности, начало экспрессии гена Noggin2 наблюдается на стадии нейрулы в области переднего нервного валика, а именно – во внутреннем (сенсорном) слое нервной пластинки, а на более поздних стадиях экспрессия обнаруживается в дорсальной области формирующегося переднего мозга, и, на более низком уровне – в районе заднего мозга, спинных участках сомитов и в формирующемся сердце (Eroshkin et al., 2006).
Долгое время считалось, что основной (по сути – единственной описанной) функцией Noggin1 в развитии позвоночных является подавление сигнального каскада BMP (bone morphogenetic proteins) – группы ростовых факторов из суперсемейства TGF-beta. Модуляция активности BMP каскада является необходимым условием для формирования нервной ткани и дифференцировки дорсальной мезодермы (Xanthos et al., 2002; Moreau, Leclerc, 2004). Таким образом, выступая в качестве антагониста BMP сигнала и обладая способностью связывать молекулы BMP, Noggin играет принципиальную роль в двух важнейших онтогенетических процессах: дорсализации и нейрализации. Дорсализация представляет собой процесс развития зародышевой мезодермы в скелетную мускулатуру, а нейрализация – дифференцировку эмбриональной эктодермы по нейральному пути. Активной секретируемой формой фактора Noggin является гомодимер типа цистинового узла, в котором две молекулы связаны между собой дисульфидным мостиком (Smith et al., 1993).
При исследовании гена Noggin2 было показано, что он обладает способностью подавлять не только BMP, но также и Nodal/Activin и Wnt/beta-cathenin сигнальные каскады, играющих ключевые роли в клеточной дифференцировке и развитии головных структур позвоночных. Оверэкспрессия мРНК Noggin2 в зародышах X. laevis приводит к формированию дополнительного комплекса осевых структур в которых наблюдается экспрессия переднеголовных генов (Bayramov et al., 2011).
Ортолог гена Noggin2, ген NogginB, экспрессирующийся в области зачатка конечного мозга на ранних стадиях его дифференцировки был обнаружен у миног (рис. 2).
В целом, при сопоставлении геноархитектуры мозга миног и челюстноротых обнаруживается много гомологий, свидетельствующих о том, что сегментация отделов мозга появилась у предковых позвоночных до разделения эволюционного пути этих групп животных.
Живых зародышей другой группы бесчелюстных – миксин, ввиду экологических особенностей этих животных, ведущих глубоководный образ жизни, не удавалось получить очень долгое время. Систематическое изучение развития миксин в лаборатории было начато лишь в последние 10–15 лет группой японских исследователей под руководством проф. Куратани (Ota et al., 2007; Oisi et al., 2013; Sugahara et al., 2016).
Анализ нейромеров головного мозга на ранних стадиях развития миксины Eptatretus burgeri показал наличие в области конечного мозга экспрессии ортологов генов FoxG1, EmxB и Pax6. Гипоталамус, обнаруживается спереди от промежуточного мозга как области экспрессии гена Hh2 (всего у миксины найдено три ортогола гена Hh) и гена Nkx2.1/2.4, ортологичного генам Nkx2.1 и Nkx2.4 позвоночных. Как и у миног, область экспрессии Hh отмечает ZLI между преталамусом и таламусом в промежуточной отделе мозга (Sugahara et al., 2016).
Таким образом, по количеству обнаруженных гомологий, в геноархитектуре мозга бесчелюстных и челюстноротых, можно заключить, что конечный мозг, впервые появился на самых ранних этапах эволюции позвоночных и основные молекулярные механизмы, лежащие в основе его закладки и формирования присутствовали у предков позвоночных.
ЭВОЛЮЦИОННЫЕ ВЕКТОРЫ РАЗВИТИЯ КОНЕЧНОГО МОЗГА У ЧЕЛЮСТНОРОТЫХ
Эволюционный расцвет конечного мозга, безусловно, приходится на челюстноротых. В ходе эволюционного пути этой группы, одним из основных векторов развития конечного мозга являлось увеличение размеров и структурированности этого отдела, обеспечивающие развитие и усложнение поведенческого репертуара животных и высших форм нервной деятельности человека. В качестве одного из возможных механизмов такой экспансии рассматривается изменение времени закладки организационных центров, модулирующих тканевую дифференцировку. По передне-задней оси тела, как уже отмечалось такими центрами являются передний край нервной пластинки, путем секреции Fgf стимулирующий экспрессию генов FoxG1 и Emx1, участвующих в развитии зачатка передних отделов мозга, и граница между средним и задним отделами мозга (MHB), секретирующая постериоризующий сигнал Wnt (Bielen et al., 2017). При этом, если у рыб активация этих сигнальных центров происходит одновременно, на стадии средней гаструлы, то у млекопитающих включение заднего центра происходит на более поздних стадиях. За счет этого временного сдвига активности заднего организатора, зачаток нервной пластинки дольше находится под воздействием сигналов, стимулирующих дифференцировку по переднему типу.
В заключение можно отметить, что, как показывает приведенный анализ литературных данных, в последние годы получено много новой информации об особенностях строения и геноархитектуры зачатка конечного мозга у низших позвоночных и их ближайших родственников – бесчерепных и оболочников. Возрастающая скорость появления этой информации и ее внушительные объемы вселяют надежду на качественный прогресс в понимании предпосылок и генетических механизмов, обеспечивших появление и последующее эволюционное развитие конечного мозга у позвоночных.
ФИНАНСИРОВАНИЕ РАБОТЫ
Исследование выполнено и публикация подготовлена при финансовой поддержке РФФИ в рамках научного проекта № 19-14-50215.
Эксперименты по исследованию генов FoxG1 и Noggin миног проведены за счет гранта РФФИ № 18-04-00015. Анализ экспрессии гена Hh выполнен за счет гранта Российского научного фонда (проект № 19-14-00098). Эксперименты по функциональному исследованию переднеголовных генов шпорцевой лягушки выполнены за счет гранта РФФИ № 18-29-07014. Исследование гена Anf выполнено за счет гранта по программе РАН “Фундаментальные исследования для биомедицинских технологий”.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что какой-либо конфликт интересов отсутствует.
Список литературы
Байрамов А.В., Ермакова Г.В., Ерошкин Ф. М. и др. Гомеобоксный ген семейства Anf, обнаруженный у тихоокеанской миноги Lethenteron camtschaticum, подтверждает гипотезу о важности появления генов Anf для возникновения конечного мозга в эволюции позвоночных // Онтогенез. 2017. Т. 48. № 4. С. 241–251.
Ермакова Г.В., Кучерявый А.В., Зарайский А.Г. и др. Гетерохрония экспрессии генов Lanf и FoxG1 у миноги подтверждает появление конечного мозга как эволюционно молодой надстройки в центральной нервной системе позвоночных // Онтогенез. 2020 (принято в печать).
Павлов Д.С., Назаров Д.Ю., Звездин А.О., Кучерявый А.В. и др. Покатная миграция раних личинок европейской речной миноги Lampetra fluviatilis // Докл. акад. наук. 2014. № 459(2). С. 248–251.
Andoniadou C.L., Signore M., Sajedi E. et al. Lack of the murine homeobox gene Hesx1 leads to a posterior transformation of the anterior forebrain // Development. 2007. V. 134(8). P. 1499–1508.
Bachy I., Berthon J., Retaux S., Defining pallial and subpallial divisions in the developing Xenopus forebrain // Mechanisms of Development. 2002. V. 117. P. 163–172.
Bayramov A.V., Ermakova G.V., Eroshkin F.M. et al. The presence of the Anf/Hesx1 homeobox in lampreys indicates that it may play important role in telencephalon emergence // Sci. Rep. 2016. V. 6. P. 39849.
Bayramov A.V., Martynova N.Yu., Eroshkin F.M. et al. The homeodomain-containing transcription factor X-nkx-5.1 inhibits expression of the homeobox gene Xanf-1 during the Xenopus laevis forebrain development // Mechanism of Development. 2004. V. 121. P. 1425–1441.
Bayramov A.V., Eroshkin F.M., Martynova N.Y. et al. Novel functions of Noggin proteins: inhibition of Activin/ Nodal and Wnt signaling // Development. 2011. V. 138. P. 5345–5356.
Benito Gutierrez E., Stemmer M., Rohr S.D. et al. Patterning of a elencephalon-like region in the adult brain of amphioxus // bioRxiv. 2018. V. 307629.
Bertrand S., Camasses A., Somorjai I. et al. Amphioxus FGF signaling predicts the acquisition of vertebrate morphological traits // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 9160–9165.
Bielen H., Pal S., Tole S. et al. Temporal variations in early developmental decisions: an engine of forebrain evolution // Curr. Opin. Neurobiol. 2017. V. 42. P. 152–159.
Botchkarev V.A., Botchkareva N.V., Roth W. et al. Noggin is a mesenchymally derived stimulator of hair-follicle induction // Nat. Cell. Biol. 1999. V. 1. P. 158–164.
Brunet L.J., McMahon J.A., McMahon et al. Noggin, cartilage morphogenesis, and joint formation in the mammalian skeleton // Science. 1998. V. 280. P. 1455–1457.
Castro L.F.C., Rasmussen S.L.K., Holland P.W.H. et al. A Gbx homeobox gene in amphioxus: insights into ancestry of the ANTP class and evolution of the midbrain/hindbrain boundary // Dev. Biol. 2006. V. 295. P. 40–51.
Dale L., Slack J.M.W. Regional specification within the mesoderm of early embryos of Xenopus laevis // Deve-lopment. 1987. V. 100. P. 279–295.
Danesin C., Houart C. A Fox stops the Wnt: implications for forebrain development and diseases // Curr. Opin. Genet. Dev. 2012. V. 22. № 4. P. 323–330.
Danesin C., Houart C. A Fox stops the Wnt: implications for forebrain development and diseases // Curr. Opin. Genet. Dev. 2012. V. 22. P. 1–8.
Danesin C., Peres J.N., Johansson M. et al. Integration of telencephalic Wnt and hedgehog signaling center activities by Foxg1 // Dev. Cell. 2009. V. 16. № 4. P. 576–587.
Dattani M.T., Martinez-Barbera J.P., Thomas P.Q. et al. Mutations in the homeobox gene HESX1/Hesx1 associated with septo-optic dysplasia in human and mouse // Nat. Genet. 1998. V. 19(2). P. 125–133. https://doi.org/10.1038/477
Delsuc F., Brinkmann H., Chourrout D. et al. Tunicates and not cephalochordates are the closest living relatives of vertebrates // Nature. 2006. V. 439. P. 965–968.
Domazet-Loso T., Brajkovic J., Tautz D. A phylostratigraphy approach to uncover the genomic history of major adaptations in metazoan lineages // Trends Genet. 2007. V. 23. P. 533–539.
Ermakova G.V., Alexandrova E.M., Kazanskaya O.V. et al. The homeobox gene, Xanf-1, can control both neural differentiation and patterning in the presumptive anterior neurectoderm of the Xenopus laevis embryo // Development. 1999. V. 126. P. 4513–4523.
Ermakova G.V., Solovieva E.A., Martynova N.Y. et al. The homeodomain factor Xanf represses expression of genes in the presumptive rostral forebrain that specify more caudal brain regions // Developmental Biology. 2007. V. 307. P. 483–497.
Ermakova G.V., Kucheryavyy A.V., Zaraisky A.G., Bayra-mov A.V. The expression of FoxG1 in the early development of the European river lamprey Lampetra fluviatilis demonstrates significant heterochrony with that in other vertebrates // Gene Expr Patterns. 2019. V. 34. P. 119073. https://doi.org/10.1016/j.gep.2019.119073
Eroshkin F.M., Ermakova G.V., Bayramov A.V. et al. Multiple noggins in vertebrate genome: cloning and expression of noggin2 and noggin4 in Xenopus laevis // Gene Expr Patterns. 2006. V. 6. P. 180–186.
Eroshkin F., Kazanskaya O., Martynova N. et al. Characterization of cis-regulatory elements of the homeobox gene Xanf-1 // Gene. 2002. V. 285. P. 279–286.
Feinberg T.E., Mallatt J. The evolutionary and genetic origins of consciousness in the Cambrian Period over 500 million years ago // Front. Psychol. 2013. V. 4. P. 667. https://doi.org/10.3389/fpsyg.2013.00667
Fletcher R.B., Watson A.L., Harland R.M. Expression of Xenopus tropicalis noggin1 and noggin2 in early development: two noggin genes in a tetrapod // Gene Expr Patterns. 2004. V. 5. P. 225–230.
Gess R.W., Coates M.I., Rubidge B.S. A lamprey from the Devonian period of South Africa // Nature. 2006. V. 443(7114). P. 981–984.
Green S.A., Bronner M.E. The Lamprey: A jawless vertebrate model system for examining origin of the neural crest and other vertebrate traits // Differentiation. 2014. V. 87. P. 44–51.
Grunz H., Tacke L. Neural differentiation of Xenopus laevis ectoderm takes place after disaggregation and delayed reaggregation without inducer // Cell Differ. Dev. 1989. V. 28(3). P. 211–217.
Hebert J.M., Fishell G. The genetics of early telencephalon patterning: some assembly required // Nat. Rev. Neurosci. 2008. V. 9. P. 678–685.
Heisenberg C.P., Houart C., Take-Uchi M. et al. A mutation in the Gsk3-binding domain of zebrafish Masterblind/Axin1 leads to a fate transformation of telencephalon and eyes to diencephalons // Genes Dev. 2001. V. 15(11). P. 1427–1434.
Holland N.D., Panganiban G., Henyey E.L. et al. Sequence and developmental expression of AmphiDll, an amphioxus Distal-less gene transcribed in the ectoderm, epidermis and nervous system: insights into evolution of craniate forebrain and neural crest // Development. 1996. V. 122. P. 2911–2920.
Holland P.W.H., Garcia-Fernandez J., Williams N.A. et al. Gene duplications and the origins of vertebrate development // Development. 1994 (suppl.). P. 125–133.
Janvier P. Modern look for ancient lamprey // Nature. 2006. V. 433. P. 921–924.
Kiecker C., Lumsden A. The role of organizers in patterning the nervous system // Annu. Rev. Neurosci. 2012. V. 35. P. 347–367.
Kiecker C., Niehrs C. A morphogen gradient of Wnt/beta-catenin signalling regulates anteroposterior neural patterning in Xenopus // Development. 2001. V. 128(21). P. 4189–4201.
Klimova L., Kozmik Z. Stage-dependent requirement of neuroretinal Pax6 for lens and retina development // Development. 2014. V. 141. P. 1292–1302.
Kortüm F., Das S., Flindt M. et al. The core FOXG1 syndrome phenotype consists of postnatal microcephaly, severe mental retardation, absent language, dyskinesia, and corpus callosum hypogenesis // J. Med. Genet. 2011. V. 8. № 6. P. 396–406.
Kremnyov S., Henningfeld K., Viebahn C. et al. Divergent axial morphogenesis and early shh expression in vertebrate prospective floor plate // EvoDevo. 2018. V. 9. P. 4.
Kumamoto T., Hanashima C. Evolutionary conservation and conversion of Foxg1 function in brain development // Dev. Growth Differ. 2017. V. 59. № 4. P. 258–269.
Kuraku S., Kuratani S. Time scale for cyclostome evolution inferred with a phylogenetic diagnosis of hagfish and lamprey cDNA sequences // Zoolog Sci. 2006. V. 23(12). P. 1053–1064.
Kuratani S., Nobusada Y., Horigome N. et al. Embryology of the lamprey and evolution of the vertebrate jaws: insights from molecular and developmental perspectives // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2001. V. 356(1414). P. 1615–1632.
Lagutin O.V., Zhu C.C., Kobayashi D. et al. Six3 repression of Wnt signaling in the anterior neuroectoderm is essential for vertebrate forebrain development // Genes Dev. 2003. V. 17(3). P. 368–379.
Lamb T.M., Knecht A.K., Smith W.C. et al. Neural induction by secreted polypeptide noggin // Science. 1993. V. 262. P. 713–718.
Linker C., Stern C.D. Neural induction requires BMP inhibition only as a late step, and involves signals other than FGF and Wnt antagonists // Development. 2004. V. 131(22). P. 5671–5681.
Maden M. Heads or tails? Retinoic acid will decide // Bioessays. 1999. V. 21(10). P. 809–812.
Martin-Duran J.M., Pang K., Borve A. et al. Convergent evolution of bilaterian nerve cords // Nature. 2018. V. 553. P. 45–50.
Martynoga B., Morrison H., Price D.J. et al. Foxg1 is required for specification of ventral telencephalon and region-specific regulation of dorsal telencephalic precursor proliferation and apoptosis // Dev. Biol. 2005. V. 283(1). P. 113–127.
Martynova N.Yu., Eroshkin F.M., Ermakova G.V. et al. Patterning the forebrain: FoxA4a/Pintallavis and Xvent-2 determine the posterior limit of the Xanf-1 expression in the neural plate // Development. 2004. V. 131. P. 2329–2338.
Mason I. Initiation to end point: the multiple roles of fibroblast growth factors in neural development // Nat. Rev. Neurosci. 2007. V. 8(8). P. 583–596.
McCauley D.W., Docker M.F., Whyard S. et al. Lampreys as Diverse Model Organisms in the Genomics Era // Bioscience. 2015. V. 65(11). P. 1046–1056.
McMahon J.A., Takada S., Zimmerman L.B. et al. Noggin-mediated antagonism of BMP signaling is required for growth and patterning of the neural tube and somite // Genes. Dev. 1998. V. 12. P. 1438–1452.
Medina L. Evolution and Embryological Development of Forebrain // Encyclopedia of Neuroscience / Eds. Binder M.D., Hirokawa N., Windhorst U. Berlin, Heidelberg: Springer, 2009.
Medina L., Abellan A. Development and evolution of the pallium // Semin. Cell Dev. Biol. 2009. V. 20(6). P. 698–711.
Mehta T.K., Ravi V., Yamasaki S. et al. Evidence for at least six Hox clusters in the Japanese lamprey (Lethenteron japonicum) // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 16044–16049.
Meléndez-Ferro M., Villar-Cheda B., Abalo X.M. et al. Early development of the retina and pineal complex in the sea lamprey: comparative immunocytochemical study // J. Comp. Neurol. 2002. V. 442. № 3. P. 250–265.
Moreau M., Leclerc C. The choice between epidermal and neural fate: a matter of calcium // Int. J. Dev. Biol. 2004. V. 48(2–3). P. 75–84.
Murakami Y., Uchida K., Rijli F.M. et al. Evolution of the brain developmental plan: Insights from agnathans // Dev. Biol. 2005. V. 280(2). P. 249–259.
Murakami Y., Ogasawara M., Sugahara F. et al. Identification and expression of the lamprey Pax6 gene: evolutionary origin of the segmented brain of vertebrates // Development. 2001. V. 128(18). P. 3521–3531.
Myojin M., Ueki T., Sugahara F. et al. Isolation of Dlx and Emx gene cognates in an agnathan species, Lampetra japonica, and their expression patterns during embryonic and larval development: conserved and diversified regulatory patterns of homeobox genes in vertebrate head evolution // J. Exp. Zool. 2001. V. 291(1). P. 68–84.
Neidert A.H., Virupannavar V., Hooker G.W. et al. Lamprey Dlx genes and early vertebrate evolution // Proc. Natl. Acad. Sci. USA. 2001. V. 98(4). P. 1665–1670.
Nomura T., Murakami Y., Gotoh H. et al. Reconstruction of ancestral brains: exploring the evolutionary process of encephalization in amniotes // Neurosci. Res. 2014. V. 86. P. 25–36.
Nord A.S., Pattabiraman K., Visel A. et al. Genomic perspectives of transcriptional regulation in forebrain development // Neuron. 2015. V. 85(1). P. 27–47.
Ohno S. Evolution by Gene Duplication. Berlin, Germany: Springer, 1970.
Oisi Y., Ota K.G., Kuraku S. et al. Craniofacial development of hagfishes and the evolution of vertebrates // Nature. 2013. V. 493(7431). P. 175–180.
Osório J., Rétaux S. The lamprey in evolutionary studies // Dev. Genes Evol. 2008. V. 218(5). P. 221–235.
Osumi N., Shinohara H., Numayama-Tsuruta K. et al. Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator // Stem Cells. 2008. V. 26. P. 1663–1672.
Ota, K.G., Kuraku, S., Kuratani S., Hagfish embryology with reference to the evolution of the neural crest // Nature. 2007. V. 446. P. 672–675.
Pani A.M., Mullarkey E.E., Aronowicz J. et al. Ancient deuterostome origins of vertebrate brain signalling centres // Nature. 2012. V. 483. P. 289–294.
Piccolo S., Agius E., Leyns L. et al. The head inducer Cerberus is a multifunctional antagonist of nodal, BMP and Wnt signals // Nature. 1999. V. 397(6721). P. 707–710.
Puelles L., Rubenstein J.L.R. A new scenario of hypothalamic organization: rationale of new hypotheses introduced in the updated prosomeric model // Front. Neuroanat. 2015. V. 9. P. 27.
Puelles L., Ferran J.L. Concept of neural genoarchitecture and its genomic fundament // Front. Neuroanat. 2012. V. 6. P. 47.
Putnam N.H., Butts T. Ferrier D.E.K. et al. The amphioxus genome and the evolution of the chordate karyotype // Nature. 2008. V. 453. P. 1064–1071.
Putnam N.H., Butts T., Ferrier D.E. et al. The amphioxus genome and the evolution of the chordate karyotype // Nature. 2008. V. 453. P. 1064–1071.
Reese D.E., Hall C.E., Mikawa T. Negative regulation of midline vascular development by the notochord // Dev. Cell. 2004. V. 6. P. 699–708.
Renaud C.B. Lampreys of the world. An annotated and illustrated catalogue of lamprey species known to date // FAO Species Catalogue for Fishery Purposes. 2011. V. 5. P. 109.
Retaux S., Kano S. Midline signaling and evolution of the forebrain in chordates: A focus on the lamprey hedgehog case // Integrative and Comparative Biology. 2010. V. 50. P. 98–109.
Rodriguez-Seguel E., Alarcon P., Gomez-Skarmeta J.L. The Xenopus Irx genes are essential for neural patterning and define the border between prethalamus and thalamus through mutual antagonism with the anterior repressors Fezf and Arx // Dev. Biol. 2009. V. 329. P. 258–268.
Scholpp S., Foucher I., Staudt N. et al. Otx1 l, Otx2 and Irx1b establish and position the ZLI in the diencephalons // Development. 2007. V. 134. P. 3167–3176.
Schubert M., Holland N.D., Laudet V. et al. A retinoic acid-Hox hierarchy controls both anterior/posterior patterning and neuronal specification in the developing central nervous system of the cephalochordate amphioxus // Dev. Biol. 2006. V. 296. P. 190–202.
Sestak M.S., Domazet-Loso T. Phylostratigraphic profiles in zebrafish uncover chordate origins of the vertebrate brain // Mol. Biol. Evol. V. 201532. P. 299–312.
Slack J.M., Tannahill D. Noggin the dorsalizer // Nature. 1993. V. 361. P. 498–499.
Smith W.C., Knecht A.K., Wu M. et al. Secreted noggin protein mimics the Spemann organizer in dorsalizing Xenopus mesoderm // Nature. 1993. V. 361. P. 547–549.
Smith W.C., Harland R.M. Expression cloning of noggin, a new dorsalizing factor localized to the Spemann orginizer in Xenopus embryos // Cell. 1992. V. 70. P. 829–840.
Streit A., Berliner A.J., Papanayotou C. et al. Initiation of neural induction by FGF signalling before gastrulation // Nature. 2000. V. 406(6791). P. 74–78.
Suda Y., Kurokawa D., Takeuchi M. et al. Evolution of Otx paralogue usages in early patterning of the vertebrate head // Dev. Biol. 2009. V. 325(1). P. 282–295.
Sugahara F., Pascual-Anaya J., Oisi Y. et al. Evidence from cyclostomes for complex regionalization of the ancestral vertebrate brain // Nature. 2016. V. 531. P. 97–100.
Sugahara F., Murakami Y., Pascual-Anaya J. et al. Reconstructing the ancestral vertebrate brain // Dev. Growth Differ. 2017. V. 59(4). P. 163–174.
Sussel L., Marin O., Kimura S. et al. Loss of Nkx2.1 homeobox gene function results in a ventral to dorsal molecular respecification within the basal telencephalon: evidence for a transformation of the pallidum into the striatum // Development. 1999. V. 126. P. 3359–3370.
Suzuki D.G., Murakami Y., Escriva H. et al. A comparative examination of neural circuit and brain patterning between the lamprey and amphioxus reveals the evolutionary origin of the vertebrate visual center // J. Comp. Neurol. 2015. V. 523. № 2. P. 251–261.
Tahara Y. Normal stages of development in the lamprey, Lampetra reissneri (Dybowski) // Zoological Science. 1988. V. 5. P. 109–118.
Takahashi H., Liu F.C. Genetic patterning of the mammalian telencephalon by morphogenetic molecules and transcription factors // Birth. Defects. Res. C. Embryo. Today. 2006. V. 78(3). P. 256–266.
Tank E.M., Dekker R.G., Beauchamp K. et al. Patterns and consequences of vertebrate Emx gene duplications // Evol. Dev. 2009. V. 11(4). P. 343–353.
Taverna E., Gotz M., Huttner W.B. The cell biology of neurogenesis: toward an understanding of the development and evolution of the neocortex // Annu. Rev. Cell. Dev. Biol. 2014. V. 30. P. 465–502.
Thomas P., Beddington R. Anterior primitive endoderm may be responsible for patterning the anterior neural plate in the mouse embryo // Curr. Biol. 1996. V. 6(11). P. 1487–1496.
Tomsa J.M., Langeland J.A. Otx expression during lamprey embryogenesis provides insights into the evolution of the vertebrate head and jaw // Dev. Biol. 1999. V. 1; 207(1). P. 26–37.
Toresson H., Maritnez-Barbera J.P., Beardsley A. et al. Conservation of BF-1 expression in amphioxus and zebrafish suggests evolutionary ancestry of anterior cell types that contribute to the vertebrate telencephalon // Dev. Genes Evol. 1998. V. 208. P. 431–439.
Vieira C., Pombero A., Garcia-Lopez R. et al. Molecular mechanisms controlling brain development: An overview of neuroepithelial secondary organizers // Int. J. Dev. Biol. 2010. V. 54. P. 7–20.
Wada H., Saiga H. Satoh N. et al. Tripartite organization of the ancestral chordate brain and the antiquity of the placodes: Insights from ascidian Pax-2/5/8, Hox, and Otx genes // Development. 1998. V. 125. P. 1113–1122.
Warren S.M., Brunet L.J., Harland R.M. et al. The BMP antagonist noggin regulates cranial suture fusion // Nature. 2003. V. 422. P. 625–629.
Watanabe K., Kamiya D., Nishiyama A. et al. Direct differentiation of telencephalic precursors from embryonic stem cells // Nature Neuroscience. 2005. V. 8. P. 288–296.
Wilson P.A., Hemmati-Brivanlou A. Induction of epidermis and inhibition of neural fate by Bmp-4 // Nature. 1995. V. 376(6538). P. 331–333.
Wilson S.I., Rydstrom A., Trimborn T. et al. The status of Wnt signalling regulates neural and epidermal fates in the chick embryo // Nature. 2001. V. 411(6835). P. 325–330.
Wilson S.W., Houart C. Early steps in the development of the forebrain // Dev. Cell. 2004. V. 6(2). P. 167–181.
Wullimann M.F., Mueller T., Distel M. et al. The long adventurous journey of rhombic lip cells in jawed vertebrates: a comparative developmental analysis // Front. Neuroanat. 2011. V. 5. P. 27.
Xanthos J.B., Kofron M., Tao Q. et al. The roles of three signaling pathways in the formation and function of the Spemann Organizer // Development. 2002. V. 129(17). P. 4027–4043.
Yang X.U., Si-Wei Z.H.U., Qing-Wei L.I. Lamprey: a model for vertebrate evolutionary research // Dongwuxue Yanjiu. 2016. V. 37(5). P. 263–269.
Zaraisky A.G., Lukyanov S.A., Vasiliev O.L. et al. A novel homeobox gene expressed in the anterior neural plate of the Xenopus embryo // Dev. Biol. 1992. V. 152. P. 373–382.
Zhang H., Ravi V., Tay B.H. et al. Lampreys, the jawless vertebrates, contain only two ParaHox gene clusters // Proc. Natl. Acad. Sci. USA. 2017. V. 114(34). P. 9146–9151.
Дополнительные материалы отсутствуют.


