Онтогенез, 2020, T. 51, № 5, стр. 369-378
Интрацитоплазматическая трансдукция кальция в сперматозоидах Bos taurus при капацитации и акросомной реакции
В. Ю. Денисенко a, Т. И. Кузьмина a, *
a Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных –филиал ФГБНУ “Федеральный научный центр животноводства – ВИЖ имени академика Л.К. Эрнста” (ВНИИГРЖ)
196601 Санкт-Петербург, Пушкин, Московское шоссе, 55а, Россия
* E-mail: prof.kouzmina@mail.ru
Поступила в редакцию 08.02.2020
После доработки 25.03.2020
Принята к публикации 27.03.2020
Аннотация
Проведен мониторинг показателей интенсивности флуоресценции комплекса мембрана-кальций-хлортетрациклин в сперматозоидах быков в процессах капацитации и акросомной реакции с использованием ингибиторного анализа. Выявлено, что добавление отдельно пролактина, дбцАМФ, ГТФ или ГДФ стимулировало в сперматозоидах освобождение Ca2+ из внутриклеточных депо (ВКД). При совместном действии пролактина и ГТФ, а также дбцАМФ и ГДФ отмечалось дополнительное освобождение Ca2+ из ВКД. Предварительная инкубация в присутствии негидролизуемых ГДФβS или ГТФγS ингибировала освобождение Ca2+ из внутриклеточных депо, стимулированное ГТФ или ГДФ, но не оказывала влияние на активированное пролактином или дбцАМФ освобождение Ca2+ из ВКД. В то же время при совместном действии пролактина и ГТФ, а также дбцАМФ и ГДФ по-прежнему присутствует дополнительный выход Ca2+ из внутриклеточных депо сперматозоидов, предварительно проинкубированных в присутствии ГДФβS или ГТФγS. Анализ локализации флуоресценции хлортетрациклина в сперматозоидах выявил, что после инкубации сперматозоидов в присутствии дбцАМФ, ГДФ или их совместном воздействии наибольшее количество капацитированных клеток регистрировали при совместном действии этих двух соединений. Инкубация клеток при добавлении пролактина, ГТФ или их совместном действии приводила к увеличению количества акросомных клеток, причем наибольшее количество фиксировали при совместном действии пролактина и ГТФ. Таким образом, допустимо предположить, что мобилизация кальция из внутриклеточных депо детерминирует рост количества капацитированных сперматозоидов быков, эффект наиболее выражен при совместном действии дбцАМФ и ГДФ, и увеличение количества акросомных клеток, максимальное количество которых выявляли при совместном действии пролактина и ГТФ.
ВВЕДЕНИЕ
Для контакта сперматозоида с яйцеклеткой и акросомального экзоцитоза, мужские гаметы млекопитающих должны пройти ряд биохимических превращений в женском репродуктивном тракте, т.е. подвергнуться капацитации. Капацитация характеризуется различными мембранными модификациями, приводящими к снижению содержания холестерола (Brouwers et al., 2011). При удалении холестерола снижается текучесть плазматической мембраны сперматозоидов, что приводит к увеличению ее проницаемости для различных ионов (Gadella, Boerke, 2016). В результате изменения проницаемости мембраны изменяются потоки Ca2+ и ${\text{HCO}}_{3}^{ - }$, что ведет к активации аденилилциклазы и изменению уровня сAMP (Harayama, 2013). Также во время капацитации происходят многочисленные биохимические изменения, в т.ч. увеличение концентраций интрацитоплазматического кальция, цАМФ, внутриклеточного рН и фосфорилирования белков по тирозину (Harrison, Gadella, 2005; Pons-Rejraji et al., 2009).
Регулирование внутриклеточной концентрации Ca2+ является одним из важнейших событий, происходящих во время капацитации (Darszon et al., 2005). В опубликованных работах было показано, что капацитация является Ca2+-зависимым процессом (Rodriguez et al., 2012), и кальций действует на различные сигнальные пути в сперме (Lawson et al., 2008). Увеличение рН, концентрации цАМФ и фосфорилирование тирозина не происходит, когда сперматозоиды инкубируют в бескальциевой среде (Battistone et al., 2013). Более того, аденилил циклаза спермы, которая значительно активируется ${\text{HCO}}_{3}^{ - }$, также активируется Ca2+ (Buffone et al., 2014). Механизмы, участвующие в регуляции Ca2+ во время капацитации, изучены недостаточно полно.
Имеются доказательства того, что акросомная реакция сперматозоидов, выражающаяся в виде экзоцитоза при приближении сперматозоида к ооциту, является Ca2+-зависимым процессом (Almadaly et al., 2015). Внеклеточный кальций необходим для акросомной реакции и использование некоторых блокаторов ионных каналов ингибирует этот процесс, указывая на важную роль этих ионов (Pons-Rejraji et al., 2009). В сперматозоидах некоторых видов грызунов, которые инкубировали в бескальциевой среде, акросомная реакция не проходила до тех пор, пока в среду не добавляли кальций (Jimenez-Gonzalez et al., 2006). Хотя точные механизмы, приводящие к увеличению Ca2+ в сперматозоидах во время акросомной реакции не известны, имеются данные, что необходимый для экзоцитоза акросомальных везикул Ca2+ входит в клетки через потенциалзависимые каналы T-типа (Florman et al., 2008). Кроме того, показано, что внутриклеточные депо Ca2+ также участвуют в инициации акросомной реакции. В отсутствие внеклеточного Ca2+ в капацитированных мышиных сперматозоидах акросомная реакция активировалась при действии тапсигаргина, который стимулировал освобождение Ca2+ из внутриклеточных депо (Herrick et al., 2005).
Использование флуоресцентных красителей, таких как Quin-2 и Fura-2 (Tsien et al., 1982; Halet, 2016), позволяет измерять концентрацию цитоплазматического Ca2+, однако эти зонды не дают ответ на вопрос об источнике увеличения Ca2+ – поступил ли он цитоплазму клетки из внеклеточной среды или из внутриклеточных депо. Концентрация цитоплазматического Ca2+ в сперматозоидах быков составляет от 50 до 200 нМ (Vijayaraghavan, Hoskins, 1989), тогда как константа диссоциации комплекса ХТЦ-Ca2+ составляет около 400 мкМ, что делает ХТЦ нечувствительным к низким концентрациям Ca2+ и не способным к измерениям Ca2+ в цитоплазме клеток (Caswell, Hutchinson, 1971). В то же время способность ХТЦ проникать через мебраны и накапливаться в местах скопления Ca2+ в высокой концентрации (внутриклеточные депо Ca2+) делает его использование удобным для изучения уровней Ca2+ в местах его высокой концентрации (Cerella et al., 2007).
Зависимость процессов капацитации и акросомной реакции от Ca2+ широко представлена в литературе, однако точные механизмы, с помощью которых Ca2+ мобилизуется в сперме млекопитающих, еще предстоит полностью установить.
Цель настоящего исследования – идентификация путей трансдукции кальция, мобилизованного из интрацитоплазматических депо сперматозоидов быков, в процессах капацитации и акросомной реакции.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использовали сперматозоиды от разных быков, полученные непосредственно перед работой. В каждом опыте использовался эякулят спермы от трех быков голштинской породы. Освобождение спермы от семенной плазмы проводили центрифугированием при 300 g в течение 10 мин в среде TALP, содержащей 100 мМ NaCl, 3.1 мМ KCl, 25 мМ NaHCO3, 0.3 мМ NaH2PO4, 21.6 мМ лактата натрия, 0.5 мМ CaCl2, 0.4 мМ MgCl2, 10 мМ HEPES, 1 мМ пирувата (Sigma, США). Для отмывания спермы к среде TALP добавляли поливинилалкоголь (молекулярной массой 30 000–70 000 Да) (Sigma, США) в концентрации 0.1%. Процедуру отмывания повторяли дважды.
Измерение Ca2+ во внутриклеточных депо проводили с помощью флуоресцентного зонда хлортетрациклин (ХТЦ) (Sigma, США), обеспечивающего при проведении представленных экспериментов вход ГТФ и ГДФ в сперматозоиды. В случае использования другого зонда для измерения кальция требовалась бы процедура пермеабилизации для обеспечения входа в клетки ГТФ и ГДФ, в то время как ХТЦ способствовал входу в клетки ГТФ и ГДФ без дополнительных процедур (Денисенко, Кузьмина, 2005). Сперматозоиды инкубировали в присутствии ХТЦ в концентрации 100 мкМ в течение 30 мин при температуре 38.5°С, 95% влажности и 5% СО2. После окрашивания клетки отмывали с помощью центрифугирования в среде TALP при 300 g в течение 10 мин. Процедуру повторяли три раза. Измерение интенсивности флуоресценции ХТЦ проводили на спектрофлуориметре (Hitachi, Япония) в среде TALP без добавления CaCl2. Величина длин волн возбуждения и излучения для ХТЦ равнялась 380 и 530 нм, соответственно. Содержание в сперматозоидах кальция внутриклеточных депо измеряли в условных единицах (усл. ед.) интенсивности флуоресценции комплекса Ca2+-ХТЦ. Концентрация сперматозоидов при измерении составляла 1.5 × 106 клеток/мл.
С целью активации процессов капацитации сперматозоиды быков инкубировали 4 ч при 38.5°С, 95% влажности и 5% СО2. Для капацитации использовали среду Sp-TALP, в которую добавляли 6 мг/мл BSA и 0.5 мМ CaCl2. Активацию акросомной реакции проводили с помощью лизофосфатидилхолина (Sigma, США) в концентрации 100 мкМ, который добавляли к предварительно капацитированным сперматозоидам (Parrish, 2014). Продолжительность акросомной реакции составляла 30 мин в условиях, аналогичных используемым для капацитации.
После прохождения капацитации или акросомной реакции из каждого экспериментального образца брали по 20 мкл суспензии сперматозоидов и 20 мкл раствора ХТЦ, смешивали и инкубировали при 38.5°С в течение 10 мин. Раствор ХТЦ (750 мкМ) готовили в буфере, который содержит 130 мМ NaCl, 5 мМ L-цистеина (Sigma, США) и 20 мМ Трис (рН 7.8) (Sigma, США). Раствор готовили ежедневно и хранили в темноте при 4°С. Затем в эту смесь для фиксации добавляли 10 мкл 25% глутаральдегида (Sigma, США) в 1 мМ Трисе (рН 7.4) до конечной концентрации 0.1%. В данной концентрации глутаральдегид обеспечивает стабильную флуоресценцию в течение 2 ч и не оказывает побочных эффектов на клетки (Ward, Storey, 1984). После этого при комнатной температуре каплю суспензии сперматозоидов (10 мкл) размещают на предметном стекле и смешивают с 10 мкл 0.22 М 1,4-диазобицикло [2.2.2]-октана (Sigma, США), растворенного в глицерол/PBS (9 : 1, v/v), для снижения выцветания флуоресценции. Образцы накрывают покровным стеклом и хранят в темноте при 4°С.
Оценку сперматозоидов проводили с использованием микроскопа ZEISS AxioLab. A1. (Zeiss, Германия) с фазовым контрастом и эпифлуоресцентной оптикой (возбуждение при 400–440 нм и излучение при 470 нм). Каждую из 200 клеток оценивали в соответствии с одним из трех типов флуоресценции ХТЦ (Fraser et al., 1995): равномерная флуоресценция во всей головке (некапацитированные клетки, образец F), свободная от флуоресценции полоса в постакросомальном районе (капацитированные клетки, образец В), и низкая флуоресценция во всей головке, за исключением тонкой яркой полосы флуоресценции в экваториальном сегменте (акросома-реактивные клетки, образец AR).
В работе использовали следующие реактивы: инкубационную среду TALP, ГДФβS, ГТФγS, ГТФ, ГДФ, дбцАМФ, пролактин, хлортетрациклин, ЭГТА (Sigma, США).
Достоверность различия сравниваемых средних значений для 4–5 независимых экспериментов оценивали с помощью t-критерия Стьюдента. Обработку данных проводили с помощью пакета статистической программы SigmaStat.
РЕЗУЛЬТАТЫ
Результаты экспериментов, отражающие воздействие ГДФβS и ГТФγS на стимулированное дбцАМФ и ГДФ освобождение Са2+ из внутриклеточных депо сперматозоидов быков представлены на рис. 1. В экспериментах использовали ГДФβS и ГТФγS в концентрациях 100 мкМ. Добавление дбцАМФ в концентрации 100 мкМ или ГДФ в концентрации 50 мкМ оказывало активирующий эффект на выход Са2+ из внутриклеточных депо сперматозоидов. Совместное действие дбцАМФ и ГДФ приводило к дополнительному освобождению Са2+ из депо. Предварительная инкубация сперматозоидов в присутствии ГДФβS ингибировала освобождение Са2+ из депо, стимулированное добавлением ГДФ. Однако, на освобождение Са2+ из внутриклеточных депо, активированное действием дбцАМФ, или дополнительный выход Са2+ из депо, стимулированный совместным действием дбцАМФ и ГДФ, обработка клеток ГДФβS влияния не оказывала. Внесение в среду инкубации сперматозоидов ГТФγS приводило к ингибированию освобождения Са2+ из депо, вызванного добавлением ГДФ. В то же время освобождение Са2+ из внутриклеточных депо, стимулированное добавлением одного дбцАМФ, или совместным действием дбцАМФ и ГДФ, по-прежнему отмечалось даже в присутствии ГТФγS.
Рис. 1.
Влияние ГДФβS и ГТФγS на стимулированное дбцАМФ и ГДФ освобождение Са2+ из внутриклеточных депо сперматозоидов быков. Концентрации ГДФβS и ГТФγS – 100 мкМ, дбцАМФ – 100 мкМ, ГДФ – 50 мкМ. По вертикали: интенсивность флуоресценции ХТЦ, %. Различия достоверны: P < 0.001 (1 и 2; 2 и 8; 3 и 4; 3 и 5; 3 и 6; 3 и 7; 3 и 8; 5 и 6; 7 и 8), P < 0.01 (1 и 3; 2 и 4; 2 и 6).

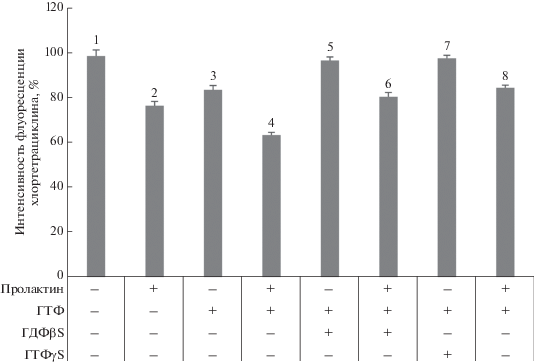
На рис. 2 представлены данные о влиянии ГДФβS и ГТФγS на стимулированное пролактином и ГТФ освобождение Ca2+ из внутриклеточных депо сперматозоидов быков. Выявлено, что добавление пролактина в концентрации 10 нг/мл или ГТФ в концентрации 10 мкМ активировало в клетках освобождение Ca2+ из внутриклеточных депо. При совместном действии пролактина и ГТФ в сперматозоидах отмечали дополнительный выход Ca2+ из депо. Инкубация сперматозоидов в присутствии ГДФβS в концентрации 100 мкМ оказывала ингибирующее влияние на освобождение Ca2+ из внутриклеточных депо при последующем добавлении ГТФ. В то же время на действие одного пролактина или на совместное действие пролактина и ГТФ предварительная обработка клеток ГДФβS не оказывала воздействия. В присутствии ГДФβS пролактин по-прежнему стимулировал выход Ca2+ из депо, а совместное действие пролактина и ГТФ активировало дополнительное освобождение Ca2+ из внутриклеточных депо. Предварительная инкубация сперматозоидов в присутствии ГТФγS приводила к ингибированию освобождения Ca2+ из внутриклеточных депо, вызванного добавлением ГТФ. Использование для активации клеток одного пролактина, или совместное действие пролактина и ГТФ, стимулировали освобождение Ca2+ из депо при действии одного реагента, или дополнительное освобождение Ca2+ из внутриклеточных депо при действии двух соединений даже в присутствии ГТФγS.
Рис. 2.
Влияние ГДФβS и ГТФγS на стимулированное пролактином и ГТФ освобождение Са2+ из внутриклеточных депо сперматозоидов быков. Концентрации ГДФβS и ГТФγS – 100 мкМ, пролактина – 10 нг/мл, ГТФ – 10 мкМ. По вертикали: интенсивность флуоресценции ХТЦ, %. Различия достоверны: P < 0.001 (1 и 3; 1 и 2; 2 и 4; 3 и 4; 3 и 5; 3 и 7).
При анализе сперматозоидов, ранжированных в соответствии c их функциональным статусом (контрольные, капацитированные и акросома-реактивные клетки, рис. 3) использовали среду TALP с добавлением кальция в концентрации 0.5 мМ. На рис. 4 представлены данные о влиянии дбцАМФ и ГДФ на капацитацию сперматозоидов быков. После 4 ч инкубации в контрольных клетках в сравнении с контролем (0 ч инкубации) обнаружено снижение количества контрольных клеток (образец F) и увеличение числа акросомных клеток (образец AR). Совместное (в течение 4 ч) действие дбцАМФ и ГДФ вызывает значительное увеличение процентного содержания капацитированных клеток (образец B), эффект отсутствовал при воздействии каждого из этих соединений в отдельности.
Рис. 3.
Репрезентативные изображения образцов окрашивания сперматозоидов быков ХТЦ после инкубации в течение 4 ч в среде Sp-TALP и 6 мг/мл BSA: (а) образец F – некапацитированные клетки, (б) – капацитированные клетки, (в) AR – акросома-реактивные клетки; Са2+ – внутриклеточные депо кальция. Концентрация ХТЦ – 750 мкМ, для оценки использовали не менее 200 клеток. Длина волн возбуждения 400 нм, эмиссии – 470 нм. Стрелками указана локализация флуоресценции зонда отражающая изменения концентрации Са2+. Объектив ×40. Размер масштабной линейки соответствует 7 мкм.
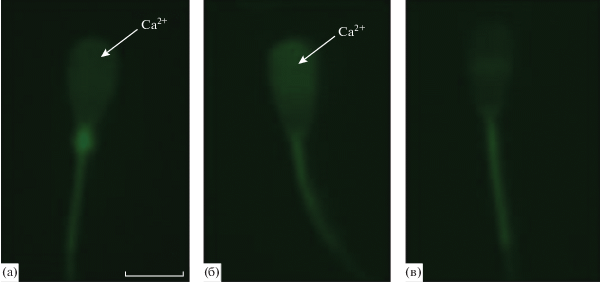
Рис. 4.
Влияние дбцАМФ и ГДФ на капацитацию сперматозоидов быков. Концентрации дбцАМФ и ГДФ составляли 100 и 50 мкМ. По вертикали: доля клеток с разным функциональным статусом, %. Различия достоверны при P < 0.001 (a и d; a и g; a и j; a и m; o и l; o и i; n и k; n и h; n и e).

На рис. 5 представлены данные, отражающие эффекты пролактина и ГТФ на акросомную реакцию сперматозоидов. Инкубация контрольных клеток (4 ч) приводит к снижению количества контрольных клеток (образец F) и росту числа акросомных клеток (образец AR) в сравнении с клетками на 0 ч инкубации. После 4 ч инкубации сперматозоидов в присутствии пролактина и ГТФ отмечали значительное увеличение количества акросомных клеток (образец AR) и снижение числа капацитированных клеток (образец B), в сравнении с действием отдельно каждого из этих соединений.
Рис. 5.
Влияние пролактина и ГТФ на акросомную реакцию сперматозоидов быков. Концентрации пролактина и ГТФ составляли 10 нг/мл и 10 мкМ. По вертикали: доля клеток с разным функциональным статусом, %. Различия достоверны при P < 0.001 (a и d; a и g; a и j; a и m; n и k; n и h), P < 0.01 (o и l; o и i).

ОБСУЖДЕНИЕ
В результате анализа данных, полученных в экспериментах, обнаружено, что добавление ГТФ или ГДФ к сперматозоидам быков стимулировало освобождение Са2+ из внутриклеточных депо. Ранее на клетках N1E-115 нейрональной клеточной линии было показано, что ГДФ стимулирует освобождение Са2+ из внутриклеточного депо с задержкой во времени, которая составляла примерно 90 с (Ueda et al., 1986). Фактически самостоятельно ГДФ не стимулирует освобождение Са2+ из внутриклеточных депо; ГДФβS, который не фосфорилируется до ГТФβS с помощью нуклеозиддифосфокиназы, не активирует освобождение Са2+ из внутриклеточных депо (Gill et al., 1988). Логично предположить, что эффект этого нуклеотида на освобождение Са2+ из внутриклеточных депо может быть обусловлен его превращением в ГТФ через катализируемую реакцию фосфорилирования, стимулируемую в присутствии АТФ. Этот процесс превращения ГДФ в ГТФ опосредуется ферментом нуклеозиддифосфокиназа (Ueda et al., 1986). ГДФβS и ГТФγS являются соединениями, которые не подвергаются реакции гидролизации. Отсутствие влияния ГТФγS на освобождение Са2+ из внутриклеточных депо и его ингибирующее действие на стимулированное ГТФ освобождение Са2+ из депо свидетельствуют о том, что для активации освобождения Са2+ необходим гидролиз ГТФ.
Таким образом, в сперматозоидах быков добавленные отдельно ГТФ и ГДФ стимулируют выход Са2+ из внутриклеточных депо, причем для реализации воздействия ГТФ необходим его гидролиз, в то время как эффект ГДФ предположительно связан с переходом его в ГТФ и последующим гидролизом.
Если добавленные отдельно ГТФ или ГДФ не стимулируют освобождение Са2+ из внутриклеточных депо в присутствии ГДФβS или ГТФγS, то при совместном действии пролактина и ГТФ, а также дбцАМФ и ГДФ в сперматозоидах быков по-прежнему отмечается дополнительное освобождение Са2+ из депо в присутствии ГДФβS и ГТФγS. Это позволяет предположить, что механизм действия на освобождение Са2+ из внутриклеточных депо при воздействии одного ГТФ или ГДФ, и при участии этих нуклеотидов в совместном действии в присутствии пролактина или дбцАМФ, различен.
В большинстве клеток млекопитающих показано наличие двух типов внутриклеточных депо кальция – инозитолтрифосфат- и рианодин-чувствительных внутриклеточных депо (Berridge, 2002). Согласно гипотезе, выдвинутой Mullaney et al. и Ghosh с соавторами, ГТФ способствует образованию связи между различными внутриклеточными депо кальция (IP3-чувствительными и IP3-нечувствительными) и обеспечивает переход Са2+ из IP3-нечувствительных в IP3-чувствительные внутриклеточные депо. Совместное действие IP3 и ГТФ способствует дополнительному освобождению Са2+ из внутриклеточных депо (Mullaney et al., 1987; Ghosh et al., 1989). В сперматозоидах млекопитающих присутствуют не менее двух различных органелл для хранения кальция, расположенных в акросомной части и области шейки (Costello et al., 2009). Для образования связи между различными внутриклеточными депо кальция необходимо, чтобы взаимодействующие соединения активировали освобождение Са2+ из различных внутриклеточных депо и одним из соединений должны быть ГТФ или ГДФ. Ранее на сперматозоидах быков нами было показано, что пролактин и ГДФ стимулируют выход Са2+ из IP3-чувствительных депо, а дбцАМФ (теофиллин) и ГТФ – из рианодин-чувствительных внутриклеточных депо кальция (Денисенко и др., 2015). Так как в сперматозоидах быков при совместном действии пролактина и ГТФ, а также дбцАМФ и ГДФ, присутствует дополнительное освобождение Са2+ из внутриклеточных депо, можно предположить, что в данном случае действие ГТФ и ГДФ направлено на образование связи и обеспечение перехода Са2+ между различными внутриклеточными депо.
Таким образом, из анализа результатов, полученных в наших экспериментах, следует, что, действуя отдельно, ГТФ или ГДФ стимулируют выход Са2+ из внутриклеточных депо, при совместном действии пролактина и ГТФ, а также дбцАМФ и ГДФ действие нуклеотидов, вероятно, направлено на образование связи и перемещение Са2+ между различными внутриклеточными депо.
После завершения капацитации сперматозоиды приобретают способность подвергаться акросомной реакции, при которой происходит экзоцитоз акросомных пузырьков. Связывание сперматозоида с одним из гликопротеинов зоны пеллюцида ооцита стимулировало вход Са2+ и акросомную реакцию в сперматозоидах млекопитающих (Abou-Haila et al., 2014). Cперматозоиды человека обладают внутриклеточными депо Са2+ и освобождение Са2+ из этих депо, стимулированное тапсигаргином, активирует вход Са2+ из внешней среды, который регулирует важные биологические процессы, являющиеся фундаментальными для акросомной реакции (Sosa et al., 2016; Engel et al., 2018). В сперматозоидах быков увеличение количества клеток на стадии акросомной реакции происходило при одновременном использовании для активации сперматозоидов пролактина и ГТФ. В этом случае действие ГТФ направлено на образование связи и обеспечение перехода Са2+ между различными (IP3- и рианодинчувствительными) внутриклеточными депо.
В процессах капацитации участвует как внутриклеточный, так и внеклеточный кальций. Инкубация сперматозоидов свиней в бескальциевой среде приводила к ингибированию капацитации, что свидетельствует о необходимости внеклеточного Са2+ для активации процессов капацитации (Martinez-Abad et al., 2017). Также было обнаружено увеличение концентрации внутриклеточного кальция во время прохождения этого процесса (Lopez-Torres et al., 2017). В сперматозоидах быков рост числа клеток на стадии капацитации наблюдали в случае совместного использования дбцАМФ и ГДФ. Вероятно, в данном случае действие ГДФ, также как и ГТФ, направлено на образование связи между различными внутриклеточными депо кальция.
На основании результатов экспериментов предлагается гипотеза, согласно которой капацитация и акросомная реакция в сперматозоидах быков происходит вследствие перемещения Са2+ между различными внутриклеточными депо при воздействии дбцАМФ, пролактина, ГТФ и ГДФ, причем стимулированное совместным действием дбцАМФ и ГДФ перемещение кальция приводит к увеличению количества капацитированных клеток, тогда как рост числа сперматозоидов на стадии акросомной реакции отмечали при воздействии на мужские гаметы пролактина и ГТФ.
Список литературы
Денисенко В.Ю., Кузьмина Т.И. Эффект гуаниновых нуклеотидов и протеинкиназы С на стимулированное пролактином освобождение Са2+ из внутриклеточных депо ооцитов свиней. Онтогенез. 2005. Т. 36. № 3. С. 1–6. (Denisenko V.Yu., Kuzmina T.I. Effects of guanine nucleotides and protein kinase C on prolactin-stimulated release of Са2+ from intracellular stores of pig oocytes // Rus. J. Devel. Biol. 2005. V. 36. № 3. P. 161–165.)
Денисенко В.Ю., Бойцева Е.Н., Кузьмина Т.И. Освобождение Са2+ из внутриклеточных депо сперматозоидов Bos Taurus в зависимости от их функционального состояния // Цитология. 2015. Т. 57. № 3. С. 233–239.
Abou-Haila A., Bendahmane M., Tulsiani D.R. Significance of egg’s zona pellucida glycoproteins in sperm-egg interaction and fertilization // Minerva. Ginecol. 2014. V. 66. № 4. P. 409–419.
Almadaly E., Hoshino Y., Ueta T. et al. Desalted and lyophilized bovine seminal plasma delays induction of the reaction in frozen-thawed bovine spermatozoa in responze to calcium ionophore // Theriogen. 2015. V. 83. № 2. P. 175–185.
Battistone M.A., Da Ros V.G., Salicioni A.M. et al. Functional human sperm capacitation requires both bicarbonate-dependent PKA activation and down-regulation of Ser/Thr phosphatases by Src family kinases // Mol. Hum. Reprod. 2013. V. 19. № 9. P. 570–580.
Berridge M.J. The negative feedback by protein kinase C // J. Biol. Chem. 2002. V. 268. P. 8425–8428.
Brouwers J.F., Boerke A., Silva P.F. et al. Mass spectrometric detection of cholesterol oxidation in bovine sperm // Biol. Reprod. 2011. V. 85. № 1. P. 128–136.
Buffone M.G., Wertheimer E.V., Visconti P.E. et al. Central role of soluble adenylyl cyclase and cAMP in sperm physiology // Biochim. Biophys. Acta. 2014. V. 1842. № 12. P. 2610–2620.
Caswell A.H., Hutchinson J.D. Selectivity of cation chelation to tetracyclines: Evidence for special conformation of calcium chelate // Biochem. Biophys. Res. Commun. 1971. V. 43. № 3. P. 625–630.
Cerella C., Mearelli C., DeNicola M., Dalessio M., Magrini A., bergamaschi A., Ghibelli L. Analysis of calcium changes in endoplasmic reticulum during apoptosis bu the fluorescent indicator chlortetracycline // Ann. N.Y. Acad. Sci. 2007. V. 1099. P. 490–493.
Costello S., Michelangeli F., Nash K. et al. Ca2+-stores in sperm: their identities and functions // Reprod. 2009. V. 138. № 3. P. 425–437.
Darszon A., Nishigaki T., Wood C. et al. Calcium channels and Ca2+ fluctuations in sperm physiology // Int. Rev. Cytol. 2005. V. 243. P. 79–172.
Engel K.M., Springsguth C.H., Grunewald S. What happens to the unsuccessful spermatozoa // Androl. 2018. V. 6. № 2. P. 1–10.
Florman H.M., Jungnickel M.K., Sutton K.A. Regulating the acrosome reaction // Int. J. Dev. Biol. 2008. V. 52. № 5–6. P. 503–510.
Fraser L.R., Abeydeera L.R., Niwa K. Ca2+-regulating mechanisms that modulate bull sperm capacitation and acrosomal exocytosis as determined by chlortetracycline analysis // Mol. Reprod. Dev. 1995. V. 40. № 2. P. 233–241.
Gadella B.M., Boerke A. An update on post-ejaculatory remodeling of the sperm surface before mammalian fertilization // Theriogen. 2016. V. 85. № 1. P. 113–124.
Ghosh T.K., Mullaney J.M., Tarazy F.I. et al. GTP-activated communication between distinct inositol 1,4,5-trisphosphate-sensitive and -insensitive calcium pools // Nature. 1989. V. 340. P. 236–239.
Gill D.L., Mullaney J.M., Ghosh T.K. Intracellular calcium translocation: mechanism of activation by guanine nucleotides and inositol phosphates // J. Exp. Biol. 1988. V. 139. P. 105–133.
Halet G. Monitoring calcium oscillations in fertilized mouse eggs // Methods Mol. Biol. 2016. V. 1457. P. 231–240.
Harayama H. Roles of intracellular cyclic AMP signal transduction in the capacitation and subsequent hyperactivation of mouse and boar spermatozoa // J. Reprod. Dev. 2013. V. 59. № 5. P. 421–430.
Harrison R.A.P., Gadella B.M. Bicarbonate-induced membrane processing in sperm capacitation // Theriogen. 2005. V. 63. № 2. P. 342–351.
Herrick S.B., Schweissinger D.L., Kim S.W. et al. The acrosomal vesicle of mouse sperm is a calcium store // J. Cell. Physiol. 2005. V. 202. № 3. P. 663–671.
Jimenez-Gonzalez C., Michelangeli F., Harper C.V. et al. Calcium signaling in human spermatozoa: a specialized toolkit of channels, transporters and stores // Hum. Reprod. Update. 2006. V. 12. № 3. P. 253–267.
Lawson C., Goupil S., Leclerc P. Increased activity of the human sperm tyrosine kinase SRC by the cAMP-dependent pathway in the presence of calcium // Biol. Reprod. 2008. V. 79. № 4. P. 657–666.
Lopez-Torres A.S., Gonzalez-Gonzalez M.E., Mata-Martinez E. et al. Luteinizing hormone modulates intracellular calcium, protein tyrosine phosphorylation and motility during human sperm capacitation // Biochem. Biophys. Res. Commun. 2017. V. 483. № 2. P. 834–839.
Martinez-Abad S., Castillo-Martin M., Gadani B. et al. Voltage-dependent anion channel 2 is involved in in vitro capacitation of boar sperm // Reprod. Domest. Anim. 2017. V. 52. № 4. P. 65–68.
Mullaney J.M., Chueh S.H., Ghosh T.K. et al. Intracellular calcium uptake activated by GTP. Evidence for a possible guanine nucleotide-induced transmembrane conveyance of intracellular calcium // J. Biol. Chem. 1987. V. 262. № 28. P. 13865–13872.
Parrish J.J. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin // Theriogen. 2014. V. 81. № 1. P. 67–73.
Pons-Rejraji H., Bailey J.L., Leclerc P. Modulation of bovine sperm signalling pathways: correlation between intracellular parameters and sperm capacitation and acrosome exocytosis // Reprod. Fertil. Dev. 2009. V. 21. № 4. P. 511–524.
Rodriguez P.C., Satorre M.M., Beconi M.T. Effect of two intracellular calcium modulators on sperm motility and heparin-induced capacitation in cryopreserved bovine spermatozoa // Anim. Reprod. Sci. 2012. V. 131. № 3–4. P. 135–142.
Sosa C.M., Zanetti M.N., Pocognoni C.A. et al. Acrosomal swelling is triggered by cAMP downstream of the opening of store-operated calcium channels during acrosomal exocytosis in human sperm // Biol. Reprod. 2016. V. 94. № 3. P. 57–61.
Tsien R.Y., Pozzan T., Rink T.J. Calcium homeostasis in intact lymphocytes: cytoplasmic free calcium monitored with a new, intracellularly trapped fluorescent indicator // J. Cell Biol. 1982. V. 94. № 2. P. 325–334.
Ueda T., Chueh S.H., Noel M.W. et al. Influence of inositol 1,4,5-trisphosphate and guanine nucleotides on intracellular calcium release within the N1E-115 neuronal cell line // J. Biol. Chem. 1986. V. 261. P. 3184–3192.
Vijayaraghavan S., Hoskins D. Quantitation of bovine sperm cytoplasmic calcium with Quin-2 and Fura-2: evidence that external calcium does not have direct access to the sperm cytoplasm // Cell Calcium. 1989. V. 10. № 4. P. 241–253.
Ward C.R., Storey B.T. Determination of the time course of capacitation in mouse spermatozoa using a chlortetracycline fluorescence assay // Dev. Biol. 1984. V. 104. № 2. P. 287–296.
Дополнительные материалы отсутствуют.


