Онтогенез, 2020, T. 51, № 5, стр. 379-385
Особенности пула протеасом в спонтанно возникающих злокачественных опухолях молочной железы мышей
Т. М. Астахова a, Е. В. Моисеева b, Н. П. Шарова a, *
a ФГБУН Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
117997 Москва, ул. Миклухо-Маклая, 16/10, ГСП-7, Россия
* E-mail: npsharova@bk.ru
Поступила в редакцию 19.04.2020
После доработки 28.04.2020
Принята к публикации 30.04.2020
Аннотация
Цель настоящей работы – исследовать особенности пула протеасом злокачественных опухолей молочной железы на уникальной модели инбредных мышей BLRB/BYRB, характеризующихся высокой вероятностью спонтанного развития этого типа рака. Обнаружено, что пул протеасом молочных желез относительно устойчив и не изменяется у мышей различного физиологического состояния: здоровых самок разных возрастов и самки-опухоленосителя. Однако при образовании злокачественных опухолей эта устойчивость нарушается, и пул протеасом подвергается комплексным изменениям. В целом, он увеличивается по количеству протеолитических субчастиц. При этом непропорционально сильнее возрастает его химотрипсинподобная активность, что указывает на дополнительные механизмы ее регуляции. К таким механизмам можно отнести выявленную повышенную экспрессию активаторов РА28αβ и 19S RC, а также изменение субъединичного состава протеасом, обусловленное увеличением экспрессии иммунных субъединиц LMP2 и LMP7. Количество каждого из исследованных компонентов пула протеасом возрастало в опухоли по-разному. Наиболее значительно увеличивалось количество двух компонентов – активатора 19S RC и субъединицы LMP2, что указывает на перспективность их использования в качестве мишеней для терапии рака молочной железы. Вместе с тем, нельзя забывать, что эти компоненты важны и для жизнедеятельности нормальных клеток. Поэтому при создании новых лекарственных препаратов следует попутно разрабатывать приемы их адресной доставки к опухоли или иные способы безопасного применения.
ВВЕДЕНИЕ
Выявление молекулярных механизмов возникновения и роста злокачественных опухолей различной этиологии является одной из наиболее актуальных задач современной биологии развития. В этой связи представляется перспективным исследование протеасом – “вездесущих” мультисубъединичных протеаз, осуществляющих важнейший метаболический путь и теоретически способных расщепить любой клеточный белок (Kondakova et al., 2020). Клетки млекопитающих обладают самым многочисленным набором множественных форм протеасом, различающихся структурой и способами распознавания и гидролиза тех или иных белковых субстратов. Особое место в пуле протеасом млекопитающих принадлежит иммунным протеасомам, содержащим протеолитические субъединицы LMP2 (β1i), LMP10 (MECL1, β2i) и LMP7 (β5i) соответственно вместо субъединиц β1, β2 и β5 конститутивных протеасом (Tanaka, Kasahara, 1998). Иммунные протеасомы эффективно образуют антигенные эпитопы для молекул главного комплекса гистосовместимости (MHC) класса I и благодаря этому являются важными участниками развития иммунных реакций. Однако функции иммунных протеасом в иммунных процессах не ограничиваются образованием антигенных эпитопов. Недавно обнаружено, что форма иммунных протеасом с субъединицей LMP2 (но не LMP7), экспрессирующаяся в клетках аллотрансплантата у крыс, связана с развитием иммунологической толерантности независимо от донор-реципиентных различий (Astakhova et al., 2019). Множественные формы протеасом отличаются не только набором протеолитических субъединиц, но и присутствием или отсутствием различных регуляторов (Tanaka, 2009). Так, регуляторный комплекс 19S (19S RC или активатор РА700) распознает убиквитинированные полноразмерные белки и осуществляет их продвижение в протеолитическую камеру протеасомы. Напротив, активаторы РА28αβ и РА200 способствуют утилизации небольших полипептидов независимо от убиквитина. Для нормального функционирования организма необходимо поддержание соотношения множественных форм протеасом, строго определенного для каждого типа клеток.
Неудивительно, что в целом ряде опухолей человека обнаружены изменения в пуле протеасом по сравнению с контролем (Sharova et al., 2011; Kondakova et al., 2014). В большинстве исследованных опухолей выявлены повышенные активность и экспрессия тотального пула протеасом. Для некоторых типов рака человека показано изменение субъединичного состава протеасом. Вместе с тем, следует учитывать, что исследование злокачественных опухолей человека имеет серьезное ограничение – отсутствие корректного контроля. В качестве контроля, как правило, используется прилежащая к опухоли ткань, которую можно рассматривать только как условно нормальную. Поэтому в дополнение к образцам злокачественных тканей пациентов полезно изучение модельных опухолей животных, позволяющих использовать более адекватный контроль. Подобные исследования важны для детального анализа и сравнения тонких различий в экспрессии отдельных субъединиц и/или субкомплексов протеасом в злокачественных опухолях животных и человека, что может быть перспективно для разработки новых способов терапии и диагностики онкологических заболеваний.
Цель настоящей работы – исследовать особенности пула протеасом злокачественных опухолей молочной железы на уникальной модели инбредных мышей BLRB/BYRB, характеризующихся высокой вероятностью спонтанного развития этого типа рака (Moiseeva, 2009; Aronov et al., 2019).
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Работу выполняли на опухолях молочной железы самок инбредных мышей близкородственных линий BLRB-Rb(8.17)1Iem и BYRB-Rb(8.17)1Iem (далее BLRB и BYRB соответственно) (Festing, 1998; Moiseeva, 2009), характеризующихся высокой частотой спонтанно проявляющегося рака молочной железы у рожавших самок (Aronov et al., 2019). Мыши поддерживались в Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук в стандартных тщательно контролируемых условиях вивария, еженедельно в колонии стареющих самок выявляли вновь появляющиеся опухоли молочной железы. Экспериментальные манипуляции с животными проводили в соответствии с международными нормами (US Department of Health and Human Services, National Institute of Health Publication No. 93–23, revised 1985), протокол исследования № 155/2014 был одобрен Комиссией по биоэтике Института биоорганической химии (http://www.ibch.ru/downloads/documents/553/Institutional_Policy_on_the_Use_of_ Laboratory_Animals.pdf). Использовали опухоли молочной железы самок мышей в возрасте 14–19 месяцев (табл. 1 и 2). Контролем служили интактные ткани молочных желез самок мышей в возрасте 3 и 18 месяцев, не имеющих опухоли, а также непораженные опухолью молочные железы самки-опухоленосителя (табл. 1 и 2). Каждый образец был разделен на четыре порции/фрагмента, которые исследовали в независимых экспериментах.
Таблица 1.
Описание самок мышей, взятых в эксперимент
| Номер мыши | Линия | Возраст, месяцы | Размеры опухоли молочной железы, мм × мм × мм |
|---|---|---|---|
| 1 | BLRB | 3 | Нет |
| 2 | BLRB | 18 | Нет |
| 3 | BLRB | 19 | 12 × 16 × 9 |
| 4 | BLRB | 14 | 12 × 16 × 8 |
| 5 | BYRB | 18 | 18 × 24 × 10 |
Таблица 2.
Описание образцов, взятых в эксперимент
| Обозначение образца | Номер мыши | Ткань |
|---|---|---|
| I | 1 | Молочные железы нерожавшей самки |
| II | 2 | Молочные железы нерожавшей самки |
| III | 5 | Молочные железы без признаков рака самки-опухоленосителя |
| IV | 3 | Рак молочной железы |
| V | 4 | Рак молочной железы |
| VI | 5 | Рак молочной железы |
Антитела. Для Вестерн-блоттинга использовали моноклональные антитела мыши к субъединицам α1,2,3,5,6,7 протеасом, субъединице Rpt6 регулятора 19S RC, поликлональные антитела кролика к иммунным субъединицам LMP2 и LMP7 протеасом, субъединице РА28α активатора РА28αβ (Enzo Life Sciences, США), моноклональные антитела мыши к β-актину (Santa Cruz Biotechnology, США), антитела козы к IgG мыши и кролика, конъюгированные с пероксидазой (Amersham Biosciences, Великобритания).
Определение химотрипсинподобной активности протеасом. Осветленные гомогенаты тканей получали в соответствии с опубликованным протоколом (Karpova et al., 2012). Химотрипсинподобную (ХТП) активность протеасом определяли в 1, 1.5 и 2 мкл осветленных гомогенатов тканей по гидролизу флуорогенного субстрата Suc-LLVY-AMC (Sigma, США) в соответствии с методикой, описанной П.А. Ероховым с соавторами (Erokhov et al., 2017). Реакцию проводили в течение 20 минут при 37°С. В этих условиях значения ХТП активности соответствовали прямолинейному отрезку графика зависимости количества гидролизуемого субстрата от времени реакции (Erokhov et al., 2017), что позволило сравнивать активность в разных пробах. Специфичность подтверждали с помощью ингибитора ХТП активности протеасом Z-leucyl-leucyl-leucinal (MG-132) (Sigma, США). Остаточная ХТП активность в пробах в присутствии 5 мкМ MG-132 составляла не более 10%. Увеличение концентрации ингибитора не изменяло значений остаточной активности. ХТП активность протеасом определяли как разницу между полной активностью в отсутствие MG-132 и остаточной активностью в присутствии 5 мкМ MG-132, выражали в количестве гидролизованного субстрата и нормализовали на 100 мкл осветленных гомогенатов.
Вестерн-блоттинг. После электрофореза осветленных гомогенатов в 13%-ном ПААГ в присутствии SDS (5 мкл на дорожку) полипептиды переносили с помощью мокрого блоттинга на нитроцеллюлозную мембрану. Обработку мембраны антителами к β-актину (1 : 1000), субъединицам протеасом (1 : 1000) и активаторов протеасом (1 : 1500) осуществляли стандартным методом (Erokhov et al., 2017). Для выявления неспецифического мечения белков проводили дополнительно обработку мембраны после переноса полипептидов антителами к IgG мыши. Оптическую плотность полос на рентгеновской пленке анализировали с помощью стандартной программы ImageJ.
Статистический анализ. Статистическую обработку результатов проводили с помощью программного приложения Excel. Результаты представлены как среднее значений, полученных в четырех аналогичных экспериментах и измеренных в трех параллельных пробах ± стандартная ошибка. Статистическую достоверность оценивали с помощью однофакторного дисперсионного анализа, достоверными считали различия при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность протеасом в злокачественных опухолях молочной железы мышей. В табл. 1 и 2 приведено описание мышей и тканей, взятых в эксперимент. ХТП активность пула протеасом опухолей молочной железы достоверно не отличалась у исследованных самок мышей BLRB/BYRB, но в три раза превышала ХТП активность контрольных тканей молочной железы (рис. 1). Примечательно, что активность протеасом была одинакова в молочных железах, взятых в качестве контрольных, несмотря на то, что в это исследование вошли, во-первых, мыши разных возрастов и, во-вторых, мыши, не имеющие опухоли, и самка-опухоленоситель. Таким образом, ХТП активность пула протеасом поддерживается в устойчивом состоянии в молочных железах у мышей с указанными физиологическими различиями, но значительно нарушается при образовании патологической опухолевой ткани. Трехкратное повышение активности в опухоли могло быть связано как с аномально высокой экспрессией протеолитических субчастиц протеасом и/или изменением их субъединичного состава, так и с увеличением экспрессии регуляторов активности протеасом. Следующая часть настоящей работы посвящена выяснению этого вопроса.
Рис. 1.
Химотрипсинподобная активность протеасом в контрольных (I–III) и опухолевых тканях (IV–VI) молочных желез мышей. Активность приведена для 100 мкл осветленных гомогенатов тканей как среднее ± ± стандартная ошибка. * Достоверное отличие от образцов I, II и III (p < 0.05, n = 4).

Особенности экспрессии субъединиц протеасом и регуляторов активности протеасом в злокачественных опухолях молочной железы мышей. Тотальный пул протеасом изучали Вестерн-блоттингом с использованием антител к субъединицам α1,2,3,5,6,7, входящим в состав всех форм протеасом. Тем же методом с использованием соответствующих антител исследовали экспрессию протеолитических иммунных субъединиц LMP2 и LMP7, вызывающих наибольший интерес в связи с их функцией образования регуляторных пептидов. Кроме того, анализировали содержание активатора 19S RC с помощью антител к одной из его субъединиц – белку Rpt6, а также активатора РА28αβ с помощью антител к субъединице РА28α (рис. 2). Предварительное исследование неспецифического связывания белков на мембране антителами к IgG мыши выявило наличие меченых полипептидов с молекулярной массой более 50 кДа, локализация которых не совпадала с локализацией изучаемых субъединиц.
Рис. 2.
Вестерн-блоты субъединиц протеасом и активаторов протеасом осветленных гомогенатов контрольных (I–III) и опухолевых тканей (IV–VI) молочных желез мышей с использованием соответствующих антител. Указаны молекулярные массы белков-маркеров.
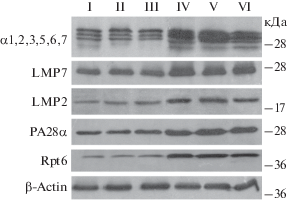
Обнаружено, что не только ХТП активность, но и содержание каждого из указанных компонентов пула протеасом одинаково в контрольных тканях молочной железы независимо от физиологического состояния мышей (рис. 2, табл. 3), что свидетельствует об устойчивости пула протеасом в целом. В опухолевых образцах все исследуемые параметры протеасом были достоверно увеличены, но по-разному. Так, тотальный пул протеасом оказался увеличенным только в 1.6 раз при трехкратном повышении его ХТП активности, что свидетельствует о сложной регуляции активности протеасом дополнительными факторами при образовании злокачественных опухолей молочной железы.
Таблица 3.
Содержание субъединиц протеасом и регуляторов активности протеасом в осветленных гомогенатах контрольных и опухолевых тканей молочных желез
| Субъединицы | Относительное содержание субъединиц в образцах, % (a) | ||||
|---|---|---|---|---|---|
| молочные железы | рак молочной железы | ||||
| II | III | IV | V | VI | |
| α1,2,3,5,6,7 | 96 ± 20 | 89 ± 19 | 153 ± 24* | 159 ± 18* | 151 ± 22* |
| LMP7 | 107 ± 11 | 104 ± 20 | 174 ± 32* | 139 ± 12* | 155 ± 15* |
| LMP2 | 98 ± 27 | 101 ± 11 | 265 ± 64* | 295 ± 75* | 230 ± 26* |
| PA28α | 102 ± 14 | 106 ± 12 | 166 ± 30* | 197 ± 43* | 167 ± 36* |
| Rpt6 | 94 ± 31 | 117 ± 23 | 426 ± 42* | 491 ± 99* | 414 ± 87* |
Большой интерес представляет существенная разница в изменении экспрессии иммунных субъединиц LMP2 и LMP7. Если экспрессия субъединицы LMP2 увеличена в 2.6 раз, то субъединицы LMP7 – всего лишь в 1.5 раза. Этот результат указывает на разные функции субтипов протеасом, содержащих субъединицы LMP2 и LMP7. Похожая закономерность была выявлена нами ранее при исследовании злокачественной трансформации клеток печени под действием дипина у мышей (Astakhova et al., 2010) и процесса роста папиллярной карциномы щитовидной железы человека (Sharova et al., 2011). Понять разницу в функциях данных субтипов иммунных протеасом удалось лишь при изучении процесса развития толерантности к аллотрансплантату на модели индукции донорспецифической толерантности у крыс. Оказалось, что увеличение экспрессии протеасом с иммунной субъединицей LMP2 в клетках трансплантата сопровождает развитие толерантности, а высокое содержание протеасом с субъединицей LMP7 в лимфоцитарно-макрофагальном инфильтрате связано с процессом отторжения трансплантата (Karpova et al., 2012; Astakhova et al., 2019). Мы полагаем, что в опухолевых клетках так же, как и в клетках трансплантата, протеасомы с субъединицей LMP2 продуцируют пептиды, которые, минуя молекулы MHC класса I, выделяются в межклеточное пространство и подавляют активность инфильтрованных цитотоксических лимфоцитов. По-видимому, данную функцию протеасомы, содержащие субъединицу LMP2, выполняют совместно с активатором РА28αβ, экспрессия которого также повышена в опухолях молочных желез (рис. 2, табл. 3). Подтверждением этому предположению служат результаты, указывающие на преимущественное “нарезание” пептидов малой длины, не пригодных для молекул MHC класса I, под действием активатора РА28αβ по сравнению с 19S RC (Raule et al., 2014).
Следует подчеркнуть, что во всех исследованных опухолевых тканях экспрессия 19S RC увеличена наиболее значительно по сравнению с другими компонентами (рис. 2, табл. 3). Это объяснимо, поскольку активно делящиеся злокачественные клетки требуют интенсивного белкового обмена, в осуществлении которого важную роль играет 19S RC, обеспечивая распознавание и утилизацию убиквитинированных белков. В той или иной степени, экспрессия этого регулятора увеличена в разных опухолевых клетках (Astakhova et al., 2010; Sharova et al., 2011; Kondakova et al., 2014). Неудивительно, что соединения, повреждающие функции 19S RC, проявляют противоопухолевую активность, в том числе по отношению к злокачественным клеткам молочной железы мыши (Astakhova et al., 2018).
ЗАКЛЮЧЕНИЕ
В данной работе впервые проведено детальное исследование пула протеасом злокачественных опухолей молочной железы по сравнению с контрольными образцами на уникальной модели мышей BLRB/BYRB. Обнаружен ряд важных фактов. Во-первых, пул протеасом ткани молочной железы характеризуется относительной устойчивостью и не изменяется у мышей различного физиологического состояния. Во-вторых, при спонтанном образовании злокачественных опухолей молочной железы пул протеасом “выбивается” из равновесия и становится подчиненным нуждам раковых клеток, что сопровождается его комплексным изменением. В целом, пул протеасом увеличивается по количеству протеолитических субчастиц. При этом непропорционально сильнее возрастает его ХТП активность, что указывает на дополнительные механизмы ее регуляции. К таким механизмам можно отнести выявленную повышенную экспрессию активаторов РА28αβ и 19S RC, а также изменение субъединичного состава протеасом, обусловленное увеличением экспрессии иммунных субъединиц LMP2 и LMP7.
Необходимо отметить, что количество каждого из исследованных компонентов пула протеасом увеличивается до необходимого для опухоли уровня (рис. 3). Наиболее сильно увеличено количество двух компонентов – активатора 19S RC и иммунной субъединицы LMP2, что указывает на перспективность их использования в качестве мишеней для терапии рака молочной железы. Вместе с тем, нельзя забывать о том, что это важные компоненты и здоровых клеток. Например, активность субъединицы LMP2 связана с передачей сигнала между нейронами (Erokhov et al., 2017). Поэтому при создании новых лекарственных препаратов следует учитывать необходимость разработки приемов их адресной доставки к опухоли или иных способов безопасного применения.
Список литературы
Aronov D.A., Zhukov V.V., Semushina S.G., Moiseeva E.V. Imbalances in cellular immunological parameters in blood predetermine tumor onset in a natural mouse model of breast cancer // Cancer Immunol. Immunother. 2019. V. 68. № 5. P. 721–729.
Astakhova T.M., Bozhok G.A., Alabedal’karim N.M., Karpova Y.D., Lyupina Yu.V., Ushakova E.M., Legach E.I., Bondarenko T.P., Sharova N.P. Proteasome expression in ovarian heterotopic allografts of Wistar and August rats under induction of donor specific tolerance // Russ. J. Dev. Biol. 2019. V. 50. № 5. P. 261–267.
Astakhova T.M., Delone G.V., Lyupina Yu.V., Abramova E.B., Uryvaeva I.V., Sharova N.P. Changes in the proteasome pool during malignant transformation of mouse liver cells // Acta Naturae. 2010. V. 2. № 1. P. 68–73.
Astakhova T.M., Morozov A.V., Erokhov P.A., Mikhailovskaya M.I., Akopov S.B., Chupikova N.I., Safarov R.R., Sharova N.P. Combined effect of bortezomib and menadione sodium bisulfite on proteasomes of tumor cells: the dramatic decrease of bortezomib toxicity in a preclinical trial // Cancers. 2018. V. 10. № 10. pii: E351.
Erokhov P.A., Lyupina Yu.V., Radchenko A.S., Kolacheva A.A., Nikishina Yu.O., Sharova N.P. Detection of active proteasome structures in brain extracts: Proteasome features of August rat brain with violations in monoamine metabolism // Oncotarget. 2017. V. 8. № 41. P. 70941–70957.
Festing M. Inbred strains of mice: BLRB // Mouse Genome Informatics. 1998. http://www.informatics.jax.org/external/festing/mouse/docs/BLRB.shtml.
Karpova Ya.D., Bozhok G.A., Lyupina Yu.V., Legach E.I., Astakhova T.M., Stepanova A.A., Bondarenko T.P., Sharova N.P. Changes in the proteasome function after induction of donor-specific tolerance in rats with ovarian allograft // Biol. Bull. (Moscow). 2012. V. 39. № 3. P. 244–249.
Kondakova I.V., Shashova E.E., Sidenko E.A., Astakhova T.M., Zakharova L.A., Sharova N.P. Estrogen receptors and ubiquitin proteasome system: mutual regulation // Biomolecules. 2020. V. 10. № 4. pii: E500.
Kondakova I.V., Spirina L.V., Koval V.D., Shashova E.E., Choinzonov E.L., Ivanova E.V., Kolomiets L.A., Chernyshova A.L., Slonimskaya E.M., Usynin E.A., Afanasyev S.G. Chymotrypsin-like activity and subunit composition of proteasomes in human cancers // Mol. Biol. 2014. V. 48. № 3. P. 384–389.
Moiseeva E. Anti-Breast Cancer Drug Testing. Original Approaches. Novel Set of Mouse Models. Saarbrucken: Lambert Academic Publishing, 2009. 225 p.
Raule M., Cerruti F., Benaroudj N., Migotti R., Kikuchi J., Bachi A., Navon A., Dittmar G., Cascio P. PA28αβ reduces size and increases hydrophilicity of 20S immunoproteasome peptide products // Chem. Biol. 2014. V. 21. № 4. P. 470–480.
Sharova N.P., Astakhova T.M., Karpova Ya.D., Lyupina Yu.V., Alekhin A.I., Goncharov N.G., Sumedi I.R., Cherner V.A., Rodoman G.V., Kuznetsov N.A., Erokhov P.A. Changes in proteasome pool in human papillary thyroid carcinoma development // Cent. Eur. J. Biol. 2011. V. 6. № 4. P. 486–496.
Tanaka K. The proteasome: Overview of structure and function // Proc. Jpn. Acad. Ser. B. 2009. V. 85. № 1. P. 12–36.
Tanaka K., Kasahara M. The MHC class I ligand-generating system: Roles of immunoproteasomes and the interferon-gamma-inducible proteasome activator PA28 // Immunol. Rev. 1998. V. 163. P. 161–176.
Дополнительные материалы отсутствуют.



