Онтогенез, 2020, T. 51, № 5, стр. 338-350
Экспрессия и роль серотонинового рецептора 1а типа в эмбриональном тимусе крыс
Н. В. Лифанцева a, Ц. О. Конеева a, С. Н. Воронова a, Г. В. Луценко b, Л. А. Захарова a, В. И. Мельникова a, *
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: v_melnikova@mail.ru
Поступила в редакцию 03.05.2020
После доработки 15.05.2020
Принята к публикации 17.05.2020
Аннотация
Серотонин участвует в регуляции широкого спектра функций иммунной системы у половозрелых животных. Ранее нами было показано, что подавление синтеза серотонина у плодов в период формирования тимуса приводит к долгосрочным необратимым изменениям в функционировании Т‑системы иммунитета. Однако механизмы морфогенетического влияния серотонина на развитие тимуса остаются невыясненными. В данной работе была выявлена экспрессия мРНК и белкового продукта серотонинового рецептора 1а типа (Htr1a) в тимусе плодов. Однократное введение плодам in utero антагониста Htr1a (NAN-190) на 17-й день эмбрионального развития вызывало стойкое повышение функциональной активности Т-лимфоцитов в постнатальной жизни. На модели органотипической культуры эмбрионального тимуса показано, что блокада Htr1a ускоряет дифференцировку Т-лимфоцитов на самых ранних стадиях их развития и слабо влияет на образование зрелых форм Т-клеток помощников и цитотоксических Т-лимфоцитов. Присутствие в развивающемся тимусе рецепторов Htr1a подтверждает возможность прямого влияния серотонина на формирование этого органа. Установлено, что серотонин через Htr1a способен изменять баланс цитокинов в формирующемся тимусе, что может лежать в основе механизмов онтогенетической пластичности иммунной системы. Цитокины, ответственные за дифференцировку клеточных элементов тимуса, по-видимому, являются одним из ключевых звеньев, через которые реализуется морфогенетический эффект серотонина, опосредованный активацией Htr1a рецептора.
ВВЕДЕНИЕ
Нейротрансмиттер серотонин участвует в регуляции широкого спектра биологических функций, как в мозге, так и в периферических органах, в том числе в иммунной системе. У половозрелых животных серотонин контролирует процессы врожденного и адаптивного иммунитета (Baganz, Blakely, 2013). Свои иммунотропные эффекты серотонин осуществляет через специфические рецепторы (Cloëz-Tayarani, Changeux, 2007; Arreola et al., 2015). Механизмы иммуномодуляторного действия серотонина характеризуются клеточной специфичностью и зависят от экспрессии тех или иных типов рецепторов на клетках иммунной системы. В частности, описано влияние серотонина на активность естественных клеток-киллеров, дендритных клеток и макрофагов, хемотаксис, секрецию цитокинов, апоптоз, пролиферацию, дифференцировку и активацию лимфоцитов, а также их созревание в лимфоидных органах (Arreola et al., 2015; Herr et al., 2017). Иммуномодуляторные функции серотонина у половозрелых животных и человека изучены достаточно полно, в то время как данные о его участии в развитии иммунной системы немногочисленны и, главным образом, охватывают ранний постнатальный период.
Становление отдельных структурно-функциональных элементов иммунной системы характеризуется высокой адаптационной пластичностью и чувствительностью ко многим регуляторным факторам, одним из которых является серотонин. Ранее нами было показано, что пренатальный дефицит серотонина в период формирования тимуса приводит к существенным долгосрочным изменениям клеточного состава тимуса и к нарушениям в функционировании Т-системы иммунитета вплоть до половозрелого возраста (Мельникова и др., 2012). Однако механизмы морфогенетического действия серотонина на развитие тимуса остаются невыясненными, в частности, отсутствие данных об экспрессии рецепторов к серотонину в тимусе плодов не позволяет судить о возможности прямого влияния серотонина на развитие этого органа.
В настоящее время выделяют семь семейств серотониновых рецепторов: Htr1, Htr2, Htr3, Htr4, Htr5, Htr6 и Htr7, многие из которых включают подтипы (Kroeze, Roth, 2006). У половозрелых животных клетки иммунной системы экспрессируют почти все типы серотониновых рецепторов, однако, наиболее представленным является Htr1а. Экспрессия Htr1а выявлена в тимусе, селезенке, лимфатических узлах, а также на циркулирующих в крови Т-лимфоцитах. Через этот тип рецепторов серотонин способен модулировать дифференцировку, пролиферацию и функциональную активность Т-лимфоцитов, а также их созревание в лимфоидных органах у половозрелых животных (Arreola et al., 2015). Антагонисты Htr1а подавляют пролиферацию Т-лимфоцитов, индуцированную митогенами или интерлейкином 2 (ИЛ-2), а также секрецию цитокинов, таких как ИЛ-2 и интерферон-γ (ИФН-γ) (Aune et al., 1994).
Многочисленные исследования свидетельствуют, что Htr1a рецепторы играют важную роль в регуляции развития многих отделов мозга у плодов (Albert, Lemonde, 2004; Gleason et sl., 2010; Kishi et al., 2011). Нарушение баланса серотонина в период формирования мозга приводит к долгосрочным структурно-функциональным изменениям, опосредованным в значительной степени через Htr1a. У человека полиморфизм гена Htr1a, обусловленный точечными мутациями в промотерном участке, связывают с патогенезом шизофрении, биполярного расстройства, депрессии, склонности к суициду (Albert, Lemonde, 2004; Kishi et al., 2011). Тимус и мозг формируются в развитии параллельно, однако, роль Htr1a в регуляции развития иммунной системы до настоящего времени не исследовали.
В данной работе мы установили, что Htr1a рецепторы экспрессируются в тимусе плодов крыс и оценили отдаленные последствия блокады этих рецепторов в период активного формирования тимуса. На модели органотипической культуры эмбриональных тимусов изучили влияние блокады Htr1a рецепторов на дифференцировку Т-лимфоцитов, а также предложили возможные механизмы реализации эффектов серотонина на развивающийся тимус, в частности, выявили его влияние на экспрессию тимических цитокинов.
МАТЕРИАЛЫ И МЕТОДЫ
Животные и экспериментальные процедуры. Работа проведена на крысах Вистар, которых содержали в стандартных условиях с контрольным режимом освещения и свободным доступом к пище и воде. Для получения самок с датированным сроком беременности использовали трех–четырехмесячных крыс весом 200–250 г. День обнаружения сперматозоидов в вагинальном мазке считали первым днем эмбрионального развития (Э1), день рождения крысят считали первым постнатальным днем (П1). Выделение экспериментального материала выполняли под изофлурановым ингаляционным наркозом с соблюдением правил проведения работ с использованием экспериментальных животных. В работе использовано 38 беременных самок крыс.
Исследование возрастной динамики экспрессии Htr1a в тимусе крыс. Экспрессию мРНК и белка Htr1a изучали методами полуколичественного ПЦР с обратной транскрипцией и Вестерн-блоттинга в тимусе плодов (в период Э16–Э21) и постнатальных крыс (П3).
ПЦР. Выделение тотальной РНК из тимусов, обратную транскрипцию и ПЦР проводили в соответствии с протоколом, описанным ранее (Melnikova et al., 2019). Ген, кодирующий рибосомальный белок L19 (RPL19), был выбран в качестве референсного. Анализ продуктов проводили с помощью агарозного гель-электрофореза и системы видеорегистрации “ChemiDoc MP Imaging System” (“Biorad”). Для исключения ложноположительного результата проводили отрицательные контроли – ПЦР без матрицы и ПЦР без обратной транскрипции. Специфические праймеры, представленные в табл. 1, подбирали с помощью сервиса NCBI Primer-BLAST с учетом экзон-интронной структуры генов. Праймеры подбирали таким образом, чтобы температура отжига была во всех случаях одинакова, и составляла 59°С. Для детекции Htr1a проводили 30 циклов, референсного гена – 25 циклов, а всех остальных образцов – 28 циклов амплификации. Этот параметр предварительно подбирали для каждого гена экспериментально так, чтобы он соответствовал зоне экспоненциального роста, когда возможен полуколичественный анализ. Выбор метода ПЦР, а не ПЦР в реальном времени был обусловлен ограниченными объемами эмбрионального материала, в то время как в экспериментах, требующих сравнения уровней экспрессии, чувствительность ПЦР была достаточной.
Таблица 1.
Олигонуклеотидные праймеры, использованные для ПЦР
| Ген | Последовательность прямого праймера | Последовательность обратного праймера | Размер продукта, п.н. |
|---|---|---|---|
| Htr1a | tgaagactctgggcatcatcat | acccaacaacgcaggcat | 116 |
| RPL19 | atcgccaatgccaactct | gagaatccgcttgtttttgaa | 321 |
| ИЛ-10 | tgctcttactggctggagtg | cctggggcatcacttctacc | 264 |
| ИФН-γ | ccctctctggctgttactgc | cgaacttggcgatgctcatg | 315 |
| ИЛ-1α | cccagatcagcacctcacag | gcgagtgacttaggacgagg | 570 |
| ИЛ-1β | tcaagcagagcacagacctg | ttctgtcgacaatgctgcct | 357 |
| ИЛ-4 | ctcatctgcagggcttccag | agtgttgtgagcgtggactc | 173 |
| ФНО-α | ccatgagcacggaaagcatg | ggctcataccagggcttgag | 586 |
Вестерн-блоттинг. Получение осветленных гомогенатов тимусов, электрофорез и перенос белков на мембрану осуществляли по протоколу, описанному ранее (Melnikova et al., 2019). На дорожку наносили одинаковое количество общего белка (по 40 мкг). Качество переноса белков и точность нанесения проб на дорожки контролировали с помощью окрашивания мембран Понсо С. Мембраны инкубировали с первичными антителами кролика к Htr1a (1 : 1000, “Abcam”) в течение ночи при 4°C. По окончании инкубации мембраны несколько раз промывали в TNT буфере (10 мМ Трис-HCl, pH 7.5, 150 мМ NaCl, 0.1% Tween-20) и инкубировали с вторичными антителами, конъюгированными с пероксидазой хрена, к IgG кролика (1 : 10 000, “Jackson Immunoresearch”) в течение 1 ч при комнатной температуре. Мембраны проявляли стандартным методом усиленной хемилюминесценции (ECL) с помощью набора “ECL Plus Western Blotting Detection Reagents”, (“Amersham”). Рентгеновские пленки сканировали, и полученные изображения обрабатывали в стандартной программе ImageJ, оценивая интегральное поглощение белковых полос. Результаты определения уровня экспрессии исследованных веществ были нормированы на общее содержание белка на дорожку.
Для прояснения вопроса о клеточном распределении рецептора, на Э19 исследовали экспрессию белка Htr1a отдельно в тимоцитах и клетках стромы тимуса. Для этого свежевыделенные тимусы гомогенизировали в стеклянном гомогенизаторе и фильтровали через капроновый фильтр. Тимоциты собирали из полученной суспензии центрифугированием, а образцы стромы тимуса собирали пинцетом с поверхности фильтра. Полученные пробы использовали для Вестерн-блоттинга, как описано выше. Для анализа выбран срок Э19, поскольку он соответствует периоду активной дифференцировки всех типов клеток в тимусе, а размер органа уже позволяет получить достаточное количество материала для анализа.
Исследование отдаленных последствий пренатальной блокады Htr1a рецепторов в тимусе. На 17‑й день беременности крысам под изофлурановым наркозом вскрывали брюшную полость и с помощью гамильтоновского шприца вводили плодам in utero антагонист Htr1a рецепторов NAN-190 (1 мкг в 5 мкл на плод), затем рану послойно ушивали. Все манипуляции проводили в асептических условиях. Контрольным животным вводили равный объем стерильного 0.9% раствора NaCl. Родившееся потомство выращивали, и на П20 и П40 оценивали функциональную активность Т‑лимфоцитов тимуса по их способности к активации Т-клеточным митогеном.
Оценка пролиферативного ответа Т-лимфоцитов тимуса на митоген конканавалин А. Функциональную активность Т-лимфоцитов тимуса оценивали по пролиферативному иммунному ответу, индуцированному митогеном конканавалином А (КонА, 2.5 мкг/мл). Пролиферацию клеток оценивали в культуре лимфоцитов по протоколу, описанному ранее (Мельникова и др., 2012), с использованием [3H]тимидина (60 Ки/мМ, “Amersham”). Для одной экспериментальной точки использовали пять лунок. После инкубации клетки переносили полуавтоматическим харвестером (“Scatron”) на стекловолокнистые фильтры GF/C (“Whatman”). Радиоактивность образцов измеряли на сцинтилляционном счетчике “Rack-beta” (“LKB”).
Органотипическая культура эмбриональных тимусов. Органотипическую культуру тимусов, выделенных из плодов на Э18, проводили по протоколу, описанному ранее (Cunningham et al., 2016; Melnikova et al., 2019). Культуру поддерживали в течение 7 дней с ежедневной заменой культуральной среды и добавлением в среду в опытных лунках антагониста Htr1a рецепторов NAN-190 (10–7 М, “Sigma”). После культивирования тимусы гомогенизировали в стеклянном гомогенизаторе, суспензию тимоцитов фильтровали через капроновый фильтр и отмывали центрифугированием. Процентное содержание популяций Т‑лимфоцитов определяли методом проточной цитометрии.
Анализ состава клеточных популяций тимуса. Степень зрелости Т-лимфоцитов анализировали с помощью двойного мечения моноклональными антителами к CD8b и к CD4 антигенам, конъюгированными с фикоэритрином и флуоресцеин изотиоцианатом, соответственно (“Cederlane”). Иммуноцитохимическое мечение и последующий анализ клеток на цитометре “Cell Lab Quanta SC”, (“Beckman-Coulter”) проводили в соответствии с методом, описанным ранее (Мельникова и др., 2012; Melnikova et al., 2019).
Оценка влияния серотонина на индуцированную митогеном пролиферацию Т-лимфоцитов. Т-лимфоциты, выделенные из тимусов плодов на Э21, культивировали с митогеном КонА, как описано выше. В отдельные лунки за 30 мин до добавления митогена вносили серотонин в диапазоне концентраций 10–4–10–8 М или антагонист NAN-190 (10–7 М). Через 72 ч оценивали включение [3H]тимидина в клетки.
Оценка влияния митогена КонА на экспрессию мРНК Htr1a рецепторов в тимусе плодов и половозрелых крыс. Т-лимфоциты, выделенные из тимусов плодов (Э18) и двухмесячных крыс (П60), инкубировали 24 ч in vitro в присутствии митогена КонА (2.5 мкг/мл) и без него. Затем в тимусах определяли мРНК Htr1a рецепторов методом ПЦР.
Анализ синтеза и секреции цитокинов. Тимусы, выделенные из плодов на Э18, инкубировали в среде RPMI-1640 в присутствии серотонина (10–7 М), агониста (8-ОН-DPAT 10–7 М) или антагониста (NAN-190 10–6 M) Htr1a рецепторов в течение 24 ч. Через 4 ч отбирали пробы среды для оценки выделения цитокинов. Через 24 ч тимусы замораживали и хранили до определения мРНК цитокинов методом ПЦР, как описано выше. Концентрацию цитокинов в образцах среды определяли с помощью цитометрических бус согласно протоколу производителя (“Rat cytokine flex set for BD Cytometric Bead Array”, BD Bioscience). Использовали бусы для определения цитокинов: ИЛ-1α, ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-10, ИФН-γ и фактор некроза опухоли (ФНО-α).
Статистическую обработку данных проводили с помощью компьютерных программ Excel и Statistica 7.0. Данные представлены в виде: среднее значение ± стандартная ошибка. Достоверность различий оценивали с использованием непараметрического критерия Манна–Уитни.
РЕЗУЛЬТАТЫ
Htr1a рецептор экспрессируется в формирующемся тимусе у плодов крыс. Методом ПЦР в развивающемся тимусе плодов крыс обнаружена экспрессия мРНК Htr1a рецептора с Э16 по П3 (рис. 1а). С помощью Вестерн-блоттинга на тех же стадиях онтогенеза была подтверждена экспрессия белкового продукта Htr1a (рис. 1б). Анализ клеток, экспрессирующих Htr1a рецептор у плодов на Э19 показал наличие рецептора как в Т-лимфоцитах, так и в стромальных элементах тимуса (рис. 1б).
Рис. 1.
Возрастная динамика экспрессии Htr1a рецептора в тимусе крыс с 16-го дня эмбрионального развития (Э16) по 3-й день постнатального развития (П3), оцениваемая с помощью полимеразной цепной реакции с обратной транскрипцией (а) и Вестерн-блоттинга (б). В качестве положительного контроля использованы гипоталамус (+) и ромбэнцефалон (++) 21-дневных плодов.

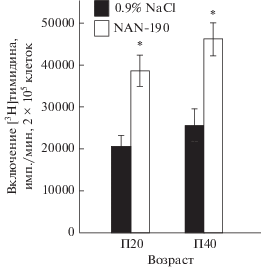
Пренатальная блокада Htr1a рецепторов в тимусе плодов приводит к долгосрочным изменениям бластогенного потенциала Т-лимфоцитов. Пренатальная блокада Htr1a рецепторов вызывала необратимые изменения функционального состояния Т-клеточного иммунитета в постнатальном развитии. Однократное введение плодам на Э17 in utero антагониста NAN-190 приводило к долговременному повышению функциональной активности (бластогенного потенциала) Т-лимфоцитов тимуса, оцениваемой по пролиферативному ответу на Т-клеточный митоген КонА, как в пре-, так и в постпубертатном периоде жизни (рис. 2).
Рис. 2.
Индуцированный митогеном конканавалином А (КонА, 2.5 мкг/мл) пролиферативный ответ лимфоцитов тимуса у крыс, которым на 17-й эмбриональный день однократно вводили антагонист рецепторов к серотонину Htr1a (NAN-190). Контрольным животным вводили 0.9%-ный раствор NaCl. Пролиферативный ответ лимфоцитов оценивали на 20-й и 40-й дни постнатального развития (П20, П40). * р < 0.05 по сравнению с контролем.
Блокада Htr1a рецепторов влияет на динамику созревания Т-лимфоцитов в органотипической культуре тимусов плодов. Добавление селективного антагониста Htr1a рецепторов (NAN-190) в органотипическую культуру тимусов, выделенных из плодов на Э18, вызывало существенные изменения в динамике дифференцировки предшественников Т-лимфоцитов в течение 7 дней in vitro. Доля наименее зрелых тимоцитов CD4–CD8–-фенотипа снижалась в 1.7 раза, а популяция двойных позитивных клеток CD4+CD8+-фенотипа, представляющих следующий этап дифференцировки Т-лимфоцитов, увеличивалась в 3 раза (рис. 3), что свидетельствует об ускорении самых ранних этапов дифференцировки предшественников. На популяции зрелых клеток помощников CD4+-фенотипа и цитотоксических лимфоцитов CD8+-фенотипа антагонист Htr1a рецептора не оказывал значимого влияния (рис. 3).
Рис. 3.
Влияние антагониста Htr1a рецепторов (NAN-190) на дифференцировку Т-лимфоцитов в тимусе плодов. Органотипическую культуру тимусов, выделенных из 18-дневных плодов, поддерживали в течение 7 дней in vitro, в культуральную среду добавляли NAN-190 (10–7 М). Экспрессию антигенов CD4 и CD8 анализировали с помощью проточной цитометрии. * р < 0.05 по сравнению с контролем.

Серотонин и антагонист Htr1a рецепторов не оказывают влияния на индуцированную митогеном пролиферацию тимоцитов у плодов крыс. Т-лимфоциты, выделенные из плодов на Э21 способны отвечать на Т-клеточный митоген усилением пролиферации (рис. 4). В отличие от половозрелых животных (Мельникова с соавт., 2012) серотонин в диапазоне концентраций 10–8–10–4 М, а также антагонист Htr1a рецепторов NAN-190 (10–7 М) не влияли на пролиферацию Т-лимфоцитов тимуса, индуцированную митогеном (рис. 4).
Рис. 4.
Влияние серотонина (10–8–10–4 М) и антагониста Htr1a рецепторов (NAN-190 10–7 M) на индуцированный митогеном конканавалином А (КонА 2.5 мкг/мл) пролиферативный ответ тимоцитов, выделенных из 21-дневных плодов. * р < 0.05 по сравнению с контролем.

Активации Т-лимфоцитов митогеном стимулирует экспрессию мРНК Htr1a рецепторов у половозрелых крыс, но не у плодов. У половозрелых животных активация тимоцитов митогеном вызывала повышение уровня экспрессии мРНК рецептора Htr1a. В отличие от половозрелых животных, у плодов на Э18 активация тимоцитов митогеном в течение 24 ч не влияла на экспрессию мРНК Htr1a рецепторов (рис. 5).
Рис. 5.
Влияние митогена конканавалина А (КонА 2.5 мкг/мл) на экспрессию мРНК Htr1a рецепторов в Т-лимфоцитах, выделенных из тимусов 18-дневных плодов (Э18) и двухмесячных крыс (П60), и инкубированных 24 ч in vitro. Представлены результаты электрофореза в агарозном геле продуктов ПЦР и оптическая плотность полос. * р < 0.05 по сравнению с контролем.

Htr1a рецептор участвует в регуляции синтеза и выделения цитокинов в тимусе плодов. Культивирование целых тимусов, выделенных из плодов на Э18, в присутствии агониста (8-OH-DPAT, 10–7 M) или антагониста (NAN-190, 10–6 M) Htr1a рецепторов приводило к изменениям секреции ИЛ-10, ИФН-γ и синтеза мРНК ИЛ-10, ИФН-γ и ФНО-α (рис. 6, 7), но не влияло на экспрессию ИЛ-1α, ИЛ-1β, ИЛ-2, ИЛ-4 (данные не представлены). Исследование секреции цитокинов в среду показало, что через 4 ч культивирования концентрации ИЛ-1α, ИЛ-2 и ИЛ-4 были менее 40 пг/мл, т.е. ниже предела чувствительности метода. В среде была выявлена относительно высокая концентрация ИЛ-10 (около 300 пг/мл) и ФНО-α (около 200 пг/мл), причем секреция ФНО-α не зависела от серотонина и его рецептора Htr1a. Экспрессия мРНК ФНО-α снижалась под действием экзогенного серотонина или агониста и этот эффект отменялся антагонистом Htr1a (рис. 6). Применение только антагониста (блокада действия внутритимического серотонина) не влияло на экспрессию мРНК ФНО-α (рис. 6).
Рис. 6.
Влияние серотонина (5HT, 10–7 М), агониста (8OH-DPAT 10–7 М) и антагониста (NAN-190 10–6 М) Htr1a рецепторов на экспрессию мРНК цитокинов ИЛ-10, ИФН-γ и ФНО-α в тимусах, выделенных из 18-дневных плодов и инкубированных 24 ч in vitro. Представлены результаты электрофореза в агарозном геле продуктов ПЦР и оптическая плотность полос. * р < 0.05 по сравнению с контролем.

Рис. 7.
Влияние серотонина (5HT, 10–7 М), агониста (8OH-DPAT 10–7 М) и антагониста (NAN-190 10–6 М) Htr1a рецепторов на секрецию цитокинов ИЛ-10 (а) и ИФН-γ (б) в тимусах, выделенных из 18-дневных плодов и инкубированных 4 ч in vitro. * р < 0.05 по сравнению с контролем.

Экспрессия мРНК ИЛ-10 не менялась в присутствии агониста Htr1a, но снижалась под влиянием антагониста Htr1a (рис. 6). Добавление в среду экзогенного серотонина или агониста Htr1a рецепторов стимулировало выделение ИЛ-10 (рис. 7а). Антагонист Htr1a, добавляемый совместно с агонистом, отменял эффект последнего, а использование только антагониста не влияло на выделение ИЛ-10 (рис. 7а).
Экспрессия мРНК ИФН-γ снижалась в присутствии антагониста и при совместном применении агониста и антагониста, но не менялась при введении только агониста Htr1a рецептора (рис. 6). Концентрация ИФН-γ в культуральной среде в контроле составляла около 65 пг/мл и не менялась в присутствии агониста Htr1a рецепторов (рис. 7б). Добавление в среду экзогенного серотонина незначительно усиливало выделение ИФН-γ клетками тимуса. Блокада действия внутритимического серотонина с помощью антагониста Htr1a рецепторов снижала секрецию ИФН-γ, также как и совместное применение агониста и антагониста Htr1a (рис. 7б). Добавление в среду экзогенного серотонина стимулировало экспрессию мРНК Htr1a.
ОБСУЖДЕНИЕ
Согласно полученным данным, у плодов крыс клетки формирующегося тимуса экспрессируют Htr1a рецептор на всех изученных стадиях онтогенеза (Э16–П3). Блокада Htr1a в период активного формирования тимуса приводит к стойкому повышению функциональной активности (увеличению бластогенного потенциала) Т-лимфоцитов в постнатальном периоде жизни. Активация Htr1a рецепторов в эмбриональном тимусе изменяет баланс цитокинов, которые, по-видимому, являются одним из ключевых звеньев, опосредующих морфогенетический эффект серотонина на формирование органа.
Присутствие как мРНК, так и соответствующего белкового продукта Htr1a на стадиях Э16–Э21, в эмбриональном тимусе свидетельствует о возможности прямого действия серотонина на формирующийся орган у плодов. Следует отметить, что белок Htr1a обнаруживается не только на созревающих предшественниках Т-лимфоцитов, но и на клетках стромы тимуса. Эмбриональный тимус является динамичной системой, где элементы стромы и тимоциты активно взаимодействуют, и дифференцировка стромальных элементов тимуса принципиальным образом зависит от взаимодействия с первыми лимфопоэтическими предшественниками (Meilin et al., 1995; Anderson et al., 2006), заселяющими эпителиальную закладку тимуса на Э13–16 (Brelinska, Malinska, 2005). Дифференцирующиеся предшественники являются транзиторной, постоянно обновляющейся популяцией в тимусе, в то время как стромальные клетки представляют собой резидентную популяцию, собственно составляющую ткань тимуса. Строма тимуса обеспечивает дифференцировку предшественников Т-лимфоцитов на протяжении всей жизни (Su, Manley, 2000; Anderson et al., 2006). Это позволяет предположить, что выявленные нами отдаленные последствия блокады Htr1a у плодов обусловлены стойкими изменениями именно в стромальных элементах тимуса. В нашем исследовании введение плодам селективного антагониста Htr1a рецепторов именно в период, когда возможно координирующее действие серотонина на созревание всех типов клеток тимуса, подтверждает это предположение. Однако, нельзя исключать, что наряду с прямым действием серотонина, через рецепторы в тимусе, возможно и опосредованное влияние серотонина на тимус через нейро-эндокринную систему, которая также является мишенью для морфогенетического действия серотонина (Ugrumov et al., 1994; Pronina et al., 2003).
Для изучения роли синтезируемого локально в тимусе серотонина были проведены исследования на модели органотипической культуры эмбрионального тимуса. Согласно полученным данным прямая блокада рецепторов Htr1a ускоряет дифференцировку Т-лимфоцитов на самых ранних стадиях (двойных негативных и двойных позитивных Т-лимфоцитов) и не влияет существенно на образование наиболее зрелых форм – Т-клеток-помощников и цитотоксических Т-лимфоцитов. Использование в данной модели антагониста рецепторов, а не добавление экзогенного серотонина, свидетельствует о том, что наблюдаемые эффекты обусловлены именно внутритимическим серотонином, а не поступающим из общей циркуляции. Полученные результаты хорошо дополняют существующие представления о том, как происходит дифференцировка стромальных клеток тимуса в эмбриогенезе, согласно которым предшественники Т-лимфоцитов, заселяющие тимус в пренатальном периоде развития, задерживаются в органе значительно дольше, чем это необходимо для дифференцировки предшественников у постнатальных крыс (Manley, 2000; Brelinska, Malinska, 2005). По-видимому, задержка пренатальной волны миграции связана с тем, что эти клетки заселяют совсем незрелый зачаток тимуса и необходимы для полноценной дифференцировки стромальных элементов. Наши данные позволяют предположить, что одним из механизмов, который в норме притормаживает дифференцировку ранних стадий предшественников Т-лимфоцитов и тем самым удлиняет время пребывания первой волны миграции в формирующемся тимусе, может быть активация Htr1a рецепторов на стромальных элементах локальным серотонином.
Помимо влияния на строму тимуса, серотонин, несомненно, действует и на дифференцирующиеся Т-лимфоциты. Известно, что у взрослых животных серотонин через свой рецептор Htr1a стимулирует пролиферацию активированных Т‑лимфоцитов (Aune et al., 1993; Abdouh et al., 2001). В зрелых Т-клетках, выделенных из селезенки и периферической крови, при активации митогеном повышается уровень экспрессии рецептора Htr1a, что, в свою очередь, усиливает пролиферативный ответ Т-лимфоцитов (Abdouh et al., 2001, 2004). В нашем предыдущем исследовании мы показали, что серотонин аналогичным образом влияет на активированные Т-лимфоциты, выделенные из тимуса половозрелых крыс (Мельникова с соавт., 2012). При активации этих клеток митогеном КонА серотонин усиливает их пролиферацию через индукцию своего рецептора (Abdouh et al., 2001). В противоположность этому, эмбриональные тимоциты, хотя и были способны к усилению пролиферативного ответа на митоген, оказались нечувствительны к серотонину и антагонисту Htr1a рецептора. При этом митоген не влиял не экспрессию Htr1a в Т-лимфоцитах, выделенных из тимуса плодов. Такая разница в эффектах серотонина на дифференцирующиеся тимоциты у взрослых и плодов может быть обусловлена малой долей Т-клеток поздних стадий дифференцировки в тимусе плодов. Таким образом, наши данные свидетельствуют о том, что механизмы регуляции экспрессии рецептора Htr1a в зрелых и незрелых предшественниках Т-лимфоцитов различаются.
Обнаруженный нами факт, что серотонин через Htr1a рецептор способен влиять на экспрессию цитокинов позволяет предположить возможный механизм долгосрочных изменений в функционировании Т-клеточного звена иммунитета. Известно, что цитокины являются основными медиаторами, обеспечивающими коммуникацию между клетками в тимусе. Существенно, что они представляют собой факторы короткодистантного действия и характеризуются определенной пространственной приуроченностью к местам реализации их эффектов. В тимусе цитокины экспрессируются в основном конститутивно. Главным источником цитокинов являются стромальные элементы – эпителиальные клетки тимуса. При этом субкапсулярные и медуллярные эпителиальные клетки отличаются более широким спектром продуцируемых цитокинов по сравнению с кортикальными клетками, тем самым создавая микроокружение, поддерживающее созревание Т-клеток на соответствующих стадиях. Уровень экспрессии цитокиновых генов и выделение самих цитокинов зависит от взаимодействия тимусных эпителиальных клеток и тимоцитов (Yarilin, Belyakov, 2004). В отличие от стромы, тимоциты продуцируют цитокины не конститутивно, а в зависимости от стадии зрелости. У незрелых кортикальных тимоцитов фенотипа CD4+CD8+ способность секретировать цитокины снижена по сравнению с более поздними стадиями дифференцировки (Wolf, Cohen, 1992).
В пренатальном периоде развития экспрессия генов цитокинов, регулирующих пролиферацию и дифференцировку клеток в тимусе, начинается не одновременно. У мышей выделяют группу “ранних” цитокинов, мРНК которых обнаруживается с Э14 (соответствует у крыс приблизительно Э16) – ИЛ-1β, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7 и ИФН-γ. С небольшой задержкой в 2–3 дня начинают экспрессироваться цитокины ИЛ-1α, ИЛ-2, ИЛ-3, GM-CSF (Montgomery, Dallman, 1991). При этом синтез ИЛ-7, стимулирующего пролиферацию, но не дифференцировку Т-лимфоцитов, замедляется к моменту синтеза ИЛ-2, что свидетельствует о вовлечении определенных цитокинов на определенных стадиях развития тимуса. В тимусе взрослых млекопитающих цитокины функционируют в виде “малой цитокиновой сети” и представляют собой факторы, осуществляющие взаимодействие клеток и индуцирующие синтез друг друга (Yarilin, Belyakov, 2004). Подобную функцию они выполняют, вероятно, и в раннем развитии тимуса. В формирующемся тимусе плодов цитокины играют важную роль в образовании клеточных ниш, способных впоследствии поддерживать корректное созревание Т-лимфоцитов (Van Ewijk et al., 2000; Nitta et al., 2011). В нашей работе мы показали, что блокада рецепторов Htr1a (т.е. блокада действия серотонина, синтезируемого в тимусе) снижает экспрессию мРНК и секрецию цитокина ИФН-γ, в то время как активация рецептора Htr1a подавляет синтез мРНК ФНО-α. Известно, что эти плейотропные цитокины участвует в регуляции межклеточных взаимодействий, апоптоза, морфогенеза (Yarilin, Belyakov 2004). Концентрации ИЛ-1α, ИЛ-2 и ИЛ-4 были ниже предела чувствительности метода (менее 40 пг/мл) и в культуральной среде не определялись. В то же время активация Htr1a агонистом усиливала секрецию регуляторного цитокина ИЛ-10, исходный уровень которого в контроле был относительно высоким (300 пг/мл). Антагонист Htr1a снижал синтез мРНК цитокина ИЛ-10. Полученные результаты показывают, что активация или блокада Htr1a рецептора меняет соотношение различных цитокинов в тимусе. Существующие к настоящему времени данные не позволяют нам обсуждать роль каждого цитокина в эмбриогенезе. Тем не менее, правильный баланс цитокинов в формирующемся тимусе крайне важен для корректного органогенеза. С другой стороны, его чувствительность к воздействию внешних факторов делает возможной тонкую подстройку внутритимического микроокружения. Способность серотонина влиять на экспрессию цитокинов может лежать в основе механизмов онтогенетической пластичности иммунной системы. Поскольку внешние и материнские факторы способны изменять уровень серотонина в общей циркуляции у плодов, этот моноамин может выступать связующим звеном между окружающей средой и формирующейся иммунной системой.
На развитие тимуса может влиять серотонин, поступающий из разных источников. Как показали наши последние исследования, у плодов крыс серотонин синтезируется клетками тимуса (Лифанцева с соавт., 2017). Из данных литературы известно, что серотонин циркулирует в крови плодов крыс в значительной концентрации. В отличие от взрослых животных, у плодов в отсутствии гематоэнцефалического барьера ведущую роль в создании физиологически активной концентрации серотонина в крови играет мозг (Насырова с соавт., 2009). Известно, что стресс или воспаление у матери стимулируют синтез серотонина плацентой и повышают уровень серотонина в крови плода (Williams et al., 2017). До настоящего времени внимание ученых было сконцентрировано на возможных последствиях изменения уровня серотонина в крови плодов для развивающегося мозга. Установлено, что при стрессе и воспалении у матери нарушается рост аксонов и созревание ряда отделов головного мозга у плодов, а механизмы таких изменений реализуются через Htr1a рецепторы на нейронах (Balakrishnan et al., 2013; Goeden et al., 2016). Мутации в гене Htr1a ассоциированы с патогенезом шизофрении, биполярного расстройства и ряда других патологий (Gleason et al., 2010; Van Velzen, Toth, 2010). В то же время показано, что у человека некоторые нарушения развития мозга сопровождаются патологиями иммунной системы, например, аутоиммунными расстройствами (Michel et al., 2012). Принято считать, что сопутствующие иммунологические патологии вторичны, обусловлены влиянием нервной системы на формирование иммунной. Поскольку в онтогенезе формирование мозга и тимуса происходит параллельно, наши данные о роли Htr1a в развитии тимуса свидетельствуют о том, что в основе регуляции развития нервной и иммунной систем могут лежать независимые механизмы, опосредованные сходным пулом активных молекул, в частности моноаминами.
Таким образом, в развивающемся тимусе плодов крыс морфогенетический эффект серотонина реализуется при участии Htr1a рецептора, от активации которого зависит экспрессия определенных цитокинов и, как следствие, дифференцировка клеточных элементов стромы и тимоцитов.
Список литературы
Лифанцева Н.В., Конеева Ц.О., Воронежская Е.Е. и др. Экспрессия компонентов серотонинергической системы в развивающемся тимусе крыс // ДАН. 2017. Т. 477. № 6. С. 745–748.
Мельникова В.И., Извольская М.С., Воронова С.Н. и др. Роль серотонина в становлении и функционировании иммунной системы на разных этапах онтогенеза // Известия РАН. Серия биологическая. 2012. № 3. С. 288–295.
Насырова Д.И., Сапронова А.Я., Балбашев А.В. и др. Развитие центральной и периферической серотонин-продуцирующей систем у крыс в онтогенезе // Журн. эволюционной биохимии и физиологии. 2009. Т. 45. № 1. С. 68–74.
Abdouh M., Storring J.M., Riad M. et al. Transcriptional mechanisms for induction of 5-HT1A receptor mRNA and protein in activated B and T lymphocytes // J. Biol. Chem. 2001. V. 276. P. 4382–4388.
Abdouh M., Albert P.R., Drobetsky E. et al. 5-HT1A-mediated promotion of mitogen-activated T and B cell survival and proliferation is associated with increased translocation of NF-kB to the nucleus // Brain, Behavior and Immunity. 2004. V. 18. P. 24–34.
Albert P.R., Lemonde S. 5-HT1A Receptors, gene repression, and depression: Guilt by association // Neuroscientist. 2004. V. 10. № 6. P. 575–593.
Arreola R., Becerril-Villanueva E., Cruz-Fuentes C. et al. Immunomodulatory effects mediated by serotonin // J. Immunol. Res. 2015. V. 2015. Article ID 354957. https://doi.org/10.1155/2015/354957
Anderson G., Lenkinson W.E., Jones T. et al. Establishment and functioning of intrathymic microenvironments // Imm. Rev. 2006. V. 209. P. 10–27.
Aune T.M., McGrath K.M., Sarr T. et al. Expression of 5HT1a receptors on activated human T cells. Regulation of cyclic AMP levels and T cell proliferation by 5-hydroxytryptamine // J. Immunol. 1993. V. 151. P. 1175–1183.
Aune T.M., Golden H.W., McGrath K.M. Inhibitors of serotonin synthesis and antagonists of serotonin 1A receptors inhibit T lymphocyte function in vitro and cell-mediated immunity in vivo // J. Immunol. 1994. V. 153. № 2. P. 489–498.
Baganz N.L., Blakely R.D. A dialogue between the immune system and brain, spoken in the language of serotonin // ACS Chem. Neurosci. 2013. V. 4. № 1. P. 48–63.
Balakrishnan B., Dai H., Janisse J. et al. Maternal endotoxin exposure results in abnormal neuronal architecture in the newborn rabbit // Dev. Neurosci. 2013. V. 35. P. 396–405.
Brelinska R., Malinska A. Homing of hemopoietic precursor cells to the fetal rat thymus: intercellular contact-controlled cell migration and development of the thymic microenvironment // Cell. Tissue Res. 2005. V. 322. P. 393–405.
Cloëz-Tayarani I., Changeux J.P. Nicotine and serotonin in immune regulation and inflammatory processes: a perspective // J. Leukoc. Biol. 2007. V. 81. № 3. P. 599–606.
Cunningham C.A., Teixeiro E., Daniels M.A. FTOC-based analysis of negative selection in T-cell development // Methods in Molecular Biology / Eds. Bosselut R.S., Vacchio M., N.Y.: Humana Press, 2016. V. 1323. P. 141–149.
Gleason G., Liu B., Bruening S. et al. The serotonin 1A receptor gene as a genetic and prenatal maternal environmental factor in anxiety // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 7592–7597.
Goeden N., Velasquez J., Arnold K.A. et al. Maternal inflammation disrupts fetal neurodevelopment via increased placental output of serotonin to the fetal brain // J. Neurosci. 2016. V. 36. P. 6041–6049.
Herr N., Bode C., Duerschmied D. The effects of serotonin in immune cells // Front. Cardiovasc. Med. 2017. V. 4. P. 48.
Kishi T., Okochi T., Tsunoka T. et al. Serotonin 1A receptor gene, schizophrenia and bipolar disorder: an association study and meta-analysis // Psychiatry Res. 2011. V. 185. P. 20–26.
Kroeze W.K., Roth B.L. Molecular biology and genomic organization of G protein-coupled serotonin receptors // The Serotonin Receptors: From Molecular Pharmacology to Human Therapeutics / Ed. Roth B.L. Totowa. Humana Press. 2006. P. 1–38.
Manley N.R. Thymus organogenesis and molecular mechanisms of thymic epithelial cell differentiation // Immunology. 2000. V. 12. P. 421–428.
Meilin A., Shoham J., Schreiber L. et al. The role of thymocytes in regulating thymic epithelial cell growth and function // Scand. J. Immunol. 1995 V. 42. P. 185–190.
Melnikova V.I., Lifantseva N.V., Voronova S.N. et al. Gonadotropin-releasing hormone in regulation of thymic development in rats: Profile of thymic cytokines // Int. J. Mol. Sci. 2019. V. 20. № 16. P. 4033. https://doi.org/10.3390/ijms20164033
Michel M., Schmidt M.J., Mirnics K. Immune system gene dysregulation in autism and schizophrenia // Dev. Neurobiol. 2012. V. 72(10). P. 1277–1287.
Montgomery R.A., Dallman M.J. Analysis of cytokine gene expression during fetal thymic ontogeny using the polymerase chain reaction // J. Immunol. 1991. V. 147. P. 554–560.
Nitta T., Ohigashi I., Nakagawa Y. et al. Cytokine crosstalk for thymic medulla formation // Curr. Op. Immunol. 2011. V. 23. P. 190–197.
Pronina T., Ugrumov M., Adamskaya E. et al. Influence of serotonin on the development and migration of gonadotropin-releasing hormone neurones in rat fetuses // J. Neuroendocrinol. 2003. V. 15. № 6. P. 549–558.
Su D.M., Manley N.R. Hoxa3 and Pax1 transcription factors regulate the ability of fetal thymic epithelial cells to promote thymocyte development // J. Immunol. 2000. V. 164. № 11. P. 5753–5760.
Ugrumov M.V., Trembleau A., Roche D. et al. Monoamine influence on neuropeptide gene expression during ontogenesis // Acta Biol. Hung. 1994. V. 45. P. 441–450.
Van Ewijk W., Hollander G., Terhorst C. et al. Stepwise development of thymic microenvironments in vivo is regulated by thymocyte subsets // Development. 2000. V. 127. № 8. P. 1583–1591.
Van Velzen A., Toth M. Role of maternal 5-HT(1A) receptor in programming offspring emotional and physical development // Genes Brain Behav. 2010. V. 9(8). P. 877–885.
Williams M., Zhang Z., Nancea E. et al. Maternal inflammation results in altered tryptophan metabolism in rabbit placenta and fetal brain // Dev. Neurosci. 2017. V. 39(5). P. 399–412.
Wolf S.S., Cohen A. Expression of cytokines and their receptors by human thymocytes and thymic stromal cells // Immunology. 1992. V. 77. № 3. P. 362–368.
Yarilin A.A., Belyakov I.M. Cytokines in the thymus: production and biological effects // Curr. Med. Chem. 2004. V. 11. № 4. P. 447–464.
Дополнительные материалы отсутствуют.


