Онтогенез, 2020, T. 51, № 5, стр. 351-362
Механизм прорастания пыльцы и рост пыльцевых трубок у можжевельника обыкновенного (Juniperus communis L.) in vitro
М. В. Сурсо a, *, Д. Г. Чухчин b, С. С. Хвиюзов a, С. А. Покрышкин b
a Федеральный исследовательский центр комплексного изучения Арктики РАН
163000 Архангельск, наб. Северной Двины, 23, Россия
b Северный (Арктический) федеральный университет им. М.В. Ломоносова
163000 Архангельск, наб. Северной Двины, 17, Россия
* E-mail: surso@fciarctic.ru
Поступила в редакцию 05.09.2019
После доработки 14.04.2020
Принята к публикации 17.04.2020
Аннотация
Пыльцевые трубки являются популярным объектом при изучении физиолого-биохимических и структурно-динамических процессов в растительных клетках. Большая часть таких исследований посвящена пыльцевым трубкам цветковых растений с коротким репродуктивным циклом. Изучению пыльцевых трубок голосеменных уделяется значительно меньше внимания. В статье рассматриваются процессы гидратации пыльцевых зерен и развитие пыльцевых трубок у можжевельника обыкновенного. Зрелое пыльцевое зерно можжевельника находится в дегидратированном состоянии и содержит не более 2–3% свободной влаги. Регидратация приводит к активации метаболизма, прорастанию пыльцы и росту пыльцевых трубок. Гидратация пыльцевого зерна можжевельника, приводящая к образованию гидрофильной капсулы, вскрытию и сбрасыванию экзины, представляет последовательность событий, контролируемых, вероятнее всего, белками наружной ядерной мембраны микроспоры. В орбикулах пыльцевых зерен можжевельника выявлено необычно большое содержание мом-инозитола, необходимого, вероятно, для быстрой диффузии воды в средний слой интины и образования гидрофильной капсулы. В пыльцевых трубках можжевельника обнаружено два фитостероида: бета-ситостерин и кампестерин, стимулирующих прорастание пыльцы и рост пыльцевых трубок. Везикулы, перемещаясь в гиалоплазме пыльцевой трубки, скапливаются вблизи ее кончика. Везикулы своими мембранами внедряются в мембрану кончика трубки, высвобождая наружу свое содержимое. Наибольшая концентрация митохондрий в растущих пыльцевых трубках наблюдается вблизи обоих ядер и по периферии протопласта, ассоциированного с ядром клетки трубки. В пыльцевых трубках обыкновенного можжевельника между ядром клетки трубки и генеративным ядром велика вероятность существования канала редокс-сигнальной связи. Не исключено, что такая связь может активироваться белками наружных мембран обоих или одного из ядер.
ВВЕДЕНИЕ
Пыльцевые трубки у большинства видов голосеменных служат средством доставки мужских половых клеток к архегониям, за исключением цикадовых и гингко, у которых они выполняют гаусториальную функцию (Козубов и др., 1982). В пыльцевых трубках обычно происходят и заключительные этапы микрогаметогенеза. Прорастание пыльцы, рост и развитие пыльцевых трубок являются важнейшей составляющей половой репродукции растений. Современные представления о развитии пыльцевых трубок базируются, в основном, на результатах исследований пыльцевых трубок покрытосеменных растений in vitro (Krichevsky et al., 2007).
Процессы гидратации пыльцевых зерен, прорастания пыльцы, роста и развития пыльцевых трубок у можжевельника изучены недостаточно. Следует отметить, что механизмы гидратации пыльцы очень сильно зависят от структурных и физиолого-биохимических составляющих пыльцевого зерна, поэтому изучение их роли в процессах прорастания пыльцы у разных видов также имеет большое значение.
Морфология пыльцы и ультраструктура оболочки пыльцевых зерен видов р. Juniperus рассматриваются в работах Д. Саузворза (Southworth, 1986) и Р. Моханти с соавт. (Mohanty et al., 2016), а также в обзоре М.Х. Курманна (Kurmann, 1994). Процессы гидратации пыльцы и механизмы сбрасывания экзины у видов сем. Cupressaceae описаны всего лишь в нескольких экспериментальных работах (Duhoux, 1982; Chichiricco, Pacini, 2008; Takaso, Owens, 2008; Chichiricco et al., 2009; Danti et al., 2011). Обзорных статей, где рассматривались бы особенности роста и развития пыльцевых трубок видов сем. Cupressaceae, также немного (Fernando et al., 2005). Экспериментальных работ, посвященных росту и развитию пыльцевых трубок можжевельника обыкновенного, крайне мало (Diavanshir, Fechner, 1975; Surso, 2018), за исключением серии статей Е. Дьюо (Duhoux, 1972а, 1972b; 1974), существенно восполнивших этот пробел.
В этой статье интерпретируются новые оригинальные экспериментальные данные о процессах гидратации пыльцы и развития пыльцевых трубок у можжевельника обыкновенного.
МАТЕРИАЛЫ И МЕТОДЫ
FTIR-спектроскопия
Относительное содержание групп химических соединений в пыльцевых трубках, пыльце и в орбикулах можжевельника изучали с использованием FTIR-спектроскопии методом нарушенного полного внутреннего отражения (НПВО). Образец пыльцевых трубок можжевельника для анализа готовили следующим образом. После проращивания на агаровой среде с 5%-ной (w/v) сахарозой в течение 7 дней в термостате при 26.5°C пыльцевые трубки смывали с поверхности геля dH2O. Суспензию осаждали центрифугированием при 1.5 тыс. об./мин. Пеллеты трижды промывали в dH2O, суспензию каждый раз центрифугировали при 1.5 тыс. об./мин. Образец пыльцевых трубок замораживали при –80°C и лиофильно высушивали. Образец пыльцы, очищенной от примесей просеиванием через мелкое сито, использовался для анализа без дополнительной обработки. Образец орбикул готовился следующим образом. Водная суспензия пыльцы просеивалась на виброшейкере Retsch через сито с диаметром отверстий 20 мкм. Прошедшая через сито фракция центрифугировалась 10 мин при 4200 об./мин. Пеллеты замораживались при –80°C и высушивались лиофильно.
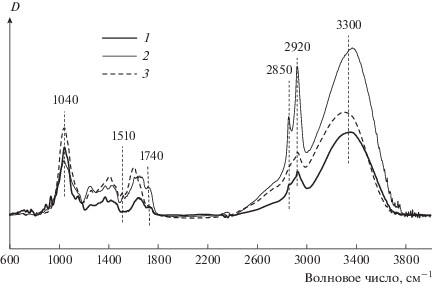
ИК-спектры записывались на ИК-Фурье-спектрофотометре IR Prestige 21 (Shimadzu, Япония) с приставкой НПВО MIRacle с призмой ZnSe (Pike, США). Полученные значения коэффициентов пропускания преобразовывались в единицы оптической плотности обработкой полученных спектров функцией АТР-коррекции с помощью программы IR Solution. В табл. 1 приведено отнесение характеристических полос поглощения к соответствующим связям.
Таблица 1.
Характеристика полос поглощения в ИК-спектрах
| Положение полосы, см–1 | Отнесение полос поглощения |
|---|---|
| 3200–3600 | Валентные колебания гидроксильных групп, вовлеченных в водородную связь |
| 2920, 2875–2850 | Валентные колебания связей С–Н в метильных и метиленовых группах |
| 1735–1740 | Валентные колебания карбонильных групп, несопряженных кетонов и карбоксильных групп |
| 1605, 1512, 1430 | Скелетные колебания ароматического кольца |
| 1650–1630 | Валентные колебания связей О–Н связанной воды |
| 1030, 1060, 1100 | Валентные колебания С–О связи полисахаридов |
| 855, 815, 750–770 (плечо) | Внеплоскостные деформационные колебания С–Н связи ароматического кольца |
С целью количественной оценки компонентного состава исследуемых образцов были рассчитаны величины относительной оптической плотности (К) с использованием внутреннего стандарта. Поскольку во всех исследованных образцах углеводы являются основным компонентом, в качестве внутреннего стандарта выбрана интенсивная полоса поглощения 3300 см–1, соответствующая колебаниям гидроксильных групп. Оптические плотности определены относительно базовой линии, которую проводили по волновым числам 4000, 3800, 2400, 1800, 800, 600 см–1 с помощью программы IRSolution. Величины K рассчитывались по формуле:
где Dк – оптическая плотность характеристической полосы поглощения компонента, Dст – оптическая плотность внутреннего стандарта 3300 см–1.Пиролиз
Для пиролиза образцы готовились так же, как и для FTIR-спектроскопии. Для анализа бралась навеска 0.11–0.35 мг. Образец подвергался пиролитическому разложению с использованием пиролизера EGA/PY-3030D (Frontier Lab) с криоловушкой. Анализ продуктов пиролиза проб проводился методом газовой хромато-масс-спектрометрии на приборе GCMS-QP2010 Plus (Shimadzu, Япония). Условия пиролиза: газовая среда – гелий, температура пиролиза 600°С, криофокусирование продуктов пиролиза в течение одной минуты, температура криоловушки –197°С. Разделение: колонка капиллярная HP-5MS, диаметр 0.25 мм, толщина неподвижной фазы 0.25 мкм, длина колонки 30 м. Ввод пробы делением потока 1 : 500, температура устройства ввода 300°С, газ-носитель – гелий, управление потоком газа – постоянное давление, поток через колонку 1 мл/мин, начальная температура термостата 40°С, подъем температуры со скоростью 10°С/мин, конечная температура термостата 350°С, изотерма 10 мин, температура устройства сопряжения 300°С, температура ионного источника 230°С, энергия ионизации 70 эВ. Настройка масс-детектора: температура интерфейса 280°С, температура ионного источника 230°С. Режим работы масс-детектора – TIC (сканирование масс-спектра), диапазон сканирования масс 30–600 Да. Напряжения на ионном источнике и детекторе – по результатам автотюнинга. Напряжение на детекторе 0.7 кВ. Интегрирование автоматическое, корректировка результатов интегрирования ручная. Библиотечный поиск по библиотекам масс-спектров NIST-11/Wiley-10.
Флуоресцентная микроскопия
Лизосомы в гидратированной пыльце и в пыльцевых трубках окрашивали лизосомальным окрашивающим реагентом Abcam-Red/Cytopainter (ab112137), являющимся флуорогенным зондом для маркировки лизосом живых клеток. Митохондрии в пыльцевых трубках окрашивали митохондриальным окрашивающим реагентом Abcam-Red/Cytopainter (ab176832), являющимся флуорогенным зондом для маркировки митохондрий живых клеток. Окрашивание препаратов живых пыльцевых трубок и пыльцы выполняли в соответствии с протоколами компании-производителя. Результаты исследования визуализировали на флуоресцентном микроскопе Altami Lum 1LED (светофильтр G, 460–550 нм).
Общий пул АФК выявляли с помощью флуоресцентного красителя DCF-DA. Окрашивание нативных препаратов пыльцы и пыльцевых трубок проводили в течение 1.5–2 ч при 26.5°C в темноте. Конечная концентрация красителя в суспензии составляла 50 мкМ. Окрашенные препараты трижды промывались в dH2O и просматривались на флуоресцентном микроскопе Altami Lum 1LED (светофильтр B, 420–485 нм).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенности морфологии пыльцевых зерен и прорастание пыльцы можжевельника
У можжевельника обыкновенного пыльцевое зерно шаровидное, диаметром около 25 мкм, с одной функциональной порой, прикрытой крышечкой (рис. 1а), которая теряется при гидратации.
Рис. 1
– Морфология пыльцевых зерен и орбикул можжевельника обыкновенного. а – вид пыльцевого зерна с экватора, видны крышечки, прикрывающие функциональные поры (показаны стрелками), поверхность экзины усеяна многочисленными орбикулами, б – вид гидратированного пыльцевого зерна с полюса, видна открывшаяся функциональная пора и перфорации, образовавшиеся на поверхности экзины в результате отрывания орбикул (показаны стрелками), в – внешний вид орбикул. Взято с сокращениями из: Surso, 2018 (с любезного разрешения Arctic Environmental Research).

Поверхность экзины хаотично усеяна многочисленными орбикулами, часть которых при гидратации отрывается, оставляя после себя крошечные перфорации (рис. 1б). Орбикулы диаметром около 150 нм, шаровидные, с “шипами” пирамидальной формы (рис. 1в). На микрофотографиях, полученных с помощью TEM, экзина у видов р. Juniperus дифференцирована на два слоя: внутренний, эндоэкзину, и внешний, эктоэкзину. В интине различимы три электронно-плотных слоя (Mohanty et al., 2016). Пыльцевое зерно можжевельника одноклеточное, т.е. представляет собой не проросшую в микрогаметофит микроспору. Ядро окружено плотным кольцом амилопластов, которое формируется сразу после распада тетрад, когда микроспоры находятся еще внутри микроспорангиев.
Процесс прорастания пыльцы можжевельника по результатам визуальных наблюдений описан в ряде работ (Duhoux, 1982; Surso, 2018). При гидратации пыльцевого зерна вода всасывается между внутренней и наружной интиной, образуя гидрофильную капсулу, которая быстро увеличивается в объеме и под воздействием тургора выходит наружу через функциональную пору вместе с микроспорой, раздвигая экзину на две равные створки и сбрасывая ее с себя. Прорастание микроспоры в микрогаметофит происходит, когда микроспора находится внутри капсулы. Проксимальный кончик растущей пыльцевой трубки проходит сквозь стенку гидрофильной капсулы, не нарушая ее целостности. Генеративное ядро остается в дистальном кончике трубки, погруженном в капсулу, ядро клетки трубки вместе с ассоциированным протопластом постоянно перемещается в сторону растущего кончика, все удаляясь от генеративного ядра. Гидрофильная капсула сохраняется в течение всего времени проращивания пыльцы in vitro и в течение всей жизни трубки in vivo, включая период зимнего покоя.
Результаты ИК Фурье-спектроскопии
ИК-спектры пыльцы, пыльцевых трубок и орбикул имеют схожий вид и характеризуются набором полос поглощения c близкими значениями частот, имеющими разную интенсивность (рис. 2). С целью определения количественных различий компонентного состава образцов рассчитаны величины относительных оптических плотностей, которые представлены в табл. 2.
Таблица 2.
Величины относительной оптической плотности
| Образец | Величина относительной оптической плотности | ||||
|---|---|---|---|---|---|
| 1047 | 1512 | 1740 | 2850 | 2920 | |
| Трубки | 0.82 | 0.05 | 0.09 | 0.37 | 0.52 |
| Пыльца | 0.33 | 0.12 | 0.17 | 0.59 | 0.89 |
| Орбикулы | 0.85 | 0.21 | 0.07 | 0.46 | 0.61 |
В пыльцевых трубках по сравнению с пыльцой наблюдается относительно большее содержание углеводов, характеризуемых величиной K1040, за счет наличия остаточной сахарозы и вновь синтезированного крахмала, меньшее содержание ароматических веществ (K1510), большее количество соединений с неполярными С–Н связями, таких как липиды, углеводы, белки, РНК, ДНК (K2920 и K2850), что свидетельствует о большей гидрофобности пыльцевых трубок. В орбикулах, по сравнению с пыльцой, отмечено большее содержание углеводов (K1040), меньшее количество соединений, содержащих карбонильные С=О группы: белки, РНК, ДНК, липиды (K1740), меньшее количество соединений с С–Н связями (K2920 и K2850), что характеризует их большую гидрофильность. Образец орбикул характеризуется наибольшим содержанием ароматических соединений (K1510), к которым можно отнести ароматические аминокислоты и углеводороды. Наименьшее количество ароматических веществ отмечено в пыльцевых трубках. Кроме того, на ИК-спектрах пыльцы и орбикул присутствует полоса 1600 см–1, соответствующая колебаниям ароматических структур, для пыльцевых трубок интенсивность данной полосы оказалась незначительна, что подтверждает наименьшее содержание в них ароматических соединений. Таким образом, методом ИК-спектроскопии выявлены различия в количественном составе химических соединений в пыльце, пыльцевых трубках и в орбикулах у можжевельника обыкновенного.
Результаты пиролиза. Гормоны роста в пыльцевых трубках можжевельника. О природе орбикул
В пыльцевых трубках можжевельника обнаружено два фитостероида: бета-ситостерин и кампестерин, являющихся стероидными спиртами. Эти стероиды регулируют эластичность и проницаемость мембран, полярный рост клеток, а также инициируют активность мембрано-ассоциированных ферментов, участвуют в гормональном и клеточном сигналинге и связаны с иммунитетом растений к патогенам (Saeidnia et al., 2014; Сулкарнаева, 2016). По своей химической структуре бета-ситостерин аналогичен холестерину, а кампестерин участвует в синтезе брассиностероидов, являющихся фитогормонами. В пыльце можжевельника и бета-ситостерин, и кампестерин отсутствуют, и появляются только в пыльцевых трубках, в период их активного роста, поэтому их с большой долей вероятности также можно рассматривать в качестве гормонов роста. Относительное содержание бета-ситостерина в пыльцевых трубках можжевельника составило 0.31%, кампестерина – 0.11%. Добавление в питательную среду стероидных гормонов стимулирует прорастание пыльцы и рост пыльцевых трубок (Ylstra et al., 1995). В пыльце видов р. Pinus (P. sylvestris L., P. nigra Ar.) в небольших количествах были обнаружены стероиды животного происхождения (Janeczko, Skoczowski, 2005). Следует отметить, что в образцах пыльцы, собранной в полевых условиях, даже после очень тщательного просеивания всегда присутствует инвазивный материал беспозвоночных животных и продуктов их жизнедеятельности. Это обстоятельство необходимо учитывать при анализе экспериментальных данных.
В орбикулах пыльцевых зерен у можжевельника выявлено необычно большое (почти 14%) содержание мом-инозитола (C7H14O6). Этот моносахарид с шестью гидроксильными группами часто содержится во многих лекарственных растениях (Sunita, Manju, 2017; El-Awadi et al., 2018) и обладает выраженными фармакологическими и антисептическими свойствами. В пыльце и трубках мом-инозитол также присутствует, но в гораздо меньших количествах. Следует отметить, что в образцах трубок и, тем более, пыльцы все еще сохраняется значительное количество орбикул, этим, вероятно, и объясняется присутствие мом-инозитола в этих образцах.
В пыльце выявлено большое содержание (6.92%) алифатических углеводородов, являющихся продуктами пиролиза жиров и восков, а также каротиноидов, входящих в состав спорополленина. Следует отметить, что в орбикулах такие соединения не обнаружены. Во всех исследованных образцах отмечено наличие лигнина и углеводов. Особенно большое количество углеводов (11.79%) содержится в пыльцевых трубках, что обусловлено, главным образом, синтезом в их протопластах крахмала, а также полисахаридов, входящих в состав оболочек трубок. Продукты пиролиза белков, нуклеиновых кислот и аминокислот обнаружены во всех исследованных образцах. При этом больше всего белков, аминокислот и, возможно, нуклеиновых кислот, содержится в орбикулах (12.89%), меньше всего – в пыльце (2.45%), в трубках их общее содержание составляет 3.48%.
Появление орбикул на поверхности экзины пыльцевых зерен чаще всего связано с образованием в клетках выстилающего слоя микроспорангиев специфичных структур, впервые описанных в 1865 г. Розановым, и вновь открытых в 1927 г. Убишем, названных именем последнего. Гипотетическая схема формирования и транспорта телец Убиша у голосеменных была предложена Г.М. Козубовым (1974). Функциональное значение их все еще во многом остается неясным. Иногда говорится о возможном участии их в синтезе спорополленина и в переносе последнего на поверхность примэкзины. Однако, отсутствие в орбикулах у можжевельника восков, жиров, каротиноидов и высокое содержание в них мом-инозитола свидетельствует, что это, скорее всего, не так.
Происхождение орбикул также не вполне понятно. Высказанное нами ранее предположение о вирусной природе орбикул не подтвердилось. Вероятнее всего, появление предшественников телец Убиша обусловлено синтезом мом-инозитола в цистернах эндоплазматического ретикулума или в вакуолях комплекса Гольджи в клетках тапетума. Тогда, возможно, орбикулы – это всего лишь застывшая масса мом-инозитола своеобразной формы и определенных размеров, “вплавленная” в примэкзину пыльцевого зерна и вмещающая в себя огромное количество белков, аминокислот и ароматических углеводородов. Косвенно это подтверждается тем, что при лиофильной сушке образец орбикул многократно увеличивается в объеме, приобретая пенистую структуру. Одним из простых объяснений функционала орбикул может быть участие их в процессе гидратации пыльцевого зерна. У можжевельника обыкновенного образование гидрофильной капсулы при гидратации пыльцевого зерна происходит в течение нескольких секунд за счет быстрого всасывания воды в пространство между внутренней и наружной интиной. Для вскрытия экзины двумя равными створками необходимо, чтобы давление стенки гидрофильной капсулы, образованной наружной интиной, на внутреннюю поверхность экзины, было бы равномерным и достаточным. “Быстрый” осмос наиболее вероятен за счет гликолитического расщепления мом-инозитола в орбикулах, частично внедрившихся в средний слой интины. Таким образом, возможно, орбикулы – это своего рода насосы, способствующие быстрому всасыванию воды через дистальную апертуру (и, возможно, через перфорации) в средний слой интины.
Локализация лизосом и митохондрий в пыльцевых трубках можжевельника
Транспорт везикул и экзоцитоз необходимы для роста и развития пыльцевых трубок, осуществляющих гетеротрофный тип питания (Pettitt, 1985; Camacho, Malho, 2003; Wang et al., 2006). Митохондрии, являющиеся энергетическими центрами, концентрируются внутри клетки там, где возникает необходимость повышенного потребления энергии, перемещаясь, как и везикулы, вдоль микрофиламентов цитоскелета. Изучение локализации и транспорта лизосом и митохондрий внутри тела пыльцевой трубки важно для понимания процессов роста пыльцевых трубок.
В гидратированной пыльце лизосомы локализованы вблизи внутренней поверхности оболочки пыльцевого зерна (рис. 3б).
Рис. 3.
Локализация лизосом (а–е) и митохондрий (ж, з) в прорастающей пыльце (а, б) и в пыльцевых трубках (в–з) можжевельника (слева – проходящий свет, светлое поле, справа – то же, флуоресценция). а–е – окрашивание лизосомальным окрашивающим реагентом Abcam-Red/Cytopainter, ж, з – митохондриальным окрашивающим реагентом Abcam-Red/Cytopainter. PG – пыльцевое зерно, HC – гидрофильная капсула, DA – дистальная апертура (функциональная пора), TCN – ядро клетки трубки, GN – генеративное ядро, EC – экзоцитоз.
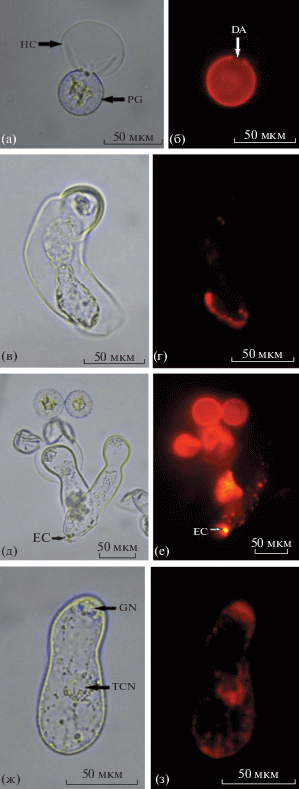
В пыльцевых трубках везикулы распределены по всему объему гиалоплазмы более или менее равномерно. Однако значительная часть везикул, особенно у активно растущих трубок, скапливается вблизи кончика трубки (рис. 3г). Скопившиеся в гиалоплазме вблизи растущего кончика трубки везикулы своими мембранами внедряются в мембрану кончика трубки, встраивая в нее рецепторные, транспортные белки и липиды, а также высвобождая наружу гидролитические ферменты, сигнальные белки и пептидные гормоны (Battey et al., 1999; Parton et al., 2001; Šamaj et al., 2004). На рис. 3е эти выделения снаружи растущего кончика трубки видны в виде ярко светящихся маленьких шариков. Митохондрии сконцентрированы вокруг обоих ядер и по периферии протопласта (рис. 3з).
Локализация АФК в прорастающей пыльце и в пыльцевых трубках. Существует ли сигнальная связь между ядром клетки трубки и генеративным ядром?
АФК играют важную роль во многих физиолого-биохимических процессах, происходящих в растительных клетках. Однако избыток АФК, обладающих повышенной реакционной способностью, или снижение уровня антиоксидантов могут вызывать окисление биомолекул (липидов клеточных мембран, белков, углеводов, нуклеиновых кислот), приводя к необратимым повреждениям клеток (Gomes et al., 2005). Важное значение АФК в регуляции роста растений подтверждено результатами многих исследований. Однако их роль в репродуктивной деятельности растений во многом остается не ясной (Смирнова, 2009; Максимов, 2019).
Зрелое пыльцевое зерно можжевельника находится в дегидратированном состоянии и содержит не более 2–3% свободной влаги. Регидратация приводит к активации метаболизма (Брейгина и др., 2012; Ермаков и др., 2016) и началу процесса, который принято называть “прорастанием пыльцы”. По увеличению или уменьшению концентрации АФК (усилению или ослаблению флуоресценции) можно проследить последовательность изменений, происходящих в пыльцевом зерне и в пыльцевых трубках.
Наши наблюдения показали, что гидратация пыльцевого зерна можжевельника не является просто осмотической диффузией, а представляет цепь событий, контролируемых, вероятнее всего, белками внешней мембраны ядерной оболочки. У гидратированных пыльцевых зерен до начала образования гидрофильной капсулы при окрашивании DCF-DA относительно слабая флуоресценция наблюдается лишь в оболочке пыльцевого зерна (рис. 4б, внизу слева), ядра почти не флуоресцируют. В момент начала выхода гидрофильной капсулы через функциональную пору наружу происходит яркая флуоресцентная вспышка на поверхности ядра (рис. 4г, вверху). Несколько менее яркая флуоресценция ядер длится до того момента, пока гидрофильная капсула не сбросит экзину. В этот короткий промежуток времени, длящийся несколько секунд, наблюдается также флуоресценция интины, более яркая по периметру дистальной апертуры, в мембране самой апертуры флуоресценции не наблюдается (рис. 4б, вверху). К моменту, когда гидрофильная капсула почти целиком выходит наружу, но микроспора все еще остается внутри экзины, флуоресценция ядер и интины начинает затухать (рис. 4г, внизу). Слабая флуоресценция ядер сохраняется и по завершении процесса гидратации, после сбрасывания экзины (рис. 4б, справа). Следует отметить, что в течение всего процесса гидратации пыльцевого зерна можжевельника ни в гидрофильной капсуле, ни в формирующей ее оболочку наружной интине флуоресценции не наблюдается. Тогда, возможно, через внутреннюю интину в орбикулы осуществляется активный транспорт АТФ и гликолитических ферментов, что вписывается в нашу концепцию функционала орбикул и роли мом-инозитола в процессе гидратации пыльцевого зерна можжевельника. У только что образовавшихся после митоза ядра микроспоры двухклеточных микрогаметофитов флуоресценция обоих ядер и протопласта также сохраняется, очень слабая флуоресценция наблюдается в оболочке проксимального кончика формирующейся трубки и в клеточной перегородке (рис. 4е). По мере роста пыльцевой трубки флуоресценция ядер и протопласта ослабевает (рис. 4з).
Рис. 4.
Выявление АФК в гидратированных пыльцевых зернах и в пыльцевых трубках можжевельника с помощью флуоресцентного красителя DCF-DA (слева – проходящий свет, светлое поле, справа – то же, флуоресценция). а, б – слева внизу – при гидратации пыльцевого зерна образования гидрофильной капсулы не произошло, слева вверху – гидрофильная капсула выходит через функциональную пору, микроспора все еще остается внутри экзины, справа – гидрофильная капсула целиком вышла наружу, раздвинув створки экзины, одноклеточная микроспора в центре гидрофильной капсулы; в – вверху – гидрофильная капсула только что начала выходить из пыльцевого зерна; г – вверху – то же спустя несколько секунд; в, г – внизу – гидрофильная капсула почти полностью вышла наружу, но микроспора все еще остается внутри экзины; д, е – пыльцевая трубка (двухклеточный микрогаметофит) туфелькообразной формы все еще целиком вмещается в гидрофильную капсулу; ж, з – сформировавшаяся пыльцевая трубка: генеративное ядро в дистальном кончике трубки прижимается к одной из ее боковых стенок, ядро клетки трубки с ассоциированным протопластом перемещается ближе к проксимальному кончику растущей трубки. PG – пыльцевое зерно, MSP – микроспора, EX – экзина, HC – гидрофильная капсула, PGN – ядро пыльцевого зерна, MN – ядро микроспоры, DA – дистальная апертура (функциональная пора), PT – пыльцевая трубка, TCN – ядро клетки трубки, GN – генеративное ядро.

Вопрос ядерных взаимосвязей в пыльцевых трубках растений затрагивался не раз (Southworth, 2001). Сложная морфологическая связь между генеративной клеткой и вегетативным ядром в прорастающей пыльце у покрытосеменных впервые была установлена на примере видов р. Rhododendron путем трехмерной реконструкции пыльцевых трубок по ультратонким срезам (Kaul et al., 1987). В пыльцевых трубках голосеменных цитоплазматический тяж между ядрами был описан для Taxus yunnanensis (Wang et al., 2008). В пыльцевых трубках можжевельника обыкновенного морфологические структуры, которые могли бы связывать оба ядра, не просматриваются.
На рис. 5 показана живая пыльцевая трубка можжевельника, окрашенная DCF-DA. Протопласт ассоциирован с ядром клетки трубки, генеративное ядро лишено собственного протопласта, что характерно для пыльцевых трубок можжевельника в большинстве случаев. При окрашивании пыльцевых трубок DCF-DA проявляется яркая устойчивая флуоресценция АФК в виде узкой неравномерно светящейся на разном протяжении дорожки, тянущейся в теле трубки от ядра к ядру сквозь протопласт и гиалоплазму и заканчивающейся (или начинающейся?) от поверхности одного из ядер. На рис. 5 флуоресценция оболочки слабо выражена только у генеративного ядра. Приведенное изображение не является артефактом или случайным событием, поскольку схожие картины наблюдались и в других трубках.
Рис. 5.
Характер флуоресценции свидетельствует о возможном существовании канала редокс-сигнальной связи между ядром клетки трубки и генеративным ядром в пыльцевой трубке можжевельника (окрашивание DCF-DA). TCN – ядро клетки трубки, GN – генеративное ядро.

В последнее время роль АФК в биологических процессах, в том числе редокс-сигналинг, широко обсуждаются. Функции АФК в передаче сигналов внутри растительной клетки трактуются неоднозначно. Неясно, являются ли АФК мессенджерами, индуцирующими новые специфичные сигнальные системы, или регуляторами, управляющими известными сигнальными путями. Потенциальные белки-мишени не обладают специфичностью ни к одной из форм АФК, однако H2O2 соответствует ряду критериев вторичных мессенджеров (Прадедова и др., 2017). Согласно концепции компартментализации, “колокализация многокомпонентных сигнальных комплексов осуществляется через белковые каркасы, которые позволяют достичь большей специфичности, чем в случае простой диффузии того же набора участников процесса” (Белоусов и др., 2013). Установлено, что АФК, продуцируемые мембранной НАДФH-оксидазой (NOX), активируют Ca2+-каналы (Foreman et al., 2003; Moonshausen et al., 2007). Считается, что основную роль в функционировании АФК-зависимых сигнальных систем растительной клетки играют редокс-регуляторы, протеинкиназы и протеинфосфатазы, а также факторы транскрипции (Октябрьский, Смирнова, 2007; Креславский и др., 2012) и, возможно, баланс редокс-пар (Билан и др., 2015). Роль актинового цитоскелета в АФК-сигналинге можно, вероятно, с определенными оговорками, рассматривать в качестве фактора компартментализации.
Отсутствие морфологически выраженной связи между ядрами в пыльцевой трубке можжевельника не означает отсутствие между ними связи как таковой. Эта связь жизненно необходима для полноценного функционирования пыльцевой трубки в онтогенезе, когда ядро клетки трубки все более отдаляется (до определенного момента) от ее генеративного ядра. Феномен, показанный на рис. 5, на наш взгляд, свидетельствует о том, что в пыльцевых трубках обыкновенного можжевельника на каких-то этапах их развития между ядром клетки трубки и генеративным ядром нельзя исключить возможного существования редокс-сигнальной связи. Не исключено, что такая связь может активироваться белками ядерных мембран. Это косвенно подтверждается тем, что в пыльцевых трубках можжевельника методами MALDI нами обнаружен белок серин/треонин-протеинкиназа, относящийся к семейству фосфатидилинозитол 3-киназ-родственных протеинов киназы, а также ряд белков, принадлежащих к суперсемейству с активностью фосфогидролазы (HD домен-содержащий протеин, металл-зависимая фосфогидролаза), которые функционально способны участвовать в работе АФК-зависимых сигнальных систем.
ЗАКЛЮЧЕНИЕ
Пыльца, орбикулы на поверхности экзины пыльцевых зерен и пыльцевые трубки у можжевельника обыкновенного различаются по химическому составу. В пыльцевых трубках можжевельника обнаружено два фитостероида: бета-ситостерин и кампестерин, стимулирующих прорастание пыльцы и рост пыльцевых трубок. В орбикулах, в отличие от пыльцы, отсутствуют воска, жиры и каротиноиды и содержится большое количество белков, аминокислот и ароматических углеводородов. В орбикулах выявлено необычно большое содержание мом-инозитола, играющего, по-видимому, важную роль в процессе гидратации пыльцы. Гидратация пыльцевого зерна можжевельника не является просто осмотической диффузией воды через дистальную апертуру, а представляет цепь событий, контролируемых, вероятнее всего, белками наружной ядерной мембраны микроспоры. В гидратированной пыльце лизосомы локализованы вблизи внутренней поверхности оболочки пыльцевого зерна. В пыльцевых трубках везикулы распределены по всему объему гиалоплазмы более или менее равномерно. Значительная часть везикул, особенно у активно растущих трубок, скапливается вблизи кончика трубки. Выделение части внутреннего содержимого везикул во внешнюю среду обеспечивается механизмом экзоцитоза. Митохондрии сконцентрированы вокруг обоих ядер и по периферии протопласта. Характер флуоресценции пыльцевых трубок можжевельника, окрашенных DCF-DA, свидетельствует о возможном существовании канала редокс-сигнальной связи между ядром клетки трубки и генеративным ядром.
Список литературы
Белоусов В.В., Ениколопов Г.Н., Мишина Н.М. Компартментализация передачи сигналов, опосредованных активными формами кислорода // Биоорганическая химия. 2013. Т. 39. № 4. С. 383–399.
Билан Д.С., Шохина А.Г., Лукьянов С.А., Белоусов В.В. Основные редокс-пары клетки // Биоорганическая химия. 2015. Т. 41. № 4. С. 385–402.
Брейгина М.А., Матвеева Н.П., Андреюк Д.С., Ермаков И.П. Трансмембранный перенос К+ и Сl– в процессе активации пыльцевого зерна in vivo и in vitro // Онтогенез. 2012. Т. 43. № 2. С. 103–112.
Ермаков И.П., Матвеева Н.П., Брейгина М.А. Физиология гаплоидного поколения семенных растений. М.: Товарищество научных изданий КМК, 2016. 276 с.
Козубов Г.М. Биология плодоношения хвойных на Севере. Л.: Наука, 1974. 135 с.
Козубов Г.М., Тренин В.В., Тихова М.А., Кондратьева В.П. Репродуктивные структуры голосеменных (сравнительное описание). Л.: Наука (Ленингр. отд-е), 1982. 104 с.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов В.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. № 2. С. 163–178.
Максимов Н.М. Регуляторная роль активных форм кислорода в прорастании мужского гаметофита семенных растений // Автореф. дис. … канд. биол. наук. М.: МГУ, 2019. 30 с.
Октябрьский О.Н., Смирнова Г.В. Редокс-регуляция клеточных функций (Обзор) // Биохимия. 2007. Т. 72. Вып. 2. С. 158–174.
Прадедова Е.В., Нимаева О.Д., Саляев Р.К. Редокс-процессы в биологических системах // Физиология растений. 2017. Т. 64. № 6. С. 433–445.
Смирнова А.В. Роль активных форм кислорода в прорастании пыльцевого зерна. Автореф. дис. … канд. биол. наук. М.: МГУ, 2009. 27 с.
Сулкарнаева А.Г. Состав стеринов и активность генов С24-стерин метилтрансферазы Triticum aestivum при стрессе. Дис. … канд. биол. наук. Казань, 2016. 157 с.
Battey N.H., James N.C., Greenland A.J., Brownlee C. Exocytosis and endocytosis // The Plant Cell. 1999. № 11. P. 643–660.
Camacho L., Malho R. Endo/exocytosis in the pollen tube apex is differentially regulated by Ca2+ and GTPases // J. Experimental Botany. 2003. № 54. P. 83–92.
Chichiricco G., Pacini E. Cupressus arizonica pollen wall zonation and in vitro hydration // Plant Syst Evol. 2008. № 270. P. 231–242.
Chichiricco G., Spano L., Torraca G. et al. Hydration, sporoderm breaking and germination of Cupressus arizonica pollen // Plant Biol. 2009. V. 11. № 3. P. 359–368.
Danti R., Della Rocca G., Calamassi R., Mori B., Mariotti Lippi M. Insights into a hydration regulating system in Cupressus pollen grains // Ann. Bot. 2011. V. 108. P. 299–306.
Diavanshir K., Fechner G.H. Pollen germination and pollen tube growth of Juniperus from autumn and winter collections // Silvae Genet. 1975. № 24. P. 26–29.
Duhoux E. Structural growth of the wall of the pollen grain of Juniperus communis (Cupressaceae), growth in vitro during the hydratation phase // Comptes Rendus Des Seanses Hebdomadaires De L’Academie Des Sciences, France, D. 1972a. V. 274. № 20. P. 2767–2770.
Duhoux E. Formation of the cell wall of the pollen tube during germination of pollen in Juniperus communis growth in vitro // Comptes Rendus Des Seanses Hebdomadaires De L’Academie Des Sciences, France, D. 1972b. V. 274. № 24. P. 3238–3241.
Duhoux E. The division of the reproductive cell and the release of its products in the pollen tubes of Juniperus communis and Cupressus arizonica // Revue Generale De Botanique. 1974. V. 81. № 962/963/964. P. 193–204.
Duhoux E. Mechanism of exine rupture in hydrated taxoid type of pollen // Grana. 1982. V. 21. № 1. P. 1–7.
El-Awadi M.E., Shalaby M.A.F., Ahmed H.F.S., Abd El-Hamid E.M., Abd El-Azem F.S., Moustafa S.M.A. Phytochemical constituents of methanol and aqueous extracts of Lupinus termis L. seeds using GC-MS // Middle East Journal of Applied Sciences. 2018. V. 8. № 1. P. 272–286.
Fernando D.D., Lazzaro M.D., Owens J.N. Growth and development of conifer pollen tubes // Sex Plant Repr. 2005. V. 18. № 4. P. 149–162.
Foreman J., Demidchik V., Bothwell J.H.F., Mylona P., Miedema H., Torres M.A., Linstead P., Costa S., Brownlee C., Jones J.D.G., Davies J.M., Dolan L. Reactive oxygen species produced by NADPH oxidase regulate plant cell growth // Nature. 2003. V. 422. P. 442–446.
Gomes A., Fernandes E., Lima J.L.F.C. Fluorescence probes used for detection of reactive oxygen species // J. Biochemical and Biophysical Methods. 2005. V. 65. P. 45–80.
Kaul V., Theunis C.H., Palser B.F., Knox R.B., Williams E.G. Association of the generative cell and vegetative nucleus in pollen tubes of Rhododendron // Ann. Bot. (USA). 1987. V. 59. № 2. P. 227–235.
Krichevsky A., Kozlovsky S.V., Tian G.-W., Chen M.-H., Zaltsman A., Citovsky V. How pollen tubes grow (Review) // Developmental Biology. 2007. V. 303. P. 405–420.
Kurmann M.H. Pollen morphology and ultrastructure in the Cupressaceae // Acta. Botanica. Gallica. 1994. V. 141. P. 141–147.
Mohanty R.P., Buchheim M.A., Portman R., Levetin E. Molecular and ultrastructural detection of plastids in Juniperus (Cupressaceae) pollen // Phytologia. 2016. V. 98. № 4. P. 298–310.
Moonshausen G.B., Bibikova T.N., Messerli M.A., Gilroy S. Oscillations in extracellular pH and reactive oxygen species modulate tip growth of Arabidopsis root hairs // Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 52. P. 20996–21001.
Janeczko A., Skoczowski A. Mammalian sex hormones in plants // Folia Histochemica et Cytobiologica. 2005. V. 43. № 2. P. 71–79.
Parton R.M., Fisher-Parton S., Watahiki M.K., Trewavas A.J. Dynamics of the apical vesicle accumulation and the rate of growth are related in individual pollen tubes // J. Cell Science. 2001. № 114. P. 2685–2695.
Pettitt J.M. Pollen tube development and characteristics of the protein emission in conifers // Ann. Bot. 1985. V. 56. № 3. P. 379–397.
Saeidnia S., Manayi A., Gohari A.R., Abdollahi M. The story of beta-sitosterol – A review // European Journal of Medicinal Plants. 2014. V. 4. № 5. P. 590–609.
Šamaj J., Baluška F., Voigt B., Schlicht M., Volkmann D., Menzel D. Endocytosis, actin cytoskeleton, and signaling // Plant Physiology. 2004. № 135. P. 1150–1161.
Southworth D. Pollen exine substructure. III. Juniperus communis // Can. J. Bot. 1986. V. 64. № 5. P. 983–987.
Southworth D. Sperm and generative cell (Isolation and manipulation). // Current Trends in the Embryology of Angiosperms / Eds. Bhojwani S.S., Soh W.Y. Springer, Dordrecht, 2001. P. 17–32.
Sunita A., Manju S. Phytochemical examination and GC-MS analysis of methanol and ethyl-acetate extract of root and stem of Gisekia pharnaceoides Linn. (Molluginaceae) from thar desert, Rajasthan, India // Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2017. V. № 4. P. 168–174.
Surso M.V. Pollination and pollen germination in common juniper (Juniperus communis: Cupressaceae) // Arctic Environmental Research. 2018. № 4. P. 162–174.
Takaso T., Owens J.N. Significance of exine shedding in Cupressaceae-type pollen // J. Plant Res. 2008. № 121. P. 83–85.
Wang B.Y., Su J.R., Fernando D.D. et al. Development of the male reproductive structures in Taxus yunnanensis // Plant Syst. Evol. 2008. № 276. P. 51–58.
Wang X.H., Teng Y., Wang Q.L. et al. Imaging of dynamic secretory vesicles in living pollen tubes of Picea meyeri using evanescent wave microscopy // Plant Physiology. 2006. № 141. P. 1591–1603.
Ylstra B., Touraev A., Brinkmann A.O., Heberle-Bors E., van Tunen A.J. Steroid hormones stimulate germination and tube growth of in vitro matured tobacco pollen // Plant Physiol. 1995. V. 107. P. 639–643.
Дополнительные материалы отсутствуют.