Онтогенез, 2020, T. 51, № 6, стр. 473-478
Создание клеточной модели для изучения взаимодействия промотора гена Pou5f1 (Oct4) с генетическим окружением
А. А. Кузьмин a, В. В. Ермакова a, Е. В. Потапенко a, М. Г. Островерхова a, Н. А. Гурьев a, А. Н. Томилин a, *
a Федеральное государственное бюджетное учреждение науки Институт цитологии Российской академии наук
194064 Санкт-Петербург, Тихорецкий просп., 4, Россия
* E-mail: a.tomilin@incras.ru
Поступила в редакцию 06.07.2020
После доработки 25.07.2020
Принята к публикации 27.07.2020
Аннотация
Ген Pou5f1 (Oct4) известен как центральный регулятор клеточной плюрипотентности, однако, многие аспекты, связанные с ролью его регуляторных элементов в транскрипционной активности близлежащих генов остаются практически не изученными. В настоящем исследовании мы осуществили биаллельную делецию промотора Pou5f1 в эмбриональных стволовых клетках (ЭСК) мыши, сохранив при этом плюрипотентные свойства клеток посредством внедрения 9.8-т.п.н. фрагмента гена Pou5f1 в транс-положение. Полученные результаты подтверждают определенные ранее границы Pou5f1, в то время как полученные ЭСК послужат незаменимой моделью для изучения энхансерной роли промотора Pou5f1 в регуляции транскрипционной активности окружающих его генов.
ВВЕДЕНИЕ
Исследования гена Pou5f1 (Oct4), как основного участника формирования плюрипотентной массы клеток в процессе эмбриогенеза млекопитающих начались с конца 80-х годов прошлого века. В дальнейшем была также показана его непосредственная вовлеченность в образование колоний индуцированных плюрипотентных стволовых клеток (иПСК). К настоящему моменту он известен, как ключевой регулятор плюрипотентности, регулирующий транскрипцию ассоциированных с этим состоянием генов, а также как пионер-фактор, способный репрограммировать дифференцированные клетки за счет связывания с закрытым хроматином (Nichols et al., 1998; Iwafuchi-Doi, Zaret, 2014). Однако, многие аспекты, связанные с регуляцией транскрипции самого гена Pou5f1, равно как и ролью его регуляторных элементов в транскрипционной активности близлежащих генов остаются не в полной мере изученными.
В 2000 году Niwa с соавторами показали, что снижение или повышение уровня экспрессии Pou5f1 более чем на 50% ведет к дифференциации клеток в направлении трофэктодермы или мезодермы/первичной энтодермы, соответственно (Niwa et al., 2000). Эти результаты свидетельствовали о наличии в стволовых клетках тонких механизмов контроля экспрессии Pou5f1. В дальнейшем был выявлен один из таких механизмов, обеспечиваемый работой проксимального (PE) и дистального энхансера (DE) этого гена. Оказалось, что работа этих энхансеров строго зависит от стадий эмбрионального развития и условий культивирования клеток.
Как известно, плюрипотентные стволовые клетки могут находится в двух основных состояниях – наивном и праймированном. Первое состояние соответствует клеткам раннего эпибласта до имплантации и обладает уникальными характеристиками. Например, такие клетки экспрессируют, помимо Oct4 и Sox2 специфичные маркеры – Nanog, Klf2, Klf4, Klf5, ESRRb, которые отсутствуют в клетках праймированых, соответствующих позднему эпибласту имплантированного эмбриона. В свою очередь последним соответствуют маркеры Otx2 и Zic2. Кроме того, каждый тип клеток зависит от метода культивирования. Например, для культивирования эпибластных стволовых клеток необходимо присутствие в среде Fgf2 и Activin A (Weinberger et al., 2016). Кроме того, оказалось, что DE активен в наивных плюрипотентных клетках, а PE активируется в праймированных клетках (Choi et al., 2016). Таким образом, эти два элемента являются частью механизма, обеспечивающего правильную пространственно-временную регуляцию экспрессии Pou5f1.
По мере развития новых молекулярно-биологических методов, в том числе методов геномной инженерии, были выявлены и другие потенциальные цис-регуляторные элементы, влияющие на уровень экспрессии гена Pou5f1. Так, используя библиотеку гидовых РНК системы CRISPR/ Cas9 был разработан метод CREST-seq, применив который, авторы обнаружили 45 CRE-элементов (цис-регуляторных элементов) для Pou5f1. Удаление этих областей ДНК оказывало влияние на уровень экспрессии гена Pou5f1. Интересно, что 17 из таких элементов представляли собой промоторы других генов и находились за пределами DE и PE (Diao et al., 2017). Такие промоторы могут представлять собой так называемые e-промоторы – регуляторные элементы, сочетающие в себе свойства как энхансеров, так и промоторов. Более того, Dao с соавторами показали, что 2–3% промоторов кодирующих генов могут проявлять энхансерную активность (Dao et al., 2017). По ряду признаков промотор Pou5f1 может выступать в роли e-промотора, и исследование такой возможности представляет несомненный интерес ввиду локализации Pou5f1 в локусе, высоко обогащенном генами.
Одним из таких признаков служит исследование, связывающее последовательность POU5F1 с аутоимунными заболеваниями. Авторами соответствующей работы было показано, что полиморфизмы нуклеотидной последовательности в области промотора этого гена ассоциированы с патогенезом псориаза (Chang et al., 2007).
В настоящем исследовании мы осуществили биаллельную делецию промотора Pou5f1, обеспечив при этом само-поддержание ЭСК за счет внедренной в дистальное геномное расположение функциональной копии гена Pou5f1. Полученные таким образом ЭСК послужат удобной моделью изучения роли промотора гена Pou5f1 в качестве е-промотора.
МАТЕРИАЛЫ И МЕТОДЫ
Плазмиды. Для CRISPR/Cas9-опосредованного внедрения конструкций в локус Rosa26 использовалась модифицированная плазмида pX330-U6-Chimeric_BB-CBh-hSpCas9, несущая в себе последовательности Cas9, гидРНК и флуоресцентный белок mCherry для селекции клеток. Последовательность гидРНК была подобрана с использованием онлайн платформы Benchling (www.benchling.com).
Клеточные линии. ЭСК мыши линии Pou5f1flox/flox, в которых промотор и первый экзон гена Pou5f1 фланкированы LoxP сайтами, были описаны ранее (Kehler et al., 2004). В качестве фидерных клеток использовали мышиные эмбриональные фибробласты (МЭФ), полученные из 14-дневных эмбрионов мышей.
Получение митомицин-инактивированных фибробластов и приготовление фидерного слоя. МЭФ, полученные от мышей линии C57/BL6, культивировали на 10-сантиметровых культуральных чашках (Eppendorf). По достижении 100% плотности, среду меняли на минимальный объем свежей среды, содержащей Митомицин-C (Sigma) в конечной концентрации 10 мкг/мл. После инкубации в течение 2.5 ч клетки промывали PBS, снимали трипсином и рассевали в концентрации 36 × 103/см2 или хранили в жидком азоте.
Культивирование клеток. ЭСК мыши культивировали в ЭСК-среде, в состав которой входили: Knockout DMEM (Gibco), 15% эмбриональная бычья сыворотка (Sigma), 100 ед./мл пенициллин (Gibco), 100 мкг/мл стрептомицин (Gibco), 2 мМ L-глутамин (Gibco), заменимые аминокислоты (NEAA, Gibco), hLIF (Leukemia inhibitory factor – лейкоз-ингибирующий фактор), приготовленный в лабораторных условиях. Пересев клеток проводился с использованием 0.05% раствора трипсина-ЕДТА. ЭСК растили на культуральном пластике, покрытом фидерным слоем митомицин-инактивированных фибробластов. Среду меняли каждый день или через день в зависимости от плотности ЭСК.
Временная трансфекция. Временная трансфекция осуществлялась в лунках 24-луночного планшета с использованием реагента FuGene HD (Promega). За день до трансфекции клетки рассевались в плотности 10 × 103/см2. За час до добавления трансфекционной смеси клеткам заменяли среду на бессывороточную (OptiMEM (Gibco) с добавлением hLIF). Через 12 ч после трансфекции среду заменяли на стандартную ЭСК-среду. Еще через день клетки рассевали на 6-см чашки и подвергали селекции на соответствующем антибиотике.
Клонирование гидовой последовательности. Гидовую последовательность клонировали в вектор pX330-U6-Chimeric_BB-CBh-hSpCas9 по сайтам BpiI. Для этого исходную плазмиду линеаризовали ферментом BpiI (Thermo Fisher Scientific), выделяли и использовали в качестве вектора. В качестве вставки использовали синтезированные олигонуклеотиды, длиной 24–25 нуклеотидов, содержащие специфическую гидовую последовательность (20–21 нуклеотидов) и короткую последовательность, соответствующую сайту рестрикции (4 нуклеотида). Два частично комплементарных олигонуклеотида смешивали в 10 мкл 1-кратного лигазного буфера, плавили при 96°С в термостате, после чего медленно остужали до 40°С. В дальнейшем лигирование с 50–100 нг вектора проводили по стандартному протоколу.
Создание генетической конструкции для переноса локуса Pou5f1. Плазмиду Rosa26-GOF-2APuro получали в два этапа. Сначала, последовательность 2A-Puro (P2A-сайт, соединенный с геном устойчивости к пуромицину) встраивали в плазмиду pGOF18, содержащую 18-килобазный геномный фрагмент, охватывающий ген Pou5f1 (Yeom et al., 1996). Встраивание производили перед стоп-кодоном, сохраняя рамку считывания. После этого, из полученной конструкции вырезали фрагмент 11 т.п.н., включающий последовательность 2A-Puro и геномную последовательность Pou5f1 (положение –5.4…+4.9 т.п.н. относительно точки начала транскрипции) и встраивали в плазмиду Ai65(RCFL-tdT) (Addgene, Cat. 61577), содержащую плечи гомологии к Rosa26.
Геномное редактирование. Для встраивания в локус Rosa26 при помощи CRISPR/Cas9 технологии была использована гидРНК 5'-ACTCCAGTCTTTCTAGAAGA-3'. После котрансфекции клоны ЭСК отбирали на антибиотике пуромицине с рабочей концентрацией 1 мкг/мл. В дальнейшем отобранные колонии генотипировали методом ПЦР на наличие всех необходимых модификаций.
Иммуноцитохимическое окрашивание. Иммуноцитохимическое окрашивание выполняли по стандартному лабораторному протоколу с использованием первичных антител против Oct4 (SantaCruz, C10, 1 : 500), Nanog (Bethyl a300-397a, 1 : 250), Sox2 (Invitrogen pa1094x, 1 : 250), Rex1 (Invitrogen pa5-27567, 1:200), а также Klf4 (Abcam 129473, 1 : 250). Протокол включал в себя фиксацию в 4% PFA в течении 10 мин, этапы пермеабилизации с Triton X100 (0.1%, 10 мин), блокировки в PBS с добавлением 1% БСА и 2% овечьей сыворотки. Фиксированные клетки инкубировали с первичными антителами в течение 2 ч при комнатной температуре. Вторичные антитела, меченные Cy3 или Alexa 488 (Jackson ImmunoResearch) разводили в соотношении 1 : 500 и инкубировали с клетками в течение полутора часов при комнатной температуре.
РЕЗУЛЬТАТЫ
В качестве объекта исследования были выбраны ранее полученные нами ЭСК мыши, в которых промотор и первый экзон Pou5f1 в обоих аллелях был фланкирован loxP-сайтами (Pou5f1flox/flox) (Kehler et al., 2004).
Для создания модельной системы, в ЭСК Pou5f1flox/flox были удалены промотор (PP) и первый экзон (ex1) обоих аллелей Pou5f1 flox/flox, для чего клетки трансфецировали плазмидой, экспрессирующей сшитую с доменами эстрогенового рецептора ERT2 Cre-рекомбиназу. Вход рекомбиназы в ядро и выщепление указанных участков запускались посредством добавления в среду лиганда – тамоксифена. Продукт такого выщепления (Pou5f1∆/∆) является нефункциональным аллелем (Kehler et al., 2004), что ведет к дифференцировке ЭСК. Для сохранения плюрипотентного статуса клеток, одновременно с инактивацией Pou5f1 flox/flox, в локус Rosa26 при помощи гомологичной рекомбинации, индуцируемой системой CRISPR/Cas9 (Bressan et al., 2017), вводили последовательность гена Pou5f1, охватывающую экзоны и интроны гена, а также его промотор (PP), проксимальный (PE) и дистальный энхансеры (DE) (положение –5.4…+4.9 т.п.н. относительно точки начала транскрипции, рис. 1а), являющиеся необходимыми и достаточными элементами для тонкой регуляции его работы в раннем/позднем эпибласте. Кроме того, для отбора мутантных клонов, непосредственно перед стоп-кодоном была встроена последовательность устойчивости к пуромицину, экспрессирующаяся в составе бицистронной последовательности совместно с Pou5f1. Отобранные клоны генотипировали на наличие делеции по обоим аллелям, а также на наличие вставки в локус Rosa26 (рис. 1б). Описание стратегии генотипирования флоксированных аллелей было приведено ранее (Kehler et al., 2004). Ампликон, характеризующий вставку, соответствует 1.48-т.п.н. фрагменту, амплифицирующемуся праймерами, с 5'-конца затрагивающими Rosa26 локус левее плеча гомологии, а с 3'-конца – фрагмент встраиваемого Pou5f1. Суммарно, из 20 отобранных колоний, у 10 были удалены флоксированные области по обоим аллелям, и у 6 из них был подтвержден перенос локуса в Rosa26. Таким образом, в результате проведенных манипуляций были успешно получены 6 клонов ЭСК Pou5f1∆/∆;Rosa26Pou5f1/+.
Рис. 1.
Получение и первичный анализ модельной линии ЭСК Pou5f1∆/∆;Rosa26Pou5f1/+. (а) Схема генетических манипуляций с исходными ЭСК Pou5f1 flox/flox позволившие делетировать промотор (PP) и удержать ЭСК в плюрипотентном состоянии посредством внедрения 10.3-т.п.н. (тысяч пар нуклеотидов) фрагмента гена Pou5f1 в локус Rosa26. (б) Пример результатов генотипирования получаемых клонов. На левой картинке отображены результаты проверки вырезания промотора и первого экзона Pou5f1. 1 – ЭСК дикого типа, 2, 4 – ЭСК Pou5f1 flox/flox, 3, 5 – ЭСК Pou5f1∆/∆;Rosa26Pou5f1/+. Бэнды в районе 500 п.н. соответствуют детектированию флоксированного (+34 п.н. за счет LoxP сайта) и/или дикого аллеля Pou5f1. Бэнд в районе 250 нуклеотидов соответствует детектированию делеции промотора и первого экзона Pou5f1. На правой картинке – детектирование встраивания последовательности гена Pou5f1 в локус Rosa26, которому соответствует 1.48-т.п.н. ампликон. 1 – ЭСК Pou5f1 flox/flox, 2 – ЭСК Pou5f1∆/∆;Rosa26Pou5f1/+. (в) Окрашивание полученных линий Pou5f1∆/∆;Rosa26Pou5f1 на маркеры плюрипотентности – Oct4, Nanog, Rex1, Sox2, Klf4. Сравнение по ряду маркеров с клетками ЭСК дикого типа и клетками ЭСК Pou5f1flox/flox. Сокращения на рисунке: PP – промотор, DE – дистальный энхансер, PE – проксимальный энхансер, e1-5 – экзоны гена Pou5f1, 2А – P2A сайт, PuroR – ген устойчивости к пуромицину, TAM – тамоксифен.
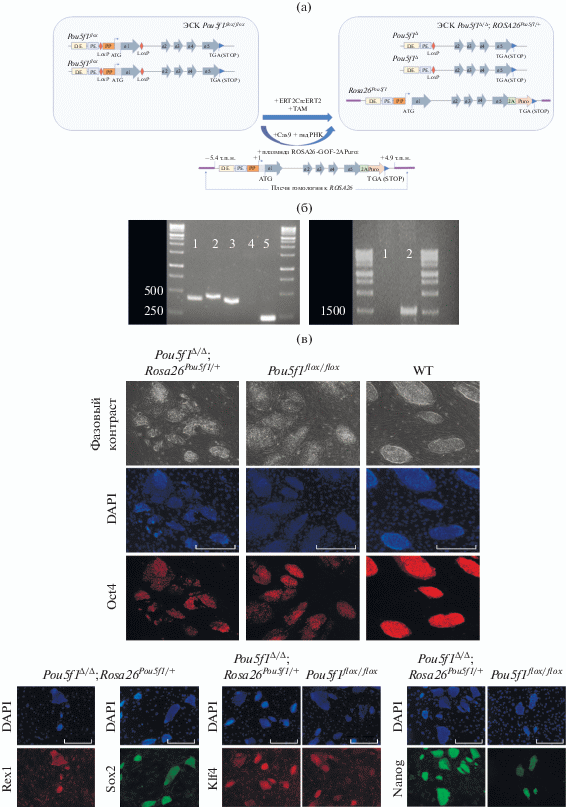
Локус Rosa26 широко используется для получения трансгенных клеточных линий, в том числе с применением системы CRISPR/Cas9. Подход, основанный на внедрении геномной последовательности Pou5f1 в данный локус был выбран по причине необходимости получения генетически равноценных линий клеток для дальнейшего адекватного анализа и сравнения. В противном случае, из-за неопределенного количества копий при получении стабильных линий, а также из-за неизвестной геномной локализации таких инсерций, возможность сделать конкретные и всеобъемлющие выводы при сравнении линий оставалась бы спорной.
Согласно статье Karwacki-Neisius с соавторами, уменьшение уровня экспрессии Pou5f1 может приводить к усилению плюрипотентных характеристик клеток, таких как повышенный уровень экспрессии Nanog, пониженная частота спонтанной дифференцировки и усиленное связывание белка Oct4 с энхансерами, ассоциированными с состоянием плюрипотентности (Karwacki-Neisius et al., 2013). В данном исследовании авторы получили и использовали гетерозиготную (Pou5f1+/–) линию ЭСК OKO160. В нашем же случае, помимо создания гетерозиготности, единственный функциональный аллель Pou5f1 был помещен в новое генетическое окружение, локус Rosa26. За исключением некоторых морфологических отличий, полученные ЭСК Pou5f1∆/∆;Rosa26Pou5f1/+ обладали сходными с ЭСК Pou5f1 flox/flox и клетками дикого типа характеристиками, продолжали нормально пролиферировать, а также конститутивно экспрессировали основной маркер плюрипотентности – белок Oct4. Помимо этого, полученные клетки экспрессировали другие маркеры плюрипотентности, такие как Nanog, Sox2, Klf4, и Rex1. Интересно, что в сравнении с контролем ЭСК Pou5f1∆/∆; Rosa26Pou5f1/+ показали более равномерное распределение Klf4, а также более высокий уровень Nanog, что полностью соответствует результатам анализа ЭСК линии OKO160 (Karwacki-Neisius et al., 2013). Таким образом, полученный результат позволяет сделать заключение о том, что перенос одной копии гена в указанных выше размерах в эктопическое положение не отражается на плюрипотентных свойствах ЭСК мыши.
ОБСУЖДЕНИЕ
Полученный в настоящей работе результат показывает, что перенос одной копии гена в эктопическое положение не отражается на жизнеспособности ЭСК мыши. Такие клетки сохраняют свою пролиферативную активность и экспрессируют продукт Pou5f1 – Oct4 на необходимом для самообновления ЭСК уровне. Таким образом, можно сделать вывод от том, что определенные ранее границы Pou5f1 охватывают все регуляторные элементы, необходимые для функционирования ЭСК (Yeom et al., 1996). Дальнейшие исследования, однако, должны показать, достаточно ли этих элементов для перехода Pou5f1 в неактивное состояние в ходе дифференцировки ЭСК, равно как и для ее нормального прохождения.
Помимо этого, полученные в настоящей работе ЭСК линии Pou5f1∆/∆;Rosa26Pou5f1/+ будут являться ценным инструментом при изучении энхансерной функции промотора Pou5f1 в отношении окружающих его генов. Дальнейшее сравнение уровней экспрессии генов в клетках с перенесенным локусом Pou5f1 и в клетках с интактным аллелем помогут указать на наличие такой функции. А дальнейшее применение методов 3C (Chromosome Conformation Capture) поможет это доказать. Изучение энхансерных функций промотора Pou5f1 представляет несомненный интерес ввиду его локализации в хромосомном локусе, высоко обогащенном генами, вовлеченными в различные биологические процессы.
Сравнивая нашу модель с другими известными клеточными моделями, позволяющими замещать функцию гена Pou5f1, можно отметить линию ЭСК ZHTc6 (Niwa et al., 2000). Создание этой линий, однако, ставило целью оценку влияния уровня белка Oct4 на судьбу ЭСК мыши и никак не отвечает нашими целями, так как промотор гена в ЭСК ZHTc6 остается интактным. Кроме того, в указанной работе для поддержания плюрипотентности ЭСК был использован трансген кДНК Oct4 под управлением CMV-промотора, что не позволяет оценить регуляцию самого Pou5f1.
Кроме того, интересным является факт сохранения плюрипотентных свойств полученных клеток при инактивации его эндогенной экспрессии. С одной стороны, это не удивительно, т.к. уже были получены и клетки ZHTc6, и была продемонстрирована исключительная важность проксимального и дистального энхансеров Pou5f1 (Choi et al., 2016). С другой стороны, плюрипотентные свойства этих клеток требуют дальнейших подтверждений, например, со стороны динамики дифференцировок в разные зародышевые листки. Недавно было показано, что существует дополнительная характеристика плюрипотентных стволовых клеток при смене наивного и праймированного состояний, так называемая “стадия розетки” (Neagu et al., 2020). Возможно, будут найдены и другие, новые стадии в процессе дифференцировки ЭСК, которые можно будет обнаружить, сравнивая полученные нами линии с контрольными. В таком случае мы также вероятно сможем охарактеризовать элементы, отвечающие за регуляцию и правильное прохождение таких стадий.
Список литературы
Bressan R.B., Dewari P.S., Kalantzaki M. et al. Efficient CRISPR/Cas9-assisted gene targeting enables rapid and precise genetic manipulation of mammalian neural stem cells // Development. 2017. V. 144. № 4. P. 635–648.
Chang Y.T., Hsu C.Y., Chou C.T. et al. The genetic polymorphisms of POU5F1 gene are associated with psoriasis vulgaris in Chinese // J. Dermatological Science. 2007. V. 46. № 2. P. 153–156.
Choi H.W., Joo J.Y., Hong Y.J. et al. Distinct enhancer activity of Oct4 in naive and primed mouse pluripotency // Stem Cell Reports. 2016. V. 7. № 5. P. 911–926.
Dao L.T.M., Galindo-Albarrán A.O., Castro-Mondragon J.A. et al. Genome-wide characterization of mammalian promoters with distal enhancer functions // Nature Genetics. 2017. V. 49. № 7. P. 1073.
Diao Y., Fang R., Li B. et al. A tiling-deletion-based genetic screen for cis-regulatory element identification in mammalian cells // Nature Methods. 2017. V. 14. № 6. P. 629–635.
Iwafuchi-Doi M., Zaret K.S. Pioneer transcription factors in cell reprogramming // Genes & Development. 2014. V. 28. № 24. P. 2679–2692.
Karwacki-Neisius V., Göke J., Osorno R. et al. Reduced Oct4 expression directs a robust pluripotent state with distinct signaling activity and increased enhancer occupancy by Oct4 and Nanog // Cell Stem Cell. 2013. V. 12. № 5. P. 531–545.
Kehler J., Tolkunova E., Koschorz B. et al. Oct4 is required for primordial germ cell survival // EMBO Reports. 2004. V. 5. № 11. P. 1078–1083.
Neagu A., van Genderen E., Escudero I. et al. In vitro capture and characterization of embryonic rosette-stage pluripotency between naive and primed states // Nature Cell Biology. 2020. V. 22. № 5. P. 534–545.
Nichols J., Zevnik B., Anastassiadis K. et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4 // Cell. 1998. V. 95. № 3. P. 379–391.
Niwa H., Miyazaki J., Smith A.G. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells // Nature Genetics. 2000. V. 24. № 4. P. 372–376.
Yeom Y.I., Fuhrmann G., Ovitt C.E. et al. Germline regulatory element of Oct-4 specific for the totipotent cycle of embryonal cells // Development. 1996. V. 122. № 3. P. 881–894.
Weinberger L., Ayyash M., Novershtern N., Hanna J.H. Dynamic stem cell states: naive to primed pluripotency in rodents and humans // Nature Reviews Molecular Cell Biology. 2016. V. 17. № 3. P. 155.
Дополнительные материалы отсутствуют.


