Онтогенез, 2020, T. 51, № 6, стр. 460-472
Морфогенез рассеченного листа березы в культуре in vitro
О. С. Машкина a, b, *, Т. М. Табацкая a
a ФГБУ Всероссийский НИИ лесной генетики, селекции и биотехнологии
394087 Воронеж, ул. Ломоносова, 105, Россия
b Воронежский государственный университет
394006 Воронеж, Университетская пл., 1, Россия
* E-mail: mashkinaos@mail.ru
Поступила в редакцию 13.05.2020
После доработки 27.05.2020
Принята к публикации 01.06.2020
Аннотация
Далекарлийская береза (Betula pendula f. ‘dalecarlica’) является разновидностью березы повислой (B. pendula) и имеет рассеченные листья. Исследована возможная природа нарушения морфогенеза листа (переход от рассеченной формы листа к нормальному цельному) у одного из 8-ми клонов березы далекарлийской в процессе культивирования in vitro. Кариологический анализ выявил у клона-ревертанта более высокую (по сравнению с клоном с рассеченными листьями) степень компактизации хроматина метафазных хромосом. Высказывается предположение, что реверсия к дикому типу имеет эпигенетическую природу. На это указывает выраженная реакция (появление листьев с рассечением) эксплантов клона-ревертанта на воздействие эпимутагена 5-азацитидина (оказывающего деметилирующее влияние на ДНК), существенное увеличение (в 6 раз) доли клеток с остаточными ядрышками в метафазе и анафазе митоза. Предполагается, что изменение гормонального статуса клетки (при введении эксплантов в культуру in vitro), уровня метилирования ДНК и степени компактизации хроматина могли изменить характер экспрессии регуляторных генов в апексе побега (в том числе, привести к репрессии транскрипции ключевых гомеобоксных KNOX1 – генов) и реверсии листа к дикому типу. Причем, индуцированное условиями культивирования in vitro “эпигенетическое молчание” достаточно стабильно и долговременно: наблюдается на протяжении 19 лет клонального микроразмножения на питательных средах без гормонов, а также сохраняется после высадки микрорастений в теплицу (ex vitro). Культивируемые in vitro клоны березы далекарлийской, контрастные по стабильности проявления признака рассеченнолистности, являются перспективной моделью для дальнейшего изучения генетики морфогенеза листа, механизмов эпигенетической изменчивости.
ВВЕДЕНИЕ
Формирование листа – сложный генетически детерминируемый процесс, важную роль в регуляции которого играют фитогормоны, различные транскрипционные (ТФ) и средовые факторы (Ежова, 2007; Лутова и др., 2010; Kawamura et al., 2010; DeMason, Villani, 2001; Bar, Ori, 2014; Chitwood, Sinha, 2016; Maugarny-Calès, Laufs, 2018; Kong et al., 2019). Изучение механизмов формирования разнообразной формы листа – одна из важных проблем биологии развития растений, поскольку феногенетическая изменчивость листовой пластинки является не только маркером видового разнообразия, но также играет важную роль в приспособлении к окружающей среде (Корона, Васильев, 2007; Jinxiu et al., 2018). Так, рассечение цельной листовой пластинки уменьшает площадь листа, облегчает теплообмен, снижает транспирацию, что способствует сохранению водного гомеостаза и адаптации к экологическому стрессу. Рассеченные листья (имеющие глубокие надрезы, почти доходящие до главной жилки) в меньшей степени испытывают механическое повреждение от ветра (Parkhurst, Loucks, 1972; Migalina et al., 2010; Chitwood, Sinha, 2016).
Генетические и молекулярные механизмы, контролирующие морфогенез цельного листа, наиболее хорошо изучены на модельном объекте Arabidopsis thaliana (Bilsborough et al., 2011; Runions, Tsiantis 2017; Jinxiu et al., 2018). Контроль развития рассеченных и сложных листьев проводится в основном на видах двудольных травянистых растений – сердечнике Cardamine hirsutа (Canales et al., 2009), горохе Pisum sativum (DeMason, Villani 2001), томатах Solanum lycopersicum (Bar, Ori, 2014; Jinxiu et al., 2018) и других. Показано, что, несмотря на наличие общих закономерностей генетической регуляции начальных этапов развития листа, могут наблюдаться существенные видовые различия характера экспрессии одних и тех же генов ТФ, приводящие к формированию листьев различной морфологии (Janssen et al., 1998; Lutova et al., 2015; Perez-Morales et al., 2017).
Установлено, что ключевую роль в развитии рассеченного листа играют гомеобоксные (гомеодомен-содержащие) KNOX1-гены (KNOTTED1-LIKE HOMEOBOX). Эти гены кодируют транскрипционные факторы, поддерживающие популяцию стволовых клеток в побеговой апикальной меристеме (ПАМ), которые генерируют всю надземную часть сосудистых растений (в том числе морфогенез листа) (Janssen et al., 1998; Pham, Sinha, 2003; Ежова, 2007, 2008; Лутова и др., 2010; Hay, Tsiantis, 2010).
Отмечено влияние гормонального статуса клетки, а также сигналов окружающей среды (температуры, света и др.) на экспрессию гомеобоксных генов (Ежова, 2007, 2008; Лутова, Додуева, 2007; Chitwood, Sinha, 2016).
В последнее десятилетие выявлена существенная роль малых РНК (small RNA, microRNA) в развитии простого и сложного листа. Эти некодирующие молекулы РНК регулируют экспрессию генов в основном на пост-транскрипционном уровне, участвуют в их сайленсинге путем расщепления транскриптов, играют важную роль в координации сложных процессов правильного развития листа (Kidner, 2010; Pulido, Laufs, 2010; Perez-Morales et al., 2017; Silva et al., 2019).
Несмотря на значительные успехи в этой области, еще недостаточно хорошо изучены механизмы контроля морфогенеза рассеченного листа у древесных растений. Исследования, выполненные в этом направлении (в том числе на березе) немногочисленны (Гендельс, 1988; Baker-Brosh, Peet, 1997; Royer, 2012; Mu et al., 2013; Bian et al., 2019). Так, результаты транскриптомного анализа листовых меристем саженцев Betula pendula ‘Dalecarlica’ с рассеченными листьями и B. pendula с цельными листьями, полученных методом культуры in vitro, показали, что транспорт и передача сигнала ауксина были изменены у ‘Dalecarlica’, что, по мнению авторов (Mu et al., 2013), способствовало изменению их краевой формы листьев. У березы ‘Dalecarlica’ выявлены гены-кандидаты, кодирующие транскрипционные факторы, участвующие в пролиферации клеток, а также синтезе и сигнальном ответе ауксина, которые, по мнению авторов (Bian et al., 2019), играют потенциальную роль в морфогенезе рассеченных листьев березы.
Отсутствуют данные о характере проявления признака “рассеченнолистности” в зависимости от генотипа растений и влияния различных сигналов окружающей среды. Для решения этих вопросов удобной экспериментальной модельной системой (в которой возможно строгое контролирование условий культивирования и состава питательной среды) является культура тканей in vitro.
Береза далекарлийская (Betula pendula f. ‘dalecarlica’ (L.f.) Schneid.) является разновидностью березы повислой (B. pendula Roth) и характеризуется красивыми глубоко рассеченными листьями, благодаря которым и используется в декоративном озеленении. Ее в основном размножают вегетативным способом (прививкой), поскольку при семенном размножении потомство часто имеет обычные (цельные) листья, что связывают с рецессивным (мутантным) характером признака (Исаков и др., 2004; Ветчинникова, 2005).
Нами разработан метод клонального микроразмножения взрослых деревьев березы далекарлийской и длительного хранения в коллекции in vitro ее наиболее ценных форм (Табацкая, Машкина, 2020). При этом выявлена интересная особенность. В сходных условиях культивирования in vitro из 8-ми генотипов в процессе клонального микроразмножения, семь – сохранили признак рассеченнолистности, а один – полностью ревертировал к нормальному фенотипу (дикому типу: цельной листовой пластинке).
Целью работы явилось исследование возможной природы нарушения морфогенеза листа у березы далекарлийской при культивировании in vitro.
В задачи работы входило изучение влияния различных факторов, обладающих регуляторным действием (гормонов, эпимутагенов), на проявление признака “рассеченнолистности” у разных генотипов березы в культуре in vitro, а также оценка особенностей кариотипа клонов, контрастных по стабильности проявления признака.
Подобные исследования являются новыми для березы и важны для более полного понимания механизмов развития рассеченного листа у древесных растений, стабильности проявления систематически значимого признака в различных средовых условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследований служило 8 клонов березы далекарлийской в культуре in vitro, полученные от 8 деревьев с типичными рассеченными листьями. Исходные деревья произрастают в озеленительных посадках г. Воронежа (№ 1 и № 2) и г. Мичуринска (№ 4), Главном Ботаническом саду им. Н.В. Цицина РАН, г. Москва (№ 3), Ботаническом саду Уральского отделения РАН, г. Екатеринбург (№ 5, 6, 7), Семилукском лесопитомнике г. Воронежа (№ 8). Деревья № 3–7 отобраны д. б. н. Ю.Н. Исаковым.
Регенерацию растений проводили путем прямого органогенеза из одноузловых эксплантов однолетних одревесневших побегов взрослых деревьев на питательной среде Мурасиге и Скуга (MS) (Murashige, Skoog, 1962), дополненной цитокинином 6-бензиламинопурином (6-БАП, Sigma) в концентрации 0.5–1 мг/л.
Для уменьшения вероятности возникновения сомаклональной изменчивости укоренение микропобегов, микроразмножение растений, их длительное хранение in vitro осуществляли на безгормональной питательной среде MS с половинным содержанием макросолей (1/2 MS) по разработанной нами методике (Табацкая, Машкина, 2020). Клональное микроразмножение с целью получения посадочного материала проводили на питательной среде 1/2 MS без гормонов, дополненной активированным углем (2.0%).
В обоих случаях в питательную среду (MS или 1/2 MS) добавляли 0.7% агар (AppliChem, США), 2% сахарозу (Panreac, Испания), 5 мг/л глицин (Вектон, Россия), 10 мг/л глутамин (Acros Organics, США), 100 мг/л мезо-инозит (Panreac, Испания), 2 мг/л тиамина, 0.5 мг/л аскорбиновой кислоты, 0.5 мг/л никотиновой кислоты и 0.5 мг/л пиридоксина при рН 5.7.
Растения выращивали в стандартных условиях культивирования: при температуре 25 ± 2°С, фотопериоде 16 ч день/8 ч ночь, освещенности 2.0 клк. Интервал субкультивирования – 1 раз в 1.5–2 мес., а при долгосрочном хранении – 1 раз в 5–6 мес.
Изучали влияние цитокинина 6-БАП (1, 2 и 5 мг/л), ауксина β-индолилуксусной кислоты (ИУК, 0.5, 2 и 5 мг/л), а также эпимутагенов 5‑азацитидина (5-аза, Sigma) – 2 мг/л, никотиновой кислоты (НК, витамин РР) – 2, 5 и 10 мг/л на морфогенез и проявление признака рассечения листовой пластинки.
Под эпимутагенами понимают вещества, химически модифицирующие ДНК или белки гистоны, изменяющие экспрессию генов (Малецкий, 2009), влияние которых на морфогенез листа березы в культуре in vitro нами было изучено впервые.
Гормоны (6-БАП, ИУК) и эпимутагены (5-аза, НК) однократно (перед автоклавированием) добавляли в питательную среду без активированного угля. Режим автоклавирования щадящий – 15 мин, 0.8 атм (117°С). Продолжительность действия агентов в каждом случае – 30 дней (1 пассаж). Для каждого клона и варианта питательной среды анализировали не менее 30–40 микрорастений.
Кариологические исследования проводили на двух клонах, контрастных по стабильности проявления признака рассеченнолистности при культивировании in vitro: клоне № 1, сохраняющем в процессе микроразмножения признак и клоне № 2, ревертирующем к нормальному фенотипу (цельный лист). Молодые листья растений из распускающихся почек фиксировали в уксусном алкоголе (3 : 1) с предобработкой (для анализа кариотипа) 0.002-молярным раствором 8-оксихинолина при температуре 10–14°С в течение 3 ч. Давленые препараты, окрашенные ацетогематоксилином, изготавливали по методике (Буторина, 1985) в нашей модификации.
Для характеристики кариотипа определяли число хромосом (2n) и их размеры. Учитывали абсолютную длину хромосом (мкм) и суммарную длину хромосом набора (сумма абсолютных длин всех хромосом данной пластинки, мкм). Просмотр препаратов осуществляли на световом микроскопе Микмед 6 при увеличении 40 × 1.5 × 10 и 100 × × 1.5 × 10. Микрофотосъемку проводили с использованием цифровой камеры окуляра DCM500. Измерение хромосом осуществлялось с помощью программы Axio Vision.
Исследования проводили в течение трех лет. Для каждого клона анализировали по 10–15 препаратов, число хромосом определяли в 20–30 метафазных пластинках, измерение хромосом проводили на 15 метафазных пластинках.
Статистическую обработку полученных данных проводили с использованием пакета статистических программ “Stadia”. Сравнение выборок осуществляли с использованием t-критерия Стьюдента.
Микросателлитный анализ образцов проводили совместно с Институтом леса НАН Беларуси (в. н. с., д. б. н. О.Ю. Барановым). Экстракцию ДНК осуществляли из молодых листьев СТАВ-методом (Doyle, Doyle, 1987). Генетическую паспортизацию образцов проводили согласно (Падутов и др., 2007) по пяти высокополиморфным ядерным SSR-локусам – L2.2, L7.8, L10.1, L52 (Kulju et al., 2004). Электрофоретический анализ и детекцию осуществляли с помощью генетического анализатора ABI Prism Genetic Analyzer 310 (Applied Biosystems). Анализ размера и количества ампликонов производили с помощью программного обеспечения Gene Mapper 4.0 (Applied Biosystems, США).
РЕЗУЛЬТАТЫ
Морфогенез листа у разных клонов березы в условиях культуры in vitro
Различия между клонами по проявлению признака рассечения листа выявлены на этапе микрочеренкования на питательной среде 1/2 MS без гормонов. Семь клонов (№ 1, № 3–8) в процессе многократного микрочеренкования регенерантов сохранили типичные для исходных деревьев рассеченные листья (рис. 1). Реверсия клона № 2 к дикому типу отмечена при переводе культур с гормональной (MS + 6-БАП 0.5–1 мг/л) на безгормональную питательную среду 1/2 MS (70% растений с цельными листьями). К концу первого года культивирования диагностирована его полная реверсия (100% культур) к нормальному фенотипу (рис. 2).
Рис. 1.
Общий вид контрастных по проявлению признака рассеченнолистности клонов далекарлийской березы в культуре in vitro: а, б – клон № 1, в – клон № 3, г – клон-ревертант № 2 с цельными листьями.

Рис. 2.
Постепенная реверсия листьев клона рассеченнолистной березы № 2 к дикому типу (цельный лист) в процессе микрочеренкования на среде 1/2 MS без гормонов. Крайний слева – лист исходного дерева. Масштаб – 1 см.

Причем, экспланты деревьев № 1, № 2 и № 3 трижды (в разные годы) вводились в культуру in vitro. Результат был сходным: сохранение признака рассеченнолистности у клонов № 1 и № 3 и реверсия к нормальному фенотипу – у клона № 2. Различия между клонами, выявленные в культуре in vitro, сохранялись и при их высадке в почву (рис. 3). В настоящее время клоны длительно (в течение 16–19 лет) поддерживаются в коллекции in vitro, стабильно сохраняя морфологические особенности листа.
Рис. 3.
Сохранение морфологии листьев растений березы клона № 1 (а, в) и клона-ревертанта № 2 (б, г), высаженных в теплицу после 1-го (а, б) и 17-ти (в, г) лет культивирования in vitro на питательных средах без гормонов.

Изучали влияние регуляторов роста цитокининовой (6-БАП) и ауксиновой (ИУК) природы, а также эпимутагенов (5-аза и НК) в составе питательной среды на морфогенез листа у клона-ревертанта № 2 (табл. 1). Наиболее яркая ответная реакция отмечена на воздействие ИУК в концентрации 2 мг/л. Признаки рассечения листа проявились у 40% растений (12 растений из 30) (рис. 4а). Однако, эффект был непродолжительным (наблюдался в течение 1–2 циклов субкультивирования) и постепенно исчезал при переходе на безгормональную среду. При более низком (0.5 мг/л) и более высоком (5 мг/л) содержании ИУК в питательной среде изменения морфологии листа не были отмечены.
Таблица 1.
Влияние регуляторов роста и эпимутагенов (5-аза и НК) на проявление фенотипических признаков у клона ревертанта № 2 на питательной среде 1/2 MS
| Добавки в питательную среду, мг/л | Доля растений с рассечением листа, % | Высота растений, см | Примечание |
|---|---|---|---|
| Контроль (без добавок) | 0.0 | 4.9 ± 0.2 | |
| 6-БАП 1.0 | 0.0 | 3.8 ± 0.2* | |
| 6-БАП 2.0 | 0.0 | 3.2 ± 0.1* | Каллусообразование на базальной части корней |
| 6-БАП 5.0 | 0.0 | 3.1 ± 0.1* | |
| ИУК 0.5 | 0.0 | 4.0 ± 0.1* | |
| ИУК 2.0 | 40.0 (n = 30) | 3.0 ± 0.1* | Каллусообразование на базальной части корней |
| ИУК 5.0 | 0.0 | – | Засыхание микрочеренков |
| 5-аза 2.0 | 11.1 (n = 36) | 2.5 ± 0.3* | Слабое рассечение ЛП |
| НК 2.0 | 0.0 | 3.5 ± 0.1* | |
| НК 5.0 | 0.0 | 3.5 ± 0.1* | Антоциановая окраска корней (10% культур) |
| НК 10.0 | 9.7 (n = 31) | 3.4 ± 0.1* | Слабое рассечение ЛП, антоциановая окраска корней (10% культур) |
Рис. 4.
Появление листьев с рассечением у клона-ревертанта № 2 (имеющего цельный лист – слева) под действием ИУК 2 мг/л (а) и 5-аза 2 мг/л (б).

Слабое рассечение листовой пластинки выявлено у отдельных растений того же клона при добавлении в питательную среду 5-азацитидина (4 растения из 36) (рис. 4б) или никотиновой кислоты в концентрации 10 мг/л (3 растения из 31). Причем, в варианте с 5-аза наблюдалось существенное снижение роста микропобегов (40% низкорослых растений высотой 0.5–2 см против 3–6 см в контроле), а в варианте с НК – появление корней с антоциановой окраской (10% культур) при 100%-ном укоренении микропобегов.
Реакция клонов березы с относительно стабильным проявлением признака рассеченнолистности, была неоднозначной на воздействие этих же эпимутагенов. Пять клонов (№ 1, № 3, № 5, № 7 и № 8) по-прежнему сохраняли рассечение листовой пластинки. У клонов № 4 и № 6 на среде с 5-аза наблюдалось усиление признака (более глубокие надрезы) (рис. 5а) и появление низкорослых растений (до 40–50% высотой 0.5–1.5 см). У клонов № 6 и № 10 на среде с НК 10 мг/л, наоборот, происходило исчезновение рассеченнолистности, появление ромбовидных листовых пластинок (рис. 5б).
Рис. 5.
Изменение морфологии листа у клона березы № 6 (исходные листья на каждой фотографии слева) под действием 5-аза – более глубокое рассечение (а) и НК 10 мг/л – исчезновение рассеченнолистности, появление ромбовидных листьев (б).

Полученные результаты позволяют говорить о неоднозначной и специфической реакции разных клонов березы на сходные условия культивирования in vitro.
Микросателлитный анализ клонов березы, контрастных по проявлению признака рассеченнолистности
Показано, что каждый из трех проанализированных клонов (№ 1, № 2 и № 3) является уникальным генотипом (табл. 2). Наличие диаллельных спектров на электрофореграмме указывает на их диплоидную природу.
Таблица 2.
Многолокусные генетические паспорта образцов клонов березы, контрастных по проявлению признака рассеченнолистности в культуре in vitro
| Клон | Микросателлитный локус, размер продукта (пн) | |||
|---|---|---|---|---|
| L2.2 | L7.8 | L10.1 | L52 | |
| № 1 | 132/138 | 294/304 | 252/256 | 265/265 |
| № 2 | 132/132 | 299/304 | 256/256 | 265/265 |
| № 3 | 132/135 | 298/310 | 256/256 | 262/269 |
Особенности кариотипа клонов березы, контрастных по проявлению признака рассеченнолистности
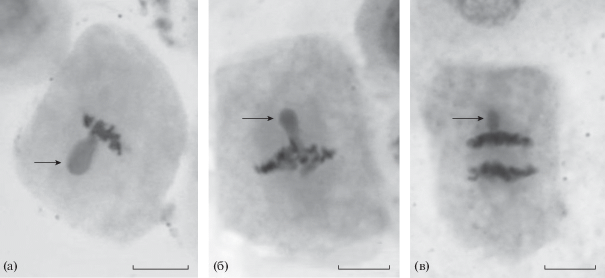
Анализ плоидности микрорастений подтвердил, что оба клона (№ 1 и № 2) являются диплоидными (2n = 28) и содержат две ядрышкообразующие хромосомы с вторичными перетяжками, что является нормой для березы повислой (Макарова, 1989) (рис. 6).
Рис. 6.
Метафазные пластинки с диплоидным числом хромосом (2n = 28) у микрорастений клона № 1 (а) и клона № 2 (б) березы далекарлийской. Стрелками обозначены две ядрышкообразующие хромосомы. Масштаб 10 мкм.
Известно, что основу хромосомы эукариот составляет хроматин – комплекс ДНК и белков (гистонов и негистоновых). В метафазной хромосоме хроматин находится в максимально конденсированном состоянии. Имеются сведения о том, что степень конденсации хромосом (в том числе метафазных) может отражать степень компактизации хроматина (Daban, 2011; Rybaczek, 2014).
В разные годы изучения кариотипа выявлена сходная закономерность: суммарная длина хромосом диплоидного набора у клона № 1 была статистически достоверно выше (47–49 мкм) по сравнению с клоном-ревертантом № 2 (38–40 мкм) (рис. 7). Это указывает на то, что степень компактизации хроматина метафазных хромосом культивируемого in vitro клона № 2 выше (в 1.2–1.3 раза), чем у клона № 1. Такая же закономерность наблюдалась между соответствующими парами хромосом указанных клонов по их абсолютной длине (табл. 3). У клона № 1 самая короткая (XIV-я) пара хромосом составила 1.2 мкм (с варьированием от 0.9 до 1.4 мкм), а самая длинная (I-ая пара) – 2.6 мкм (от 2.1 до 3.1 мкм). У клона № 2 эти значения составили соответственно 1.0 мкм (от 0.8 до 1.2 мкм) и 2.0 мкм (от 1.2 до 2.7 мкм). Низкие значения коэффициента вариации свидетельствуют о низком уровне изменчивости анализируемого признака.
Рис. 7.
Суммарная длина хромосом диплоидного набора клонов березы, контрастных по стабильности проявления признака разрезнолистности в культуре in vitro. Различия между клонами № 1 и № 2 в разные годы достоверны при р < 0.001.
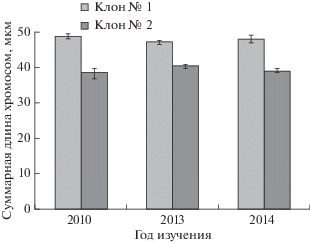
Таблица 3.
Размеры хромосом диплоидного набора клонов березы, контрастных по проявлению признака рассеченнолистности в культуре in vitro
| Номер пары | Клон № 1 | Клон № 2 | ||
|---|---|---|---|---|
| абсолютная длина хромосом, мкм | CV, % | абсолютная длина хромосом, мкм | CV, % | |
| I | 2.6 ± 0.05 | 10.7 | 2.0 ± 0.05 | 13.4 |
| II | 2.2 ± 0.04 | 10.2 | 1.7 ± 0.04 | 13.2 |
| III | 2.0 ± 0.03 | 9.4 | 1.6 ± 0.03 | 11.1 |
| IV | 1.8 ± 0.03 | 8.6 | 1.5 ± 0.03 | 10.4 |
| V–VII | 1.7 ± 0.02 | 7.4 | 1.4 ± 0.03 | 9.8 |
| VIII–IX | 1.6 ± 0.02 | 6.9 | 1.3 ± 0.02 | 9.3 |
| X–XI | 1.5 ± 0.01 | 6.3 | 1.2 ± 0.02 | 8.6 |
| XII | 1.4 ± 0.02 | 10.2 | 1.2 ± 0.02 | 8.0 |
| XIII | 1.3 ± 0.02 | 10.3 | 1.1 ± 0.01 | 7.4 |
| XIV | 1.2 ± 0.02 | 10.1 | 1.0 ± 0.02 | 9.4 |
| Суммарная длина хромосом, мкм | 47.9 ± 0.8 | 6.9 | 39.2 ± 1.0 | 9.8 |
Известно, что представители рода Betula L. характеризуются чрезвычайно мелкими хромосомами, вследствие чего являются трудным объектом для изучения кариотипа. Сведения о размерах хромосом ограничиваются отдельными работами (Taper, Grant, 1973; Макарова, 1989). Согласно Тапер (Taper, Grant, 1973) суммарная длина хромосом диплоидных видов березы (в том числе, B. pendula Roth) варьирует от 23.3 до 29.5 мкм; триплоидного гибрида (2n = 42) – 46.1 мкм, тетраплоидного вида березы бумажной (Betula papyrifera var. subcordata (Rydberg) Sargent) – 75.4 мкм. В нашем случае клон-ревертант № 2 по суммарной длине хромосом ближе к диплоидной березе повислой с нормальными цельными листьями, чем клон № 1 с рассеченными листовыми пластинками.
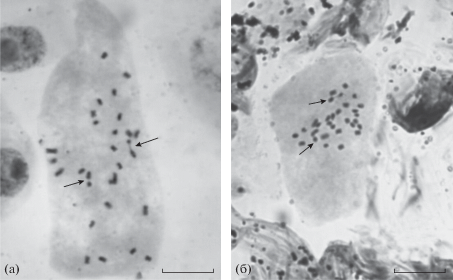
У клона-ревертанта № 2 отмечено существенное увеличение (в 6 раз – 20.5% против 3.5% у клона № 1) доли клеток с остаточными ядрышками в метафазе и анафазе митоза (рис. 8). Как известно, в норме ядрышки исчезают в конце профазы, что сопряжено с приостановкой синтеза рРНК. Появление остаточных ядрышек в метафазе и анафазе митоза рассматривают как проявление эпигенетической изменчивости. Изменение генетического материала при этом не происходит, но наблюдаемый пуффинг конденсированных хромосом является цитологическим проявлением активности генов рРНК, обычно ингибированной на этих стадиях (Буторина, Тиен, 2008).
ОБСУЖДЕНИЕ
Принято считать, что при клональном микроразмножении полностью сохраняются генетические особенности исходного растения. Это подтверждают и исследования по микроразмножению Betula pendula Roth ‘Dalecarlica’ с использованием меристемных и каллусных культур (Iliev et al., 2010; Zhang et al., 2018).
Тем не менее, в процессе культивирования клеток и тканей в условиях in vitro нередко возникает сомаклональная изменчивость, нарушающая единообразие клонов. Она может быть обусловлена генотипом растения-донора, условиями и длительностью культивирования in vitro и другими причинами. Показано, что в ходе длительного субкультивирования может накапливаться генетическая изменчивость клеток и тканей, особенно если присутствует стадия каллусообразования (Smykal et al., 2007; Mashkina et al., 2011). Отмечено, что даже оптимальный уровень растительных гормонов при длительном культивировании часто приводит к генетической и эпигенетической изменчивости растений (Smykal et al., 2007). Следует отметить, что в нашем случае различия между 8 изученными клонами березы по проявлению признака рассечения листа проявились в сходных условиях культивирования in vitro.
Известно, что морфогенез рассеченного листа контролируется группой координировано функционирующих генов, ключевую роль в котором играют гомеобоксные KNOX1-гены. У видов растений, имеющих простые цельные листья, экспрессия KNOXI-генов, выключенная в участках инициации листового примордия, не возобновляется на последующих стадиях его развития. При формировании рассеченного листа происходит возобновление экспрессии (эктопическая экспрессия) KNOXI-генов в нескольких участках по краю листовой пластинки (Janssen, 1998; Ежова, 2007, 2008; Лутова и др., 2010; Hay, Tsiantis, 2010; Lutova et al., 2015). Считают, что экспрессия KNOXI-генов способствует накоплению белка PIN1 (pinformed), что приводит к локальному увеличению содержания ауксина на периферии ПАМ. Ауксины стимулируют экспрессию гена ANT (AINTEGUMENTA), играющего основную роль в пролиферации клеток листового примордия и росте лопасти (Barkoulas et al., 2007; Лутова и др., 2010; Kong et al., 2019). Гены CUC2 (CUP-SHAPED COTYLEDON), экспрессия которых регулируется микроРНК miRNA164, определяют границу лопасти (Barkoulas et al., 2007; Лутова и др., 2010). Повышение уровня экспрессии гена CUC3 (негативный регулятор “усложнения” листа) приводит к слиянию лопастей и развитию листовых пластинок без рассечения (Лутова и др., 2010).
KNOX1-гены, играющие важную роль в регуляции развития и усложнении структуры листа, являются эволюционно древними и высоко консервативными (Pham, Sinha, 2003; Лутова, 2010; Lutova et al., 2015). Так, например, простые листья одуванчика лекарственного (Taraxacum officinsle Web.) становились сильно рассеченными при его трансформации KNOXI-генами ячменя (Hordeum vulgare L.) (Muller et al., 2006). Многочисленными примерами показано, что изменение характера экспрессии указанных регуляторных генов в апексе побега приводит к изменению морфологии листа. Так, у трансгенных растений сердечника Cardamine hirsutа (в норме имеющего рассеченные листья) со сниженной экспрессией одного из KNOXI-генов, листья становились цельными (Hay, Tsiantis, 2010). Установлена важная роль ауксина в морфогенезе листа, формировании его краевой формы (цельные, зубчатые, лопастные, рассеченные) (Wang et al., 2005; Bilsborough, 2011; Jinxiu et al., 2018; Kong et al., 2019).
Выявленные нами различия между клонами березы ‘Dalecarlica’ по характеру проявления признака рассечения листа в условиях in vitro могут быть обусловлены специфической реакцией разных генотипов на сходные условия культивирования (в частности, гормональный состав питательной среды). В условиях проведенного эксперимента ревертирующий к норме клон березы № 2 проявил себя как гормончувствительный генотип. Культивирование первичных эксплантов (при их введении в условия in vitro) на питательной среде с цитокинином 6-БАП (0.5–1 мг/л) могло изменить эндогенный баланс гормонов в соматической ткани, что, в свою очередь, повлияло на характер экспрессии KNOXI-генов (вызвало их сайленсинг) и морфогенез листа (привело к супрессии мутантного морфотипа “рассеченный лист”). Ранее нами было установлено более высокое содержание регуляторов роста индольной (ауксины) и фенольной природы в побегах ревертанта № 2 по сравнению с растениями клонов № 1 и № 3 со стабильным проявлением признака рассеченнолистности в культуре in vitro (Исаков и др., 2004; Самсонова и др., 2010). Косвенным показателем изменения характера экспрессии генов (в частности, генов рРНК), повышения метаболической активности клеток листовой меристемы клона № 2 является существенное увеличение (по сравнению с клоном № 1) доли клеток с остаточными ядрышками в метафазе и анафазе митоза (рис. 8).
Специфическая реакция (гормончувствительность) генотипа № 2, по-видимому, проявлялась и на воздействие ауксина ИУК в концентрации 2 мг/л. У клона-ревертанта с нормальными цельными листьями наблюдалось частичное (у 40% растений клона) восстановление исходного фенотипа “рассеченный лист” (табл. 1). У остальных клонов березы в тех же условиях культивирования изменений морфологии листа не отмечено.
Переход от рассеченной формы листа к дикому типу (цельный лист) и обратно в условиях культуры in vitro может осуществляться с помощью эпигенетических механизмов как результат взаимодействия генотип-среда. В этом случае в ходе адаптации генотипа к изменяющимся условиям среды (изолирование экспланта от исходного дерева, его введение в культуру in vitro, субкультивирование с использованием гормональных, а затем безгормональных питательных сред) могут происходить существенные изменения экспрессии генов (в том числе ключевых генов-регуляторов). Известно, что неактивное (или, наоборот, активное) состояние генов может стабильно наследоваться в клеточных поколениях в ходе митотических делений и неограниченно долго сохраняться при вегетативном размножении (Ежова, 2008; Лутова, 2010; Lebedeva et al., 2017).
Результаты наших кариологических исследований указывают на более высокую степень компактизации хроматина метафазных хромосом клона-ревертанта № 2 в условиях in vitro по сравнению с клоном № 1 с рассеченными листьями (рис. 7, табл. 3), что в свою очередь, явилось одной из возможных причин подавления транскрипционной активности KNOX1-генов. В литературных источниках отмечается влияние уровня компактизации хроматина на экспрессию гомеобоксных генов (Pham, Sinha, 2003; Ежова и др., 2008; Лутова и др., 2010). Изменение структуры хроматина может происходить вследствие химической модификации ДНК и гистонов. Характер модификации гистонов служит эпигенетической меткой для присоединения других белков, осуществляющих ремоделирование хроматина (преобразования, ведущего к изменению структуры нуклеосом и плотности их расположения на ДНК). Компактная упаковка хроматина снижает доступность участков связывания регуляторных белков, затрудняя процесс транскрипции. Ключевыми для регуляции экспрессии генов являются метилирование и ацетилирование лизиновых остатков гистона H3 (Lebedeva et al., 2017). На модельных объектах продемонстрировано, что триметилированный H3K27 встречается в транскрипционно неактивных участках хроматина и играет важную роль в регуляции генов, контролирующих развитие организма (в том числе, морфогенез листа) (Zhang et al., 2007; He et al., 2012; Lebedeva et al., 2017).
Метилирование ДНК в генах (в том числе в их промоторах) обычно ассоциировано с подавлением транскрипции (Zilberman et al., 2007), поскольку приводит к более плотной упаковке хроматина и невозможности присоединения в этом районе ДНК транскрипционного комплекса (Razin, 1998).
Показано, что эпигенетическая репрессия генов KNOX происходит с участием транскрипционных факторов ASYMMETRIC LEAF 1 (AS1), ASYMMETRIC LEAF 2 (AS2), белков группы CURLY LEAF (CLF), SWINGER (SWN), POLYCOMB REPRESSIVE COMPLEX (PRC) и других (Лутова и др., 2010). SET домены CLF и SWN обладают активностью гистонметилтрансферазы, которая облегчает поддержание сайленсинга экспрессии целевого гена в течение нескольких клеточных делений (Hay, Tsians, 2010). Репрессивный комплекс PRC связывается с метилированными гистонами, что приводит к подавлению транскрипции генов KNOX (Xu, Shen, 2008). Для репрессии транскрипции генов KNOX в примордии листа также необходим фактор ремоделинга хроматина HIRA, контролирующий образование гетерохроматина (Lutova et al., 2015).
На эпигенетическую природу наблюдаемых изменений у клона № 2, указывают и наши эксперименты по использованию эпимутагена 5-азацитидина, при добавлении которого в питательную среду у отдельных растений ревертанта (имеющего цельный лист) наблюдалось формирование листьев с слабым рассечением (табл. 1). Известно, что эпимутаген 5-азацитидин оказывает деметилирующее влияние на ДНК (Ванюшин, 2013; Малецкий, 2009). Он встраивается в молекулу ДНК при репликации и ковалентно связывает метилтрансферазы, которые обеспечивают процесс метилирования.
Можно предположить, что добавление в питательную среду 5-аза обеспечило восстановление исходного статуса метилирования ДНК в клетках листовой меристемы клона № 2, что, в свою очередь, привело к снижению уровня компактизации хроматина, индуцировало возобновление экспрессии группы координировано функционирующих регуляторных генов (в том числе, KNOXI-генов) и появление листовых пластинок с признаками рассечения. Однако, наблюдаемый эффект был непродолжительным и исчезал при исключении деметилирующего агента из питательной среды.
Слабое рассечение листа у клона № 2 наблюдалось и при воздействии никотиновой кислоты (10 мг/л), которую также относят к числу эпимутагенов. В опытах с мягкой пшеницей было продемонстрировано, что обработка прорастающих семян никотиновой кислотой природного происхождения индуцировала длительно наследуемые (в течение 57 поколений) эпигенетические изменения (Богданова, 2003). Это проявлялось в изменении ряда морфофизиологических признаков, появлении высокорослых и продуктивных растений, устойчивых к экстремальным воздействиям окружающей среды. У измененных растений (названных Генотроф 1) выявлено повышенное (по сравнению с исходным сортом) содержание ядерной ДНК и РНК (что автор объясняет амплификацией генов под действием НК), измененный спектр и активность эндогенных регуляторов роста.
По всей видимости, именно индивидуальные (генотипические и физиолого-биохимические) особенности клонов березы с относительно стабильным проявлением признака рассеченнолистности определили неоднозначность их реакции на экзогенное воздействие этих же эпимутагенов (рис. 5а, 5б). Отмеченные изменения, по-видимому, также имеют эпигенетическую природу и исчезают при исключении 5-аза и НК из среды.
Таким образом, выявленный нами (у одного из 8-ми клонов березы далекарлийской) феномен изменения морфогенеза листа в процессе культивирования in vitro (переход от рассеченной формы листа к дикому типу – цельный лист) по всей видимости, имеет эпигенетическую природу. На это указывают: выраженная реакция (появление листьев с рассечением) эксплантов на воздействие 5-азацитидина (который изменяя уровень метилирования ДНК, по-видимому, приводит к разрыхлению хроматина и активации целой группы регуляторных генов, в том числе ключевых KNOX1-генов); положительный отклик на никотиновую кислоту; наличие остаточных ядрышек в митозе клеток листовой меристемы. Результаты исследований показали, что данный генотип (клон № 2) характеризуется также повышенной гормончувствительностью к воздействию регуляторов роста цитокининовой (6-БАП) и ауксиновой (ИУК) природы.
Мы предполагаем, что изменение гормонального статуса клетки (при введении эксплантов в культуру in vitro и начальных этапах культивирования), уровня метилирования ДНК и степени компактизации хроматина могли привести к подавлению экспрессии гомеобоксных KNOX1-генов (кодирующих транскрипционные факторы, влияющих на морфогенез листа) и реверсии к дикому типу (цельному листу). Причем, индуцированное условиями культивирования in vitro “эпигенетическое молчание” достаточно стабильно и долговременно, передается по клеточным поколениям в процессе клонального микроразмножения (наблюдается на протяжении 16–19 лет культивирования in vitro), а также сохраняется после высадки микрорастений в теплицу (ex vitro).
Таким образом, согласно литературным, а также нашим экспериментальным данным, природа рассеченности листа у березы может иметь как мутационную, так и эпигенетическую природу. Исчезновение этого признака у далекарлийской березы при семенном размножении связывают с рецессивной мутацией, вызывающей рассеченность листа (Исаков и др., 2004). В тоже время, исчезновение проявления признаков характерно и для генетических химер, у которых мутация затрагивает клетки только определенных слоев апикальной меристемы. В частности, если мутация произошла в клетках слоя L1 (из которых образуется эпидермис побега) или L3 (из которых формируются внутренние ткани листа и стебля), то признак исчезнет у половых потомков, поскольку у двудольных растений гаметы формируются из слоя L2 (Pogany, Lineberger, 1990; Лутова и др., 2010). У вегетативно размножаемых растений химеры (в том числе, периклинальные) встречаются довольно часто. При черенковании (в том числе, в культуре in vitro) может наблюдаться их разрушение (Pogany, Lineberger, 1990; Лутова и др., 2010).
Предполагают, что рассеченные листья в эволюционном плане являются более молодыми (по сравнению с простыми цельными листьями) (Тахтаджян, 1964). Возможно поэтому рассеченнолистная береза далекарлийская (являющаяся формой березы повислой с цельными листьями) сильнее (хотя и по-разному для разных генотипов) реагирует на сигналы внешней и внутренней среды. Реализация же разнообразных эпигенетических механизмов регуляции генов, по-видимому, обусловливает высокую (хотя и неоднозначную) пластичность генотипа к выбору программ развития листа в различных условиях культивирования in vitro.
Мы показали, что культивируемые in vitro клоны березы далекарлийской, контрастные по стабильности проявления признака рассеченнолистности, являются перспективной моделью для дальнейшего изучения генетики морфогенеза листа древесных растений, механизмов эпигенетической изменчивости. Подобные исследования также имеют и прикладное значение, поскольку генотипы со стабильным проявлением признака рассеченнолистности в условиях культуры in vitro представляют интерес для клонального микроразмножения с целью получения посадочного материала с гарантированным сохранением морфотипа с декоративными листьями.
Список литературы
Богданова Е.Д. Эпигенетическая изменчивость, индуцированная никотиновой кислотой у Triticum aestivum L. // Генетика. 2003. Т. 39. № 9. С. 1221–1227.
Буторина А.К. Цитогенетика хозяйственно-ценных форм карельской березы // Генетика. 1985. Т. XXI. № 7. С. 1192–1198.
Буторина А.К., Тиен Д.Н. Ритмы суточной митотической активности у золотистой фасоли Vigna radiate (L.) R. Wilczek // Цитология. 2008. Т. 50. № 8. С. 729–733.
Ванюшин Б.Ф. Эпигенетика сегодня и завтра // Вавиловский журнал генетики и селекции. 2013. Т. 17. № 4/2. С. 805–832.
Ветчинникова Л.В. Карельская береза и другие редкие представители рода Betula L. М.: Наука, 2005. 269 с.
Гендельс Т.В. Особенности морфогенеза листа двудольных // Ботанический журнал. 1988. Т. 73. № 11. С. 1554–1559.
Ежова Т.А. Генетический контроль ранних этапов развития листа // Онтогенез. 2007. Т. 38. № 6. С. 434–445.
Ежова Т.А. Генетическая и эпигенетическая регуляция морфогенеза листа // Вестник ТвГУ, серия “Биология и экология”. 2008. № 9. С. 66–75.
Исаков Ю.Н., Табацкая Т.М., Машкина О.С. и др. Генетико-селекционные особенности рассеченнолистной формы березы повислой // Генетика в XXI в.: современное состояние и перспективы развития. М.: УРСС, 2004. Т. 1. С. 184.
Корона В.В., Васильев А.Г. Строение и изменчивость листьев растений: Основы модульной теории. Екатеринбург: УрО РАН, 2007. 280 с.
Лутова Л.А., Додуева И.Е. Роль меристемоспецифичных генов растений в формировании генетических опухолей // Онтогенез. 2007. Т. 38. № 6. С. 420–433.
Лутова Л.А., Ежова Т.А., Додуева И.Е. и др. Генетика развития растений. СПб.: Изд-во Н-Л, 2010. 432 с.
Макарова Т.П. Сравнительный кариологический анализ березы повислой и березы пушистой центральной части Южной тайги: Автореф. дис. … канд. биол. наук. М., 1989. 19 с.
Малецкий С.И. Семантическая структура понятий “наследственность” и “эволюция” // Вестник ВОГиС. 2009. Т. 13. № 4. С. 820–852.
Падутов В.Е., Баранов О.Ю., Воропаев Е.В. Методы молекулярно-генетического анализа. Минск: Юнипол, 2007. 176 с.
Самсонова А.Е., Табацкая Т.М., Машкина О.С. и др. Фитогормоны и стабильность проявления признака разрезнолистности березы повислой при культивировании in vitro // Организация и регуляция физиолого-биохимических процессов. Воронеж: ООО “Центрально-Черноземное книжное издательство”, 2010. Вып. 12. С. 200–207.
Табацкая Т.М., Машкина О.С. Опыт долговременного хранения коллекции ценных генотипов березы с использованием безгормональных питательных сред // Лесоведение. 2020. № 2. С. 147–161.
Тахтаджян А.Л. Основы эволюционной морфологии покрытосеменных М.–Л.: Наука, 1964. 236 с.
Bar M., Ori N. Leaf development and morphogenesis // Development. 2014. V. 141. № 22. P. 4219–4230.
Baker-Brosh K.F., Peet R.K. The ecological significance of lobed and toothed leaves in temperate forest trees // Ecology. 1997. V. 78. № 4. P. 1250–1255.
Barkoulas M., Galinha C., Grigg S.P. et al. From genes to shape: regulatory interactions in leaf development // Curr. Opin. Plant Biol. 2007. V. 10. № 6. P. 660–666.
Bian X., Qu C., Zhang M. et al. Transcriptome analysis provides new insights into leaf shape variation in birch // Trees. 2019. V. 33, № 5. P. 1265–1281.
Bilsborough G. D., Runions A., Barkoulas M. et al. Model for the regulation of Arabidopsis thaliana leaf margin development // Proc. Natl. Acad. Sci. 2011. V. 108. № 8. P. 3424–3429.
Canales C., Barkoulas M., Galinha C. et al. Weeds of change: Cardamine hirsuta as a new model system for studying dissected leaf development // J. Plant Res. 2009. V. 123. № 1. P. 25–33.
Chitwood D.H., Sinha N.R. Evolutionary and environmental forces sculpting leaf development // Curr. Biol. 2016. V. 26. № 7. P. 297–306.
Daban J.R. Electron microscopy and atomic force microscopy studies of chromatin and metaphase chromosome structure // Micron. 2011. V. 42. № 8. P. 733–750.
DeMason D.A., Villani P.J. Genetic control of leaf development in pea (Pisum sativum) // International Journal of Plant Sciences. 2001. V. 162. № 3. P. 493–511.
Doyle J.J., Doyle J.L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue // Phytochemical Bulletin. 1987. № 19. P. 11–15.
Hay A., Tsiantis M. KNOX genes: versatile regulators of plant development and diversity // Development. 2010. V. 137. № 19. P. 3153–3165.
He C., Chen X., Huang H. et al. Reprogramming of H3K27me3 is critical for acquisition of pluripotency from cultured Arabidopsis tissues // PLoS Genet. 2012. V. 8. № 8. P. e1002911.
Iliev I., Scaltsoyiannes A., Tsaktsira M. et al. Micropropagation of Betula pendula Roth cultivars by adventitious shoot induction from leaf callus // Acta Horticulturae. 2010. № 885. P. 161–173.
Janssen B.J., Williams A., Chen J.J. et al. Isolation and characterization of two knotted-like homeobox genes from tomato // Plant Mol. Biol. 1998. V. 36. Issue 3. P. 417–425.
Jinxiu Ke, Duo Chen, Yanping Guo. Designing leaf marginal shapes: Regulatory mechanisms of leaf serration or dissection // Biodiversity Science. 2018. V. 26. № 9. P. 988–997.
Kawamura E., Horiguchi G., Tsukaya H. Mechanisms of leaf tooth formation in Arabidopsis // Plant J. 2010. V. 62. № 3. P. 429–441.
Kidner C.A. The many roles of small RNAs in leaf development // J. Genet Genomics. 2010. V. 37. № 1. P. 13–21.
Kong X., Huang G., Xiong Y. et al. IBR5 regulates leaf serrations development via modulation of the expression of PIN1 // Int. J. Mol. Sci. 2019. V. 20. № 18. P. 4429.
Kulju K.K.M., Pekkinen M., Varvio S. Twenty-three microsatellite primer pairs for Betula pendula (Betulaceae) // Molecular Ecology Notes. 2004. V. 4. № 3. P. 471–473.
Lebedeva M.A., Tvorogova V.E., Tikhodeyev O.N. Epigenetic mechanisms and their role in plant development // Russ. J. Genet. 2017. V. 53. № 10. P. 1057–1071.
Lutova L.A., Dodueva I.E., Lebedeva M.A. et al. Transcription factors in developmental genetics and the evolution of higher plants // Russ. J. Genet. 2015. V. 51. № 5. P. 449–466.
Mashkina O.S., Butorina A.K., Tabatskaya T.M. Karelian birch (Betula pendula Roth var. carelica Merkl.) as a model for studying genetic and epigenetic variation related to the formation of patterned wood // Russ. J. Genet. 2011. V. 47. № 8. P. 951–957.
Maugarny-Calès A., Laufs P. Getting leaves into shape: A molecular, cellular, environmental and evolutionary view // Development. 2018. V. 145. № 13. P. 1–16.
Migalina S.V., Ivanova L.A., Makhnev A.K. Changes of leaf morphology in Betula pendula Roth and B. pubescens Ehrh. along a zonal-climatic transect in the Urals and Western Siberia // Russ. J. Ecol. 2010. № 41. P. 293–301.
Mu H., Lin L, Liu G. et al. Transcriptomic analysis of incised leaf-shape determination in birch // Gene. 2013. V. 531. Issue 2. P. 263–269.
Muller K., He X., Fischer R. et al. Constitutive knox1 gene expression in dandelion (Taraxacum officinsle Web.) changes leaf morphology from simple to compound // Planta. 2006. V. 224. P. 1023–1027.
Murashige T., Skoog F. A revised medium for rapid growth and bio assays with Tobacco tissue cultures // Phisiol. Plant. 1962. V. 15. № 13. P. 473–497.
Parkhurst D. F., Loucks O.L. Optimal leaf size in relation to environment // Journal of Ecology. 1972. V. 60. № 2. P. 505–537.
Perez-Morales M.B., Covarrubias A.A., Reyes J.L. The key role of small RNAs in the making of a leaf // Ind. J. Plant Physiol. 2017. V. 22. № 4. P. 393–400.
Pham T., Sinha N. Role of Knox genes in shoot development of Welwitschia mirabilis // J. Plant Sci. 2003. V. 164. P. 333–343.
Pogany M.F., Lineberger R.D. Phenotypic variation during micropropagation of the chimera Rhododendron ‘President Roosevelt’ // Plant Cell Tiss. Organ. Cult. 1990. № 21. P. 201–209.
Pulido A., Laufs P. Co-ordination of developmental processes by small RNAs during leaf development // J. Experimental Botany. 2010. V. 61. Issue 5. P. 1277–1291.
Razin A. CpG methylation, chromatin structure and gene silencing – a three-way connection // The EMBO J. 1998. V. 17. № 17. P. 4905–4908.
Royer D.L. Leaf shape responds to temperature but not CO2 in Acer rubrum // PLoS One. 2012. V. 7. № 11: e49559.
Runions A., Tsiantis M. The shape of things to come: From typology to predictive models for leaf diversity // Am. J. Bot. 2017. V. 104. № 10. P. 1437–1441.
Rybaczek D. Ultrastructural changes associated with the induction of premature chromosome condensation in Vicia faba root meristem cells // Plant Cell Rep. 2014. № 33. P. 1547–1564.
Silva P.O., Batista D.S., Cavalcanti J.H.F. et al. Leaf heteroblasty in Passiflora edulis as revealed by metabolic profiling and expression analyses of the microRNAs miR156 and miR172 // Ann. Bot. 2019. V. 123. № 7. P. 1191–1203.
Smykal P., Valledor L., Rodríguez R. et al. Assessment of genetic and epigenetic stability in long-term in vitro shoot culture of pea (Pisum sativum L.) // Plant Cell Reports. 2007. V. 26. № 11. P. 1985–1998.
Taper L.J., Grant W. F. The relationship between chromosome size and DNA content in birch (Betula) species // Caryologia. 1973. V. 26. № 2. P. 263–273.
Wang H., Jones B., Li Z. et al. The tomato Aux/IAA transcription factor IAA9 is involved in fruit development and leaf morphogenesis // Plant Cell. 2005. V. 17. № 10. P. 2676–2692.
Xu L., Shen W.H. Polycomb silencing of KNOX genes confines shoot stem cell niches in Arabidopsis // Curr. Biol. 2008. V. 18. № 24. P. 1966–1971.
Zhang X., Clarenz O., Cokus S. et al. Whole-genome analysis of histone H3 lysine 27 trimethylation in Arabidopsis // PLoS Biol. 2007. V. 5. № 5. P. e129.
Zhang L.-J., He J.-Y., Sun X.-M. Tissue Culture and Plantlet Regeneration of Betula pendula Roth ‘Dalecarlica’ // Forest Research. 2018. V. 31. № 4. P. 135–141.
Zilberman D., Gehring M., Tran R.K. et al. Genome-wide analysis of Arabidopsis thaliana DNA methylation uncovers an interdependence between methylation and transcription // Nature Genetics. 2007. V. 39. № 1. P. 61–69.
Дополнительные материалы отсутствуют.