Онтогенез, 2021, T. 52, № 1, стр. 10-18
Локализация РНК Germes в ооцитах Xenopus
М. Б. Пономарев a, В. В. Кондукторова b, *, Н. Н. Лучинская b, А. В. Белявский a
a Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, Вавилова, 32, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: virgo584@yandex.ru
Поступила в редакцию 30.05.2020
После доработки 26.06.2020
Принята к публикации 30.06.2020
Аннотация
Идентифицированный нами ранее ген Germes экспрессируется в ооцитах Xenopus, мРНК которого ассоциируется с половой плазмой. В настоящем исследовании были охарактеризованы цис-действующие факторы, которые регулируют локализацию РНК germes в развивающемся ооците. Инъекция флуоресцентно меченых РНК, соответствующих различным частям последовательности мРНК germes, продемонстрировала, что последовательность, необходимая и достаточная для правильной локализации в митохондриальное облако ооцита ранней стадии развития, расположена в 3'НТО. Было обнаружено, что домен, богатый CAC-мотивами, выявленными в дистальной части 3 'НТО, является достаточным для локализации РНК. В пределах этого домена были идентифицированы один незначительный (а) и два необходимых (b и с) поддоменов. Было обнаружено, что 37-буквенный субдомен c, примыкающий к поли-A хвосту, нужен для локализации, поскольку его удаление из нескольких протестированных конструкций лишает их способности к локализации. Анализ последовательности 3 'НТО показал наличие трех различных мотивов локализации РНК в ооците.
ВВЕДЕНИЕ
Локализация молекул РНК в клетках является важным и широко распространенным механизмом регуляции целого ряда клеточных функций. У многих видов животных РНК, локализованные в ооците, играют решающую роль в раннем развитии, инициируя разнообразные процессы в различных областях зародыша. Такие эндогенные РНК могут концентрироваться в ооците на анимальном или вегетативном полюсе, но на вегетативном полюсе концентрирование за счет заякоривания в кортексе идет массово (King et al., 2005). Некоторые из локализованных материнских РНК сосредоточены на вегетативном полюсе в половой плазме – особой структуре, определяющей развитие первичных половых клеток у некоторых многоклеточных, включая бесхвостых амфибий. Как правило РНК участвующие в ранней разметке зародышей Xenopus и специализации соматических тканей локализуются на вегетативный полюс на более поздней стадии развития ооцита, чем РНК половой плазмы (Kloc, Etkin, 1995). Механизм локализации РНК в превителлогенных ооцитах (стадия I) включает в себя первоначальную ассоциацию этих РНК с околоядерной структурой, называемой митохондриальным облаком (MО), и носит название раннего или METRO (Message Transport Organizer) опосредованного. В начале вителлогенеза (стадии II–III) МО приходит в контакт с вегетативным кортексом ооцита, где и закрепляются РНК и белки МО. Позже с III стадии роста ооцита и вплоть до созревания половая плазма выглядит как островки в субкортикальной области. Поздно вегетативно локализующиеся РНК используют механизм, включающий транспорт по микротрубочкам с участием кинезинов (Yisraeli et al., 1990; Betley et al., 2004; Yoon and Mowry, 2004; King et al., 2005).
Однако жесткой корреляции способа и времени локализации нет. Houston даже выделяет особый “промежуточный” путь (Houston, 2013). Для ряда РНК показана способность использовать оба эти пути. Так, РНК wnt11, как правило, локализуется ранним путем, но ее также обнаруживают в РНП частицах позднего пути. Другой пример – РНК половой плазмы Xcat2/nos1, Xpat, Xlsirt, использующие механизм METRO, могут локализоваться в островки по механизму позднего пути (Zhou, King, 1996; Hudson, Woodland, 1998; Berekelya et al., 2003). И наоборот, ключевые вегетативные РНК Vg1 и VegT, локализующиеся по позднему пути, обнаруживают в структурах половой плазмы (ПП), сформированных ранним механизмом (Nijjar, Woodland, 2013). Для РНК ПП germes основным путем локализации является METRO, но после инъекций в ооцит на поздних стадиях обнаруживается в ПП, что говорит о возможности локализации эндогенной РНК, не попавшей в МО на ранней стадии, использовать поздний путь (Berekelya et al., 2003, 2007).
Исследования механизмов локализации различных мРНК у Xenopus привели к открытию множества цис-действующих элементов локализации (ЭЛ), в основном, в 3'-нетранслируемой области (НТО) последовательности РНК и транс-действующих с ними белков. Стало ясно, что единой консенсусной последовательности локализации РНК не существует. ЭЛ могут быть разной длины, как правило, около 300 п.н. (Bubunenko et al., 2002). У многих РНК были найдены одинаковые мотивы в элементах локализации, которые, как полагают, могут конкурировать за одни и те же транс-действующие белки (Houston, 2013). За последнее время накоплено немало такого рода данных, однако, ясной схемы локализации различных РНК к вегетативному полюсу ооцита по-прежнему нет.
Описанная нами ранее РНК гена Germes локализуется в ооцитах Xenopus на вегетативный полюс по раннему механизму (Berekelya et al., 2003). Целью настоящего исследования было найти необходимый и достаточный ЭЛ, охарактеризовать цис-действующие последовательности, ответственные за это. Как и для многих других локализующихся РНК, было установлены мотивы, содержащие CAC элементы в 3'НТО germes. Попытки уменьшить размеры ЭЛ были в основном безуспешными, что указывает на то, что общая вторичная структура этого региона РНК важна для его функции.
МАТЕРИАЛЫ И МЕТОДЫ
Создание конструктов
В работе были использованы следующие олигонуклеотиды:
xGer-3U/Xho-S9: TCATCTCGAGTAAAGATGGTAAAGACTGAAAA;
xGer-3U/Xho-S8: TCATCTCGAGTATTGTTGGAGTGCAGTTTTT;
xGer-3U/Xho-S7: TCATCTCGAGTGTTTAGATGTGTCTTATATTTAG;
xGer-3U/Sal-A6: CTGAGTCGACATAAAATATTTGAATTTATTGAGG;
XhoI-UTR/s6: TCATCTCGAGTATCACTTTCTGCACTTTTT;
SpeI-UTR/as5: CAACTAGTATCCAATCTTATCAAATC;
SpeI-UTR/s5: AGACTAGTATAACTTTTGAACCAC;
SalI-UTR/as4: CTGAGTCGACGTATTAATTAGAAGTTGTG;
XhoI-UTR/s4: CATCCTCGAGTGCAAAATTGTCACTTG;
XhoI-UTR/s3: GACACTCGAGATAACTTTTGAACCACACTG;
XhoI-UTR/s2: CAGACTCGAGAAAAAAATGTATTTCATTTG;
UTR/as1: ACAAGCATGCACAGACTACAAATGAAATAC;
UTR/s1: GGCTTCATGCATGCAAAATTG.
Для получения конструкций для экспрессии поддоменов 3'НТО germes соответствующие фрагменты кДНК амплифицировали с плазмиды, содержащей полнодлинновую кДНК germes, с использованием следующих пар праймеров для указанных клонированных поддоменов.
c: XhoI-UTR/s4 & xGer-3U/Sal-A6
bc: XhoI-UTR/s3 & xGer-3U/Sal-A6
Lbc: XhoI-UTR/s2 & xGer-3U/Sal-A6
abc: XhoI-UTR/s6 & xGer-3U/Sal-A6
3'НТО: Ger-3U/Xho-S9 & xGer-3U/Sal-A6
a'bc: xGer-3U/Xho-S7 & xGer-3U/Sal-A6
a''bc: xGer-3U/Xho-S8 & xGer-3U/Sal-A6
abc': XhoI-UTR/s6 & SalI-UTR/as4
Lbc': XhoI-UTR/s2 & SalI-UTR/as4
bc': XhoI-UTR/s3 & SalI-UTR/as4
c': XhoI-UTR/s4 & SalI-UTR/as4.
После амплификации фрагменты обрабатывали рестриктазами XhoI и SalI, встраивали в вектор pSP73 (Promega) и после клонирования проверяли секвенированием.
Для создания конструкций с делециями основные цепи, лишенные соответствующих областей, амплифицировали из плазмиды, содержащей полную 3'НТО со следующими парами праймеров:
3'UTRΔa: SpeI-UTR/s5 & SpeI-UTR/as5
3'UTRΔb: UTR/s1 & UTR/as1.
Конструкт 3'UTRΔc был сделан из конструкта 3'НТО, путем удаления области рестриктазами SphI и SnaBI.
Создание флуоресцентных РНК зондов
РНК-зонды были синтезированы с плазмид с помощью стандартных техник по протоколу производителя (mMessage mMachine, Ambion) с добавлением Alexa488-UTP или тетраметилродамин-UTP (Molecular Probes) и смеси немеченых нуклеотидов (соотношение 1 : 5). Несвязанные нуклеотиды удаляли с использованием колонок Sephadex G-50 Quick Spin (Roche).
Микроинъекции
Ооциты I/II стадии (или III/IV) (по Dumont, 1972) высвобождали из иссеченных яичников после обработки коллагеназой А (Sigma, 0.8 мг/мл в 0.1 М NaH2PO4, рН 7.4) путем легкого покачивания в среде L-15: 50% среда Leibowitz (Sigma) с добавлением 1 мг/мл BSA, 100 мкг/мл гентамицина, 1 ед./мл пенициллина и 1 мкг/мл стрептомицина. Затем ооциты промывали трижды и переносили в свежую среду. Микроинъекции в обьеме 30–100 пл (в концентрации 1 мг/мл ) проводили с помощью аппарата Eppendorf Femtojet. После инъекций ооциты переносили в свежую среду L-15, но без БСА с добавлением 1 мМ L-глутамина, 1 мкг/мл инсулина, 15 мМ Hepes (pH 7.8), 50 ед./мл нистатина и 5–10% сыворотки Xenopus, содержащей вителлогенин (Opresko, 1991). Культивирование проводили в темноте при 18°C в герметичных камерах, состоящих из двух стеклянных покровных стекол, разделенных прокладкой из увлажненной фильтровальной бумаги (Zhou, King, 1996).
Конфокальная микроскопия ооцитов
Для визуализации эндоплазматического ретикулума в ооциты инъецировали 30 пл насыщенного DiIC16 в растительном масле Wesson (Terasaki, Jaffe, 1991). Изображения были получены через 3–30 ч после введения РНК. Для исследований мутаций две РНК, синтезированные в присутствии различных флуоресцентных меток (Alexa488 и Tetramethylrhodamine), смешивали в равном молярном соотношении и инъецировали в ооциты. После инкубации в течение 24–48 ч ооциты исследовали на инвертированном конфокальном микроскопе Leica SP2 с использованием программного обеспечения Leica и ImageJ.
РЕЗУЛЬТАТЫ
РНК germes локализуется в митохондриальное облако с помощью 3'НТО
Для определения цис-последовательности, ответственной за локализацию РНК germes, флуоресцентно меченые синтетические РНК или РНК участков регионов germes инъецировали в ранние ооциты (ст. I–II/III), а затем исследоваловали их распределение с помощью конфокальной микроскопии. Через 24–48 часов после инъекции полноразмерная РНК germes локализовалась в МО ооцитов, что соответствует раннему механизму локализации (рис. 1а, 1б). Кроме того, было показано, что как полноразмерная РНК germes, так и 3'НТО РНК колокализуются в МО с совместно инъецированной 3'НТО РНК xcat2 (nanos homolog 1) (рис. 1в, 1г), в отличие от РНК открытой рамки считывания (ORF) germes, которая оставалась равномерно распределенной в цитоплазме (данные не приводятся). Был сделан вывод, что за правильную локализацию РНК germes в ооците необходимой и достаточной является 3'НТО, где должны содержаться цис-действующие элементы локализации.
Рис. 1.
3'НТО ответственна за локализацию РНК germes в митохондриальное облако ооцитов. (а, б) Полноразмерная флуоресцентно меченая мРНК germes локализуется в ооцитах I (а) и II/III (б) стадий преимущественно в МО через 24–48 ч. (в, г) Флуоресцентно меченые 3'НТО РНК germes (в) и xcat2 (г) совместно инъецированные в оцитах I/II стадии также локализуются в МО, однако xcat2 концентрируется на его границах, в отличие от равномерно распределенного germes. Я – ядро, МО – митохондриальное облако.
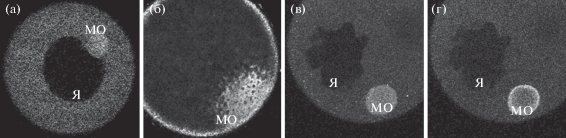
Удалось показать, что инъецированные флуоресцентные РНК xcat2 и germes по-разному распределяются внутри МО: РНК germes – равномерно, а РНК Xcat2 концентрируется на границах МО (рис. 1в–1г). Локализация других мРНК в разных компартментах МО отмечалась и ранее при исследовании локализации методом электронной микроскопии (Kloc et al., 2002).
CAC-богатый регион 3'НТО РНК germes необходим для локализации
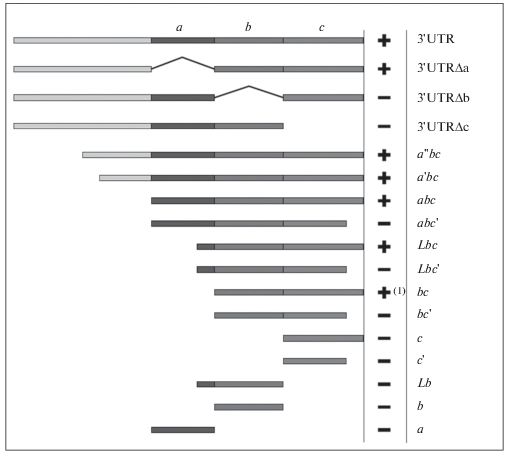
Для идентификации области мРНК germes, возможно вовлеченной в локализацию, полноразмерная последовательность была проанализирована с помощью программы REPFIND (Betley et al., 2002). Протяженный домен, богатый CAC-мотивами, был обнаружен в 3'-концевой области 3'НТО РНК germes (pис. 3а). Первоначально, мы подразделили его на три условных поддомена, которые были обозначены как a, b и c (рис. 3б).
Инъекция родамин-меченой РНК 3'НТО, в которой отсутствуют области a, b или c, совместно с Alexa–488-меченой РНК 3'НТО (в качестве положительного контроля) в ооциты I/II стадии показала, что РНК, лишенные областей b или c, были полностью или частично исключены из МО, в отличие от полноразмерной РНК 3'НТО (рис. 2а–2г). Удаление области а не препятствовало локализации РНК в МО (не показано). Можно сделать вывод, что дистальные CAC повторы поддоменов b и c необходимы для правильной локализации РНК germes, тогда как поддомен a не является обязательным, хотя и влияет на процесс.
Рис. 2.
Локализация РНК поддоменов 3'НТО germes. (а–г) РНК 3'НТО с делецией поддомена b (б) и с делецией поддомена с (г) не локализуются в МО в отличие от совместно инъецированной полной 3'НТО в качестве положительного контроля (а и в соответственно). (д–е) РНК поддоменов bc и Lbc локализуется в МО. (ж–з) РНК поддоменов c и Lbc' исключаются из митохондриального облака. Я – ядро, МО – митохондриальное облако.
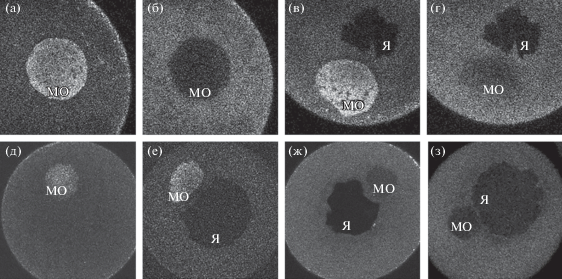
Рис. 3.
Анализ РНК germes с использованием программного обеспечения REPFIND. (а) Показаны CAC-содержащие повторы с наименьшими значениями P (изображены штрихами на последовательности). 3'НТО выделена серым цветом. (б) Домен, богатый CAC-повторами, разделен на три поддомена, a, b и c. Показаны CAC-содержащие повторы с самыми низкими значениями P. (в) Последовательность 3'НТО germes. Нумерация соответствует полноразмерной РНК germes. Минимальная локализующаяся область bc выделена серым цветом. CAC мотивы выделены курсивом с тенью. 3'-терминальная 37 п.н. область, критическая для локализации, подчеркнута. Сайт полиаденилирования показан жирным шрифтом. Отмечена повторность GCAC. Выделены мотивы VM1, E2 и MCLC.

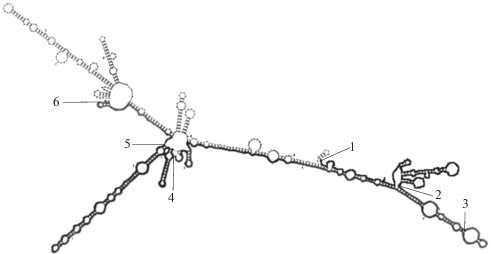
С помощью алгоритма MFOLD (Mathews et al., 1999; Zuker, 2003) была предсказана вторичная структура 3'НТО последовательности Germes, в частности CAC-богатой области. С высокой вероятностью можно предположить, что последовательность формирует компактные вторичные структуры на протяжении всей длины 3'НТО (рис. 4). Области a и b (фрагменты 1–4, рис. 4) вместе формируют совместную двухцепочечную структуру с петлями и группой шпилек, полностью сформированной поддоменом а (участок 1–2, рис. 4). Оставшаяся часть поддомена а, обозначенная как L (участок 2–3, рис. 4), образует спираль с петлями совместно с b. Регион c отмечен на рис. 4, участок 4–6, большая его часть формирует две автономные спирали с петлями, который мы условно назвали c' (участок 4–5 на рис. 4).
Рис. 4.
Вторичная структура 3'НТО РНК germes с наименьшим значением Р, полученная с использованием алгоритма MFOLD. Фрагмент 1–3 соответствует поддомену а, фрагмент 3–4 – поддомену b, фрагмент 4–6 – поддомену c, 2–4 соответствует области Lb, 4–5 – области с'.
Основываясь на анализе вторичной структуры, были синтезированы и проверены в отношении их способности к локализации в ооцитах различные фрагменты последовательности РНК, представленные на рис. 5. Флуоресцентные РНК, соответствующие этим последовательностям, инъецировали в ооциты I/II стадии. Последовательность abc локализуется в МО как и совместно вводимая полная последовательность 3'НТО в качестве положительного контроля. РНК с фрагментов a, b, c, c', abc', Lb и Lbc' не локализовались в МО (рис. 2б, 2ж, 2з). РНК abc'-конструкции отличается от abc отсутствием дистальных 37 п.н., что указывает на важность этой короткой 3'-концевой последовательности (участок 5–6 на рис. 4). Этот результат был также подтвержден аналогичными сравнениями между областями bc (рис. 2д) и bc' (не показаны) и областями Lbc и Lbc' (рис. 2е, 2з). В каждом случае удаление 3'-конца приводило к нарушению локализации РНК конструкта. Таким образом, минимальной последовательностью, поддерживающей локализацию, является область bc, хотя она окрашивает МО не типично. Следующий по размеру конструкт Lbc локализуется неотличимо от контрольной 3'НТО.
ОБСУЖДЕНИЕ
В этом исследовании мы показали, что 3'НТО РНК germes является необходимой и достаточной для ее правильной локализации в ооцитах по раннему пути. Была изучена роль различных регионов РНК 3'НТО germes в локализации. Хотя более детальный анализ делеций проведен не был, похоже, что минимальная последовательность, необходимая для локализации, не может быть меньше, чем область bc. Картина локализации в МО bc уже выглядит атипично. Усеченные на 5' или 3' конце производные области bc конструкции c и bc' теряли способность к локализации. Таким образом, ЭЛ РНК germes может быть определена как последовательность из 300 п.н., сходная с элементами локализации, определенными для ранней xcat2 (240 п.н.) и поздних локализующихся РНК Vg1 (340 п.н.) и VegT (300 п.н.) (Bubunenko et al., 2002).
Какие особенности РНК germes определяют ее поведение локализации в ооцитах? Мы не нашли четких доказательств критической роли вторичной структуры РНК. Конструкция bc, которая в соответствии с предсказаниями MFOLD не способна имитировать свертывание полной 3'НТО, локализовалась почти так же, как и полноразмерная 3'НТО и более длинные конструкции. Кроме того, было продемонстрировано, что наиболее дистальная 3'-концевая область фрагмента с, которая, как ожидалось, не участвует в компактном сворачивании областей bc или Lbc, является важной для локализации. Исследования других ЭЛ известных РНК в ооцитах Xenopus также не выявили важности вторичной структуры РНК в локализации, исключение составляет РНК Xlsirt (Allen et al., 2003). Отсутствие корреляции между предсказанной вторичной структурой РНК и ее поведением может отражать как недостатки алгоритма MFOLD, так и то, что вторичная структура РНК меняется при взаимодействии с белками.
Какова бы ни была роль вторичной структуры, CAC мотивы остаются существенными для локализации. В 3'НТО germes обнаружено 15 повторов CAC, тогда как в РНК их всего 6 (рис. 3а). Количество CAC мотивов само по себе не является достаточным для локализации РНК. В частности, область abc' содержит больше количество мотивов CAC, чем область bc, но только последняя продемонстрировала способность правильно локализоваться. Потеря одного мотива CAC в критической 3' области домена с (подчеркнута на рис. 3в) не компенсировалась добавлением домена a, содержащего три мотива CAC.
Для других РНК также известны мотивы локализации, содержащие CAC повторы, например мотив UGCAC локализации в митохондриальное облако (MCLS). Он был найден в нетранслируемой области РНК xcat2/nos1, отвечающей за локализацию в МО (Zhou, King, 1996; Chang et al., 2004). Однако для РНК xpat показано, что кластеризованные повторы UGCAC необходимы, но не достаточны для локализации в МО (Betley et al., 2002). В 3'НТО РНК germes обнаружено три мотива MCLS (UGCAC), два из которых располагаются в области bc, ответственной за локализацию.
Среди мотивов CAC, обнаруженных в 3'НТО germes, найдены 8 последовательностей UUCAC, AUCAC, ACCAC и UCCAC. Показано, что они участвуют во взаимодействии с белком Vg1RBP/ Vera/Igf2bp3 и получили название E2 (WYCAC) (Betley et al., 2002; Kwon et al., 2002). Необходимо заметить, что локализация многих РНК в ооцитах многих видов хордовых сопряжена с наличием E2 (UUCAC) мотива и взаимодействием с белком Vg1RBP/Vera/Igf2bp3 (Betley et al., 2002).
В РНК germes имеется также цис-действующая последовательность мотива, названного VM1(YYUCU): UUUCU, CUUCU, UCUCU. Последовательность связывает белок hnRNPI/ VgRBP60/Ptbp1 (Cote et al., 1999; Lewis et al., 2004). В двух работах было продемонстрировано, что кластеризация сайтов связывания белков Vg1RBP/Vera/Igf2bp3 и hnRNPI/VgRBP60/Ptbp1 имеет решающее значение для локализации РНК Vg1 и VegT по позднему пути (Bubunenko et al., 2002; Snedden et al., 2013). Интересно, мотивы E2 и VM1 важны для локализации как к вегетативному, так и анимальному полюсу, как это показано для PHAX РНК (Snedden et al., 2013). В РНК germes сайты E2 и VM1 также кластеризованы, однако находятся вне зоны bc, ответственной за локализацию.
Choo c соавторами продемонстрировали, что ранние и поздние пути локализации РНК используют общие клеточные механизмы. Мотивы MCLC (UGCAC), E2 (UUCAC) важны для локализации РНК как ранним, так и поздним путем (Choo et al., 2005). РНК germes также содержит мотивы ранней и поздней локализации. Именно они, по видимому, обеспечивают локализацию на вегетативный полюс после инъекции РНК в ооциты стадии III–IV по позднему механизму. Возможно, это путь используется и эндогенной РНК germes. На стадии II–III не вся РНК сконцентрирована в МО и транспортируется по раннему пути, существенная часть РНК остается распределeнной по объeму ооцита. Можно предположить, что эта РНК использует поздний механизм для локализации в половую плазму вегетативного полюса.
Список литературы
Allen L., Kloc M., Etkin L.D. Identification and characterization of the Xlsirt cis-acting RNA localization element // Differentiation. 2003. V. 71. P. 311–321.
Berekelya L.A., Ponomarev M.B., Luchinskaya N.N. et al. Xenopus Germes encodes a novel germ plasm-associated transcript // Gene Expr. Patterns. 2003. V. 3. P. 521–524.
Berekelya L.A., Mikryukov A.A., Luchinskaya N.N. et al. The protein encoded by the germ plasm RNA Germes associates with dynein light chains and functions in Xenopus germline development // Differentiation. 2007. V. 75(6). P. 546–558.
Betley J.N., Frith M.C., Graber J.H. et al. A ubiquitous and conserved signal for RNA localization in chordates // Curr. Biol. 2002. V. 12. P. 1756–1761.
Betley J.N., Heinrich B., Vernos I. et al. Kinesin II mediates Vg1 mRNA transport in Xenopus oocytes // Curr. Biol. 2004. V. 14. P. 219–224.
Bubunenko M., Kress T.L., Vempati U.D. et al. A consensus RNA signal that directs germ layer determinants to the vegetal cortex of Xenopus oocytes // Dev. Biol. 2002. V. 248. P. 82–92.
Cote A. C., Gautreau D., Denegre J. et al. A Xenopus protein related to hnRNP I has a role in cytoplasmic RNA localization // Mol Cell. 1999. V. 4(3). P. 431–437.
Chang P., Torres J., Lewis R.A. et al. Localization of RNAs to the mitochondrial cloud in Xenopus oocytes through entrapment and association with endoplasmic reticulum // Mol. Biol. Cell. 2004. V. 15. P. 4669–4681.
Choo S., Heinrich B., Betley J.N. et al. Evidence for common machinery utilized by the early and late RNA localization pathways in Xenopus oocytes // Dev. Biol. 2005. V. 278. P 103–117.
Dumont J.N. Oogenesis in Xenopus laevis (Daudin). I. Stages of oocyte development in laboratory maintained animals // J. Morphol. 1972. V. 136. P. 153–179.
Hudson C., Woodland H.R. Xpat, a gene expressed specifically in germ plasm and primordial germ cells of Xenopus laevis // Mech. Dev. 1998. V. 73. P. 159–168.
Houston D.W. Regulation of cell polarity and RNA localization in vertebrate oocytes // Int. Rev. Cell. Mol. Biol. 2013. V. 306. P. 127–185.
King M.L., Messitt T.J., Mowry K.L. Putting RNAs in the right place at the right time: RNA localization in the frog oocyte // Biol. Cell. 2005. V. 97. P. 19–33.
Kloc M., Etkin L.D. Two distinct pathways for the localization of RNAs at the vegetal cortex in Xenopus oocytes // Development. 1995 V. 121. P. 287–297.
Kloc M., Dougherty M.T., Bilinski S. et al. Three-dimensional ultrastructural analysis of RNA distribution within germinal granules of Xenopus // Dev. Biol. 2002. V. 241. P. 79–93.
Kwon S., Abramson T., Munro T.P. et al. UUCAC- and Vera-dependent localization of VegT RNA in Xenopus oocytes // Curr. Biol. 2002. V. 12. P. 558–564.
Lewis R.A., Kress T.L., Cote C.A. et al. Conserved and clustered RNA recognition sequences are a critical feature of signals directing RNA localization in Xenopus oocytes // Mech. Dev. 2004. V. 121. P. 101–109.
Mathews D.H., Sabina J., Zuker M. et al. Expanded sequence dependence of thermodynamic parameters improves prediction of RNA secondary structure // J. Mol. Biol. 1999. V. 288. P. 911–940.
Nijjar S., Woodland H.R. Localisation of RNAs into the germ plasm of vitellogenic Xenopus Oocytes // PLoS ONE. 2013. V. 8(4). e61847.
Opresko L.K. Vitellogenin Uptake and in Vitro Culture of Oocytes // Methods Cell Biol. 1991. V. 36. P. 117–132.
Snedden D.D., Bertke M.M., Vernon D. et al. RNA localization in Xenopus oocytes uses a core group of trans-acting factors irrespective of destination // RNA. 2013. V. 19. P. 889–895.
Terasaki M., Jaffe L.A. Organization of the sea urchin egg endoplasmic reticulum and its reorganization at fertilization // J. Cell Biol. 1991. V. 114. P. 929–940.
Yisraeli J.K., Sokol S., Melton D.A. A two-step model for the localization of maternal mRNA in Xenopus oocytes: involvement of microtubules and microfilaments in the translocation and anchoring of Vg1 mRNA // Development. 1990. V. 108. P. 289–298.
Yoon Y.J., Mowry K.L. Xenopus Staufen is a component of a ribonucleoprotein complex containing Vg1 RNA and kinesin // Development. 2004. V. 131. P. 3035–3045.
Zhou Y., King M.L. RNA transport to the vegetal cortex of Xenopus oocytes // Dev. Biol. 1996. V. 179. P. 173–183.
Zuker M. Mfold web server for nucleic acid folding and hybridization prediction // Nucleic Acids Res. 2003. V. 31. P. 3406–3415.
Дополнительные материалы отсутствуют.