Онтогенез, 2021, T. 52, № 1, стр. 19-26
Некоторые парадоксальные явления гистофизиологии волосяных фолликулов
Э. Б. Всеволодов a, А. С. Мусаева b, *, И. Ф. Латыпов b, О. В. Бурлакова c, Е. Н. Никерясова c, В. А. Голиченков c
a Казахский национальный университет им. аль Фараби
050040 Алматы, ул. аль Фараби, 71, Республика Казахстан
b Институт общей генетики и цитологии КН МОН РК
050060 Алматы, ул. аль Фараби, 93, Республика Казахстан
c Московский государственный университет имени М.В. Ломоносова
119234 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: aimus_@mail.ru
Поступила в редакцию 12.12.2019
После доработки 18.03.2020
Принята к публикации 21.03.2020
Аннотация
Работа посвящена изучению морфологических особенностей волосяного фолликула и волоса грубошерстной овцы. Ее результаты позволяют объяснить парадоксальное явление сочетания прочного закрепления волоса в коже с его непрерывным продвижением в сторону поверхности кожи в процессе роста волос. Показано приуроченное к муфте волосяного фолликула образование выступов в кутикуле волоса и комплементарных им впадин в кутикуле внутреннего влагалища, разъединяющихся только ближе к поверхности волоса в области ниже истмуса. Изучена также изменчивость некоторых признаков волос (диаметр волоса и соотношение толщины его слоев) на стандартном участке кожи, а также влияние внешних условий на формирование структуры отдельного волоса. Обсуждаются возможные механизмы регуляции временной и пространственной изменчивости структуры волос.
ВВЕДЕНИЕ
Волосяные фолликулы рассматриваются как модельный объект биологии индивидуального развития (Oliver, 1971), гистофизиологии (Chapman, 1971) и цитофизиологии стволовых клеток (Oshima et al., 2001; Reik et al., 2001; Rhee et al., 2006; Nowak et al., 2008; Greco et al., 2009; Rompolas et al., 2012; Panteleyev, 2018), а также как объект исследования молекулярно-генетических механизмов, не только определяющих морфогенез самого волоса как деривата кожи (Panteleyev et al., 1999, 2000; Rendl et al., 2005; Hwang et al., 2008; Romano et al., 2010), но и участвующих в гистиотипической специализации, включая механизмы, обеспечивающие рецепцию клеткой внешних сигналов (Rippa et al., 2013; Rudkouskaya et al., 2014).
Волосяной фолликул демонстрирует ряд парадоксальных гистофизиологических свойств. ПАРАДОКС ПЕРВЫЙ. С одной стороны, в ходе роста волоса его погруженная в кожу корневая часть непрерывно выдвигается в сторону поверхности кожи, а затем созревающий в ходе этого движения внутри кожи волос выдвигается дальше за пределы кожи, иногда несколько лет без остановок (например, волос скальпа человека, волос мериносной овцы). С другой стороны, растущие продвигающиеся по влагалищу волосы крепко фиксированы в коже (Vsevolodov, 2017). Как можно совместить прочную фиксацию волоса с непрерывным его выдвижением из волосяного фолликула?
ВТОРОЙ ПАРАДОКС: парадоксальным можно назвать само фенотипическое разнообразие морфометрических характеристик волос (и их дериватов) в пределах индивидуального генома не только в пределах анатомической локализации (например, скальп, кожа тела, ладонь, дорсальная и вентральная поверхность концевых фаланг пальцев человека), но и в пределах анатомически обозначенных территорий. Если механизмы развития волоса, связанных с территориальными различиями, в достаточной мере исследованы (Всеволодов и др., 2015а), то формирование морфогенетических особенностей разнообразия волос внутри выделенных гомологичных территорий обращало на себя внимание исследователей в меньшей степени. Цель настоящей работы – попытка разрешения отмеченных парадоксов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом исследования служили образцы кожи и волос грубошерстных овец Ovis aries из стада экспериментальной базы Института экспериментальной биологии Комитета науки Министерства образования и науки Республики Казахстан (г. Алматы), расположенной в Илийском районе Алматинской области. Взятие биопсийного материала проводили с соблюдением биоэтических норм, руководствуясь требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях. Под местной анестезией (инъекция 2% раствора новокаина) у овцы иссекали участок кожи размером 0.5 × 0.5 см на дорзальной поверхности в области крестца, предварительно срезав образцы волос с этого участка. Рану обрабатывали антисептиком и овцу отпускали в стадо. В работе использованы образцы, взятые у 10 овец, не состоящих в прямом генетическом родстве. Биопсийный материал кожи от каждой из 10 овец разделяли на 2 части для анализа методом световой микроскопии (окраска гематоксилин-эозин) и методом трансмиссионной электронной микроскопии. Подготовку образцов для электронной микроскопии проводили по методике, описанной ранее (Конюхов и др., 1993). Использовали микроскоп ПЭМ-125К, фирма SELMI. Часть срезанного пучка волос от каждой овцы (всего 10 образцов) анализировали с применением сканирующей электронной микроскопии. Подготовку образцов проводили по оригинальной методике, предложенной одним из соавторов настоящей статьи (И.Ф. Латыповым): часть срезанных волос – пучок волос, срезанных перпендикулярно оси волоса на определенном расстоянии от поверхности кожи, – помещали в пластиковый капилляр, затем лезвием бритвы делали срез перпендикулярно длине капилляра (получали поперечный срез пучка волос). Срез капилляра с заключенным пучком волос без обработки контрастирующими агентами анализировали с использованием сканирующего электронного микроскопа JSM6510LA фирмы JEOL. По несколько волос (не менее 10), оставшихся от каждого из 10 образцов, анализировали под световым микроскопом без гистологической обработки, определив время начала роста волоса (в зависимости от сезона) по скорости его выдвижения из кожи (у грубошерстной овцы порядка 0.5 мм в сутки). Фотографировали участки одного волоса, соответствующие этапу формирования в определенное время года.
РЕЗУЛЬТАТЫ
Анализируя структуру волосяного фолликула и волоса после выхода из кожи, удалось проследить особенности формирования их структуры.
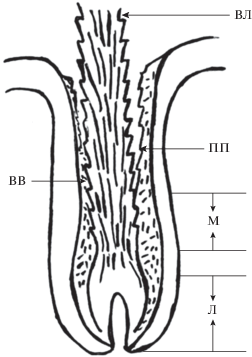
Поперечные срезы кожи с волосом на разной глубине волосяного фолликула на уровне муфты и над ней (рис. 1) позволили продемонстрировать разную степень сопряженности клеток коркового слоя волоса с клетками внутреннего влагалища.
Рис. 1.
Схема расположения муфты, крепящей стержень корня волоса в волосяном фолликуле. ВЛ – стержень корня волоса; ПП - пилярное пространство; ВВ – внутреннее корневое влагалище; М – муфта; Л – луковица волосяного фолликула.
На электронной микрофотографии, полученной при анализе срезов кожи на глубине, соответствующей муфте волосяного фолликула, хорошо различимо образование выступов как клеток внутреннего влагалища, так и сопряженных с ними зубчиков клеток кутикулы волоса (рис. 2). В клетках кутикулы волоса видны апоптозные сферические тельца, эпикутикула лабиринтообразна, что свидетельствует о завершающих этапах кератинизации клеток. Слой Гексли внутреннего влагалища оказывается наименее ороговевшим на данном уровне. Ороговевший слой Генле внутреннего влагалища имеет узкие складки.
Рис. 2.
Участок волосяного фолликула вблизи нижней границы “муфты” грубошерстной овцы (Vsevolodov, 2017). КВ – корковый слой волоса с меланосомами; КТ – клетка кутикулы волоса; Я – ядро клетки КТ; ЛЭ – лабиринтообразная эпикутикула КТ; КУ – клетка кутикулы внутреннего влагалища; ГК – слой Гексли внутреннего влагалища; ГН – слой Генле внутреннего влагалища; НВ – ядро клетки наружного влагалища. Трансмиссионная электронная микроскопия. © 2017 Vsevolodov E.B. Published in “Hair and scalp disoders” Kutlubay and Serdaroglu, eds. under CC BY 3.0 license. Available from: htpp://dx.doi.org/10.5772/67275.

В верхней границе “муфты” (рис. 3, световой микроскоп) появляется воздушная щель между волосом и кутикулой внутреннего влагалища – пилярный просвет. Видно, что выступающие зубцы, сформированные кутикулой внутреннего влагалища, отошли от соответствующих ямок в кутикуле волоса. Степень кератинизации клеток выше наблюдаемой в клетках на уровне муфты. На срезе хорошо видны клетки сердцевины волоса.
Рис. 3.
Появление пилярного просвета на уровне верхней границы “муфты” у волоса грубошерстной овцы (Vsevolodov, 2017). ПП – пилярное пространство; СВ – сердцевина волоса; КВ – кора волоса; КТ – зубец кутикулы волоса, КУ – кутикула внутреннего влагалища; ГН – ороговевший слой Генле внутреннего влагалища; НВ – наружное влагалище. Световая микроскопия. Окраска гематоксилином и эозином. © 2017 Vsevolodov E.B. Published in “Hair and scalp disoders” Kutlubay and Serdaroglu, eds. under CC BY 3.0 license. Available from: htpp://dx.doi.org/10.5772/67275.

Использование сканирующего микроскопа для изучения поперечного среза пучка волос над поверхностью кожи (рис. 4) позволило обнаружить разнообразие диаметров и структуры волос. В волосах большего диаметра всегда представлена сердцевина волоса, варьирующая по относительному диаметру, тогда как в наиболее тонких волосах сердцевина отсутствует. Такая картина наблюдалась во всех исследованных образцах.
Рис. 4.
Электронная микрофотография поперечного среза пучка волос грубошерстной овцы. КВ – кора волоса; СВ – сердцевина волоса. Сканирующая электронная микроскопия.

Анализ структуры волоса под световым микроскопом на протяжении длительного периода роста позволил проследить изменение его структуры, сформированной в разные сезоны. Временная принадлежность отрезка определялась по расстоянию от поверхности кожи по скорости роста, для овец этой породы равной около 0.5 мм в сутки. Отчетливо прослеживается изменение структуры волос, формирующейся в разные сезоны года. В летний период (рис. 5, верхний фрагмент) кутикула волоса наиболее тонкая, сердцевина имеет максимальный диаметр. Осенью (второй сверху фрагмент волоса) куликула утолщена, сердцевина сужена. В зимний период волос представлен кератинизированной кутикулой и полностью лишен сердцевины (рис. 5, нижний фрагмент). На протяжении третьего сверху фрагмента (рис. 5), соответствующего формированию волоса поздней осенью, можно проследить переход от “осенней” к “зимней” структуре (справа налево на снимке). Следует отметить, что волосяной фолликул и волос позволяет проследить изменения во времени гистофизиологии волосяного фолликула, “запечатленные” в структуре волоса.
ОБСУЖДЕНИЕ
ПАРАДОКС 1. Как можно совместить прочную фиксацию волоса с непрерывным выдвижением корня волоса? Решение этого парадокса в том, что выдвижение происходит с помощью гистофизиологических механизмов, обеспечивающих, например, у овцы, выдвижение волоса (рост) со скоростью, порядка 0.5 мм в сутки, т.е. 18 см в год. Та морфофизиологическая структура, которая играет важную роль в его продвижении к поверхности кожи, обеспечивает и фиксацию волоса в коже. Стержень волоса в верхней (ближе к поверхности кожи) части волосяного фолликула отделен от окружающих слоев фолликула воздушной щелью (“пилярным просветом”). В нижней части волосяного фолликула, где только начинающий накапливать кератин корень волоса граничит с камбиальной зоной луковицы, клетки лишены механической прочности и не могут фиксировать волос в коже. Следовательно, стержень волоса зафиксирован в коже и одновременно снабжен механизмом медленного выдвижения к поверхности кожи на средней глубине волосяного фолликула (рис. 1).
Близкий к завершению ороговения волос тесно контактирует с поверхностью внутреннего корневого влагалища (рис. 2), причем выступающие зубцы наружной поверхности волоса входят в соответствующие ямки внутренней поверхности внутреннего корневого влагалища как зубцы шестеренки между зубцами сопряженной с нею второй шестеренкой. Как клетки поверхности волоса (кутикула волоса и подстилающий ее корковый слой), так и клетки внутреннего корневого влагалища (слой кутикулы и слой Генле) близки к завершению кератинизации и, следовательно, имеют высокую механическую прочность. Это связано с тем, что большая часть клетки или почти весь ее объем заполняются кератином или кератиноподобными белками. Кератины образуют волокнистый компонент (промежуточные филаменты), во внутреннем влагалище и корковом слое встроены в матрикс, образованный богатыми цистеином кератин-ассоциированными белками (Rogers, 2004). На поздних стадиях кератинизации матриксные белки претерпевают структурные уплотнение за счет образования дисульфидных связей (Fraser, Parry, 2012), и это значительно повышает прочность волоса. В кутикуле волоса филаментарного компонента нет, но ее матриксные белки также уплотнены дисульфидными мостиками, что обеспечивает их физическую и химическую устойчивость.
Даже сама по себе описанная зубчатая структура (рис. 2) делает невозможным гладкое скольжение волоса мимо примыкающего к нему снаружи внутреннего корневого влагалища волоса, если попытаться вырвать волос из кожи. Эта зубчатая структура является одним из компонентов фиксации волоса в коже. Усилие, передаваемое от вытягиваемого волоса на волосяное влагалище должно приводить к образованию складок влагалища, которые зажимают волос внутри соединительнотканной сумки волосяного фолликула, и при нарастании усилия стержень волоса будет вырван вместе с частью клеток влагалища волосяного фолликула, что и наблюдается при выдергивании волоса из кожи. “Зубчики” кутикулы волоса во всех случаях остаются в теснейшем контакте с корковым слоем волоса. Их, по нашим данным, можно отделить от коркового слоя волоса и частично друг от друга только помещением зрелых волос на 1 ч в кипящую 6 N HCl (широко принятый способ мацерации волос).
Связь клеток волоса между собой и с внутренним влагалищем обеспечивается всеми типами межклеточных контактов. Десмосомы, щелевые контакты и плотные контакты формируются между дифференцирующимися кератиноцитами волос и кератиноцитами и внутренним влагалищем волосяного фолликула. Их соотношение и белковый состав меняются на восходящем пути волоса в фолликуле (Kurzen et al., 1998). Плотные контакты (zonula occludens) также установлены между клетками слоев Генле и Гексли и между клетками слоя Генле и клетками наружной оболочки влагалища. Эти соединения, вероятно, изменяют движение малых молекул (сигнальные молекулы и метаболиты) между клетками. Щелевые контакты и десмосомы занимают около 10% поверхности плазматической мембраны кортикальных клеток в области луковицы, причем десмосомы более обильны в клетках внутреннего влагалища по сравнению с развивающимся кортексом. По мере дальнейшей дифференцировки слоев клеток волоса и внутреннего корневого влагалища локальные очаговые контакты – десмосомы заменяются непрерывной областью послойного контакта клеток (Rogers, 2004).
Таким образом, фиксация волоса в фолликуле происходит в “муфте”, расположенной несколько выше луковицы волосяного фолликула, но ниже уровня, где наблюдается отделение стержня волоса от окружающего его внутреннего влагалища (рис. 3). В состав этой “муфты” входят помимо стержня волоса, клетки внутреннего слоя внутреннего влагалища (кутикула), уже подвергшиеся существенной кератинизации, но не отделившиеся еще от влагалища, а также взаимодействующие с ними клетки более наружных слоев волосяного фолликула. Муфта остается постоянно на одном и том же уровне в фолликуле, но составляющие ее клетки мигрируют параллельно с ростом волоса от луковицы в сторону поверхности кожи. Миграция обеспечивается активностью клеток наружного корневого влагалища (Straile, 1965; Chapman, 1971; Vsevolodov et al., 2014). Те клетки, которые выходят из верхнего края муфты, теряют связь с волосом и более не относятся к муфте, т.е. бывшие клетки муфты мигрируют вверх, но верхняя граница муфты остается на месте.
Потеря клеток из верхнего края муфты компенсируется поступлением клеток в муфту через нижнюю ее границу. Будущие клетки муфты ниже ее нижней границы еще недостаточно ороговевают и не имеют достаточной прочности, чтобы фиксировать волос в коже, но приобретают эту прочность в ходе ороговения по достижении нижней границы муфты (рис. 3). Таким образом, и нижняя граница муфты не меняет своего положения в волосяном фолликуле.
РЕШЕНИЕ ПАРАДОКСА 1. Волос скреплен в волосяном фолликуле не с неподвижной клеточной структурой, а с клетками наружного корневого влагалища, движущимися в “муфте” со скоростью роста волоса (у овцы около 0.5 мм в сутки). Поэтому закрепленность волоса в “муфте” не мешает его медленному движению в сторону поверхности кожи. При этом “муфта” находится на постоянном удалении от луковицы, представляя собой определенную стадию дифференцировки (ороговения) волосяного влагалища, которая соответствует степени ороговения клеток самого волоса. Дифференцировка прогрессирует по мере миграции клеток из камбия луковицы в сторону поверхности кожи. Она недостаточна для крепления волоса ниже муфты и приводит к изоляции волоса от окружающих структур выше муфты за счет появления пилярного пространства (рис. 2).
ПАРАДОКС ВТОРОЙ. Фенотипическое разнообразие морфометрических характеристик волос или облигатная изменчивость параметров волос на одном и том же стандартном участке кожи (т.е. структура волосяной группы) (Vsevolodov et al., 2015) может считаться вторым парадоксом. Структура волосяного покрова характеризуется, прежде всего, двумя основными параметрами: 1) набором морфометрических параметров самих волос (число волос на 1 см2 кожи, диаметр, длина, обеспеченная продолжительностью непрерывного роста волоса) и 2) набором слоев, из которых состоит волос (сердцевина, корковый слой и кутикула волоса), и которым соответствует разный набор белков-кератинов и кератиноподобных белков (Ryder, 1968).
Набор слоев волоса является эволюционно довольно консервативным, несмотря на крайнее внешнее разнообразие волос от пухового до иглы дикобраза. Во всех случаях присутствует кутикула волосяного влагалища и корковый слой и только сердцевины иногда может не быть. Различия параметров волос у разных видов и пород могут быть обусловлены различиями геномов. Сложнее объяснить закономерную изменчивость параметров волос на одном и том же участке кожи. Действительно, на участке кожи в 1 мм2 у грубошерстной овцы могут расти волосы диаметром от 130 до 12 мкм (Всеволодов и др., 2015), причем наиболее мелкие волосы могут не иметь сердцевины. Формирование структуры волоса в волосяном фолликуле обусловлено интенсивностью кератинизации клеток коры волоса. Чем меньше диаметр волоса, тем меньшую долю занимает сердцевина, а у самых тонких волос она вообще не формируется. Показана роль в регуляции начальных этапов дифференцировки волосяного фолликула определенных генных каскадов. Так, гены семейства ВMP запускают экспрессию ряда транскрипционных регуляторов дифференцировки кератиноцитов, таких как Hoxc13, Foxn1, Msx1 и Msx2, а Noggin, соответственно, предотвращает кератинизацию (Kulessa et al., 2000). Таким образом, этой формы регуляции кератинизации достаточно для качественных различий формирования слоев волоса. Вероятно, условия в мелких волосяных фолликулах не обеспечивают локальных различий в степени кератинизации клеток, образующих волос, поэтому развивается волос, лишенный сердцевинного слоя. Итак, в таком, казалось бы, наследственно обусловленном качественном проявлении морфогенеза как дифференцировка на слои волоса, гены специфической экспрессии могут подчиняться складывающимся условиям количественного характера (размер луковицы) в популяциях клеток, участвующих в дифференцировке.
Качественные различия структуры можно наблюдать и на одном волосе (рис. 5). Волосы грубошерстных овец, формирующие в благоприятный сезон (летом) сердцевинный слой, в менее благоприятный стрессогенный сезон (зимой) уменьшаются в диаметре и могут совсем лишиться сердцевины (рис. 5). Т.о., механизмы, регулирующие образование слоев волоса, зависят от внешних условий и связаны с сезонным стрессом (более голодная диета и холод), что, например, способствует усилению секреции гормонов коры надпочечников, тормозящих пролиферацию в камбии луковиц и нарушающих прежнее равновесие между делением клеток, их дифференцировкой и эвакуацией из камбия (Всеволодов, 1979).
РЕШЕНИЕ ПАРАДОКСА 2. Размер луковицы фолликула, определяющий диаметр волоса, регулируется размером соединительно-тканного сосочка, на котором она сформирована (Oliver, 1971; Jahoda et al., 1984). Закладка волосяных фолликулов начинается с синтеза медленно диффундирующих паракринных факторов Wnt в очагах базального слоя кожного эпидермиса. Это приводит к очаговому усилению пролиферации базальных клеток и образованию плакод (локальных утолщений и уплотнений базального слоя эпидермиса). В тех же очагах включается с небольшим опозданием и синтез ингибиторов Wnt, в частности, из семейств генов Dickkopf и BMP (Reddy et al., 2001; Andl et al., 2002; Lei et al., 2014). Они диффундируют быстрее и обгоняют фронт диффузии Wnt и предотвращают дальнейшее расширение плакод, не допуская их слияния друг с другом (Sick et al., 2006). Очевидно, что заложившиеся позже плакоды оказываются мельче. Такой механизм очаговой дифференцировки первоначально однородных полей на теле эмбриона был назван диффузионно-реакционным (математическая модель выдающегося британского математика Тьюринга). Таким образом, число и размеры закладывающихся плакод зависят, в частности, от соотношения скоростей диффузии Wnt и BMP.
Образовавшиеся плакоды индуцируют скопление под ними эмбриональных фибробластов дермы, из которых формируется соединительно-тканный сосочек – важный источник морфогенетической сигнализации во взрослом организме, поддерживающий пролиферацию камбия луковиц волосяного фолликула и детерминирующего размер волосяного фолликула и диаметр волоса при оптимальных условиях (Reynolds, Jahoda, 1992; Rendl et al., 2008; Morgan, 2014). Размер, достигаемый каждым волосяным фолликулом, зависит от двух важнейших факторов: 1) параметры сосочка-регулятора (стабильные в силу ограниченной способности клеток к пролиферации), которые установились в ходе эмбриогенеза и определяют верхний возможный предел размеров данного волосяного фолликула при оптимальных условиях; 2) совокупность лабильных, подверженных условиям содержания воздействий, которые лимитируют пролиферацию камбия луковицы и влияют на относительную степень развития разных слоев волосяного фолликула вплоть до отсутствия сердцевины волоса.
Таким образом, изменение количественного параметра (размер соединительнотканных сосочков и, соответственно, луковицы волосяного фолликула), вероятно, влияет на проявление разнокачественности дифференцировок. Чем позже закладываются фолликулы, тем они мельче, и тем тоньше волосы, которые они формируют. Это хорошо вписывается в представление о соотношении времени и, соответственно, величине закладки органа и сложности его дифференцировок (Голиченков и др., 1991).
Список литературы
Всеволодов Э.Б. Волосяные фолликулы. Алма-Ата: Наука, 1979. 245 с.
Всеволодов Э.Б., Голиченков В.А., Латыпов И.Ф. и др. Оценка событий послойной дифференцировки волосяного фолликула // Вестн. МГУ. Серия 16. Биология. 2015. № 2. С. 13–18.
Всеволодов Э.Б., Голиченков В.А., Мусаева А.С. и др. Наши волосы. Алматы: Казак университетi, 2015а. 45 с.
Голиченков В.А., Никерясова Е.Н., Попов Д.В. Значение массы клеток для становления и эволюции онтогенеза // В сб. Современная эволюционная морфология. Киев: Наукова думка, 1991. С. 130–139.
Конюхов Б.В., Всеволодов Э.Б., Сажина М.В. Ультраструктурный анализ клеток наружного корневого влагалища волосяных фолликулов у мышей мутантной линии WELLHAARIG // Онтогенез. 1993. Т. 24. № 1. С. 96–102.
Andl N., Reddy S.T., Gaddapara T. et al. WNT signals are required for the initiation of hair follicle development // Dev. Cell. 2002. V. 2. P. 643–653.
Chapman R.E. Cell migration in wool follicles of sheep // J. Cell Sci. 1971. V. 9. P. 791–803.
Fraser B.R.D., Parry D.A. The role of disulfide bond formation in the structural transition observed in the intermediate filaments of developing hair // J. Struct. Biol. 2012. V. 80. № 1. P. 117–124.
Greco V., Chen T., Rendl M. et al. A two-step mechanism for stem cell activation during hair regeneration // Cell Stem Cell. 2009. V. 4. P. 155–169.
Hwang J., Mehrani T., Millar S.E. et al. Dlx3 is a crucial regulator of hair follicle differentiation and cycling // Dev. 2008. V. 135. P. 3149–3159.
Jahoda C.A., Horne K.A., Oliver R.F. Induction of hair growth by implantation of cultured dermal papilla cells // Nature. 1984. V. 311. P. 560–562.
Kulessa H., Turk G., Hogan B.L. Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle // EMBO J. 2000. V. 24. № 19. P. 6664–6674.
Kurzen H., Moll I., Moll R. et al. Compositionally different desmosomes in various compartments of human hair follicle // Differentiation. 1998. V. 63. P. 295–304.
Lei M., Guo H., Qiu W.et al. Modulating hair follicle size with Wnt10b-DKK1 pair during hair regeneration // Exp. Dermatol. 2014. V. 23. № 6. P. 407–413.
Morgan B.A. The dermal papilla: an instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle // Cold Spring Harb Perspect. Med. 2014. 4: a015180.
Nowak J.A., Polak L., Pasolli H.A. et al. Hair follicle stem cells are specified and function in early skin morphogenesis // Stem Cell. 2008. V. 3. P. 33–43.
Oliver R.F. The dermal papilla and development and growth of hair // J. Soc. Cosmetic Chem. 1971. V. 22. P. 741–755.
Oshima H., Rochat A., Kedzia C. et al. Morphogenesis and renewal of hair follicles from adult multipotent stem cells // Cell. 2001. V. 104. P. 233–245.
Panteleyev A.A. Functional anatomy of the hair follicle: The Secondary Hair Germ // Experimental Dermatology. 2018. V. 27. P. 701–720.
Panteleev A.A., Botchareva N.V., Sundberg J.P. et al. The role of the hairless (hr) gene in the regulation of hair follicle catagen transformation // Am. J. Pathol. 1999. V. 155. № 1. P. 159–171.
Panteleyev A.A., Paus R., Christiano A.M. Patterns of hairless (hr) gene expression in mouse hair follicle morphogenesis and cycling // Am. J. Pathol. 2000. V. 157. № 4. P. 1071–1079.
Reddy S., Andl T., Bagasra A. et al. Characterization of Wnt gene expression in developing and postnatal hair follicles and identification of Wnt5a as a target of Sonic hedgehog in hair follicle morphogenesis // Mech. Dev. 2001.V. 107. P. 69–82.
Reik W., Dean W., Walter J. Epigenetic reprogramming in mammalian development // Science. 2001. V. 293(532). P. 1089–1093.
Rendl M., Lewis L., Fuchs E. Molecular dissection of mesenchymal-epithelial interactions in the hair follicle // PLoS Biol. 2005. V. 3. № 11. P. 303–331.
Rendl M., Polak L., Fuchs E. BMP signaling in dermal papilla cells is required for their hair follicle-inductive properties // Gen. Dev. 2008. V. 22. P. 543–557.
Reynolds A.J., Jahoda C.A. Cultured dermal papilla cells induce follicle formation and hair growth by transdiffer- entiation of an adult epidermis // Development. 1992. V. 115. P. 587–593.
Rhee H., Polak L. Fuchs E. Lhx2 maintains stem cell character in hair follicles // Science. 2006. V. 312(5782). P. 1946–1949.
Rippa A.L., Vorotelyak E.A., Vasiliev A.V., Terskikh V.V. The role of integrins in the development and homeostasis of the epidermis and skin appendages // Acta Naturae. 2013. V. 5. № 4 (19). P. 22–33.
Rogers G.E. Hair follicle differentiation and regulation // Int. J. Dev. Biol. 2004. V. 48. P. 163–170.
Romano R.A., Smalley K., Liu S. et al. Abnormal hair follicle development and altered cell fate of follicular keratinocytes in transgenic mice expressing ΔNp63α // Development. 2010. V. 137. № 9. P. 1431–1439.
Rompolas P., Elizabeth R., Giovanni Z. et al. Live imaging of stem cell and progeny behavior in physiological hair-follicle regeneration // Nature. 2012. V. 487(7408). P. 496–499.
Rudkouskaya A., Welcha I., Dagnino L. ILK modulates epithelial polarity and matrix formation in hair follicles // Mol. Biol. Cell. 2014. V. 25. P. 620–632.
Ryder M.L., Stephenson S.K. Wool Growth. London. New York: Academic Press, 1968. P. 10–805.
Sick S., Reinker S., Timmer J. et al. WNT and DKK determine hair follicle spacing through a reaction-diffusion mechanism // Science. 2006. V. 314. P. 1447–1450.
Straile W.E. Root sheath-dermal papilla relationships and the control of hair growth // Biology of the Skin and Hair Growth / Eds. Lyne A.G., Short B.F., Sydney: Angus and Robertson, 1965. P. 35–58.
Vsevolodov E.B. The histological mechanisms of hair loss // Hair and Scalp Disorders. 2017. Chapter 5. P. 67–79.
Vsevolodov E.B., Golichenkov V.A., Latyhov I.F. Cellular dynamics of the outer layers of the hair follicle of fine-wool sheep during the phase of stable hair growth // Rus. J. Dev. Biol. 2014. V. 45. № 6. P. 412–422.
Vsevolodov E.B., Golichenkov V.A., Latypov I.F. et al. Estimation of events of hair follicle layers differentiation // Mos. Univ. Biol. Sci. Bul. 2015. V. 70. № 2. P. 62–66.
Дополнительные материалы отсутствуют.



