Онтогенез, 2021, T. 52, № 1, стр. 68-79
Гиперэкспрессия гена рецептора урокиназы uPAR в головном мозге мыши стимулирует миграцию нейронов в кору в эмбриогенезе
А. А. Шмакова a, А. В. Балацкий a, d, М. А. Кулебякина b, Т. Шауб c, М. Н. Карагяур b, К. Ю. Кулебякин b, К. Д. Рысенкова a, b, В. С. Тарабыкин c, e, В. А. Ткачук a, b, Е. В. Семина a, b, *
a Лаборатория молекулярной эндокринологии, ФГБУ НМИЦ Кардиологии Минздрава России
121552 Москва, ул. 3я Черепковская, 15а, Россия
b Лаборатория генных и клеточных технологий, факультет фундаментальной медицины, МГУ имени
М.В. Ломоносова
119991 Москва, Ломоносовский проспект, 27/1, Россия
c Институт клеточной биологии и нейробиологии клиники Шарите
10117 Берлин, Charitéplatz 1, Германия
d Отдел лабораторной диагностики, Медицинский научно-образовательный центр, МГУ имени М.В. Ломоносова
119991 Москва, Ломоносовский проспект, 27/10, Россия
e Лаборатория генетики развития мозга, Институт нейронаук, ФГАОУ ВП “Нижегородский Государственный университет им. Н.И. Лобачевского”
603950 Нижний Новгород, пр. Гагарина, 23/7, Россия
* E-mail: e-semina@yandex.ru
Поступила в редакцию 19.05.2020
После доработки 29.06.2020
Принята к публикации 07.07.2020
Аннотация
Регуляция миграции молодых нейронов в коре головного мозга в процессе эмбрионального развития – один из самых важных, но малоизученных процессов, от которого зависит правильное формирование нейронных сетей и развитие когнитивных функций. Мутации гена рецептора урокиназы (uPAR) у мышей приводят к спонтанным судорогам, а у человека полиморфизмы гена PLAUR, кодирующего uPAR, ассоциированы с расстройствами аутистического спектра. Нами было исследовано влияние гиперэкспрессии гена uPAR на стимуляцию радиальной миграции нейронов в коре головного мозга в эмбриогенезе мышей. Была проведена оценка числа нейронов, мигрирующих из вентрикулярной зоны пролиферирующих предшественников в наружные слои коры головного мозга. Обнаружено, что гиперэкспрессия uPAR существенно стимулирует радиальную миграцию нейронов в дифференцирующуюся кору. Эти данные впервые показывают uPAR-зависимую регуляцию миграции нейронов в эмбриональном развитии коры головного мозга. Дальнейшее изучение роли uPAR в регуляции траектории миграции нейрональных предшественников позволит продвинуть наше понимание механизмов формирования головного мозга в норме и при патологии.
ВВЕДЕНИЕ
Нейрогенез является многоступенчатым процессом, который начинается с образования нейральных прогениторных клеток (нейральных стволовых клеток), и, проходя стадии пролиферации, направленной миграции, дифференцировки, заканчивается формированием зрелого нейрона (Sauvageot, Stiles, 2002; Stiles, Jernigan, 2010). На настоящий момент выделяется два основных направления миграции нейрональных предшественников при развитии коры головного мозга: радиальная миграция из субвентрикулярной зоны наружу к кортикальной пластинке по каркасу радиальных глиальных клеток и тангенциальная миграция, характерная для ГАМК-интернейронов, проходящая преимущественно из ганглионарного бугорка тангенциально к кортикальной пластинке (Miyazaki et al., 2016). Регуляция миграции нейронов и их предшественников в развивающемся головном мозге – один из самых сложных молекулярных процессов, от точности и координирования которого зависит дальнейшее функционирование нервной системы и организма в целом (Huang, 2009; Valiente, Marín, 2010; Miyazaki et al., 2016).
Урокиназная система является важным регулятором направленной клеточной миграции. Многочисленными исследованиями подтверждается и продолжает изучаться важная роль урокиназной системы в нервной ткани в периоды ее развития, регенерации и патологической деформации (Семина и др., 2016; Шмакова и др., 2019). Урокиназная система состоит из активатора плазминогена урокиназного типа (урокиназа, uPA) и еe рецептора (uPAR). uPA является сериновой протеазой, которая расщепляет плазминоген до активного плазмина, что стимулирует протеолиз внеклеточного матрикса, а взаимодействие uPA с рецептором uPAR увеличивает ее каталитическую активность, локализует протеолиз непосредственно рядом с клеткой, в том числе при еe миграции по градиенту хемоаттрактантов, одним из которых является лиганд uPAR урокиназа, а также может запускать передачу внутриклеточного сигнала (Blasi, Carmeliet, 2002; Smith, Marshall, 2010). Активация внутриклеточной сигнализации может осуществляться за счeт латерального взаимодействия uPAR с мембранными рецепторами: интегринами, белками эндоцитоза, рецепторными тирозинкиназами и др. (Eden et al., 2011). Кроме того, растворимая форма uPAR сама по себе может быть хемокином, регулирующим клеточный сигналинг и миграцию (Klimovich, Semina, 2020).
Вовлечение урокиназной системы в различные патологические и физиологические процессы в нервной системе подтверждается изменением экспрессии и активности ее компонентов при травмах и заболеваниях нервной системы (Bruneau, Szepetowski, 2011; Merino et al., 2017; Pitkänen et al., 2014; Semina et al., 2016); изучением роли нокаута, блокирования или экзогенного введения компонентов урокиназной системы на животных и изолированных тканях (Powell et al., 2001, 2003; Levitt, 2005; Semina et al., 2016; Klimovich et al., 2020; Klimovich, Semina, 2020); обнаружением взаимосвязи между полиморфизмами генов компонентов урокиназной системы и различными неврологическими патологиями у людей (Roll et al., 2006; Campbell et al., 2008; Zandifar et al., 2014). Однако во многом роль и механизмы действия урокиназной системы в развивающейся и зрелой нервной системе остаются малоизученными.
Возможно, ввиду более широкого спектра латеральных партнeров и разнообразия механизмов реализации сигнальных эффектов (Шмакова и др., 2020), именно рецептор uPAR, а не урокиназа, играет основную роль в урокиназной системе как регулятор критических процессов в нервной ткани. Этому существует несколько подтверждений. На модели травмы периферического нерва у мышей отсутствие гена Plaur (кодирует uPAR), но не Plau (кодирует uPA), существенно замедляет регенерацию нерва, что говорит о том, что более критичным для роста и регенерации нервов служит способность uPAR латерально взаимодействовать с мембранными лигандами (Klimovich et al., 2020). На модели острых генерализованных судорог у мышей нами было обнаружено, что uPAR, но не uPA, является непосредственно ранним геном, индуцируемым в короткие сроки при активации нейронов в разных областях головного мозга, и это не зависит от дополнительного синтеза белка de novo (Shmakova et al., 2019). Такой быстрый и универсальный ответ подтверждает важную роль uPAR в регуляции нейронального ответа на возбуждение и/или повреждение. Наконец, нокаут по гену Plaur (Powell et al., 2001, 2003; Levitt, 2005; Ndode-Ekane, Pitkänen, 2013; Bolkvadze et al., 2016), но не по гену Plau (Lahtinen et al., 2010; Bolkvadze et al., 2015), вызывает у животных подверженность судорогам, более тяжелое течение индуцированных судорог и усиление нейродегенеративных процессов.
Изучение фенотипа нокаута гена Plaur у мышей указало на его важную роль в развитии головного мозга. Было обнаружено, что нокаут Plaur у мышей приводит к потере почти половины парвальбумин-содержащих ГАМК-интернейронов в коре головного мозга (Powell et al., 2003; Eagleson et al., 2005). Вероятно, одной из множества функций uPAR является регулирование направленной миграции нейронов в процессе эмбрионального развития. Однако, Eagleson et al. высказали предположение о том, что поскольку нейроны утрачивались постнатально, uPAR скорее вовлечен в регуляцию их созревания и выживаемости (Eagleson et al., 2005, 2011). В связи с тем, что модель традиционного нокаута гена имеет ограничения и не всегда указывает на прямое действие определенного белка (Eisener-Dorman et al., 2009), мы решили исследовать напрямую, как экспрессия uPAR в эмбриональном периоде влияет на миграцию нейронов. Для изучения этой роли был использован метод in utero электропорации плазмидой для гиперэкспрессии uPAR.
МАТЕРИАЛЫ И МЕТОДЫ
Работа с лабораторными животными
Для получения образцов эмбрионального мозга мыши использовали мышей линии NMRI. Мыши данной линии отличаются сравнительно большим (в среднем 18) числом эмбрионов при беременности, что делает их удобным объектом для исследований процессов, связанных с эмбриональным и ранним постнатальным развитием (Rose et al., 2012). Эксперименты по получению датированной беременности и внутриматочной электропорации проводили в клинике Шарите, г. Берлин, Германия (Institute of Cell Biology and Neurobiology, Charité, Universitätsmedizin Berlin), конфокальную флуоресцентную микроскопию и анализ изображений проводили в МГУ имени М.В. Ломоносова и ФГБУ НМИЦ Кардиологии, г. Москва, Россия. Манипуляции с животными проводили в соответствии с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22.09.2010 г. о защите животных, использующихся для научных целей. Всего в эксперименте было использовано 8 самок и 100 эмбрионов, у каждой самки эмбрионы примерно поровну распределялись на эксперимент и контроль (46 контроль, 53 эксперимент). Для наркоза использовали ингаляционный наркоз изофлуран (isoflurane IsoFlo®, USP, 0.1 мг/кг).
Работа с культурой линейных клеток Neuro2A
В работе была использована линия нейробластомы мыши Neuro2A (ATCC® CCL-131™). Клетки культивировали в среде DMEM (Hyclone), 10% фетальной бычей сыворотки, 1× MEM раствор незаменимых аминокислот, 1× раствор антибиотика-антимикотика (все от Gibco), 5% СО2, 37°С. Клетки высевали в концентрации 1 × 105 клеток/мл. Трансфекцию клеток Neuro2A плазмидами проводили по протоколу Lipofectamine2000 (Life Technologies).
Создание плазмиды для гиперэкспрессии uPAR
Для изучения роли uPAR в миграции нейронов была создана плазмидная конструкция, позволяющая создать гиперэкспрессию uPAR в нейральных стволовых клетках, которые далее дифференцируются в нейроны и мигрируют в различные слои коры головного мозга. Для этого использовали последовательность кДНК uPAR мыши (NM_011113.4), которая была получена из клеток Neuro2A (ATCC®CCL-131™) путем выделения тотальной РНК (RNeasy® Mini Kit, Qiagen, Германия), обратной транскрипции (RevertAid H Minus First Strand cDNA Synthesis Kit, Fermentas) и амплификации с использованием специфических праймеров 5'-ACCATGGGACTCCCAAGGCGGC-3' (прямой) и 5'-TCAGGTCCAGAGGAGGACGCCCCATAG-3' (обратный). Последовательность кДНК была клонирована в плазмиду phCMV1 по сайтам рестрикции HindIII-HF и EcoRI. Последовательность вставки кДНК uPAR и ориентация была подтверждена секвенированием (Евроген) с использованием праймеров 5'‑GAGTGACGTAAGTACCGCCT-3' (прямой), 5'-AACACTGGAAGCCATTCGGT-3' (обратный), 5'-TCCAGAGCACAGAAAGGAGC-3' (прямой) (Евроген). Далее последовательность кДНК uPAR была переклонирована в плазмиду pCAGIG (Addgene) по сайтам XbaI и NotI. Данная плазмида также содержит ген GFP (Matsuda, Cepko, 2004) в качестве репортерного гена для экспрессии бицистронной мРНК, кодирующей uPAR и GFP. При клонировании в плазмиду pCAGIG к кДНК uPAR были добавлены сайты рестрикции, по которым требовалось провести клонирование (рестриктазы XbaI и NotI), а также последовательность Козак для увеличения стабильности мРНК и экспрессии белка uPAR. Последовательности праймеров, использованных для переклонирования кДНК uPAR из исходной плазмиды – 5'-GAATTCACCATGGGACTCCCAAGGCGGCTGCT-3' (прямой) и 5'-GCGGCCGCTCAGGTCCAGAGGAGGACG-CCC-3' (обратный). Анализ полученной плазмиды pCAGIG-uPAR проводили методом рестрикционного анализа с использованием рестриктаз АраI, BamHI, а также методом секвенирования с использованием праймеров с последовательностями 5'‑GCCTCTGCTAACCATGTTCAT-3' (прямой) и 5'-GCTTCGGCCAGTAACGTTAG-3' (обратный). В качестве контроля использовали плазмиду pCAGIG, кодирующую только GFP. На рис. 1 представлен рестрикционный анализ полученной плазмиды со вставкой uPAR и контрольной плазмиды.
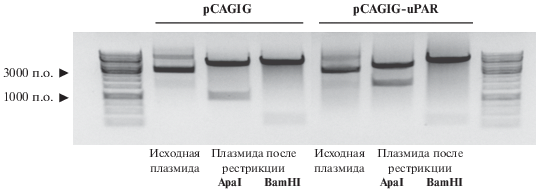
Рис. 1.
Рестрикционный анализ плазмиды pCAGIG-uPAR и контрольной плазмиды pCAGIG. Рестриктаза ApaI расщепляет контрольную плазмиду на фрагменты ~5000 и ~1000 п.о. и плазмиду со вставкой uPAR на фрагменты ~5000 и ~2400 п.о.; рестриктаза BamHI расщепляет контрольную плазмиду на фрагменты ~5600 и ~400 п.о. и плазмиду со вставкой uPAR на фрагменты ~7000 и ~400 п.о.
Внутриматочная электропорация нейронов головного мозга эмбрионов in vivo плазмидой для гиперэкспрессии uPAR и иммунофлуо-ресцентная микроскопия
Метод внутриматочной электропорации (in utero electroporation) – метод изменения экспрессии генов путем введения плазмид в развивающийся мозг эмбриона in vivo (dal Maschio et al., 2012). Датируемую беременность получали ссаживанием 2–3 самок с одним самцом на трое суток; далее самок, имеющих вагинальные пробки, отсаживали. День спаривания определяли как E0.5. О наличии беременности судили по прибавке в весе в течение первых 10 дней.
В данном эксперименте использовали самок датированной беременности сроком Е15.5, на котором часть клеток предшественников нейронов головного мозга выходят из митотического цикла и начинают мигрировать из субвентрикулярной зоны в сторону кортикальной пластинки (Dwyer et al., 2016). На этом сроке вентрикулярная зона коры головного мозга содержит преимущественно предшественники нейронов верхних слоев коры головного мозга (II–IV), таким образом, данный подход позволяет трансфицировать избирательно нейроны этих слоeв. Беременных самок анестезировали, в асептических условиях визуализировали эмбрионы в матке, далее стерильную плазмидную ДНК (pCAGIG-uPAR или pCAGIG, 0.5 мкг/мкл) вводили в боковые желудочки эмбрионального мозга, проводили электропорацию плазмидами, после чего рану зашивали и эмбрионы продолжали свое развитие в условиях in vivo (рис. 2). Электропорация 3-мм электродом состояла из 6 импульсов по 50 V в течение 40 мс с промежутками между импульсами 950 мс.
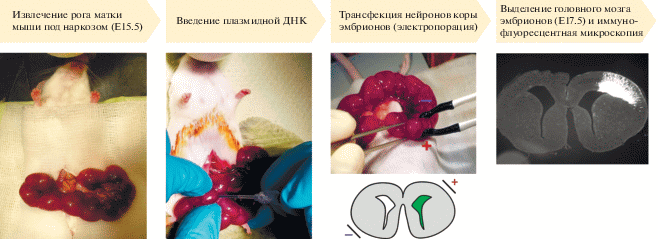
Рис. 2.
In utero трансфекция нейрональных предшественников эмбриона мыши. Датируемую беременность запускали ссаживанием самок с самцом на трое суток. На сроке E15.5 беременных самок анестезировали, в асептических условиях проводили извлечение рога матки, визуализировали эмбрионы в матке. Далее стерильную плазмидную ДНК вводили в боковые желудочки эмбрионального мозга, проводили электропорацию, после чего рану зашивали и эмбрионы продолжали свое развитие в условиях in vivo. На сроке E17.5 самок летально анестезировали, выделяли эмбрионы и изолировали головной мозг. Для визуализации клеток, экспрессирующих плазмиду с GFP, проводили иммунофлуоресцентную съемку образцов с помощью широкопольного микроскопа с последующей конфокальной микроскопией.
На сроке E17.5 самки были летально анестезированы, эмбрионы выделены, головной мозг изолирован (рис. 2). Далее образцы инкубировали при 4°C в 4% растворе параформальдегида в течение ночи, затем в 15% растворе сахарозы в течение 6–8 ч, после чего в 30% растворе сахарозы в течение ночи. Приготовление срезов толщиной 50 мкм осуществляли на криотоме Leica CM1850 UV. Срезы монтировали на предметные стeкла и окрашивали антителами кролика GFP и вторичными антителами, мечеными Alexa Fluor 488, а также ядерным красителем DRAQ5. Иммунофлуоресцентную съемку образцов осуществляли с помощью конфокального микроскопа (Leica SP5) при возбуждении 488 нм для детекции GFP и при возбуждении 647 нм для детекции DRAQ5. Полученные изображения анализировали с помощью программы ImageJ (США) и алгоритма на языке программирования R-3.6.0, разработанного нами, позволяющего в автоматическим режиме определять число зеленых клеток в выбранных областях поля зрения (RStudio 1.2.1335, США). Для анализа были отобраны образцы с выраженной различимой флуоресценцией GFP: 15 эмбрионов от трeх разных самок (9 эмбрионов для pCAGIG-uPAR и 6 эмбрионов для pCAGIG), всего проанализировано 82 изображения срезов головного мозга (44 для pCAGIG-uPAR и 38 для контроля).
Иммунофлуоресцентное окрашивание Neuro2A клеток
Клетки Neuro2A высевали в лунки системы Nunc® Lab-Tek® Chamber Slide™ в низкой концентрации (2 × 104/мл) в полной ростовой среде. 24 ч спустя клетки последовательно фиксировали в 4% растворе формальдегида и обрабатывали 10% раствором сыворотки донора вторых антител для блокирования неспецифического окрашивания. Далее образцы последовательно инкубировали с первичными антителами анти-uPAR мыши (1 : 100, MAB531, RD Systems) или c неиммунными IgG в качестве контроля специфичности окрашивания, затем со вторичными антителами (1 : 500, AlexaFluor®594, Invitrogen), промывая раствором Хэнкса. Ядра окрашены DAPI. Иммунофлуоресцентную съемку образцов осуществляли с помощью конфокального микроскопа (Leica SP5) при возбуждении 405 нм для детекции DAPI, 488 нм для детекции GFP и 594 нм для детекции uPAR.
Статистическая обработка данных
Данные анализировали с использованием программного обеспечения GraphPad Prism 8 (GraphPad software Inc., США). Непарный t-тест Student использовался для сравнения между двумя группами. Различия между несколькими группами определялись с помощью 2-way ANOVA, попарные сравнения проводили с использованием post hoc теста Sidak. Данные представлены как среднее ± стандартная ошибка среднего (SEM). Критический уровень значимости принимали равным р < 0.05.
РЕЗУЛЬТАТЫ
Подтверждение гиперэкспрессии uPAR на поверхности клеток при использовании плазмиды pCAGIG-uPAR
Для доказательства гиперэкспрессии uPAR на поверхности клеток при трансфекции их плазмидой pCAGIG-uPAR, были использованы клетки мышиной нейробластомы Neuro2A, которые представляют собой линию опухолевых клеток нейрального происхождения (симпатоадреналовый предшественник симпатических нейронов). Используя иммунофлуоресцентное окрашивание, мы показали, что трансфекция плазмидой pCAGIG-uPAR клеток Neuro2A уже через 24 часа значительно увеличивает экспрессию белка uPAR на мембране GFP-положительных клеток (рис. 2а). При этом, в клетках, трансфицированных контрольной плазмидой pCAGIG, также обнаруживалась экспрессия uPAR, но на более низком уровне (рис. 3а). Специфичность окрашивания была подтверждена c использованием неиммунных IgG антител (рис. 3б). Совмещенное трeхмерное изображение клеток Neuro2A c гиперэкспрессией uPAR подтвердило мембранное расположение рецептора, в том числе его кластеризацию по краю ламеллоподий, что указывает на его функциональность и подтверждает его важную роль в адгезивных контактах и миграции (рис. 3в).
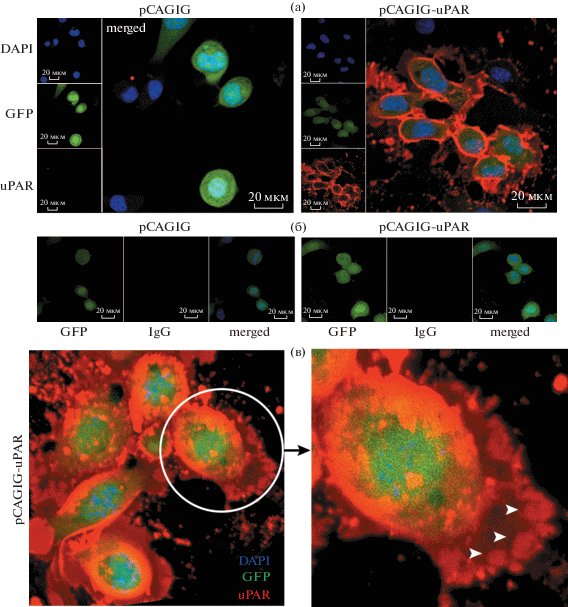
Рис. 3.
Гиперэкспрессия uPAR на поверхности клеток Neuro2A при трансфекции плазмидой pCAGIG-uPAR или контрольной pCAGIG. а, б – иммунофлуоресцентное окрашивание клеток Neuro2A, трансфицированных плазмидами pCAGIG (контроль) и pCAGIG-uPAR. Ядра окрашены DAPI (синий канал). Обе плазмиды экспрессируют GFP (зеленый канал), в случае pCAGIG-uPAR наблюдается сильная гиперэкспрессия uPAR (красный канал). Масштабный отрезок 20 мкм. б – неиммунные IgG (красный канал) использовали в качестве контроля специфичности окрашивания. в – совмещенное трехмерное изображение, полученное на конфокальном микроскопе, клеток Neuro2A c гиперэкспрессией uPAR подтвердило мембранное расположение рецептора. Белыми стрелками обозначена кластеризация uPAR в мембране клетки по краю ламеллоподий.
Таким образом, трансфекция плазмидой pCAGIG-uPAR позволяет идентифицировать клетки, гиперэкспрессирующие uPAR по экспрессии GFP, что было использовано нами в дальнейшем для оценки миграции GFP-положительных нейронов, гиперэкспрессирующих uPAR, в головном мозге in vivo.
Подход к созданию алгоритма для измерения количества мигрирующих GFP-положительных нейронов
Для анализа и сравнения степени миграции GFP+ нейронов в эмбриональном периоде мы решили оценить количество нейронов в трех слоях головного мозга: желудочковом, или внутреннем слое, промежуточном слое и кортикальной пластинке, или наружном слое. Миграция нейронов происходила из желудочкового слоя, где проводилась электропорация, в область кортикальной пластинки и, для правильной оценки и сравнения миграции, расстояние (длина пути) миграции, должна быть одинаковой в каждом из слоев по выбранному направлению от желудочка до границы коры головного мозга. Поэтому нами был разработан алгоритм на языке программирования R, определяющий границы равноширинных слоев головного мозга, отражающих равные длины пути мигрирующих нейронов, и количество нейронов в каждом из этих слоев (рис. 4). Для этого на изображениях головного мозга вручную обозначали границы коркового и желудочкового слоев, выбирая минимум 100 точек с помощью инструмента multi-point selection ImageJ, и получали данные об XY-координатах этих точек. Аналогичным образом определяли положение GFP+ нейронов. С помощью алгоритма проводили полиномиальную аппроксимацию, получая уравнение кривых границ коркового и желудочкового слоев. Далее вычисляли уравнения границ трех равноширинных слоев головного мозга, путем полиномиальной аппроксимации точек, делящих на три равные части линии, соединяющие между собой границы коркового и желудочкового слоев, построенные из 1000 автоматически рассчитанных равноудаленных между собой точек на каждой из кривых. Используя полученные XY-координаты GFP+ нейронов, рассчитывали общее количество нейронов в каждом из трех слоев головного мозга.
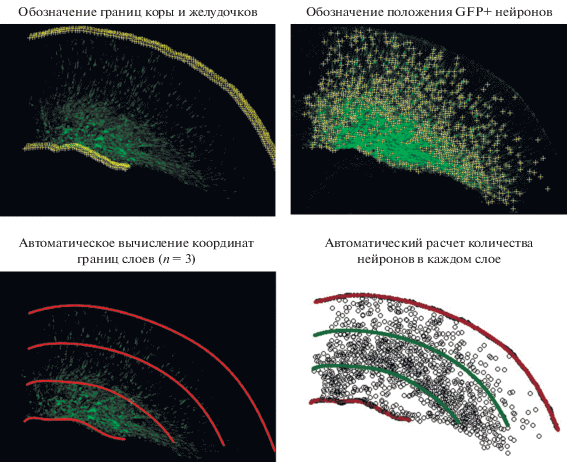
Рис. 4.
Алгоритм расчета количества мигрирующих GFP-положительных нейронов по слоям головного мозга. На изображениях вручную обозначали границы коркового и желудочкового слоев, определяли положение GFP+ нейронов и получали данные об XY-координатах этих точек. Далее с помощью алгоритма проводили полиномиальную аппроксимацию, получая уравнение кривых границ коркового и желудочкового слоев, и вычисляли уравнения границ трех равноширинных слоев головного мозга. Используя полученные XY-координаты GFP+ нейронов, рассчитывали общее количество нейронов в каждом из трех слоев головного мозга.
Гиперэкспрессия uPAR симулирует миграцию нейронов в кору головного мозга
Мы изучали миграцию GFP+ нейронов в норме и при гиперэкспрессии uPAR при развитии коры головного мозга у мышей на эмбриональном сроке Е15.5–E17.5 (рис. 5а). На представленных репрезентативных микрофотографиях заметно, что гиперэкспрессия uPAR способствует радиальной миграции нейронов в сторону кортикальной пластинки. Морфология мигрирующих нейронов не отличалась в контроле и при гиперэкспрессии uPAR (рис. 5б).
Рис. 5.
Гиперэкспрессия uPAR стимулирует миграцию нейронов коры головного мозга. (а) Слева представлены репрезентативные ч/б микрофотографии срезов головного мозга, полученные на широкопольном микроскопе; в центре – увеличенные изображения среза головного мозга, полученные на конфокальном микроскопе при возбуждении 488 нм; справа – обозначение границ равноширинных слоев головного мозга для анализа, 1 – желудочковый, внутренний слой, 2 – промежуточный слой, 3 – корковый, наружный слой. (б) Морфология мигрирующих нейронов в контроле (сверху) и при гиперэкспрессии uPAR (снизу). (в) Относительное количество GFP+ нейронов на различных слоях головного мозга в контроле и при гиперэкспрессии uPAR. 2-way ANOVA, post hoc тест Sidak, * p < 0.05, ** p < 0.01, **** p < 0.0001. (г) Отношение числа GFP+ нейронов в 3 и 2 слоях головного мозга в контроле и при гиперэкспрессии uPAR. Непарный t-тест Student, * p < 0.05. Контроль – in utero электропорация плазмидой pCAGIG, экспрессирующей только GFP, uPAR – in utero электропорация плазмидой pCAGIG-uPAR, экспрессирующей uPAR и GFP. Данные представлены как среднее ± стандартная ошибка среднего (SEM).
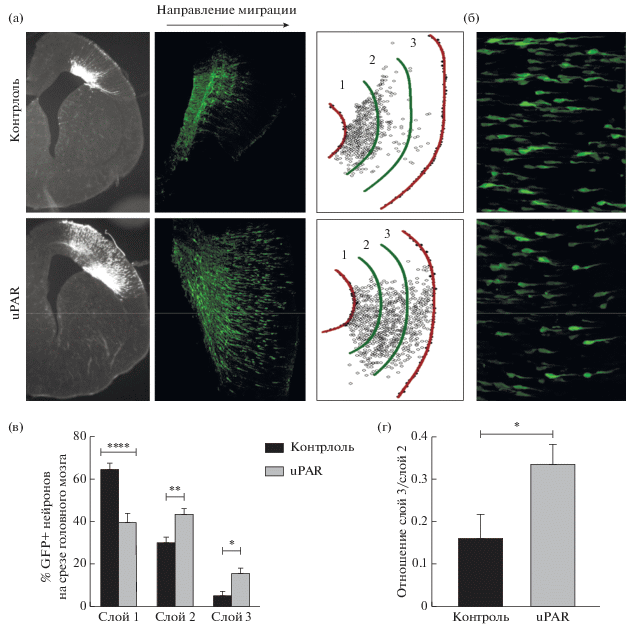
Оценивать абсолютное количество промигрировавших нейронов оказалось нецелесообразным, так как в каждом случае уровень трансфекции и общее количество GFP+ нейронов, попавших на срез изображения головного мозга, могли варьироваться. Поэтому мы рассчитали процент нейронов в каждом из трех слоев головного мозга по отношению к общему количеству GFP+ нейронов на изображении (рис. 5в). При оценке относительного количества нейронов в трех слоях головного мозга мы обнаружили, что при гиперэкспрессии uPAR снижается относительное количество нейронов в первом (желудочковом) слое головного мозга по отношению к контролю (2-way ANOVA, **** p < 0.0001). Однако относительное количество нейронов во втором (промежуточном) и третьем (корковом) слоях, напротив, выше при гиперэкспрессии uPAR по сравнению с контролем (2-way ANOVA, ** p < 0.01, * p < < 0.05 соответственно). Это означает, что гиперэкспрессия uPAR способствует миграции нейронов в сторону коркового слоя.
В связи с тем, что электропорация плазмид проводилась в области желудочков, иногда оценить точное количество окрашенных нейронов в первом (внутреннем, желудочковом) слое представлялось затруднительным из-за сильной флуоресценции (см. рис. 4). Поэтому для подтверждения полученных результатов мы также оценили такой параметр, как отношение количества нейронов в третьем (наружном, корковом) слое к количеству нейронов во втором (промежуточном) слое, который отражает относительный уровень миграции нейронов в кору (рис. 5г). Это отношение также было значимо выше при гиперэкспрессии uPAR (t-тест Student, * p < 0.05), то есть нейроны, в которых экспрессия uPAR повышена, в большей степени мигрируют до наружного слоя коры головного мозга по сравнению с контрольными нейронами. Эти данные говорят о том, что экспрессия uPAR способствует миграции нейронов в кору при эмбриональном развитии головного мозга.
ОБСУЖДЕНИЕ
Наши данные доказывают полученные ранее результаты о том, что урокиназный рецептор может регулировать миграцию нейронов в эмбриональном периоде и опосредовать морфогенез коры головного мозга. В нескольких ограниченных исследованиях было показано, что нокаут uPAR снижает миграцию парвальбумин-экспрессирующих ГАМК-интернейронов в кору головного мозга (Powell et al., 2003), которые в норме экспрессируют uPAR, и в зрелом головном мозге составляют основную часть нейрональной экспрессии uPAR (Lahtinen et al., 2009). У мышей, нокаутных по гену Plaur, наблюдается повышенная тревожность, нарушенное социальное поведение, большая подверженность индуцированным судорогам по сравнению с мышами дикого типа (Powell et al., 2001, 2003). Несмотря на то, что ГАМК-интернейроны преимущественно мигрируют тангенциально (Miyazaki et al., 2016), полученные нами результаты говорят о том, что uPAR может быть также вовлечeн в регуляцию радиальной миграции нейронов в коре, т.к. при гиперэкспрессии uPAR мы наблюдали увеличение миграции из желудочкового слоя в корковый слой. Однако до сих пор остается неясным, как экспрессия uPAR способствует корковому направлению миграции нейронов и по градиенту какого лиганда uPAR движется нейрон во время созревания коры головного мозга.
Точный механизм, с помощью которого uPAR регулирует миграцию нейронов в эмбриональном периоде, еще предстоит выяснить. Связывание uPA с рецептором uPAR активирует ряд внутриклеточных сигнальных каскадов, что приводит к перестройкам цитоскелета и обеспечивает направленную миграцию различных клеток, в частности нейронов (D’Alessio, Blasi, 2009; Lino et al., 2014; Semina et al., 2016). Также существует предположение, что действие uPAR в эмбриональном периоде связано с фактором роста гепатоцитов (HGF), так как потеря uPAR в эмбриогенезе ассоциирована со сниженным уровнем HGF и его рецептора Met в головном мозге (Powell et al., 2001). В зрелом мозге также обнаружена корреляция между HGF и uPA/uPAR (Campbell et al., 2007; Russo, Pietsch, 2013). HGF и его рецептор Met являются важными регулятором пролиферации, дифференцировки и миграции нейронов в эмбриональном развитии головного мозга (Powell et al., 2001; Wang et al., 2011). Сигнальный путь HGF/Met оказывается критичным для нормального развития головного мозга, т. к. нокаут по гену HGF или его рецептору Met оказывается летальным, в то время как нокаут по гену Plaur связан лишь с уменьшением активности пути HGF/Met (Levitt, 2005). Считалось, что при миграции интернейронов uPAR участвует в регуляции экспрессии HGF и/или его протеолитической активации (Powell et al., 2001; Levitt, 2005), однако другие исследования не подтвердили участия uPA в протеолитической активации HGF (Owen et al., 2010) и присутствия Met рецептора на интернейронах (Eagleson et al., 2011). В эмбриональном периоде рецептор Met в основном экспрессируется на глутаматергических нейронах (Eagleson et al., 2011). Несмотря на это, постнатальное экзогенное введение HGF нивелирует потерю интернейронов и неврологический дефицит у uPAR-дефицитных мышей (Bae et al., 2010; Bissonette et al., 2010). Эти данные могут отражать более сложные механизмы взаимодействия в системе HGF/Met. Действительно, было показано, что в норме в зрелом мозге существует положительная связь между экспрессией HGF и Met, в то время как при расстройствах аутистического спектра эта связь становится отрицательной (Campbell et al., 2007). Кроме того, наши предварительные данные говорят о том, что связь между системой HGF/Met и uPAR может существовать на уровне микроРНК, т.к. при нокауте Plaur повышается содержание mmu-miR-34c-5p (данные готовятся к публикации), существенно подавляющей экспрессию Met.
ЗАКЛЮЧЕНИЕ
Таким образом, высокая экспрессия uPAR в эмбриональном периоде у мышей стимулирует радиальную миграцию нейронов в кортикальную пластинку. Это подтверждает важную роль урокиназной системы и, в частности, урокиназного рецептора, в эмбриональном развитии головного мозга. Дальнейшие изучение uPAR и его возможных лигандов, вовлеченных в регуляцию миграции, определение траектории нейронов и их предшественников, позволит расширить наше понимание развития головного мозга в норме и при неврологических патологиях, многие из которых ассоциированы с нарушением миграции нейронов в эмбриогенезе.
Список литературы
Семина Е.В., Рубина К.А., Степанова В.В., Ткачук В.А. Участие рецептора урокиназы и его эндогенных лигандов в развитии головного мозга и формировании когнитивных функций // Российский физиологический журн. им. И.М.Сеченова. 2016. Т. 102. № 8. С. 881–903.
Шмакова А.А., Рубина К.А., Анохин К.В., Ткачук В.А., Семина Е.В. Роль системы активаторов плазминогена в патогенезе эпилепсии // Биохимия. 2019. Т. 84. № 9. С. 1211–1225.
Шмакова А.А., Рубина К.А., Ткачук В.А., Семина Е.В. Рецептор урокиназы: от регуляции протеолиза до направленного роста аксонов и регенерации нервов. Механизмы взаимодействия с мембранными лигандами и внутриклеточная сигнализация // Цитология. 2020. Т. 62. № 6. С. 1–11.
Bae M.H., Bissonette G.B., Mars W.M., Michalopoulos G.K., Achim C.L., Depireux D.A., Powell E.M. Hepatocyte growth factor (HGF) modulates GABAergic inhibition and seizure susceptibility // Exp. Neurol. 2010. V. 221. № 1. P. 129–135.
Bissonette G.B., Bae M.H., Suresh T., Jaffe D.E., Powell E.M. Astrocyte-mediated hepatocyte growth factor/scatter factor supplementation restores GABAergic interneurons and corrects reversal learning deficits in mice // J. Neurosci. 2010. V. 30. № 8. P. 2918–2923.
Blasi F., Carmeliet P. uPAR: a versatile signalling orchestrator // Nat. Rev. Mol. Cell Biol. 2002. V. 3. № 12. P. 932–943.
Bolkvadze T., Puhakka N., Pitkänen A. Epileptogenesis after traumatic brain injury in Plaur- deficient mice // Epilepsy Behav. 2016. V. 60. P. 187–196.
Bolkvadze T., Rantala J., Puhakka N., Andrade P., Pitkänen A. Epileptogenesis after traumatic brain injury in Plau-deficient mice // Epilepsy Behav. 2015. V. 51. P. 19–27.
Bruneau N., Szepetowski P. The role of the urokinase receptor in epilepsy, in disorders of language, cognition, communication and behavior, and in the central nervous system // Curr. Pharm. Des. 2011. V. 17. № 19. P. 1914–1923.
Campbell D.B., D’Oronzio R., Garbett K., Ebert P.J., Mirnics K., Levitt P., Persico A.M. Disruption of cerebral cortex MET signaling in autism spectrum disorder // Ann. Neurol. 2007. V. 62. № 3. P. 243–250.
Campbell D.B., Li C., Sutcliffe J.S., Persico A.M., Levitt P. Genetic evidence implicating multiple genes in the MET receptor tyrosine kinase pathway in autism spectrum disorder // Autism Res. 2008. V. 1. № 3. P. 159–168.
’Alessio S., Blasi F. The urokinase receptor as an entertainer of signal transduction // Front. Biosci. 2009. V. 14. P. 4575–4587.
dal Maschio M., Ghezzi D., Bony G., Alabastri A., Deidda G., Brondi M., Sato S.S., Zaccaria R.P., Fabrizio E. Di, Ratto G.M., Cancedda L. High-performance and site-directed in utero electroporation by a triple-electrode probe // Nat. Commun. 2012. V. 3. № 1. P. 960.
Dwyer N.D., Chen B., Chou S.J., Hippenmeyer S., Nguyen L., Ghashghaei H.T. Neural stem cells to cerebral cortex: Emerging mechanisms regulating progenitor behavior and productivity // J. Neuroscience Society for Neuroscience. 2016. V. 36. № 45. P. 11394–11401.
Eagleson K.L., Bonnin A., Levitt P. Region- and age-specific deficits in γ-aminobutyric acidergic neuron development in the telencephalon of the uPAR–/– mouse // J. Comp. Neurol. 2005. V. 489. № 4. P. 449–466.
Eagleson K.L., Campbell D.B., Thompson B.L., Bergman M.Y., Levitt P. The autism risk genes MET and PLAUR differentially impact cortical development // Autism Res. 2011. V. 4. № 1. P. 68–83.
Eden G., Archinti M., Furlan F., Murphy R., Degryse B. The urokinase receptor interactome // Curr. Pharm. Des. 2011. V. 17. № 19. P. 1874–1889.
Eisener-Dorman A.F., Lawrence D.A., Bolivar V.J. Cautionary insights on knockout mouse studies: the gene or not the gene? // Brain. Behav. Immun. 2009. V. 23. № 3. P. 318–324.
Huang Z. Molecular regulation of neuronal migration during neocortical development // Mol. Cell Neurosci. 2009. V. 42. № 1.https://doi.org/10.1016/j.mcn.2009.06.003
Klimovich P.S., Semina E.V., Karagyaur M.N., Rysenkova K.D., Sysoeva V.Y., Mironov N.A., Sagaradze G.D., Az’muko A.A., Popov V.S., Rubina K.A., Tkachuk V.A. Urokinase receptor regulates nerve regeneration through its interaction with α5β1-integrin // Biomed. Pharmacother. 2020. V. 125. P. 110008.
Klimovich P.S., Semina E.V. Mechanisms of participation of the urokinase receptor in directed axonal growth // Mol. Biol. 2020. V. 54. № 1. P. 89–98.
ahtinen L., Huusko N., Myöhänen H., Lehtivarjo A.-K., Pellinen R., Turunen M.P., Ylä-Herttuala S., Pirinen E., Pitkänen A. Expression of urokinase-type plasminogen activator receptor is increased during epileptogenesis in the rat hippocampus // Neuroscience. 2009. V. 163. № 1. P. 316–328
Lahtinen L., Ndode-Ekane X.E., Barinka F., Akamine Y., Esmaeili M.H., Rantala J., Pitkänen A. Urokinase-type plasminogen activator regulates neurodegeneration and neurogenesis but not vascular changes in the mouse hippocampus after status epilepticus // Neurobiol. Dis. 2010. V. 37. № 3. P. 692–703.
Levitt P. Disruption of interneuron development // Epilepsia. 2005. V. 46. № s7. P. 22–28.
Lino N., Fiore L., Rapacioli M., Teruel L., Flores V., Scicolone G., Sánchez V. uPA-uPAR molecular complex is involved in cell signaling during neuronal migration and neuritogenesis // Dev. Dyn. 2014. V. 243. № 5. P. 676–689.
Matsuda T., Cepko C.L. Electroporation and RNA interference in the rodent retina in vivo and in vitro // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 1. P. 16–22.
Merino P., Diaz A., Jeanneret V., Wu F., Torre E., Cheng L., Yepes M. Urokinase-type plasminogen activator (uPA) binding to the uPA receptor (uPAR) promotes axonal regeneration in the central nervous system // J. Biol. Chem. 2017. V. 292. № 7. P. 2741–2753.
Miyazaki Y., Song J.W., Takahashi E. Asymmetry of radial and symmetry of tangential neuronal migration pathways in developing human fetal brains // Front. Neuroanat. 2016. V. 10. № JAN. P. 2.
Ndode-Ekane X.E., Pitkänen A. Urokinase-type plasminogen activator receptor modulates epileptogenesis in mouse model of temporal lobe epilepsy // Mol. Neurobiol. 2013. V. 47. № 3. P. 914–937.
Owen K.A., Qiu D., Alves J., Schumacher A.M., Kilpatrick L.M., Li J., Harris J.L., Ellis V. Pericellular activation of hepatocyte growth factor by the transmembrane serine proteases matriptase and hepsin, but not by the membrane-associated protease uPA // Biochem. J. 2010. V. 426. № 2. P. 219–228.
Pitkänen A., Ndode-Ekane X.E., Łukasiuk K., Wilczynski G.M., Dityatev A., Walker M.C., Chabrol E., Dedeurwaerdere S., Vazquez N., Powell E.M. Neural ECM and epilepsy // Prog. Brain Res. 2014. V. 214. P. 229–262.
Powell E.M., Campbell D.B., Stanwood G.D., Davis C., Noebels J.L., Levitt P. Genetic disruption of cortical interneuron development causes region- and GABA cell type-specific deficits, epilepsy, and behavioral dysfunction // J. Neurosci. 2003. V. 23. № 2. P. 622–631.
Powell E.M., Mars W.M., Levitt P. Hepatocyte growth factor/scatter factor is a motogen for interneurons migrating from the ventral to dorsal telencephalon // Neuron. 2001. V. 30. № 1. P. 79–89.
Roll P., Rudolf G., Pereira S., Royer B., Scheffer I.E., Massacrier A., Valenti M.-P., Roeckel-Trevisiol N., Jamali S., Beclin C., Seegmuller C., Metz-Lutz M.-N., Lemainque A., Delepine M., Caloustian C., Martin A. de Saint, Bruneau N., Depétris D., Mattéi M.-G., Flori E., Robaglia-Schlupp A., Lévy N., Neubauer B.A., Ravid R., Marescaux C., Berkovic S.F., Hirsch E., Lathrop M., Cau P., Szepetowski P. SRPX2 mutations in disorders of language cortex and cognition // Hum. Mol. Genet. 2006. V. 15. № 7. P. 1195–1207.
Rose C., Schwegler H., Hanke J., Yilmazer-Hanke D.M. Pregnancy rates, prenatal and postnatal survival of offspring, and litter sizes after reciprocal embryo transfer in DBA/2JHd, C3H/HeNCrl and NMRI mice // Theriogenology. 2012. V. 77. № 9. P. 1883–1893.
Russo A.J., Pietsch S.C. Decreased hepatocyte growth factor (HGF) and gamma aminobutyric acid (GABA) in individuals with obsessive-compulsive disorder (OCD) // Biomark. Insights. 2013. V. 8. P. BMI.S11931.
Sauvageot C.M., Stiles C.D. Molecular mechanisms controlling cortical gliogenesis // Curr. Opin. Neurobiol. 2002. V. 12. № 3. P. 244–249.
Semina E., Rubina K., Sysoeva V., Rysenkova K., Klimovich P., Plekhanova O., Tkachuk V. Urokinase and urokinase receptor participate in regulation of neuronal migration, axon growth and branching // Eur. J. Cell Biol. 2016. V. 95. № 9. P. 295–310.
Shmakova A.A., Rubina K.A., Rysenkova K.D., Gruzdeva A.M., Ivashkina O.I., Anokhin K. V., Tkachuk V.A., Semina E.V. Urokinase receptor and tissue plasminogen activator as immediate early genes in pentylenetetrazole-induced seizures in the mouse brain // Eur. J. Neurosci. 2019. P. ejn.14584.
Smith H.W., Marshall C.J. Regulation of cell signalling by uPAR // Nat. Rev. Mol. Cell Biol. 2010. V. 11. № 1. P. 23.
Stiles J., Jernigan T.L. The basics of brain development // Neuropsychol. Rev. 2010. № 4. P. 327–348.https://doi.org/10.1007/s11065-010-9148-4
Valiente M., Marín O. Neuronal migration mechanisms in development and disease // Curr. Opin. Neurobiol. 2010. V. 20. № 1. P. 68–78.https://doi.org/10.1016/j.conb.2009.12.003
Wang T.-W., Zhang H., Gyetko M.R., Parent J.M. Hepatocyte growth factor acts as a mitogen and chemoattractant for postnatal subventricular zone-olfactory bulb neurogenesis // Mol. Cell. Neurosci. 2011. V. 48. № 1. P. 38–50.
Zandifar A., Soleimani S., Iraji N., Haghdoost F., Tajaddini M., Javanmard S.H. Association between promoter region of the uPAR (rs344781) gene polymorphism in genetic susceptibility to migraine without aura in three Iranian hospitals // Clin. Neurol. Neurosurg. 2014. V. 120. P. 45–48.
Дополнительные материалы отсутствуют.


