Онтогенез, 2021, T. 52, № 1, стр. 56-67
Ксенотрансплантация полнослойного кожного лоскута человека – модель для изучения регенерации кожи и цикла волосяных фолликулов
Е. П. Калабушева a, *, А. Л. Риппа a, А. А. Цитрина a, А. Пинто b, А. В. Терских b, Э. С. Чермных a, Е. А. Воротеляк a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Sanford Burnham Prebys Medical Discovery Institute
92037 La Jolla, CA, USA
* E-mail: Kalabusheva.e@gmail.com
Поступила в редакцию 01.05.2020
После доработки 02.07.2020
Принята к публикации 20.07.2020
Аннотация
Ксенотрансплантация кожи человека животным с иммунодефицитом – одна из наиболее успешных моделей для изучения тканей человека в норме и патологии. Основным ограничением данного подхода является размер трансплантата – в эксплантах кожи площадью более 10 × 10 мм отсутствует нижняя часть дермы и подкожная жировая клетчатка, полнослойные ксенотрансплантаты редко превышают размер 3 × 3 мм. В настоящем исследовании показано, что трансплантация полнослойных лоскутов размером 15 × 5 мм обеспечивает успешную интеграцию и сохранение всех структур кожи: эпидермиса, дермы, кровеносных сосудов, волосяных фолликулов, сальных и потовых желез. Волосяные фолликулы в составе трансплантатов воспроизводят цикл физиологической регенерации. Данная модель подходит для изучения регенерации волосяных фолликулов, желез, интерфолликулярного эпидермиса и других структур кожи.
ВВЕДЕНИЕ
Исследование тканей человека, в том числе кожи, в норме и патологии затруднено по многим причинам: ограниченное количество биологического материала не позволяет изучать процессы в динамике, невозможность использовать современные методы in vivo затрудняет возможность проводить трейсерный анализ и генетические манипуляции. Ученые разработали множество биологических моделей in vitro, in situ и in vivo (Salgado et al., 2017), расширяющих спектр проводимых научных работ. Эксперименты по ксенотрансплантации кожи человека проводятся с 1970х (Manning et al., 1973; Reed, Manning, 1973). Подобные операции позволили выявить пролиферативный потенциал стволовых клеток эпидермиса (Weinstein et al., 1984; Ghazizadeh, Taichman, 2005), исследовать динамику и механизмы ранозаживления (Démarchez et al., 1987; Shanmugam et al., 2015), подробно изучить цикл волосяного фолликула (Oh et al., 2016), а также моделировать заболевания, такие как псориаз (Nestle et al., 2005; Di Meglio et al., 2016), плоскоклеточная карцинома (Patel et al., 2012), меланома (Berking et al., 2002), разные виды алопеций (Sundberg et al., 1999; Keren et al., 2015; Gilhar et al., 2015), и др. Для каждого из исследований проводили тщательный анализ параметров трансплантата. Кожа человека и кожа мыши значительно отличается по толщине, плотности клеток, механизмам регенерации и т.д. (Rippa et al., 2019), разница в этих характеристиках ограничивает размеры трансплантата. Исследователи были вынуждены конкретизировать ткань или определенный клеточный тип как объект исследования, удаляя из трансплантата остальные структуры. В работах по изучению эпидермиса и пигментных клеток использовали биоптаты кожи площадью от 0.6 до 1 см2, не содержащие подкожной жировой клетчатки и ретикулярной дермы (Ghazizadeh, Taichman, 2005; Boyman et al., 2004). В то же время, при изучении волосяных фолликулов площадь трансплантата составляла в среднем менее 0.3 см2 (Gilhar et al., 2015; Oh et al., 2016). Подобные модели позволяли решать определенный спектр задач. Накопление знаний о физиологии кожи лабораторных животных показало, что изоляция определенных клеточных типов или кожных дериватов приводит к потере значительного пула данных о реципрокном взаимодействии внутри кожи, что крайне важно в контексте изучения механизмов гомеостаза, регенерации и патологических процессов (Ito et al., 2005; Lawlor, Kaur, 2015; Roy et al., 2016; Foster et al., 2018). Разработка модели ксенотрансплантации, соответствующей современным требованиям, является целью данного пилотного исследования. Трансплантат должен обеспечивать микроокружение, состоящее из тканей человека и поддерживающее физиологические параметры цикла волосяных фолликулов.
Кожа человека состоит из трех основных слоев: эпидермиса, дермы и подкожной жировой клетчатки. Помимо этого, в коже располагаются пигментные клетки, меланоциты, иммунные клетки, сеть капилляров и лимфатических сосудов, мышечные и нервные волокна, а также множество кожных дериватов: волосяные фолликулы, сальные и потовые железы. В то время как основным предметом исследования волосяных фолликулов были их циклические изменения при физиологической регенерации, интерфолликулярные участки кожи рассматривали как статичные, равномерно обновляющиеся ткани. С накоплением знаний стало очевидным взаимодействие между фолликулярным и интерфолликулярным компартментами как при поддержании гомеостаза, так и при раневом заживлении. Цикл волосяного фолликула состоит из фазы роста – анагена, деградации – катагена и покоя – телогена. У большинства млекопитающих цикл волосяных фолликулов синхронизирован и ассоциирован с сезонными изменениями шерстяного покрова. В течение цикла эпителиальная часть фолликула редуцируется более чем на 50%, восстанавливаясь в следующую фазу анагена, что обеспечивается эпителиальными стволовыми клетками области балдж (Myung, Ito, 2012). Интерфолликулярный эпидермис также содержит пул эпителиальных стволовых клеток, поддерживающих физиологическую регенерацию (Sada et al., 2016). В 2005 г. при помощи лабораторных мышей, несущих ген β-галактозидазы под промотором кератина 15, специфического для стволовых клеток волосяного фолликула, группа Джорджа Котсареллиса показала, что стволовые клетки волосяных фолликулов участвуют в процессах ранозаживления (Ito et al., 2005). Однако, мигрируя в центр раны они быстро дифференцируются в короткоживущие предшественники и спустя несколько недель элиминируются, не внося существенный вклад в нормальный гомеостаз эпидермиса. Это было одним из первых ключевых фактов, показавших взаимодействие волосяных фолликулов с интерфолликулярными участками. Недавно исследователи выявили, что стволовые эпидермальные клетки, располагающиеся в интерфолликулярном эпидермисе, имеют разную пролиферативную активность в зависимости от удаления от фолликулов. Потомство клеток, прилежащих к воронке фолликулов, формирует клоны большего размера в отличие от более удаленных. При этом основной пик пролиферации приходится на фазу роста волосяных фолликулов (Roy et al., 2016). Цикл волосяных фолликулов оказывает влияние не только на эпидермис. Кровеносные и лимфатические сосуды дермы меняют свое расположение, плотность и протяженность в зависимости от стадии цикла ближайших фолликулов (Li et al., 2019). Соответствующие гипертрофические и гиперплазические изменения наблюдаются и в жировой ткани (Foster et al., 2018). Все эти данные были получены с использованием модельных организмов – лабораторных мышей, так как для проведения значительной части работы было необходимо внесение генетических модификаций, инъекции флуоресцентных трейсеров, большой объем и стандартизация биологического материала. Проведение подобных исследований, по понятным причинам, на человеке невозможно, а результаты, полученные на мышиных моделях, требуют подтверждения. Модель ксенотрансплантации позволяет решить часть этих проблем. Важным моментом является возможность изучения поведения стволовых клеток волосяных фолликулов и межфолликулярного эпидермиса человека в условиях повреждения и последующей регенерации (Oh et al., 2016). Для проведения подобных исследований на коже человека требуется преодоление ограничений площади и толщины трансплантата, обсужденных выше. Следует отметить, что существенным также является выбор линии иммунодефицитных мышей, свойства которой могут повлиять на интенсивность реакции отторжения и динамику приживления трансплантата (Oh et al., 2016). Мы провели пилотное исследование по трансплантации полнослойных лоскутов кожи человека площадью 15 × 5 мм лабораторным мышам линии NOD/SCID c иммунодефицитом и полагаем, что данная модель может быть использована для проведения подобных работ в области исследований биологии кожи и ее дериватов.
МАТЕРИАЛЫ И МЕТОДЫ
Трансплантация
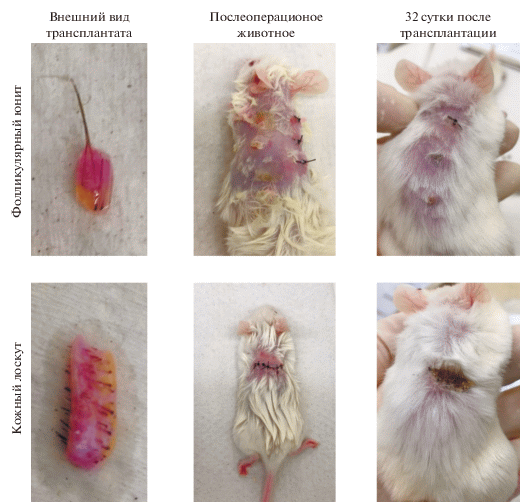
Кожа волосистой части головы была получена после операции по круговой подтяжке лица из МНИОИ им. П.А. Герцена с информированного согласия пациентов. Биоптаты промывали раствором Хэнкса (ПанЭко) с добавлением 3мг/мл гентамицина, после чего при помощи скальпеля и изогнутых ножниц под бинокулярным контролем нарезали до необходимых размеров (рис. 1).
Лабораторные мыши линии NOD/SCID были получены из питомника Charles River, содержались в условиях SPF с соблюдением светового режима. Проведение эксперимента одобрено комиссией по контролю за содержанием и использованием лабораторных животных этического комитета по клиническим исследованиям РНИМУ им. Н.И. Пирогова (номер заявки 09/2019). Животных наркотизировали внутрибрюшинным введением 2,2,2,-трибромэтанола (Sigma) (250 мг на кг массы тела). Для трансплантации лоскута кожи на спине мыши между лопаток проводили надрез длиной 1.5 см, куда помещали трансплантат, который фиксировали хирургическими швами (шелковая нить Волоть 4-0). Для трансплантации фолликулярных юнитов на спине мыши делали несколько надрезов диаметром 1–2 мм, в которые помещали трансплантат. Края раны фиксировали медицинским клеем БФ-6 (Вертекс) или шовным материалом. Площадь трансплантатов составляла не более 3 мм2, поэтому использование шовных техник при фиксации приводило к повреждению эпидермиса, однако позволяло надежно закрепить юниты. При трансплантации лоскута площадь трансплантата позволяла накладывать швы таким образом, чтобы оставлять обширные участки неповрежденного эпидермиса. После трансплантации, кожу человека накрывали лоскутом кожи мыши, чтобы избежать высушивания (рис. 1). После операции наносили фиксирующий бандаж TegadermTM. Всего в работе было использовано 3 животных в группе кожного лоскута и 1 животное в группе фолликулярных юнитов. Животных выводили из эксперимента на 32 и 78 сут после операции.
Получение криосрезов
Работа проводилась с использованием оборудования ЦКП ИБР им Н.К. Кольцова РАН. Образцы трансплантатов промывали в DPBS (ПанЭко), далее удаляли лишнюю влагу, затем заключали в среду для формирования криоблоков (Tissue-Tek, SAKURA) и замораживали сначала в парах азота, далее окуная в жидкий азот 2–3 раза по 3–5 с. Криоблоки хранили при –70°С. С помощью криостата (Microm HM 525, Thermo Scientific) получали срезы толщиной 7–9 мкм. Полученные срезы высушивали при комнатной температуре в течение суток. Далее срезы хранили при –70°C или проводили гистологическое и иммуногистохимическое исследование. Предварительно срезы фиксировали в растворе 4% параформальдегида (Sigma) в течение 10 мин, далее промывали 3 раза по 5 мин DPBS и проводили анализ.
Гистологическое исследование
Для морфологического анализа срезы окрашивали гематоксилин-эозином (BioVitrum) по стандартному протоколу и заключали в витрогель (BioVitrum).
Иммуногистохимическое исследование
Срезы инкубировали с первичными антителами, разведенными в блокирующем растворе (DPBS, 5% ЭТС (HyClone), 0.3% TRITON X-100 (Sigma)) во влажной камере при 4°С в течение 12–14 ч. Далее применяли вторичные антитела, конъюгированные с флуорофорами или с пероксидазой хрена (ImmPRESS® HRP Horse Anti-Rabbit IgG Polymer Detection Kit, Peroxidase MP-7401 и ImmPACT® VIP Substrate, Peroxidase (HRP) SK-4605) по стандартному протоколу. Срезы с соответствующими вторичными флуоресцентными антителами инкубировали в течение 1 ч при комнатной температуре. Ядра клеток докрашивали DAPI. Съемку гистологических препаратов осуществляли на микроскопе Keyence BZ-9000.
Список использованных в работе антител
Первичные антитела: Anti-Keratin 10 (Santa Cruz Biotechnology, sc23877); anti-Keratin 14 (Abcam, ab181595); anti-Ki67 (Abcam, ab16667); Anti-Nuclei Antibody, clone 235-1 (Millipore MAB 1281); CD 31 (Abcam, ab28364). Вторичные антитела: Alexa Fluor 488 и Alexa Fluor 594 (Invitrogen).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Модель полнослойной ксенотрансплантации
Были проведены два типа операционных вмешательств – ксенотрансплантация фолликулярных юнитов и кожных лоскутов. Фолликулярные юниты являются наиболее распространенной моделью при изучении цикла волосяных фолликулов (Gilhar et al., 2015; Oh et al., 2016), они представляют собой несколько волосяных фолликулов с близлежащими устьями, с минимальным количеством окружающих тканей. Лоскуты кожи имели площадь 15 × 5 мм, содержали около 20 волосяных фолликулов (рис. 1). Обе модели содержали дерму и подкожную жировую клетчатку, в которую были погружены волосяные луковицы.
Первый забор материала проводили на 32 сут после операционного вмешательства. Из 6 трансплантированных юнитов на животном сохранилось 2, которые изначально были зафиксированы шовным материалом. Лоскут кожи человека сохранился и интегрировался в кожу животного, на его поверхности наблюдали волосяные стержни (рис. 1). Таким образом, сама процедура трансплантации лоскута не является более трудоемкой, в сравнении с общепринятой моделью – фолликулярными юнитами. В дальнейшей работе мы сосредоточились именно на изучении и описании морфологии лоскута кожи.
Морфология трансплантированного лоскута кожи человека
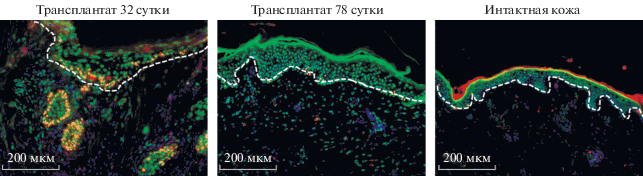
Материал фиксировали на 32 и 78 сут после трансплантации. Для детекции тканей трансплантата использовали антиген против ядер человека (Human Nuclei). Полученные изображения позволили определить характерные признаки трансплантата, которые мы в дальнейшем смогли использовать и в других окрашиваниях: утолщенный эпидермис, крупный размер волосяных фолликулов, рыхлая дермальная ткань (рис. 2).
Рис. 2.
Детекция ксенотрансплантата. Иммуногистохимия. Флуоресцентная микроскопия. Масштабный отрезок – 200 мкм. Пунктирной линией обозначены границы трансплантата. * – автофлуореценция эпидермиса мыши.

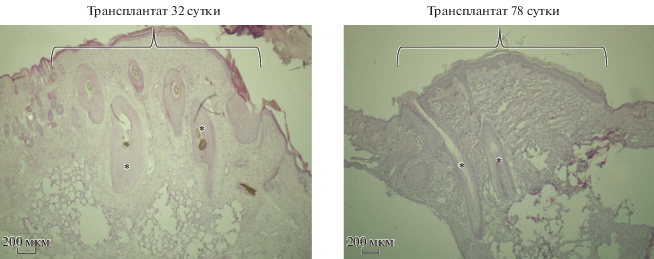
Окрашивание гематоксилин-эозином показало полную интеграцию кожи человека в кожу мыши (рис. 3). На 32 сут по краям трансплантата наблюдаются эпителиальные валики, причиной появления которых может быть как регенерация эпидермиса человека, так и послеоперационные швы. На препаратах заметны волосяные фолликулы человека, по размерам значительно превышающие фолликулы мыши. Стоит отметить хорошую сохранность дермальной ткани и подкожной жировой клетчатки. На 32 сут дерма выглядит гомогенно, к 78 сут наблюдается разделение на более плотную папиллярную и рыхлую ретикулярную дерму (рис. 3).
Рис. 3.
Морфология трансплантата кожного лоскута человека. Гематоксилин-эозин. Световая микроскопия. Масштабный отрезок 200 мкм. * – волосяные фолликулы. Черным цветом обозначены структуры кожи человека, белым – кожи мыши. Фигурная скобка отмечает границы трансплантата.
Выявление маркера эндотелия сосудов CD31 показало хорошую васкуляризацию трансплантатов на исследуемых сроках (рис. 4). Это свидетельствует об отсутствии очагов некроза в центре биоптата. В трансплантате частые мелкие сосуды, видимые на 32 сут, сменяются на редкие оформленные на 78 сут.
Рис. 4.
Васкуляризация ксенотрансплантата. CD31 – положительные сосуды окрашены в фиолетовый цвет. Световая микроскопия. Масштабный отрезок 200 мкм. * – волосяные фолликулы. В выносках в белой рамке располагаются увеличенные фрагменты среза.

Процесс приживления трансплантата можно рассматривать в контексте регенерации кожных ран. Заживление кожи мыши и кожи человека отличается. Кожа мыши в большей степени подвергается процессу контракции (стягивания), что сокращает площадь раны и ускоряет процесс заживления. Однако в целом, ранозаживление проходит следующие стадии: стадия воспаления (миграция макрофагов и гранулоцитов), стадия пролиферации (образование грануляционной ткани, миграция фибробластов и эндотелиальных клеток, замещение воспалительных клеток на противовоспалительные) и стадия ремоделинга (сжатие грануляционной ткани миофибробластами, реактивация миофибробластов, апоптоз, синтез и реорганизация внеклеточного матрикса фибробластами) (Zomer, Trentin, 2018). На 32 сут мы наблюдаем активную пролиферацию ткани трансплантата, сеть мелких сосудов в дерме, эпидермальные валики на стыке трансплантата с кожей реципиента, что напоминает стадию пролиферации при ранозаживлении. На 78 сут отмечается общее снижение пролиферации и отсутствие фиброзной ткани, наличие папиллярной и ретикулярной дермы, что позволяет предполагать, что стадия ремоделинга дермы (в терминах ранозаживления) завершилась. Волосяные фолликулы поддерживают цикл физиологической регенерации после трансплантации.
Ранее было показано, что при трансплантации небольших панч-биоптатов и фолликулярных юнитов животным с иммунодефицитом волосяные фолликулы в коже человека синхронизируют свой цикл, вступая в фазу деградации (Gilhar et al., 2013; Oh et al., 2016). Середина катагена приходится на 18 сут после трансплантации, на 33 сут фолликулы находятся на переходной стадии, стадия катагена завершается и фолликулы вступают в фазу роста, достигая ее середины к 47 сут. К 90-м суткам фолликулы достигают финальной стадии развития и максимального размера (Oh et al., 2016).
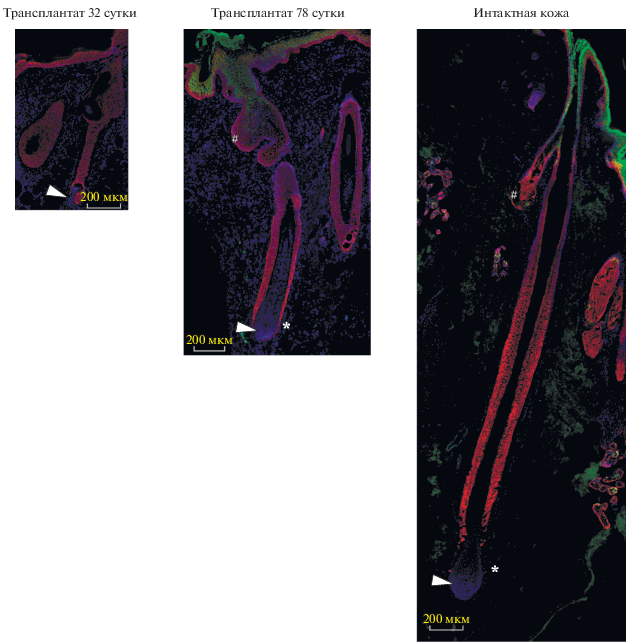
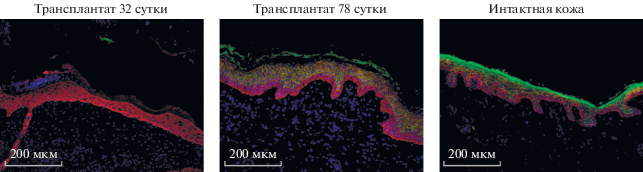
Морфологию волосяных фолликулов исследовали при помощи окрашивания на кератин 14, маркер фолликулярных эпителиальных клеток и кератиноцитов базального слоя эпидермиса. В качестве контрольного образца мы использовали интактную кожу человека (рис. 5). На 32 сут после трансплантации фолликулы соответствуют стадии позднего катагена: размер фолликула сокращен более чем в 2 раза, в фолликуле отсутствует выраженная луковица с клетками герминативного матрикса, редуцированная эпителиальная часть волосяного фолликула связана с мезенхимным регуляторным центром, дермальной папиллой, тонким столбиком эпителиальных клеток. Вокруг фолликула не наблюдается сальных желез. К 78 сут фолликулы значительно увеличиваются в размерах за счет прогрессивного роста. В них наблюдается сформированная луковица, в которую погружена дермальная папилла, присутствуют сальные железы и формирующийся стержень волоса. Морфологически стадия развития таких фолликулов может быть охарактеризована как анаген V.
Рис. 5.
Морфология волосяных фолликулов. Иммуногистохимия в сочетании с флуоресцентной микроскопией. Масштабный отрезок 200 мкм. Зеленое окрашивание – кератин 10, красное окрашивание – кератин 14. Ядра докрашены DAPI. Размер фотографий пропорционален размеру волосяных фолликулов. # – сальная железа. Стрелками указано расположение дермальной папиллы.
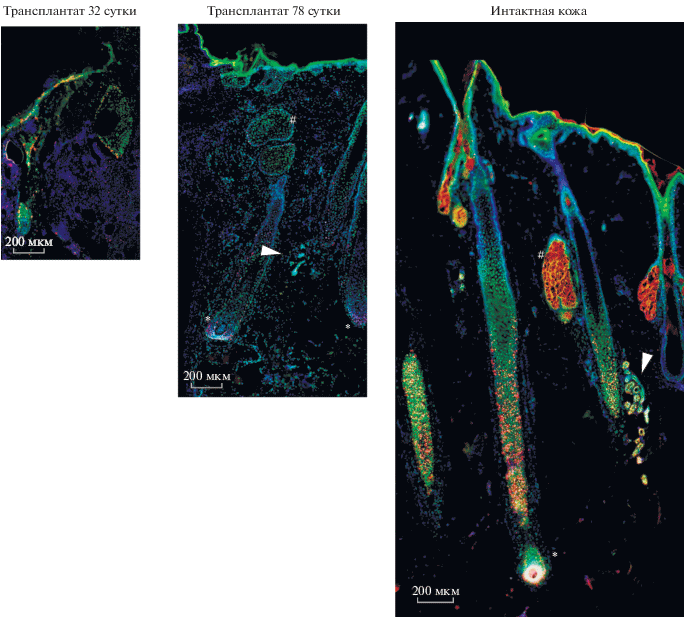
Стадию развития фолликулов можно косвенно подтвердить при помощи детекции маркеров пролиферации. Количество пролиферирующих клеток волосяного фолликула значительно возрастает в фазу роста. Наши результаты показывают, что в фолликулах на 32 сут после трансплантации маркер пролиферирующих клеток Ki67 выявляется лишь в отдельных ядрах, в то время как на 78 сут наблюдается активное деление клеток в луковице волоса (рис. 6). Также на 78 сут в трансплантате впервые обнаруживаются потовые железы (рис. 6). Полученные результаты свидетельствуют о соответствии цикла волосяных фолликулов, описанному в подробном руководстве, полученном с использованием фолликулярных юнитов (Oh et al., 2016).
Рис. 6.
Пролиферация в волосяных фолликулах. Иммуногистохимия в сочетании с флуоресцентной микроскопией. Масштабный отрезок 200 мкм. Зеленое окрашивание – Human Nuclei, красное окрашивание – Ki67. Ядра докрашены DAPI. Размер фотографий пропорционален размеру волосяных фолликулов. * – луковица волосяного фолликула, # – сальная железа. Стрелками указано расположение потовых желез.
Регенерация трансплантата
Для оценки степени регенерации и приживления трансплантатов измерили уровень пролиферации в эпидермисе и дерме интерфолликулярных участков трансплантированной кожи человека. В качестве контроля использовали интактный биоптат кожи человека (рис. 7). Визуально можно отметить значительное уменьшение количества пролиферирующих ядер как в эпидермисе, так и в дерме на 78 сут в сравнении с 32 сут после операции.
Рис. 7.
Пролиферация эпидермиса и дермы в интерфолликулярных участках кожи человека. Иммуногистохимия в сочетании с флуоресцентной микроскопией. Масштабный отрезок 200 мкм. Зеленое окрашивание – Human Nuclei, красное окрашивание – Ki67. Ядра докрашены DAPI. Пунктирной линией обозначена граница эпидермиса.
Для количественной оценки пролиферации измерили количество пролиферирующих клеток на 1 мм эпидермиса и 1 мм2 дермы (рис. 8). Уровень пролиферации как в дерме, так и в эпидермисе к 78 сут снижается более чем в 2 раза. Пролиферация клеток дермы практически достигает уровня интактной кожи, в то время как в эпидермисе даже на 78 сут сохраняется достаточно высокой. Таким образом, на 32 сут трансплантат находится в состоянии активной регенерации, которая постепенно замедляется к 78 сут. Полученные данные показывают, что реконструкция дермы на 78 сут завершается, и ее гомеостаз устанавливается, по-видимому, раньше эпидермиса, который к этому сроку еще активно пролиферирует.
Структура интерфолликулярного эпидермиса
Эпидермис человека обладает слоистой структурой: на базальной мембране располагается герминативный слой, маркером которого являются кератины 5 и 14. Базальные клетки при делении формируют шиповатый слой, клетки которого постепенно дифференцируются, теряя экспрессию кератинов 5/14. Специализированными маркерами шиповатого слоя являются кератины 1 и 10. Толщина и соотношение слоев эпидермиса являются важнейшей характеристикой его физиологического состояния.
Произвели анализ строения эпидермиса в трансплантатах на исследуемых сроках. На 32 сут наблюдали наиболее радикальные отличия от интактной кожи человека, в эпидермисе отсутствовала экспрессия маркера шиповатого слоя, кератина 10. К 78 суткам выявлялось стойкое положительное окрашивание данного маркера (рис. 9).
Рис. 9.
Анализ экспрессии маркеров базального и шиповатого слоя эпидермиса в интерфолликулярных участках кожи человека. Иммуногистохимия в сочетании с флуоресцентной микроскопией. Масштабный отрезок 200 мкм. Зеленое окрашивание – кератин 10, красное окрашивание – кератин 14. Ядра докрашены DAPI.
Количественно оценили толщину кератин 14 и кератин 10 положительных слоев (рис. 10). Результаты подсчета показали значительное утолщение кератин 14 положительного слоя в трансплантатах на исследуемых сроках. Толщина шиповатого слоя (кератин 10+) на 78 сут также значительно превышала значение, полученное для интактной кожи человека.
Рис. 10.
Количественные параметры эпидермиса ксенотрансплантата. Доверительный интервал – ошибка среднего. Правый и средний график – толщина кератин 14 и кератин 10 положительных слоев эпидермиса. Левый график – количество эпидермальных гребней на 1 мм трансплантата. * – статистически значимый результат при р ≤ 0.05, Mann–Whitney U test.
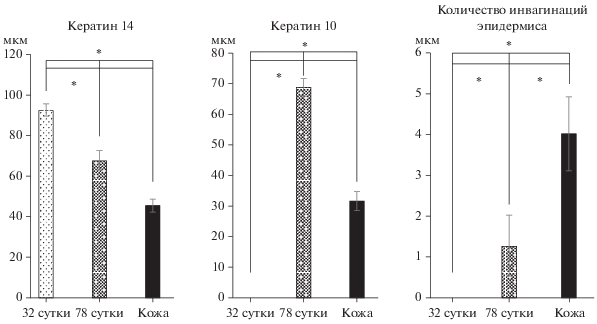
Другой важнейшей характеристикой является структура контакта между эпидермисом и дермой Папиллярный слой дермы кожи человека формирует специализированные сосочки, между которыми наблюдается утолщение эпидермиса в виде гребней. Оценили количество подобных интердигитаций на разных сроках трансплантации и сравнили полученный результат с интактной кожей человека. Полученные данные свидетельствуют о недоразвитости эпидермальных гребней на всех исследуемых сроках после трансплантации. На 32 сут подобные интердигитации отсутствуют. На 78 сут эпидермальные гребни обнаруживаются, однако их значительно меньше чем в интактной коже (рис. 10).
На конечной точке наблюдений (78 сут) ряд объективных критериев: обособление папиллярной и ретикулярной дермы; появление эпидермальных гребней; восстановление сальных и потовых желез; вступление волосяных фолликулов в фазу активного роста; уменьшение уровня пролиферации клеток трансплантата в общем (пролиферация в дерме достигает уровня контроля) и формирование зрелой сосудистой сети (плотная сеть мелких сосудов замещается оформленными крупными сосудами); место контакта эпидермиса реципиента и донора приобретает непрерывную структуру без видимой области гиперпролиферации и/или инвагинации позволяет предполагать завершение процесса ремоделирования и достижение начальной фазы гомеостаза кожи. Следует отметить, что становление структуры дермы на 78 сут завершается, но интерфолликулярному эпидермису, вероятно, требуется более длительное время для достижения уровня пролиферации, близкого к интактной коже. Поддержание стабильного гомеостаза требует дополнительного экспериментального подтверждения. Определение физиологического состояния трансплантата необходимо для планирования дальнейших экспериментов. На сроке 78 сут после трансплантации еще рано проводить исследования, затрагивающие процессы, происходящие в здоровой коже. Определение характера приживления может быть интересной темой для дальнейших исследований.
Данная модель позволит исследовать финальные механизмы регенерации, такие как стратификация дермы (рис. 3), восстановление сальных и потовых желез (рис. 5 и 6), а также вовлеченность стволовых клеток волосяного фолликула области балдж в регенерацию эпидермиса. Дальнейшие исследования по увеличению размера трансплантата, анализу динамики его приживления и достижения гомеостаза могут позволить изучать процессы ранозаживления и формирование гипертрофических рубцов, характерных для кожи человека (Zhu et al., 2016; Alrobaiea et al., 2016).
В целом мы надеемся, что описанная модель гуманизированной кожи позволит преодолеть текущие ограничения в изучении цикла волосяного фолликула человека, интерфолликулярного эпидермиса, дермы и подкожной жировой клетчатки кожи человека.
ЗАКЛЮЧЕНИЕ
Описанная модель трансплантации полнослойного лоскута кожи человека позволяет сохранить все структуры: эпидермис, дерму и подкожную жировую клетчатку, а также производные кожи – волосяные фолликулы, сальные и потовые железы. Данная модель на сроках до 78 сут позволяет исследовать инициацию цикла волосяного фолликула и механизмы регенерации дермы и эпидермиса. Вероятно, определенное влияние на состояние трансплантата в ходе приживления оказывает и динамика химеризма, т.е. соотношение клеточных компонентов реципиента и донора, что представляется интересным для будущих исследований. Тенденции скорости регенерации трансплантата позволяют предположить, что на сроках более 90 сут, когда волосяные фолликулы достигнут максимальной стадии развития, данный способ трансплантации может быть пригоден для моделирования процессов, протекающих в здоровой коже человека.
Список литературы
Alrobaiea S.M., Ding J., Ma Z. et al. A novel nude mouse model of hypertrophic scarring using scratched full thickness human skin grafts // Adv. Wound Care (New Rochelle). 2016. V. 5. № 7. P. 299–313.
Berking C., Takemoto R., Binder R.L. et al. Photocarcinogenesis in human adult skin grafts// Carcinogenesis. 2002. V. 23. № 1. P. 181–187.
Boyman O., Hefti H.P., Conrad C. et al. Spontaneous development of psoriasis in a new animal model shows an essential role for resident T cells and tumor necrosis factor-alpha // J. Expd. 2004. V. 199. № 5. P. 731–736.
Démarchez M., Hartmann D.J., Herbage D. et al. Wound healing of human skin transplanted onto the nude mouse: II. An immunohistological and ultrastructural study of the epidermal basement membrane zone reconstruction and connective tissue reorganization // Dev. Biol. 1987. V. 121. № 1. P. 119–129.
Di Meglio P., Villanova F., Navarini A.A. et al. Targeting CD8(+) T cells prevents psoriasis development // J. Allergy Clin. Immunol. 2016. V. 138. № 1. P. 274–276.
Foster A.R., Nicu C., Schneider M.R. et al. Dermal white adipose tissue undergoes major morphological changes during the spontaneous and induced murine hair follicle cycling: a reappraisal // Arch. Dermatol. Res. 2018. V. 310. № 5. P. 453–462.
Ghazizadeh S., Taichman L.B. Organization of stem cells and their progeny in human epidermis// J. Invest. Dermatol. 2005. V. 124. № 2. P. 367–372.
Gilhar A., Keren A., Shemer A. et al. Autoimmune disease induction in a healthy human organ: a humanized mouse model of alopecia areata // J. Invest. Dermatol. 2013. V. 133. № 3. P. 844–847.
Ito M., Liu Y., Yang Z. et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis // Nat. Med. 2005. V. 11. № 12. P. 1351–1354.
Keren A., Shemer A., Ullmann Y. et al. The PDE4 inhibitor, apremilast, suppresses experimentally induced alopecia areata in human skin in vivo // J. Dermatol. Sci. 2015. V. 77. № 1. P. 74–76.
Lawlor K.T., Kaur P. Dermal contributions to human interfollicular epidermal architecture and self-renewal // Int. J. Mol. Sci. 2015. V. 16. № 12. P. 28098–28107.
Li K.N., Jain P., He C.H. et al. Skin vasculature and hair follicle cross-talking associated with stem cell activation and tissue homeostasis // Elife. 2019. V. 8. P. e45977.
Manning D.D., Reed N.D., Shaffer C.F. Maintenance of skin xenografts of widely divergent phylogenetic origin of congenitally athymic (nude) mice // J. Exp. Med. 1973. V. 138. № 2. P. 488–494.
Myung P., Ito M. Dissecting the bulge in hair regeneration // J. Clin. Invest. 2012. V. 122. № 2. P. 448–454.
Nestle F.O., Conrad C., Tun-Kyi A. et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-alpha production // J. Exp. Med. 2005. V. 202. № 1. P. 135–143.
Oh J.W., Kloepper J., Langan E.A. et al. A guide to studying human hair follicle cycling in vivo // J. Invest. Dermatol. 2016. V. 136. № 1. P. 34–44.
Patel G.K., Yee C.L., Yuspa S.H. et al. A humanized stromal bed is required for engraftment of isolated human primary squamous cell carcinoma cells in immunocompromised mice // J. Invest. Dermatol. 2012. V. 132. № 2. P. 284–290.
Reed N.D., Manning D.D. Long-term maintenance of normal human skin on congenitally athymic (nude) mice // Proc. Soc. Exp. Biol. Med. 1973. V. 143. № 2. P. 350–353.
Rippa A.L., Kalabusheva E.P., Vorotelyak E.A. Regeneration of dermis: scarring and cells involved // Cells. 2019. V. 8. № 6. P. E607.
Roy E., Neufeld Z., Cerone L. et al. Bimodal behaviour of interfollicular epidermal progenitors regulated by hair follicle position and cycling // EMBO J. 2016. V. 35. № 24. P. 2658–2670.
Sada A., Jacob F., Leung E. et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin // Nat. Cell Biol. 2016. V. 18. № 6. P. 619–631.
Salgado G., Ng Y.Z., Koh L.F. et al. Human reconstructed skin xenografts on mice to model skin physiology // Differentiation. 2017. V. 98. P. 14–24.
Shanmugam V.K., Tassi E., Schmidt M.O. Utility of a human-mouse xenograft model and in vivo near-infrared fluorescent imaging for studying wound healing // Int. Wound J. 2015. V. 12. № 6. P. 699–705.
Sundberg J.P., Beamer W.G., Uno H. Androgenetic alopecia: in vivo models // Exp. Mol. Pathol. 1999. V. 67. № 2. P. 118–130.
Weinstein G.D., McCullough J.L., Ross P. Cell proliferation in normal epidermis // J. Invest. Dermatol. 1984. V. 82. № 6. P. 623–628.
Zhu Z., Ding J., Zengshuan M. et al. The natural behavior of mononuclear phagocytes in HTS formation // Wound Repair Regen. 2016. V. 24. № 1. P. 14–25.
Zomer H.Z., Trentin A.G. Skin wound healing in humans and mice: challenges in translational research // J. Dermatol. Sci. 2018. V. 90. № 1. P. 3–12.
Дополнительные материалы отсутствуют.