Онтогенез, 2021, T. 52, № 2, стр. 146-150
Влияние инсулиноподобного фактора роста первого типа на развитие in vitro эмбрионов мышей после их криоконсервации
Е. Ю. Брусенцев a, Е. А. Кизилова a, Т. Н. Игонина a, С. В. Раннева a, С. Я. Амстиславский a, *
a Федеральное государственное бюджетное научное учреждение “Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской академии наук”
630090 Новосибирск, пр. ак. Лаврентьева, 10, Россия
* E-mail: amstis@yandex.ru
Поступила в редакцию 05.03.2020
После доработки 03.07.2020
Принята к публикации 08.07.2020
Аннотация
Криоконсервацию гамет и эмбрионов широко применяют для сохранения генетических ресурсов животных. В работе исследовано развитие дробящихся эмбрионов мышей линий CD1 в культуре in vitro при воздействии инсулиноподобного фактора роста первого типа (IGF-1) после процедур криоконсервации. Зародыши мышей, полученные in vivo на стадии 4–6 клеток вначале замораживали, согласно стандартному протоколу программного замораживания с использованием 10%-го раствора пропиленгликоля в качестве криопротектора, а после оттаивания культивировали in vitro до стадии бластоцисты в среде KSOM в течение 48 ч. Добавление в среду для культивирования IGF-1 в концентрации 40 нг/мл приводило к повышению доли развивающихся до стадии бластоцисты эмбрионов по сравнению с контролем (78.9 и 47.4% соответственно, p < 0.01). Кроме того, заморожено-оттаянные эмбрионы после культивирования с IGF-1 имели большее число клеток по сравнению с контролем (79.8 ± 3.9 и 58.6 ± 3.6 клеток соответственно, p < 0.001). Между тем, уровень фрагментации ядер не различался между этими группами бластоцист. Результаты представленных экспериментов свидетельствуют о стимулирующем воздействии фактора роста IGF-1 на развитие дробящихся эмбрионов мышей в преимплантационный период после их криоконсервации.
ВВЕДЕНИЕ
Криоконсервацию биологических объектов и создание криобанков генетических ресурсов успешно используют для сохранения биоразнообразия животных; в таких криобанках хранят сперматозоиды, ооциты и преимплантационные эмбрионы (Agca, 2012). Однако в процессе охлаждения и последующего оттаивания эмбрионов нередко возникают криоповреждения (Игонина и др., 2015). Культивирование эмбрионов in vitro после процедур криоконсервации позволяет оценить степень их жизнеспособности (Brusentsev et al., 2014; Игонина и др., 2015).
Современные питательные среды для культивирования in vitro репродуктивных клеток могут сильно варьировать по своему химическому составу, оставаясь при этом субоптимальными по сравнению с условиями in vivo (Aguilar, Reyley, 2005), что негативно влияет на качество эмбрионов млекопитающих (Khatir et al., 2005; Brusentsev et al., 2014). Известно, что включение отдельных ростовых факторов в состав культуральной среды может минимизировать негативные эффекты культивирования эмбрионов in vitro (Amstislavsky et al., 2015; Брусенцев и др., 2015).
Одним из важнейших ростовых факторов, участвующих в росте и развитии фолликулов и эмбрионов, является инсулиноподобный фактор роста 1-го типа (IGF-1), который в перспективе может быть использован в клинической практике. Рецепторы к IGF-1 детектируются, начиная с ранних стадий дробления зародышей мышей (Heyner et al., 1989). В настоящее время имеются данные о стимулирующем воздействии IGF-1 на эмбрионы этих животных (Lin et al., 2003). Однако, изучение воздействия фактора IGF-1 на эмбрионы мышей после процедур замораживания-оттаивания проводили лишь в двух исследованиях (Desai et al., 2000, 2007). В первом из них изучали развитие in vitro преимплантационных эмбрионов после их криоконсервации на стадии морулы (Desai et al., 2000). В другой работе этого же коллектива авторов изучали влияние IGF-1 на развитие in vitro преимплантационных эмбрионов после их криоконсервации на стадии зиготы (Desai et al., 2007). Целью настоящего исследования было изучение влияния IGF-1 на развитие in vitro эмбрионов мышей после их криоконсервации на стадии дробления.
МАТЕРИАЛЫ И МЕТОДЫ
В эксперименте было использовано 10 половозрелых самок и пять самцов мышей линии CD1 в возрасте от двух до трех месяцев. Животных содержали в стандартных условиях конвенционального вивария Института цитологии и генетики (Новосибирск, Россия).
Cамок мышей линии CD1 на стадии проэструс-эструс ссаживали на ночь с фертильными самцами этой же линии. День обнаружения вагинальной пробки считали первым днем беременности. Таких самок подвергали эвтаназии путем дислокации шейных позвонков на второй день беременности, в 16 ч. Яйцеводы и матку извлекали и промывали средой Flushing Solution (FertiPro, Belgium), как описано ранее (Igonina et al., 2019).
Для криоконсервации дробящихся зародышей мышей применяли программное замораживание. Все полученные эмбрионы были на стадии 4–6 клеток. В качестве криопротектора использовали 10% (v/v) пропиленгликоль (ХимМед, Россия) в среде Flushing Solution (FertiPro, Belgium). Эмбрионы помещали в центральную часть (второй сектор) 0.25 мл пластиковой соломины (Cryo Bio System, Франция) и криоконсервировали с использованием программного замораживателя CL 8800 (CryoLogic, Australia) как описано ранее (Игонина и др., 2015; Amstislavsky et al., 2015).
Для оттаивания соломины с эмбрионами доставали из резервуара с жидким азотом, выдерживали в течение 40 с при комнатной температуре, а затем помещали на 40 с в водяную баню при 30.0°C как описано ранее (Игонина и др., 2015; Amstislavsky et al., 2015). Содержимое выдавливали на чашку Петри (Corning, USA) и освобождали от криопротектора путем переноса оттаянных эмбрионов через три капли (50 мкл) среды Flushing Solution (FertiPro, Бельгия). После удаления криопротектора, эмбрионы оценивали визуально. Зародыши, у которых было разрушено более 25% бластомеров, либо были серьезные нарушения прозрачной оболочки (или ее полное отсутствие) были отбракованы согласно критериям, принятым для оценки эффективности процедуры криоконсервации эмбрионов мышей (Игонина и др., 2015); остальные – переносили в индивидуальную каплю среды KSOM (Merck, Германия) и культивировали in vitro как описано ниже.
Были сформированы две группы: 1) без добавления факторов роста (контроль); 2) с добавлением 40 нг/мл IGF-1 (Merck, Германия). Данная дозировка выбрана нами исходя из литературных данных (Desai et al., 2000, 2007) и наших предварительных исследований. Согласно нашей предыдущей работы, эта дозировка была оптимальной для развития эмбрионов мышей без криоконсервации. Чистота препарата IGF-1 составляла ≥98%. Культивирование производили под минеральным маслом (Merck, Germany) в течение 48 ч при 37.0°С, 5% СО2 и влажности 90% в CO2-инкубаторе New BrunswickTM Galaxy 48R (Eppendorf, Германия).
Оценку преимплантационных эмбрионов проводили микроскопически, определяя стадию их развития при помощи стереомикроскопа S8 APO (Leica Microsystems, Германия). В бластоцистах определяли наличие хэтчинга, подсчитывали число клеток, индекс фрагментации, а также митотический индекс после окрашивания DAPI (2 мкг/мл 4,6-диамидино-2-фенилиндола), как описано нами ранее (Amstislavsky et al., 2015). Подсчет числа интерфазных ядер, их фрагментов и метафазных пластинок в развивающихся бластоцистах производили путем визуальной оценки препаратов с применением флуоресцентного микроскопа AxioImager A1 (Carl Zeiss, Германия), имеющегося в распоряжении ЦКП МАБО СО РАН, с соответствующим кубическим фильтром для окрашивания DAPI. Индекс фрагментации рассчитывали, как число фрагментов ×100 деленое на общее число ядер. Митотический индекс рассчитывали, как число митозов ×100 деленое на общее число ядер.
Статистическую обработку результатов исследования проводили с помощью стандартного пакета программного обеспечения STATISTICA V 8.0 (StatSoft, Inc). Доли зародышей, развивающихся до стадии бластоцисты сравнивали с помощью теста хи-квадрат. Для сравнения данных по числу клеток в бластоцистах и индексу фрагментации использовали t-критерий Стьюдента. Результаты считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
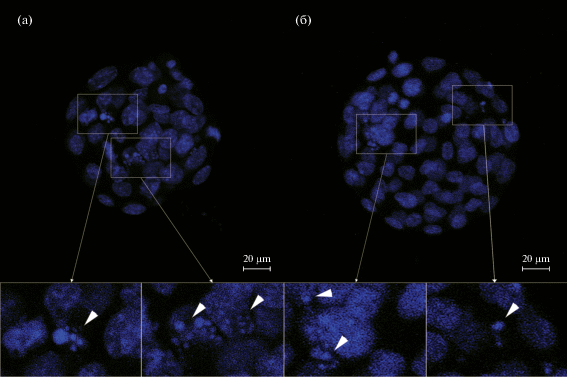
После процедур замораживания-оттаивания 76 из 89 зародышей, визуально были оценены как морфологически нормальные (т.о. всего было отбраковано ~15%). Все морфологически нормальные эмбрионы были использованы в дальнейших экспериментах: 38 из них культивировали в среде KSOM с добавлением IGF-1 в концентрации 40 нг/мл и 38 – культивировали в той же среде без добавления этого фактора роста. Добавление в культуральную среду IGF-1 приводило к улучшению показателей развития эмбрионов по сравнению с контролем (рис. 1а, 1б), таких как доля зародышей, развивающихся до стадии бластоцисты (78.9 и 47.4% соответственно, p < 0.01) и число клеток в них (79.8 ± 3.9 и 58.6 ± 3.6 соответственно, p < 0.001). Однако не было обнаружено достоверных различий по доле бластоцист достигших стадии хэтчинга между экспериментальной группой и контролем (13.1 и 7.9% соответственно). При этом митотический индекс был существенно ниже при использовании IGF-1 по сравнению с контрольной группой (5.0 ± 0.7 и 14.1 ± 3.0 соответственно, p < 0.01). Между тем, не было обнаружено достоверных различий по индексу фрагментации между экспериментальной группой и контролем (9.2 ± 1.5 и 9.8 ± 1.7 соответственно).
ОБСУЖДЕНИЕ
Давно установленный факт замедленного развития зародышей, полученных in vitro, по сравнению с эмбрионами, находящимися в условиях in vivo (Bowman, McLaren, 1970), указывает на важную роль паракринных факторов, секретируемых репродуктивным трактом, в ускорении их развития. Естественная среда репродуктивных путей млекопитающих содержит множество разнообразных компонентов, в том числе различные факторы роста (Aguilar, Reyley, 2005). Так, например, в эндометрии человека показана экспрессия большого числа цитокинов и факторов роста, поддерживающих эмбриональное развитие (Kawamura et al., 2012).
Исследования на животных моделях подтверждают важную роль аутокринных/паракринных факторов, секретируемых преимплантационными эмбрионами и репродуктивным трактом для эмбрионального развития и имплантации (Neira et al., 2010). Перспективным подходом к оптимизации культуральных систем является включение отдельных факторов роста, присутствующих во внутриматочной среде in vivo, или их комбинаций в питательные среды, что способствует улучшению раннего эмбрионального развития и увеличению доли имплантирующихся зародышей (Kawamura et al., 2012; Брусенцев и др., 2015; Amstislavsky et al., 2015).
В нашей работе было показано, что при культивировании с IGF-1 заморожено-оттаянных эмбрионов на стадии дробления повышается доля развивающихся бластоцист и число клеток в них. Наши данные согласуются с результатами более ранних исследований, в которых было показано, что добавление IGF-1 к средам для культивирования in vitro повышало долю развивающихся до стадии бластоцисты эмбрионов у мышей (Desai et al., 2000), и у других видов млекопитающих (Sirisathien, Brackett, 2003; Chen et al., 2017). В частности, в концентрации 30 нг/мл этот фактор повышал долю образования бластоцист и число клеток в них при культивировании зародышей мышей in vitro (Desai et al., 2000). Показано, что IGF-1 стимулирует эмбриональный рост и развитие, действуя в качестве митогенного фактора, индуцирующего пролиферацию клеток через митоген-активированную протеинкиназу (Velazquez et al., 2009). Кроме того, IGF-1 участвует в регулировании связанных с апоптозом генов Bcl-2/Bax (Chen et al., 2017). Это подтверждается результатами других исследований, которые указывают на то, что культивирование с IGF-1 способствует снижению уровня апоптоза в бластоцистах, которое происходит через активацию PI3K/Akt пути (Velazquez et al., 2009).
Согласно нашим данным, митотический индекс в бластоцистах при культивировании с IGF-1 был ниже, чем в контроле. Действительно, наши результаты, в своей совокупности, свидетельствуют о том, что при воздействии данного фактора роста бластоцисты более продвинуты в своем развитии (имеют больше число клеток). Между тем, известно, что в более поздних преимплантационных эмбрионах мышей скорость деления клеток снижается (Copp, 1978; Handyside, Hunter, 1986).
Ранее уже исследовали влияние фактора IGF-1 на процессы восстановления преимплантационных эмбрионов мышей, подвергавшихся криоконсервации на стадии морулы (Desai et al., 2000) и зиготы (Desai et al., 2007). Было показано, что морулы мышей после криоконсервации и последующего оттаивания быстрее достигают стадии бластоцисты и имеют больше клеток, если культивировать их с IGF-1 в концентрации 30 нг/мл (Desai et al., 2000). Однако, если эмбрионы мышей были заморожены на стадии зиготы этот эффект нивелировался (Desai et al., 2007). В данной работе мы восполнили пробел, связанный с тем, что не было изучено влияние этого фактора на развитие зародышей мышей после их криоконсервации на стадии дробления и продемонстрировали способность IGF-1 в концентрации 40 нг/мл стимулировать развитие дробящихся зародышей в приимплантационный период после процедур замораживания-оттаивания.
Список литературы
Брусенцев Е.Ю., Игонина Т.Н., Рожкова И.Н., Рагаева Д.С., Амстиславский С.Я. Эффекты воздействия факторов роста при культивировании in vitro эмбрионов мышей и крыс // Вавиловский журн. генетики и селекции. 2015. Т. 19. № 4. С. 372–377.
Игонина Т.Н., Брусенцев Е.Ю., Рожкова И.Н., Напримеров В.А., Амстиславский С.Я. Сравнение различных сочетаний криопротекторов и методов оттаивания при криоконсервации эмбрионов мышей и крыс // Вавиловский журн. генетики и селекции. 2015. Т. 19. № 4. С. 77–81.
Agca Y. Genome resource banking of biomedically important laboratory animals // Theriogenology. 2012. V. 78. P. 1653–1665.
Aguilar J.J., Reyley M. The uterine tubal fluid: secretion, composition and biological effects // Anim. Reprod. 2005. V. 2. № 2. P. 91–105.
Amstislavsky S., Brusentsev E., Kizilova E. et al. Embryo cryopreservation and in vitro culture of preimplantation embryos in Campbell’s hamster (Phodopus campbelli) // Theriogenology. 2015. V. 83. P. 1056–1063.
Brusentsev E.Y., Igonina T.N., Amstislavsky S.Y. Traditional and modern approaches to culture of preimplantation mammalian embryos in vitro // Russ. J. Dev. Biol. 2014. V. 45. P. 53–65. https://doi.org/10.1134/S1062360414020039
Bowman P., McLaren A. Cleavage rate of mouse embryos in vivo and in vitro // J. Embryol. Exp. Morphol. 1970. V. 24. № 1. P. 203–207.
Chen P., Pan Y., Cui Y. et al. Insulin-like growth factor I enhances the developmental competence of yak embryos by modulating aquaporin 3 // Reprod. Domest. Anim. 2017. V. 52. № 5. P. 825–835.
Copp A.J. Interaction between inner cell mass and trophectoderm of the mouse blastocyst. II. The fate of the polar trophectoderm // J. Embryol. Exp. Morphol. 1979. V. 51. P. 109–120.
Desai N., Kattal N., Abdel Hafez F.F., Szeptycki-Lawson J., Goldfarb J. Granulocyte-macrophage colony stimulating factor (GM-CSF) and co-culture can affect post-thaw development and apoptosis in cryopreserved embryos // J. Assist. Reprod. Genet. 2007. V. 24. № 6. P. 215–222.
Desai N., Lawson J., Goldfarb J. Assessment of growth factor effects on post-thaw development of cryopreserved mouse morulae to the blastocyst stage // Hum. Reprod. 2000. V. 15. № 2. P. 410–418.
Handyside A.H., Susan H. Cell division and death in the mouse blastocyst before implantation // Roux. Arch. Dev. Biol. 1986. V. 195. № 8. P. 519–526.
Heyner S., Smith R.M., Schultz G.A. Temporally regulated expression of insulin and insulin-like growth factors and their receptors in early mammalian development // Bioessays. 1989. V. 11. № 6. P. 171–176.
Igonina T.N., Ragaeva D.S., Petrova O.M. et al. Effects of in vitro culture at the preimplantation embryo stage on early development and hypertension in ISIAH rats // Hypertens. Pregnancy. 2019. P. 1–9.
Kawamura K., Chen Y., Shu Y. et al. Promotion of human early embryonic development and blastocyst outgrowth in vitro using autocrine/paracrine growth factors // PLoS One. 2012. V. 7. № 11. e49328.
Khatir H., Anouassi A., Tibary A. In vitro and in vivo developmental competence of dromedary (Camelus dromedarius) embryos produced in vitro using two culture systems (mKSOMaa and oviductal cells) // Reprod. Domest. Anim. 2005. V. 40. № 3. P. 245–249.
Lin T.-C., Yen J.-M., Gong K.-B., Hsu T.-T., Chen L.-R. IGF-1/IGFBP-1 increases blastocyst formation and total blastocyst cell number in mouse embryo culture and facilitates the establishment of a stem-cell line // BMC Cell Biology. 2003. V. 4. P. 14.
Neira J.A., Tainturier D., Pena M.A., Martal J. Effect of the association of IGF-I, IGF-II, bFGF, TGF-beta1, GM‑CSF, and LIF on the development of bovine embryos produced in vitro // Theriogenology. 2010. V. 73. № 5. P. 595–604.
Sirisathien S., Brackett B.G. TUNEL analyses of bovine blastocysts after culture with EGF and IGF-I // Mol. Reprod. Dev. 2003. V. 65. № 1. P. 51–56.
Velazquez M.A., Zaraza J., Oropeza A., Webb R., Niemann H. The role of IGF1 in the in vivo production of bovine embryos from superovulated donors // Reproduction. 2009. V. 137. № 2. P. 161–180.
Дополнительные материалы отсутствуют.