Онтогенез, 2021, T. 52, № 4, стр. 295-304
Вольвокс как модель для изучения гибели клеток и старения
Санкт-Петербургский государственный университет, кафедра эмбриологии
199034 Санкт-Петербург, Университетская набережная, 7/9, Россия
* E-mail: adesnitskiy@mail.ru
** E-mail: a.desnitsky@spbu.ru
Поступила в редакцию 05.11.2020
После доработки 30.12.2020
Принята к публикации 06.01.2021
Аннотация
Сферическая зеленая водоросль вольвокс состоит из нескольких сотен или тысяч соматических клеток, которые претерпевают терминальную дифференцировку, старение и смерть, и небольшого числа гонидий (бесполых репродуктивных клеток), которые дают начало особям следующего поколения. В первой части настоящей статьи кратко рассмотрены онтогенетическое разнообразие рода Volvox, а также механизмы дифференцировки на два упомянутых выше типа клеток, которые были обстоятельно исследованы в последние годы у Volvox carteri. Затем проведен подробный критический анализ литературных и некоторых собственных данных по старению и гибели клеток (в основном у V. carteri и в меньшей степени у V. aureus) и отмечено, что этот аспект биологии развития вольвокса изучен недостаточно. Указаны некоторые перспективы дальнейшего исследования процессов гибели клеток и старения у представителей рода Volvox в сравнительном аспекте.
ВВЕДЕНИЕ
Процессы старения и гибели клеток изучаются в последние годы на разнообразных объектах и модельных системах: многоклеточных животных (Goldsmith, 2015; Brusentsev et al., 2017; Davaapil et al., 2017; Skulachev, Skulachev, 2017; Zhu et al., 2019 и др.), высших растениях (van Doorn, Woltering, 2004; Rogers, 2015; Locato, De Gara, 2018; Woo et al., 2019; Doronina et al., 2020 и др.), одноклеточных организмах, включая протистов (Gordeeva et al., 2004; Franklin et al., 2006; Deponte, 2008; Kasuba et al., 2015; Bidle, 2016; Durand et al., 2016). Среди модельных организмов (систем) для анализа этой проблемы достаточно важное место могли бы занимать одни из самых примитивных многоклеточных (колониальных) организмов – вольвоксовые водоросли, на что в литературе традиционно обращали внимание (см., например: Weismann, 1893, 1904; Golstein et al., 2003; Bhatia-Dey et al., 2016). Тем не менее, первые экспериментальные исследования старения водоросли Volvox (Chlorophyta, Volvocales, Volvocaceae) были опубликованы около 40 лет тому назад (Hagen, Kochert, 1980; Pommerville, Kochert, 1981, 1982), последующие работы по упомянутой теме появлялись лишь эпизодически и не было специальных обобщающих публикаций о гибели клеток и старении у этого типичного представителя фитопланктона стоячих пресных вод. В настоящей статье вначале кратко изложены некоторые современные данные по биологии развития Volvox (важные для понимания основной темы обзора), а затем представлено обсуждение данных литературы и некоторых собственных данных по гибели клеток и старению у вольвокса, что расширит представления об особенностях этих процессов у низших растений.
Говоря о старении и клеточной гибели у вольвокса, как правило, имеют в виду возрастные изменения соматических клеток в ходе развития модельного вида V. carteri. В этой статье впервые в литературе по старению Volvox предпринята попытка применить сравнительный подход и привлечь данные по “немодельному” виду V. aureus. Наконец, хотелось также привлечь внимание к особенностям гибели гонидий (потенциально бессмертных бесполых репродуктивных клеток) при ограничении ресурсов в стареющих культурах у разных видов вольвокса.
ОСНОВНЫЕ ДАННЫЕ О РАЗВИТИИ И ДИФФЕРЕНЦИРОВКЕ КЛЕТОК У VOLVOX
Род Volvox включает более 20 видов (Herron, Nedelcu, 2015; Nozaki et al., 2015, 2019, 2020) и эти зеленые жгутиковые водоросли предоставляют возможность анализировать индивидуальное развитие в системе, состоящей лишь из двух клеточных типов – нескольких сотен или тысяч маленьких соматических клеток и небольшого числа (обычно 8–16) крупных репродуктивных клеток. Несмотря на относительную простоту организации вольвокса (рис. 1), исследователи сталкиваются здесь с целым рядом интересных явлений и процессов: формированием клеточных линий, ростом и дроблением репродуктивных клеток, перестройками онтогенеза в эволюции родственных видов, морфогенезом, половыми феромонами и т.д. Таким образом, вольвокс стал весьма популярным модельным объектом биологии развития – упомянутым выше аспектам онтогенеза этой водоросли посвящен ряд обзорных статей последних лет (Herron, 2016; Matt, Umen, 2016; Desnitskiy, 2018, 2019; Desnitskiy et al., 2018; Umen, 2020 и др.).
Рис. 1.
Молодые бесполые колонии (сфероиды) Volvox carteri f. weismannia незадолго до освобождения из родительского сфероида, соматические клетки которого скоро вступят в фазу старения.

Цикл бесполого развития Volvox, который изучают в условиях клональных аксеничных (содержащих микроорганизмы только одного вида) культур, включает рост гонидий, период их дробления (серия 9–15 синхронных делений у различных видов), инверсию (выворачивание наизнанку) молодых сфероидов, их рост внутри родительской особи, освобождение из родительского сфероида, после чего происходят рост и дробление гонидий следующей генерации. С другой стороны, остающийся сферический “каркас” (hulk), состоящий только из родительской сомы, стареет и умирает. Традиционно различали два основных типа бесполого развития и размножения у Volvox (Starr, 1970; Kochert, 1975; Desnitski, 1992, 1995; Desnitskiy, 2016). Можно говорить также о наличии двух репродуктивных стратегий. У нескольких видов (V. africanus, V. carteri f. kawasakiensis, V. carteri f. nagariensis, V. carteri f. weismannia, V. gigas, V. spermatosphaera), гонидии в результате продолжительного периода свето-зависимого роста до начала дробления достигают крупных размеров и превышают соматические клетки по диаметру по крайней мере в 6–8 раз; во время быстрых последовательных делений (весь период дробления занимает не более 10–12 часов), которые могут происходить в темноте, нет клеточного роста. Напротив, у других видов (например, V. aureus, V. ferrisii, V. globator, V. rousseletii), зрелые гонидии относительно небольшого размера и превышают соматические клетки по диаметру не более, чем в 3–4 раза, поскольку период роста гонидий короткий и клетки зародыша растут в длительных интервалах между делениями дробления, требующего света. Следовательно, в данном случае период дробления растянут по крайней мере на двое или трое суток. Деления начинаются утром первого дня, временно блокируются ночью, возобновляются утром следующего дня, снова останавливаются ночью и т.д. (Desnitskiy, 2017). Филогенетический анализ (Herron et al., 2010) показывает, что такой тип бесполого развития вольвокса (с медленным светозависимым дроблением) является эволюционно продвинутым.
Циклы полового онтогенеза вольвокса включают развитие и дифференцировку сфероидов с мужскими или женскими репродуктивными клетками (вместо бесполых гонидий). Единственной диплоидной стадией в жизненном цикле Volvox является зигота (зигоспора), которая прорастает после периода покоя (Starr, 1975). У большинства представителей рода Volvox выявлены видо-специфичные половые феромоны (Starr, 1970; Kirk, 1998; Hallmann, 2011; Coleman, 2012). В частности, у V. carteri f. nagariensis под влиянием такого феромона, производимого спонтанно образовавшейся мужской особью или соматическими клетками бесполой особи, находящейся в стрессовых условиях (например, тепловой шок или механическая травма), гонидии бесполой особи подвергаются модифицированному паттерну дробления и формируют в следующем поколении половые особи (с яйцеклетками в женском клоне или с андрогонидиями в мужском клоне).
Возвращаясь к краткому описанию бесполого цикла развития перейдем к проблеме дифференцировки на типы репродуктивных и соматических клеток. Прежде всего заметим, что наличие в сфероиде вольвокса соматических клеток – это несомненный признак многоклеточного организма. При этом отличительной особенностью и достоинством данного объекта (по сравнению, например, с многоклеточными животными или высшими растениями) является то, что сома у вольвокса представлена всего лишь одним типом клеток. Согласно филогенетическому анализу (Herron, Michod, 2008) сома возникала три раза в ходе эволюции водорослей порядка Volvocales, причем дважды в пределах полифилетического рода Volvox. Основными функциями двужгутиковых соматических клеток вольвокса являются обеспечение подвижности организма (включая фототаксис), а также синтез гликопротеинового межклеточного матрикса, объединяющего в составе сфероида клетки обоих типов (Matt, Umen, 2018). Предполагали (Koufopanou, Bell, 1993; Koufopanou, 1994; Hoops et al., 2006) возможность передачи от молодых соматических клеток питательных веществ (синтезированных ими либо даже “подхваченных” из окружающей среды) к гонидиям и дробящимся зародышам, хотя до сих пор это окончательно не доказано.
Зародыши V. africanus, V. carteri f. kawasakiensis, V. carteri f. nagariensis, V. carteri f. weismannia, V. obversus, и V. reticuliferus характеризуются асимметричными (неравными) делениями и дифференциацией линий презумптивных репродуктивных и соматических клеток на относительно ранних этапах развития, на 16-клеточной, 32-клеточной либо на несколько более поздних стадиях дробления (Starr, 1969; Karn et al., 1974; Nozaki, 1988; Herron et al., 2010; Desnitskiy, 2016). У зародышей других видов вольвокса асимметричных делений нет и гонидии становятся морфологически отличимыми от соматических клеток только после завершения дробления или даже после инверсии молодого сфероида.
Теперь перейдем к краткому изложению данных по клеточным и молекулярно-генетическим механизмам дифференцировки на сому и гонидии у V. carteri f. nagariensis, единственному представителю рода, подробно изученному в этом отношении (Tam, Kirk, 1991; Kirk, 1998, 2001, 2005; Pappas, Miller, 2009; Matt, Umen, 2016 и др.). Когда зародыш этого вида и формы Volvox достигает 32-клеточной стадии дробления (после пяти симметричных делений), 16 передних клеток делятся асимметично на большие и маленькие клетки, соответственно линии презумптивных гонидиальных и соматических клеток следующей генерации. Напротив, 16 клеток в задней части зародыша претерпевают только симметичные деления и таким образом вносят вклад только в формирование линии маленьких соматических клеток. Асимметричные деления в передних клетках зародыша происходят под контролем генов glsA и Hsp70A, которые кодируют белки шапероны (соответственно glsA и Hsp70A) взаимодействующие с митотическим веретеном и смещающие плоскость клеточного деления (Kirk et al., 1999; Cheng et al., 2005; Pappas, Miller, 2009). Интересно, что имеется несколько работ, показавших вовлечение гена glsA также в мужской гаметогенез (Mori et al., 2003; Igawa et al., 2009) у лилиецветных (Liliales) либо в другие морфогенетические процессы у высших растений (Guzman-Lopez et al., 2016).
В ходе развития зародыша V. carteri f. nagariensis после асимметричного деления дробления продукты гена lag подавляют активность соматических генов в больших клетках, тогда как в маленьких клетках продукты гена regA подавляют активность гонидиальных генов (Kirk, 2001; Matt, Umen, 2016). Следовательно, большие и маленькие клетки зародыша дифференцируются соответственно в большие репродуктивные клетки (бесполые гонидии) и маленькие соматические клетки. Предыдущие экспериментальные исследования (Pall, 1975; Kirk et al., 1993) показали, что все клетки зародыша, достигающие в конце серии делений 8 мкм в диаметре или более, становятся гонидиями (независимо от их положения в сфероиде), а все клетки менее 8 мкм в диаметре дифференцируются как соматические. Заметим, что в ходе нормального развития у V. carteri f. nagariensis формирующиеся гонидии в конце серии делений имеют размер около 13 мкм в диаметре, а молодые соматические клетки – около 2 мкм. Таким образом, важным фактором, определяющим направление дифференцировки клеток молодого сфероида этого вида вольвокса, является их размер. Однако причина прямой связи между размером эмбриональной клетки и определением ее судьбы остается загадочной. Формальная схема процесса дифференциации на гонидии и соматические клетки у V. carteri f. nagariensis представлена на рис. 2.
Рис. 2.
Схематичное изображение процесса дифференцировки на соматические и репродуктивные клетки в ходе бесполого цикла развития у Volvox carteri. Показано, на каких этапах онтогенеза активны гены glsA, hsp70A, regA и lag (по: Kirk, 2001, 2005; Matt, Umen, 2016, с упрощениями).
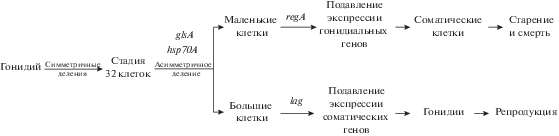
Из всех упомянутых выше генов V. carteri f. nagariensis наиболее подробно изучен ген regA, контролирующий соматическую дифференцировку, препятствующий биогенезу хлоропластов и кодирующий локализующийся в ядре репрессор транскипции (Tam et al., 1991; Choi et al., 1996; Kirk et al., 1999; Stark et al., 2001; Duncan et al., 2007; Grochau-Wright et al., 2017 и др.). В свете этих данных становится понятно, почему содержание хлоропластной ДНК в гонидии перед началом периода дробления превышает содержание хлоропластной ДНК в соматической клетке примерно в 120 раз (Kochert, 1975). Интересно отметить, что в мутантных линиях regA– сначала формируются морфологически нормальные молодые бесполые сфероиды с обоими клеточными типами. Однако затем соматические клетки увеличиваются в размерах, трансдифференцируются в гонидии и претерпевают серию делений дробления. Эта группа мутаций у V. carteri f. nagariensis была впервые описана около 50 лет назад и была тогда названа “somatic regenerator” (Starr, 1970).
Интересно, что Э. Ханшен и соавторы (Hanschen et al., 2014) недавно идентифицировали ген regA также и у нескольких других представителей полифилетического рода Volvox, в том числе у V. ferrisii, вида с маленьким размером зрелых гонидий и без асимметричного деления. Последний общий предок V. carteri f. nagariensis и V. ferrisii не имел соматических клеток (Herron, Michod, 2008) и, таким образом, в двух эволюционных линиях сома возникла независимо. Ген regA, критически важный для соматической дифференцировки у V. carteri f. nagariensis, имеет гомолога у одноклеточной родственной водоросли Chlamydomonas reinhardtii из порядка Volvocales. У C. reinhardtii этот гомологичный ген экспрессируется в стрессовых условиях, когда клеточный рост и размножение подавлены (Nedelcu, Michod, 2006; Nedelcu, 2009a; König, Nedelcu, 2020). С другой стороны, ген lag, важный для дифференцировки гонидий у V. carteri f. nagariensis, еще не был предметом тщательного изучения (в отличие от генов regA, glsA и Hsp70A) и сравнительно недавно было отмечено (Matt, Umen, 2016), что конкретный механизм действия этого гена в дифференцировке на два клеточных типа пока неясен.
СТАРЕНИЕ И ГИБЕЛЬ КЛЕТОК У ВОЛЬВОКСА
Соматические клетки вольвокса являются терминально дифференцированными пост-митотическими клетками, претерпевающими старение и смерть (Starr, 1970; Kochert, 1975; Kirk, 1998; Matt, Umen, 2016 и др.). Они не способны делиться после завершения процессов дробления и инверсии зародыша. Имеющееся в литературе описание деления соматической клетки у V. aureus (Soyer, 1973, Plate 3 , Fig. 2) не заслуживает доверия и представляется чрезвычайно сомнительным. Впрочем, нельзя полностью исключить возможность терминологической путаницы в упомянутой статье, автор которой не указала на каких этапах жизненного цикла вольвокса брала материал для исследования. Клетки дробящегося зародыша (еще не дифференцированного на два клеточных типа) в этой публикации могли бы быть ошибочно названы соматическими.
Первая серия экспериментальных работ по старению соматических клеток у вольвокса была выполнена на частично синхронизированных культурах V. carteri f. nagariensis (Hagen, Kochert, 1980) и V. carteri f. weismannia (Pommerville, Kochert, 1981, 1982) при температуре 28–30°C, свето-темновых режимах 39 ч : 9 ч или 29 ч : 19 ч и пересевах на свежую питательную среду каждые два дня (за эти 48 ч завершался один цикл бесполого развития). У этих форм вольвокса соматические клетки от момента своего формирования до этапов терминальной дифференцировки и старения в большинстве случаев увеличиваются в диаметре от примерно 2 до 5–6 мкм. В упомянутых исследованиях лаборатории Г. Кохерта были показаны существенные различия в паттернах мечения полипептидов (по включению 35S) между молодыми соматическими клетками и гонидиями, а также между молодыми и стареющими соматическими клетками. Эти данные говорили о перспективности использования V. carteri как модельного объекта для изучения процесса старения сомы. Уместно отметить, что ранее в той же лаборатории был разработан метод разделения на два клеточных типа в культурах вольвокса для последующего биохимического анализа (Yates et al., 1975).
Соматические клетки молодых растущих сфероидов (после их освобождения из родительской особи) характеризуются интенсивной работой жгутиков и активно синтезируют внеклеточный гликопротеиновый матрикс. На этом этапе развития белковый синтез в относительно молодых соматических клетках протекает примерно в пять раз интенсивнее, чем в стареющем каркасе родительской сомы, внутри которого уже нет особей молодого поколения и который мало подвижен вследствие резкого ослабления интенсивности работы жгутиков (Hagen, Kochert, 1980; Pommerville, Kochert, 1982). Однако даже на этом завершающем этапе бесполого жизненного цикла соматические клетки сохраняют способность к регенерации жгутиков, которая осуществляется за два часа (дефлагелляцию на обеих стадиях развития производили путем резкого понижения pH от 8.0 до 4.0 в течение 90 с) (Coggin, Kochert, 1986). Сопоставление особенностей соматических клеток на разных этапах цикла бесполого развития показывает, что в процессе старения на фоне уменьшения содержания в клетках белков и уменьшения числа цитоплазматических рибосом, происходит также интенсивная аккумуляция цитоплазматических липидных телец, замедление фотосинтетической активности и затем ее утрата, нарушение структуры хлоропласта, уменьшение содержания хлорофилла, в результате чего зеленая пигментация клеток ослабевает и в конце концов исчезает (Hagen, Kochert, 1980; Pommerville, Kochert, 1981, 1982). Эти возрастные изменения сомы у вольвокса постепенные и кумулятивные; они напоминают процессы, происходящие, например, при старении листьев у высших растений (Guo, Gan, 2005).
К сожалению, четкая хронологическая последовательность развития сомы, а также однозначные определения молодых, зрелых и переходящих к старению соматических клеток отсутствуют в рассмотренных работах лаборатории Кохерта. Тем не менее, было показано, что у V. carteri f. nagariensis соматические клетки начинают стареть и умирают значительно раньше, чем у V. carteri f. weismannia (время жизни соматических клеток после их исходного формирования при развитии сфероида составляет соответственно около 4 и 5–7 сут) (Pommerville, Kochert, 1982). Авторы не объяснили причину таких различий по темпам старения. Как бы то ни было, данные пионерских исследований Кохерта говорили в пользу того, что прохождение соматических клеток вольвокса через этапы старения и смерти является частью генетически контролируемой эндогенной программы развития, а не пассивного процесса некроза. Вместо того, чтобы умирать случайным образом, независимо друг от друга, соматические клетки в пределах одного сфероида гибнут синхронно. Кроме того, потеря жизнеспособности сомы существенно задерживается, когда стареющую колонию вольвокса обрабатывают ингибитором синтеза белка циклогексимидом в концентрации 0.1 мкг/мл; в результате авторы (Pommerville, Kochert, 1982) сделали вывод, что гибель соматических клеток вольвокса является активным процессом. Однако они не указали, что при этом конкретно имели в виду.
Очень интересно, что у обеих форм V. carteri соматические клетки женских сфероидов подвергаются старению гораздо медленнее и умирают на несколько дней позднее, чем соматические клетки бесполых сфероидов (Hagen, Kochert, 1980; Pommerville, Kochert, 1982). Авторы опять никак не объяснили этот результат. Однако мне представляется возможным предложить соответствующий комментарий с учетом специфики цикла полового онтогенеза вольвокса. В данном случае нет освобождения молодых сфероидов из стареющего каркаса родительской сомы. Дело в том, что после того, как содержащиеся в женском сфероиде яйцеклетки будут оплодотворены, образовавшиеся зиготы претерпевают длящийся несколько дней процесс созревания внутри материнского сфероида. Сначала зиготы имеют темно-зеленую окраску (свето-зависимый этап онтогенеза), а затем красную или оранжевую и окружаются тремя оболочками (Starr, 1969; Kirk, 1998). Соматические клетки умирают только после этого. Таким образом, цикл полового развития у всех видов вольвокса длится существенно дольше, чем цикл бесполого развития.
Важно, что если у молодого бесполого сфероида V. carteri f. nagariensis удалить гонидии, то получившийся в таком эксперименте молодой каркас соматических клеток будет развиваться и стареть с такой же скоростью, как и контрольные интактные сфероиды (Hagen, Kochert, 1980). На этом основании было сделано предположение, что развитие репродуктивных клеток не оказывает влияния на процессы терминальной дифференцировки, старения и смерти соматических клеток. Однако эта идея не согласуется с рассмотренными выше данными тех же авторов о замедлении темпов старения соматических клеток в женских сфероидах (содержащих яйцеклетки вместо бесполых гонидий). Было бы очень интересно проверить темпы старения каркаса сомы женского сфероида после экспериментального удаления из него яйцеклеток. Данные об отсутствии влияния яйцеклеток на процесс старения соматических клеток женской особи вольвокса дали бы основания предполагать наличие разных программ старения и смерти у сомы из бесполых и женских сфероидов. Кроме того, была высказана идея (Kirk, 1998) допускавшая принципиальную возможность, что на темпы старения сомы V. carteri мог бы оказывать влияние уже упомянутый выше половой феромон, который, таким образом, контролировал бы процессы онтогенеза не только у репродуктивных клеток, но также и у соматических.
В связи с рассмотренными выше данными по замедленным темпам старения соматических клеток женских сфероидов V. carteri представляется обоснованным упомянуть об особенностях старения сфероидов у нескольких линий V. aureus. Дело в том, что этот вид представлен не только линиями, для которых характерно половое размножение и формирование зигот (Darden, 1966; Starr, Zeikus, 1993), но также и линиями, в которых мужские сфероиды отсутствуют или встречаются чрезвычайно редко (Darden, 1968; Starr, Zeikus, 1993; Desnitski, 2000). В культурах таких линий многие гонидии без оплодотворения постепенно трансформируются в предположительно гаплоидные партеноспоры (цитологический или генетический анализ не производили), хотя они имеют такой же внешний вид, как зрелые диплоидные зиготы, и также являются резистентной покоящейся стадией. Сфероиды V. aureus, содержащие партеноспоры, живут на несколько дней дольше, чем сфероиды с гонидиями (Desnitskiy, 2009). Таким образом, партеноспоровые линии этого вида вольвокса могли бы быть использованы для анализа особенностей старения их соматических клеток.
К сожалению, подробно рассмотренные выше исследования лаборатории Кохерта по старению соматических клеток у V. carteri не были им продолжены. Перейдем к данным других авторов, хотя изучение старения и смерти не всегда было основной темой их публикаций. В обстоятельном микроспектрофлуорометрическом исследовании (окраска DAPI) лаборатории А. Коулман (Coleman, Maguire, 1982) было показано, что у V. aureus и V. carteri f. nagariensis содержание ядерной ДНК в соматических клетках в ходе бесполого цикла развития остается постоянным от момента завершения дробления зародыша до самой смерти. У обоих видов вольвокса содержание хлоропластной ДНК в соматических клетках также существенно не изменяется в ходе дифференцировки и старения (в контрасте с резким увеличением содержания хлоропластной ДНК в растущих гонидиях).
В молекулярно-генетических исследованиях лаборатории Д. Керка были идентифицированы 12 транскриптов, специфичных для соматических клеток и 19 транскриптов, специфичных для гонидий V. carteri f. nagariensis (Tam, Kirk, 1991; Tam et al., 1991). Эти 12 соматических транскриптов разделяются на две категории: 5 “ранних”, которые активно аккумулируются, начиная с момента формирования соматических клеток непосредственно после дробления зародыша, и 7 “поздних”, которые не могут быть обнаружены до выхода молодых сфероидов из старой родительской особи. Однако авторы (Tam et al., 1991) сомневались, что “поздние соматические гены” играют решающую роль в старении сомы, поскольку период, в течение которого была максимальная аккумуляция поздних транскриптов, предшествует фазе старения. Интересно, что один из этих поздних соматических генов (ген LSG2) кодирует гликопротеиновый литический фермент, который аккумулируется в межклеточном гликопротеиновом матриксе развивающегося сфероида. Затем этот фермент принимает участие в деградации (частичном переваривании) матрикса, что позволит освободиться сфероидам нового поколения (Nishimura et al., 2017). Таким образом, экспрессия гена LSG2 косвенно подготавливает основу для последующего старения каркаса соматических клеток.
Тем не менее, имеются публикации (Shimizu et al., 2001, 2002), показавшие более важную роль некоторых других поздних соматических генов у V. carteri f. nagariensis в процессе старения сомы. Так, например, был клонирован и изучен ген, кодирующий связанную со старением РНКазу. Соответствующая иРНК аккумулируется непосредственно в фазе старения соматических клеток, тогда как содержание тотальной клеточной РНК многократно уменьшается в ходе этого процесса. Очевидно, что такие результаты не согласуются с представлениями Керка и соавторов (Tam, Kirk, 1991; Tam et al., 1991) о роли поздних соматических генов в старении и смерти сомы.
Наконец, заслуживают упоминания данные о метакаспазах типа I и типа II у V. carteri f. nagariensis (Nedelcu, 2009b), протеолитических ферментах, играющих ключевую роль в процессе программированной клеточной смерти (ПКС) у низших эукариотов (Bidle, 2016; Durand et al., 2016).
Итак, после рассмотрения литературы по процессу старения и последующей гибели соматических клеток у вольвокса становится видно, что этот вопрос (несмотря на его актуальность) к настоящему времени изучен явно недостаточно. В литературе по онтогенезу вольвокса неоднократно отмечали, что его соматические клетки претерпевают ПКС (например, Hagen, Kochert, 1980; Kirk et al., 1987; Kirk, 1998). Однако авторы одного из последних обзоров по биологии развития этой зеленой водоросли указали, что они воздерживаются от использования термина ПКС, “поскольку он подразумевает стереотипный набор событий, определяемых процессом апоптоза в клетках животных, которые не были исследованы у Volvox” (Matt, Umen, 2016, p. 109).
Перейдем к проблеме, которая обычно не привлекает внимание исследователей: особенностям гибели гонидий у вольвокса. Более ста лет тому назад А. Вейсман (Weismann, 1904, p. 261) заметил, что гонидии (бесполые репродуктивные клетки, дающие начало новому поколению сфероидов вольвокса) являются потенциально бессмертными. Однако нельзя забывать, что при ограничении ресурсов (как в природных условиях, так и в условиях стареющих лабораторных культур) гонидии могут гибнуть, не давая потомства.
В связи со сказанным представляет интерес статья, содержащая некоторую информацию о бесполых репродуктивных клетках в переполненной стареющей культуре V. carteri f. nagariensis (Gilles, Jaenicke, 1982). В то время как в активно растущей культуре (с плотностью около 10 сфероидов на мл) сфероиды содержали обычно по 12–16 гонидий, в стареющей культуре (с плотностью более 1000 сфероидов на мл) большинство сфероидов содержали по 8–12 гонидий. Мои многолетние наблюдения над культурами этого же вида и формы Volvox согласуются с данными цитированной выше работы в отношении числа гонидий у бесполых сфероидов из молодых и старых культур. Более того, поддерживая в течение ряда лет культуры вольвокса, я наблюдал, что в стареющих культурах V. carteri f. nagariensis (через 2–3 нед. после пересева на свежую питательную среду) гонидии перестают вступать в период дробления, затем постепенно обесцвечиваются и в конце концов гибнут, разделяя судьбу соматических клеток (замечу, что музейные культуры вольвокса обычно поддерживают путем регулярных пересевов дважды в месяц).
В активно растущих (молодых) культурах V. aureus бесполые сфероиды содержат по 3–15 гонидий (чаще 8–12) (Darden, 1966; Shelton et al., 2012 и др.). С другой стороны, мои многолетние наблюдения показали, что в старых культурах V. aureus (примерно через 3–4 нед. после пересева на свежую среду) формируются миниатюрные бесполые сфероиды, содержащие лишь 1–3 гонидия. Таким образом, в данном случае нет прекращения процесса бесполого размножения, имеющего место в старых культурах V. carteri f. nagariensis. Однако эти старые культуры V. aureus не являются переполненными, что дает основания полагать гибель значительной части популяции на фоне формирования относительно небольшого количества миниатюрных особей, способных впоследствии дать нормальное потомство после пересева на свежую среду. В связи со сказанным уместно вспомнить о публикациях, развивающих концепцию “альтруистической” клеточной гибели у некоторых одноклеточных протистов в стрессовых ситуациях (Durand et al., 2011, 2014; Nedelcu et al., 2011), когда часть популяции гибнет, поддерживая выживание и размножение остальных особей. Однако в настоящий момент трудно оценить, насколько мои упомянутые выше предварительные и неопубликованные данные на стареющих культурах V. aureus укладываются в рамки концепции альтруистической клеточной гибели. В будущем было бы интересно изучить этот вопрос подробнее.
Как бы то ни было, V. aureus и V. carteri f. nagariensis, характеризуются не только разными репродуктивными стратегиями в оптимальных условиях культивирования (как указано выше в разделе о развитии и дифференцировке клеток у этих водорослей), но также и разными стратегиями выживания при ограничении ресурсов в стареющих культурах. У V. carteri f. nagariensis дробление гонидий в таких культурах блокируется, но в течение относительно короткого времени (несколько дней) все репродуктивные клетки сохраняют способность начать новую серию делений (если условия улучшатся). У V. aureus способность к формированию новых колоний сохраняется в неблагоприятных условиях гораздо дольше (более месяца), но бесполое размножение происходит только у относительно небольшого числа особей. Это согласуется с моими исследованиями по экологии вольвокса (Desnitskiy, 2016, 2017, 2020), которые показывают, что V. aureus, единственный космополитный и наиболее часто встречающийся в природе представитель данного рода водорослей, лучше других видов адаптирован к жизни в суб-оптимальных и суб-экстремальных условиях.
ЗАКЛЮЧЕНИЕ
Вольвокс стал перспективным модельным объектом, который успешно используют для изучения процессов дифференцировки и морфогенеза в относительно простой системе, состоящей лишь из двух типов клеток. Однако настоящий обзор сведений о старении и гибели клеток у этой зеленой водоросли показывает, что данная тема к настоящему времени разработана весьма слабо и желательны дальнейшие исследования. Прежде всего было бы важно четко определить и подробно охарактеризовать разные этапы старения сомы как в ходе бесполого цикла развития, так и в онтогенезе колоний, формирующих резистентные покоящиеся стадии (зиготы или партеноспоры). Заслуживает внимания также и более подробный анализ процесса старения лабораторных культур вольвокса и гибели гонидий, происходящей при ограничении питательных ресурсов.
Род Volvox характеризуется значительным разнообразием особенностей циклов развития. Поэтому в будущем для экспериментального анализа процессов старения и гибели клеток было бы оптимальным применить сравнительный подход и использовать не только V. carteri (наиболее изученный вид), но также и другие виды (прежде всего V. aureus).
Список литературы
Bhatia-Dey N., Kanherkar R.R., Stair S.E. et al. Cellular senescence as the causal nexus of aging // Front. Genet. 2016. V. 7:13. https://doi.org/10.3389/fgene.2016.00013
Bidle K.D. Programmed cell death in unicellular phytoplankton // Curr. Biol. 2016. V. 26. № 13. P. R594–R607.
Brusentsev E.Y., Tikhonova M.A., Herbeck Y.E. et al. Developmental aspects of senescence // Russ. J. Dev. Biol. 2017. V. 48. № 2. P. 93–105.
Cheng Q., Pappas V., Hallmann A. et al. Hsp70A and GlsA interact as partner chaperones to regulate asymmetric division in Volvox // Dev. Biol. 2005. V. 286. № 2. P. 537–548.
Choi G., Przybylska M., Straus D. Three abundant germ line-specific transcripts in Volvox carteri encode photosynthetic proteins // Curr. Genet. 1996. V. 30. № 4. P. 347–355.
Coggin S.J., Kochert G. Flagellar development and regeneration in Volvox carteri (Chlorophyta) // J. Phycol. 1986. V. 22. № 3. P. 370–381.
Coleman A.W. A comparative analysis of the Volvocaceae (Chlorophyta) // J. Phycol. 2012. V. 48. № 3. P. 491–513.
Coleman A.W., Maguire M.J. A microspectrofluorometric analysis of nuclear and chloroplast DNA in Volvox // Dev. Biol. 1982. V. 94. № 2. P. 441–450.
Darden W.H. Sexual differentiation in Volvox aureus // J. Protozool. 1966. V. 13 № 2. P. 239–255.
Darden W.H. Production of male-inducing hormone by a parthenosporic Volvox aureus // J. Protozool. 1968. V. 15. № 3. P. 412–414.
Davaapil H., Brockes J.P., Yun M.H. Conserved and novel functions of programmed cellular senescence during vertebrate development // Development. 2017. V. 144. № 1. P. 106–114.
Deponte M. Programmed cell death in protists // Biochim. Biophys. Acta. 2008. V. 1783. № 7. P. 1396–1405.
Desnitski A.G. Cellular mechanisms of the evolution of ontogenesis in Volvox // Arch. Protistenkd. 1992. V. 141. № 3. P. 171–178.
Desnitski A.G. A review on the evolution of development in Volvox – morphological and physiological aspects // Europ. J. Protistol. 1995. V. 31. № 3. P. 241–247.
Desnitski A.G. Development and reproduction of two species of the genus Volvox in a shallow temporary pool // Protistology. 2000. V. 1. № 4. P. 195–198.
Desnitskiy A.G. Volvox (Chlorophyta, Volvocales) as a model organism in developmental biology // Russ. J. Dev. Biol. 2009. V. 40. № 4. P. 238–241.
Desnitskiy A.G. Major ontogenetic transitions during Volvox (Chlorophyta) evolution: when and where might they have occurred? // Dev. Genes Evol. 2016. V. 226. № 5. P. 349–354.
Desnitskiy A.G. On ecological aspects of the evolutionary reorganizations of Volvox ontogeny // Int. J. Plant Reprod. Biol. 2017. V. 9. № 2. P. 183–186.
Desnitskiy A.G. Comparative analysis of embryonic inversion in algae of the genus Volvox (Volvocales, Chlorophyta) // Russ. J. Dev. Biol. 2018. V. 49. № 3. P. 129–133.
Desnitskiy A.G. Advances in the research of sexual reproduction in colonial volvocine algae // Russ. J. Dev. Biol. 2019. V. 50. № 5. P. 225–229.
Desnitskiy A.G. Algae of the genus Volvox (Chlorophyta) in sub-extreme habitats // Int. J. Plant Reprod. Biol. 2020. V. 12. № 2. P. 156–158.
Desnitskiy A.G., Sym S., Durand P.M. On the contribution of Mary Agard Pocock to developmental biology research of the genus Volvox L. // Trans. Roy. Soc. South Afr. 2018. V. 73. № 3. P. 277–282.
Doronina T.V., Sheval E.V., Lazareva E.M. Programmed cell death during the formation of embryo sac and seed // Russ. J. Dev. Biol. 2020. V. 51. № 3. P. 135–147.
Duncan L., Nishii I., Harryman A. et al. The VARL gene family and the evolutionary origins of the master cell-type regulatory gene, regA, in Volvox carteri // J. Mol. Evol. 2007. V. 65. № 1. P. 1–11.
Durand P.M., Rashidi A., Michod R.E. How an organism dies affects the fitness of its neighbors // Am. Nat. 2011. V. 177. № 2. P. 224–232.
Durand P.M., Choudhury R., Rashidi A. et al. Programmed death in a unicellular organism has species-specific fitness effects // Biol. Lett. 2014. V. 10. № 2. https://doi.org/10.1098/rsbl.2013.1088
Durand P.M., Sym S., Michod R.E. Programmed cell death and complexity in microbial systems // Curr. Biol. 2016. V. 26. № 13. P. R587–R593.
Franklin D.J., Brussaard C.P.D., Berges J.A. What is the role and nature of programmed cell death in phytoplankton ecology? // Eur. J. Phycol. 2006. V. 41. № 1. P. 1–14.
Gilles R., Jaenicke L. Differentiation in Volvox carteri: study of pattern variation of reproductive cells // Zeitschr. Naturforsch. 1982. V. 37. № 10. P. 1023–1030.
Goldsmith T.C. Is the evolutionary programmed/non-programmed aging argument moot? // Curr. Aging Sci. 2015. V. 8. № 1. P. 41–45.
Golstein P., Aubry L., Levraud J.-P. Cell-death alternative model organisms: why and which? // Nat. Rev. Mol. Cell Biol. 2003. V. 4. № 10. P. 798–807.
Gordeeva A.V., Labas Y.A., Zvyagilskaya R.A. Apoptosis in unicellular organisms: mechanisms and evolution // Biochemistry (Moscow). 2004. V. 69. № 10. P. 1055–1066.
Grochau-Wright Z.I., Hanschen E.R., Ferris P.J. et al. Genetic basis for soma is present in undifferentiated volvocine green algae // J. Evol. Biol. 2017. V. 30. № 6. P. 1205–1218.
Guo Y. Gan S. Leaf senescence: signals, execution, and regulation // Curr. Top. Dev. Biol. 2005. V. 71. P. 83–112.
Guzman-Lopez J.A., Abraham-Juarez M.J., Lozano-Sotomayor P. et al. Arabidopsis thaliana gonidialess A/Zuotin related factors (GlsA/ZRF) are essential for maintenance of meristem integrity // Plant Mol. Biol. 2016. V. 91. № 1–2. P. 37–51.
Hagen G., Kochert G. Protein synthesis in a new system for the study of senescence // Exp. Cell Res. 1980. V. 127. № 2. P. 451–457.
Hallmann A. Evolution of reproductive development in the volvocine algae // Sex. Plant Reprod. 2011. V. 24. № 2. P. 97–112.
Hanschen E.R., Ferris P.J., Michod R.E. Early evolution of the genetic basis for soma in the Volvocaceae // Evolution. 2014. V. 68. № 7. P. 2014–2025.
Herron M.D. Origins of multicellular complexity: Volvox and the volvocine algae // Mol. Ecol. 2016. V. 25. № 6. P. 1213–1223.
Herron M.D., Michod R.E. Evolution of complexity in the volvocine algae: transitions in individuality through Darwin’s eye // Evolution. 2008. V. 62. № 2. P. 436–451.
Herron M.D., Desnitskiy A.G., Michod R.E. Evolution of developmental programs in Volvox (Chlorophyta) // J. Phycol. 2010. V. 46. № 2. P. 316–324.
Herron M.D., Nedelcu A.M. Volvocine algae: from simple to complex multicellularity // Evolutionary Transitions to Multicellular Life / Eds. Ruiz-Trillo I., Nedelcu A.M. Dordrecht (the Netherlands): Springer, 2015. P. 129–152.
Hoops H.J., Nishii I., Kirk D.L. Cytoplasmic bridges in Volvox and its relatives // Cell–Cell Channels / Eds. Baluska F., Volkmann D., Barlow P. Georgetown (Texas): Landes Bioscience, 2006. P. 65–84.
Igawa T., Hoshino Y., Yanagawa Y. Isolation and characterization of the plant glsA promoter from Alstroemeria // Plant Biol. 2009. V. 11. № 6. P. 878–885.
Karn R.C., Starr R.C., Hudock G.A. Sexual and asexual differentiation in Volvox obversus (Shaw) Printz, strains WD3 and WD7 // Arch. Protistenkd. 1974. V. 116. № 1–2. P. 142–148.
Kasuba K.C., Vavilala S.L., D’Souza J.S. Apoptosis-like cell death in unicellular photosynthetic organisms – a review // Algal Res. 2015. V. 12. P. 126–133.
Kirk D.L. Volvox: Molecular-Genetic Origins of Multicellularity and Cellular Differentiation. N.Y.: Cambridge Univ. Press, 1998. 381 p.
Kirk D.L. Germ-soma differentiation in Volvox // Dev. Biol. 2001. V. 238. № 2. P. 213–223.
Kirk D.L. A twelve-step program for evolving multicellularity and a division of labor // BioEssays. 2005. V. 27. № 3. P. 299–310.
Kirk D.L., Baran G.J., Harper J.F. et al. Stage-specific hypermutability of the regA locus of Volvox, a gene regulating the germ-soma dichotomy // Cell. 1987. V. 48. № 1. P. 11–24.
Kirk M.M., Ransick A., McRae S.E. et al. The relationship between cell size and cell fate in Volvox carteri // J. Cell Biol. 1993. V. 123. № 1. P. 191–208.
Kirk M.M., Stark K., Miller S.M. et al. regA, a Volvox gene that plays a central role in germ-soma differentiation, encodes a novel regulatory protein // Development. 1999. V. 126. № 4. P. 639–647.
Kochert G. Developmental mechanisms in Volvox reproduction // The developmental biology of reproduction / Eds. Markert C.L., Papaconstantinou J. N.Y., San Francisco, London: Acad. Press, 1975. P. 55–90.
Koufopanou V. The evolution of soma in the Volvocales // Amer. Nat. 1994. V. 143. № 5. P. 907–931.
Koufopanou V., Bell G. Soma and germ: an experimental approach using Volvox // Proc. Roy. Soc. London. Ser. B. 1993. V. 254. № 1340. P. 107–113.
König S.G., Nedelcu A.M. The genetic basis for the evolution of soma: mechanistic evidence for the co-option of a stress-induced gene into a developmental master regulator // Proc. Roy. Soc. Ser. B. 2020. V. 287: 20201414. https://doi.org/10.1098/rspb.2020.1414
Locato V., De Gara L. Programmed cell death in plants: an overview // Methods Mol. Biol. 2018. V. 1743. P. 1–8. https://doi.org/10.1007/978-1-4939-7668-3_1
Matt G., Umen J. Volvox: A simple algal model for embryogenesis, morphogenesis and cellular differentiation // Dev. Biol. 2016. V. 419. № 1. P. 99–113.
Matt G.Y., Umen J.G. Cell-type transcriptomes of the multicellular green alga Volvox carteri yield insights into the evolutionary origins of germ and somatic differentiation programs // G3 (Bethesda) // 2018. V. 8. № 2. P. 531–550.
Mori T., Kuroiwa H., Higashiyama T. et al. Identification of higher plant GlsA, a putative morphogenesis factor of gametic cells // Biochem. Biophys. Res. Commun. 2003. V. 306. № 2. P. 564–569.
Nedelcu A.M. Environmentally induced responses co-opted for reproductive altruism // Biol. Lett. 2009a. V. 5. № 6. P. 805–808.
Nedelcu A.M. Comparative genomics of phylogenetically diverse unicellular eukaryotes provide new insights into the genetic basis for the evolution of the programmed cell death machinery // J. Mol. Evol. 2009b. V. 68. № 3. P. 256–268.
Nedelcu A.M., Michod R.E. The evolutionary origin of an altruistic gene // Mol. Biol. Evol. 2006. V. 23. № 8. P. 1460–1464.
Nedelcu A.M., Driscoll W.W., Durand P.M. et al. On the paradigm of altruistic suicide in the unicellular world // Evolution. 2011. V. 65. № 1. P. 3–20.
Nishimura M., Nagashio R., Sato Y. et al. Late somatic gene 2 disrupts parental spheroids cooperatively with Volvox hatching enzyme A in Volvox // Planta. 2017. V. 245. № 1. P. 183–192.
Nozaki H. Morphology, sexual reproduction and taxonomy of Volvox carteri f. kawasakiensis f. nov. (Chlorophyta) from Japan // Phycologia. 1988. V. 27. № 2. P. 209–220.
Nozaki H., Matsuzaki R., Yamamoto K. et al. Delineating a new heterothallic species of Volvox (Volvocaceae, Chlorophyceae) using new strains of “Volvox africanus” // PLoS One. 2015. V. 10(11): e0142632. https://doi.org/10.1371/journal.pone.0142632
Nozaki H., Takusagawa M., Matsuzaki R. et al. Morphology, reproduction and taxonomy of Volvox dissipatrix (Chlorophyceae) from Thailand, with a description of Volvox zeikusii sp. nov. // Phycologia. 2019. V. 58. № 2. P. 192–199.
Nozaki H., Mahakham W., Heman W. et al. A new preferentially outcrossing monoicous species of Volvox sect. Volvox (Chlorophyta) from Thailand // PLoS One. 2020. V. 15(7): e0235622. https://doi.org/10.1371/journal.pone.0235622
Pall M.L. Mutants of Volvox showing premature cessation of division: evidence for a relationship between cell size and reproductive cell differentiation // Developmental Biology: Pattern Formation, Gene Regulation / Eds. McMahon D., Fox C.F. Menlo Park (California): W.A. Benjamin, Inc., 1975. P. 148–156.
Pappas V., Miller S.M. Functional analysis of the Volvox carteri asymmetric division protein GlsA // Mech. Dev. 2009. V. 126. № 10. P. 842–851.
Pommerville J.C., Kochert G. Changes in somatic cell structure during senescence of Volvox carteri // Europ. J. Cell Biol. 1981. V. 24. № 2. P. 236–243.
Pommerville J.C., Kochert G. Effects of senescence on somatic cell physiology in the green alga Volvox carteri // Exp. Cell Res. 1982. V. 140. № 1. P. 39–45.
Rogers H.J. Senescence-associated programmed cell death // Plant Programmed Cell Death / Eds. Gunawardena A.N., McCabe P.F. Cham (Switzerland): Springer, 2015. P. 203–233.
Shelton D.E., Desnitskiy A.G., Michod R.E. Distribution of reproductive and somatic cell numbers in diverse Volvox (Chlorophyta) species // Evol. Ecol. Res. 2012. V. 14. № 6. P. 707–721.
Shimizu T., Inoue T., Shiraishi H. A senescence-associated S-like RNase in the multicellular green alga Volvox carteri // Gene. 2001. V. 274. № 1–2. P. 227–235.
Shimizu T., Inoue T., Shiraishi H. Cloning and characterization of novel extensin-like cDNAs that are expressed during late somatic cell phase in the green alga Volvox carteri // Gene. 2002. V. 284. № 1–2. P. 179–187.
Skulachev M.V., Skulachev V.P. Programmed aging of mammals: proof of concept and prospects of a biochemical approach for antiaging therapy // Biochemistry (Moscow). 2017. V. 82. № 12. P. 1403–1422.
Soyer M.-O. Complément á l'étude ultrastructural des Volvocales. Étude des colonies femelles de Volvox aureus E. // Ann. Sci. Natur. Zool. (Ser. 12). 1973. V. 15. № 2. P. 231–258.
Stark K., Kirk D.L., Schmitt R. Two enhancers and one silencer located in the introns of regA control somatic cell differentiation in Volvox carteri // Genes Dev. 2001. V. 15. № 11. P. 1449–1460.
Starr R.C. Structure, reproduction and differentiation in Volvox carteri f. nagariensis Iyengar, strains HK9 and 10 // Arch. Protistenkd. 1969. V. 111. № 3–4. P. 204–222.
Starr R.C. Control of differentiation in Volvox // Dev. Biol. 1970. Suppl. 4. P. 59–100.
Starr R.C. Meiosis in Volvox carteri f. nagariensis // Arch. Protistenkd. 1975. V. 117. № 1–2. P. 187–191.
Starr R.C., Zeikus J.A. UTEX – the culture collection of algae at the University of Texas at Austin. 1993 list of cultures // J. Phycol. 1993. V. 29. Suppl. to № 2. P. 1–106.
Tam L.-W., Kirk D.L. Identification of cell-type-specific genes of Volvox carteri and characterization of their expression during the asexual life cycle // Dev. Biol. 1991. V. 145. № 1. P. 51–66.
Tam L.-W., Stamer K.A., Kirk D.L. Early and late gene expression programs in developing somatic cells of Volvox carteri // Dev. Biol. 1991. V. 145. № 1. P. 67–76.
Umen J.G. Volvox and volvocine green algae // EvoDevo. 2020. V. 11:13. https://doi.org/10.1186/s13227-020-00158-7
van Doorn W.G., Woltering E.J. Senescence and programmed cell death: substance or semantics? // J. Exp. Bot. 2004. V. 55. № 406. P. 2147–2153.
Weismann A. The Germ-Plasm. A Theory of Heredity. N.Y.: Charles Scribner’s Sons, 1893. 477 p.
Weismann A. The Evolution Theory. Volume 1. London: Edward Arnold, 1904. 416 p.
Woo H.R., Kim H.J., Lim P.O. et al. Leaf senescence: systems and dynamics aspects // Ann. Rev. Plant Biol. 2019. V. 70. P. 347–376.
Yates I., Darley M., Kochert G. Separation of cell types in synchronized cultures of Volvox carteri // Cytobios. 1975. V. 12. № 47–48. P. 211–223.
Zhu Y., Liu X., Ding X. et al. Telomere and its role in the aging pathways: telomere shortening, cell senescence and mitochondria dysfunction // Biogerontology. 2019. V. 20. № 1. P. 1–16.
Дополнительные материалы отсутствуют.


