Онтогенез, 2021, T. 52, № 5, стр. 317-328
Морфометрическое исследование пространственно-временной динамики деформаций эмбриональной ткани в ходе гаструляции Xenopus laevis
Д. В. Бредов a, b, *, И. В. Володяев a, Н. Н. Лучинская a
a Кафедра эмбриологии, биологический факультет, Московский государственный, университет
им. М.В. Ломоносова
119934 Москва, ул. Ленинские Горы, 1, стр. 12, Россия
b Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: d2707bredov@yandex.ru
Поступила в редакцию 15.05.2021
После доработки 26.05.2021
Принята к публикации 27.05.2021
Аннотация
В основе изменения формы эмбриона лежат как локальные, так и глобальные деформации тканей. Согласно законам классической механики, источником деформации может являться только механическая сила. Локализовать механические силы и качественно оценить их величину можно на основе динамики деформаций тканей эмбриона, обусловленных этими силами. Один из основных источников таких деформаций – различия скорости и направления движений соседних клеток. Мы детально описали движение клеток в эпиктодерме супрабластопоральной области (СБО) средней гаструлы Xenopus laevis. Была выявлена пространственная неоднородность движения клеток СБО; вдоль медиолатеральной оси эмбриона обнаружены регионы, различающиеся по средней скорости движения клеток. В частности, наибольшая скорость и сонаправленность движений клеток чаще всего наблюдались в медиальной зоне СБО. Анализ формы клеток показал, что именно в медиальном регионе СБО, который первым вовлекается в инволюцию, происходят наиболее активные перегруппировки клеток, связанные с формированием розеток. Мы предполагаем, что такие перегруппировки позволяет компенсировать растяжение материала медиальной зоны СБО в ходе инволюции.
ВВЕДЕНИЕ
Процессы морфогенеза в эмбриональном развитии сопровождаются значительными деформациями тканей. Источником деформации биологических тканей является механическая сила (Murray, 2003; Davidson, 2011), поэтому для детального изучения механизмов морфогенеза необходимо локализовать силы, приводящие к наблюдаемым в морфогенезе деформациям, и выявить механизмы их возникновения.
Наиболее ранней методикой локализации механических сил является анализ скорости и амплитуды расхождения краев ткани в области локального надреза (т.е. деформации ткани после релаксации существующего напряжения). Если величина деформации пропорциональна действующей в этой области силе, возможно качественное описание распределения сил в эмбриональных тканях. Такое описание можно осуществить, сравнив величину деформации после надреза в различных участках эмбриона на разных стадиях развития. Исследования с применением этого метода показали, что в эмбрионе механическая сила имеет неоднородное пространственное распределение (называемое также паттерном), качественно изменяющееся в ходе развития (Beloussov et al., 1975). Экспериментальная релаксация этих напряжений или их имитация в эктопических участках оказывает влияние на ход морфогенетических процессов в эмбрионе или эксплантатах эмбриональной ткани (Beloussov et al., 1990, 2000; Chien et al., 2015).
Метод надрезов сохранил актуальность для задач, требующих качественной оценки механических сил в тканях (Ma et al., 2009; Campinho et al., 2013; Hara et al., 2013). В настоящее время для регистрации и исследования механических сил в биологических тканях стал доступен широкий спектр методик. Одними из наиболее распространенных являются методики, основанные на применении FRET-зондов. Это флуоресцентные микрозонды, которые позволяют оценить субклеточные деформации по падению интенсивности флуоресценции, вызванном расхождением двух связанных молекул флуорофора (Gayrard, Borghi, 2016; Eroshkin et al., 2018). Флуорофоры в составе такого зонда связаны между собой молекулой с известной жесткостью, что позволяет по зарегистрированной деформации зонда рассчитать подействовавшую на него силу. Количественную оценку механических сил также позволяют произвести эластичные или эмульсионные зонды. Зная механические свойства материала, из которого изготовлен такой зонд, можно по деформации зонда вычислить силу, которая к ней привела (Campàs et al., 2014; Mohagheghian et al., 2018).
Качественно иной подход был предложен Streichan с соавторами, картировавшими механические напряжения в тканях гаструлы Drosophila melanogaster на основании пространственной анизотропии распределения миозина (Streichan et al., 2018). Так как актомиозиновый комплекс является основным источником механической силы в ходе движений и перегруппировок клеток, неоднородность его распределения определяет пространственный паттерн механических напряжений в ткани. Измерив концентрацию миозина в различных регионах эмбриона, авторы обнаружили, что его пространственное распределение описывается тремя характерными паттернами, сменяющими друг друга в ходе гаструляции. На основе этих измерений исследователи смоделировали карту механических напряжений, для каждого из трех пространственных паттернов миозина (Streichan et al., 2018). Таким образом, данная работа косвенно показывает, что на каждой стадии развития D. melanogaster формируется специфический паттерн механических напряжений. Этот результат принципиально схож с результатом работы группы Белоусова, картировавшей механические напряжения методом надрезов (Beloussov et al., 1975). Картирование механических напряжений, произведенное Streichan с соавторами (Streichan et al., 2018), несет не только описательную функцию. На основании этого картирования авторы рассчитали движения клеток поверхностного слоя, которые должны возникнуть под действием смоделированных механических напряжений. Предсказанные таким методом движения клеток совпали с реально зарегистрированными. Они, как и пространственное распределение миозина, характеризуются тремя хронологически последовательными паттернами (Streichan et al., 2018). Паттерн движений клеток представляет собой векторное поле – совокупность векторов, каждый из которых описывает ток материала через выбранную точку исследуемой области эмбриона (Zamir et al., 2008; Tambe et al., 2011; Brunet et al., 2013). Таким образом, стадиеспецифические паттерны механических напряжений с большой вероятностью позволяют предсказать морфогенетические движения в нормальном развитии.
Однако, если продолжительность гаструляции превышает характерное время клеточных перегруппировок, то последние должны привести к изменению существующего паттерна механических сил (Mongera et al., 2018). Для решения подобной задачи необходимо связать данные о клеточных движениях с изменением локализации и/или величины механических сил в определенный период развития.
Количественный подход к описанию движений клеток называется кинематическим. Данный подход основан на регистрации координат клеток и последующем расчете производных от них величин (скоростей смещения, ориентации смещений и др.). (Davidson, 2011). В этом случае, под “координатами клетки” обычно понимают координаты геометрического центра клетки или ее ядра (Diz-Muñoz et al., 2010; Heller et al., 2016). Кинематическое описание позволяет оценить такие параметры, как пространственное распределение и временная динамика скоростей клеточных смещений, их ориентация, динамика смены соседей. Эти параметры позволяют установить, насколько активно перемешиваются клетки внутри ткани и, следовательно, насколько выраженно релаксируются в ней напряжения. В силу неинвазивности, кинематический подход позволяет успешно исследовать развитие in vivo (Blanchard et al., 2009; Bi et al., 2016; Mongera et al., 2018; Schaumann et al., 2018).
Однако статистический анализ только координат центров клеток не позволяет связать изменение формы клеток с перемещением центров клеток. Для более содержательного описания деформации в ткани нужно учесть изменения формы самой клетки. Это позволит качественнее оценить пространственное распределение механических сил в ткани в ходе морфогенетических движений.
Данный подход было бы особенно интересно применить к модельным системам, в которых механические силы уже были картированы иными методами. Одной из наиболее подходящих под данную задачу модельных систем является гаструла X. laevis. Для гаструлы X. laevis были картированы механические силы и описана общая картина клеточных движений (Keller, 1978).
Движения клеток начинаются на стадии поздней бластулы (ст. 8) с радиальной интеркаляцией в крыше бластоцеля (Szabó et al., 2016). Так как радиальная интеркаляция сопровождается увеличением площади поверхности тканевого пласта, в крыше бластоцеля возникает избыток клеточного материала, который начинает смещаться в вентральном направлении в ходе эпиболии. Одновременно, на дорсальной стороне эмбриона начинает формироваться бластопор. На стадии 10 начинается ключевой для гаструляции X. laevis тип клеточных движений – инволюция материала мезодермальной закладки. Инволюция, начинающаяся на дорсальной стороне эмбриона, приводит к углублению бластопора. К стадии 10.5 бластопор начинает распространяться в латеральных направлениях (к стадии 11.5 он сомкнется на вентральной стороне зародыша), а прогрессирующая интернализация материала на дорсальной стороне формирует дорсальную губу бластопора. Через нее происходит наиболее активная миграция клеток внутрь эмбриона. Зону, расположенную непосредственно анимальнее дорсальной губы бластопора, называют супрабластопоральной областью (СБО, в англоязычном варианте – dorsal marginal zone, DMZ). Более глубокие клетки СБО составляют материал хордомезодермы, поверхностные – материал нейральной эктодермы. Инволюировавшие клетки хордомезодермы вовлекаются в движения медиолатеральной, или конвергентной, интеркаляции. В ходе этих движений каждая из клеток удлиняется вдоль медиолатеральной оси и формирует на концах направленные выросты, которые образуют С-кадгериновые контакты с телами соседних клеток. Затем, за счет сократительной активности миозина клетки встраиваются друг между другом вдоль медиолатеральной оси. Клетки эктодермы СБО X. laevis к этому моменту оказываются вовлечены в движения эпиболии (которые завершатся к стадии 11.5), но также осуществляют и конвергентную интеркаляцию (Keller, 1978; Keller et al., 2000; Keller, Sutherland, 2020). Они осуществляют движения интеркаляции путем сокращения клеточных границ, ориентированных в медиолатеральном направлении с последующим формированием в зоне контакта новой границы, ориентированной в антерио-постериорном направлении (Butler, Wallingford, 2018). Интересно, что движения конвергентной интеркаляции осуществляют не только глубокие клетки эктодермы, но и ее поверхностный слой – эпиэктодерма, который является эпителиальной тканью. Последнее означает, что конвергентная интеркаляция происходит в пласте клеток, механически связанных апикальным комплексом клеточных контактов, включающем адгезионные и плотные контакты (Higashi et al., 2016).
Особенный интерес представляет исследование клеточной подвижности именно в эпителиальных тканях. Эпителиальные ткани наиболее доступны для наблюдения, в особенности в интактных зародышах, благодаря чему через измерение морфометрических параметров их клеток возможно зарегистрировать действие сил, создаваемых подлежащими тканями эмбриона (Morita et al., 2012). Соседние клетки внутри эпителиального пласта могут отличаться скоростью и направлением движения. Эти различия могут являться одним из источников деформаций ткани (Vasilyev et al., 2012), приводящей к изменению паттерна механических сил. Хотя описание движений клеток поверхностного слоя СБО уже было произведено ранее (Keller, 1978), оно не включало подобный кинематический анализ движений клеток. Из-за этого оказывается невозможным связать клеточные движения с возникающими в ткани деформациями. К тому же, описание (Keller, 1978) не учитывает данные о паттернах механических напряжений при гаструляции амфибий (Beloussov et al., 1975), а также описания клеточных переупаковок (Solnica-Krezel, 2005; Blankenship et al., 2006).
Целью данной работы было картировать деформации эпиктодермы СБО гаструлы X. laevis на основании наблюдаемых в этой области клеточных движений.
Для достижения этой цели было необходимо измерить скорости движения клеток, направление их смещения, а также охарактеризовать динамику их формы.
Мы произвели кинематическое описание движений клеток в СБО средней гаструлы X. laevis, охарактеризовав для каждой клетки величину и направление смещения на каждом из интервалов цейтраферной съемки. Мы обнаружили, что регионы, расположенные вдоль медиолатеральной оси, различаются по значениям средней скорости и сонаправленности движений клеток. Анализ формы клеток выявил, что область с наиболее высокими значениями средней скорости и сонаправленности характеризуется наиболее активными перегруппировками клеток. Мы предположили, что наблюдаемые перегруппировки клеток могут служить способом компенсации растяжения ткани в ходе гаструляционных движений.
МАТЕРИАЛЫ И МЕТОДЫ
Получение и культивирование эмбрионов
Икру Х. laevis получали согласно стандартному протоколу (Sive et al., 2000), оплодотворяли in vitro и культивировали в 0.1 Marc’s Modified Ringer (MMR) (Sive et al., 2000) при комнатной температуре. Стадию развития эмбрионов определяли согласно таблицам нормального развития (Nieuwkoop, Faber, 1967).
Инъекция РНК
Для визуализации клеточных границ осуществляли инъекцию мРНК мембранного (GAP43-GFP) и ядерного (H2B-mCherry) маркеров. мРНК синтезировали с имеющихся в лаборатории плазмид pCS2+/GAP43-GFP и pCS2+/H2B-mCherry, которые любезно предоставил доктор Dietmar Gradl (Karlsruhe Institute of Technology, Karlsruhe). Выделение целевых плазмид после амплификации осуществляли с помощью набора Plasmid Miniprep (Evrogen), синтез РНК – с помощью набора mMESSAGE mMACHINE™ SP6 Transcription (Invitrogen), согласно предоставленному производителем протоколу. Оба набора были любезно предоставлены С.В. Кремнёвым (каф. эмбриологии МГУ им. М.В. Ломоносова).
Зародышей на стадиях от 2-х до 4-х бластомеров переносили из 0.1 MMR в раствор фиколла на 0.3 MMR. Затем осуществляли инъекцию мембранного (РНК GAP43-GFP) и ядерного (РНК H2B-mCherry) маркеров общим количеством 230 пг в случае GAP43-GFP и 230 пг в случае H2B-mCherry. Инъекцию производили в каждый из двух анимальных бластомеров, суммарный объем инъекции составлял 4.6 или 9.2 нл. После инъекции зародышей оставляли в растворе фиколла на 0.3 MMR и помещали в термостат с температурой 14–15°C для предотвращения образования протрузий в местах инъекции. Через 7–8 ч раствор фиколла меняли на 0.1 MMR, после чего продолжали культивирование при температуре 14–15°C до достижения зародышами стадии 10–10.5 согласно таблицам нормального развития.
Съемка на конфокальном микроскопе
На стадии 10.5 зародышей переносили в 1× MMR, снимали желточные оболочки с помощью двух металлических пинцетов и оставляли на 5 мин для компенсации стресса от снятия оболочек. По прошествии 5 мин зародыши переносили в 35 мм чашки Петри с дном из покровного стекла, заполненные 1% агарозой с низкой температурой плавления на 1× MMR. Зародыши ориентировали запаянной стеклянной пипеткой Пастера внутри сделанных в агарозе лунок так, чтобы медиальный участок СБО каждого эмбриона оказался вблизи покровного стекла. После этого чашку устанавливали в лазерный сканирующий конфокальный микроскоп Olympus FV-10i и осуществляли цейтраферную микрофотосъемку. В связи с наличием большого количества желтка в клетках X. laevis, визуализация флуоресценции вблизи базального отдела клеток затруднена. Поэтому в ходе съемки регистрировали единичный оптический срез вблизи апикальной поверхности клеток эпиэкодермы. В дальнейшем, под формой клетки мы будем понимать форму сечения клетки, зарегистрированного на таком оптическом срезе. Для съемки использовали 10× 0.4 NA объектив UPLSAP и цифровое увеличение ×1.8 (суммарное увеличение т. о. составило ×18). Съемку производили в течение часа с частотой 1 кадр/мин, время съемки единичного кадра – 8 с, интенсивность обоих лазеров 30%. Для обработки использовали данные по эмбрионам, дожившим до стадии хвостовой почки.
Морфометрический анализ
Распознавание клеточных границ на кадрах цейтраферной съемки осуществляли с помощью свободно распространяемого программного обеспечения EpiTools 2.1.6 (Heller et al., 2016). При необходимости, перед морфометрическим анализом результаты распознавания клеточных границ корректировали вручную с помощью плагина CellEditor в составе EpiTools 2.1.6. Данные морфометрического анализа экспортировали через соответствующую опцию плагина CellOverlay, и затем осуществляли статистическую обработку данных в программах ICY, Microsoft Excel 365, RStudio 1.4.1106 и STATISTICA 10.0.
Смещения клеток оценивали с помощью модуля CELL_OUTLINE в составе ПО EpiTools 2.1.6. С помощью данного модуля на каждом из кадров цейтраферной съемки вычисляли координаты геометрического центра каждой из клеток на оптическом срезе и экспортировали полученные значения в Microsoft Excel 365. Затем для каждой клетки в Microsoft Excel 365 рассчитывали величину смещения и угол между направлением смещения клетки и антерио-постериорной осью за время между двумя кадрами.
1) Смещение рассчитывали, как кратчайшее расстояние между геометрическим центром клетки на двух последовательных кадрах. Для этого вычисляли отдельно разность координат X (ΔХ) и разность координат Y (ΔY) центра масс клетки между двумя последовательными кадрами, после чего находили смещение D как корень из суммы квадратов ΔХ и ΔY (т. к. смещение D и его компоненты ΔХ и ΔY образуют прямоугольный треугольник, где D – гипотенуза, а ΔХ и ΔY – катеты) (рис. 1). Так временной промежуток между кадрами составляет 1 мин, рассчитанное перемещение D фактически представляет собой среднюю скорость смещения клетки с размерностью мкм/мин.
Рис. 1.
Описание смещения индивидуальной клетки. ΔХ: изменение координаты геометрического центра масс (красная точка) по оси X, ΔY: изменение координаты геометрического центра клетки по оси Y; D – результирующее смещение; вектор D и его компоненты ΔХ и ΔY образуют прямоугольный треугольник, D = = $\sqrt {{{{(\Delta X)}}^{2}} + {{{(\Delta Y)}}^{2}}.} $
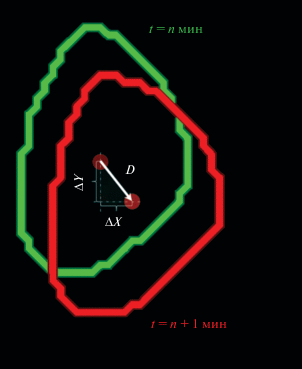
2) Для вычисления угла α (принимает значения от 0° до 360°) между вектором смещения клеток и антерио-постериорной осью (совпадает с осью 0°–180°, где 0° соответствует постериорному полюсу, а 180° – антериорному) сначала находили тангенс угла смещения tg(α) = ΔХ/ΔY, после чего с помощью функции арктангенс (ATAN) находили величину угла смещения в градусах.
3) Сонаправленность смещений клеток оценивали с помощью параметра порядка S = 〈cos(α)〉, где α – угол между направлением смещения отдельной клетки и антерио-постериорной осью эмбриона (α принимает значения от 0° до 360°), а скобки 〈 〉 означают усреднение по нескольким значениям. Использование функции cos вместо непосредственного значения угла позволяет одновременно оценить как параллельность траектории смещения клетки антерио-постериорной оси (по модулю значения cos), так и направление смещения клетки (по знаку величины cos): если траектория смещения и антеропостериорная ось параллельны и сонаправлены, угол между ними равен 0°, и S принимает значение равное cos(0°) = 1, если же они параллельны, но имеют противоположные направления, угол между ними равен 180°, а S принимает значение равное cos(180°) = –1 (Kemkemer et al., 2006; Reffay et al., 2011).
4) Форму клеток оценивали через эксцентриситет – числовую характеристику конического сечения, показывающую степень его отклонения от окружности. Выбор эксцентриситета для данной задачи объясняется тем, что форму клеток удобно описывать с помощью аппроксимации эллипсом (или окружностью), который является частным случаем конического сечения. Также, эксцентриситет является удобной оценкой формы клеток, так как отражает изменение соотношения длины большой и малой осей клетки. Эксцентриситет рассчитывали как Е = $\sqrt {1 - \frac{{{{b}^{2}}}}{{{{a}^{2}}}}} ,$ где a – длина большой оси, b – длина малой оси. Длину большой и малой оси для каждой клетки на кадре вычисляли с помощью модуля ELLIPSE_FIT.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ пространственно-временной динамики скоростей смещений клеток
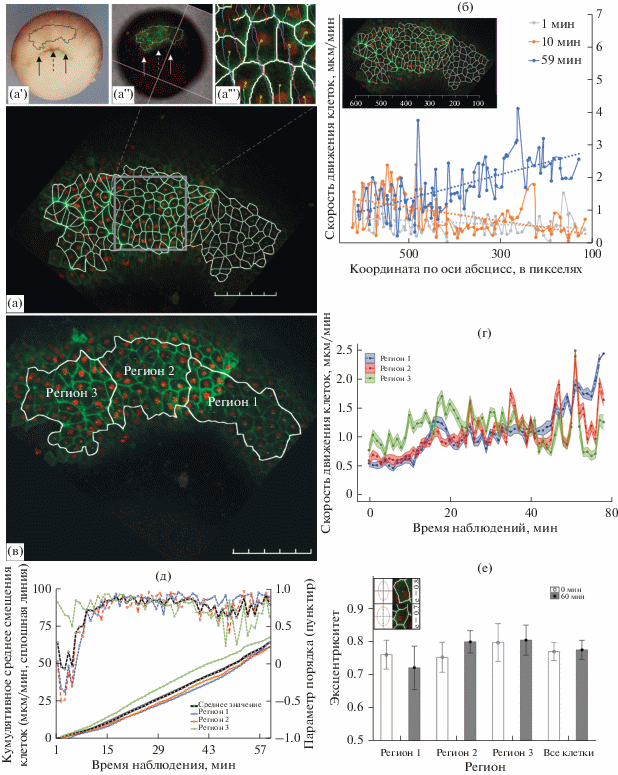
Для количественного описания деформаций эпиэктодермы СБО в ходе гаструляции X. laevis, мы провели анализ пространственного распределения скоростей смещений клеток в исследуемой области, включающей 88 клеток (рис. 2а). На момент начала съемки эмбрион достиг стадии 10.5. На данной стадии начинается интернализация колбовидных клеток на дорсальной стороне эмбриона (рис. 2а' и 2а", пунктирная стрелка), а бластопор начинает распространяться в латеральных направлениях, формируя латеральные губы (рис. 2а' и 2а", сплошные стрелки).
Рис. 2.
(а) Общий вид дорсальной области эмбриона X. laevis на стадии 10–10.5 с распознанными клеточными границами (а, линейка соответствует 100 мкм, деление – 20 мкм) и положение исследуемой области в эмбрионе (а', а"). Для каждой из распознанных клеток (а) была прослежена траектория ее смещения в течение часа (а"'). Для каждой траектории цветовым кодом обозначены ее начальный (желто-зеленый интервал), промежуточный (сине-фиолетовый интервал) и конечный (оранжево-красный интервал) участки. (б) Оценка пространственной однородности смещения клеток вдоль медиолатеральной оси. В течение наблюдения распределение величины смещений отклоняется от равномерного (1 мин наблюдения, серая сплошная линия), и наибольшие значения смещений превалируют в медиальной (10 мин наблюдения, оранжевая сплошная линия) или латеральной (59 мин наблюдения, синяя сплошная линия) областях губы бластопора. По оси абсцисс: координата геометрического центра клетки. По оси ординат: величина смещения за интервал между текущим и следующим кадрами. Пунктирная линия – линейный тренд. На графике приведены данные для начала (смещения за 1-ю и 10-ю минуту наблюдения) и конца (59-я минута наблюдения) съемки. (в) Для оценки динамики пространственной однородности смещения клеток вдоль медиолатеральной оси вся исследуемая область была разбита на три региона по 29–30 клеток (линейка соответствует 100 мкм, деление – 20 мкм). (г) Чтобы статистически оценить региональные различия скоростей смещения, для каждого из регионов была рассчитана средняя скорость смещения клеток. Центральная линия – средняя скорость смещения в регионе, заливка – стандартная ошибка среднего. (д) Для более удобного анализа для каждого из регионов были рассчитаны кумулятивное среднее скоростей смещения клеток и среднее параметра порядка для каждого из кадров съемки. Сплошные линии (ось ординат слева): кумулятивное среднее смещение клеток (средние скоростей смещения клеток были последовательно суммированы в течение всего времени наблюдения). Полученный график демонстрирует, что наибольшие значения смещений клеток в начале наблюдения обнаруживается в регионе 3. Затем динамика скоростей уравнивается во всех трех регионах, но к концу наблюдения достигает наибольших значений в регионе 1. Пунктирные линии: среднее значение параметра порядка S = 〈cos(α)〉 для каждого из регионов. (е) Для выявления к локальных деформаций внутри регионов оценили динамику эксцентриситета клеток. Нам не удалось выявить статистически достоверных различий между эксцентриситетом клеток в начале и в конце наблюдения во всех трех регионах, ровно как и в среднем по всем клеткам исследуемой области.
Количественное исследование пространственной анизотропии тканевых деформаций должно опираться на алгоритм, который позволял бы выявлять внутри исследуемой области зародыша регионы с наиболее выраженными деформациями. Выявив такие регионы, можно провести более детальный, сравнительный анализ характерной для каждого из них пространственно-временной динамики деформаций. Наиболее удобной функцией для этой задачи является параметр порядка S, т.к. он позволяет выявить регионы и временные интервалы с наименее сонаправленными смещениями клеток, и потому потенциально наиболее выраженными деформациями. Параметр порядка рассчитывали как косинус угла между вектором смещения отдельной клетки и антеропостериорной осью эмбриона (которая совпадала с осью 0°–180°, где 0° соответствует вегетативному полюсу, а 180° – анимальному). Однако выраженность деформации зависит не только от направления движения клеток, но и от того, на какое расстояние они расходятся при смещении. Для этого необходимо соотнести значение скорости смещения клеток со значением параметра порядка. Скорость V рассчитывали как частное смещения отдельной клетки D за промежуток времени между двумя кадрами и продолжительности этого промежутка t $\left( {V = \frac{D}{t}} \right).$ Так как интервал между кадрами цейтраферной съемки составлял 1 мин, смещение клетки за промежуток времени между двумя кадрами представляет собой ее среднюю скорость в мкм/мин.
Для каждого кадра цейтраферной съемки мы упорядочили индивидуальные номера распознанных на нем клеток согласно их положению вдоль медиолатеральной оси эмбриона (т.е. согласно значению координаты соответствующей клетки по оси абсцисс). Затем построили график, на котором по оси абсцисс откладывали координаты геометрических центров клеток относительно медиолатеральной оси эмбриона, а по оси ординат – скорость смещения каждой клетки (рис. 2б). На полученном графике видно, что изначально скорости смещения клеток были равномерно распределены вдоль медиолатеральной оси (рис. 2б, серая линия). В течение наблюдения скорости смещений принимали наибольшие значения в медиальной (рис. 2б, оранжевая линия) или наиболее латеральных областях губы (рис. 2б, синяя линия), формируя градиент вдоль медиолатеральной оси. Чтобы статистически оценить пространственную неоднородность скоростей движения клеток, мы подразделили исследуемую область на отдельные регионы, так, чтобы каждый состоял из 29–30 клеток (рис. 2в). В результате исследуемая область оказалась подразделена на 3 региона.
Для каждого из трех получившихся регионов проследили динамику средней скорости смещений клеток и среднего параметра порядка S. Абсолютные значения средней скорости движения клеток в регионе 3 превышают таковые в регионах 1 и 2, и в течение первых 15–18 мин съемки демонстрируют тенденцию к возрастанию (рис. 2г, зеленая линия). Однако, в силу выраженных колебаний средней скорости смещений отдельных клеток достоверно выявить тренд при подобном представлении данных затруднительно. Для этого удобнее выводить на график кумулятивное среднее скоростей смещения клеток, т.е. не абсолютные значения средней скорости, а последовательность сумм средних скоростей за все предшествующие данному интервалы наблюдения (рис. 2д, сплошные линии, ось ординат слева). Тогда график будет иметь более линейную форму, что упростит сравнение регионов между собой. Такой график более отчетливо демонстрирует, что, хотя изначально средние скорости клеток практически идентичны для всех регионов, в первые 15–18 мин наблюдения средняя скорость клеток в регионе 3 (рис. 2д, сплошная зеленая линия) растет быстрее таковых в регионах 1 и 2 (рис. 2д, синяя и красная сплошные линии соответственно), и в среднем по всем клеткам исследуемой области зародыша (рис. 2д, черная сплошная линия). Это можно определить по более пологой форме графика на этом интервале. Одновременно с этим, мы сравнили среднее значение параметра порядка S для каждого региона со средним для всех 88 клеток образца, что позволило выявить региональные различия в сонаправленности клеточных движений (рис. 2д, пунктирные линии, ось ординат справа). Так, значение параметра порядка в регионе 3 (рис. 2д, зеленая пунктирная линия) систематически превышает среднее по всем клеткам образца в течение первых 6 мин наблюдения (рис. 2д, черная пунктирная линия). Этот вывод подтверждается статистически с помощью критерия Манна–Уитни: для первых 6 кадров съемки значение параметра порядка в регионе 3 статистически достоверно отличается от среднего для всех клеток эмбриона (значение p-value меньше 0.01), в отличие от регионов 1 и 2 (рис. 2д, синяя и красная пунктирные линии соответственно).
На интервале 6–24 мин наблюдения параметр порядка S возрастает во всех регионах, а его колебания уменьшаются. Одновременно с этим возрастают и скорости движения клеток: в области 19 мин для регионов 1 и 2 и в области 17 мин для региона 3 на графиках средней скорости явно присутствуют точки перегиба. В области 31-й минуты наблюдения значения параметра порядка в регионах 1 и 2 начинают превышать таковые в регионе 3. С 47-й мин наблюдения среднее значения параметра порядка в регионе 3 начинает статистически достоверно отличаться от среднего по зародышу в меньшую сторону. Одновременно с этим в регионе 3 замедляется рост средней скорости смещения клеток, что можно определить по возникновению второго перегиба на соответствующем графике (рис. 2д, сплошная зеленая линия, начиная с 27-й мин). Одновременно, в регионах 1 и 2 рост средней скорости продолжается. Это приводит к тому, что к концу наблюдения отличия в значениях средних скоростей значительно уменьшаются для всех трех зон, а графики кумулятивных средний смещения клеток во всех трех регионов отклоняются от линейной зависимости. Наиболее наглядно это отклонение визуализируется при сравнении графиков кумулятивного среднего смещения клеток для регионов с графиком для всех 88 клеток, который с высокой степенью достоверности аппроксимируется линейной зависимостью (R2 = 0.9953).
Таким образом, скорости и сонаправленность движений клеток в регионе 3 систематически отличается от регионов 1 и 2.
Анализ пространственно-временной динамики формы клеток
Чтобы найти причину выявленной неоднородности движений клеток, мы проанализировали форму границ клеток на полученной серии изображений в каждом из трех регионов. Важно уточнить, что в ходе съемки регистрировали единичный оптический срез вблизи апикальной поверхности клеток эпиэкодермы. В связи с этим, общей границей для пары соседних клеток мы будем называть зону контакта мембран этих клеток, попавшую на оптический срез, а формой клетки – форму сечения клетки, зарегистрированного на оптическом срезе.
Чтобы оценить локальные деформации внутри отдельных регионов, мы проанализировали динамику эксцентриситета (меры отклонения формы клетки от окружности) отдельных клеток в исследуемых регионах. Нам не удалось выявить статистически значимых различий между средним значением эксцентриситета клеток в начале и в конце наблюдения, как в целом по эмбриону, так и внутри отдельных регионов (рис. 2е). Однако анализ формы клеток позволил выявить множество клеточных структур, называемых розетками. Подобные структуры являются промежуточным этапом специфических, пространственно ориентированных переупаковок клеток (рис. 3а–3а'''). Розетка формируется за счет сокращения общих границ внутри группы клеток, выстроенных в два параллельных тяжа (рис. 3а). Каждая клетка внутри данной пары клеточных тяжей сокращает свою границу, которой она контактирует с клетками из соседнего тяжа так (рис. 3а'), что на оптическом срезе граница контакта между клетками двух тяжей сходятся в точку (рис. 3а"). На кадре съемки такая точка возникает из-за прохождения оптического среза через общую границу для всех клеток розетки (сонаправленную апикобазальной оси). Затем клетки розетки группируются в два новых тяжа, перпендикулярных ориентации первоначальных тяжей (рис. 3а'''). Такие клеточные переупаковки могут иметь морфогенетическое значение. В частности, в гаструляции D. melanogaster такие перегруппировки опосредуют аксиальное удлинение эмбриона, приводя к реориентации тяжей клеток в антериопостериорном направлении (Blankenship et al., 2006). Чтобы оценить, как переупаковки клеток через розетки соотносятся с картой механических напряжений в гаструляции X. laevis, мы проследили переупаковки клеток розеток, попавших в исследуемую область.
Рис. 3.
(а–а''') Схема формирования и распада клеточной розетки в ходе удлинения зародышевой полоски Drosophila melanogaster (на основе данных, представленных в Blankenship et al., 2006). (a) Два тяжа клеток, которые впоследствии сформируют розетку. (a') При инициации формирования розетки каждая клетка внутри клеточного тяжа сокращает свою границу, которой она контактирует с клетками из соседнего тяжа. (a'') Формирование розетки заканчивается, когда граница контакта между клетками двух тяжей сходятся в точку (красная точка). (a''') В ходе распада розетки образующий домен клеток группируется в два новых тяжа, перпендикулярных ориентации первоначальных тяжей. Красная линия – граница контакта между клетками двух тяжей, пунктирные красные стрелки – направление сокращения/формирования границы между клетками двух тяжей, красная точка – центр розетки. (б–б''') Последовательные этапы распада клеточной розетки у X. laevis. (б) конфигурация розетки в момент начала съемки. (б'–б''') конфигурация розетки на 20-й, 40-й и 60-й минуте съемки (б', б", и б''' соответственно). На (б', б'') можно наблюдать распад изначальной розетки на две новых, после чего на б''' центры розеток исчезают. Числа в клетках (белый шрифт) обозначают порядковый номер клетки, красная точка – центр розетки, красная пунктирная линия – формирующаяся новая граница контакта между клетками розетки.
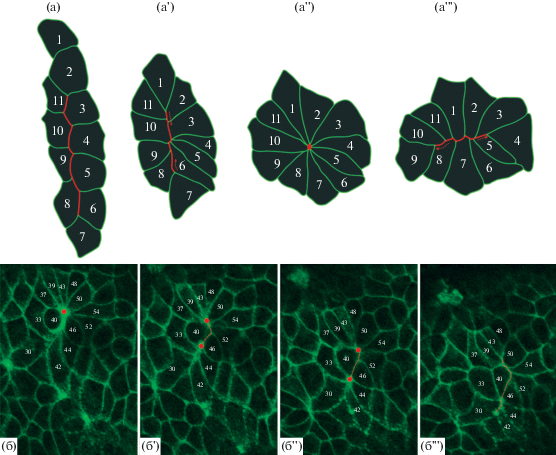
На кадрах съемки удалось идентифицировать 9 розеток, из них 7 были локализованы в регионе 3, 1 – в регионе 2, и 1 – в регионе 1. Распознать все составляющие их клетки удалось только для 5 из 9 идентифицированных розеток. Из этих 5 розеток 4 были локализованы в регионе 3, 1 – в регионе 2. Интересно, что формирование розетки в регионе 2 последовало за делением одной из клеток.
Ранее, с помощью анализа клеточной морфологии на фиксированных эмбрионах было продемонстрировано, что розетки преимущественно локализуются в медиальной области СБО (Evstifeeva et al., 2010). Эти данные позволяют нам более точно идентифицировать положение медиальной линии эмбриона. Оказалось, что она локализована в регионе 3, который, таким образом, соответствует медиальной зоне СБО. Таким образом, медиальная линия СБО не соответствует срединной линии исследуемой области и смещена влево относительно нее. Тогда регионы 1 и 2 являются участками одной из латеральных зон СБО. Исходя из этого, можно предположить, что регион 3 соответствует области зародыша, где наиболее активно протекает процесс инволюции.
Выбранное время наблюдения не позволило зарегистрировать процесс возникновения и распада розетки полностью, однако инициацию распада трех розеток удалось зафиксировать (рис. 3б–3б'''). В ходе распада розетки изменяется направление наибольшей протяженности образующего ее домена клеток (Blankenship et al., 2006). Поэтому ориентация клеточных границ между формирующихся при распаде розетки тяжами, может служить оценкой внутритканевой деформации. В связи с этим, мы проанализировали протяженность и ориентацию границ клеток при распаде розеток. За протяженность границ принимали длину границы между формирующимися тяжами на момент окончания съемки. Формирующиеся границы оказались сонаправлены антерипостериорной оси, отклоняясь от нее на 5.1°, 6.7° и 8.6°. Таким образом, при распаде розетки новые границы формируются практически параллельно антерипостериорной оси. Согласно реконструкции карт механических напряжений, изложенной в (Beloussov, 2015), формирующиеся границы также оказываются параллельны линиям напряжения внутри СБО. Это позволяет нам предположить, что наблюдаемые перестройки компенсируют усиленное растяжение поверхностного слоя клеток в ходе инволюции. В пользу этого предположения косвенно свидетельствует наибольшее значение средней скорости движений клеток в регионе 3 в первую треть наблюдения.
В дальнейшем мы планируем получить прямые доказательства того, что розетки выполняют важную роль в регулировании механической деформации ткани. В первую очередь, надо установить, приводит ли инволюция к усиленному растяжению материала СБО. Для этого необходимо измерить деформации ткани СБО. Затем, мы планируем провести более продолжительную цейтраферную съемку, чтобы зарегистрировать полный цикл формирования и распада розеток, а также проанализировать протяженность домена образующих розетку клеток до и после распада розетки. Цикл формирования розеток необходимо описать кинематически. Кроме того, нужно изучить лежащий в его основе клеточный механизм, так как его понимание позволит косвенно оценить распределения сил в ходе формирования розетки.
Описаны как минимум два основных типа формирования розеток, отличающихся по характеру распределения сигнальных комплексов и сократительного аппарата клетки (Harding et al., 2014). В первом случае, F-актин, миозин II и ряд белков, (ключевыми среди которых являются Par-белки и белки клеточных контактов) колокализуются в апикальном домене клетки, а процесс формирования розетки сводится к апикальному сокращению образующих ее клеток. Во втором случае актомиозиновый комплекс и сигнальные молекулы оказываются распределены вдоль взаимоперпендикулярных осей. Как правило, F-актин и миозин II локализованы на медиальных поверхностях клеток, вдоль антеропостериорной оси эмбриона, в то время как Par-белки и белки клеточных контактов локализуются на антериорной или постериорной поверхностях клеток, вдоль медиолатеральной оси эмбриона. Кроме того, F-актин и миозин II не концентрируются в апикальном домене, а распределяются вдоль апикобазальной оси. Эти два типа розеток также отличаются временем существования. Розетки первого типа могут существовать продолжительное время, в то время как розетки второго типа быстро перестраиваются. Как правило, процессы, связанные с вытяжением ткани сопровождаются перестроением именно розеток второго типа. Поэтому, чтобы доказать высказанное нами предположение о роли обнаруженных нами розеток в деформации ткани СБО, мы планируем установить, к какому из типов принадлежат эти розетки.
ЗАКЛЮЧЕНИЕ
В представленной здесь работе мы осуществили детальное количественное описание движений клеток в эпиэктодерме СБО гаструлы X. laevis. Мы обнаружили, что низкая скорость смещения клеток наблюдается одновременно с низкой сонаправленностью движений и, наоборот, при высокой скорости движений клеток наблюдали высокую сонаправленность их смещений. При этом, распределение скоростей и направлений смещения клеток внутри исследуемой области оказалось пространственно неоднородным. Эта неоднородность приводит к региональным различиям средней скорости и сонаправленности движений клеток вдоль медиолатеральной оси. Чтобы установить, сопровождаются ли обнаруженные региональные различия внутритканевыми деформациями, мы проанализировали динамику формы клеток в выделенных регионах. Нам не удалось выявить статистически значимых различий между формой клеток в начале и в конце наблюдения как в целом по эмбриону, так и внутри отдельных регионов. Однако анализ формы клеток позволил зафиксировать региональные различия в активности их перегруппировок. В частности, в медиальной зоне СБО были сконцентрированы клеточные структуры, называемые розетками. Анализ распада розеток позволил установить, что в ходе этого процесса домен клеток, образующих розетку, начинает удлиняться в направлении антериопостериорной оси. Мы предполагаем, что подобные перестройки компенсируют растяжение материала СБО в ходе процесса инволюции. Именно поэтому розетки превалируют в медиальном регионе СБО, который первым вовлекается в процесс инволюции.
Таким образом, в данной работе впервые описана пространственная неоднородность движений клеток, которая может служить потенциальным источником глобальных деформаций в СБО бесхвостых амфибий. Дальнейшее исследование этого процесса позволит изучить механизм поддержания стадиеспецифических паттернов механических сил в эмбриогенезе.
Список литературы
Beloussov L.V. et al. Effects of relaxation of mechanical tensions upon the early morphogenesis of Xenopus laevis embryos // Int. J. Dev. Biol. 1990. V. 34. № 4. P. 409–419.
Beloussov L.V. Morphomechanics of Development. 2015. 1–195 p.
Beloussov L.V. et al. Tension-dependent collective cell movements in the early gastrula ectoderm of Xenopus laevis embryos // Dev. Genes Evol. 2000. V. 210. № 2. P. 92–104.
Beloussov L.V et al. Mechanical stresses and morphological patterns in amphibian embryos // J. Embryol. Exp. Morphol. 1975. V. 34. № 3. P. 559–574.
Bi D. et al. Motility-driven glass and jamming transitions in biological tissues // Phys. Rev. X. 2016. V. 6. № 2.
Blanchard G.B. et al. Tissue tectonics: Morphogenetic strain rates, cell shape change and intercalation // Nat. Methods. 2009. V. 6. № 6. P. 458–464.
Blankenship J.T. et al. Multicellular rosette formation links planar cell polarity to tissue morphogenesis // Dev. Cell. 2006. V. 11. № 4. P. 459–470.
Brunet T. et al. Evolutionary conservation of early mesoderm specification by mechanotransduction in Bilateria // Nat. Commun. 2013. V. 4. P. 1–15.
Butler M.T., Wallingford J.B. Spatial and temporal analysis of PCP protein dynamics during neural tube closure // Elife. 2018. V. 7. P. 1–23.
Campàs O. et al. Quantifying cell-generated mechanical forces within living embryonic tissues // Nat. Methods. 2014. V. 11. № 2. P. 183–189.
Campinho P. et al. Tension-oriented cell divisions limit anisotropic tissue tension in epithelial spreading during zebrafish epiboly // Nat. Cell Biol. 2013. V. 15. № 12. P. 1405–1414.
Chien Y.H. et al. Mechanical strain determines the axis of planar polarity in ciliated epithelia // Curr. Biol. 2015. V. 25. № 21. P. 2774–2784.
Davidson L.A. Embryo Mechanics. Balancing Force Production with Elastic Resistance during Morphogenesis. Elsevier Inc., 2011. № 1. P. 215–241.
Diz-Muñoz A. et al. Control of directed cell migration in vivo by membrane-to-cortex attachment // PLoS Biol. 2010. V. 8. № 11.
Eroshkin F.M. et al. Development of methods and techniques to visualize mechanical tension in embryos using genetically encoded fluorescent mechanosensors // Russ. J. Dev. Biol. 2018. V. 49. № 6. P. 362–369.
Evstifeeva A.Y., Kremnyov S.V., Beloussov L.V. Changes in topology and geometry of the embryonic epithelium of Xenopus during relaxation of mechanical tension // Russ. J. Dev. Biol. 2010. V. 41. P. 156–163.
Gayrard C., Borghi N. FRET-based molecular tension microscopy // Methods. 2016. V. 94. P. 33–42.
Hara Y. et al. Directional migration of leading-edge mesoderm generates physical forces: Implication in Xenopus notochord formation during gastrulation // Dev. Biol. 2013. V. 382. № 2. P. 482–495.
Harding M.J. et al. The roles and regulation of multicellular rosette structures during morphogenesis // Dev. 2014. V. 141. № 13. P. 2549–2558.
Heller D. et al. EpiTools: An open-source image analysis toolkit for quantifying epithelial growth dynamics // Dev. Cell. 2016. V. 36. № 1. P. 103–116.
Higashi T. et al. Maintenance of the epithelial barrier and remodeling of cell-cell junctions during cytokinesis // Curr. Biol. 2016. V. 26. № 14. P. 1829–1842.
Keller R. et al. Mechanisms of convergence and extension by cell intercalation // Philos. Trans. R. Soc. B Biol. Sci. 2000. V. 355. № 1399. P. 897–922.
Keller R.E. Time-lapse cinemicrographic analysis of superficial cell behavior during and prior to gastrulation in Xenopus laevis // J. Morphol. 1978. V. 157. № 2. P. 223–247.
Keller R., Sutherland A. Convergent Extension in the Amphibian, Xenopus laevis. Elsevier Inc., 2020. № 1. P. 271–317.
Kemkemer R. et al. Cell orientation by a microgrooved substrate can be predicted by automatic control theory // Biophys. J. 2006. V. 90. № 12. P. 4701–4711.
Ma X. et al. Probing embryonic tissue mechanics with laser hole drilling // Phys. Biol. 2009. V. 6. № 3.
Mohagheghian E. et al. Quantifying compressive forces between living cell layers and within tissues using elastic round microgels // Nat. Commun. 2018. V. 9. № 1.
Mongera A. et al. A fluid-to-solid jamming transition underlies vertebrate body axis elongation // Nature. 2018. V. 561. № 7723. P. 401–405.
Morita H. et al. Cell movements of the deep layer of non-neural ectoderm underlie complete neural tube closure in Xenopus // Development. 2012. V. 139. № 8. P. 1417–1426.
Murray J.D. Mathematical Biology Biomedical Applications., 2003. 814 p.
Nieuwkoop P.D., Faber J. Normal tables of Xenopus laevis (Daudin) // 1967.
Reffay M. et al. Orientation and polarity in collectively migrating cell structures: Statics and dynamics // Biophys. J. 2011. V. 100. № 11. P. 2566–2575.
Schaumann E.N. et al. Force localization modes in dynamic epithelial colonies // Mol. Biol. Cell. 2018. V. 29. № 23. P. 2835–2847.
Sive H.L. et al. Early Development of Xenopus laevis: A Laboratory Manual. CSHL Press, 2000. P. 249–297.
Solnica-Krezel L. Conserved patterns of cell movements during vertebrate gastrulation // Curr. Biol. 2005. V. 15. № 6. P. 213–228.
Streichan S.J. et al. Global morphogenetic flow is accurately predicted by the spatial distribution of myosin motors // Elife. 2018. V. 7.
Szabó A. et al. The molecular basis of radial intercalation during tissue spreading in early development // Dev. Cell. 2016. V. 37. № 3. P. 213–225.
Tambe D.T. et al. Collective cell guidance by cooperative intercellular forces // Nat. Mater. 2011. V. 10. № 6. P. 469–475.
Vasilyev A. et al. Mechanical stretch and PI3K signaling link cell migration and proliferation to coordinate epithelial tubule morphogenesis in the zebrafish pronephros // PLoS One. 2012. V. 7. № 7.
Zamir E.A. et al. The ECM moves during primitive streak formation – Computation of ECM versus cellular motion // PLoS Biol. 2008. V. 6. № 10. P. 2163–2171.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


