Онтогенез, 2021, T. 52, № 5, стр. 329-344
Сердце крысы в пренатальном и постнатальном периоде онтогенеза
В. В. Иванова a, *, И. В. Мильто a, b, О. Н. Серебрякова a, И. В. Суходоло a
a ФГБОУ ВО Сибирский государственный медицинский университет Минздрава России
634050 Томск, Московский тракт, 2, Россия
b ФГУП Северский биофизический научный центр ФМБА России
636013 Северск-13, а/я № 130, Россия
* E-mail: ivvera92@rambler.ru
Поступила в редакцию 09.02.2021
После доработки 13.05.2021
Принята к публикации 18.05.2021
Аннотация
Крысы являются самыми распространенными лабораторными животными, которые используются в экспериментах по оценке кардиотоксических, в том числе тератогенных, эффектов терапевтических агентов. Для корректной интерпретации результатов экспериментальных исследований необходимо иметь детальное представление об особенностях развития и строения сердца лабораторных животных. Кардиоморфогенез крыс, в сравнении с таковым у человека, имеет следующие особенности: (1) пик пролиферативной активности кардиомиоцитов приходится на поздние этапы пренатального периода онтогенеза; (2) переход миокарда от гиперпластического типа роста к гипертрофическому происходит в раннем постнатальном периоде онтогенеза; (3) гипертрофический тип роста миокарда заключается в образовании кардиомиоцитов с несколькими диплоидными ядрами – многоядерных кардиомиоцитов.
ВВЕДЕНИЕ
Крысы являются самым распространенным видом лабораторных животных, которых используют в экспериментах по оценке кардиотоксических, в том числе тератогенных, эффектов терапевтических агентов (Jacob, 1999; Corstius et al., 2005; Rodríguez-Rodríguez et al., 2017; Chen et al., 2019; Nefodova et al., 2019; Cohen et al., 2021). Крысы, по сравнению с другими видами лабораторных животных, имеют следующие преимущества: короткая продолжительность жизни, высокая плодовитость, относительно крупный размер, низкая частота врожденных аномалий сердца (Bradley et al., 2018). Особо стоит отметить принципиальную схожесть строения и функционирования сердца у крыс и человека: относительная масса сердца, а также относительная толщина стенки правого и левого желудочков у крыс соответствуют аналогичным параметрам сердца человека (Bryda, 2013; Buetow, Laflamme, 2018). Строение сердца половозрелых крыс подробно описано, тогда как сведения о пренатальном и постнатальном кардиоморфогенезе крыс разрозненны и противоречивы. Показано, что результаты только 37% биомедицинских исследований на лабораторных животных транслируют на человека (Hackam, Redelmeier, 2006; Ferreira et al., 2020). Для повышения эффективности исследований на животных необходимо грамотное планирование эксперимента и корректная интерпретация результатов, что невозможно без детального представления об особенностях строения органов лабораторных животных на различных этапах онтогенеза. Целью данного обзора является систематизация и анализ особенностей кардиоморфогенеза крыс.
В данном обзоре акцент сделан на кардиоморфогенез крыс линий Вистар, Спрег-Доули, а также беспородных крыс – наиболее часто используемых в экспериментах по оценке кардиотоксичности. Развитие сердца у беспородных крыс, а также крыс линий Вистар и Спрег-Доули не имеет различий. Продолжительность пренатального периода онтогенеза крыс этих линий одинакова и составляет 22–23 дня (Абрашова и др., 2013), что позволяет сопоставлять сведения о пренатальном кардиоморфогенезе крыс этих линий.
РАЗВИТИЕ СЕРДЦА КРЫСЫ В ПРЕНАТАЛЬНОМ ПЕРИОДЕ ОНТОГЕНЕЗА
Сердце является первым органом, формирующимся в ходе эмбриогенеза. Закладку сердца образуют клетки зародышевой мезодермы (первичное и вторичное сердечное поле) и нейроэктодермы (нервный гребень), которые в различные временные периоды вносят вклад в формирование сердца. Вклад вышеупомянутых эмбриональных источников в развитие клеток сердца обобщен в таблице (табл. 1).
Таблица 1.
Потенции кардиогенных эмбриональных источников в развитии клеток сердца крыс (Nakagawa et al., 1993; Hildreth et al., 2008; Wessels et al., 2012; Liang et al., 2013; Чумасов и др., 2017)
| Эмбриональный источник | Участие в кардиоморфогенезе | Производные | Потенциал дифферецировки |
|---|---|---|---|
| Первичное сердечное поле | На 9 сутки пренатального периода онтогенеза формирует прямую сердечную трубку | Закладка эндокарда | • Фибробласты клапанов сердца • Эндотелиоциты эндокарда • Эндотелиоциты сосудов сердца |
| Закладка миокарда | • Сократительные, секреторные и проводящие кардиомиоциты | ||
| Вторичное сердечное поле | На 9.5 сутки пренатального периода онтогенеза преобразует прямую сердечную трубку в С-образную сердечную трубку | Закладка эндокарда | • Эндотелиоциты эндокарда • Фибробласты клапанов сердца • Эндотелиоциты сосудов сердца |
| Закладка миокарда | • Сократительные, секреторные
и проводящие кардиомиоциты • Фибробласты перепончатой части перегородки сердца |
||
| Закладка эпикарда | • Мезотелий эпикарда • Фибробласты миокарда • Фибробласты клапанов сердца • Гладкие миоциты и эндотелиоциты сосудов сердца |
||
| Нервный гребень | На 11 сутки пренатального периода онтогенеза заселяет выходной тракт S-образной сердечной трубки | Закладка артериальных клапанов сердца, нервных узлов | • Проводящие кардиомиоциты • Фибробласты клапанов сердца • Эндотелиоциты и гладкие миоциты сосудов сердца • Нейроны и глиальные клетки вегетативных узлов сердца |
Формирование прямой сердечной трубки
Первичное сердечное поле у зародыша крысы выявляется на 9 сутки пренатального периода онтогенеза в составе висцерального листка спланхнотома. Детерминация и последующая дифференцировка клеток висцерального листка спланхнотома в направлении кардиогенных клеток-предшественников происходит в результате индукционного влияния клеток энтодермы посредством фактора роста фибробластов, костных морфогенетических белков, Shh, Wnt11 и др. (Paige et al., 2015) и регулируется транскрипционными факторами Nkx2.5, Tbx5, Hand1, Hand2 и GATA4 (Takeuchi, Bruneau, 2009).
Первичное сердечное поле – это скопление клеток в форме подковы, разомкнутой частью обращенной каудально, расположенное в краниальной части зародыша крыс (Baldwin et al., 1991; Suzuki et al., 1995). Клетки первичного сердечного поля, обращенные в целом, являются предшественниками кардиомиоцитов, тогда как клетки, прилежащие к энтодерме, являются предшественниками эндотелиоцитов (Manner, Yelbuz, 2019). Краниальная часть целома является преперикардиальной полостью. В течение суток прекардиальная мезодерма первичного сердечного поля претерпевает значительные изменения: клетки боковых отделов первичного сердечного поля перемещаются к срединной линии тела зародыша и формируют непарное продольное скопление, которое преобразуется в прямую сердечную трубку (рис. 1) (DeRuiter et al., 1992). Клетки первичного сердечного поля вносят вклад в формирование миокарда и эндокарда левого желудочка и обоих предсердий (Liang et al., 2013). Стоит отметить, что уже на стадии прямой сердечной трубки закладка сердца обладает сократительной активностью (Chacko, 1976).
Рис. 1.
Формирование закладки сердца крысы клетками висцерального листка спланхнотома. Зародышевая эктодерма (Эк), зародышевая энтодерма (Эн), зародышевый целом (Ц), хорда (Х), сомит (С), зародышевая кишка (Ки), нервная трубка (Н). Предшественники кардиомиоцитов (К), предшественники эндотелиоцитов (Э), сердечная трубка (СТ), дорсальный мезокард (ДМ). Рисунок выполнен на основе анализа снимков гистологических препаратов зародышей крыс линии Вистар (Suzuki et al., 1995).
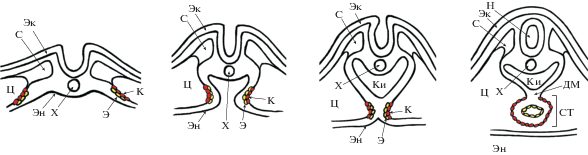
Формирование С-образной сердечной трубки
Мультипотентные клетки-предшественники в составе фарингеальной мезодермы формируют парное вторичное сердечное поле, расположенное медиальнее и дорсальнее латеральных участков первичного сердечного поля (Ivanovitch et al., 2017). Дифференцировка клеток вторичного сердечного поля регулируется транскрипционным фактором Isl1 (Moretti et al., 2006).
Клетки вторичного сердечного поля перемещаются к краниальному и каудальному концам прямой сердечной трубки и вносят вклад в формирование закладок миокарда предсердий, правого желудочка и выносящего тракта, а также образуют закладку эпикарда в каудальной части закладки сердца (Dodou et al., 2004). Не исключен также вклад неизвестного, отличного от вторичного сердечного поля, источника формирования закладки эпикарда. Закладка эпикарда представлена скоплением Wt1 и Scx-позитивных клеток, которые являются предшественниками мезотелиоцитов, фибробластов, гладких миоцитов и эндотелиоцитов сердца.
В результате присоединения клеток вторичного сердечного поля, прямая сердечная трубка трансформируется в С-образную сердечную трубку (Van Vliet et al., 2012). На закладке сердец крыс линии Спрег-Доули продемонстрировано, что C-образная сердечная трубка имеет справа выпуклую большую кривизну, слева – вогнутую меньшую кривизну, и бороздами разделена на отделы (рис. 2а). Каудальное положение занимает закладка предсердий, в которую впадают правый и левый рога венозного синуса. Краниальнее закладки предсердий последовательно расположены атрио-вентрикулярный отдел, закладка левого желудочка и закладка правого желудочка. Самое краниальное положение в С-образной сердечной трубке занимает артериальный конус (Marcela et al., 2012). Закладка сердца сохраняет связь с висцеральным листком спланхнотома посредством дорсального мезокарда. Между закладкой миокарда и закладкой эндокарда в составе прямой и С-образной сердечной трубки определяется сердечное желе (Козлов и др., 1995; Sedmera, McQuinn, 2008) – бесклеточный гелеобразный слой, содержащий тонкие переплетающиеся радиально направленные филаменты, прикрепляющиеся к базальным мембранам закладки миокарда и закладки эндокарда. Сердечное желе обеспечивает однонаправленный ток крови в трубчатом сердце (Manner, Yelbuz, 2019).
Рис. 2.
Формирование петли (а) и перегородок (б) в закладке сердца крысы. Венозный синус (С), закладка предсердий (П), закладка левого желудочка (ЛЖ), закладка правого желудочка (ПЖ), артериальный конус (АК), артериальный ствол (АС). Закладка миокарда (М), закладка эндокарда (Э), сердечное желе (Ж). Атрио-вентрикулярные эндокардиальные подушки (ЭП), эндокардиальные гребни аортального конуса (ЭГ), первичная предсердная перегородка (ПП), трабекулы закладки миокарда желудочков (Т). Рисунок выполнен на основе анализа сканирующих электронограмм и гистологических препаратов закладки сердца крыс линии Спрег-Доули (Marcela et al., 2012).
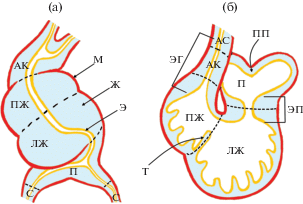
Формирование S-образной сердечной трубки
На 10 сут пренатального периода онтогенеза крыс происходит формирование петли закладки сердца, в результате чего она принимает вид S-образной трубки. Закладки предсердий смещаются дорсально и краниально, исчезает дорсальный мезокард, на вентральной стенке рогов венозного синуса определяются проэпикардиальные выпячивания (Marcela et al., 2012). Нокаут генов транскрипционных факторов Nkx2.5, MEF-2, Hand-1 и Hand-2 блокирует развитие сердца на стадии формирования петли (Van Vliet et al., 2012). Венозный синус и закладка предсердий у крыс в период формирования петли образованы слоем миокарда и эндокарда, между которыми практически отсутствует сердечное желе. Закладки миокарда и эндокарда атрио-вентрикулярного отдела, закладок желудочков и артериального конуса разделены выраженным слоем сердечного желе (Manner, Yelbuz, 2019). Образование петли сердца сопровождается увеличением частоты сокращений закладки сердца (Chacko, 1976). Начиная с 11 сут пренатального периода онтогенеза, сокращения закладки сердца являются ритмичными и эффективными.
Появление перегородок в закладке сердца и трабекуляция миокарда
На 11 сут пренатального периода онтогенеза в трубчатой закладке сердца у крыс формируются первичное межпредсердное отверстие, первичное межжелудочковое отверстие и закладка атрио-вентрикулрярных клапанов (рис. 2б). Край первичной предсердной перегородки и атрио-вентрикулярные эндокардиальные подушки ограничивают первичное межпредсердное отверстие (Rogers, Morse, 1986). Первичное межжелудочковое отверстие у крыс ограничено атрио-вентрикулярными эндокардиальными подушками и некоторыми трабекулами закладок миокарда желудочков (Marcela et al., 2012).
Первичная предсердная перегородка следует от дорсо-краниальной стенки закладки предсердий вентро-каудально (Rogers, Morse, 1986). Закладка первичной предсердной перегородки появляется в виде мышечного гребня стенки закладки предсердий, в области растущего края которого позднее появляется мезенхимный колпачок (Anderson et al., 2002). В формировании мезенхимного колпачка принимают участие эндотелиоциты, которые продуцируют компоненты межклеточного вещества и, претерпевая эпителио-мезенхимный переход, формируют мезенхимные клетки растущей первичной предсердной перегородки (Deepe et al., 2020).
Эндотелиоциты атрио-вентрикулярного отдела также претерпевают эпителио-мезенхимный переход и мигрируют в подлежащее сердечное желе, в результате чего формируются дорсальная и вентральная атрио-вентрикулярные эндокардиальные подушки (Manner, Yelbuz, 2019), которые являются первичными клапанами закладки сердца. Эпителио-мезенхимному переходу эндотелиоцитов способствуют трансформирующий фактор роста β, Notch1 и Wnt/β-катенин (Combs, Yutzey, 2009).
На 11 сут пренатального периода онтогенеза у крыс наблюдается трабекуляция миокарда желудочков (Marcela et al., 2012). Инвагинации закладки эндокарда погружаются в сердечное желе и достигают закладки миокарда, после чего под индукционным влиянием клеток закладки эндокарда, начинается перемещение предшественников кардиомиоцитов в сердечное желе (Manner, Yelbuz, 2019). В результате в закладках желудочков сердца крысы появляются рыхло расположенные миокардиальные трабекулы, выстланные закладкой эндокарда, а сердечное желе начинает редуцироваться. Показано, что взаимодействие предшественников эндотелиоцитов и предшественников кардиомиоцитов в ходе трабекуляции опосредуется Notch (Grego-Bessa et al., 2007). Деградация сердечного желе регулируется металлопротеиназой Adamts1, экспрессия которой клетками эндокарда находится под контролем Brg1 (Stankunas et al., 2008).
На 12 сут пренатального периода онтогенеза закладка сердца снаружи покрыта закладкой эпикарда. Клетки закладки эпикарда начинают погружаться в закладку миокарда и строму атрио-вентрикулярных эндокардиальных подушек (эпителио-мехзенхимный переход), причем вклад клеток эпикардиального происхождения в формирование разных створок клапанов сердца различен (Wessels et al., 2012).
На 13 сут пренатального периода онтогенеза у зародыша крысы в вентро-краниальной части первичной предсердной перегородки появляется вторичное межпредсердное отверстие в виде множественных перфораций, которые затем объединяются (Morse et al., 1984). Межжелудочковая перегородка объединяется с атрио-вентрикулярными эндокардиальными подушками, оба желудочка сообщаются с артериальным конусом первичным межжелудочковым отверстием (Marcela et al., 2012).
Появление артериального ствола в закладке сердца
Изучение кардиоморфогенеза крыс линии Спрег-Доули показало, что в закладке сердца на 11 сут пренатального периода онтогенеза появляется дистальный отдел выносящего тракта – артериальный ствол, образованный мезенхимой, выстланной предшественниками эндотелиоцитов (Marcela et al., 2012).
В области аортального конуса в сердечное желе погружаются мезенхимные клетки эндокардиального происхождения – формируются синистро-вентральный и декстра-дорсальный эндокардиальные гребни аортального конуса, служащие закладками артериальных клапанов сердца (Manner, Yelbuz, 2019).
Мезенхима нервного гребня участвует в образовании перегородки выносящего тракта сердца, а также дает начало клеткам вегетативных узлов сердца (Hildreth et al., 2008). Клетки нервного гребня, которые вносят вклад в формирование закладки сердца, экспрессируют Wnt1, Pax3 и Sox10 (Witman et al., 2020). Мезенхима артериального ствола и нервного гребня вносят вклад в формирование стенки крупных артерий, артериальных клапанов и фиброзного скелета сердца (Chan et al., 2004).
На 13 сут пренатального периода онтогенеза у зародыша крысы артериальный ствол трансформируется в заслонки артериальных клапанов (Marcela et al., 2012).
Компактизация миокарда
В закладках желудочков сердца крысы на 13 сут пренатального периода онтогенеза прогрессивно снижается объем сердечного желе, предшественники кардиомиоцитов устанавливают контакты друг с другом и со структурами закладки эндокарда. Помимо внутреннего трабекулярного слоя миокарда, в закладке сердца появляется наружный компактный слой миокарда (Козлов и др., 1995). Для обеспечения достаточного питания в утолщающемся миокарде желудочков зародышей крыс в результате васкуло- и ангиогенеза появляются кровеносные сосуды (Ratajska et al., 2003). В формировании сосудов сердца принимают участие клетки эпикардиального, эндокардиального и нейроэктодермального генеза (Chan et al., 2004; Чумасов и др., 2017).
Завершение формирования перегородок в закладке сердца
На 14 сут пренатального периода онтогенеза в сердце зародыша крысы в результате объединения дорсальной и вентральной атрио-вентрикулярных эндокардиальных подушек появляется атрио-вентрикулярная перегородка. У зародышей крыс линий Вистар (Wenink et al., 1996) и Спрег-Доули (Marcela et al., 2012) в закладке сердца на 14 сут пренатального периода онтогенеза начинают формироваться створки атрио-вентрикулярных клапанов, сухожильные нити и сосочковые мышцы. Вторичное межжелудочковое отверстие ограничено межжелудочковой перегородкой, правыми бугорками атрио-вентрикулярных эндокардиальных подушек и синистро-вентральным гребнем артериального конуса.
На 15 сут пренатального периода онтогенеза у зародыша крысы справа от первичной межпредсердной перегородки формируется вторичная межпредсердная перегородка и овальное отверстие (Rogers, Morse, 1986). Происходит окончательное разделение выносящего тракта сердца, вторичное межжелудочковое отверстие уменьшается, но сохраняется. Межжелудочковое отверстие закрывается на 16 сут пренатального периода онтогенеза крыс.
Заключительные этапы пренатального морфогенеза сердца
На 16 сут пренатального периода онтогенеза сердце зародыша крысы анатомически сформировано. Межжелудочковая перегородка представлена апикальной (трабекулярной, мышечной), средней и базальной (гладкие и компактные, перепончатые) зонами. У плодов крыс линии Вистар определяются все структуры проводящей системы сердца (van Kempen et al., 1991). Толщина стенки желудочков закладки сердца крысы на 18 сут пренатального периода онтогенеза в несколько раз превышает толщину стенки предсердий (рис. 3а). Продолжается утолщение стенки желудочков, преимущественно, за счет компактного слоя миокарда (Козлов и др., 1995). Толщина сосудистого сплетения, покрывающего закладку миокарда, возрастает, крупные вены и артерии сердца постепенно удлиняются, ветви кровеносных сосудов проникают вглубь миокарда (Ratajska et al., 2003). У крыс на 20–21 сут пренатального периода онтогенеза локализация артерий и вен сердца аналогична таковой у половозрелых крыс (Ratajska et al., 2003).
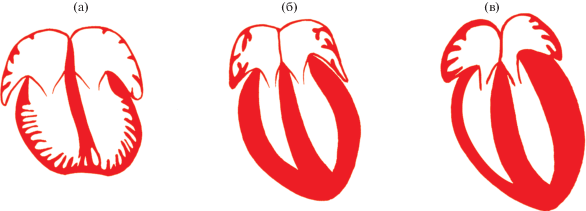
Рис. 3.
Сравнительная морфология сердца крысы в различные периоды онтогенеза. Сердце крысы на 19 сутки пренатального периода онтогенеза (а), 1 сут постнатального периода онтогенеза (б) и 7 сут постнатального периода онтогенеза (в). Рисунок выполнен на основе результатов изучения гистологических препаратов сердца плодов крыс, новорожденных крыс и крыс-сосунов линии Вистар (собственные наблюдения авторов).
Пик пролиферативной активности кардиомиоцитов крыс приходится на 18 сут пренатального периода онтогенеза (Загоруйко и др., 2019). Изучение пренатального развития сердца у плодов крыс линий Спрег-Доули (Bishop et al., 1990) и Вистар (Загоруйко и др., 2019) свидетельствует о том, что на 17–20 сут пренатального периода онтогенеза наблюдается значительное увеличение размеров сердца (табл. 2). Общий объем сердца крыс линии Спрег-Доули увеличивается с 2.9 мм3 на 15 сут пренатального периода онтогенеза до 33.2 мм3 на 22 сут пренатального периода онтогенеза (Markel et al., 2020). Стоит отметить, что авторы зачастую не дают подробного описания методики препаровки сердца перед измерением, что может быть причиной различий морфометрических показателей сердца крыс, полученных разными исследовательскими группами.
Таблица 2.
Динамика морфометрических показателей сердца плодов крыс на примере крыс линии Вистар (Clark, 1973; Ito et al., 1998, 2001)
| Срок пренатального периода онтогенеза, сутки | Масса сердца, мг | Толщина стенки левого желудочка, мм | Площадь митрального клапана, мм2 | Площадь аортального клапана, мм2 |
|---|---|---|---|---|
| 16 | 2.7 | – | – | – |
| 18 | 4.0 | 0.35 | 0.26 | 0.05 |
| 20 | 11.7 | 0.45 | 0.28 | 0.12 |
| 22 | 25.9 | 0.50 | 0.50 | 0.26 |
Преобразование эндокарда закладки сердца крыс
Закладка эндокарда отличима от закладки миокарда уже на стадии прямой сердечной трубки как по локализации, так и по экспрессии клетками специфических маркеров, таких как CD31, VE-кадгерин, VEGFR2 (Drake, Fleming, 2000). Исследование закладок сердца зародышей крыс линии Вистар показало, что закладка эндокарда у крысы во всех отделах прямой и С-образной сердечной трубки имеет одинаковое строение. Клетки закладки эндокарда плотно прилежат друг к другу, вдаются в просвет сердечной трубки, придавая эндокарду вид булыжной мостовой. Клетки закладки эндокарда содержат сферическое крупное ядро с преобладанием эухроматина и 1–2 ядрышками, а также выраженный белок-синтетический аппарат (Markwald et al., 1975).
Различия в строении клеток закладки эндокарда появляются с началом септации закладки сердца и зависят от локализации клеток. Клетки закладки эндокарда предсердий и желудочков постепенно уплощаются, в дальнейшем их структура практически не изменяется. Уплощенные клетки, выстилающие полости предсердий и желудочков, являются предшественниками эндотелиоцитов эндокарда.
Напротив, клетки закладки эндокарда, выстилающие атрио-вентрикулярный отдел и артериальный конус, приобретают овоидную форму, некоторые из них имеют направленные в сердечное желе филоподии, а в их цитоплазме развит гранулярный эндоплазматический ретикулум и пластинчатый комплекс (Markwald et al., 1975). Часть клеток закладки эндокарда, выстилающих артио-вентрикулярный отдел и артериальный конус, погружается в сердечное желе и участвует в формировании стромы атрио-вентрикулярных эндокардиальных подушек и эндокардиальных гребней артериального конуса (Manner, Yelbuz, 2019). Не погружающиеся в сердечное желе клетки закладки эндокарда атрио-вентрикулярных эндокардиальных подушек и эндокардиальных гребней аортального конуса постепенно уплощаются, и, начиная с 13 сут пренатального периода онтогенеза, не отличаются от эндотелиоцитов эндокарда предсердий и желудочков (Markwald et al., 1975). Уплощенные клетки, выстилающие атрио-вентрикулярные эндокардиальные подушки и эндокардиальные гребни аортального конуса, являются предшественниками эндотелиоцитов клапанов сердца.
Преобразование миокарда закладки сердца крыс
Предшественники кардиомиоцитов в закладке сердца идентифицируются, начиная с 9.5 сут пренатального периода онтогенеза, по экспрессии α‑SMA, α и β тяжелых цепей миозина (Ya et al., 1997). На 9.5 сут пренатального периода онтогенеза в закладке миокарда крыс линии Спрег-Доули впервые выявляются диффузно расположенные HNK-1-позитивные клетки, представляющие собой предшественники проводящих кардиомиоцитов (Nakagawa et al., 1993). На 12 сут пренатального периода онтогенеза в закладке сердца крыс выявляются диффузно расположенные секреторные кардиомиоциты, содержащие предсердный натрийуретический пептид (Navaratnam et al., 1989).
На стадии прямой и С-образной сердечной трубки закладки миокарда предсердий и желудочков крыс морфологически неотличимы и состоят из 1–2 слоев рыхло расположенных предшественников кардиомиоцитов. Это одноядерные клетки, обеспечивающие сердцебиение: в их цитоплазме обнаруживаются отдельные короткие неупорядоченные миофибриллы. Митохондрии в предшественниках кардиомиоцитов имеют незначительное количество крист, канальцы агранулярного эндоплазматического ретикулума практически не выявляются (Козлов и др., 1995). Начиная с 10 сут пренатального периода онтогенеза, на предшественниках кардиомиоцитов крыс линии Спрег-Доули выявляется коннексин 43. Коннексины диффузно распределены в плазмолемме кардиомиоцитов, их количество прогрессивно увеличивается в ходе пренатального периода онтогенеза (Gourdie et al., 1992).
Закладки миокарда предсердий и миокарда желудочков у эмбрионов крыс начинают отличаться на 11 сут пренатального периода онтогенеза, с началом трабекуляции миокарда желудочков. Ядра предшественников кардиомиоцитов на этой стадии светлые, с крупным ядрышком, а в их цитоплазме определяются полисомы и трофические включения. Миофибриллы увеличиваются в длину и ориентированы под углом друг к другу на периферии цитоплазмы кардиомиоцита (Bishop et al., 1990; Козлов и др., 1995). Предшественники проводящих кардиомиоцитов предсердно-желудочкового пучка определяются вдоль вентрикулярных миокардиальных трабекул, формирующих первичную межжелудочковую перегородку (Nakagawa et al., 1993; Liang et al., 2013).
Показано, что закладка миокарда предсердий у крыс линии Вистар на 12 сут пренатального периода онтогенеза состоит из 4–8 слоев рыхло расположенных сферических предшественников кардиомиоцитов, тогда как закладка миокарда желудочков состоит из 8–10 слоев округлых или овальных предшественников кардиомиоцитов, формирующих трабекулярную сеть (Seki et al., 2003). Впервые в некоторых предшественниках кардиомиоцитов появляются секреторные везикулы, содержащие предсердный натрийуретический пептид. Секреторные кардиомиоциты диффузно расположены в миокарде закладки сердца (Navaratnam et al., 1989). В закладке сердца у зародышей крыс линии Спрег-Доули на 12.5 сут пренатального периода онтогенеза определяются правая и левая ножки предсердно-желудочкового пучка. Клетки нервного гребня образуют закладку синусно-предсердного узла (Nakagawa et al., 1993).
На 13 сут пренатального периода онтогенеза в закладке миокарда желудочков различают темные и светлые предшественники кардиомиоцитов (Козлов и др., 1995). Светлые предшественники кардиомиоцитов активно сокращаются и пролиферируют (Загоруйко, Загоруйко, 2017). Темные предшественники кардиомиоцитов являются функциональным резервом, активирующимся к рождению крысы. Изучение популяций предшественников кардиомиоцитов у зародышей крыс Вистар показало, что темные и светлые предшественники кардиомиоцитов способны к взаимному превращению (Загоруйко, Загоруйко, 2018). Светлые и темные предшественники кардиомиоцитов обладают различной чувствительностью к действию повреждающих факторов (Ямщикова, 2004).
На 14 сут пренатального периода онтогенеза предшественники секреторных кардиомиоцитов определяются в предсердиях и в желудочках, их ультраструктура свидетельствует о высокой синтетической активности (Shevchenko, 2019). В соединительной ткани закладки миокарда определяются низкодифференцированные фибробласты и пучки коллагеновых волокон (Загоруйко, Загоруйко, 2018).
На 18 сут пренатального периода онтогенеза миокард предсердий плодов крыс образован 2–3 слоями кардиомиоцитов. В их цитоплазме определяются пучки миофибрилл, митохондрии, синтетический аппарат.
Миокард желудочков крыс представлен тремя разнонаправленными слоями кардиомиоцитов (Козлов и др., 1995). Кардиомиоциты желудочков крыс на данном сроке имеют вытянутую форму (Seki et al., 2003) и плотно прилежат друг к другу, миофибриллы в них занимают значительный объем цитоплазмы, однако расположены неупорядоченно, саркомеры имеют типичную ультраструктуру (Wenink et al., 1996). Митохондрии в предшественниках кардиомиоцитов преимущественно локализованы перинуклеарно (Козлов и др., 1995). У плодов крыс линии Спрег-Доули накопление секреторных везикул в секреторных кардиомиоцитах желудочков крыс происходит до конца пренатального периода онтогенеза, однако, их количество гораздо меньше, чем в кардиомиоцитах предсердий (Lam et al., 2002). Наибольшее количество секреторных везикул с предсердным натрийуретическим пептидом показано в кардиомиоцитах внутреннего слоя миокарда ушек предсердий. В желудочках секреторные везикулы с предсердным натрийуретическим пептидом определяются в субэндокардиально расположенных кардиомиоцитах межжелудочковой перегородки и в основании сосочковых мышц (Thompson et al., 1989).
Начиная с 20 сут пренатального периода онтогенеза, в миокарде крыс определяются единичные двуядерные кардиомиоциты (Загоруйко, Загоруйко, 2017).
Таким образом, дифференцировка предшественников кардиомиоцитов в ходе пренатального периода онтогенеза заключается в увеличении в них количества органелл, уменьшении удельного объема трофических включений и усложнении организации клеточных контактов.
Кардиомиоциты крыс в пренатальном периоде онтогенеза имеют метаболические особенности: основным энергетическим субстратом кардиомиоцитов является глюкоза, что объясняет высокую активность гликолитических ферментов в них в этот период. К моменту рождения активность гексокиназы в кардиомиоцитах снижается, тогда как активность α-глицерофосфатдегидрогеназы, АТФазы, цитратсинтазы, сукцинатдегидрогеназы, митохондриальной и цитоплазматической креатинкиназы, напротив, возрастает. Показано, что у плодов крыс линий Спрег-Доули и Вистар в предшественниках кардиомиоцитов экспрессируются β-МНС (β-myosin heavy chain – β‑тяжeлая цепь миозина) и ssTnI (slow skeletal muscle troponin I – тропонин I медленных скелетных мышц) (Andrés et al., 1984; Lam et al., 2002). Выраженное изменение электрофизиологических свойств кардиомиоцитов предсердий и желудочков крыс наблюдается после 19 суток пренатального периода онтогенеза (Couch et al., 1969). Экспрессия Na+,Ca2+-обменника возрастает в ходе эмбриогенеза, достигая максимальных значений на 18 сут пренатального периода онтогенеза крыс (Koban et al., 1998). Напротив, экспрессия Са2+-АТФазы мембраны саркоплазматического ретикулума у плодов крыс снижена, по сравнению с новорожденными и половозрелыми крысами (Ribadeau-Dumas et al., 1999).
Структурные и метаболические преобразования кардиомиоцитов в ходе пренатального периода онтогенеза приводят к улучшению сократительной функции миокарда.
Преобразование эпикарда закладки сердца крыс
Изучение сердец эмбрионов крыс линии Спрег-Доули показало, что к 13.5 сут пренатального периода развития закладка эпикарда полностью покрывает закладку сердца. Закладка эпикарда образована эпителиальными клетками и подлежащим слоем межклеточного вещества. На 13.5 сут пренатального периода онтогенеза большинство эпителиоцитов, образующие закладку эпикарда, имеют уплощенную форму с небольшим количеством микроворсинок на апикальном полюсе. Также в составе закладки эпикарда, главным образом, в области атрио-вентрикулярной перегородки, определяются сферические клетки. В области атрио-вентрикулярной перегородки сердца клетки закладки эпикарда претерпевают эпителио-мезенхимный переход и мигирируют в субэпикардиальный слой (Nesbitt et al., 2006). Изучение пренатального кардиоморфогенеза крыс линии Вистар показало, что клетки закладки эпикарда дают начало фибробластам соединительной ткани сердца и гладким миоцитам стенки кровеносных сосудов сердца (Чумасов и др., 2017). Клетки закладки эпикарда, покрывающие сердце снаружи, являются предшественниками мезотелиоцитов эпикарда.
РАЗВИТИЕ СЕРДЦА КРЫСЫ В ПОСТНАТАЛЬНОМ ПЕРИОДЕ ОНТОГЕНЕЗА
Переход от пренатального развития к жизни вне утробы матери сопровождается сменой плацентарного газообмена легочным. Функциональное закрытие артериального протока у крыс происходит в первые часы, венозного протока – на 2 день, овального отверстия – на 3 день постнатального периода онтогенеза (Greeley, White-Hunt, 2016). Структурное и функциональное созревание сердца продолжаются у крыс до периода половой зрелости. Структурные перестройки сердца половозрелых крыс связаны, в основном, с продолжающимся ростом животных и увеличением гемодинамической нагрузки на сердце. Кроме того, известен модулирующий эффект половых гормонов на морфо-функциональное состояние сердца (Forman et al., 1997).
Строение сердца неполовозрелых крыс
К рождению крысы толщина стенки предсердий значительно меньше, чем желудочков. Толщина стенок левого желудочка, правого желудочка и межжелудочковой перегородки примерно одинакова (рис. 3б). С изменением гемодинамических условий после рождения, нагрузка на сердце возрастает, что приводит к интенсивному росту миокарда (табл. 3), главным образом, левого желудочка (рис. 3в) (Anversa et al., 1980). Однако, в первые сутки постнатального периода онтогенеза масса крыс и их сердца не только не возрастает, но и может несколько снижаться. Предсосный период у крыс, соответствующий первым 6 ч после рождения, характеризуется адаптацией животного к новым условиям существования (прекращение плацентарного питания, высокое парциальное давление кислорода во вдыхаемом воздухе, непостоянная температура окружающей среды) и длится до начала питания материнским молоком. Таким образом, крысы в первые часы постнатального периода онтогенеза не получают питательных веществ, с чем связывают наблюдаемую, в том числе в кардиомиоцитах, активацию процессов аутофагии (Ošt'ádalová, Babický, 2012).
Таблица 3.
Динамика морфометрических показателей сердца крыс в постнатальном периоде развития на примере крыс линии Спрег Доули (Harmon et al., 1986; Jurado et al., 2013; Piao et al., 2013; Gear et al., 2017: Xue et al., 2019)
| Срок постнатального периода онтогенеза, сутки | Отношение массы сердца к массе тела, мг/г | Масса сердца, мг | Толщина стенки левого желудочка, мм | |||
|---|---|---|---|---|---|---|
| самцы | самки | самцы | самки | самцы | самки | |
| 2 | 7.1 | 61 | – | |||
| 7 | 6.0 | 71.2 | – | |||
| 15 | 5.7 | 135.0 | – | |||
| 21 | 4.8 | 300 | 1.85 | |||
| 90 | 3.3 | 3.6 | 1440 | 990 | 2.57 | 2.50 |
| 180 | 2.8 | 3.1 | 1620 | 1100 | 2.60 | 2.30 |
С момента рождения до 8 сут постнатального периода онтогенеза масса правого желудочка по отношению к массе тела практически не изменяется, тогда как масса левого желудочка по отношению к массе тела после рождения прогрессивно увеличивается. К концу первой недели постнатального периода онтогенеза у крыс линий Вистар (Anversa et al., 1980) и Спрег-Доули (Greeley, White-Hunt, 2016) толщина стенки левого желудочка сердца у крыс превышает толщину стенки правого желудочка в три раза. Площадь створок и заслонок клапанов увеличивается соответственно росту сердца (Greeley, White-Hunt, 2016).
Преобразование эндокарда неполовозрелых крыс
Клапаны сердца новорожденных крыс образованы тонким слоем базофильного межклеточного матрикса, в который погружено множество низкодифференцированных клеток. Клапаны выстланы одним слоем эндотелиоцитов. Эндотелиоциты, выстилающие камеры сердца, являются функционально незрелыми клетками (Чумасов и др., 2018).
С 14 сут постнатального периода онтогенеза у крыс клеточность соединительнотканной основы клапанов сердца прогрессивно уменьшается, а плотность коллагеновых и эластических волокон – увеличивается (Greeley, White-Hunt, 2016). Структурное развитие клапанов сердца у крыс завершается к 35 дню постнатального периода онтогенеза.
Преобразование миокарда неполовозрелых крыс
В миокарде крыс на 1 сут постнатального периода онтогенеза численно преобладающей популяцией клеток являются кардиомиоциты (62% от всех клеток) (Banerjee et al., 2007). Среди них доля темных кардиомиоцитов составляет 41%, однако в течение первой недели постнатального периода онтогенеза их количество стремительно уменьшается за счет перехода от физиологического покоя к сократительной активности (Загоруйко, Загоруйко, 2017). Отдельные кардиомиоциты желудочков крыс в пренатальном и неонатальном периодах онтогенеза имеют первичную ресничку. Вероятно, первичная ресничка имеет значение в регуляции кальциевого гомеостаза кардиомиоцитов исключительно на этапе развития сердца (Kaur et al., 2018). На 11 сут постнатального периода онтогенеза кардиомиоциты правого и левого желудочков у крыс линии Вистар морфологически неразличимы, также отсутствуют различия в организации субэндокардиальных и субэпикардиальных участков миокарда желудочков (Olivetti et al., 1980). В миокарде предсердий и желудочков новорожденных крыс активно протекает ангиогенез (Чумасов и др., 2018).
Быстрое увеличение массы миокарда у крыс наблюдается с 1 по 14 сут постнатального периода онтогенеза, после чего процесс продолжается медленнее до 42 сут (Greeley, White-Hunt, 2016). В постнатальном периоде онтогенеза увеличение массы миокарда у крыс происходит по гиперпластическому и гипертрофическому типам (Clubb, Bishop, 1984; Li et al., 1996).
Гиперпластический тип роста миокарда у крыс наблюдается на 1–3 сут постнатального периода онтогенеза и заключается в увеличении количества кардиомиоцитов в результате их деления. Количество кардиомиоцитов в течение первых трех дней постнатального периода онтогенеза у крыс линии Спрег-Доули увеличивается на 68% и после остается постоянным (Li et al., 1996). Миокард в этот период образован одноядерными кардиомиоцитами с центральным расположением ядра, перинуклеарной локализацией митохондрий и субплазмолеммальным расположением миофибрилл (Bishop et al., 1990; Иванченко, Твердохлеб, 2014). Размер кардиомиоцитов, а также удельный объем митохондрий и миофибрилл в их цитоплазме превышает аналогичные показатели кардиомиоцитов плодов крыс. Миофибриллы расположены более упорядоченно вдоль длинной оси кардиомиоцитов. С 1 по 3 сут постнатального периода онтогенеза у крыс значительно увеличивается количество нексусов и десмосом между кардиомиоцитами (Козлов и др., 1995). Нексусы не имеют четкой локализации, а диффузно расположены в плазмолемме кардиомиоцитов (Gourdie et al., 1992). В кардиомиоцитах предсердий количество секреторных везикул с предсердным натрийуретическим пептидом ниже, чем в поздний плодный период, в кардиомиоцитах желудочков они не определяются (Navaratnam et al., 1989). Показано увеличение содержания предсердного натрийуретического пептида в секреторных кардиомиоцитах предсердий крыс линии Спрег-Доули с 3 по 21 сут постнатального периода онтогенеза (Wei et al., 1987).
Гипертрофический тип роста миокарда у крыс наблюдается, начиная с 4 сут постнатального периода онтогенеза. Кардиомиоциты крыс теряют способность завершать цитокинез на 3–4 сут после рождения животного: полноценные митозы сменяются эндомитозом, в результате которого образуются двуядерные кардиомиоциты (Clubb, Bishop, 1984; Li et al., 1997). Показано, что к 12 сут постнатального периода онтогенеза у крыс линии Спрег-Доули доля двуядерных кардиомиоцитов достигает 90% (Li et al., 1996). После 15 сут постнатального периода онтогенеза у крыс линии Вистар общее количество кардиомиоцитов и доля двуядерных кардиомиоцитов остаются постоянными (Загоруйко и др., 2019).
Кардиомиоциты желудочков крыс на 6–12 сут постнатального периода онтогенеза представляют собой клетки вытянутой формы, содержащие одно или два центрально расположенных ядра. В цитоплазме кардиомиоцитов крыс линии Спрег-Доули миофибриллы занимают периферическое положение, многочисленные митохондрии – центральное (Bishop et al., 1990). На кардиомиоцитах беспородных крыс показано постепенное увеличение количества межмиофибриллярных митохондрий (Иванченко, Твердохлеб, 2014). На 6–9 сут постнатального периода онтогенеза в кардиомиоцитах крыс впервые визуализируются короткие Т-трубочки. К 14–15 сут постнатального периода онтогенеза в кардиомиоцитах крыс линии Вистар значительно усложняется система Т‑трубочек, которые проникают вглубь цитоплазмы (Seki et al., 2003). Поперечная исчерченность саркоплазмы кардиомиоцитов крыс полностью формируется к 21 сут после рождения. К этому же времени удельный объем митохондрий достигает величины, характерной для кардиомиоцитов взрослых крыс (Козлов и др., 1995). Изоформы ферментов и их активность в кардиомиоцитах крыс линий Вистар и Спрег-Доули на 21 сут после рождения аналогичны таковым у взрослых крыс (Andrés et al., 1984; L’Ecuyer et al., 1991; Lam et al., 2002). Экспрессия коннексина 43 сократительными кардиомиоцитами крыс линии Спрег-Доули достигает максимума к 21 сут постнатального периода онтогенеза, после чего наблюдается трехкратное снижение данного показателя к 45 сут постнатального периода онтогенеза (Gourdie et al., 1992). Изменение экспрессии коннексина 43 сопряжено с перераспределением нексусов в плазмолемме сократительных кардиомиоцитов и формированием вставочных дисков в постнатальном периоде онтогенеза (van Kempen et al., 1991; Gourdie et al., 1992).
Исследования сердца крыс линий Спрег-Доули и Вистар показали, что на 28 сут постнатального периода онтогенеза кардиомиоциты отличаются от таковых у половозрелых крыс только меньшими размерами. Ядра кардиомиоцитов в этот срок занимают центральное положение, миофибриллы равномерно распределены в цитоплазме, митохондрии располагаются вдоль саркомеров, Т‑трубочки представляют собой сложную развитую систему (Bishop et al., 1990; Seki et al., 2003). Гипертрофия кардиомиоцитов у крыс с 28 по 42 сут постнатального периода онтогенеза заключается в увеличении размеров клеток (Iliev et al., 2018), тогда как их ультраструктурная организация практически не изменяется (Greeley, White-Hunt, 2016). Размер кардиомиоцитов и их ядер прогрессивно увеличиваются, что объясняется полиплоидизацией без кариокинеза, и стабилизируется к 45 сут (Загоруйко, Загоруйко, 2017).
Преобразование эпикарда неполовозрелых крыс
Эпикард сердца крысы на 1 сут постнатального периода онтогенеза образован слоем гетерогенных по форме и размеру мезотелиоцитов, лежащих на субмезотелиальном слое (Чумасов и др., 2017). Для новорожденных крыс характерна субэпикардиальная локализация вегетативных нервных узлов и сплетений в предсердиях и желудочках, тогда как иннервация миокарда развита незначительно (Чумасов и др., 2009).
СТРОЕНИЕ СЕРДЦА ПОЛОВОЗРЕЛЫХ КРЫС
Крысы достигают половой зрелости к 60 сут постнатального периода развития, однако рост животных и увеличение размеров сердца продолжается и в пубертатный период (табл. 3). Строение сердца крыс аналогично таковому у человека (Buetow, Laflamme, 2018), однако имеет некоторые видовые особенности.
В частности, у крыс правый и левый атрио-вентрикулярные клапаны не имеют четкого разделения створок. Сухожильные нити, прикрепляющиеся к створкам атрио-вентрикулярных клапанов, следуют от свободного конца сосочковых мыщц или непосредственно от стенки желудочка (Buetow, Laflamme, 2018).
Проводящая система сердца крыс подробно описана у половозрелых крыс линий Вистар и Спрег-Доули. Синусно-предсердный узел у крыс локализован в стенке правого предсердия, вдоль артерии синусно-предсердного узла (Buetow, Laflamme, 2018), предсердно-желудочковый узел – в нижней части межпредсердной перегородки (Mochet et al., 1975). Предсердно-желудочковый пучок и ножки предсердно-желудочкового пучка следуют в межжелудочковой перегородке. Терминальным компонентом проводящей системы сердца являются субэндокардиальная проводящая сеть, локализованная под эндокардом желудочков. Миокард предсердий в области атрио-вентрикулярного соединения представляет собой правое и левое кольца проводящей системы сердца крыс. На основании сердца в области межпредсердной перегородки расположен ретроаортальный узел. Не доказан вклад ретроаортального узла, левого и правого колец проводящей системы сердца в нормальное функционирование сердца крыс (Atkinson et al., 2013).
Строение эндокарда половозрелых крыс
У половозрелых крыс эндокард представлен одним слоем эндотелиоцитов и тонким соединительнотканным субэндотелиальным слоем, более выраженным в предсердиях, нежели в желудочках (Buetow, Laflamme, 2018). У половозрелых крыс эндотелиоциты, выстилающие полости предсердий и желудочков, являются уплощенными клетками с гладкой люминальной поверхностью. В эндотелиоцитах, выстилающих клапаны сердца, наблюдаются признаки высокой секреторной активности (Чумасов и др., 2019). В основании клапана строма представлена плотной оформленной соединительной тканью, тогда как строма апикальной части клапана сформирована менее упорядоченной, богатой основным аморфным веществом соединительной тканью.
Строение миокарда половозрелых крыс
В миокарде половозрелых крыс линии Вистар до 96% кардиомиоцитов – двуядерные клетки (Bensley et al., 2016; Загоруйко и др., 2019). Митохондрии зрелого кардиомиоцита занимают 30–40% объема клетки и формируют кластеры, объединенные межмитохондриальными контактами (Иванченко, Твердохлеб, 2014). Секреторные кардиомиоциты у половозрелых крыс локализуются исключительно в предсердиях, процессы синтеза, накопления и высвобождения секреторных везикул в них сбалансированы (Shevchenko, 2019).
В миокарде у половозрелых крыс кардиомиоциты преобладают по объему, но не по численности, составляя 30% клеток миокарда. Среди других типов клеток выявляются эндотелиоциты (64%), фибробласты (27%) и лейкоциты (9%) (Guo, Pu, 2020). Эндомизий миокарда представлен коллагеновыми волокнами, окружающими отдельные кардиомиоциты, перимизий миокарда представляет собой более выраженную сеть коллагеновых волокон, окружающую группы кардиомиоцитов. У беспородных крыс удельный объем клеток и волокон соединительной ткани в предсердиях преобладает над таковым в желудочках (Павлович и др., 2007). Соединительная ткань миокарда богата кровеносными капиллярами (Buetow, Laflamme, 2018).
Проводящая система сердца крыс образована нодальными проводящими кардиомиоцитами, переходными проводящими кардиомиоцитами и миоцитами Пуркинье. Нодальные проводящие кардиомиоциты – это мелкие одноядерные веретеновидные клетки, в цитоплазме которых определяются неупорядоченно расположенные миофибриллы, митохондрии, выраженный пластинчатый комплекс, саркоплазматический ретикулум. У крыс линии Вистар Т-трубочки у нодальных кардиомиоцитов отсутствуют (Волкова и др., 2011). Переходные проводящие кардиомиоциты – это более крупные клетки полигональной формы, имеющие одно крупное центрально расположенное ядро и немногочисленные миофибриллы. Сарколемма переходных проводящих кардиомиоцитов образует широкие инвагинации (Mochet et al., 1975). Миоциты Пуркинье – это крупные овальные клетки, которые по размеру превосходят переходные проводящие кардиомиоциты. У беспородных крыс миоциты Пуркинье характеризуются центральным расположением ядра и эозинофилией цитоплазмы без поперечной исчерченности (Павлович, 2007).
Нодальные и переходные проводящие кардиомиоциты располагаются в узлах проводящей системы сердца крысы небольшими группами, окруженными соединительной тканью (Волкова и др., 2011). Предсердно-желудочковый пучок образован переходными проводящими кардиомиоцитами и миоцитами Пуркинье, расположенными параллельно его продольной оси. Соединительная ткань локализована на периферии предсердно-желудочкового пучка (Buetow, Laflamme, 2018). Субэндокардиальная проводящая сеть сформирована миоцитами Пуркинье.
Строение эпикарда половозрелых крыс
Эпикард у половозрелых крыс образован слоем мезотелия и незначительным количеством подлежащей соединительной ткани (Buetow, Laflamme, 2018).
У половозрелых крыс определяются эндокардиальное, миокардиальное и эпикардиальное нервные сплетения. Афферентные нервные волокна обнаруживаются во всех оболочках сердца. Терминали эфферентных нервных волокон локализованы, преимущественно, в местах впадения в предсердия или выхода из желудочков кровеносных сосудов, а также в миокарде предсердий, миокарде передней и задней стенок желудочков. В области верхушки сердца в миокарде плотность терминалей эффекторных нервных волокон низкая (Чумасов и др., 2009).
ЗАКЛЮЧЕНИЕ
Таким образом, развитие сердца у крыс в целом аналогично таковому у человека (Buetow, Laflamme, 2018), однако, имеет ряд особенностей, которые следует учитывать при интерпретации результатов экспериментальных исследований.
1. У крыс пик пролиферативной активности кардиомиоцитов приходится на поздние этапы пренатального периода онтогенеза, тогда как у человека кардиомиоциты прекращают делиться к концу пренатального периода развития (Xavier-Vidal et al., 1995).
2. Переход с гиперпластического типа роста миокарда на гипертрофический тип у крыс наблюдается на 4 сутки постнатального периода онтогенеза, тогда как у человека происходит еще внутриутробно (Xavier-Vidal et al., 1995).
3. В отличие от миокарда человека, в котором определяются одноядерные полиплоидные кардиомиоциты (Bergmann et al., 2015), в миокарде крыс гипертрофический тип роста миокарда заключается в появлении двуядерных кардиомиоцитов.
4. В составе эпикарда крыс, в отличие от такового у человека, отсутствуют или немногочисленны адипоциты. Это может быть связано с тем, что венечные артерии в сердце крыс локализуются не в толще эпикарда, как у человека, а интрамиокардиально.
5. Субэндокардиальная основа у крыс имеет незначительную толщину, в сравнении с таковой в эндокарде человека.
6. Атрио-вентрикулярные клапаны у крыс не имеют четкого разделения на створки, а у человека четко определяются две створки в составе левого атрио-вентрикулярного клапана и три створки в составе правого атрио-вентрикулярного клапана.
Структурно-функциональные особенности сердца крыс в различные периоды онтогенеза необходимо учитывать при интерпретации результатов экспериментальных исследований.
Список литературы
Абрашова Т.В., Гущин Я.А., Ковалева М.А. и др. Доклинические исследования. Справочник: Физиологические, биохимические и биометрические показатели нормы экспериментальных животных / Под ред. Макарова В.Г., Макаровой М.Н. / СПб.: Изд-во “ЛЕМА”, 2013. 116 с.
Волкова О.В., Тихонова Т.А., Илларионова Н.Г. и др. Цитоархитектоника синусно-предсердного узла сердца крысы // Ученые записки СПбГМУ им. И.П. Павлова. 2011. № 2. С. 44–45.
Загоруйко Г.Е., Загоруйко Ю.В. Возрастные изменения размеров и числа кардиомиоцитов, их ядер в процессе пренатального и раннего постнатального развития сердца крыс // Вестник проблем биологии и медицины. 2017. Т. 3. № 4. С. 304–311.
Загоруйко Г.Е., Загоруйко Ю.В., Филатова В.Л. Морфометрическая характеристика популяций кардиомиоцитов образующих паренхиму миокарда в процессе постнатального кардиомиогенеза // Вестник проблем биологии и медицины. 2018. Т. 2. № 4. С. 282–286.
Загоруйко Ю.В., Загоруйко Г.Е., Марциновский В.П. и др. Закономерности кардиомиогенеза у крыс Wistar: рост суммарной численности кардиомиоцитов и образование популяции двуядерных миоцитов в паренхиме миокарда комплекса (ЛЖ + МЖП) // Вестник проблем биологии и медицины. 2019. Т. 2. № 1. С. 70–74.
Иванченко М.В., Твердохлеб И.В. Характер образования межмитохондриальных контактов в процессе онтогенетического формирования митохондриального аппарата в норме и в условиях гипоксического повреждения кардиогенеза // Российский медико-биологический вестник им. акад. И.П. Павлова. 2014. № 2. С. 10–17.
Козлов В.А., Твердохлеб И.В., Шпонька И.С. и др. Морфология развивающегося сердца (структура, ультраструктура, метаболизм). Днепропетровск: Днепропетровская государственная медицинская академия, 1995. 220 с.
Павлович Е.Р., Писцова Т.В., Федосеев В.А. Сравнительный количественый анализ соединительно-тканного компонента рабочего миокарда правого предсердия и левого желудочка сердца интактной крысы // Современные наукоемкие технологии. 2007. № 5. С. 73–74.
Павлович Е.Р. Электронно-микроскопическое исследование ножек пучка Гиса в сердце интактной крысы // Современные наукоемкие технологии. 2007. № 10. С. 78–79.
Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Иннервация сердца крысы (иммуногистохимическое исследование) // Морфология. 2009. Т. 135. № 2. С. 33–37.
Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Изучение строения развивающегося эпикарда и особенностей васкуляризации в сердце новорожденных крыс // Актуальные вопросы ветеринарной биологии. 2017. № 2(34). С. 12–18.
Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Структурно-функциональная характеристика эндотелиальных клеток сосудов сердца новорожденной крысы (иммуногистохимическое исследование) // Регионарное кровообращение и микроциркуляция. 2018. Т. 17(2). С. 80–85.
Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Структурные и функциональные особенности эндотелия сосудов сердца половозрелых крыс по данным иммуногистохимического исследования // Регионарное кровообращение и микроциркуляция. 2019. Т. 18(2). С. 70–77.
Ямщикова Е.Н. Морфологическая характеристика реактивных изменений сердечной мышечной ткани в условиях экспериментально измененного гистогенеза: Автореф. дис. … канд. мед. наук. Оренбург: Сам. гос. мед. ун-т, 2004, 22 с.
Anderson R.H., Brown N.A., Webb S. Development and structure of the atrial septum // Heart. 2002. V. 88(1). P. 104–110.
Andrés A., Satrústegui J., Machado A. Development of enzymes of energy metabolism in rat heart // Biol. Neonate. 1984. V. 45(2). P. 78–85.
Anversa P., Olivetti G., Loud A.V. Morphometric study of early postnatal development in the left and right ventricular myocardium of the rat. I. Hypertrophy, hyperplasia, and binucleation of myocytes // Circ. Res. 1980. V. 46(4). P. 495–502.
Atkinson A.J., Logantha S.J., Hao G. et al. Functional, anatomical, and molecular investigation of the cardiac conduction system and arrhythmogenic atrioventricular ring tissue in the rat heart // J. Am. Heart Assoc. 2013. V. 2(6):e000246.
Baldwin H.S., Jensen K.L., Solursh M. Myogenic cytodifferentiation of the precardiac mesoderm in the rat // Differentiation. 1991. V. 47(3). P. 163–172.
Banerjee I., Fuseler J.W., Price R.L. et al. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse // Am. J. Physiol. Heart Circ. Physiol. 2007. V. 293(3). P. H1883–H1891.
Bensley J., De Matteo R., Harding R. et al. Three-dimensional direct measurement of cardiomyocyte volume, nuclearity, and ploidy in thick histological sections // Scientific Reports. 2016. V. 6. P. 23756.
Bergmann O., Zdunek S., Felker A. et al. Dynamics of cell generation and turnover in the human heart // Cell. 2015. V. 161(7). P. 1566–1575.
Bishop S.P., Anderson P.G., Tucker D.C. Morphological development of the rat heart growing in oculo in the absence of hemodynamic work load // Circ. Res. 1990. V. 66(1). P. 84–102.
Bradley A., Fant P., Guionaud S. et al. Chapter 30 – Cardiovascular System // Boorman’s Pathology of the Rat (Second Edition) / Ed. Suttie A.W. Academic Press, 2018. P. 591–627.
Bryda E.C. The mighty mouse: the impact of rodents on advances in biomedical research // Mo. Med. 2013. V. 110(3). P. 207–211.
Buetow B.S., Laflamme M.A. Cardiovascular // Comparative Anatomy and Histology (Second Edition). A Mouse, Rat, and Human Atlas / Eds. Treuting P., Dintzis S., Montine K.S. London: Academic Press, 2018. P. 163–189.
Chacko K.J. Observations on the ultrastructure of developing myocardium of rat embryos // J. Morphol. 1976. V. 150(3). P. 681–709.
Chan W.Y., Cheung C.S., Yung K.M. et al. Cardiac neural crest of the mouse embryo: axial level of origin, migratory pathway and cell autonomy of the splotch (Sp2H) mutant effect // Development. 2004. V. 131(14). P. 3367–3379.
Chen X., Zhang L., Wang C. Prenatal hypoxia-induced epigenomic and transcriptomic reprogramming in rat fetal and adult offspring hearts // Sci. Data. 2019. V. 6(238).
Clark C.M., Jr. Characterization of glucose metabolism in the isolated rat heart during fetal and early neonatal development // Diabetes. 1973. V. 22(1). P. 41–49.
Clubb F.J., Jr., Bishop S.P. Formation of binucleated myocardial cells in the neonatal rat. An index for growth hypertrophy // Lab. Invest. 1984. V. 50(5). P. 571–577.
Cohen E.D., Yee M., Porter G.A. et al. Neonatal hyperoxia inhibits proliferation and survival of atrial cardiomyocytes by suppressing fatty acid synthesis // JCI Insight. 2021. 140785.
Combs M.D., Yutzey K.E. Heart valve development: regulatory networks in development and disease // Circ. Res. 2009. V. 105(5). P. 408–421.
Corstius H.B., Zimanyi M.A., Maka N. et al. Effect of intrauterine growth restriction on the number of cardiomyocytes in rat hearts // Pediatr. Res. 2005. V. 57(6). P. 796–800.
Couch J.R., West T.C., Hoff H.E. Development of the action potential of the prenatal rat heart // Circ. Res. 1969. V. 24(1). P. 19–31.
Deepe R., Fitzgerald E., Wolters R. et al. The mesenchymal cap of the atrial septum and atrial and atrioventricular septation // J. Cardiovasc. Dev. Dis. 2020. V. 7(4). P. 50.
van Kempen M.J., Fromaget C., Gros D. et al. Spatial distribution of connexin43, the major cardiac gap junction protein, in the developing and adult rat heart // Circ. Res. 1991. V. 68(6). P. 1638–1651.
DeRuiter M.C., Poelmann R.E., VanderPlas-de Vries I. et al. The development of the myocardium and endocardium in mouse embryos. Fusion of two heart tubes? // Anatomy and Embryology. 1992. V. 185(5). P. 461–473.
Dodou E., Verzi M.P., Anderson J.P. et al. Mef2c is a direct transcriptional target of ISL1 and GATA factors in the anterior heart field during mouse embryonic development // Development. 2004. V. 131(16). P. 3931–3942.
Drake C.J., Fleming P.A. Vasculogenesis in the day 6.5 to 9.5 mouse embryo // Blood. 2000. V. 95(5). P. 1671–1679.
Ferreira G.S., Veening-Griffioen D.H., Boon W.P.C. et al. Levelling the translational gap for animal to human efficacy data // Animals (Basel). 2020. V. 10(7): 1199.
Forman D.E., Cittadini A., Azhar G. et al. Cardiac morphology and function in senescent rats: gender-related differences // J. Am. Coll. Cardiol. 1997. V. 30(7). P. 1872–1877.
Gear R., Kendziorski J.A., Belcher S.M. Effects of bisphenol A on incidence and severity of cardiac lesions in the NCTR-Sprague-Dawley rat: A CLARITY-BPA study // Toxicol. Lett. 2017. V. 275. P. 123–135.
Gourdie R.G., Green C.R., Severs N.J. et al. Immunolabelling patterns of gap junction connexins in the developing and mature rat heart // Anat. Embryol. (Berl.). 1992. V. 185(4). P. 363–378.
Greeley M.A., White-Hunt S.J. Cardiovascular system // Atlas of Histology of the Juvenile Rat / Eds. Parker G.A., Picut C.A. Cambridge, MA: Academic Press, 2016. P. 423–437.
Grego-Bessa J., Luna-Zurita L., del Monte G. et al. Notch signaling is essential for ventricular chamber development // Dev. Cell. 2007. V. 12(3). P. 415–429.
Guo Y., Pu W.T. Cardiomyocyte maturation: New phase in development // Circ. Res. 2020. V. 126(8). P. 1086–1106.
Hackam D.G., Redelmeier D.A. Translation of research evidence from animals to humans // JAMA. 2006. V. 296(14). P. 1731–1732.
Harmon J.R., Delongchamp R.R., Kimmel G.L. et al. Effect of prenatal propranolol exposure on development of the postnatal rat heart // Teratog. Carcinog. Mutagen. 1986. V. 6(2). P. 139–150.
Hildreth V., Webb S., Bradshaw L. et al. Cells migrating from the neural crest contribute to the innervation of the venous pole of the heart // J. Anat. 2008. V. 212(1). P. 1–11.
Iliev A.A., Kotov G.N., Landzhov B.V. et al. A comparative morphometric study of the myocardium during the postnatal development in normotensive and spontaneously hypertensive rats // Folia Morphologica. 2018. V. 77(2). P. 253–265.
Ito T., Orino T., Harada K. et al. Morphological maturation of left ventricle in fetal rats: changes in left ventricular volume, mass, wall thickness, and mitral valvular size // Early. Hum. 1998. V. 53(1). P. 1–7.
Ito T., Harada K., Takada G. In situ morphometric analysis of left and right ventricles in fetal rats: changes in ventricular volume, mass, wall thickness, and valvular size // Tohoku. J. Exp. Med. 2001. V. 193(1). P. 37–44.
Ivanovitch K, Temiño S, Torres M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis // Elife. 2017. V. 6. e30668.
Jacob H.J. Functional genomics and rat models // Genome Res. 1999. V. 9(11). P. 1013–1016.
Jurado S.R., da Silva Franco R.J., Bankoff A.D.P. et al. The heart is a target organ in offspring rats due to maternal hypertension // J. Clin. Trial. Cardiol. 2013. V. 1(1). P. 1.
Kaur S., McGlashan S.R., Ward M.L. Evidence of primary cilia in the developing rat heart // Cilia. 2018. V. 7: 4.
Koban M.U., Moorman A.F., Holtz J. et al. Expressional analysis of the cardiac Na-Ca exchanger in rat development and senescence // Cardiovasc. Res. 1998. V. 37(2). P. 405–423.
L’Ecuyer T.J., Schulte D., Lin J.J. Thin filament changes during in vivo rat heart development // Pediatr. Res. 1991. V. 30(3). P. 232–238.
Lam M.L., Bartoli M., Claycomb W.C. The 21-day postnatal rat ventricular cardiac muscle cell in culture as an experimental model to study adult cardiomyocyte gene expression // Mol. Cell. Biochem. 2002. V. 229(1–2). P. 51–62.
Li F., Wang X., Capasso J.M., Gerdes A.M. Rapid transition of cardiac myocytes from hyperplasia to hypertrophy during postnatal development // J. Mol. Cell. Cardiol. 1996. V. 28(8). P. 1737–1746.
Li F., Wang X., Gerdes A.M. Formation of binucleated cardiac myocytes in rat heart: II. Cytoskeletal organization // J. Mol. Cell. Cardiol. 1997. V. 29(6). P. 1553–1565.
Liang X., Wang G., Lin L. et al. HCN4 dynamically marks the first heart field and conduction system precursors // Circ. Res. 2013. V. 113(4). P. 399–407.
Manner J., Yelbuz T.M. Functional morphology of the cardiac jelly in the tubular heart of vertebrate embryos // J. Cardiovasc. Dev. Dis. 2019. V. 6(1). P. 12.
Marcela S.G., Cristina R.M., Angel P.G. et al. Chronological and morphological study of heart development in the rat // Anat. Rec. (Hoboken). 2012. V. 295(8). P. 1267–1290.
Markel M., Ginzel M., Peukert N. et al. High resolution three-dimensional imaging and measurement of lung, heart, liver, and diaphragmatic development in the fetal rat based on micro-computed tomography (micro-CT) // J. Anat. 2020. V. 238(4). P. 1042–1054.
Markwald R.R., Fitzharris T.P., Smith W.N. Structural analysis of endocardial cytodifferentiation // Dev. Biol. 1975. V. 42(1). P. 160–180.
Mochet M., Moravec J., Guillemot H. et al. The ultrastructure of rat conductive tissue; an electron microscopic study of the atrioventricular node and the bundle of His // J. Mol. Cell. Cardiol. 1975. V. 7(12). P. 879–889.
Moretti A., Caron L., Nakano A. et al. Multipotent embryonic isl1+ progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification // Cell. 2006. V. 127(6). P. 1151–1165.
Morse D.E., Rogers C.S., McCann P.S. Atrial septation in the chick and rat: a review // J. Submicrosc. Cytol. 1984. V. 16(2). P. 259–272.
Nakagawa M., Thompson R.P., Terracio L. et al. Developmental anatomy of HNK-1 immunoreactivity in the embryonic rat heart: co-distribution with early conduction tissue // Anat. Embryol. 1993. V. 187(5). P. 445–460.
Navaratnam V., Woodward J.M., Skepper J.N. Specific heart granules and natriuretic peptide in the developing myocardium of fetal and neonatal rats and hamsters // J. Anat. 1989. V. 163. P. 261–273.
Nefodova O.O., Shatorna V.F., Halperin O.I. et al. Cardiogenesis changes under the impact of cadmium chloride in rat embryogenesis // Мир медицины и биологии. 2019. T. 15. № 3(69). C. 209–213.
Nesbitt T., Lemley A., Davis J. et al. Epicardial development in the rat: a new perspective // Microsc. Microanal. 2006. V. 12(5). P. 390–398.
Olivetti G., Anversa P., Loud A.V. Morphometric study of early postnatal development in the left and right ventricular myocardium of the rat. II. Tissue composition, capillary growth, and sarcoplasmic alterations // Circ. Res. 1980. V. 46(4). P. 503–512.
Ošt'ádalová I., Babický A. Periodization of the early postnatal development in the rat with particular attention to the weaning period // Physiol. Res. 2012. V. 61. Suppl. 1:S1-7.
Paige S.L., Plonowska K., Xu A. et al. Molecular regulation of cardiomyocyte differentiation // Circ. Res. 2015. V. 116(2). P. 341–353.
Piao Y., Liu Y., Xie X. Change trends of organ weight background data in Sprague Dawley rats at different ages // J. Toxicol. Pathol. 2013. V. 26(1). P. 29–34.
Ratajska A., Ciszek B., Sowińska A. Embryonic development of coronary vasculature in rats: corrosion casting studies // Anat. Rec. 2003. V. 270(2). P. 109–116.
Ribadeau-Dumas A., Brady M., Boateng S.Y. et al. Sarco(endo)plasmic reticulum Ca(2+)-ATPase (SERCA2) gene products are regulated post-transcriptionally during rat cardiac development // Cardiovasc. Res. 1999. V. 43(2). P. 426–436.
Rodríguez-Rodríguez P., López de Pablo A.L., García-Prieto C.F. et al. Long term effects of fetal undernutrition on rat heart. Role of hypertension and oxidative stress // PLoS One. 2017. V. 12(2).
Rogers C.S., Morse D.E. Atrial septation in the rat. I. A light microscopic and histochemical study // J. Submicrosc. Cytol. 1986. V. 18(2). P. 313–324.
Sedmera D., McQuinn T. Embryogenesis of the heart muscle // Heart Fail. Clin. 2008. V. 4(3). P. 235–245.
Seki S., Nagashima M., Yamada Y. et al. Fetal and postnatal development of Ca2+ transients and Ca2+ sparks in rat cardiomyocytes // Cardiovasc. Res. 2003. V. 58(3). P. 535–548.
Shevchenko K.M. Morphological features of atrial myocardium embryonic development and its changes caused by hypoxia effect // Regul. Mech. Biosyst. 2019. V. 10 (1). P. 129–135.
Stankunas K., Hang C.T., Tsun Z.Y. et al. Endocardial Brg1 represses ADAMTS1 to maintain the microenvironment for myocardial morphogenesis // Dev. Cell. 2008. V. 14(2). P. 298–311.
Suzuki H.R., Solursh M., Baldwin H.S. Relationship between fibronectin expression during gastrulation and heart formation in the rat embryo // Dev. Dyn. 1995. V. 204(3). P. 259–277.
Takeuchi J.K., Bruneau B.G. Directed transdifferentiation of mouse mesoderm to heart tissue by defined factors // Nature. 2009. V. 459(7247). P. 708–711.
Thompson R.P., Göbel J., Lindroth J.R et al. Embryology of the endocrine heart // Functional Morphology of the Endocrine Heart / Eds. Forssmann W.G., Scheuermann D.W., Alt J. Springer: Berlin Heidelberg N.Y., 1989. P. 1–11.
Van Vliet P., Wu S.M., Zaffran S. et al. Early cardiac development: a view from stem cells to embryos // Cardiovasc. Res. 2012. V. 96(3). P. 352–362.
Wei Y.F., Rodi C.P., Day M.L. et al. Developmental changes in the rat atriopeptin hormonal system // J. Clin. Invest. 1987. V. 79(5). P. 1325–1329.
Wenink A.C., Knaapen M.W., Vrolijk B.C. et al. Development of myocardial fiber organization in the rat heart // Anat. Embryol. 1996. V. 193(6). P. 559–567.
Wessels A., van den Hoff M.J., Adamo R.F. et al. Epicardially derived fibroblasts preferentially contribute to the parietal leaflets of the atrioventricular valves in the murine heart // Dev. Biol. 2012. V. 366(2). P. 111–124.
Witman N., Zhou C., Beverborg N.G. et al. Cardiac progenitors and paracrine mediators in cardiogenesis and heart regeneration // Semin. Cell. Dev. Biol. 2020. V. 100. P. 29–51.
Xavier-Vidal R., Mandarim-de-Lacerda C.A. Cardiomyocyte proliferation and hypertrophy in the human fetus: quantitative study of the myocyte nuclei // Bull. Assoc. Anat. (Nancy). 1995. V. 79(246). P. 27–31.
Xue Q., Chen F., Zhang H. et al. Maternal high-fat diet alters angiotensin II receptors and causes changes in fetal and neonatal rats // Biol. Reprod. 2019. V. 100(5). P. 1193–1203.
Ya J., Markman M.W., Wagenaar G.T. et al. Expression of the smooth-muscle proteins alpha-smooth-muscle actin and calponin, and of the intermediate filament protein desmin are parameters of cardiomyocyte maturation in the prenatal rat heart // Anat. Rec. 1997. V. 249(4). P. 495–505.
Дополнительные материалы отсутствуют.


