Онтогенез, 2021, T. 52, № 5, стр. 384-394
Глутаминсинтетаза в клетках формирующегося спинного мозга крысы
Е. А. Колос a, *, Д. Э. Коржевский a
a Федеральное государственное бюджетное научное учреждение “Институт экспериментальной медицины”
197376 Санкт-Петербург, ул. Академика Павлова, 12, Россия
* E-mail: koloselena1984@yandex.ru
Поступила в редакцию 29.03.2021
После доработки 21.04.2021
Принята к публикации 30.04.2021
Аннотация
Формирование глутаматергической системы спинного мозга широко изучается, однако исследования, посвященные изучению динамики формирования глутаминсинтетаза-содержащих структур, обеспечивающих защиту нервных клеток эмбрионального спинного мозга от токсического воздействия глутамата, практически отсутствуют. В настоящей работе изучены локализация, распределение и морфологические особенности клеток спинного мозга (СМ) крыс, экспрессирующих глутаминсинтетазу (ГС), в эмбриональном и в раннем постнатальном периоде с применением иммуногистохимических методов. Установлено, что первые клетки, содержащие ГС, идентифицируются в вентральной части эпендимного слоя формирующегося СМ в период начала глиогенеза – на 15 сут эмбрионального развития. Через сутки клетки, экспрессирующие фермент, присутствуют также в мантийном слое СМ. В настоящем исследовании впервые показано, что часть клеток пограничной шапочки (boundary cap cells), располагающихся в переходной зоне между СМ и периферической нервной системой, синтезирует глутаминсинтетазу. Настоящее исследование позволило определить динамику формирования ГС-содержащих глиальных клеток эмбрионального спинного мозга и предположить функциональное значение таких клеток в эмбриогенезе.
ВВЕДЕНИЕ
В спинном мозге основным возбуждающим нейромедиатором является глутамат (Todd et al., 2003; Todd, 2010). Известно, что повышенная концентрация внеклеточного глутамата может привести к эксайтотоксичности и гибели нейронов (Choi et al., 1987; Danbolt, 2001). Токсическое воздействие глутамата отмечено как важный патогенетический фактор при большом количестве нейродегенеративных заболеваний (Miguel-Hidalgo et al., 2010; Bame et al., 2012; Kulijewicz-Nawrot et al., 2013; Lewerenz, Maher, 2015). Поддержание концентрации внеклеточного глутамата на физиологическом уровне регулируется клетками нейроглии. Показано, что около 80% высвобожденного из пресинаптического нервного окончания глутамата поглощается глиальными клетками и превращается в нетоксичную для нейронов аминокислоту глутамин. Для осуществления этого процесса необходим фермент глутаминсинтетаза (ГС), имеющий важное функциональное значение в поддержании гомеостаза ЦНС. Участвуя не только в утилизации глутамата, но и в процессах детоксикации аммиака, ГС предотвращает чрезмерное накопление этих веществ в синаптических областях и тем самым блокирует нейротоксичность. Снижение активности и уровня ГС выявлено при различных патологических изменениях в головном и спинном мозге (Jayakumar, Norenberg, 2016).
В современных исследованиях, посвященных формированию глутаматергической нервной передачи в период эмбриогенеза, установлено, что рецепторы глутамата присутствуют в спинном мозге мышей на достаточно ранних сроках пренатального развития (ЭД12.5) (Myers et al., 2005), что соответствует примерно 14 сут развития у крыс (Ross et al., 2015). Показано, что в этот же срок глутаматергическая синаптическая система начинает функционировать (Czarnecki et al., 2014). Что касается появления в эмбриогенезе ГС-содержащих клеток, которые должны обеспечивать утилизацию внеклеточного глутамата, в литературе встречаются лишь отдельные работы, которые не касаются собственно СМ (Caldani et al., 1982; Mearow et al., 1989; Tokunaga et al., 2004; Kolos, Korzhevskii, 2018). О распределении и локализации ГС-содержащих клеток в эмбриональной нервной системе млекопитающих на разных этапах развития почти ничего не известно. При этом очевидно, что функциональное значение системы детоксикации глутамата в эмбриональной нервной системе очень велико. Установлено, что нокаутные по гену ГС мыши погибают на ранних сроках эмбрионального развития (ЭД3,5) (He et al., 2007), а гетерозиготы проявляют повышенную восприимчивость к фебрильным судорогам (van Gassen et al., 2009).
Цель настоящей работы – изучить локализацию и морфологические особенности клеток спинного мозга крыс, экспрессирующих глутаминсинтетазу, в эмбриональном и в раннем постнатальном периоде с применением иммуногистохимических методов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовались эмбрионы крыс Вистар 12–19 сут развития (ЭД12–ЭД19, n = 25), новорожденные крысы (ПД1, n = 5). Животных с датированным сроком беременности получали по общепринятому методу (Дыбан и др., 1975). Все манипуляции с животными проводились в соответствии с “Правилами проведения работ с использованием экспериментальных животных” и с соблюдением Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986 г.). Настоящее исследование одобрено этическим комитетом ФГБНУ “ИЭМ” (протокол № 3/19 от 25 апреля 2019). У новорожденных животных и эмбрионов выделяли фрагменты шейного отдела СМ (СIII–CV). Полученный материал фиксировали в растворе цинк-этанол-формальдегида (Korzhevskii et al., 2015) в течение суток, обезвоживали в спиртах и ксилоле, заливали в парафин. На ротационном микротоме (Rotary 3003 PFM, Германия) изготавливали срезы толщиной 5 мкм. После депарафинирования и регидратации полученных срезов проводили иммуноцитохимическое выявление глутаминсинтетазы. В настоящем исследовании были использованы моноклональные антитела мыши (клон GS-6, разведение 1 : 400, Merck Millipore (ранее Chemicon), США) и вторичные реагенты из набора EnVision+ System Labelled Polymer-HRP Anti-Mouse (Dako, Дания). Визуализацию прореагировавших антител проводили с применением диаминобензидина (DAB+ Dako, Дания). Препараты заключали в среду Cytoseal 60 (Thermo Scientifice, Германия). Исследование полученных препаратов и их фотографирование производили при помощи микроскопа LeicaDM750 и фотокамеры ICC50 (Leica, Германия). Анализ и обработку полученных изображений проводили с использованием программного обеспечения LAS EZ (Leica, Германия).
Для флуоресцентной микроскопии с целью выявления ГС-содержащих клеток перед постановкой иммуногистохимической реакции производили тепловое демаскирование антигена в течение 25 мин (99.5°С, в пароварке) в предварительно разогретом до 60°С демаскирующем растворе. В качестве вторичного реагента применяли биотинилированные антитела против мышиных иммуноглобулинов из набора R&D Systems (CTS002, Сell & Tissue staining kit, R&D Systems, США), а также конъюгат стрептавидина с флуорохромом Rhodamine Red-X, (RRX, Jackson ImmunoReaserch, США). Для визуализации ядер клеток использовали ядерный краситель SYTOX Green (1 : 100) (Invitrogen, США). Полученные препараты исследовали при помощи конфокального лазерного микроскопа Zeiss LSM 800 (Zeiss, Германия). Для возбуждения флуоресценции RRX использовали лазер с длинной 561 нм, для SYTOX Green – 488 нм. Полученные изображения анализировали с применением программ Zen-2012 и LSM Image Browser (Zeiss, Германия).
С целью оценки специфичности иммуногистохимической и иммунофлуоресцентной реакции на глутаминсинтетазу проводили отрицательный и положительный контроль. При исследовании на часть срезов эмбрионального СМ вместо первичных антител наносили разбавитель для антител (S0809) (Dako, Дания). В качестве положительного контроля были использованы астроциты головного и спинного мозга взрослых животных, фиксированных и обработанных таким же образом, как и исследуемый материал. В качестве гистологического контроля использовались препараты эмбрионального СМ 12–19-х сут развития, а также спинного мозга новорожденных животных, окрашенные квасцовым гематоксилином и толуидиновым синим.
РЕЗУЛЬТАТЫ
При проведении отрицательного контроля для иммуногистохимической и иммунофлуоресцентной реакции на глутаминсинтетазу отмечено, что на срезах эмбрионального СМ отсутствуют клетки и другие структуры, проявляющие иммунопозитивность. Неспецифическое фоновое окрашивание и автофлуоресценция тканей отсутствовали. При проведении положительного контроля иммунопозитивная реакция отмечена в отростчатых клетках, имеющих типичные морфологические признаки астроцитов. При этом нейроны спинного и головного мозга взрослых животных не содержали продукт иммуногистохимической реакции, что подтверждает высокую специфичность метода выявления фермента. Неспецифицеское окрашивание и автофлуоресценция отсутствовали.
В ходе настоящего исследования при гистологическом анализе формирующегося спинного мозга крысы на разных этапах эмбриогенеза изучали четыре анатомические зоны: крыловидную (алярную) и базальную пластинки, потолочную и донную пластинки.
Установлено, что на ЭД12 в формирующемся спинном мозге ГС-иммунопозитивные клетки отсутствуют. Начиная с ЭД13, в вентральной части СМ эмбрионов крыс идентифицируется тонкий слой округлых нейробластов, дающих начало серому веществу вентральных рогов СМ. На этом сроке также не было выявлено ГС-иммунопозитивных клеток.
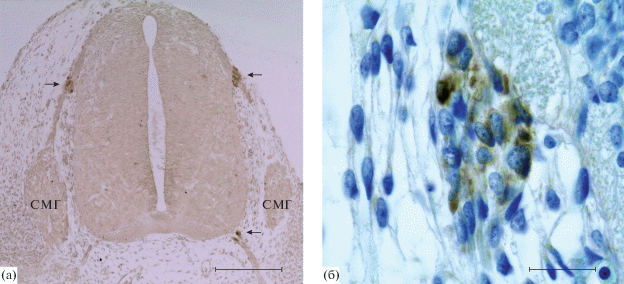
На ЭД14 в эмбриональном СМ четко идентифицируются три концентрических зоны: эпендимная, мантийная и маргинальная. В области алярной пластинки формирующегося СМ идентифицируется тонкий слой округлых нейробластов, впоследствии образующих серое вещество задних рогов СМ. Также в дорзальной части СМ начинает формироваться зона входа заднего корешка. В вентро-латеральной части мантийного слоя базальной пластинки идентифицируются округлые нейробласты, некоторые из которых имеют отростки, формирующие презумптивные передние корешки СМ. Клетки эмбрионального СМ в этот срок не экспрессируют ГС. В непосредственной близости к зоне входа дорсального корешка и в точках выхода вентральных двигательных нервов, формирующегося СМ идентифицируются скопления округлых клеток – клеток пограничной “шапочки” (boundary cap cells, КПШ). Часть этих клеток экспрессирует ГС (рис. 1).
Рис. 1.
Поперечный срез шейного отдела спинного мозга эмбриона крысы на 14 сут развития с соответствующими спинномозговыми ганглиями (а) и глутаминсинтетаза-содержащие клетки пограничной “шапочки” (boundary cap cells) формирующегося дорзального корешка СМ (б). Стрелки – клетки пограничной “шапочки” (boundary cap cells); СМГ – спинномозговой ганглий. Иммуногистохимическая реакция на глутаминсинтетазу (а, б); подкраска толуидиновым синим (б). Масштаб: (а) – 200 мкм, (б) – 20 мкм.
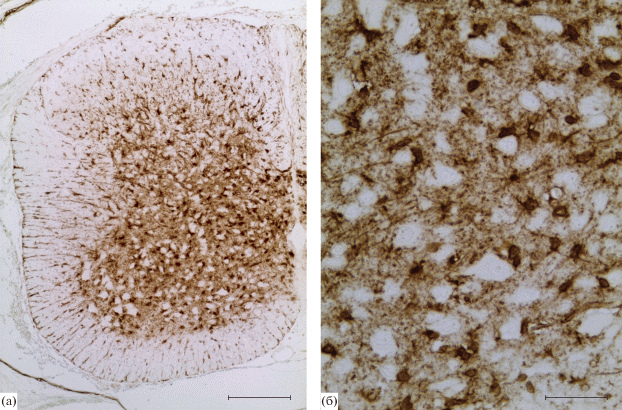
На 15 сут развития эпендимный слой с плотно расположенными клетками расширяется в дорзальной части СМ и сокращается в базальных пластинках. Мантийный слой формирующегося спинного мозга наиболее развит в вентральной части. Маргинальная зона СМ представлена тонким слоем по периферии формирующегося СМ. В мантийном слое базальной пластинки идентифицируются кластеры молодых мотонейронов и окружающие их вставочные нейробласты. Волокна клеток донной пластинки, достигающие базальной мембраны СМ, формируют презумптивную вентральную срединную борозду. Также в мантийном слое СМ появляются дорзо-вентрально ориентированные комиссуральные нейробласты. Нами отмечено, что на 15 сут развития ГС начинает экспрессироваться в телах большого количества нейроэпителиальных клеток вентральной части эпендимного слоя, причем в области донной пластинки такие клетки отсутствуют. Иммунопозитивные клетки локализуются в области вентральных доменов предшественников СМ (pV0–pV3, pMN) (рис. 2). В ходе настоящего исследования иммунореактивность была отмечена в отростках клеток эпендимной зоны, проходящих через мантийный и маргинальный слой и достигающих пиальной поверхности в вентральной части формирующегося СМ. Иммунореактивность проявляют также субпиальные ножки радиальной глии.
Рис. 2.
Глутаминсинтетаза-иммунопозитивные клетки формирующегося шейного отдела спинного мозга эмбриона крысы 15 сут развития (а) и схема поперечного среза СМ с обозначением общепринятого расположения доменов предшественников дорзальной (pd1–pd6) и вентральной (pV0–pV3, pMN) части эпендимного слоя спинного мозга эмбриона крысы (б), генерирующих двигательные нейроны (MН), олигодендроциты (ОЛ), астроциты (А) и различные группы интернейронов (ИН). 1 – центральный канал, 2 – эпендимный слой, 3 – мантийный слой, 4 – маргинальный слой, 5 – донная пластинка, 6 – потолочная пластинка, 7 – зона входа заднего корешка. Иммуногистохимическая реакция на глутаминсинтетазу (а). Масштаб 200 мкм.
На 15 сут развития в непосредственной близости к зоне входа дорсального корешка и в точках выхода вентральных двигательных нервов формирующегося СМ идентифицируются скопления округлых иммунопозитвных клеток – клеток пограничной шапочки.
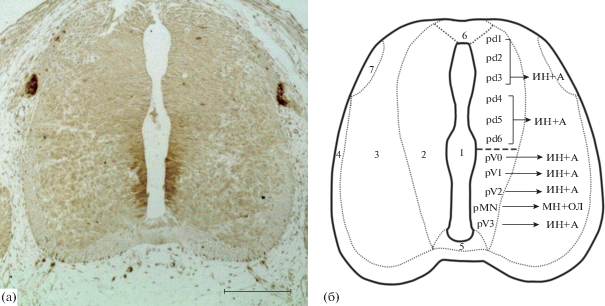
Формирующийся СМ эмбрионов крыс 16–17-х суток развития претерпевает изменения: центральный канал сужается, мантийный слой алярной пластинки увеличивается в объеме, расширяется маргинальный слой, эпендимный слой алярной пластинки сужается. В этот период развития количество иммунопозитивных клеток в эпендимном слое увеличивается. Многочисленные ГС-содержащие клетки идентифицируются в вентральной части эпендимного слоя, отдельные клетки эпендимной зоны в дорзальной части СМ также начинают синтезировать фермент. На ЭД16–ЭД17 в мантийном слое базальной пластинки формирующегося СМ присутствуют немногочисленные иммунопозитивные овальные или веретеновидные клетки, обладающие несколькими отростками с интенсивно окрашенной цитоплазмой. Отростки таких клеток также содержат фермент. Нами также отмечена внутриядерная локализация глутаминсинтетазы в иммунопозитивных клетках эпендимного и мантийного слоя. В ходе исследования отмечены многочисленные иммунопозитивные отростки, проходящие радиально через мантийный и маргинальный слои базальной пластинки СМ. Иммунореактивность проявляют также структуры, расположенные непосредственно под оболочками СМ – субпиальные ножки клеток радиальной глии (рис. 3а).
Рис. 3.
Поперечный срез шейного отдела спинного мозга эмбриона крысы на 16 сутки развития. (а) – глутаминсинтетаза-иммунопозитивные клетки формирующегося спинного мозга; (б) – клетки пограничной “шапочки” (boundary cap cells) формирующегося заднего корешка спинного мозга. Иммуногистохимическая реакция на глутаминсинтетазу (а); иммунофлуоресцентная реакция на глутаминсинтетазу (Rhodamine Red-X – красное окрашивание) с окраской ядер клеток красителем SYTOX Green (зеленое окрашивание) (б). Масштаб: (а) – 200 мкм, (б) – 20 мкм.
В этот срок в непосредственной близости к зоне входа заднего корешка и зоне выхода аксонов двигательных нейронов формирующегося СМ идентифицируются скопления ГС-иммунопозитивных округлых клеток (рис. 3б).
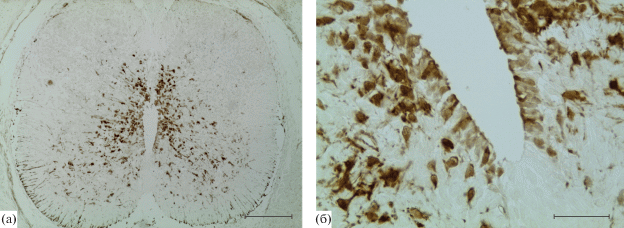
К 18 сут развития центральный канал формирующегося спинного мозга сокращается, эпендимный слой становится узким. Мантийный слой приобретает конфигурацию серого вещества СМ взрослых животных. Центральный канал сужается, расширяется область формирующегося серого вещества и белого вещества СМ, вентральная и дорзальная борозды, которые делят белое вещество, углубляются. Маргинальный слой расширяется как в вентральной, так и в дорзальной части и его форма приобретает сходство с белым веществом СМ взрослых крыс. Иммунореактивность наблюдается в клетках эпендимного слоя как вентральной, так и дорзальной части СМ. Однако отдельные клетки данной зоны не экспрессируют ГС (рис. 4б). В мантийном слое, преимущественно в вентральной части, выявляется большое количество иммунопозитивных клеток (рис. 4а). Это клетки неправильной формы с двумя или более отростками. В формирующихся передних рогах СМ выявляется большое количество радиально ориентированных иммунопозитивных отростков, проходящих через серое и белое вещество и достигающих пиальной поверхности. В области зоны входа заднего корешка, формирующегося СМ идентифицируются небольшие группы ГС-иммунопозитивных округлых клеток.
Рис. 4.
Поперечный срез шейного отдела спинного мозга эмбриона крысы на 18 сутки развития. Иммуногистохимическая реакция на глутаминсинтетазу. Масштаб: (а) – 200 мкм, (б) – 50 мкм.
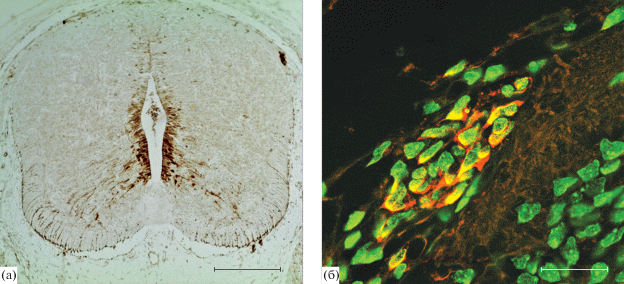
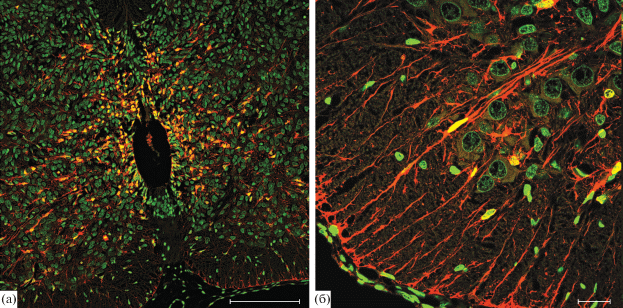
На ЭД19 экспрессия ГС наблюдается в клетках эпендимного слоя вентральной и дорзальной части СМ. Отдельные клетки данной зоны не экспрессируют ГС. В мантийном слое вентральной и дорзальной части СМ присутствует большое количество отростчатых иммунопозитивных клеток неправильной формы (рис. 5а). Также в формирующемся СМ выявляется большое количество радиально ориентированных иммунопозитивных отростков, проходящих через серое и белое вещество и достигающих пиальной поверхности. Субпиальные ножки астроцитов также содержат ГС (рис. 5б). В области зоны входа заднего корешка формирующегося СМ идентифицируются небольшие группы ГС-иммунопозитивных округлых клеток.
Рис. 5.
Глутаминсинтетаза-иммунопозитивные клетки в формирующемся СМ крысы на 19 сутки развития: (а) – общий вид, (б) – фрагмент серого и белого вещества передних рогов СМ. Иммунофлуоресцентная реакция на глутаминсинтетазу (Rhodamine Red-X – красное окрашивание) с окраской ядер клеток красителем SYTOX Green (зеленое окрашивание). Конфокальная лазерная микроскопия. Масштаб: (а) – 200 мкм, (б) – 20 мкм.
После рождения (ПД1) конфигурация СМ приобретает вид СМ взрослых животных. Отчетливо идентифицируются слой эпендимы, серое и белое вещество, вентральная и дорзальная борозды, которые делят белое вещество. При проведении иммуногистохимической реакции на ГС в сером веществе СМ новорожденных животных выявляется большое количество звездчатых иммунопозитивных клеток (рис. 6а). Отмечено, что продукт иммуногистохимической реакции локализуется преимущественно в перинуклеарной цитоплазме, часто маскируя ядро. В белом веществе идентифицируется большое количество иммунопозитивных радиально проходящих отростков, а также немногочисленные иммунопозитивные овальные и веретеновидные тела иммунопозитивных клеток с двумя, реже несколькими отростками (рис. 6б). Глутаминсинтетезу содержат также субпиальные ножки астроцитов по периферии спинного мозга. В эпендимном слое ГС-содержащие клетки отсутствуют. В области зоны входа заднего корешка, формирующегося СМ идентифицируются небольшие скопления ГС-иммунопозитивных округлых клеток.
ОБСУЖДЕНИЕ
Согласно результатам большого числа исследований известно, что у взрослых животных высокие уровни глутаминсинтетазы, превращающей большую часть глутамата внеклеточного пространства в глутамин, экспрессируют астроциты. В связи с этим при исследовании ЦНС взрослых лабораторных животных и человека глутаминсинтетаза часто используется как маркер, специфичный для клеток астроглии (Anlauf, Derouiche, 2013). В настоящее время астроциты считаются основными глиальными клетками взрослой ЦНС, выполняющими инактивацию свободного глутамата, предотвращая эксайтотоксичность (Anlauf, Derouiche, 2013; Xin et al., 2019). Несмотря на то, что присутствие фермента в клетках, отличных от астроцитов, вызывает споры, недавние исследования экспрессии ГС во взрослом головном и спинном мозге показали, что отдельные олигодендроциты, нейроны и микроглиоциты способны синтезировать ГС в норме и при повреждении (Liu et al., 2013; Bernstein et al., 2014, 2015; Xin et al., 2019). Вопрос возможности участия различных популяций глиальных клеток эмбриональной ЦНС в детоксикации внеклеточного глутамата и аммиака остается до настоящего времени не изученным.
В настоящем исследовании установлено, что ГС начинает экспрессироваться клетками СМ на 15 сут развития. В этот срок фермент обнаруживается лишь в телах клеток в вентральной части эпендимной зоны и их длинных отростках, достигающих пиальной поверхности. Таким образом, иммунопозитивные клетки имеют типичную морфологию клеток радиальной глии. Присутствие ГС в клетках радиальной глии позволяет предположить, что в период миграции нейробластов, до появления астроцитарной глии, радиальная глия осуществляет защиту клеток от эксайтотоксических уровней глутамата. Появление в этот период (ЭД15) иммунопозитивных структур в субпиальной области – ножек радиальной глии, свидетельствует о начале формирования барьера СМ. Присутствие ГС в периваскулярных и субпиальных отростках радиальной глии и астроцитов обеспечивает защиту СМ и уменьшает нейротоксичность аммиака, способного свободно проникать через гематоэнцефалический и гематоменингиальный барьер (Suarez et al., 2002; Castegna, Menga, 2018). Известно, что ионы аммония, циркулирующие по кровеносным сосудам головного и спинного мозга, а также в спинномозговой жидкости, поглощаются астроцитами и включаются в амидную группу глутамина. Избыток выделенного астроцитами глутамина может диффундировать из нервной ткани в кровь и цереброспинальную жидкость (Ott, Larsen 2004; Cooper, 2012; Hawkins, Vina, 2016; Devriendt et al., 2019). Таким образом ГС-содержащие ножки радиальной глии и астроцитов, как элемент глутамин-глутаматной транспортной системы барьера СМ, участвуют в метаболизме азота, защищают от развития нейротоксичности, предотвращая накопление глутамата и аммиака.
На ранних этапах эмбриогенеза в нервной трубке происходит сегментация нейроэпителия на дискретные домены предшественников различных групп нейронов и клеток глии. Идентификация доменов основана на экспрессии определенного набора транскрипционных факторов, который определяет дальнейшую судьбу предшественников (Lai et al., 2016; Danesin, Soula, 2017; Prochazka et al., 2017). В процессе эмбриогенеза первыми генерируются предшественники нейронов вентральной части СМ. В более позднем эмбриональном периоде (примерно ЭД15 у крыс) эти домены предшественников СМ переключаются на глиогенез. Нами отмечено, что клетки вентральной части эпендимного слоя СМ начинают экспрессировать ГС с 15 сут развития. Исследования показали, что генерация первых предшественников астроцитов в этот период происходит в пределах вентральных доменов pV0, pV1, pV2 и pV3 (Hochstim et al., 2008; Tien et al., 2012). Предшественники олигодендроцитов также начинают формироваться в этот срок из клеток вентральной эпендимной зоны (домен мотонейронов pMN) (Sun et al., 1998; Lu et al., 2000). На следующие сутки развития (ЭД16), т.е., к концу нейроногенеза в дорзальной части СМ, некоторые клетки дорзального эпендимного слоя в области pd1–pd6 доменов также начинают синтезировать ГС. Таким образом, появление фермента в клетках вентральной и дорзальной части эпендимного слоя коррелирует с переходом от нейроногенеза к глиогенезу. Однако период, когда предшественники астоцитов и олигодендроцитов покидают эпендимную зону не вполне исследован и не определен (Ohayon et al., 2016). Нами отмечено появление немногочисленных ГС-экспрессирующих клеток вне эпендимной зоны, начиная с ЭД16. Можно предположить, что на этих стадиях предшественники астроцитов и/или олигодендроцитов начинают мигрировать из эпендимной зоны и заселяют формирующееся серое вещество СМ. При этом у иммунопозитивных клеток мантийного слоя не прослеживается связь с центральным каналом и мягкой мозговой оболочкой. Таким образом, в этот срок ГС синтезируют как радиальные глиоциты, так и непосредственные предшественники олигодендроцитов и астроглии.
В недавних исследованиях высказывается предположение о влиянии ГС на синаптогенез, в особенности на формировании глутаматергических синапсов развивающегося головного мозга (Son et al., 2019). Было показано, что после подавления активности ГС в период синаптогенеза, у взрослых животных снижается глутаматергическая нейротрансмиссия в области гиппокампа и отмечается нарушение пространственной памяти (Son et al., 2019). Вероятно, ГС-содержащие предшественники астроцитов спинного мозга регулируют синаптогенез в период эмбрионального развития. Данное предположение требует дополнительных исследований.
Долгое время ГС считалась цитозольным ферментом, однако недавние исследования продемонстрировали везикулярное расположение ГС в астроцитах (Anlauf, Derouiche, 2013). В настоящей работе нами было отмечено, что, начиная с ЭД16, в иммунопозиивных клетках эпендимного и мантийного слоя СМ, глутаминсинтетаза присутствует как в цитоплазме, так и в ядре клетки, что является неизвестной ранее особенностью.
В настоящем исследовании отмечено присутствие групп иммунопозитивных клеток в областях, прилежащих к зоне входа заднего корешка и к зоне выхода вентрального корешка, начиная с раннего эмбрионального периода развития (ЭД14). Эти области представляют собой особые переходные зоны, образующие условную границу между ЦНС и ПНС. Эта пограничная зона образована ножками радиальной глии и астроцитов (образующих глиальную пограничную мембрану), мозговыми оболочками и специализированным внеклеточным матриксом. Переходные зоны избирательно проницаемы для аксонов, что обеспечивает связь между ЦНС и ПНС (Suter, Jaworski, 2019). Зоны входа и выхода нервных корешков представляют собой области нервной системы, где клетки ЦНС и ПНС находятся в непосредственном контакте. В период эмбрионального развития для переходных зон в области нервных корешков СМ характерно локальное изменение некоторых компонентов барьера и наличие специализированных клеток – клеток пограничной “шапочки” (boundary cap cells). КПШ являются временной популяцией клеток, но продолжительность их существования в области корешков СМ остается неизвестной. Анализ экспрессии специфических для КПШ маркеров (Krox20, Prss56, Hey2 и Wif1) показал, что эти клетки впервые идентифицируются в дорсальной и вентральной части СМ мышей в период начала вхождения первых сенсорных аксонов спинномозгового ганглия (СМГ) и выхода двигательных аксонов. Экспрессия этих маркеров сохраняется в КПШ мыши до ЭД16.5 (Coulpier et al., 2009; Radomska, Topilko, 2017). Однако ранние исследования, проведенные с применением электронной микроскопии, демонстрируют, что размер кластеров КПШ уменьшаются с ЭД17 и далее, а полностью исчезают они лишь к ПД6 (Golding, Cohen, 1997; Altman, Bayer, 2001). В настоящем исследовании показано, что КПШ, содержащие ГС, присутствуют в непосредственной близости к зоне входа заднего корешка и зоне выхода аксонов двигательных нейронов, начиная с раннего эмбрионального периода (ЭД14) до рождения. По-видимому, ГС-содержащие КПШ совместно с ГС-иммунопозитивными отростками радиальной глии и астроцитов (пограничной глиальной мембраной) образуют двухсторонний барьер на границе ПНС-ЦНС, препятствующий миграции глиальных предшественников по корешкам в СМ, а также глиальных предшественников и нейробластов спинного мозга на периферию. То есть, КПШ предотвращают преждевременное вторжение астроцитов в зону входа заднего корешка, а астроциты предотвращают вход шванновских клеток в ЦНС (Fontenas, Kucenas, 2017). Функциональное значение экспрессии глутаминсинтетазы клетками пограничной шапочки, образующими барьер в пограничной зоне, требует дополнительного исследования. Можно предположить, что ГС-содержащие клетки пограничных зон представляют собой особую популяцию глиальных клеток, обеспечивающих контроль пограничной зоны, аналогично ГС-содержащей пограничной глиальной мембране. Некоторые исследования, выполненные на культурах, предполагают, что во время эмбриогенеза глутамат влияет на рост, ветвление и подвижность растущих аксонов, а также на синаптогенез, когда аксоны достигают своих целевых областей (Kreibich et al., 2004). Авторы выдвигают гипотезу об участии глутамата в модулировании чувствительности конуса роста аксонов к различным молекулам, ответственным за отталкивание растущих аксонов (Kreibich et al., 2004). Стоит отметить, что сенсорные нейроны спинномозгового ганглия являются глутаматергическими клетками и двигательные нейроны передних рогов СМ также способны синтезировать глутамат (Colombo, Francolini, 2019). В период ЭД13–ЭД14 растущие аксоны формирующихся глутаматергических нейронов СМГ направляются к дорсолатеральной части спинного мозга и входят в маргинальный слой СМ через зону входа заднего корешка. Лишь через несколько дней аксоны проникают в мантийный слой. Этот “период ожидания” регулируется репеллентными молекулами (Masuda et al., 2009). Высвобождение глутамата из растущих аксонов СМГ, вероятно, снижает их ответ на молекулы отталкивания. Регуляцию концентрации глутамата, выделяемого растущими аксонами в переходных зонах СМ, могут осуществлять КПШ совместно с пограничной глиальной мембраной. В этот же период растущие аксоны формирующихся мотонейронов, способных синтезировать глутамат, формируют передний корешок и покидают спинной мозг. Некоторые из вентральных КПШ образуют длинные тонкие цитоплазматические выросты, которые проникают в эмбриональный СМ, и, охватывая аксоны мотонейронов, направляют их (Radomska, Topilko, 2017). Концентрация же глутамата во внеклеточном пространстве в области входа заднего корешка и в области выхода отростков двигательных нейронов при прохождении аксонами глутаматергических нейробластов пограничной зоны регулируется глутаминсинтетаза-содержащими КПШ и ножками астроцитов.
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе настоящего исследования получены данные по распределению глутаминсинтетазы в клетках спинного мозга крыс на разных сроках эмбрионального и раннего постнатального развития. Установлено, что первые глутаминсинтетаза-содержащие клетки появляются в вентральной части эпендимного слоя спинного мозга крысы на 15 сут эмбрионального развития, в период начала глиогенеза. На следующие сутки эмбриогенеза (ЭД16) глутаминсинтетаза-содержащие клетки идентифицируются также в мантийном слое. В этих клетках с помощью двойного флуоресцентного маркирования и конфокальной микроскопии выявлена ядерная локализация фермента.
Впервые установлено, что часть клеток пограничной шапочки (boundary cap cells), располагающейся в корешках СМ на границе с ПНС, синтезирует глутаминсинтетазу. Отмечено, что такие клетки присутствуют в области корешков СМ в период с 14-х сут эмбрионального развития до рождения. Дальнейшие исследования роли глутаминсинтетазы в клетках переходных зон спинного мозга могут внести вклад в понимание их функционирования в период установления связей между ЦНС и ПНС.
Список литературы
Дыбан А.П., Пучков В.Ф., Баранов B.C. и др. Лабораторные млекопитающие: мышь Mus musculus, крыса Rattus norvegicus, кролик Oryctolagys cuniculus, хомячок Cricetus griseous // Объекты биологического развития. М.: Наука, 1975. С. 505–566.
Altman J., Bayer S.A. Development of the Human Spinal Cord: An Interpretation Based on Experimental Studies in Animals. N.Y.: Oxford University Press, 2001. 542 p.
Anlauf E., Derouiche A. Glutamine synthetase as an astrocytic marker: its cell type and vesicle localization // Front. Endocrinol. 2013. V. 4. P. 144.
Bame M., Pentiak P.A., Needleman R., Brusilow W.S. Effect of sex on lifespan, disease progression, and the response to methionine sulfoximine in the SOD1 G93A mouse model for ALS // Gend. Med. 2012. V. 9. № 6. P. 524–535.
Bernstein H.-G., Bannier J., Meyer-Lotz G. et al. Distribution of immunoreactive glutamine synthetase in the adult human and mouse brain. Qualitative and quantitative observations with special emphasis on extra-astroglial protein localization // J. Chem. Neuroanat. 2014. V. 61–62. P. 33–50.
Bernstein H.-G., Meyer-Lotz G., Dobrowolny H. et al. Reduced density of glutamine synthetase immunoreactive astrocytes in different cortical areas in major depression but not in bipolar I disorder // Front Cell. Neurosci. 2015. V. 9. P. 273.
Caldani M., Rolland B., Fages C., Tardy M. Glutamine synthetase activity during mouse brain development // Experientia. 1982. V. 38. P. 1199–1202.
Castegna A., Menga A. Glutamine synthetase: localization dictates outcome // Genes. 2018. V. 9. P. E108.
Choi D.W., Maulucci-Gedde M., Kriegstein A.R. Glutamate neurotoxicity in cortical cell culture // J. Neurosci. 1987. V. 7. P. 357–368.
Colombo M.N., Francolini M. Glutamate at the vertebrate neuromuscular junction: from modulation to neurotransmission // Cells. 2019. V. 8. № 9. P. 996.
Cooper A.J. The role of glutamine synthetase and glutamate dehydrogenase in cerebral ammonia homeostasis // Neurochem. Res. 2012. V. 37. P. 2439–2455.
Coulpier F., Le Crom S., Maro G.S. et al. Novel features of boundary cap cells revealed by the analysis of newly identified molecular markers // Glia. 2009. V. 57. P. 1450–1457.
Czarnecki A., Le Corronc H., Rigato C. et al. Acetylcholine controls GABA-, glutamate- and glycine-dependent giant depolarizing potentials that govern spontaneous motoneuron activity at the onset of synaptogenesis in the mouse embryonic spinal cord // J. Neurosci. 2014. V. 34. P. 6389–6404.
Danbolt N.C. Glutamate uptake // Prog. Neurobiol. 2001. V. 65. № 1. P. 1–105.
Danesin C., Soula C. Moving the Shh source over time: what impact on neural cell diversification in the developing spinal cord? // J. Dev. Bio. 2017. V. 5. № 2. P. 4.
Devriendt N., Or M., Meyer E. et al. Comparative accuracy and precision of two commercial laboratory analyzers for the quantification of ammonia in cerebrospinal fluid // Vet. Clin. Pathol. 2020. V. 49. № 1. P. 119–124.
Fontenas L., Kucenas S. Motor exit point (MEP) glia: Novel myelinating glia that bridge CNS and PNS myelin // Frontiers in Cellular Neuroscience. 2018. V. 12. P. 333.
Golding J.P., Cohen J. Border controls at the mammalian spinal cord: late-surviving neural crest boundary cap cells at dorsal root entry sites may regulate sensory afferent ingrowth and entry zone morphogenesis // Mol. Cell. Neurosci. 1997. V. 9. P. 381–396.
Hawkins R.A., Vina J.R. How glutamate is managed by the blood brain barrier // Biology. 2016. V. 5. P. 37.
He Y., Hakvoort T.B., Vermeulen J.L. et al. Glutamine synthetase is essential in early mouse embryogenesis // Dev. Dyn. 2007. V. 236. № 7. P. 1865–1875.
Hochstim C., Deneen B., Lukaszewicz A. et al. The spinal cord contains positionally distinct astrocyte subtypes whose identities are specified by a homeodomain transcriptional code // Cell. 2008. V. 133. № 3. P. 510–522.
Jayakumar A.R., Norenberg M.D. Glutamine synthetase: Role in neurological disorders // Adv. Neurobiol. 2016. V. 13. P. 327–350.
Kolos E.A., Korzhevskii D.E. Glutamine synthetase-containing cells of the dorsal root ganglion at different stages of rat ontogeny // Russ J. Dev. Biol. 2018. V. 49. P. 179–183.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde // European J. Histochemistry. 2015. V. 59. № 3. P. 233–237.
Kreibich T.A., Chalasani S.H., Raper J.A. The neurotransmitter glutamate reduces axonal responsiveness to multiple repellents through the activation of metabotropic glutamate receptor 1 // J. Neurosci. 2004. V. 24. P. 7085–7095.
Kulijewicz-Nawrot M., Sykova E., Chvatal A. et al. Astrocytes and glutamate homoeostasis in Alzheimer’s disease: a decrease in glutamine synthetase, but not in glutamate transporter-1, in the prefrontal cortex // ASN Neuro. 2013. V. 5. P. 273–282.
Lai H.C., Seal R.P., Johnson J.E. Making sense out of spinal cord somatosensory development // Development. 2016. V. 143. P. 3434–3448.
Lewerenz J., Maher P. Chronic glutamate toxicity in neurodegenerative diseases—what is the evidence? // Front. Neurosci. 2015. V. 9. P. 469.
Liu C., Wu W., Zhang B. et al. Temporospatial expression and cellular localization of glutamine synthetase following traumatic spinal cord injury in adult rats // Mol. Med. Rep. 2013. V. 7. P. 1431–1436.
Lu Q.R., Yuk D., Alberta J.A. et al. Sonic hedgehog–regulated oligodendrocyte lineage genes encoding bHLH proteins in the mammalian central nervous system // Neuron. 2000. V. 25. P. 317–329.
Masuda T., Yaginuma H., Sakuma C., Ono K. Netrin-1 signaling for sensory axons: involvement in sensory axonal development and regeneration // Cell. Adh. Migr. 2009. V. 3. P. 171–173.
Mearow K.M., Mill J.F., Vitkovic L. The ontogeny and localization of glutamine synthetase gene expression m rat brain // Mol. Brain Res. 1989. V. 6. № 4. P. 223–232.
Miguel-Hidalgo J.J., Waltzer R., Whittom A.A. et al. Glial and glutamatergic markers in depression, alcoholism, and their comorbidity // J. Affect Disord. 2010. V. 127. P. 230–240.
Myers C.P., Lewcock J.W., Hanson M.G. et al. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits // Neuron. 2005. V. 46. № 1. P. 37–49.
Ohayon D., Garces A., Joly W. et al. Onset of spinal cord astrocyte precursor emigration from the ventricular zone involves the zeb1 transcription factor // Cell Rep. 2016. V. 17. P. 1473–1481.
Ott P., Larsen F.S. Blood–brain barrier permeability to ammonia in liver failure: a critical reappraisal // Neurochem. Int. 2004. V. 44. P. 185–198.
Prochazka A., Gosgnach S., Capaday C., Geyer H. Neuromuscular models for locomotion // Bioinspired Legged Locomotion / Ed. Sharbafi M., Seyfarth A. Oxford: Butterworth-Heinemann. 2017. P. 401–453.
Radomska K.J., Topilko P. Boundary cap cells in development and disease // Curr. Opin. Neurobiol. 2017. V. 47. P. 209–215.
Ross E.J., Graham D.L., Money K.M., Stanwood G.D. Developmental consequences of fetal exposure to drugs: what we know and what we still must learn // Neuropsychopharmacology. 2015. V. 40. P. 61–87.
Son H., Kim S., Jung D.-H. et al. Insufficient glutamine synthetase activity during synaptogenesis causes spatial memory impairment in adult mice // Scientific Reports. 2019. V. 9. № 1. P. 252.
Suarez I., Bodega G., Fernandez B. Glutamine synthetase in brain: effect of ammonia // Neurochem. Int. 2002. V. 41. P. 123–142.
Sun T., Pringle N.P., Hardy A.P. et al. Pax6 influences the time and site of origin of glial precursors in the ventral neural tube // Mol. Cell. Neurosci. 1998. V. 12. P. 228–239.
Suter T.A.C.S., Jaworski A. Cell migration and axon guidance at the border between central and peripheral nervous system // Science. 2019. P. 1–8.
Tien A.C., Tsai H.H., Molofsky A.V. et al. Regulated temporal-spatial astrocyte precursor cell proliferation involves BRAF signalling in mammalian spinal cord // Development. 2012. V. 139. P. 2477–2487.
Todd A.J., Hughes D.I., Polgar E. et al. The expression of vesicular glutamate transporters VGLUT1 and VGLUT2 in neurochemically defined axonal populations in the rat spinal cord with emphasis on the dorsal horn // Eur. J. Neurosci. 2003. V. 17. P. 13–27.
Todd A.J. Neuronal circuitry for pain processing in the dorsal horn // Nat. Rev. Neurosci. 2010. V. 11. P. 823–836.
Tokunaga A., Kohyama J., Yoshid T. Mapping spatio-temporal activation of Notch signaling during neurogenesis and gliogenesis in the developing mouse brain // J. Neurochem. 2004. V. 90. № 1. P. 142–154.
van Gassen K.L., van der Hel W.S., Hakvoort T.B. et al. Haploinsufficiency of glutamine synthetase increases susceptibility to experimental febrile seizures // Genes Brain Behav. 2009. V. 8. P. 290–295.
Xin W., Mironova Y.A., Shen H. et al. Oligodendrocytes support neuronal glutamatergic transmission via expression of glutamine synthetase // Cell Rep. 2019. V. 2. P. 2262–2271.
Дополнительные материалы отсутствуют.