Онтогенез, 2021, T. 52, № 5, стр. 367-383
Деацетилазы гистонов в процессе реагрегации клеток губки Halisarca dujardinii
О. И. Кравчук a, *, А. В. Бураков b, Н. Г. Горностаев a, К. В. Михайлов b, c, К. И. Адамейко a, А. Д. Финошин a, А. А. Георгиев d, В. С. Михайлов a, Ю. Э. Ерюкова d, Г. А. Рубиновский e, Д. В. Заиц f, Г. Р. Газизова g, О. А. Гусев g, h, Е. И. Шагимарданова g, Ю. В. Люпина a
a Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, ул. Вавилова, 26, Россия
b Московский государственный университет им. М.В. Ломоносова, Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского
119991 Москва, Ленинские горы, 1, стр. 40, Россия
c Институт проблем передачи информации им. А.А. Харкевича Российской академии наук
127051 Москва, Большой Каретный, 19, стр. 1, Россия
d Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 12, Россия
e Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Министерства здравоохранения Российской Федерации
117997 Москва, ул. Островитянова, 1, Россия
f Первый Московский государственный медицинский университет им. И.М. Сеченова
119991 Москва, ул. Трубецкая, 8, стр. 2, Россия
g Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
h Department of Regulatory Transcriptomics for Medical Diagnostics, Juntendo University
113-8421 Tokyo, Japan
* E-mail: kravchuk444@mail.ru
Поступила в редакцию 17.02.2021
После доработки 30.04.2021
Принята к публикации 10.05.2021
Аннотация
Одной из наиболее распространенных эпигенетических модификаций белков у эукариот является ацетилирование/деацетилирование лизина. Гистоновые деацетилазы (HDACs) снижают уровень ацетилирования гистонов, что приводит к подавлению транскрипции. У позвоночных животных хорошо задокументировано участие гистоновых деацетилаз в регуляции пролиферации и дифференцировки клеток, эмбриональном развитии, возникновении и прогрессии злокачественных опухолей. У базальных многоклеточных животных механизмы регуляции экспрессии генов, связанные с активностью гистоновых диацетилаз, не изучены. Однако известно, что процесс реагрегации клеток губок сопровождается их дедифференцировками и трансдифференцировками, что может указывать на вовлечнность диацетилаз в регуляцию этого процесса. Целью нашей работы было изучение экспрессии гистоновых диацетилаз у губки Halisarca dujardinii (Demospongia). На основе анализа транскриптомов губки H. dujardinii и генома губки Amphymedon queenslandica (Demospongia) мы идентифицировали представителей всех классов Zn2+-зависимых HDACs губок. Был проведен анализ дифференциальной экспрессии HDAC в суспензии клеток губки H. dujardinii после диссоциации ее тела и в агрегатах после 24 ч реагрегации. Было исследовано дозозависимое влияние двух селективных ингибиторов HDAC класса I (бутирата натрия и вальпроевой кислоты) на процесс реагрегации клеток. Показано, что добавление селективных ингибиторов HDAC класса I в инкубационную среду при реагрегации приводит к изменению морфологических характеристик клеточных агрегатов губки. Можно предположить, что участие гистоновых деацетилаз в регуляции трансдифференцировки клеток является эволюционно древним механизмом, использовавшимся многоклеточными животными еще до становления тканевой организации.
ВВЕДЕНИЕ
Система регуляции генной экспрессии имеет ключевое значение для процесса дифференцировки клеток. Механизмы активации и репрессии генов хорошо изучены у модельных видов из группы билатерально-симметричных животных, но недостаточно у низших многоклеточных. Губки (Porifera), одни из самых эволюционно древних ныне существующих многоклеточных животных. Тело губок образовано несколькими типами клеток. Пластичность клеток – главная особенность губок. В отличии от других многоклеточных животных, клетки тела губок в течение всей жизни находятся в процессе постоянного движения и трансдифференцировки, связанными, в частности, с непрерывной реорганизацией водоносной системы (Ereskovsky et al., 2013; Lavrov, Kosevich, 2014; Sogabe et al., 2019).
Одной из форм проявления пластичности является способность клеток губок к формированию многоклеточных агрегатов после диссоциации тела губки (Ereskovsky et al., 2021). В начальной стадии реагрегации отдельные клетки губок приобретают округлую форму. Далее клетки слипаются и образуют многоклеточные агрегаты, не имеющие правильной формы (Sipkema et al., 2003). Из агрегатов неправильной формы образуются примморфы – клеточные агрегаты округлой, почти сферической формы, покрытые пинакоцитами – уплощенными клетками, сходными с эпителиальными (Lavrov, Kosevich, 2014). Скорость реагрегации отличается у разных видов губок, но у всех видов агрегаты имеют вначале неправильную форму и небольшие размеры и правильную форму и большие размеры на более поздних ее этапах (Lavrov, Kosevich, 2014; Ereskovsky et al., 2021). Так, у губок класса Demospongiae агрегаты из 15–30 клеток формируются через 15–40 мин после диссоциации тела губки, а через 2–4 ч после диссоциации агрегаты достигают размеров сотен микрометров (Lavrov, Kose-vich, 2014). Реагрегация сопровождается активной миграцией клеток, многочисленными клеточными дедифференцировками и трансдифференцировками (Lavrov, Kosevich, 2014; Ereskovsky et al., 2016). Несмотря на то, что процесс реагрегации описан в 1907 г. (Wilson, 1907), до сих пор остается неясным, как происходит трансдифференцировка клеток губок во время этого процесса (Adamska, 2018). Можно предположить, что определенную роль в регуляции клеточных трансдифференцировок в ходе реагрегации у губок играют эпигенетические модификации белков.
Известно, что при формировании различных клеточных линий из плюрипотентных клеток происходит активация одних генов и репрессия других с помощью эпигенетических меток. Ацетилирование лизина является одной из наиболее распространенных эпигенетических модификаций белков в эукариотических клетках. Ацетилирование и деацетилирование находится под контролем гистоновых ацетилтрансфераз (histone acetyltransferases, HATs) и гистоновых деацетилаз (histone deacetylases, HDACs). Ацетилирование лизина в гистонах приводит к созданию участков открытого хроматина и, следовательно, повышению транскрипции генов. HDACs снижают уровень ацетилирования гистонов и тем самым приводят к компактизации хроматина и подавлению транскрипции (Pazin, Kadonaga, 1997). Помимо лизинов гистонов HDACs способны деацетилировать лизины в других белках (в частности, компонентах транскрипционных комплексов), изменяя различные биологические процессы в клетке. Таким образом, взаимодействие HATs и HDACs обеспечивает динамический гомеостаз клеточных белков. Показано участие HDACs в регуляции пролиферации и дифференцировки, эмбриональном развитии, возникновении и прогрессии злокачественных опухолей (Choi et al., 2001; Lagger, 2002; Sjoblom et al., 2006; Wilson et al., 2006; Montgomery et al., 2007; Bhaskara et al., 2008; Marks, 2010). Различные HDACs в клетках эукариот разделяют на 4 основных класса: три из них – Zn2+-зависимые (I, II, IV) и один – NAD+ зависимый (III). Одним из эффективных методов исследования функции HDACs в клетках является использование специфических ингибиторов. В настоящее время известно большое количество фармакологических ингибиторов, действующих либо на определенные, либо на все HDACs. Одна из групп ингибиторов HDACs, созданная на основе солей жирных кислот, блокирует в основном деацетилазы класса I (Silva et al., 2018) и широко применяются для изучения функции этих ферментов у позвоночных. Бутират натрия (NaBu) и вальпроевая кислота (VPA) – соли жирных кислот, ремоделирующие структуру хроматина, вызывающие гиперацетилирование гистонов, влияющие на экспрессию большого количества генов, в том числе, генов плюрипотенции: sox2, oct4, klf4, c-myc, DPPA2, DPPA3, DPPA4, DPPA5, NANOG, клеточный цикл и дифференцировку клеток (табл. 1). Ингибиторы HDACs NaBu и VPA применяются при получении индуцированных плюрипотентных клеток (D’Anna et al., 1980; Huangfu et al., 2008; Liang et al., 2010; Mali et al., 2010; Chen et al., 2013; Zhang, Wu, 2013; Mahapatra et al., 2017), а также при лечении некоторых типов рака (Louis et al., 2004; Wang et al., 2006; Michaelis et al., 2007; Marks, 2010; Tang et al., 2011; Terranova-Barberio et al., 2017; McClure et al., 2018; Tran et al., 2019; Heers et al., 2018). Многочисленные исследования с использованием NaBu и VPA были проведены на клетках позвоночных, которые являются сложными многоклеточными организмами с высоким уровнем дифференцировки клеток.
Таблица 1.
Влияние NaBu и VPA на клетки в культуре
| Клеточная линия, организм | Концентрация | Наблюдаемые эффекты | Литературный источник | |
|---|---|---|---|---|
| NaBu | CHO, клетки яичника китайского хомячка | 1 мМ и выше, сила эффекта зависит от концентрации | Гиперацетилирование гистонов H2B, H3, H4. Снижается способность клеток переходить из G1 в S фазу | D’Anna et al., 1980 |
| MCF7 и MCF7-A (устойчивая к адриамицину), инвазивная аденокарциномы протоков молочной железы человека | 1 мМ | Остановка клеточного цикла в G1 фазе | Fagot et al., 1994 | |
| KB-3-1 и KB-A (устойчивая к адриамицину), рак эпиталеальной ткани человека | 2 мМ 3 мМ |
Остановка клеточного цикла в G1 и G2/M фазе Временное снижение экспрессии гена c-myc |
Fagot et al., 1994 | |
| IMR90, фибробласты человека | 0.5 мМ | Гиперацетилирование H3K9 гистона H3, усиление ДНК деметилирования. Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc, повышение экспрессии генов, связанных с плюрипотенцией (DPPA2, DPPA3, DPPA4, DPPA5, и NANOG) | Mali et al., 2010 | |
| MEF, эмбриональные мышиные фибробласты | 0.25–1 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc | Liang et al., 2010 | |
| HFF, фибробласты человека | 0.5 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc. Повышение стабильности и повышение экспрессии микро-РНК miR302/367 кластера | Zhang, Wu, 2013 | |
| MEF, эмбриональные мышиные фибробласты | 1 мМ | Спонтанная конверсия преиндуцированных стволовых плюрипотентных клеток (pre-iPSCs) в iPSCs, повышение экспрессии в pre-iPSCs клетках p15, p21, p53, Nanog, Sox2, Oct4, Klf4, c-Myc | Kang et al., 2014 | |
| MAC-T, бычьи эпителиальные клетки молочной железы | От 0 до 5 мМ | Гиперацетилирование H3K9/14, H3K18 и H3K27 гистона H3; селективное ингибирование HDAC2, 3 и 8 (при концентрации выше 1 мМ) | Silva et al., 2018 | |
| VPA | IMR90, фибробласты человека | 1 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc. Повышение экспрессии генов, связанных с плюрипотенцией (DPPA2, DPPA3, DPPA4, DPPA5, и NANOG). Эффект слабее, чем в случае NaBu | Mali et al., 2010 |
| MEF, эмбриональные мышиные фибробласты | 2 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием 4 ТФ (Oct4, Sox2, Klf4, c-Myc) или 3 ТФ (Oct4, Sox2, Klf4) | Huangfu et al., 2008 | |
| HeLa, раковая опухоль шейки матки человека |
От 0 до 5 мМ |
Ингибирование деацетилазы HDAC1 (сила эффекта зависит от концентрации) | Phiel et al., 2001 | |
| Эмбрионы шпорцевой лягушки | 5 мМ | Тератогенный эффект (уменьшение размеров и нарушение развития эмбриона) | ||
| Neuro2A, мышиная нейробластома | 0, 2, 5 мМ | Активирует транскрипцию с различных промоторов при концентрации выше 2 мМ | ||
| 293T, эмбриональные почечные клетки человека | От 0 до 20 мМ | Активирует транскрипцию с различных промоторов при концентрации выше 2мМ | ||
| P19, эмбриональная карцинома мышей | 0.1–1 мМ | Индукция дифференциации плюрипотентных клеток эмбриональной мышиной карциномы в скелетные миоциты. Активация транскрипции, специфичной для мышц (Pax3, MYOG и MyoD). | Chen et al., 2013 | |
| FNS (культура 328), мозг 9-недельного эмбриона человека | 1 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc | Medvedev et al., 2011 | |
| Индуцированные плюрипотентные клетки человека (hiPS) | 1 мМ | Повышение эффективности дифференциации hiPS в гепатоциты | Kondo et al., 2014 | |
| bFFs, фетальные фибробласты буйвола (Bubalus bubalis) | 1.5 мМ | Повышение эффективности получения индуцированных плюрипотентных клеток с использованием ТФ Oct4, Sox2, Klf4, и c-Myc | Mahapatra et al., 2017 |
Насколько древней и эволюционно консервативной является регуляция дифференцировки клеток с помощью гистоновых деацетилаз? Ответ на этот вопрос может быть получен при изучении животных, филогенетически далеких от позвоночных и не имеющих настоящих тканей. Учитывая, что в ходе реагрегации клеток губок наблюдаются трансдифференцировки клеток (Lavrov 2016, 2020; Ereskovsky 2018, 2021), мы рассчитывали приблизиться к ответу на данный вопрос за счет экспериментов на реагрегирующих клетках H. dujardinii.
Целью настоящей работы было описание деацетилаз гистонов морской губки H. dujardinii из класса Demospongiae и исследование их экспрессии в ходе реагрегации диссоциированных клеток. Основным экспериментальным подходом являлось изучение реагрегации клеток губок в условиях подавления активности HDACs ингибиторами NaBu и VPA.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы губок
Образцы губок H. dujardinii были собраны в сублиторальной зоне (0–2 м) в районе Беломорской биологической станции МГУ. Сборы губок осуществлялись в январе и ноябре. Ранее установлено, что на разных стадиях жизненного цикла процесс реагрегации клеток губки H. dujardinii имеет сходный паттерн, но отличается по темпам реагрегации (Lavrov et al., 2020). Температура воды в районе сбора в январе составляла 0–2°С, а в ноябре 5–6°С. Губок собирали с субстратом (водорослями) для сохранения микроокружения по 7–8 особей в 5 л аквариумах с природной морской водой, которые помещали в термобоксы с контролем температуры 1–4°С зимой и 5–8°C осенью и транспортировали в ИБР РАН. До экспериментов губки содержались на субстрате в 5 л аквариумах с природной морской водой при температуре 4–5°С зимой и 8–10°С осенью. Период адаптации составлял не более 5 дней до начала эксперимента (Finoshin et al., 2020). Перед экспериментом у губок выявляли функциональную целостность водоносной системы по наличию фильтрации воды через оскулюмы и очищали от сопутствующих беспозвоночных.
Эксперимент по диссоциации и реагрегации губки
Губок снимали с субстрата индивидуально, измельчали с помощью стерильных одноразовых микроскальпелей на приблизительно одинаковые части размером 2 × 2 × 2 мм в стерильной чашке Петри в морской воде, фильтрованной через фильтр 0.22 мкм (Merck Millipore, США), и диссоциировали с помощью пипетки со стерильным наконечником на 1000 мкл, как было описано ранее (Finoshin et al., 2020). Полученная суспензия была профильтрована через стерильное сито с диаметром поры 40 мкм (Life Sciences, США). Клеточную суспензию центрифугировали 5 мин при 300 g. Клетки анализировали сразу после диссоциации. Были подсчитаны количество и процент живых клеток (обычно более 96–98%) в 10 мкл суспензии, смешанной с 10 мкл 0.4% трипанового синего с помощью стандартного гемоцитометра. Из части клеточной суспензии интактной губки выделяли РНК (см ниже). Другую часть клеточной суспензии в концентрации 1 × × 107 кл/мл высевали по 2 мл в лунки 6-луночного планшета и инкубировали 24 ч при температуре 5°С зимой и 10°С осенью для получения агрегатов, после чего их собирали в пробирки и выделяли РНК (Finoshin et al., 2020).
Реагрегация в условиях воздействия ингибиторов HDACs
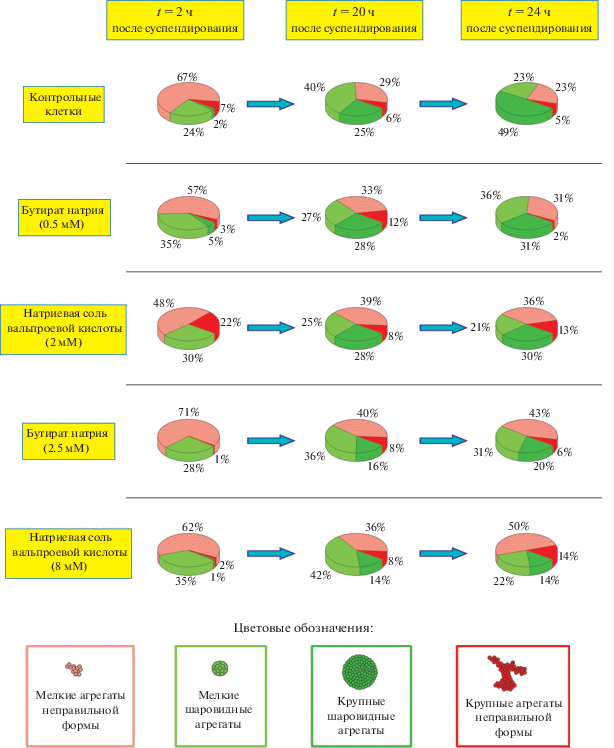
Эксперименты по влиянию ингибиторов на процесс реагрегации проводили с губками, собранными осенью. Исследовали начальную стадию реагрегации и стадию образования первичных примморфов. Появление первичных клеточных агрегатов неправильной формы регистрировали через 1 ч, а многоклеточных агрегатов через 5–7 ч после диссоциации губок в соответствии с ранее опубликованными данными (Lavrov, Kosevich, 2014; Lavrov et al., 2020). Для регистрации первичных агрегатов фотосъемку проводили через 2 ч, а для первичных примморфов – через 20 и 24 ч после диссоциации клеток тела губки. Процесс реагрегации проводили в культуральных 4-луночных флаконах (SPL LifeSciences, Корея). В клеточную суспензию (объем 2 мл) добавляли бутират натрия, NaBu (до концентрации 0.5 и 2.5 мМ) или натриевую соль вальпроевой кислоты, VPA (до концентрации 2 и 8 мМ). В контрольную лунку добавляли соответствующее количество фильтрованной морской воды. Клетки инкубировали при температуре 5–7°С. Оценку морфологических параметров отдельных клеток и клеточных агрегатов проводили в указанные сроки с помощью световой микроскопии с использованием инвертированного микроскопа Olympus IX51, снабжeнного 14-битной CCD-камерой Olympus XM10 под управлением лицензионного программного обеспечения CellSense, и шаттером UniBlitz model D122 под управлением программы Micro-manager. Суспензии клеток помещали в ячейки SPL Life Sciences 30104. При съемке применяли сухой фазовоконтрастный объектив LUCPlanFLN 40×. Для поддержания температурного режима во время съемки предметный столик микроскопа охлаждали хладогентами и дополнительно использовали систему OkoLab Uno, помещая емкость для увлажнения подаваемого к клеткам воздуха в лед. Размер и форму агрегатов анализировали в трех временных точках – через 2, 20 и 24 ч после диссоциации губок и инкубации клеток в присутствии NaBu 0.5 мМ, NaBu 2.5 мМ, VPA 2 мМ, VPA 8 мМ и в отсутствие ингибиторов (контроль). Агрегаты из 3–5 клеток не учитывались. К мелким относили агрегаты, хотя бы один линейный промер которых составлял от 20 до 40 мкм, к крупным – от 40 до 70 мкм. Самым большим был агрегат размером 70 мкм. Размер и форму агрегатов анализировали в трех временных точках – через 2, 20 и 24 ч после диссоциации губок и инкубации клеток в присутствии NaBu 0.5 мМ, NaBu 2.5 мМ, VPA 2 мМ, VPA 8 мМ и в отсутствие ингибиторов (контроль). Для каждой из 15 экспериментальных точек были сделаны по 10 фотографий произвольно выбранных полей зрения, на которых сформированы 4 группы (крупные шаровидные агрегаты, мелкие шаровидные агрегаты, крупные агрегаты неправильной формы, мелкие агрегаты неправильной формы) и подсчитано количество агрегатов в группе. Для каждой из четырех выборок чисел, соответствующих количеству клеточных агрегатов разной морфологии определяли относительные значения, выраженные в процентах (абсолютные значения менялись в ходе эксперимента в сторону уменьшения благодаря постепенной сборке из мелких агрегатов меньшего количества более крупных). Статистическую обработку результатов экспериментов проводили при помощи лицензионного программного обеспечения Origin 6.1. Суммарное количество всех проанализированных клеточных агрегатов составило 1517 единиц. Дисперсионный анализ (One-way ANOVA) с доверительным интервалом p = 0.05 показал, что для каждой экспериментальной точки средние значения выборок являются достоверно различными.
Выделение РНК, конструирование библиотек кДНК и секвенирование
РНК была выделена с использованием TRI Reagent (Molecular Research Center, Inc.), обработана DNase I (Ambion) и очищена с помощью Ribo-zero rRNA Removal Kit (Human/Mouse/Rat) (Illumina). Для одно-концевых прочтений длиной 50 по мРНК была выделена с помощью NEBNext® Poly(A) mRNA Magnetic Isolation Module (New England Biolabs) из 300 нг тотальной РНК. Фрагменты кДНК для библиотек получали с использованием NEBNext® Ultra™ II Directional RNA Library Prep Kit для Illumina® (“New England Biolabs”, США), проверяли, используя Agilent 2100 DNA High Sensitivity Kit, и секвенировали на приборе Illumina Hiseq2500.
Транскриптомная сборка и анализ дифференциальной экспрессии
На основе транскриптомной сборки, полученной ранее на базе парно-концевых прочтений (Finoshin et al., 2020), произведено предсказание белковых продуктов с помощью TransDecoder v. 5.5 (Haas et al., 2013). Гомологи HDACs найдены с помощью программы blastp (Altschul, 1997). Одно-концевые прочтения для интактной губки, диссоциированных клеток и агрегатов были картированы на транскриптомную сборку с помощью bowtie 2 v. 2.4.1 (Langmead, Salzberg, 2012). Уровни экспрессии транскриптов были рассчитаны с помощью RSEM v. 1.3.3 (Li, Dewey, 2011), после фильтрации низкоэкспрессирующихся транскриптов они были нормализованы методом TMM (trimmed mean of M-values, усеченное среднее М-значений – логарфмированных уровней изменения экспрессии) и переведены в значения CPM (counts per million, число прочтений, отнесенных к данному транскрипту, на миллион прочтений) с помощью пакета edgeR v. 3.32 (McCarthy et al., 2012). Были вычислены логарифмированные уровни изменения экспрессии в диссоциированных и реагрегировавших клетках по отношению к интактной ткани тела губки, из которой они были получены. Для каждого транскрипта был вычислен уровень значимости при модели отрицательно-биномиального распределения с факторами сезона и стадии реагрегации, скорректированный затем методом Бенджамини–Хохберга. В качестве порогового уровня FDR (false discovery rate, доли ложноположительных результатов) использован уровень 0.01. Ген считался дифференциально экспрессирующимся, если наблюдался хотя бы один случай достоверно изменяющейся экспрессии в процессе реагрегации. Полученные данные визуализированы с помощью пакета ComplexHeatmap v. 2.6.2 (Gu et al., 2016).
Филогенетический анализ деацетилаз гистонов классов I и II
Гомологи HDAC для выборки эукариотических организмов определяли при помощи кластеризации протеомов с программой OrthoFinder (Emms, Kelly, 2015). Для кластеризации использовали геномные данные из баз данных NCBI (https://www.ncbi.nlm.nih.gov), UniProt (https:// www.uniprot.org/), а также Mnemiopsis Genome Project Portal (https://research.nhgri.nih.gov/mnemiopsis/) и Multicellgenome Lab (https://multicellgenome.com). Гомологи HDAC в геномных и транскриптомных данных губок Oscarella pearsei (https://figshare.com/articles/dataset/Oscarella_pearsei_assemblies/7107638/1) и Sycon ciliatum (http://www.compagen.org/datasets.html) искали программой BLASTp (Altschul, 1997). Последовательности из ортогрупп, соответствующих деацетилазам классов I и II, выравнивали программой MAFFT (Katoh, Standley, 2013) в режиме L-INS-i. При подготовке выравниваний для филогенетического анализа, их инспектировали вручную и обрабатывали методом gappyout программы trimAl (Capella-Gutierrez et al., 2009), с целью удаления сомнительных и разрозненных участков выравнивания. Филогенетический анализ проводили методом максимального правдоподобия, реализованного в программе IQ-TREE (Minh et al., 2020). Модели эволюции для реконструкции деревьев были выбраны на основе автоматического поиска с ModelFinder (Kalyaanamoorthy et al., 2017). Статистическая поддержка узлов деревьев была рассчитана методом бутстрэпа с 1000 реплик. Визуализацию консенсусных деревьев проводили при помощи программы MEGA (Kumar et al., 2018).
РЕЗУЛЬТАТЫ
Аннотация Zn2+-зависимых HDACs губки H. dujardinii
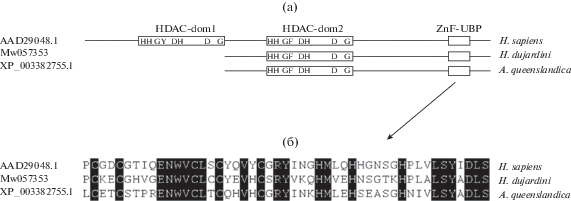
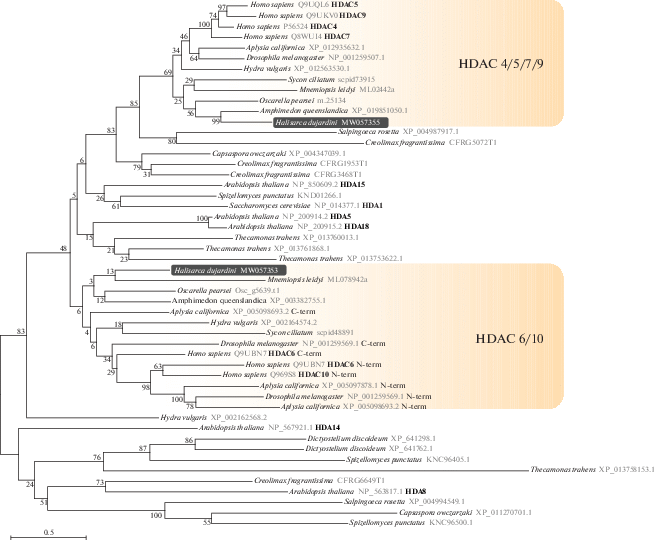
На основе транскриптомных сборок для H. dujardinii, описанных нами ранее (NCBI, PRJNA594150), были идентифицированы представителей всех классов Zn2+-зависимых HDACs характерных для животных (табл. 2). Гистоновые деацетилазы класса I представлены у H. dujardinii тремя генами, которые соответствуют ортологам HDAC1/2, HDAC3 и, предположительно, HDAC8 человека (рис. 1). Деацетилазы класса II представлены у H. dujardinii двумя генами, группирующимися с HDAC6/10 и HDAC4/5/7/9 животных (рис. 2). Состав Zn2+-зависимых деацетилаз у H. dujardinii соответствует ожидаемому предковому состоянию для животных – сходный состав деацетилаз также найден у губок Amphimedon queenslandica и Sycon ciliatum и представителей другой базальной ветви животных, гребневика Mnemiopsis leidyi. Дупликации, приведшие к обособлению HDAC6 и HDAC10, а также появлению дополнительных представителей группы HDAC4/5/7/9, возникают позже в эволюции животных. Так, обособленные HDAC6 и HDAC10 встречаются только у билатерально-симметричных животных. Дополнительный каталитический домен, характерный для деацетилаз HDAC6 и HDAC10 билатерий, отсутствует у H. dujardinii и других ранних представителей животных (рис. 3а), что указывает на более позднее возникновение второго домена у HDAC6/10 путем дупликации. Также, как и у млекопитающих, у губок на C конце HDAC6 присутствует убиквитин-связывающий домен (рис. 3б). Таким образом, как и ожидалось, мы обнаружили у H. dujardinii HDAC1/2 (HDAC1), HDAC3, HDAC8 (класс I); HDAC4/5/7/9 (HDAC4), HDAC6/10 (HDAC6) (класс II); HDAC11 (класс IV). Из всех HDACs H. dujardinii, представители первого класса, HDAC1 и HDAC3, имеют наибольшее сходство с белками человека (табл. 2), а HDAC6 и 8 – наименьшее сходство.
Таблица 2.
Zn2+-зависимые гистоновые деацетилазы (HDACs) губок H. dujardinii и A. queenslandica. Указаны идентификационные номера в базе NCBI (https://www.ncbi.nlm.nih.gov)
| Класс | Название | Локализация у человека | H. dujardinii | A. queenslandica (идентичность в % с а.к. последовательностью H. dujardinii) |
H. sapiens (идентичность в % с а.к. последовательностью H. dujardinii) |
|---|---|---|---|---|---|
| I (гомологи RPD3 дрожжей) |
HDAC1 | Ядро | BankIt2388591 Seq1 MW057352 | XP_003385311.1 (76%) | NP_004955.2 (78%) |
| HDAC2 | Ядро | NP_001518.3 (75%) | |||
| HDAC3 | Ядро | BankIt2388591 Seq5 MW057356 | XP_019850949.1 (81%) | NP_003874.2 (71%) | |
| HDAC8 | Ядро | BankIt2388591 Seq6 MW057357 | XP_003384638.1 (46%) | NP_060956.1 (48%) | |
| IIa (гомологи HDA1 дрожжей) |
HDAC4 | Ядро/ цитоплазма |
BankIt2388591 Seq4 MW057355 | XP_011403467.2 (58%) | AAD29046.1 (53%) |
| HDAC5 | Ядро/ цитоплазма |
AAD29047.1 (53%) | |||
| HDAC7 | Ядро/ цитоплазма |
AAF63491.1 (51%) | |||
| HDAC9 | Ядро/ цитоплазма |
AAO27363.1 (51%) | |||
| IIb (несут два каталитических сайта) |
HDAC6 | Цитоплазма | BankIt2388591 Seq2 MW057353 | XP_003382755.1 (45%) | AAH13737.1 (49%) |
| HDAC10 | Цитоплазма | AAS48345.1 (38%) | |||
| IV (имеют участки гомологии с классами I и II) |
HDAC11 | Ядро/ цитоплазма |
BankIt2388591 Seq3 MW057354 | XP_003389345.2 (67%) | NP_079103.2 (60%) |
Рис. 1.
Филогенетическое дерево деацетилаз гистонов класса I. Дерево реконструировано методом максимального правдоподобия с программой IQ-TREE; для реконструкции была использована модель эволюции LG + I + G4, выбранная при помощи ModelFinder как наиболее подходящая; цифры на ветвях дерева соответствуют значениям поддержки в процентах, рассчитанным методом бутстрэпа с 1000 реплик. На дереве выделены последовательности HDAC из H. dujardinii, а также отмечены и названы группы HDAC животных, соответствующие ортологам из Homo sapiens. Последовательность H. dujardinii MW057357 группируется вместе с дивергентными представителями деацетилаз класса I, в числе которых HDAC8 из H. sapiens, и, вероятно, является ортологом HDAC8, однако данная группа не отмечена на дереве, так как последовательности из животных не образуют монофилетическую группу, кластеризуясь с деацетилазами из грибов, включая Hos1 дрожжей.
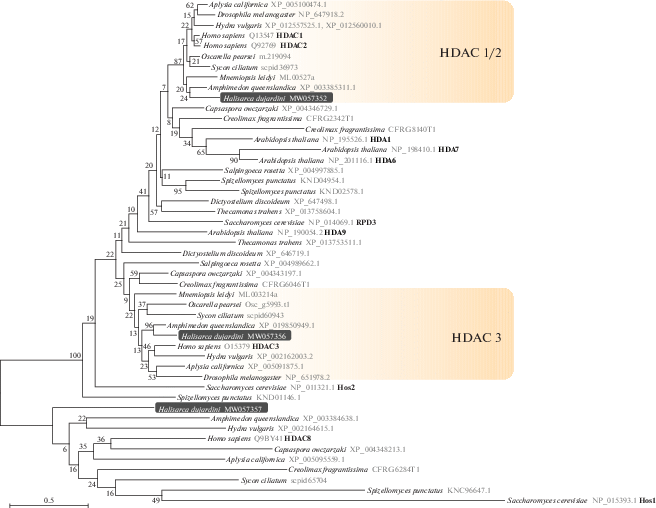
Рис. 2.
Филогенетическое дерево деацетилаз гистонов класса II. Дерево реконструировано методом максимального правдоподобия с программой IQ-TREE; для реконструкции была использована модель эволюции LG + R5, выбранная при помощи ModelFinder как наиболее подходящая; цифры на ветвях дерева соответствуют значениям поддержки в процентах, рассчитанным методом бутстрэпа с 1000 реплик. На дереве выделены последовательности HDAC из H. dujardinii, а также отмечены и названы группы HDAC животных, соответствующие ортологам из Homo sapiens. Деацетилазы животных HDAC 6/10 с двумя каталитическими доменами были разделены на N-терминальный (N-term) и C‑терминальный (C-term) домены; высоко дивергентный C-терминальный домен HDAC10 из H. sapiens и Aplysia californica был исключен из анализа.
Дифференциальная экспрессия генов HDACs в процессе реагрегации
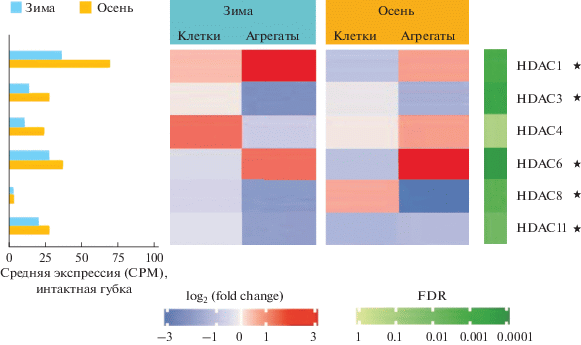
Для того, чтобы охарактеризовать экспрессию HDACs в ходе реагрегации, мы сравнили методом RNA-seq уровень их экспрессии в интактных губках, клеточной суспензии и агрегатах. Эксперимент по реагрегации был проведен в лабораторных условиях, как описано в Материалах и методах. В ходе агрегации наблюдался достаточно высокий уровень экспрессии всех деацетилаз, кроме HDAC8 (табл. 3, рис. 4), самый высокий уровень экспрессии был у HDAC1. Экспрессия HDAC4 в ходе агрегации не изменялась, все остальные гистоновые деацетилазы экспрессировались дифференциально. Так, образование агрегатов сопровождалось увеличением экспрессии HDAC1 и 6 и уменьшением экспрессии HDAC3, 8 и 11. Несмотря на некоторые различия в среднем уровне экспрессии в интактных губках, собранных осенью и зимой, для этих деацетидаз наблюдались сходные изменения в процессе реагрегации. Изменение экспрессии деацетилаз в ходе реагрегации свидетельствует о возможном их участии в регуляции этого процесса.
Таблица 3.
Уровень экспрессии в интактных губках (тк), клеточной суспензии (кл) и агрегатах (аг), рассчитанный в CPM (число прочтений, отнесенных к данному транскрипту, на миллион прочтений) после нормализации методом TMM (усеченное среднее М-значений); логарифмированные уровни изменения экспрессии (log fold change) в диссоциированных клетках и агрегатах по отношению к интактной ткани (кл-тк и аг-тк); уровень значимости P; скоректированные уровни значимости FDR (false discovery rate, доля ложноположительных результатов)
| Наз-вание | Уровень экспрессии, зима | Уровень экспрессии, осень | log fold change, зима | log fold change, осень | P | FDR | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| тк1 | тк2 | тк3 | кл1 | кл2 | кл3 | аг1 | аг2 | аг3 | тк1 | тк2 | кл1 | кл2 | аг1 | аг2 | кл-тк | аг-тк | кл-тк | аг-тк | |||
| HDAC1 | 40.42 | 38.43 | 39.91 | 49.09 | 49.97 | 49.73 | 144.72 | 87.82 | 106.26 | 72.92 | 72.20 | 47.20 | 45.03 | 104.63 | 103.57 | 0.32 | 1.51 | –0.65 | 0.52 | 0.00010 | 0.00113 |
| HDAC3 | 17.33 | 15.44 | 15.79 | 15.68 | 17.61 | 16.32 | 4.99 | 7.12 | 4.57 | 31.44 | 28.94 | 27.96 | 28.24 | 15.72 | 16.22 | 0.03 | –1.52 | –0.10 | –0.91 | 0.00002 | 0.00033 |
| HDAC4 | 11.13 | 12.51 | 12.24 | 22.43 | 23.53 | 24.07 | 8.02 | 9.91 | 7.90 | 25.44 | 26.84 | 27.20 | 26.36 | 39.87 | 36.32 | 0.96 | –0.47 | 0.03 | 0.54 | 0.05862 | 0.13030 |
| HDAC6 | 33.18 | 26.61 | 31.62 | 24.50 | 25.63 | 25.00 | 46.93 | 56.49 | 65.50 | 35.90 | 41.92 | 24.59 | 24.33 | 128.15 | 125.83 | –0.28 | 0.88 | –0.67 | 1.70 | 0.00001 | 0.00015 |
| HDAC8 | 4.92 | 4.71 | 4.99 | 4.09 | 3.41 | 3.72 | 2.40 | 1.21 | 1.98 | 5.89 | 4.94 | 7.26 | 7.68 | 1.21 | 1.23 | –0.37 | –1.34 | 0.46 | –2.07 | 0.00029 | 0.00257 |
| HDAC11 | 24.96 | 18.71 | 21.86 | 16.81 | 18.13 | 21.68 | 8.10 | 9.37 | 10.07 | 30.61 | 31.70 | 17.41 | 17.84 | 19.23 | 18.38 | –0.21 | –1.24 | –0.82 | –0.73 | 0.00119 | 0.00731 |
Рис. 4.
Анализ дифференциальной экспрессии гистоновых деацетилаз (HDACs) во время диссоциации и реагрегации губки H. dujardinii. Слева показан средний уровень экспрессии в интактных губках для зимних и осенних образцов, рассчитанный в CPM (число прочтений, отнесенных к данному транскрипту, на миллион прочтений) после нормализации методом TMM (усеченное среднее М-значений). На тепловой карте справа показаны логарфмированные уровни изменения экспрессии (log fold change) в диссоциированных клетках и агрегатах по отношению к интактной ткани и скорректированные уровни значимости FDR (false discovery rate, доля ложноположительных результатов). * FDR < 0.01.
Влияние ингибиторов HDACs NaBu и VPA на процесс реагрегации
Нами были проведены опыты по реагрегации клеток губки после механической диссоциации ее тела на отдельные клетки в присутствии ингибиторов HDACs – NaBu и VPA. Ингибиторы NaBu и VPA селективно действуют на HDACs класса I, поэтому из двух деацетилаз этого класса, показывающих высокую экспрессию в агрегатах (HDAC1 и 6, рис. 4), они могут ингибировать только HDAC1 (Matsuyama, 2002). Выбор концентраций ингибиторов осуществляли на основе данных литературы (табл. 1) и предварительных экспериментов. Известно, что 0.5 мМ NaB и 2 мМ VPA не оказывают выраженного токсического эффекта на клетки. Эти концентрации ингибиторов были использованы как начальные. Губки механически диссоциировали (рис. 5а) и инкубировали в присутствии ингибиторов или без таковых (рис. 6). Через 2 ч после получения суспензии во всех образцах наблюдали слипание клеток и образование преимущественно мелких агрегатов (20–40 мкм), неправильной формы (рис. 5в) и некоторого количества мелких агрегатов правильной формы (рис. 5б), что соответствует начальной стадии реагрегации. В дальнейшем появлялись крупные агрегаты (40–70 мкм) неправильной (рис. 5д) и правильной шаровидной формы (рис. 5г). Через 20 ч после диссоциации стали очевидны различия между контрольными и опытными образцами в количестве крупных агрегатов шаровидной формы – в опытных образцах в присутствии 2.5 мМ NaBu и 8 мМ VPA их относительное количество было значительно снижено по сравнению с контрольными образцами (рис. 6). Этот эффект был более выражен после 24 ч инкубации – пробы с ингибиторами отличались от контрольных низким относительным количеством агрегатов правильной шарообразной формы (рис. 6). При этом ингибитор VPA в концентрации 8 мМ оказывал более сильное ингибирующее действие на продукцию крупных правильных агрегатов, чем NaBu в концентрации 2.5 мМ (рис. 6). Таким образом, эффект ингибиторов заключался в уменьшении эффективности образования крупных агрегатов правильной формы. Оба ингибитора HDACs замедляли и, очевидно, нарушали процесс реагрегации.
ОБСУЖДЕНИЕ
Проведенное исследование показало, что у губок H. dujardinii, A. quuenslandica и Sycon ciliatum система деацетилирования белков сложно устроена: у них имеются представители всех классов Zn2+-зависимых деацетилаз гистонов (HDACs), характерных для животных (табл. 2, рис. 1, 2). Наибольший уровень экспрессии в теле губки обнаружен у принадлежащей к классу I деацетилазе HDAC1. Деацетилазы класса I широко распространены у разных животных. Они экспрессируются в тканях всех типов и имеют большее значение для выживания клеток и пролиферации, чем HDACs других классов (Marks, 2010). HDACs класса I участвуют в регуляции пролиферации и дифференцировки клеток в эмбриональном развитии (Choi et al., 2001; Lagger, 2002; Sjoblom et al., 2006; Wilson et al., 2006; Montgomery et al., 2007; Bhaskara et al., 2008). Именно деацетилазы класса I губок, HDAC1 и 3, имеют наибольшее сходство в аминокислотной последовательности с гомологичными белками человека, что говорит об эволюционной консервативности их структуры и, вероятно, функции. Модификация “гистоного кода” за счет активности деацетилаз является ключевым звеном в эпигенетической регуляции функционирования генома (Wang et al., 2008).
Одна из удобных модельных систем, позволяющая исследовать поведение и процессы де/дифференцировки и трансдифференцировки клеток у Porifera – формирование агрегатов из диссоциированных клеток губок. Мы использовали эту модель для оценки дифференциальной экспрессии деацетилаз гистонов в клетках губок в процессах диссоциации и реагрегации. Было обнаружено, что экспрессия деацетилаз разных классов изменяется в ходе реагрегации клеток H. dujardinii дифференциально – экспрессия HDAC1 и 6 увеличивается, а экспрессия HDAC3, 8 и 11 уменьшается. Эти результаты позволили сделать предположение о том, что деацетилазы гистонов могут быть вовлечены в регуляцию процесса реагрегации. Для проверки этого предположения были проведены эксперименты по реагрегации с использованием селективных ингибиторов HDACs I класса.
Мы обнаружили, что селективные ингибиторы HDACs I класса нарушают процесс реагрегации клеток H. dujardinii – под их воздействием уменьшается доля крупных агрегатов (40–70 мкм) и агрегатов шаровидной формы. Причем этот эффект зависит от дозы ингибитора – с увеличением его концентрации наблюдаемый эффект усиливался (рис. 5 и 6). Опыты с селективными ингибиторами показывают важную роль HDACs I класса для нормального протекания процесса реагрегации. Поскольку начальные этапы реагрегации клеток контрольной и опытной групп не отличаются (рис. 5б, 5в), очевидно, что уменьшение доли крупных агрегатов происходит или вследствие нарушения слияния мелких клеточных агрегатов, или за счет нарушения включения свободных клеток из суспензии. Также возможно, что мелкие клеточные агрегаты в опытной и контрольной группе различны по составу морфологических типов клеток. Регуляция экспрессии генов в процессе клеточной дедифференцировки осуществляется с помощью различных механизмов, среди которых большое значение имеет эпигенетическая регуляция (Wang et al., 2008; Smith, Meissner, 2013). Дедифференциация происходит вскоре после диссоциации тела губки и во время нее, когда большинство клеток теряют свои морфологические признаки, приобретая амебоидный фенотип (Lavrov, Kosevich, 2016), а первичные мелкие агрегаты представляют собой совокупность клеток, имеющих амебовидную или шаровидную формы (Lavrov, Kosevich, 2016; Ereskovsky et al., 2021). Можно предположить, что снижение активности деацетилаз может влиять на дедифференцировку клеток в суспензии или снижать подвижность и адгезивные свойства клеток амебоидного типа, необходимых для установления межклеточных контактов (Inoue et al., 2006; Sacks et al., 2018).
Дифференциальная экспрессия деацетилаз и нарушения, наблюдаемые при воздействии ингибиторов, могут также указывать на важную роль циклов ацетилирования/деацетилирования негистоновых белков в регуляции реагрегации клеток губок. Такое предположение подтверждается имеющейся информацией о роли деацетилаз в модификации транскрипционных факторов (Marks, 2010).
У интактных губок H. dujardinii ген HDAC6 показал довольно высокий уровень экспрессии, и его экспрессия повышалась в клеточных агрегатах (рис. 3). Возможно, что участие именно этой деацетилазы – HDAC6 (класс IIb) – в регуляции реагрегации является важным. Мы показали, что HDAC6 губок H. dujardinii и А. queenslandica имеет деацетилазный домен dom2 и на C-конце сайт связывания убиквитина. Данные литературы говорят о том, что деацетилазный домен dom2 участвует в деацетилировании тубулина (Matsuyama, 2002; Haggarty et al., 2003) и HSP90 (Marks, 2010). Снижение экспрессии HDAC6 приводит к накоплению этих белков в ацетилированном виде. Ацетилированный белок HSP90 теряет функции шаперона, а его партнеры убиквитинируются и деградируют (Kawaguchi et al., 2003; Boyault et al., 2006). Не вызывает сомнения важная роль HSP90 в морфогенетических процессах у беспозвоночных, о чем свидетельствуют данные литературы, показывающие, что его экспрессия меняется в процессе развития (Giudice et al., 1999; Bishop et al., 2001; Bishop, Brandhorst, 2001; Gunter, Degnan, 2007).
Проведенное исследование показало, что система деацетилирования лизина в молекулах белка у губки H. dujardinii имеет общие функциональные характеристики с таковой у позвоночных животных (в т.ч. человека). Это эволюционно древний механизм регуляции активности генома. Вопрос о возможном участии деацетилаз, и особенно HDAC6, в регуляции клеточных процессов, необходимых для реагрегации клеток губок, заслуживает дополнительного изучения. Дальнейшее изучение деацетилаз и их белков-мишеней у губок и других беспозвоночных позволит выяснить закономерности эволюции молекулярных механизмов, регулирующих процессы развития многоклеточных животных.
Список литературы
Зенкевич Л.А. Биология морей СССР / Москва: АН СССР, 1963. 738 с.
Фокина Н.Н., Нефедова З.А., Немова Н.Н. Биохимические адаптации морских двустворчатых моллюсков к аноксии (обзор) // Труды Карельского научного центра РАН. 2011. № 3. С. 121–130.
Adamska M. Differentiation and transdifferentiation of sponge cells // Marine Organisms as Model Systems in Biology and Medicine Results and Problems in Cell Differentiation / Ed. Kloc J.Z. Kubiak. Cham: Springer International Publishing, 2018. P. 229–253.
Altschul S. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs // Nucleic Acids Research. 1997. V. 25. № 17. P. 3389–3402.
Bhaskara S., Chyla B.J., Amann J.M. et al. Deletion of histone deacetylase 3 reveals critical roles in S phase progression and DNA damage control // Molecular Cell. 2008. V. 30. № 1. P. 61–72.
Bishop C.D., Bates W.R., Brandhorst B.P. Regulation of metamorphosis in ascidians involves NO/cGMP; signaling and HSP90 // J. Exp. Zool. 2001. V. 289. № 6. P. 374–384.
Bishop C.D., Brandhorst B.P. NO/cGMP signaling and HSP90 activity represses metamorphosis in the sea urchin Lytechinus pictus // The Biological Bulletin. 2001. V. 201. № 3. P. 394–404.
Boyault C., Gilquin B., Zhang Y. et al. HDAC6–p97/VCP controlled polyubiquitin chain turnover // EMBO J. 2006. V. 25. № 14. P. 3357–3366.
Capella-Gutierrez S., Silla-Martinez J.M., Gabaldon T. trimAl: a tool for automated alignment trimming in large-scale phylogenetic analyses // Bioinformatics. 2009. V. 25. № 15. P. 1972–1973.
Chen J., Lacroix N., Li Q. Histone deacetylase inhibitor valproic acid as a small molecule inducer to direct the differentiation of pluripotent stem cells // Gene Regulation Methods in Molecular Biology / Ed. Bina M. Totowa, NJ: Humana Press, 2013. P. 359–363.
Choi J.-H., Kwon H.J., Yoon B.I. et al. Expression profile of histone deacetylase 1 in gastric cancer tissues // Japanese Journal of Cancer Research. 2001. V. 92. № 12. P. 1300–1304.
Costa S., Nicosia A., Cuttitta A. et al. An intronic cis-regulatory element is crucial for the alpha tubulin Pl-tuba1a gene activation in the ciliary band and animal pole neurogenic domains during sea urchin development // PLoS One. 2017. 12:e0170969.
D’Anna J.A., Tobey R.A., Gurley L.R. Concentration-dependent effects of sodium butyrate in Chinese hamster cells: cell-cycle progression, inner-histone acetylation, histone H1 dephosphorylation, and induction of an H1-like protein // Biochemistry. 1980. V. 19. № 12. P. 2656–2671.
Emms D.M., Kelly S. OrthoFinder: solving fundamental biases in whole genome comparisons dramatically improves orthogroup inference accuracy // Genome Biol. 2015. V. 16. № 1. P. 157.
Ereskovsky A. Reproduction cycles and strategies of the cold-water sponges Halisarca dujardini (Demospongiae, Halisarcida), Myxilla incrustans and Iophon piceus (Demospongiae, Poecilosclerida) from the White Sea // The Biological Bulletin. 2000. V. 198. № 1. P. 77–87.
Ereskovsky A., Borisenko I.E., Bolshakov F.V. et al. Whole-body regeneration in sponges: Diversity, fine mechanisms, and future prospects // Genes. 2021. V. 12. № 4. P. 506.
Ereskovsky A.V., Chernogor L.I., Belikov S.I. Ultrastructural description of development and cell composition of primmorphs in the endemic Baikal sponge Lubomirskia baicalensis // Zoomorphology. 2016. V. 135. № 1. P. 1–17.
Ereskovsky A.V., Renard E., Borchiellini C. Cellular and molecular processes leading to embryo formation in sponges: evidences for high conservation of processes throughout animal evolution // Dev. Genes Evol. 2013. V. 223. № 1–2. P. 5–22.
Fagot D., Buquet-Fagot C., Lallemand F. et al. Antiproliferative effects of sodium butyrate in adriamycin-sensitive and -resistant human cancer cell lines: // Anti-Cancer Drugs. 1994. V. 5. № 5. P. 548–556.
Finoshin A.D., Adameyko K.I., Mikhailov K.V. et al. Iron metabolic pathways in the processes of sponge plasticity // PLoS One. 2020. V. 15. № 2. P. e0228722.
Giudice G., Sconzo G., Roccheri M.C. Studies on heat shock proteins in sea urchin development // Dev. Growth Differ. 1999. V. 41. № 4. P. 375–380.
Gu Z., Eils R., Schlesner M. Complex heatmaps reveal patterns and correlations in multidimensional genomic data // Bioinformatics. 2016. V. 32. № 18. P. 2847–2849.
Gunter H.M., Degnan B.M. Developmental expression of Hsp90, Hsp70 and HSF during morphogenesis in the vetigastropod Haliotis asinina // Dev. Genes Evol. 2007. V. 217. № 8. P. 603–612.
Haas B.J., Papanicolaou A., Yassour M. et al. De novo transcript sequence reconstruction from RNA-seq using the Trinity platform for reference generation and analysis // Nat. Protoc. 2013. V. 8. № 8. P. 1494–1512.
Haggarty S.J., Koeller K.M., Wong J.C. et al. Domain-selective small-molecule inhibitor of histone deacetylase 6 (HDAC6)-mediated tubulin deacetylation // Proceedings of the National Academy of Sciences. 2003. V. 100. № 8. P. 4389–4394.
Heers H., Stanislaw J., Harrelson J. et al. Valproic acid as an adjunctive therapeutic agent for the treatment of breast cancer // European J. Pharmacology. 2018. V. 835. P. 61–74.
Huangfu D., Maehr R., Guo W. et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds // Nat. Biotechnol. 2008. V. 26. № 7. P. 795–797.
Inoue K., Kobayashi M., Yano K. et al. Histone deacetylase inhibitor reduces monocyte adhesion to endothelium through the suppression of vascular cell adhesion molecule-1 expression // Arterioscler. Thromb. Vasc. Biol. 2006. V. 26. P. 2652–2659.
Kalyaanamoorthy S., Minh B.Q., Wong T.K.F. et al. ModelFinder: fast model selection for accurate phylogenetic estimates // Nat. Methods. 2017. V. 14. № 6. P. 587–589.
Kang S.-J., Park Y.I., So B. et al. Sodium butyrate efficiently converts fully reprogrammed induced pluripotent stem cells from mouse partially reprogrammed cells // Cellular Reprogramming. 2014. V. 16. № 5. P. 345–354.
Katoh K., Standley D.M. MAFFT multiple sequence alignment software version 7: Improvements in performance and usability // Molecular Biology and Evolution. 2013. V. 30. № 4. P. 772–780.
Kawaguchi Y., Kovacs J.J., McLaurin A. et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress // Cell. 2003. V. 115. № 6. P. 727–738.
Kondo Y., Iwao T., Yoshihashi S. et al. Histone deacetylase inhibitor valproic acid promotes the differentiation of human induced pluripotent stem cells into hepatocyte-like cells // PLoS One. 2014. V. 9. № 8. P. e104010.
Kumar S., Stecher G., Li M. et al. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Molecular Biology and Evolution. 2018. V. 35. № 6. P. 1547–1549.
Lavrov A.I., Kosevich I.A. Sponge cell reaggregation: Mechanisms and dynamics of the process // Russ. J. Dev. Biol. 2014. V. 45. P. 205–223. https://doi.org/10.1134/S1062360414040067
Lagger G. Essential function of histone deacetylase 1 in proliferation control and CDK inhibitor repression // The EMBO J. 2002. V. 21. № 11. P. 2672–2681.
Langmead B., Salzberg S.L. Fast gapped-read alignment with Bowtie 2 // Nat. Methods. 2012. V. 9. № 4. P. 357–359.
Lavrov A.I., Saidov D.M., Bolshakov F.V. et al. Intraspecific variability of cell reaggregation during reproduction cycle in sponges // Zoology. 2020. V. 140. P. 125795.
Lavrov A.I., Kosevich I.A. Sponge cell reaggregation: Mechanisms and dynamics of the process // Russ. J. Dev. Biol. 2014. V. 45. № 4. P. 205–223.
Lavrov A.I., Kosevich I.A. Sponge cell reaggregation: Cellular structure and morphogenetic potencies of multicellular aggregates // J. Exp. Zool. A. Ecol. Genet. Physiol. 2016. V. 325. P. 158–177.
Li B., Dewey C.N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome // BMC Bioinformatics. 2011. V. 12. № 1. P. 323.
Liang G., Taranova O., Xia K. et al. Butyrate promotes induced pluripotent stem cell generation // J. Biological Chemistry. 2010. V. 285. № 33. P. 25516–25521.
Louis M., Rosato R.R., Brault L. et al. The histone deacetylase inhibitor sodium butyrate induces breast cancer cell apoptosis through diverse cytotoxic actions including glutathione depletion and oxidative stress // Int. J. Oncol. 2004. V. 25. № 6. P. 1701–1711.
Mahapatra P.S., Singh R., Kumar K. et al. Valproic acid assisted reprogramming of fibroblasts for generation of pluripotent stem cells in buffalo (Bubalus bubalis) // Int. J. Dev. Biol. 2017. V. 61. № 1–2. P. 81–88.
Mali P., Chou B.K., Yen J. et al. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes // STEM CELLS. 2010. V. 28. № 4. P. 713–720.
Marks P.A. The clinical development of histone deacetylase inhibitors as targeted anticancer drugs // Expert Opinion on Investigational Drugs. 2010. V. 19. № 9. P. 1049–1066.
Matsuyama A. In vivo destabilization of dynamic microtubules by HDAC6-mediated deacetylation // EMBO J. 2002. V. 21. № 24. P. 6820–6831.
McCarthy D.J., Chen Y., Smyth G.K. Differential expression analysis of multifactor RNA-Seq experiments with respect to biological variation // Nucleic Acids Res. 2012. V. 40. № 10. P. 4288–4297.
McClure J.J., Li X., Chou C.J. Advances and challenges of HDAC inhibitors in cancer therapeutics // Advances in Cancer Research. Elsevier, 2018. P. 183–211.
Medvedev S.P., Grigor’eva E.V., Shevchenko A.I. et al. Human induced pluripotent stem cells derived from fetal neural stem cells successfully undergo directed differentiation into cartilage // Stem Cells and Development. 2011. V. 20. № 6. P. 1099–1112.
Michaelis M., Doerr H.W., Cinatl J. Valproic acid as anti-cancer drug // Curr. Pharm. Des. 2007. V. 13. № 33. P. 3378–3393.
Minh B.Q., Schmidt H.A., Chernomor O. et al. IQ-TREE 2: new models and efficient methods for phylogenetic inference in the genomic era // Molecular Biology and Evolution. 2020. V. 37. № 5. P. 1530–1534.
Montgomery R.L., Davis C.A., Potthoff M.J. et al. Histone deacetylases 1 and 2 redundantly regulate cardiac morphogenesis, growth, and contractility // Genes Dev. 2007. V. 21. № 14. P. 1790–1802.
Pazin M.J., Kadonaga J.T. What’s up and down with histone deacetylation and transcription? // Cell. 1997. V. 89. № 3. P. 325–328.
Phiel C.J., Zhang F., Huang E.Y. et al. Histone deacetylase is a direct target of valproic acid, a potent anticonvulsant, mood stabilizer, and teratogen // J. Biological Chemistry. 2001. V. 276. № 39. P. 36734–36741.
Sacks D., Baxter B., Campbell B.C.V. et al. Multisociety consensus quality improvement revised consensus statement for endovascular therapy of acute ischemic stroke // Int. J. Stroke. 2018. V. 13. P. 612–632.
Silva L.G., Ferguson B.S., Avila A.S. et al. Sodium propionate and sodium butyrate effects on histone deacetylase (HDAC) activity, histone acetylation, and inflammatory gene expression in bovine mammary epithelial cells1 // J. Animal Science. 2018. V. 96. P. 5244–5252.
Sipkema D., van Wielink R., van Lammeren A.A.M. et al. Primmorphs from seven marine sponges: formation and structure // J. Biotechnology. 2003. V. 100. № 2. P. 127–139.
Sjoblom T., Jones S., Wood L.D. et al. The consensus coding sequences of human breast and colorectal cancers // Science. 2006. V. 314. № 5797. P. 268–274.
Smith Z.D., Meissner A. DNA methylation: roles in mammalian development // Nat. Rev. Genet. 2013. V. 14. P. 204–220.
Sogabe S., Hatleberg W.L., Kocot K.M. et al. Pluripotency and the origin of animal multicellularity // Nature. 2019. V. 570. № 7762. P. 519–522.
Stillman J.H. Causes and consequences of thermal tolerance limits in rocky intertidal porcelain crabs, genus petrolisthes // Integr. Comp. Biol. 2002. V. 42. P. 790–796.
Tang Y., Chen Y., Jiang H. et al. The role of short-chain fatty acids in orchestrating two types of programmed cell death in colon cancer // Autophagy. 2011. V. 7. № 2. P. 235–237.
Terranova-Barberio M., Pecori B., Roca M.S. et al. Synergistic antitumor interaction between valproic acid, capecitabine and radiotherapy in colorectal cancer: critical role of p53 // J. Exp. Clin. Cancer. Res. 2017. V. 36. № 1. P. 177.
Tran L.N.K., Kichenadasse G., Sykes P.J. Combination therapies using metformin and/or valproic acid in prostate cancer: possible mechanistic interactions // CCDT. 2019. V. 19. № 5. P. 368–381.
Wang Y.-F., Chen N.S., Chung Y.P. et al. Sodium butyrate induces apoptosis and cell cycle arrest in primary effusion lymphoma cells independently of oxidative stress and p21CIP1/WAF1 induction // Mol. Cell. Biochem. 2006. V. 285. № 1–2. P. 51–59.
Wang Z., Zang C., Rosenfeld J.A. et al. Combinatorial patterns of histone acetylations and methylations in the human genome // Nat Genet. 2008. V. 40. P. 897–903.
Wilson A.J., Byun D.S., Popova N. et al. Histone deacetylase 3 (HDAC3) and other class I HDACs regulate colon cell maturation and p21 expression and are deregulated in human colon cancer // J. Biological Chemistry. 2006. V. 281. № 19. P. 13548–13558.
Wilson H.V. On some phenomena of coalescence and regeneration in sponges // J. Exp. Zool. 1907. V. 5. № 2. P. 245–258.
Zhang Z., Wu W.-S. Sodium butyrate promotes generation of human induced pluripotent stem cells through induction of the miR302/367 cluster // Stem Cells and Deve-lopment. 2013. V. 22. № 16. P. 2268–2277.
Дополнительные материалы отсутствуют.