Онтогенез, 2021, T. 52, № 6, стр. 429-440
Динамика плюрипотентности в эмбриогенезе и в культуре
М. Н. Гордеев a, Е. И. Бахмет a, А. Н. Томилин a, *
a ФГБУН Институт цитологии РАН
194064 Санкт-Петербург, Тихорецкий проспект 4, Россия
* E-mail: a.tomilin@incras.ru
Поступила в редакцию 17.05.2021
После доработки 08.06.2021
Принята к публикации 15.06.2021
Аннотация
Для раннего эмбрионального развития мыши и человека характерно наличие недифференцированных плюрипотентных клеток, которые дают начало всем тканям развивающегося эмбриона. Такие клетки еще 40 лет назад удалось выделить и культивировать в стабильном плюрипотентном состоянии. С тех пор накопилось множество данных о механизмах, лежащих в основе функционирования таких клеток, о ключевых генах, необходимых для их работы, а также об основах их дифференцировки в различных направлениях. К настоящему времени, в зависимости от стадии эмбриогенеза, стали выделять несколько типов плюрипотентных стволовых клеток, которые принципиально отличаются друг от друга сигнальными путями, условиями культивирования и способностью к дифференцировке. Данная обзорная работа суммирует известные на сегодняшний день сведения о динамике плюрипотентности в эмбриогенезе, а также о соответствующих типах культивируемых плюрипотентных клеток.
ВВЕДЕНИЕ
Плюрипотентные стволовые клетки обнаруживаются на ранних стадиях эмбрионального развития мыши в эпибласте до и после имплантации, и дают начало трем основным линиям – эктодерме, мезодерме и энтодерме. В 1981 г. двум группам ученых удалось получить стабильную культуру плюрипотентных клеток мыши, которые были названы эмбриональными стволовыми клетками (ЭСК) (Evans, Kaufman, 1981; Martin, 1981). Возможность “удерживать” эти клетки в плюрипотентном состоянии открыла новые горизонты для изучения процессов дифференцировки, а также ключевых генов раннего развития и сигнальных каскадов. За последние 15 лет представления о данном типе клеток были значительно расширены. Стало очевидным, что несмотря на сохранение потенциала к дифференцировке, плюрипотентные клетки эпибласта существенно отличаются до и после имплантации. Во время этого процесса происходит переключение сигнальных путей, смена экспрессии ключевых маркеров, эпигенетические перестройки. Вследствие этих изменений эпибласт “созревает”, и становится готов к дальнейшей дифференцировке. Аналогично, в культуре также стали выделять несколько типов плюрипотентных клеток в зависимости от стадии развития. В данной обзорной работе обобщены имеющиеся на сегодняшний день данные о динамике плюрипотентных состояний in vivo и in vitro. Описаны процессы, которые приводят к дифференцировке этих клеток. Также приведены некоторые сведения об участии главных факторов плюрипотентности Oct4, Sox2 и Nanog в выборе программ дифференцировки.
НАИВНАЯ ПЛЮРИПОТЕНТНОСТЬ
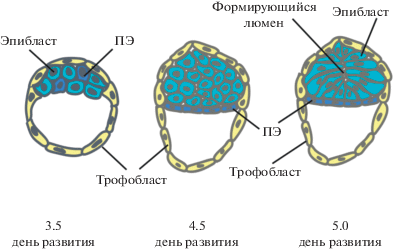
Плюрипотентные стволовые клетки (ПСК) сущесвуют с 3.5 по 8 сут эмбрионального развития мыши. До 2.75 сут эмбрион представлен тотипотентными клетками – зиготой и, после дробления последней, бластомерами. Далее, к 4.5 сут развития происходит два события дифференцировки. Бластомеры дают начало трофэктодеме и клеткам внутренней клеточной массы (ВКМ). К 4.5 сут развития клетки ВКМ дифференцируются во внезародышевую (первичную) энтодерму и плюрипотентный эпибласт, способный затем дать начало трем основным зародышевым листкам. На начальном этапе этого процесса клетки ВКМ представляют собой смешанную популяцию (рис. 1), однако, уже в это время клеточные типы можно разделить по экспрессии специфических маркеров. Так, для клеток первичной энтодермы характерна экспрессия транскрипционного фактора Gata6, в то время как в эпибласте обнаруживается высокий уровень Nanog (Bessonnard et al., 2014).
Развитие методов культивирования дало возможность выделять из эмбриона мыши клетки ВКМ и культивировать их in vitro с сохранением плюрипотентных свойств. Такой тип клеток стали называть эмбриональными стволовыми клетками мыши (мЭСК) (Evans et al., 1981; Martin, 1981). мЭСК также можно вводить в эмбрионы до имплантации, где они демонстрируют способность включаться в три зародышевых листка и линию половых клеток. При этом, мЭСК не способны включаться в эмбриональное развитие при введении в эмбрионы после имплантации (Huang et al., 2012). На сегодняшний день рутинное культивирование мЭСК происходит преимущественно в среде, содержащей лейкемия-ингибирующий фактор (ЛИФ, LIF) и сыворотку. Кроме того, в качестве подложки часто используют митотически инактивированные эмбриональные фибробласты мыши (МЭФ) (Niwa et al., 2009). Такие культуры, однако, неоднородны и демонстрирует значительную гетерогенность экспрессии маркеров и эпигенетических модификаций (Hayashi et al., 2008; Guo et al., 2016). Получить однородную культуру мЭСК удалось с применением так называемой “2i-LIF” среды. В ее состав входит ЛИФ, ингибитор GSK3 киназы (CHIR99021), являющейся негативным регулятором Wnt-сигнального пути, и ингибитор MEK-киназы (PD0325901), которая в свою очередь является неотъемлемым компонентом сигнального пути FGF/ERK (Ying et al., 2008). мЭСК в ходе культивирования в среде 2i-LIF по паттернам экспрессии основных маркеров и по эпигенетическим модификациям являются in vitro-аналогами плюрипотентного эпибласта мыши на 4.5 сут развития (Boroviak et al., 2014), и поэтому также называются “наивными”. Такие клетки характеризуются экспрессией Rex1, Klf4, Klf5 и Esrrb (Azami et al., 2018), наряду с основными факторами плюрипотентности – Oct4, Sox2 и Nanog (Chambers et al., 2007). Кроме того, подавление активности FGF/ERK приводит практически к полному удалению метилирования в CpG-островках генома (Habibi et al., 2013), что является, по-видимому, следствием подавления работы Dmnt1 – метил-трансферазы, поддерживающей паттерны метилирования при митотическом делении (Meyenn von et al., 2016). Вероятно, именно постепенным снижением доли метилированной ДНК в геноме можно объяснить тот факт, что для полного перехода к наивной плюрипотентности, мЭСК необходимо культивировать в среде 2i-LIF около 5–7 дней.
Наивные мЭСК имеют ограниченную способность дифференцироваться в клетки экстра-эмбриональных типов, таких как первичная энтодерма (Martin Gonzalez et al., 2016). При этом, недавно была показана возможность расширить “потенциал” мЭСК, используя модуляцию Wnt- и ингибирование FGF/ERK-, p38-, JNK-, SRC-сигнальных путей (Yang et al., 2017; Bayerl et al., 2021). Использование такого подхода позволило получить клетки, способные образовывать как плюрипотентный эпибласт, так и первичную энтодерму в бластоидах – in vitro моделях, воспроизводящих развитие эмбриона до имплантации (Sozen et al., 2019). Важно отметить, что ЭСК человека (чЭСК), изначально полученные в культуре (Thomson et al., 1998), соответствуют эпибласту после имплантации, то есть являются “праймированными” (речь об этом состоянии плюрипотентности пойдет далее). Относительно недавно была показана возможность получать наивные чЭСК (Chan et al., 2013), причем по паттернам экспрессии они оказались схожими как с клетками ВКМ (Theunissen et al., 2016), так и с мЭСК с расширенным потенциалом.
ПЕРЕХОД ОТ НАИВНОЙ К ПРАЙМИРОВАННОЙ ПЛЮРИПОТЕНТНОСТИ
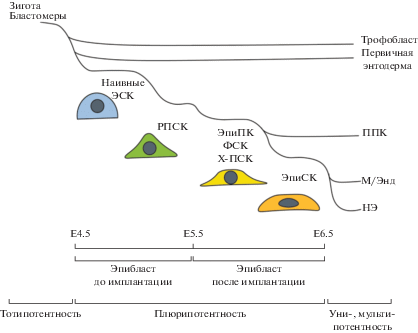
Перед имплантацией эмбриона, в эпибласте происходит ряд морфологических и молекулярных перестроек, подготавливающих его к дальнейшему развитию. При этом, клетки эпибласта постепенно переходят из “наивного” в “праймированное” состояние плюрипотентности, становясь готовыми к дифференцировке в трех основных направлениях – в экто-, мезо-, и энтодерму (Brons et al., 2007; Tesar et al., 2007). Также, во время этого перехода выделяют несколько промежуточных состояний, имеющих свои отличительные особенности (табл. 1, рис. 2). Клетки наивного эпибласта непосредственно перед имплантаций становятся более поляризованными, в его центре формируется полость – люмен (рис. 1) (Shahbazi et al., 2017). Недавняя работа Дерка Берджа и соавторов (Neagu et al., 2020) показала возможность удерживать такие клетки в культуре, обозначенные авторами как розетко-подобные стволовые клетки (РПСК), на протяжении многих пассажей благодаря комбинации ЛИФ, IWP2 (ингибитор Wnt-пути) и PD0325901 ингибитор MEK-киназы. Популяция РПСК демонстрировала одновременную экспрессию “праймированных” факторов Oct6, Otx2, а также “наивных” маркеров Klf4 и Esrrb. Поддержание РПСК в культуре обеспечивается, с одной стороны, ингибированием Wnt-сигнального пути, ответственного за поддержание наивной плюрипотентности, а с другой стороны, ингибированием FGF-пути, отвечающего за созревание бластоцисты.
Таблица 1.
Сравнение различных плюрипотентных клеточных линий мыши
| Характеристика/статус | Наивные (2i) |
ЭпиПК | РПСК | ФСК | X-ПСК | Праймированные | |
|---|---|---|---|---|---|---|---|
| Стабильность в культуре | Да | Нет | Да | Да | Да | Да | |
| Сигнальные пути | FGF | Ингибирование | Активация | Ингибирование | Активация | Активация | Активация |
| Nodal | – | Активация | – | Слабая активация | Активация | Активация | |
| Wnt | Активация | – | Ингибирование | Ингибирование | Активация | Ингибирование (для продолжительного культивирования) | |
| RA | – | – | – | Ингибирование | – | – | |
| LIF/STAT | Активация | – | – | – | – | – | |
| Неопределенный вклад | – | KORS | – | – | MEF | – | |
| Возврат в состояние наивной плюрипотентности | – | Нет | Да | Нет | Не проверялось | Нет | |
| Прямая дифференцировка в ППК | Нет | Да | Не проверялось | Да | Да | Нет | |
| Эквивалент в эмбриогенезе | E4.5 эпибласт | E5.5 эпибласт | E5.0 эпибласт | E5.5–6.0 эпибласт | E5.5 эпибласт | E6.5–7.5 эпибласт | |
| Наличие бивалентных промоторов | Небольшое | Высокое | Высокое | Высокое | Не проверялось | Высокое | |
| Инактивация Х-хромосомы | XaXa | XaXi | XaXa | Не проверялось | XaXa | XaXi | |
| Метилирование ДНК | Низкое | Промежуточное | Промежуточное | Не проверялось | Не проверялось | Высокое | |
Рис. 2.
Динамика плюрипотентных сотояний in vitro. РПСК – розеткоподобные стволовые клетки; ЭпиПК – эпибластоподобные клетки; ФСК – формативные стволовые клетки; ЭпиСК – эпибластные стволовые клетки; ППК – первичные половые клетки; М/Энд – мезодерма/энтодерма; НЭ – нейроэктодерма; E4.5, E5.5, E6.5 – дни эмбрионального развития мыши.
Дальнейшее развитие эмбриона связано с имплантацией, происходящей на 5.5 сутки эмбриогенеза. Эпибласт окончательно утрачивает свойства наивной плюрипотентности, и постепенно становится “праймированным”, то есть готовым к дальнейшей дифференцировке. Кроме того, во время имплантации в клетках эпибласта прекращается экспрессия Klf4, Rex1 и Esrrb. In vitro, репрессия этих генов обеспечивается снижением активности Wnt-сигнального пути, что ведет к освобождению репрессирующего комплекса Tcf3 и подавлению его мишеней (Yi et al., 2011). Эпибласт только что имплантировавшегося эмбриона обладает рядом характеристик, позволяющих выделить еще одну промежуточную “формативную” стадию плюрипотентности (Smith, 2017). Ключевым свойством таких клеток является способность давать начало зародышевой линии – первичным половым клеткам (ППК). Интересно, что такая способность у клеток эпибласта сохраняется достаточно короткое время и теряется приблизительно к 6.5 сут эмбриогенеза, т.е. к началу гаструляции (Ohinata et al., 2009). Главным маркером и регулятором формативной плюрипотентности является транскрипционный фактор Otx2, увеличение экспрессии которого происходит при выходе клеток из наивного состояния. Его функциональная роль выражена в первую очередь в перераспределении белка Oct4 на другие регуляторные элементы генома (Buecker et al., 2014; Yang et al., 2014). У самого гена Pou5f1, кодирующего Oct4, происходит переключение энхансеров с дистального на проксимальный (Choi et al., 2016). Кроме Oct4, переключение управляющих экспрессией регуляторных элементов показано для большого количества генов, транскрибирующихся как в наивных, так и праймированных плюрипотентных клетках (Factor et al., 2014). Кроме переключения регуляторных последовательностей происходит перестройка их регуляции через эпигенетические модификации. Клетки начинают экспрессировать de novo метилтранcферазы Dnmt-семейства. Предполагается, что такого рода эпигенетические модификации обеспечивают однонаправленность развития эмбриона. Кроме того, было обнаружено большое количество так называемых бивалентных генов, характеризующихся одновременным присутствием как репрессивной H3K4me3 метки, так и метки H3K27me3, ассоциированной с активацией транскрипции (Mas et al., 2018). Значительное количество бивалентных генов кодируют регуляторы дифференцировки и морфогенеза. Они не являются активно-транскрибирующимися в плюрипотентной клетке, при этом на них присутствует гипо-фосфорилированная форма РНК-полимеразы-II, вероятно, для быстрого перехода к элонгации транскрипции во время запуска программы дифференцировки (Tee et al., 2014). Гипо-фосфолирирование полимеразы происходит благодаря активности ERK-киназы. Во время дифференцировки бивалентные гены по-разному утрачивают либо активные, либо репрессивные метки хроматина, что зависит от выбранной траектории дифференцировки (Blanco et al., 2020).
Формативная плюрипотентность может быть воспроизведена in vitro несколькими способами. Такие клетки характеризуется целым набором черт, самой примечательной из которых является способность дифференцироваться в ППК под действием BMP4 (Hayashi et al., 2011; Wang et al., 2014). Одним из способов получения формативных плюрипотентных клеток in vitro является перевод c 2i-LIF среды, на среду, содержащую Fgf2 и Activin A. На второй день такого перехода клетки соответствуют эпибласту 5.5 сут развития, и называются эпибластоподобными стволовыми клетками (ЭпиПК) (Hayashi et al., 2011). Исходно, ЭпиПК являлись транзиторной популяцией, и при пролонгированном культивировании в среде с Ffg2 и Activin A переходили в праймированное состояние, характерное для эпибласта во время гаструляции (6.5–7.5 сутки развития), и, как следствие, теряли потенциал к дифференцировке в ППК. Недавние работы (Kinoshita et al., 2021; Yu et al., 2021) открыли возможности получения клеток, стабильно сохраняющих свойства формативной плюрипотентности на протяжении длительного периода культивирования (30 и более пассажей). В одной из этих работ, стабильную линию “формативных” клеток (названных X-ПСК) удалось получить с помощью активации FGF-, Nodal- и Wnt-путей благодаря использованию Fgf2 совместно с Activin A и CHIR99021, соответственно (Yu et al., 2021). Полученные результаты являются довольно неожиданными, учитывая схожесть с протоколом культивирования ЭпиПК и наличие активатора Wnt, ответственного за индукцию дифференцировки в эмбрионе после имплантации. Тем не менее, среда в данном протоколе имеет не полностью определенный состав, так как клетки поддерживаются на митотически инактивированных эмбриональных фибробластах (МЭФ), дающих неизвестный вклад цитокинов в культуральную среду. Можно предположить, что именно МЭФ являются источником тех лигандов, которые обеспечивают удержание формативной плюрипотентности. В работе Остина Смита (Kinoshita et al., 2021) и коллег, была получена культура так называемых формативных стволовых клеток (ФСК). Среда для их культивирования содержала Activin A в низкой концентрации, а также ингибиторы XAV939 и BMS493, блокирующие сигнальные пути Wnt и ретиноевой кислоты соответственно. Было показано, что ФСК не могут вернуться к наивному состоянию плюрипотентности. Интересно, что данные клетки культивируют без добавления в культуральную среду Fgf2, что, однако, не исключает наличия аутокринных молекул Fgf. ФСК характеризует, как и ЭпиПК, способность генерировать in vitro аналоги первичных половых клеток. Таким образом, использование новых стабильных культур формативных плюрипотентных клеток может внести значительный вклад в понимание процессов, ведущих к разделению соматических линий и клеток зародышевого пути.
ПРАЙМИРОВАННАЯ ПЛЮРИПОТЕНТНОСТЬ
Клетки эпибласта на 6.5–7.5 сут эмбрионального развития являются праймированными (рис. 3), а их культивируемые in vitro аналоги называются эпибластными стволовыми клетками (ЭпиСК) (Brons et al., 2007; Tesar et al., 2007). При этом, по паттернам экспрессии генов, культивируемые ЭпиСК наиболее сходны с эпибластом на 7 сут развития (Kojima et al., 2014). Клетки на данном этапе уже коммитированы в направлении различных клеточных линий благодаря установившемуся сигнальному градиенту внутри эмбриона (Ben-Haim et al., 2006). Этим фактом может объясняться нестабильность ЭпиСК при пролонгированном культивировании без добавления ингибитора сигнального пути Wnt. Было предложено относить данный тип клеток к переднему эпибласту эмбриона во время гаструляции, являющегося предшественником нейроэктодермы. Это, однако, не согласуется с тем фактом, что ЭпиСК демонстрируют экспрессию некоторых маркеров первичной полоски (Brachyury, Eomes), что не наблюдается у переднего эпибласта (Pijuan-Sala et al., 2019). Объяснение может заключаться в различиях линий ЭпиСК (Kojima et al., 2014). Как уже упоминалось ранее, исходно, культивируемые чЭСК также являются праймированными и обладают множеством общих черт с ЭпиСК мыши (Morgani et al., 2017). Различные подходы к культивированию праймированных клеток обеспечивают получение линий с более выраженной территориальной специфичностью, чем у классических ЭпиСК. Например, благодаря использованию IWR, блокирующего Wnt-путь, а также Fgf2, активирующего FGF-сигнальный путь, была получена клеточная линия, преимущественно включающаяся в состав заднего эпибласта (Wu et al., 2015). Кроме того, была показана возможность получения линии ЭпиСК с большей предрасположенностью к нейрональной дифференцировке, чем классические ЭпиСК. Это достигалось путем добавления FGF-лигандов и инигибиторов Nodal-пути (SB431542) (Liu et al., 2018).
Рис. 3.
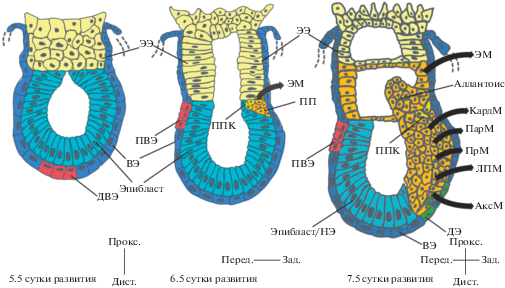
Развитие эмбриона после имплантации. ДВЭ – дистальная висцеральная энтодерма; ПВЭ – передняя висцеральная энтодерма; ППК – первичные половые клетки; ЭЭ – экстра-эмбриональная эктодерма; ВЭ – висцеральная энтодерма; ДЭ – дефинитивная энтодерма; НЭ – нейроэктодерма; ПП – первичная полоска; ЭМ – экстраэмбриональная мезодерма; КардМ – кардиальная мезодерма; ПарМ – паракисальная мезодерма; ПрМ – промежуточная мезодерма; ЛПМ – мезодерма латеральной пластинки; АксМ – аксиальная мезодерма.
ДИФФЕРЕНЦИРОВКА ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В НАПРАВЛЕНИИ ТРЕХ ЗАРОДЫШЕВЫХ ЛИСТКОВ
В эмбрионе после имплантации можно выделить проксимально расположенную трофоэктодерму, соединяющую плод с материнским организмом, и дистальную часть эмбриона, представленную эпибластом (рис. 3). При этом, весь эмбрион, включая трофэктодерму и эпибласт, покрыт висцеральной энтодермой. Еще до имплантации в висцеральной энтодерме можно выделить популяцию клеток, экспрессирующих Lefty1 – ингибитор сигнального пути Nodal (Liu et al., 2018). После имплантации эта группа клеток образует на конце эмбриона сигнальный центр – дистальную висцеральную энтодерму (ДВЭ), и вместе с трофэктодермой способствует установке дистально-проксимальной оси эмбриона (Rodriguez et al., 2005; Takaoka et al., 2006). Интересно, что по-видимому, этот процесс происходит в эмбрионе автономно, и не зависит от материнской части плаценты (Bedzhov et al., 2015). Дальнейшее развитие связано с миграцией клеток ДВЭ в будущий передний полюс эмбриона, и c образованием сигнального центра – передней висцеральной энтодермы (ПВЭ). Данный процесс завершается к 6.5 сут эмбрионального развития (Srinivas et al., 2004). ПВЭ определяет передне-заднюю ось эмбриона, выделяя Dkk1, Cer1 и Lefty1 (антогонисты Wnt-, BMP- и Nodal-синалинга) (Perea-Gomez et al., 2002; Kimura-Yoshida et al., 2005), и формирует тем самым градиент активности этих сигнальных путей. В задней части эпибласта высокая активность вышеупомянутых путей приводит к образованию первичной полоски, вследствие развития которой образуется мезодерма и дефинитивная энтодерма (рис. 3). Передний эпибласт, примыкающий к ПВЭ, дает начало клеткам нейроэктодермы.
Первичная полоска – динамическая структура, образующаяся в задней части эпибласта, и расширяющаяся к переднему краю эмбриона (рис. 3). Клетки эпибласта в данной области претерпевают эпителиально-мезенхимальный переход (ЭМП) и начинают мигрировать в формирующуюся первичную полоску (Francou, Anderson, 2020). Время и место миграции определяет выбор судьбы клетки. Клеточная популяция, расположенная на заднем конце эпибласта, в непосредственной близости от экстра-эмбриональной эктодермы, мигрирует проксимально от первичной полоски и образует экстраэмбриональную мезодерму (Saykali et al., 2019). В дальнейшем она развивается в хорион и алантоис. В состав последнего входит также небольшое число ППК-клеток (Ohinata et al., 2009). Первичная полоска далее расширяется к переднему краю, ее производными являются кардиальная мезодерма, параксиальная мезодерма, промежуточная мезодерма, мезодерма латеральной пластинки и аксиальная мезодерма (Ferretti, Hadjantonakis, 2019). Последняя, кроме того, содержит и клетки дефинитивной энтодермы, претерпевающей мезенхимально-эпителиальный переход. Важно отметить, что далее в образовании кишки принимает участие не только дефинитивная энтодерма, как считалось ранее, но и эмбриональная висцеральная энтодерма (Kwon et al., 2008; Viotti et al., 2014). Потомки обеих линий присутствуют в первичной кишке вплоть до середины периода эмбрионального развития, распределяясь при этом неравномерно (Nowotschin et al., 2019).
На ранних этапах развития первичной полоски, клетки, входящие в нее, подвергаются воздействию высоких концентраций BMP4, продуцируемого со стороны экстраэмбриональной трофэктодермы (Ben-Haim et al., 2006). По мере активного роста эмбриона и удаления первичной полоски от экстраэмбриональной трофэктодермы, действие BMP4 на передние области первичной полоски ослабевает, а ключевым регулятором дифференцировки в этой зоне становится Nodal (Costello et al., 2011). Кроме того, в передней первичной полоске экспрессируются антагонисты BMP– Noggin и Chordin (Pijuan-Sala et al., 2019). Важными участниками гаструляции являются Wnt- и FGF-сигнальные пути, нокауты по главным компонентам которых, приводят к отсутствию первичной полоски или к быстрому коллапсу ее развития (Guo, Li, 2007; Tortelote et al., 2013). Хорошей моделью для изучения различных градиентов сигнальных молекул являются 2d микропаттерны (Chhabra et al., 2019; Martyn et al., 2019). Несмотря на несоответствие морфологии и отсутствие активной миграции клеток, они, благодаря микрофлюидной технологии, точно воспроизводят дифференцировку различных линий клеток во время гаструляции (Morgani et al., 2018).
На переднем крае эпибласта после окончания формирования первичной полоски к 7.5 сут развития (рис. 3), происходит дифференцировка эпибласта в нейроэктодерму (Liu et al., 2018). Клетки переднего эпибласта, в отличие от клеток мезодермы и дефинитивной энтодермы, не переписывают эпигенетичесикие метки, такие как модификации гистонов и метилирование ДНК (Mohammed et al., 2017). Таким образом, считается, что нейрональная дифференцировка идет “по умолчанию”. Действительно, нокаут по основным компонентам BMP- и Wnt-сигнальных путей ведет к потере производных первичной полоски и преобладанию нейроэктодермальных производных. Такую дифференцировку “по умолчанию” могут обеспечивать бивалентные гены, функционирование которых зависит от хроматин-ремоделирующего комплекса PRC1/2 (Cruz-Molina et al., 2017). Нокаут по одному из его главных компонентов (Eed) приводит к фактическому отсутствию нейроэктодермы даже в условиях ингибирования сигнального пути Nodal (Grosswendt et al., 2020). Дальнейшее развитие нейроэктодермы идет в направлении нервной ткани и эпидермиса (Cajal et al., 2012).
ПОТЕНЦИАЛЬНАЯ РОЛЬ ФАКТОРОВ ПЛЮРИПОТЕНТНОСТИ OCT4, SOX2 И NANOG В ВЫБОРЕ НАПРАВЛЕНИЯ ДИФФЕРЕНЦИРОВКИ
Транскрипционные факторы Oct4, Sox2 и Nanog являются ключевыми маркерами плюрипотентных стволовых клеток, и детектируются в эпибласте до, во время (кроме Nanog), и после имплантации, т.е. на стадиях наивной, формативной и праймированной плюрипотентности, соответственно (Morgani et al., 2017). Основная часть исследований, касающихся этих белков, направлена в первую очередь на изучение их функций в поддержании плюрипотентного состояния. Однако, в последнее время также появляются свидетельства об их активном участии и в ранней дифференцировке плюрипотентных клеток. В эмбриональном развитии, с началом гаструляции пространственная локализация Oct4, Sox2 и Nanog меняется: Sox2 экспрессируется в переднем эпибласте, который впоследствии даст начало нейроэктодерме, а Oct4 и Nanog – в заднем эпибаласте, то есть в области формирования первичной полоски (Mulas et al., 2018; Barral et al., 2019). Результаты in vitro-исследований функций Oct4, Sox2 и Nanog в ранней дифференцировке разнятся в зависимости от использования наивных мЭСК или праймированных чЭСК. Данные отличия вероятнее всего обусловлены соответствием этих клеток разным стадиям плюрипотентности – наивной для мЭСК, и более поздней праймированной для чЭСК, как уже было сказано ранее. Так, например, на мЭСК было показано, что снижение уровня Oct4 ведет к трофобластной дифференцировке (Niwa et al., 2000), тогда как увеличение экспрессии этого фактора приводило к спонтанной дифференцировке мЭСК в направлении мезо-, экто-, и энтодермы (Radzisheuskaya et al., 2013). В случае с чЭСК, оверэкспрессия Oct4 давала начало клеткам первичной полоски (мезоэнтодермы), а нокдаун приводил к эктодермальной дифференцировке (Wang et al., 2012). В регуляции экспрессии Oct4 в праймированных плюрипотентных клетках (в эпибласте после имплантации) была продемонстрирована роль сигнального пути FGF. Так, ингибирование ERK в праймированных ЭпиСК мыши влекло за собой подавление Oct4 и, как следствие, дифференцировку этих клеток в нейроэктодермальном направлении (Yu et al., 2018). Sox2 рассматривается прежде всего как фактор, способствующий нейроэктодермальному пути развития. После нокаута Sox2 в мЭСК, следовала дифференцировка в трофэктодерму (Masui et al., 2007), как и в случае с Oct4, в то время как оверэкспрессия Sox2 приводила к запуску нейроэктодермальной дифференцировки (Kopp et al., 2008). У чЭСК при оверэкспрессии этого фактора отмечалось усиление эктодермального пути развития и ингибирование дифференцировки в направлении первичной полоски (Wang et al., 2012). В 2019 году было показано, что, в то время как в ЭСК Oct4 и Sox2 в основном функционируют в виде гетеродимера, в нейроэктодермальной дифференцировке партнером Sox2 является белок Pax6. Как следствие, меняются и основные мишени Sox2 в геноме в сторону нейроэктодермальных (Zhang et al., 2019). Oct4 и Sox2 также рассматриваются как антагонисты в выборе начального мезоэнтодермального и нейроэктодермального пути развития, соответственно. При запуске мезоэнтодермального пути Sox2 снижает экспрессию, а Oct4 колокализуется с маркером первичной полоски Brachyury; в нейроэктодермальной дифференцировке, наоборот, Oct4 перестает экспрессироваться, а Sox2 колокализуется с нейроэктодермальным фактором Sox1 (Thomson et al., 2011). В этом ключе также обнаружились партнеры Oct4 и Sox2 – Nac1 и Tcf3, которые вместе координируют программу выбора двух описанных направлений дифференцировки (Malleshaiah et al., 2016). Кроме того, было показано, что Sox2 является антагонистом Brachyury в выборе мезоэнтодермального пути (Koch et al., 2017). Хотя работы на клеточных культурах указывают на роль Oct4 в развитии мезоэнтодермы, in vivo исследования не дают таких однозначных результатов. Так, подавление экспрессии Oct4 после 7.5 сут эмбриогенеза приводило к нарушению оси развития эмбриона, усилению развития дефинитивной энтодермы на фоне снижения образования мезодермы и, как следствие, к раннему летальному фенотипу (DeVeale et al., 2013; Mulas et al., 2018). Nanog, как и Oct4, блокирует нейроэктодермальную дифференцировку, при этом способствует развитию дефинитивной энтодермы через регуляцию гена Eomes (Teo et al., 2011). Подавление экспрессии Nanog в мЭСК приводило к трофэктодермальной, мезодермальной и эктодермальной дифференцировке (Ivanova et al., 2006), а оверэкспрессия белка отражалась в поддержании плюрипотентного статуса независимо от добавления LIF (Chambers et al., 2003). В чЭСК оверэкспрессия Nanog приводила к усилению экспрессии маркеров первичной полоски и к блокировке эктодермального пути, в то время как нокдаун, наоборот, усиливал эктодермальную дифференцировку (Teo et al., 2011). Кроме того, Nanog работает как супрессор нейроэктодермального пути развития через регуляцию гена Pou3f1 (Barral et al., 2019). В целом, ввиду своего более позднего, праймированного статуса, культуры чЭСК, мЭпиПК и мЭпиСК являются более релевантными моделями для изучения дифференцировок в направлении трех зародышевых листков. Таким образом, для адекватного изучения направленной in vitro дифференцировки мЭСК в сторону экто-, мезо-, и энтодермы, их следует предварительно переводить в “праймированные” условия перед добавлением дифференцировочных факторов (BMP4, ActivinA и т.д.). Так, например, получить ППК из мЭСК удалось только после их предварительного перевода в среду с добавлением Fgf2 и Activin A (Hayashi et al., 2011).
Экспрессию факторов плюрипотентности Oct4, Sox2 и Nanog можно наблюдать и после начала гаструляции (Pijuan-Sala et al., 2019). В последующем развитии все три фактора обнаруживаются в первичных половых клетках (Zhang et al., 2018), Oct4 детектируется в мезодерме, вплоть до 8.25 сут развития (Yeom et al., 1996; Pijuan-Sala et al., 2019), а Sox2 после начала гаструляции работает как регулятор нейроэктодермального развития (Mittnenzweig et al., 2021). Играя важную роль в поддержании плюрипотентности и последующего раннего развития, Oct4, Nanog и Sox2, по-видимому, также принимают участие в спецификации клеток краниального нервного гребня. Данный тип клеток является прямым потомком эктодермы, но при этом они способны дифференцироваться в мезенхиму или глиальные клетки. Вероятно, такое “репрограммирование” обеспечивается коротким всплеском экспрессии этих факторов плюрипотентности (Zalc et al., 2021). Вопрос о том, имеют ли место подобные события во время других периодов развития, пока остается открытым.
ЗАКЛЮЧЕНИЕ
Исходя из имеющихся на сегодняшний день данных, становится очевидно, что клетки плюрипотентного эпибласта не являются стабильной недифференцированной линией. Напротив, во время имплантации наблюдается динамический процесс, который подготавливает эпибласт к дальнейшей дифференцировке в трех основных направлениях. На данный момент известно по крайней мере о четырех различных типах плюрипотентных клеток, которые имеют стабильно культивируемые in vitro аналоги. Учитывая то, что дифференцировка запускается из позднего “праймированного” состояния, многие результаты прошлых лет, полученные с использованием “наивных” мЭСК, требуют пересмотра. Для адекватного изучения дифференцировки мЭСК в культуре и для экстраполяции данных на процессы, происходящие in vivo, необходимо моделировать сигнальное окружение, которое соответствует таковому у эпибласта после имплантации. К примеру, первичные половые клетки из мЭСК удалось получить только путем предварительной смены стандартной среды на “праймированную”. Также, как видно из заключительного раздела, многие данные, например, о функциях Oct4, Sox2 и Nanog отличаются, в зависимости от использования наивных мЭСК или праймированных чЭСК. Несмотря на бурное развитие данной темы, остаются невыясненными некоторые вопросы. Например, как именно происходит дифференцировка в сторону нейроэктодермы? Известно, что данный выбор происходит “по умолчанию” в отсутствии сигнальных молекул, но не ясно, что заставляет клетки эпибласта выходить из плюрипотентного состояния. Также данные об участии факторов Oct4, Sox2 и Nanog в ранней дифференцировке остаются весьма фрагментарными. Учитывая, например, что оверэкспрессия Oct4 и Sox2 не усиливает плюрипотентный статус клеток, а наоборот ведет к их дифференцировке, необходимо выяснить, происходит ли это по причине активации определенных генов мишеней или имеют место специфические модификации данных белков. Решение этих вопросов улучшит наше понимание механизмов, лежащих в основе раннего эмбриогенеза, а также позволит эффективнее использовать плюрипотентные стволовые клетки в регенеративной медицине.
Список литературы
Azami T., Matsumoto K., Jeon H. et al. Klf5 suppresses ERK signaling in mouse pluripotent stem cells // PLoS One. 2018. V. 13. № 11. P. e0207321.
Barral A., Rollan I., Sanchez-Iranzo H. et al. Nanog regulates Pou3f1 expression at the exit from pluripotency during gastrulation // Biol. Open. 2019. V. 8. № 11. P. bio046367.
Bayerl J., Ayyash M., Shani T. et al. Principles of signaling pathway modulation for enhancing human naive pluripotency induction // Cell Stem Cell. 2021. V. 28. P. 1–17.
Bedzhov I., Bialecka M., Zielinska A. et al. Development of the anterior-posterior axis is a self-organizing process in the absence of maternal cues in the mouse embryo // Cell Res. 2015. V. 25. № 12. P. 1368–1371.
Ben-Haim N., Lu C., Guzman-Ayala M. et al. The Nodal precursor acting via activin receptors induces mesoderm by maintaining a source of its convertases and BMP4 // Dev. Cell. 2006. V. 11. № 3. P. 313–323.
Bessonnard S., De Mot L., Gonze D. et al. Gata6, Nanog and Erk signaling control cell fate in the inner cell mass through a tristable regulatory network // Dev. 2014. V. 141. № 19. P. 3637–3648.
Blanco E., González-Ramírez M., Alcaine-Colet A. et al. The bivalent genome: Characterization, structure, and regulation // Trends Genet. 2020. V. 36. № 2. P. 118–131.
Boroviak T., Loos R., Bertone P. et al. The ability of inner-cell-mass cells to self-renew as embryonic stem cells is acquired following epiblast specification // Nat. Cell Biol. 2014. V. 16. № 6. P. 513–525.
Brons I.G.M., Smithers L.E., Trotter M.W.B. et al. Derivation of pluripotent epiblast stem cells from mammalian embryos // Nature. 2007. V. 448. № 7150. P. 191–195.
Buecker C., Srinivasan R., Wu Z. et al. Reorganization of enhancer patterns in transition from naive to primed pluripotency // Cell Stem Cell. 2014. V. 14. № 6. P. 838–853.
Cajal M., Lawson K.A., Hill B. et al. Clonal and molecular analysis of the prospective anterior neural boundary in the mouse embryo // Development. 2012. V. 139. № 2. P. 423–436.
Chambers I., Colby D., Robertson M. et al. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells // Cell. 2003. V. 113. № 5. P. 643–655.
Chambers I., Silva J., Colby D. et al. Nanog safeguards pluripotency and mediates germline development // Nature. 2007. V. 450. № 7173. P. 1230–1234.
Chan Y.S., Göke J., Ng J.H. et al. Induction of a human pluripotent state with distinct regulatory circuitry that resembles preimplantation epiblast // Cell Stem Cell. 2013. V. 13. № 6. P. 663–675.
Chhabra S., Liu L., Goh R. et al. Dissecting the dynamics of signaling events in the BMP, WNT, and NODAL cascade during self-organized fate patterning in human gastruloids // PLoS Biol. 2019. V. 17. № 10. P. e3000498.
Choi H.W., Joo J.Y., Hong Y.J. et al. Distinct enhancer activity of Oct4 in naive and primed mouse pluripotency // Stem Cell Reports. 2016. V. 7. № 5. P. 911–926.
Costello I., Pimeisl I.M., Dräger S. et al. The T-box transcription factor Eomesodermin acts upstream of Mesp1 to specify cardiac mesoderm during mouse gastrulation // Nat. Cell Biol. 2011. V. 13. № 9. P. 1084–1091.
Cruz-Molina S., Respuela P., Tebartz C. et al. PRC2 facilitates the regulatory topology required for poised enhancer function during pluripotent stem cell differentiation // Cell Stem Cell. 2017. V. 20. № 5. P. 689–705.
DeVeale B., Brokhman I., Mohseni P. et al. Oct4 is required ~E7.5 for proliferation in the primitive streak // PLoS Genet. 2013. V. 9. № 11. P. e1003957.
Evans M.J., Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos // Nature. 1981. V. 292. № 5819. P. 154–156.
Factor D.C., Corradin O., Zentner G.E. et al. Epigenomic comparison reveals activation of “seed” enhancers during transition from naive to primed pluripotency // Cell Stem Cell. 2014. V. 14. № 6. P. 854–863.
Ferretti E., Hadjantonakis A.K. Mesoderm specification and diversification: from single cells to emergent tissues // Curr. Opin. Cell Biol. 2019. V. 61. P. 110–116.
Francou A., Anderson K.V. The Epithelial-to-mesenchymal transition in development and cancer // Annu. Rev. Cancer Biol. 2020. V. 4. P. 197–220.
Grosswendt S., Kretzmer H., Smith Z.D. et al. Epigenetic regulator function through mouse gastrulation // Nature. 2020. V. 584. № 7819. P. 102–108.
Guo G., Pinello L., Han X. et al. Serum-based culture conditions provoke gene expression variability in mouse embryonic stem cells as revealed by single-cell analysis // Cell Rep. 2016. V. 14. № 4. P. 956–965.
Guo Q., Li J.Y.H. Distinct functions of the major Fgf8 spliceform, before and during mouse gastrulation // Development. 2007. V. 134. № 12. P. 2251–2260.
Habibi E., Brinkman A.B., Arand J. et al. Whole-genome bisulfite sequencing of two distinct interconvertible DNA methylomes of mouse embryonic stem cells // Cell Stem Cell. 2013. V. 13. № 3. P. 360–369.
Hayashi K., de S. Lopes S.M.C., Tang F. et al. Dynamic equilibrium and heterogeneity of mouse pluripotent stem cells with distinct functional and epigenetic states // Cell Stem Cell. 2008. V. 3. № 4. P. 391–401.
Hayashi K., Ohta H., Kurimoto K. et al. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells // Cell. 2011. V. 146. № 4. P. 519–532.
Huang Y., Osorno R., Tsakiridis A. et al. In vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation // Cell Rep. 2012. V. 2. № 6. P. 1571–1578.
Ivanova N., Dobrin R., Lu R. et al. Dissecting self-renewal in stem cells with RNA interference // Nature. 2006. V. 442. № 7102. P. 533–538.
Kimura-Yoshida C., Nakano H., Okamura D. et al. Canonical Wnt signaling and its antagonist regulate anterior-posterior axis polarization by guiding cell migration in mouse visceral endoderm // Dev. Cell. 2005. V. 9. № 5. P. 639–650.
Kinoshita M., Barber M., Mansfield W. et al. Capture of mouse and human stem cells with features of formative pluripotency // Cell Stem Cell. 2021. V. 28. № 3. P. 453–471.
Koch F., Scholze M., Wittler L. et al. Antagonistic activities of Sox2 and brachyury control the fate choice of neuro-mesodermal progenitors // Dev. Cell. 2017. V. 42. № 5. P. 514–526.e7.
Kojima Y., Kaufman-Francis K., Studdert J.B. et al. The transcriptional and functional properties of mouse epiblast stem cells resemble the anterior primitive streak // Cell Stem Cell. 2014. V. 14. № 1. P. 107–120.
Kopp J.L., Ormsbee B.D., Desler M. et al. Small increases in the level of Sox2 trigger the differentiation of mouse embryonic stem cells // Stem Cells. 2008. V. 26. № 4. P. 903–911.
Kwon G.S., Viotti M., Hadjantonakis A.K. The endoderm of the mouse embryo arises by dynamic widespread intercalation of embryonic and extraembryonic lineages // Dev. Cell. 2008. V. 15. № 4. P. 509–520.
Liu C., Wang R., He Z. et al. Suppressing Nodal signaling activity predisposes ectodermal differentiation of epiblast stem cells // Stem Cell Reports. 2018. V. 11. № 1. P. 43–57.
Malleshaiah M., Padi M., Rue P. et al. Nac1 coordinates a sub-network of pluripotency factors to regulate embryonic stem cell differentiation // Cell Rep. 2016. V. 14. № 5. P. 1181–1194.
Martin G.R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells // Proc. Natl. Acad. Sci. USA. 1981. V. 78. № 12 II. P. 7634–7638.
Martin Gonzalez J., Morgani S.M., Bone R.A. et al. Embryonic stem cell culture conditions support distinct states associated with different developmental stages and potency // Stem Cell Reports. 2016. V. 7. № 2. P. 177–191.
Martyn I., Siggia E.D., Brivanlou A.H. Mapping cell migrations and fates in a gastruloid model to the human primitive streak // Curr. Opin. Cell Biol. 2019. V. 66. P. 89–96.
Mas G., Blanco E., Ballaré C. et al. Promoter bivalency favors an open chromatin architecture in embryonic stem cells // Nat. Genet. 2018. V. 50. № 10. P. 1452–1462.
Masui S., Nakatake Y., Toyooka Y. et al. Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells // Nat. Cell Biol. 2007. V. 9. № 6. P. 625–635.
Meyenn F. von, Iurlaro M., Habibi E. et al. Impairment of DNA methylation maintenance is the main cause of global demethylation in naive embryonic stem cells // Mol. Cell. 2016. V. 62. № 6. P. 848–861.
Mittnenzweig M., Mayshar Y., Cheng S. et al. Article A single-embryo, single-cell time-resolved model for mouse gastrulation A single-embryo, single-cell time-resolved model for mouse gastrulation // Cell. 2021. V. 184. № 11. P. 2825–2842.e22.
Mohammed H., Hernando-Herraez I., Savino A. et al. Single-cell landscape of transcriptional heterogeneity and cell fate decisions during mouse early gastrulation // Cell Rep. 2017. V. 20. № 5. P. 1215–1228.
Morgani S.M., Metzger J.J., Nichols J. et al. Micropattern differentiation of mouse pluripotent stem cells recapitulates embryo regionalized cell fate patterning // Elife. 2018. V. 7. № 7. P. e32839.
Morgani S., Nichols J., Hadjantonakis A.K. The many faces of pluripotency: in vitro adaptations of a continuum of in vivo states // BMC Dev Biol. 2017. V. 17. № 1. P. 1–20.
Mulas C., Chia G., Jones K.A. et al. Oct4 regulates the embryonic axis and coordinates exit from pluripotency and germ layer specification in the mouse embryo // Development. 2018. V. 145. № 12. P. 1–13.
Neagu A., van Genderen E., Escudero I. et al. In vitro capture and characterization of embryonic rosette-stage pluripotency between naive and primed states // Nat. Cell Biol. 2020. V. 22. № 5. P. 534–545.
Niwa H., Ogawa K., Shimosato D. et al. A parallel circuit of LIF signalling pathways maintains pluripotency of mouse ES cells // Nature. 2009. V. 460. № 7251. P. 118–122.
Niwa H., Miyazaki J., Smith A.G. Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells // Nat. Genet. 2000. V. 24. № 4. P. 372–376.
Nowotschin S., Setty M., Kuo Y.Y. et al. The emergent landscape of the mouse gut endoderm at single-cell resolution // Nature. 2019. V. 569. № 7756. P. 361–367.
Ohinata Y., Ohta H., Shigeta M. et al. A signaling principle for the specification of the germ cell lineage in mice // Cell. 2009. V. 137. № 3. P. 571–584.
Perea-Gomez A., Vella F.D.J., Shawlot W. et al. Nodal antaginists in the anterior visceral endoderm prevent the formation of multiple primitive streaks // Dev. Cell. 2002. V. 3. № 5. P. 745–756.
Pijuan-Sala B., Griffiths J.A., Guibentif C. et al. A single-cell molecular map of mouse gastrulation and early organogenesis // Nature. 2019. V. 566. № 7745. P. 490–495.
Radzisheuskaya A., Chia Gle B., dos Santos R.L. et al. A defined Oct4 level governs cell state transitions of pluripotency entry and differentiation into all embryonic lineages // Nat. Cell Biol. 2013. V. 15. № 6. P. 579–590.
Rodriguez T.A., Srinivas S., Clements M.P. et al. Induction and migration of the anterior visceral endoderm is regulated by the extra-embryonic ectoderm // Development. 2005. V. 132. № 11. P. 2513–2520.
Saykali B., Mathiah N., Nahaboo W. et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo // Elife. 2019. V. 8. P. e42434.
Shahbazi M.N., Scialdone A., Skorupska N. et al. Pluripotent state transitions coordinate morphogenesis in mouse and human embryos // Nature. 2017. V. 552. P. 239–243.
Smith A. Formative pluripotency: The executive phase in a developmental continuum // Dev. 2017. V. 144. № 3. P. 365–373.
Sozen B., Cox A.L., De Jonghe J. et al. Self-organization of mouse stem cells into an extended potential blastoid // Dev. Cell. 2019. V. 51. № 6. P. 698–712.e8.
Srinivas S., Rodriguez T., Clements M. et al. Active cell migration drives the unilateral movements of the anterior visceral endoderm // Development. 2004. V. 131. № 5. P. 1157–1164.
Takaoka K., Yamamoto M., Shiratori H. et al. The mouse embryo autonomously acquires anterior-posterior polarity at implantation // Dev. Cell. 2006. V. 10. № 4. P. 451–459.
Tee W.W., Shen S.S., Oksuz O. et al. Erk1/2 activity promotes chromatin features and RNAPII phosphorylation at developmental promoters in mouse ESCs // Cell. 2014. V. 156. № 4. P. 678–690.
Teo A.K.K., Arnold S.J., Trotter M.W.B. et al. Pluripotency factors regulate definitive endoderm specification through eomesodermin // Genes Dev. 2011. V. 25. № 3. P. 238–250.
Tesar P.J., Chenoweth J.G., Brook F.A. et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells // Nature. 2007. V. 448. № 7150. P. 196–199.
Theunissen T.W., Friedli M., He Y. et al. Molecular criteria for defining the naive human pluripotent state // Cell Stem Cell. 2016. V. 19. № 4. P. 502–515.
Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. Embryonic stem cell lines derived from human blastocysts // Science. 1998. V. 282. № 5391. P. 1145–1147.
Thomson M., Liu S.J., Zou L.N. et al. Pluripotency factors in embryonic stem cells regulate differentiation into germ layers // Cell. 2011. V. 14. № 6. P. 875–889.
Tortelote G.G., Hernández-Hernández J.M., Quaresma A.J.C. et al. Wnt3 function in the epiblast is required for the maintenance but not the initiation of gastrulation in mice // Dev. Biol. 2013. V. 374. № 1. P. 164–173.
Viotti M., Nowotschin S., Hadjantonakis A.K. SOX17 links gut endoderm morphogenesis and germ layer segregation // Nat. Cell Biol. 2014. V. 16. № 12. P. 1146–1156.
Wang R.N., Green J., Wang Z. et al. Bone morphogenetic protein (BMP) signaling in development and human diseases // Genes Dis. 2014. V. 1. № 1. P. 87–105.
Wang Z., Oron E., Nelson B. et al. Distinct lineage specification roles for NANOG, OCT4, and SOX2 in human embryonic stem cells // Cell Stem Cell. 2012. V. 10. № 4. P. 440–454.
Wu J., Okamura D., Li M. et al. An alternative pluripotent state confers interspecies chimaeric competency // Nature. 2015. V. 521. № 7552. P. 316–321.
Yang J., Ryan D.J., Wang W. et al. Establishment of mouse expanded potential stem cells // Nature. 2017. V. 550. № 7676. P. 393–397.
Yang S.H., Kalkan T., Morissroe C. et al. Otx2 and Oct4 drive early enhancer activation during embryonic stem cell transition from naive pluripotency // Cell Rep. 2014. V. 7. № 6. P. 1968–1981.
Yeom Y.Il, Fuhrmann G., Ovitt C.E. et al. Germline regulatory element of Oct-4 specific for the totipotent cycle of embryonal cells // Development. 1996. V. 122. № 3. P. 881–894.
Yi F., Pereira L., Hoffman J.A. et al. Opposing effects of Tcf3 and Tcf1 control Wnt stimulation of embryonic stem cell self-renewal // Nat. Cell Biol. 2011. V. 13. № 7. P. 762–770.
Ying Q.L., Wray J., Nichols J. et al. The ground state of embryonic stem cell self-renewal // Nature. 2008. V. 453. № 7194. P. 519–523.
Yu L., Wei Y., Sun H.X. et al. Derivation of intermediate pluripotent stem cells amenable to primordial germ cell specification // Cell Stem Cell. 2021. V. 28. № 3. P. 550–567.e12.
Yu Y., Wang X., Zhang X. et al. ERK inhibition promotes neuroectodermal precursor commitment by blocking self-renewal and primitive streak formation of the epiblast // Stem Cell Res. Ther. 2018. V. 9. № 1. P. 2.
Zalc A., Sinha R., Gulati G.S. et al. Reactivation of the pluripotency program precedes formation of the cranial neural crest // Science. 2021. V. 371. № 6529.
Zhang M., Leitch H.G., Tang W.W.C. et al. Esrrb complementation rescues development of nanog-null germ cells // Cell Rep. 2018. V. 22. № 2. P. 332–339.
Zhang S., Bell E., Zhi H. et al. OCT4 and PAX6 determine the dual function of SOX2 in human ESCs as a key pluripotent or neural factor // Stem Cell Res. Ther. 2019. V. 10. № 1. P. 1–14.
Дополнительные материалы отсутствуют.