Онтогенез, 2021, T. 52, № 6, стр. 419-428
Развитие сети семенника и ее роль в функционировании мужской гонады
А. Ю. Кулибин a, *, Е. А. Малолина a
a ФГБУН Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: Kulibin.A.BKRJ@gmail.com
Поступила в редакцию 21.06.2021
После доработки 30.06.2021
Принята к публикации 05.07.2021
Аннотация
Сеть семенника или rete testis – первый отдел выносящей системы, соединяющей извитые семенные канальцы, в которых развиваются половые клетки, с выносящими канальцами и придатком семенника – эпидидимисом, где гаметы дозревают и приобретают мобильность. Морфогенез этой структуры у мышей в эмбриональный и постнатальный периоды развития был детально изучен в нескольких недавних исследованиях. Показано, что часть сети семенника возникает из предшественников соматических клеток гонады еще до момента детерминации пола. Другая часть образуется из эмбриональных клеток Сертоли половых тяжей, прилежащих к мезонефросу. Процесс трансформации клеток Сертоли в клетки rete testis, по-видимому, не ограничивается только эмбриональным этапом развития, а продолжается также в постнатальном развитии семенников. Недавно было установлено, что сеть семенника участвует в формировании и поддержании региональной специализации клеток Сертоли концевых участков извитых семенных канальцев – транзиторных зон. Согласно современным представлениям, транзиторные зоны семенных канальцев могут представлять собой нишу для сперматогониальных стволовых клеток, область длительной пролиферации клеток Сертоли в пубертатный и постпубертатный периоды развития семенника, а также служить генератором сперматогенных волн. Исходя из всего этого можно заключить, что сеть семенника не ограничивается лишь транспортом гамет из семенника в эпидидимис, поддержанием внутритестикулярного давления и регуляцией состава выделяемой семенниками жидкости, но также влияет на сам сперматогенный процесс.
ВВЕДЕНИЕ
У большинства животных, за исключением наиболее примитивных форм, процесс развития мужских гамет – сперматогенез, происходит в специализированных органах – семенниках. У млекопитающих их структурной единицей являются извитые семенные канальцы (рис. 1а), в сперматогенном эпителии которых и развиваются половые клетки. Процесс дифференцировки начинается со сперматогониальных стволовых клеток (ССК), расположенных на базальной мембране в окружении соматических клеток Сертоли (КС), выполняющих как нишеобразующую функцию, так и поддерживающих развитие половых клеток на всех этапах сперматогенеза (рис. 1б). ССК, вступая в дифференцировку, вначале претерпевают ряд митотических делений, а затем входят в профазу мейоза, где происходит последний раунд репликации ДНК перед двумя последовательными делениями, завершающимися формированием гаплоидных округлых сперматид. Мейотические половые клетки на стадии прелептотены покидают базальную мембрану, пересекают область плотных контактов между соседними КС и переносятся в адлюминальный компартмент (рис. 1б), где завершают процесс мейоза и вступают в последний этап дифференцировки – спермиогенез. В процессе спермиогенеза округлые сперматиды через ряд морфологических изменений, охватывающих все органеллы клетки, преобразуются в удлиняющиеся сперматиды (рис. 1б). Последние теряют связь со сперматогенным эпителием и попадают в просвет семенного канальца, становясь сперматозоидами. Сперматозоиды далее покидают семенник и с током жидкости, образуемым КС, переносятся из семенных канальцев в первый отдел выносящей системы – сеть семенника или rete testis (рис. 1в).
Рис. 1.
Строение семенника мыши, сети семенника (rete testis) и сегмента сперматогенного эпителия извитого семенного канальца. (а) – схема строения семенника взрослой мыши с выносящими канальцами и эпидидимисом. Извитые семенные канальцы представляют собой дугу, обоими концами соединяющуюся с сетью семенника. Снаружи канальцы окружены интерстициальной тканью. (б) – схема поперечного среза сегмента сперматогенного эпителия. Обозначения: АК – адлюминальный компартмент сперматогенного эпителия, БК – базальный компартмент, БМ – базальная мембрана, ЗПК – зона плотных контактов между соседними клетками Сертоли, КС – клетка Сертоли, ОС – округлые сперматиды, СГ – дифференцирующиеся сперматогонии, СП – сперматоциты, ССК – сперматогониальные стволовые клетки, УС – удлиняющиеся сперматиды. (в) – срез семенника половозрелой мыши в области сети семенника, окраска гематоксилин-эозином. Обозначения: ВК – выносящие канальцы, RT – сеть семенника (rete testis), TR – прямые канальцы (tubuli recti), ТЗ – транзиторные зоны. (г) – трехмерная реконструкция по серийным срезам сети семенника, начальных участков выносящих канальцев и концевых участков извитых семенных канальцев взрослой мыши, представлена в нескольких проекциях.
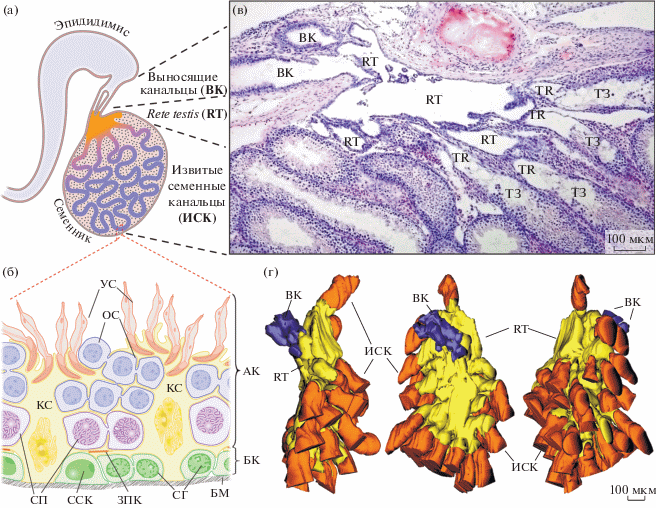
Сеть семенника представляет собой группу связанных друг с другом полостей и каналов, выстланных однослойным эпителием, по которым сперматозоиды переносятся из гонады через выносящие канальцы в придаток семенника – эпидидимис, где окончательно созревают и приобретают мобильность (рис. 1а, 1в, 1г). В то время как биология ССК, КС, а также весь процесс развития мужских половых клеток достаточно хорошо изучены и освещены во множестве обзоров (Griswold, 1998, 2018; Hess, Renato de Franca, 2008; Kopera et al., 2010; Kubota, Brinster, 2018; de Rooij, 2017), процессы развития сети семенника и понимание ее роли в функционировании сперматогенной системы только начинают приобретать ясность. Так, в недавнем исследовании (Imura-Kishi et al., 2021) была установлена роль сети семенника в поддержании региональной специализации КС концевых отделов (транзиторных зон) извитых семенных канальцев. Есть сведения, что концевые отделы семенных канальцев являются нишей для Gfra1+ ССК (Aiyama et al., 2015), местом длительной пролиферации КС в пубертальном и постпубертальном семеннике (Figueiredo et al., 2016, 2019; Малолина, Кулибин, 2017), а также местом генерации сперматогенных волн, поддерживающих непрерывность развития мужских половых клеток (Perey et al., 1961). Взятые вместе, результаты этих работ позволяют расширить функции сети семенника от простого транзита гамет из семенника в эпидидимис, поддержания внутритестикулярного давления и регуляции состава, выделяемой семенниками жидкости (Hess, Hermo, 2018), до участия в развитии сперматогенной системы и поддержке сперматогенеза. В настоящем обзоре мы кратко рассмотрим последние данные по развитию сети семенника у мышей, структуру и функции транзиторных зон извитых семенных канальцев и участие rete testis в их формировании.
ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ СЕТИ СЕМЕННИКА У МЫШЕЙ
У мышей развитие гонад начинается около 9.0 сут эмбрионального развития (E9.0), когда Sf1+ (Steroidogenic factor 1), Wt1+ (Wilms’ tumor protein 1) клетки целомического эпителия, расположенные на вентральной стороне мезонефроса, начинают активно пролиферировать и погружаться в его паренхиму, формируя к E9.5 небольшие утолщения (половые валики), обращенные в целомическую полость. На E10.0 валики начинают заселять половые клетки, приходящие из задней кишки (Nef et al., 2019). В этот момент развития гонады устроены одинаково у обоих полов, а составляющие их Sf1+ предшественники соматических клеток бипотенциальны и могут дифференцироваться как в клетки яичников, так и семенников.
Выбор пути дальнейшего развития – детерминация пола, запускается сложным каскадом экспрессии генов. Для большинства млекопитающих, в том числе мышей, ключевым фактором, определяющим развитие семенников, является ген Y хромосомы Sry (Sex-determining region Y), в отсутствие экспрессии которого гены Rspo1 (R-spondin 1) и Wnt4 (Wnt family member 4) направляют развитие бипотенциальных гонад в яичники (Svingen, Koopman, 2013). Sry запускает экспрессию гена Sox9 (SRY-box transcription factor 9) в клетках предшественниках, активируя в них программу развития в КС. Те в ответ начинают высоко экспрессировать гены-маркеры КС Amh (Anti-Mullerian hormone) и Dmrt1 (Doublesex and mab-3 related transcription factor 1), активно пролиферировать и к E12.5 формируют нерегулярную сеть из половых тяжей с половыми клетками, расположенными в центре (Cool et al., 2012).
Половые тяжи – предшественники извитых семенных канальцев семенника, а мезонефрический проток и канальцы мезонефроса дают начало большей части его выносящей системы, соответственно, эпидидимису и выносящим канальцам. Сеть же семенника закладывается как связующая структура между двумя этими зачатками (рис. 2а). Такое положение сети семенника определяет особенности ее формирования. Согласно полученным недавно данным (Kulibin, Malolina, 2020; Omotehara et al., 2020, подробно рассмотрены в обзоре Major et al., 2021), у мышей эта структура может закладываться как два отдельных зачатка. Один из них начинает формироваться еще на стадии бипотенциальной гонады на E10.5 из небольшой группы Sf1+ клеток-предшественников, расположенных между канальцами мезонефроса на переднем конце гонады (Omotehara et al., 2020, рис. 2б1). Эти клетки к E12.5 образуют уже сеть канальцев, распространяющуюся от переднего конца гонады до заднего и контактирующую с одной стороны с канальцами мезонефроса, а с другой – с половыми тяжами гонады (рис. 2б2).
Рис 2.
Эмбриональное развитие сети семенника мышей. (а) – репрезентативная фотография гонадо-мезонефрического комплекса мышей на E14.5, окрашенного на Sox9 и AMH. Максимальная проекция c серии оптических срезов, снятых на конфокальном микроскопе (взята из работы (Kulibin, Malolina, 2020) и представлена здесь с небольшими изменениями). (б1–б5) – схема развития сети семенника у мышей. (б1–б2) по данным (Omotehara et al., 2020). (б3–б5) – часть схемы взята из работы (Kulibin, Malolina, 2020) и представлена здесь с небольшими изменениями. Стрелка на (б4) – указывает направление формирования части сети семенника, образующейся из эмбриональных КС. В прямоугольных вставках на схеме указаны гены-маркеры канальцев мезонефроса, сети семенника и половых тяжей на различные сроки эмбрионального развития.
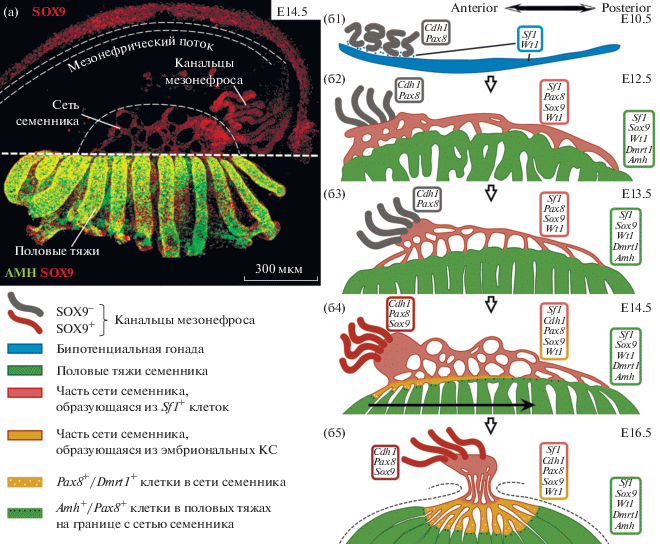
Вторая часть сети семенника начинает развиваться после E13.5 из соединенных между собой в единую сеть концевых отделов половых тяжей, обращенных в сторону мезонефроса (рис. 2б3, 2б4), т.е. из эмбриональных КС (Kulibin, Malolina, 2020). В процессе трансформации в клетки rete testis КС начинают экспрессировать Pax8 (Paired box 8 ) – маркер клеток сети семенника (Ozcan et al., 2011; Malolina, Kulibin, 2019), теряют экспрессию Amh, но частично сохраняют экспрессию Dmrt1 (рис. 2б4). Этот процесс начинается на переднем конце гонады и распространяется к ее заднему концу, завершаясь к E16.5 формированием отдельных Amh+ половых тяжей, которые соединены между собой Pax8+ канальцами сети семенника (рис. 2б5). Такое сложное формирование rete testis из двух частей, по-видимому, необходимо для правильного соединения между собой в единую сеть всех концов половых тяжей, число которых на E13.5–14.5 колеблется между 10 и 11 (Nel-Themaat et al., 2009), с концами 4-х канальцев мезонефроса выносящей системы.
Можно резюмировать, что обе представленные работы (Kulibin, Malolina, 2020; Omotehara et al., 2020) приводят доказательства в пользу гипотезы о “гонадном” происхождении клеток сети семенника (Combes et al., 2009) в противовес предположению о ее “мезонефрическом” происхождении (Zamboni, Upadhyay, 1982; Wrobel, 2000; Joseph et al., 2009).
При развитии яичников на границе между гонадой и мезонефросом также образуется структура, гомологичная сети семенника – сеть яичника или rete ovary (Byskov, Lintern-Moore, 1973). Омотехара и соавторы (Omotehara et al., 2020) показали, что ее формирование в эмбриональном развитии происходит схожим образом, из Sf1+ клеток, выделившихся на стадии индифферентной гонады. В двух работах (Kulibin, Malolina, 2020; McKey et al., 2021) было показано, что в сети яичника в непосредственной близости от гонады есть клетки, ко-экспрессирующие Pax8 и маркер фолликулярных клеток FoxL2 (Forkhead box L 2). Присутствие таких клеток позволяет предположить, что фолликулярные клетки, подобно эмбриональным КС, принимают участие в формировании сети яичника. Не исключен также и обратный процесс трансформации клеток rete ovary в клетки яичника. Так, есть доказательства, что клетки сети яичника могут становиться клетками теки (Smith et al., 2014; Liu et al., 2015). Окончательный ответ на этот вопрос может быть получен только после проведения lineage tracing исследования.
Мало что известно о механизмах регуляции развития сети, но можно предположить, что транскрипционный фактор Pax8, который вместе с Pax2 принимает участие в развитии мезонефроса (Sharma et al., 2015), также играет важную роль в формировании сети у обоих полов. Так, согласно данным Омотехары и соавторов (Omotehara et al., 2020), часть сети семенника и яичника возникает из Sf1+ клеток, которые начинают экспрессировать Pax8 между E11.5–12.5 (Kulibin, Malolina, 2020), во время формирования ими канальцев сети. Кроме этого, присутствие клеток с промежуточным фенотипом Pax8+/Amh+ (рис. 2б4, 2б5) на границе между новообразованной сетью семенника и половыми тяжами (Kulibin, Malolina, 2020) указывает на участие Pax8 в процессе трансформации КС в клетки rete testis.
Также вероятно, что морфогенетические факторы, продуцируемые клетками канальцев мезонефроса, могут поддерживать процессы формирования сети семенника и ее присоединение к выносящей системе. Как отмечают Омотехара с соавторами (Omotehara et al., 2020), присоединение канальцев мезонефроса к сети семенника может регулироваться Notch сигнальным путем. Ретиноевая кислота (РК), вырабатываемая мезонефросом, распространяется от переднего конца гонады к заднему и также может быть вовлечена в морфогенез сети семенника. Так, искусственное увеличение концентрации РК в эмбриональных семенниках приводит к возрастанию экспрессии Nr0b1 (nuclear receptor subfamily 0 group B member 1), подавляющего экспрессию генов-маркеров КС, в том числе и Amh (Bowles et al., 2018). Известно, что после E12.5 Nr0b1 высоко экспрессируется в клетках сети семенника (Swain et al., 1996; Ikeda et al., 2001). Можно предположить, что после E13.5 концентрация РК на границе между мезонефросом и семенником достаточно высока, чтобы увеличить экспрессию Nr0b1 в КС половых тяжей и подавить в них экспрессию Amh, что совместно с действием Pax8 приведет к трансформации КС в клетки сети семенника, но для подтверждения этой гипотезы необходимы дальнейшие исследования.
С другой стороны, клетки формирующейся сети семенника, могут, совместно с клетками гонады, вырабатывать факторы, поддерживающие выживание и пролиферацию клеток канальцев мезонефроса. Одним из таких факторов, как отмечают де Мело Сантос и Хинтон (de Mello Santos, Hinton, 2019), мог бы быть эпидермальный фактор роста (EGF), предотвращающий клеточную гибель в развивающейся почке (Carev et al., 2008).
РАЗВИТИЕ СЕТИ СЕМЕННИКА МЫШЕЙ В ПОСТНАТАЛЬНЫЙ ПЕРИОД
Формирование сети семенника, начавшиеся в эмбриональный период развития, продолжается и в постнатальный период. В это время клетки сети семенника активно пролиферируют и формируют полость, выстланную однослойным эпителием, высота которого изменяется в разных участках от плоского до кубического (Major et al., 2021; Малолина, Кулибин, 2017). Снаружи сеть семенника окружена слоем перитубулярно-мышечных клеток, а также интерстициальной тканью, пронизанной сетью кровеносных и лимфатических капилляров (см. рис. 3, Rebourcet et al., 2014; Figueiredo et al., 2016). Пролиферация клеток сети семенника у мышей in vivo в постнатальном периоде развития заканчивается примерно в то же время, когда и пролиферация КС в извитых семенных канальцах, то есть после 18 сут (Малолина, Кулибин, 2017). Тем не менее, клетки сети семенника, полученные от взрослых мышей, в отличие от КС извитых семенных канальцев сохраняют способность к активной пролиферации и формированию колоний в клеточной культуре (Малолина, Кулибин, 2018; Malolina, Kulibin, 2019).
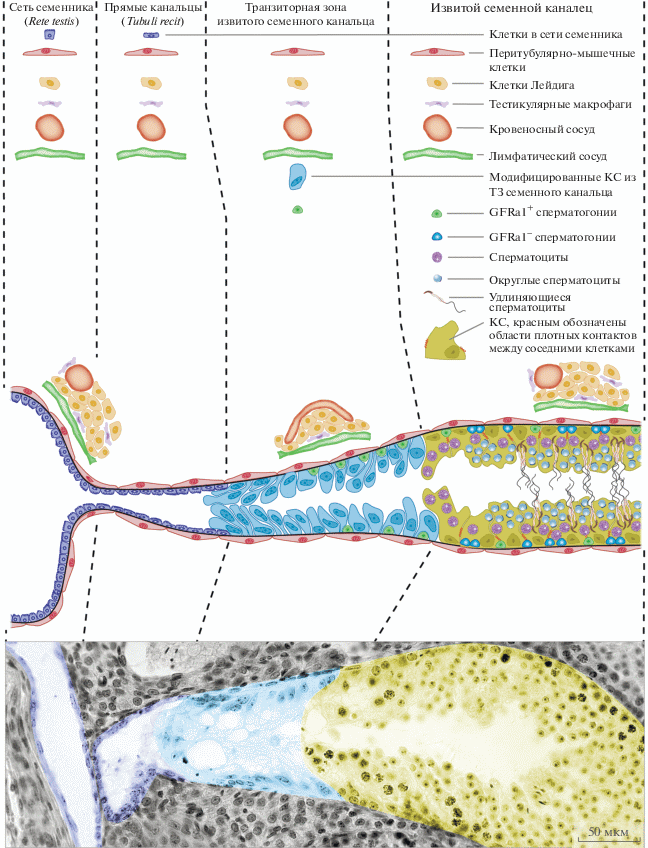
Рис. 3.
Схема строения транзиторной зоны извитого семенного канальца и сети семенника взрослых мышей. В нижней части рисунка представлена репрезентативная фотография среза концевого отдела извитого семенного канальца половозрелой мыши, окраска гематоксилин-эозином. На фотографии цветной кодировкой обозначены различные участки сети семенника и семенного канальца, представленные на схеме выше.
В недавнем исследовании (Malolina, Kulibin, 2019) были выявлены гены-маркеры клеток сети семенника, которыми являются уже упомянутый Pax8, а также Krt8 (Keratin 8) и Cdh1 (Cadherin 1, Aiyama et al., 2015). Интересно, что на 6 сутки постнатального развития значительная часть клеток сети семенника также экспрессирует маркер КС ген Dmrt1, экспрессия которого затем снижается и у взрослых животных остается лишь в единичных клетках сети. Кроме этого, в сети семенника на 6 сутки после рождения в областях присоединения к извитым семенным канальцам присутствует много Amh+/Dmrt1+ КС, а также клеток, экспрессирующих одновременно маркеры КС и клеток сети семенника: Amh+/Sox9+/Cdh1+, Amh+/Sox9+/Pax8+ и Amh+/Dmrt1+/Cdh1+ клеток. Присутствие таких клеток в сети семенника в этот период может объяснить большое количество Dmrt1+ клеток в ней, а также позволяет предположить, что пополнение клеток сети за счет КС может продолжаться и в постнатальный период развития этой структуры. Снижение экспрессии Dmrt1 в клетках сети у взрослых животных по сравнению с 6 сут постнатального развития можно рассматривать как расхождение в путях дифференцировки между КС извитых семенных канальцев и клетками сети семенника. Это предположение подтверждается данными ПЦР анализа, показывающего, что уровень экспрессии генов-маркеров КС в клетках сети семенника у 6-ти суточных животных больше соответствует таковому в КС того же возраста, чем в клетках сети и КС, полученных от взрослых животных (Malolina, Kulibin, 2019).
СТРУКТУРА И ФУНКЦИИ КОНЦЕВЫХ ОТДЕЛОВ ИЗВИТЫХ СЕМЕННЫХ КАНАЛЬЦЕВ
Сеть семенника образует специальные выросты – прямые канальцы или tubuli recti (рис. 1в), посредством которых она соединяется с концевыми отделами извитых семенных канальцев, т.н. транзиторными зонами (ТЗ) (Roosen-Runge, Holstein, 1978; Hess, Hermo, 2018). На рис. 3 представлена схема и гистологический срез концевого отдела семенного канальца мыши. Как видно из рисунка, в ТЗ происходит постепенное уменьшение диаметра канальца за счет исчезновения из него половых клеток. В результате, в концевой части ТЗ находятся только немногочисленные сперматогониальные клетки и КС, имеющие, по данным электронно-микроскопических исследований (Perey et al., 1961; Dym, 1974; Nykänen, 1979; Wrobel et al., 1986), видоизмененную морфологию. Эти видоизмененные КС, лишенные связи с половыми клетками, образуют цитоплазматические выросты, занимающие почти весь просвет и формирующие в конце своеобразный клапан (Hermo, Dworkin, 1988), который позволяет только односторонний ток жидкости и сперматозоидов из извитых семенных канальцев в сеть семенника и, затем, в выносящие канальцы (рис. 3).
Согласно Никанену (Nykänen, 1979), ядра ТЗ КС имеют обычную для КС многолопастную форму, но с бóльшим числом периферических гетерохроматиновых глыбок (рис. 3), что делает их похожими на ядра недифференцированных КС неполовозрелых животных. Действительно, КС из ТЗ не полностью дифференцированы. Так, по данным Фигуеиредо и соавторов (Figueiredo et al., 2016), у половозрелых крыс только часть из них экспрессирует такие важные маркеры дифференцировки КС как транскрипционный фактор Gata 4 (GATA binding protein 4) и андрогеновый рецептор (Ar, androgen receptor). В ТЗ КС снижена экспрессия транскрипционного фактора Dmrt1 (Kulibin, Malolina, 2016; Малолина, Кулибин, 2017; Malolina, Kulibin, 2019), необходимого для правильной дифференцировки КС в процессе полового созревания и поддержания развития половых клеток (Raymond et al., 2000; Kim et al., 2007; Matson et al., 2011; Minkina et al., 2014). В то же время, по данным Аиямы и соавторов (Aiyama et al., 2015), в ТЗ КС повышен уровень экспрессии регулятора пролиферации ССК фактора роста GDNF (Glial cell line-derived neurotrophic factor, Meng et al., 2000). Наконец, Иммура-Киши и соавторы (Imura-Kishi et al., 2021) показали, что для ТЗ КС характерен высокий уровень экспрессии фермента, разрушающего РК – цитохрома Cyp26a1 (cytochrome P450 family 26 subfamily A member 1). РК исключительно важна для поддержания пролиферации и дифференцировки сперматогониальных клеток, равно как и их вступления в мейоз (Gewiss et al., 2020), высокая экспрессия фермента, разрушающего ее, объясняет отсутствие в ТЗ дифференцирующихся половых клеток. Вместе с тем, повышенная экспрессия GDNF способствует поддержанию популяции Gfra1+ ССК и формированию ниши (Aiyama et al., 2015). Так как ниши для ССК встречаются по всей длине извитых семенных канальцев (Kubota, Brinster, 2018; de Rooij, 2017) и поддерживают баланс между пролиферацией и дифференцировкой ССК в норме, то “концевые” ниши в ТЗ могут играть роль резерва.
Еще одна интересная особенность ТЗ КС у грызунов была отмечена в нескольких недавних исследованиях, проведенных на сирийских хомяках, крысах и мышах (Aiyama et al., 2015; Figueiredo et al., 2016, 2019; Малолина, Кулибин, 2017). Это продленная, по сравнению с КС из извитых семенных канальцев, пролиферация ТЗ КС в постнатальном развитии семенников. Как отмечают Фигуеиредо и соавторы (Figueiredo et al., 2016, 2019), это явление может широко встречаться среди млекопитающих других видов, но ранее не было замечено исследователями из-за того, что они не изучали пролиферацию КС в ТЗ. Как показали авторы в одной из своих последних работ (Figueiredo et al., 2019), транзиторный гипотиреоз у крыс, вызванный введением ингибитора синтеза гормона T3 – PTU (goitrogen 6-n-propyl-2-thiouracil) после 21-х суток постнатального развития, когда КС в извитых семенных канальцах уже дифференцированы и не способны к пролиферации, приводит к увеличению массы семенников, числа КС и выработки спермы у 160-суточных крыс по сравнению с интактным контролем, за счет пролиферации КС в ТЗ. Результаты этой работы показывают, что сперматогенная система, теоретически, с помощью такой дополнительной пролиферации КС в ТЗ может компенсировать их недостаток в извитых семенных канальцах в случае нарушений процессов развития и, таким образом, обеспечивать достаточную для фертильности выработку зрелых гамет.
Наконец, как уже давно известно, сперматогенные волны берут начало от ТЗ семенных канальцев. Сперматогенная волна, впервые описанная Переем и соавторами (Perey et al., 1961), представляет собой серию смежных сегментов семенного канальца, содержащих все возможные сочетания дифференцирующихся половых клеток – стадии цикла сперматогенного эпителия (у мышей их 12, Oakberg, 1956; у крыс 14, Leblond, Clermont, 1952). Если проследить сперматогенную волну от ТЗ, то, чем дальше мы будем уходить от сети семенника, тем более ранние стадии цикла будем встречать. Сперматогенные волны определяют пространственно-временную организацию сперматогенеза, без которой совместное развитие множества генераций половых клеток по всему семеннику будет невозможно. Механизм формирования волн неизвестен, но ТЗ, вероятно, участвуют в этом процессе.
ФУНКЦИИ СЕТИ СЕМЕННИКА ВЗРОСЛЫХ МЫШЕЙ
Долгое время было принято считать, что основные функции сети семенника – это транзит гамет из извитых семенных канальцев в выносящие канальцы, а также регуляция белкового и солевого состава семенной жидкости (подробно рассмотрено в обзоре Hess, Hermo, 2018). Кроме этого, в случае возникновения непроходимости различных отделов половых протоков или нарушения абсорбции жидкости в выносящих канальцах, сеть семенника выполняет защитную функцию и регулирует внутритестикулярное давление в семеннике, значительно увеличиваясь в объеме (Lupien et al., 2006; Nanjappa et al., 2016; Hess, Hermo, 2018; Major et al., 2021; Cao et al., 2021).
В недавнем исследовании Иммура-Киши и соавторы (Imura-Kishi et al., 2021) показали, что сеть семенника может участвовать в региональной специализации КС в ТЗ. Исследователи провели трансплантацию меченых КС, полученных из извитых семенных канальцев мышат (C57BL/6-R26-H2B-mCherry), в семенники мышей-реципиентов (C57BL/6-Tg AMH-Treck, Shinomura et al., 2014), чьи КС были предварительно уничтожены введением дифтерийного токсина. Через 45 сут после трансплантации донорские КС формировали новые ТЗ в концевых участках извитых семенных канальцев реципиента, окрашивались на маркеры этой зоны p-AKT (RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha, Imura-Kishi et al., 2021) и ace-Tub (ацетилированная форма тубулина, Aiyama et al., 2015) и высоко экспрессировали GDNF, как это происходит в норме.
Полученные результаты свидетельствуют в пользу того, что специализация ТЗ КС является регион-специфической и определяется факторами, исходящими от сети семенника. Такими факторами могут быть факторы роста фибробластов (FGF fibroblast growth factor). Методом РНК-секвинирования Иммура-Киши и соавторы (Imura-Kishi et al., 2021) показали, что клетки сети семенника высоко экспрессируют FGF9, а на ТЗ КС присутствуют рецепторы к этому фактору роста. Было установлено, что FGF сигналы от сети семенника вызывают в ТЗ КС конститутивную активацию серин/треониновой протеинкиназы (AKT), ключевого фермента фосфоинозитид-3-киназного сигнального пути (PI3K/AKT). В отличие от ТЗ КС, в КС извитых семенных канальцев активность AKT циклически изменяется, достигая максимума на II–VI стадиях цикла сперматогенного эпителия и минимума на IX–XII. Таким образом, фосфорилированный (p-AKT) является молекулярным маркером ТЗ региона, также как и фосфорилированый активатор транскрипции 3 (p-STAT3, Nagasawa et al., 2018), о котором было сообщено ранее.
Авторы установили, что p-AKT впервые появляется в концевых отделах извитых семенных канальцев мышей на 7 сут постнатального развития, свидетельствуя о начале формирования ТЗ региона. Так как PI3K/AKT сигнальный путь активен в большинстве типов клеток и одними из его основных функций являются блокирование апоптоза и стимулирование пролиферации (Chen et al., 2001), можно предположить, что конститутивная активность AKT в ТЗ регионе ответственна за длительную пролиферативную активность КС в концевых участках канальцев, о которой написано выше. Так это или нет еще предстоит установить, но полученные в этой работе результаты дают понять, что сеть семенника это не просто часть выносящей системы, но и важный структурный элемент, участвующий в развитии сперматогенной системы.
Список литературы
Малолина Е.А., Кулибин А.Ю. Изучение области сети семенника и прилегающих к ней семенных канальцев в постэмбриональном развитии мыши// Онтогенез. 2017. Т. 48. № 6. С. 450–458.
Малолина Е.А., Кулибин А.Ю. Пролиферативная активность клеток Сертоли извитых семенных канальцев мыши // Цитология. 2018. Т. 60. № 4. С. 308–315.
Aiyama Y., Tsunekawa N., Kishi K., Kawasumi M. et al. A niche for GFRα1-positive spermatogonia in the terminal segments of the seminiferous tubules in hamster testes // Stem Cells (Dayton, Ohio). 2015. V. 33. № 9. P. 2811–2824.
Bowles J., Feng C.W., Ineson J. et al. Retinoic acid antagonizes testis development in mice // Cell Rep. 2018. V. 24. № 5. P. 1330–1341.
Byskov A.G., Lintern-Moore S. Follicle formation in the immature mouse ovary: the role of the rete ovarii // J. Anat. 1973. V. 116. P. 207–217.
Cao Y., Liu L., Lin J., Sun P. et al. Dysregulation of Notch-FGF signaling axis in germ cells results in cystic dilation of the rete testis in mice // J. Cell Commun. Signal. 2021. Epub ahead of print.
Carev D., Saraga M., Saraga-Babic M. Expression of intermediate filaments, EGF and TGF-alpha in early human kidney development // J. Mol. Histol. 2008. V. 39. № 2. P. 227–235.
Chen W.S., Xu P.Z., Gottlob K., Chen M.L. et al. Growth retardation and increased apoptosis in mice with homozygous disruption of the Akt1 gene // Genes Dev. 2001. V. 15. № 17. P. 2203–2208.
Combes A.N., Lesieur E., Harley V.R., Sinclair A.H. et al. Three-dimensional visualization of testis cord morphogenesis, a novel tubulogenic mechanism in development // Dev. Dyn. 2009. V. 238. P. 1033–1041.
Cool J., DeFalco T., Capel B. Testis formation in the fetal mouse: dynamic and complex de novo tubulogenesis // Wiley Interdiscip. Rev. Dev. Biol. 2012. V. 1. № 6. P. 847–859.
Dym M. The fine structure of monkey Sertoli cells in the transitional zone at the junction of the seminiferous tubules with the tubuli recti // Am. J. Anat. 1974. V. 140. № 1. P. 1–25.
Figueiredo A.F.A., França L.R., Hess R.A., Costa G.M.J. Sertoli cells are capable of proliferation into adulthood in the transition region between the seminiferous tubules and the rete testis in Wistar rats // Cell Cycle. 2016. V. 15. P. 2486–2496.
Figueiredo A.F.A., Wnuk N.T., Tavares A.O., Miranda J.R. et al. Prepubertal PTU treatment in rat increases Sertoli cell number and sperm production // Reprod. 2019. V. 158. № 2. P. 199–209.
Gewiss R., Topping T., Griswold M.D. Cycles, waves, and pulses: Retinoic acid and the organization of spermatogenesis // Androl. 2020. V. 8. № 4. P. 892–897.
Griswold M.D. The central role of Sertoli cells in spermatogenesis// Semin. Cell Dev. Biol. 1998. V. 9. № 4. P. 411–416.
Griswold M.D. 50 years of spermatogenesis: Sertoli cells and their interactions with germ cells // Biol. Reprod. 2018. V. 99. № 1. P. 87–100.
Hermo L., Dworkin J. Transitional cells at the junction of seminiferous tubules with the rete testis of the rat: their fine structure, endocytic activity, and basement membrane // Am. J. Anat. 1988. V. 181. № 2. P. 111–131.
Hess R.A., Renato de Franca L. Spermatogenesis and cycle of the seminiferous epithelium // Adv. Exp. Med. Biol. 2008. V. 636. P. 1–15.
Hess R.A., Hermo L. Rete testis: Structure, cell biology and site for stem cell transplantation // Encyclopedia of Reproduction. 2nd ed. Oxford: Academic Press, 2018. P. 263–269.
Ikeda Y., Takeda Y., Shikayama T., Mukai T. et al. Comparative localization of Dax-1 and Ad4BP/SF-1 during development of the hypothalamic-pituitary-gonadal axis suggests their closely related and distinct functions // Dev. Dyn. 2001. V. 220. № 4. P. 363–376.
Imura-Kishi K., Uchida A., Tsunekawa N., Suzuki H. et al. Low retinoic acid levels mediate regionalization of the Sertoli valve in the terminal segment of mouse seminiferous tubules // Sci. Rep. 2021. V. 11. № 1. P. 1110–1124.
Joseph A., Yao H., Hinton B.T. Development and morphogenesis of the Wolffian/epididymal duct, more twists and turns // Dev. Biol. 2009. V. 325. № 1. P. 6–14.
Kim S.L., Bardwell V.J., Zarkower D. Cell type-autonomous and non-autonomous requirements for Dmrt1 in postnatal testis differentiation// Dev. Biol. 2007. V. 307. № 2. P. 314–327.
Kopera I.A., Bilinska B., Cheng C.Y., Mruk D.D. Sertoli-germ cell junctions in the testis: a review of recent data // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2010. V. 27. № 365. P. 1593–1605.
Kubota H., Brinster R.L. Spermatogonial stem cells // Biol. Reprod. 2018. V. 99. № 1. P. 52–74.
Kulibin A.Y., Malolina E.A. Only a small population of adult Sertoli cells actively proliferates in culture // Reproduction. 2016. V. 152. № 4. P. 271–281.
Kulibin A.Y., Malolina E.A. Formation of the rete testis during mouse embryonic development // Dev. Dyn. 2020. V. 249. № 12. P. 1486–1499.
Leblond C.P., Clermont Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat // Ann. N.Y. Acad. Sci. 1952. V. 55. № 4. P. 548–573.
Liu C., Peng J., Matzuk M.M., Yao H.H. Lineage specification of ovarian theca cells requires multicellular interactions via oocyte and granulosa cells // Nat. Commun. 2015. V. 6. P. 6934.
Lupien M., Dievart A., Morales C.R., Hermo L. et al. Expression of constitutively active Notch1 in male genital tracts results in ectopic growth and blockage of efferent ducts, epididymal hyperplasia and sterility // Dev. Biol. 2006. V. 300. № 2. P. 497–511.
Major A.T., Estermann M.A., Smith C.A. Anatomy, endocrine regulation, and embryonic development of the rete testis // Endocrinol. 2021. V. 162. № 6. P. bqab046.
Malolina E.A., Kulibin A.Y. The rete testis harbors Sertoli-like cells capable of expressing DMRT1 // Reproduction. 2019. V. 158. № 5. P. 399–413.
Matson C.K., Murphy M.W., Sarver A.L., Griswold M.D. et al. DMRT1 prevents female reprogramming in the postnatal mammalian testis // Nature. 2011. V. 476. P. 101–104.
McKey J., Anbarci D.N., Bunce C., Capel B. Integration of mouse ovary morphogenesis with developmental dynamics of the oviduct, ovarian ligaments, and rete ovarii // bioRxiv 2021. 05.21.445181. Preprint.
Meng X., Lindahl M., Hyvonen M.E. et al. Regulation of cell fate decision of undifferentiated spermatogonia by GDNF // Science. 2000. V. 287. P. 1489–1493.
Minkina A., Matson C.K., Lindeman R.E. et al. DMRT1 protects male gonadal cells from retinoid-dependent sexual transdifferentiation // Dev. Cell. 2014. V. 29. № 5. P. 511–520.
Nagasawa K., Imura-Kishi K., Uchida A. et al. Regionally distinct patterns of STAT3 phosphorylation in the seminiferous epithelia of mouse testes // Mol. Reprod. Dev. 2018. V. 85. P. 262–270.
Nanjappa M.K., Hess R.A., Medrano T.I., Locker S.H. et al. Membrane-localized estrogen receptor 1 is required for normal male reproductive development and function in mice // Endocrinol. 2016. V. 157. № 7. P. 2909–2919.
Nef S., Stévant I., Greenfield A. Characterizing the bipotential mammalian gonad // Curr. Top. Dev. Biol. 2019. V. 134. P. 167–194.
Nel-Themaat L., Vadakkan T.J., Wang Y., Dickinson M.E. et al. Morphometric analysis of testis cord formation in Sox9-EGFP mice // Dev. Dyn. 2009. V. 238. № 5. P. 1100–1110.
Nykänen M. Fine structure of the transitional zone of the rat seminiferous tubule // Cell Tissue Res. 1979. V. 198. № 3. P. 441–454.
Oakberg E.F. A description of spermiogenesis in the mouse and its use in analysis of the cycle of the seminiferous epithelium and germ cell renewal // Am. J. Anat. 1956. V. 99. № 3. P. 391–413.
Omotehara T., Wu X., Kuramasu M., Itoh M. Connection between seminiferous tubules and epididymal duct is originally induced before sex differentiation in a sex-independent manner // Dev. Dyn. 2020. V. 249. № 6. P. 754–764.
Ozcan A., Shen S.S., Hamilton C., Anjana K. et al. PAX8 expression in non-neoplastic tissues, primary tumors, and metastatic tumors: a comprehensive immunohistochemical study // Mod. Pathol. 2011. V. 24. № 6. P. 751–764.
Perey B., Clermont Y., Leblond C.P. The wave of the seminiferous epithelium in the rat // Am. J. Anat. 1961. V. 108. P. 47–78.
Raymond C.S., Murphy M.W., O’Sullivan M.G. et al. Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation // Genes Dev. 2000. V. 14. № 20. P. 2587–2595.
Rebourcet D., O’Shaughnessy P.J., Pitetti J.L., Monteiro A. et al. Sertoli cells control peritubular myoid cell fate and support adult Leydig cell development in the prepubertal testis // Dev. 2014. V. 141. № 10. P. 2139–2149.
de Rooij D.G. The nature and dynamics of spermatogonial stem cells // Dev. 2017. V. 144. № 17. P. 3022–3030.
Roosen-Runge E.C., Holstein A.F. The human rete testis // Cell Tissue Res. 1978. V. 189. № 3. P. 409–433.
de Mello Santos T., Hinton B.T. We, the developing rete testis, efferent ducts, and Wolffian duct, all hereby agree that we need to connect // Andrology. 2019. V. 7. № 5. P. 581–587.
Sharma R., Sanchez-Ferras O., Bouchard M. Pax genes in renal development, disease and regeneration // Semin. Cell Dev. Biol. 2015. V. 44. P. 97–106.
Shinomura M., Kishi K., Tomita A., Kawasumi M. et al. A novel Amh-Treck transgenic mouse line allows toxin-dependent loss of supporting cells in gonads // Reprod. 2014. V. 148. P. 1–9.
Smith P., Wilhelm D., Rodgers R.J. Development of mammalian ovary // J. Endocrinol. 2014. V. 221. № 3. P. R145–R161.
Swain A., Zanaria E., Hacker A., Lovell-Badge R. et al. Mouse Dax1 expression is consistent with a role in sex determination as well as in adrenal and hypothalamus function // Nat. Genet. 1996. V. 12. № 4. P. 404–409.
Svingen T., Koopman P. Building the mammalian testis: origins, differentiation, and assembly of the component cell populations // Genes Dev. 2013. V. 27. № 22. P. 2409–2426.
Wrobel K.H. Morphogenesis of the bovine rete testis: the intratesticular rete and its connection to the seminiferous tubules // Anat. Embryol. (Berl.) 2000. V. 202. P. 475–490.
Wrobel K.H., Schilling E., Zwack M. Postnatal development of the connexin between tubulus seminiferous and tubulus rectus in the bovine testis // Cell Tissue Res. 1986. V. 246. № 2. P. 387–400.
Zamboni L., Upadhyay S. The contribution of the mesonephros to the development of the sheep fetal testis // Am. J. Anat. 1982. V. 165. № 3. P. 339–356.
Дополнительные материалы отсутствуют.


