Онтогенез, 2021, T. 52, № 6, стр. 453-466
Влияние гормонального фона на экспрессию рецепторов к половым гормонам и миграторного потенциала клеток эпителия и стромы эндометрия мыши in vitro
Л. Ш. Измайлова a, *, А. А. Гайдамака a, О. О. Сербина a, Е. А. Воротеляк a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: luba.ranaway-94@yandex.ru
Поступила в редакцию 25.06.2021
После доработки 22.07.2021
Принята к публикации 27.07.2021
Аннотация
Подготовка к имплантации эмбриона – это комплексный процесс, включающий в себя изменения как на клеточном, так и на тканевом уровнях в эпителии и строме эндометрия матки. От регуляции преимплантационных изменений эндометрия и наступления периода рецептивности зависит успешность прохождения беременности. Моделирование регуляции функционирования эндометрия in vitro позволяет изучить процесс подготовки эндометрия к имплантации эмбриона, что особенно важно для разработки терапевтических подходов для лечения заболеваний, ассоциированных с бесплодием. В работе показано влияние стероидных половых гормонов на изменение полярности эпителия эндометрия in vitro, что также является немаловажным процессом во время имплантации in vivo. Также описано взаимное влияние эстрогена и прогестерона как основных регуляторов функционирования эндометрия на экспрессию их рецепторов.
ВВЕДЕНИЕ
Внутренняя оболочка матки, эндометрий, поддерживает имплантацию и дальнейшее развитие эмбриона. Основные клеточные популяции эндометрия представлены клетками люминального и железистого эпителия и подлежащей стромы. В ходе приобретения рецептивности эндометрий проходит серию последовательных изменений. Процесс преобразования эндометрия перед имплантацией у человека и мыши управляется двумя основными гормонами: эстрогеном (E2) и прогестероном (P4), которые активируют соответствующие сигнальные пути (Wang, Dey, 2006).
Нарушение процесса имплантации у человека является причиной более чем половины случаев потери беременности на ранних сроках (Wilcox et al., 1988). В связи с этим молекулярная регуляция имплантации активно изучается.
Изучение имплантации эмбриона человека в матке по техническим и этическим причинам затруднено, поэтому исследования в этой области проводятся с использованием модельных животных. Одним из распространенных модельных объектов является мышь (Mus musculus). Помимо решения проблем, возникающих при репродукции, модели имплантации эмбрионов in vitro необходимы для исследования раннего постимплантационного развития. Этот этап мало изучен, так как прикрепившийся эмбрион развивается внутри матки, что затрудняет наблюдение и манипуляции с ним. Для решения этой проблемы использование мыши в качестве модельного объекта в системах in vitro является перспективным направлением. Например, в одной из последних работ было показано развитие эмбриона мыши in vitro от стадии гаструляции до позднего органогенеза (Aguilera-Castrejon et al., 2021). Также для мыши была показана имплантация эмбриона in vitro с последующим развитием зародышевого цилиндра (Bedzhov et al., 2014). Работа с мышью помогает избежать этических вопросов при исследовании как имплантации эмбриона и его развития, так и функционирования эндометрия во время беременности. Модели с использованием клеток эпителия и стромы, выделенных из эндометрия мыши, позволяют реконструировать имплантацию in vitro.
Подготовка к имплантации у мыши начинается с секреции преовуляторного Е2 фолликулярными клетками яичников. Функция E2 обеспечивается путем его взаимодействия с ядерными рецепторами ERα (Estrogen Receptor α) и ERβ (Estrogen Receptor β). ERα является доминирующей формой рецепторов к E2 в матке мыши, поскольку она отвечает за подготовку эндометрия к имплантации (Vasquez and DeMayo, 2013). На 1–2 сутки беременности Е2 запускает пролиферацию эпителия, связываясь с ERα стромы (Vasquez and DeMayo, 2013). В строме включается экспрессия инсулин-подобного фактора роста-1 (Insulin-like growth factor 1; IGF-1) и белков семейства факторов роста фибробластов (Fibroblast growth factors; FGFs), которые паракринно действуют на эпителиальные клетки и активируют пролиферацию (Hantak et al., 2014). Кроме того, фолликулярный Е2 обеспечивает подготовку клеток стромы к децидуализации и активирует экспрессию рецепторов к P4 (Progesterone receptors; PRs) в эндометрии. Также были получены данные, не согласующиеся с приведенными выше результатами. Тан с соавторами показали, что в первый день беременности ER экспрессируется только в эпителии, но не в строме (Tan et al., 1999). Однако, эти данные были получены методом FISH с детекцией при помощи метода авторадиографии, что затрудняет однозначную трактовку полученных результатов. К 4 суткам, когда желтое тело уже сформировано, наблюдается небольшой пик E2, который участвует в активации эмбриона и подготовке стромы к децидуальной реакции (Zhang et al., 2013). Растущий на 3 сутки беременности уровень P4 вызывает в эндометрии изменения, необходимые для поддержания развития прикрепившегося эмбриона. P4 действует через ядерные рецепторы – PRs. Они также имеют 2 изоформы: PRA и PRB, которые транскрибируются под разными промоторами с одного гена (Vasquez and DeMayo, 2013). P4 подавляет экспрессию ERα в эндометрии, пролиферацию эпителиальных клеток и, наоборот, активирует пролиферацию клеток стромы, которая связана с децидуальной реакцией (Zhang et al., 2013). В дополнение к этому, Р4 вызывает ремоделирование эпителиального барьера, которое необходимо для облегчения прикрепления и инвазии эмбриона (Ye, 2020). Исходя и этих данных, можно заключить, что баланс эстроген-зависимых и прогестерон-зависимых эффектов во многом обуславливает успешное прохождение имплантации.
Несмотря на то, что существует немало работ в этой области, до сих пор не выяснено, каким образом половые стероидные гормоны влияют на экспрессию их рецепторов в эпителиальном и стромальном компартментах эндометрия во время беременности. Также не ясно, вносит ли взаимодействие клеточных популяций эпителия и стромы какой-либо вклад в изменение экспрессии рецепторов к половым гормонам. Например, для мыши было показано, что PR экспрессируется в ЛЭ в околоимплантационные сроки, уровень его экспрессии снижается с началом децидуализации стромы. При этом, показано, что сигнальный путь, индуцируемый Р4 через PR необходим для прохождения имплантации. На этапе, когда полностью сформирована децидуальная зона, экспрессия PR в эпителии уже не детектируется. В то же время у псевдобеременных мышей снижение уровня экспрессии PR в эпителии происходит только если искусственно индуцирована децидуальная реакция. Таким образом, прекращение экспрессии PR в эпителии эндометрия регулируется локальными факторами, продуцируемыми в матке, и регулируется за счет диалога между стромальным и эпителиальным компартментами (Honglu et al., 2012).
Для создания адекватной модели эндометрия необходимо понимание изменений, происходящих в ответ на гормональную стимуляцию в нативных клетках эпителия и стромы. Регуляция экспрессии рецепторов к половым гормонам в течение эстрального цикла и беременности, а также роли взаимодействия эпителия и стромы требует отдельного изучения. Также исследования в этой области помогут расширить знания о регуляции эндометрия in vivo.
Люминальный эпителий (ЛЭ) эндометрия является первым барьером на пути инвазии эмбриона. Эпителий в ходе имплантации претерпевает трансформацию цитоплазматической мембраны (ТЦМ), которая характеризуется изменением поляризации клеток. Этот процесс начинается перед инвазией бластоцисты и, вероятно, необходим для облегчения прохождения эмбриона сквозь эпителиальный барьер. Во многом ТЦМ сходна с эпителио-мезенхимным переходом (ЭМП), свойственным опухолевым клеткам.
Ряд авторов высказали предположение, что в околоимплантационный период ЛЭ проходит именно ЭМП и приобретает способность к миграции. Эта гипотеза была проверена на линии клеток аденокарциномы эндометрия (Ishikawa – Ишикава). Ишикава – это клеточная линия, используемая в качестве модели рецептивного эпителия эндометрия. В работе Учиды с соавторами (Uchida et al., 2012) показали, что культивирование клеток эпителия эндометрия в среде с E2 и P4 вызывает повышение миграторного потенциала клеток, перестройку актинового цитоскелета с образованием стресс-фибрилл актина и повышение уровня экспрессии виментина. Также в эпителиальных клетках как при обработке гормонами, так и при добавлении сфероидов из клеток хориокарциномы человека (JAR-cells) происходило характерное для ЭМП “кадгериновое переключение”: снижение уровня экспрессии Е-кадгерина и повышение уровня экспрессии N-кадгерина. Монослойная культура клеток Ишикава поддерживала прикрепление сфероидов in vitro, при этом площадь разрастания сфероидов была больше, если клетки предварительно культивировали в среде с E2 и P4. Авторы предложили модель, согласно которой клетки ЛЭ приобретают способность к миграции и перемещаются по направлению от зоны имплантации, тем самым облегчая прохождение эмбриона сквозь эпителиальный барьер (Uchida et al., 2012). Однако этот результат получен с использованием опухолевых клеток.
Целью данной работы было проверить гипотезу о прохождении клетками эпителия ЭМП in vitro и внести ясность в вопрос о влиянии половых стероидов на уровень экспрессии их рецепторов в клетках эпителия и стромы матки мыши in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
В работе были использованы самки мыши линии Balb/C в возрасте 8–12 недель. Животные содержались в стандартных условиях вивария ИБР РАН по 4–6 особей в клетке, со свободным доступом к корму и воде. В каждом эксперименте было задействовано по 6 особей, которые до начала эксперимента содержались в одной клетке. Все манипуляции с животными были одобрены этической комиссией ИБР РАН (Протокол № 40 от 17.09.2021).
Для получения культур клеток эпителия и стромы матки самок мыши стимулировали E2 для синхронизации в фазе эструса по стандартному протоколу (De Clercq et al., 2017).
Получение культур клеток эпителия и стромы матки
Для получения культур клеток животных выводили из эксперимента при помощи цервикальной дислокации и изолировали матки. Рога маток промывали раствором Хенкса (ПанЭко, Россия) с добавлением 1% раствора гентамицина и разрезали продольно. Из ткани маток всех животных, участвовавших в эксперименте, выделяли тотальные фракции клеток эпителия и стромы, которые затем распределялись по группам в зависимости от времени культивирования и типа гормонального воздействия. Для выделения эпителия ткань рогов матки помещали в 0.1% раствор диспазы при 4°С на 12 ч. На следующий день ткань в растворе диспазы (Gibco, Ирландия) инкубировали при 37°С в течение 15 мин с последующим интенсивным встряхиванием на вортексе в течение 2 мин. Среду с отделившимися эпителиальными пластами отбирали и центрифугировали. Эпителий промывали полной средой ДМЕМ, осаждали центрифугированием. Для выделения стромы оставшуюся после выделения эпителия ткань матки гомогенизировали и помещали в 0.2% раствор коллагеназы первого типа (Gibco, Ирландия) на 5 ч при 37°С при постоянном перемешивании. Далее отбирали и центрифугировали раствор с клетками стромы эндометрия. Строму промывали полной средой ДМЕМ и осаждали центрифугированием. Осадок с клетками эпителия или стромы переносили в лунки 12–96 луночного планшета или чашки Петри.
Культивирование клеток эпителия и стромы эндометрия
Клетки эпителия и стромы культивировали в полной минимальной среде Игла ДМЕМ в инкубаторе в стандартных условиях – 37°С, 5% СО2. Полная среда ДМЕМ состояла из среды ДМЕМ (Gibco, Ирландия), 10% эмбриональной телячьей сыворотки (ЭТС), 1% Glutamax (Gibco, Ирландия), 1% PenStrep (Gibco, Ирландия). Для моделирования гормонального воздействия на эпителий и строму эндометрия, соответствующего имплантации, в среду добавляли гормоны, разведенные в диметилсульфоксиде (DMSO; SigmaAldrich, США) с конечной концентрацией Е2 – 0.9 нМ и Р4 – 63.5 нМ (SigmaAldrich, США). Конечная концентрация ДМСО (SigmaAldrich, США) в среде после добавления в нее гормонов не превышала 0.02%. Культивирование клеток проводили в 4-х гормональных режимах – контроль без добавления гормонов, с добавлением Е2, с добавлением Р4 и с обоими гормонами. Концентрации гормонов, соответствующие гормональному фону мыши в период имплантации, были подобраны по результатам анализа литературы (Ye et al., 2012). Смена сред проводилась каждые 1–2 дня.
Иммуноцитохимия
Для иммуноцитохимического окрашивания клетки предварительно были посажены в лунки 48 луночного планшета. Фиксацию, отмывки и окраску первичными и вторичными антителами (табл. 1) проводили по стандартному протоколу (De Clercq et al., 2017). Клетки анализировали при помощи флуоресцентного микроскопа Olympus IX51 (Olympus, Япония). В качестве контроля использовали образцы клеток, окрашенных без добавления первых антител.
Таблица 1.
Список антител, использованных в работе
| Название | В каком животном изготовлено | Фирма, каталожный номер |
|---|---|---|
| I Polyclonal Anti-Vimentin antibody | Chicken | Abcam ab24525 |
| I Monoclonal Anti-PanCytokeratin antibody | Mouse | Abcam ab7753 |
| II Anti-Сhicken Alexa-488 conjugated antibody | Goat | Thermo Fisher A11039 |
| II Anti-Mouse Alexa-488 conjugated antibody | Goat | Thermo Fisher A32723 |
Проточная цитометрия
Клетки снимали с пластика стандартным способом (Kubaczka et al., 2014). Пробоподготовку для анализа клеток при помощи метода проточной цитофлуориметрии проводили стандартным способом (Shakya et al., 2020). Образцы анализировали на проточном цитофлуориметре Attune NxT (ThermoFisher, США). В качестве контроля использовали образцы клеток, окрашенных без добавления первичных антител.
Определение времени удвоения культуры
Время удвоения культуры определяли на приборе xCELLigence (RTCA, CША) стандартным способом (Hamidi et al., 2017).
ПЦР-РВ (полимеразная цепная реакция с детекцией в реальном времени)
Из клеток эпителия, стромы эндометрия мыши или гомогената ткани матки мыши выделяли тотальную РНК с помощью Quick-RNA Miniprep Kit (Zymo Research, США) по инструкциям производителя. Затем синтезировали кДНК с помощью набора для обратной транскрипции MMLV RT kit (Евроген, Россия) со случайными праймерами по инструкциям производителя. После этого проводили количественную ПЦР с детекцией в реальном времени с применением смеси для ПЦР qPCRmix-HS SYBR (Евроген, Россия) по инструкциям производителя на приборе LightCycler 96 (Roche, Швейцария). В качестве контроля в каждом повторе эксперимента для каждого праймера (табл. 2) были проанализированы пробы RT–, то есть пробы, в которые на этапе обратной транскрипции не была добавлена обратная транскриптаза. Данные пробы не содержали к-ДНК и их анализ методом ПЦР-РВ был показателем геномной ДНК в пробе. Полученные результаты были нормированы на экспрессию референсного гена ActinB, выбранного на основании обзора литературы (Lin et al., 2013).
Таблица 2.
Праймеры, использованные при проведении ПЦР-РВ. Все праймеры были произведены фирмой Евроген, Россия
| Название | Последовательность |
|---|---|
| moVim-F | GCCAGGCCAAGCAGGAGTCAAAC |
| moVim-R | ATCCTGCAGGCGGCCAATAGTGT |
| moCdh1-F | GCTGGACCGAGAGAGTTACC |
| moCdh1-R | CCGGGCATTGACCTCATTCT |
| moKrt8-F | AACAAGTTCGCCTCCTTCATT |
| moKrt8-R | CATGTTGTCCATGTTGCTCCTC |
| moPgr-F | CAATGGAAGGGCAGCATAACT |
| moPgr-R | ACACCGTCAAGGGTTCTCATA |
| moEsr1-F | AGGCTTTGGGGACTTGAATCT |
| moEsr1-R | CATGCGGAACCGACTTGAC |
| moActb-F | ACCCGCCACCAGTTCG |
| moActb-R | AGCATCGTCGCCCGC |
| moTbp-F | ACCGTGAATCTTGGCTGTAAA |
| moTbp-R | GTCTGGATTGTTCTTCACTCTTG |
| moCdh2-F | GCCCGGTTTCACTTGAGAG |
| moCdh2-R | GTACCGCAGCATTCCATTCA |
| moSnai2-F | GCCTCCAAGAAGCCCAACTA |
| moSnai2-R | GCCGACGATGTCCATACAGT |
| moTwist2-F | GGACCAAGGCTCTCAGAACAA |
| moTwist2-R | TCCAGGCTTCCTCGAAACAG |
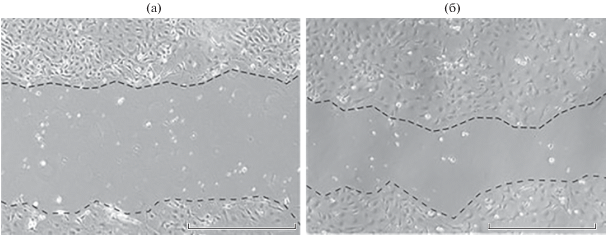
Модель раны и оценка уровня миграции клеток эпителия эндометрия
Клетки эпителия эндометрия культивировали при каждом гормональном режиме 2 сут до достижения 90% конфлюэнтности. Затем микропипеткой с пластиковым носиком удаляли клетки полосой в монослое, анализировали и фотографировали область раны. Через 24 ч после нанесения раны ее повторно фотографировали (рис. 1). Анализ зарастания раны производился описанным ранее методом (Uchida et al., 2012).
Статистические методы
Данные анализировали с помощью Microsoft Excel и программы GraphPad Prism 5.0 (GraphPad Software, v.5, США). Для статистического анализа данных и построения графиков использовали программу GraphPad® Prism (GraphPad Software, v.5, США). Если распределение сравниваемых значений параметра в нескольких независимых выборках отличалось от нормального, то для статистической обработки результатов использовали непараметрический аналог ANOVA – ранговый дисперсионный анализ Краскела–Уоллиса. Для распределений, не отличающихся от нормального, использовали дисперсионный анализ ANOVA. Проверку гипотезы о нормальности распределения проводили с помощью критерия Колмогорова–Смирнова. Статистически значимыми приняты данные со значением P < 0.05. Для попарного сравнения двух нормально распределенных зависимых выборок использовался парный t‑критерий Стьюдента. Для выборок, имеющих не нормальное распределение, использовали непараметрический аналог – критерий Уилкоксона. Для сравнения двух несвязанных выборок применялся t-критерий Стьюдента для независимых выборок и его непараметрический аналог – критерий Манна–Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика полученных культур
Культуры эпителия и стромы выделяли из эндометрия матки мыши по разработанному нами протоколу: подобрали время и условия инкубирования с растворами ферментов (см. Материалы и методы), благодаря которым в рамках одного эксперимента возможно выделить из матки мыши и эпителий, и клетки стромы. Это позволяет использовать культуры клеток эпителия и стромы от одной группы животных, что повышает достоверность экспериментов.
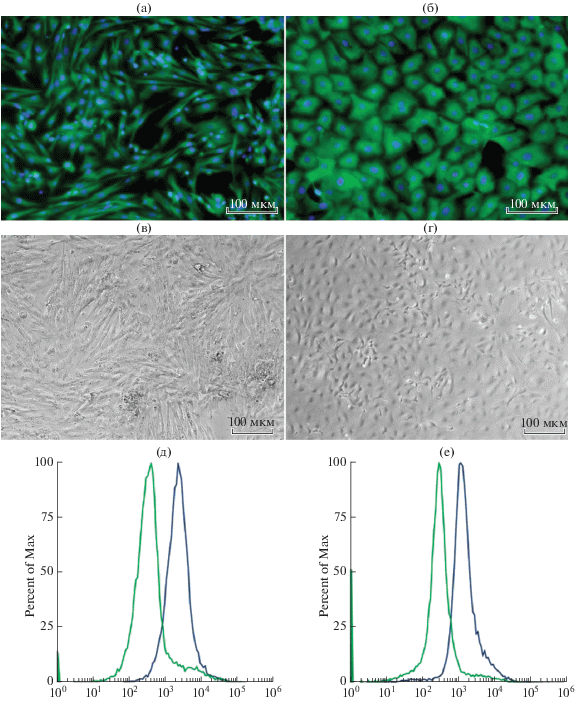
Стромальные и эпителиальные клетки в культуре имели фибробластоподобную и эпителиальную морфологию, соответственно (рис. 2в, 2г). Клеточные культуры стромы и эпителия были окрашены на мезенхимальные (виментин) (рис. 2а, 2д) и эпителиальные (PanCK) (рис. 2б, 2е) маркеры и проанализированы при помощи методов иммуноцитохимии и проточной цитофлуориметрии.
Рис. 2.
Культуры клеток, выделенные из эндометрия мыши. Иммуноцитохимическая окраска клеток, (а) строма, окраска антителами к виментину и DAPI, (б) эпителий, окраска антителами к PanCK и DAPI. Общий вид культуры, фазовый контраст, (в) строма, (г) эпителий. Проточная цитометрия, (д) строма, окраска антителами к виментину, (е) эпителий, окраска антителами к PanCK. На графиках представлено сравнение интенсивности флуоресценции окрашенных образцов (синий) и контроля (зеленый).
Была проведена оценка экспрессии эпителиальных и мезенхимальных маркеров в клетках эпителия и стромы при помощи метода ПЦР-РВ (рис. 3). В этом эксперименте в качестве эпителиальных маркеров использовали Е-кадгерин и специфический маркер эпителия эндометрия кератин 8. Для оценки уровня экспрессии стромальных маркеров использовали виментин.
Рис. 3.
Анализ экспрессии генов эпителиальных и мезенхимальных маркеров в культурах клеток эпителия и стромы, выделенных из эндометрия матки. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
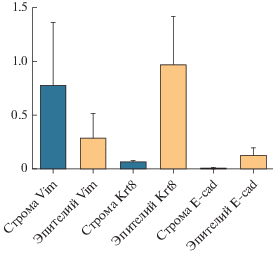
Эти эксперименты подтвердили эпителиальную природу культуры эпителия эндометрия и мезенхимальную природу культуры клеток стромы эндометрия мыши, что демонстрирует эффективность протокола их выделения и чистоту полученных культур. Для дальнейшей характеризации выделенных культур клеток скорость их пролиферации была оценена при помощи прибора xCELLegence (RTCA). Среднее время удвоения популяции клеток эпителия составляло 100 ч и было достоверно выше, чем среднее время удвоения клеток культуры стромы эндометрия мыши (69 ч).
Уровень миграции клеток эпителия эндометрия при разных гормональных режимах культивирования
Для оценки влияния половых стероидных гормонов на способность к миграции эпителия эндометрия была исследована подвижность клеток на модели раны. Через 24 ч после нанесения царапины были обнаружены статистически значимые различия в изменении площади раны практически между всеми группами, кроме образцов, обработанных обоими гормонами (E2P4) и контролем (без обработки гормонами; Б/Г) (рис. 4). При этом степень закрытия раны была наибольшей в группе клеток, обработанных Р4, что говорит о высокой клеточной подвижности. Самая низкая подвижность клеток была обнаружена в культуре, которая находилась в среде с Е2. Уровень миграции в группе клеток, обработанных обоими гормонами, имел промежуточные значения.
Рис. 4.
График зависимости уровня миграции клеток эпителия эндометрия от типа гормонального воздействия. Статистически значимые различия обнаружены между всеми группами, кроме Е2Р4 и Б/Г (без обработки гормонами). P-значение ≤0.006.
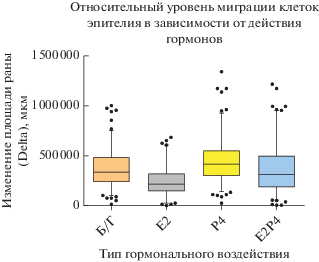
В ходе анализа уровня миграции опухолевых клеток в модели раны было обнаружено достоверное повышение подвижности клеток при культивировании в среде с обоими гормонами (Uchida et al., 2012). Мы также наблюдали увеличение уровня миграции клеток в условиях культивирования с Е2Р4, однако только относительно обработанных Е2 клеток, но не контрольной группы. При этом наибольшая подвижность клеток обнаружена в культуре, обработанной P4, а наименьшая – в среде с E2. Исходя из полученных данных, мы пришли к выводу, что Р4 активирует способность к миграции эпителия, а Е2 – подавляет ее. Известно, что Е2 оказывает эффект, поддерживающий полярность эпителия, и восстанавливает микроворсинки на апикальной поверхности клеток (Quinn et al., 2019; Whitby et al., 2020). Следовательно, подавление миграции клеток эпителия эндометрия может быть связано с ингибирующим действием Е2. Необходимо также подчеркнуть, что именно Р4 является основным регулятором процесса имплантации. Кроме того, показана роль контролируемых Р4 факторов в снижении апико-базальной полярности эпителия эндометрия (Zhang et al., 2013; Kallen et al., 2014). Этот результат согласуется с данными, полученными в более ранних исследованиях, и может частично подтверждать предположения о приобретении подвижности клетками люминального эпителия во время имплантации in vivo и ключевом влиянии Р4 на этот процесс. Поэтому наша модель в контексте оценки подвижности клеток является релевантной и отражает некоторые гормон-зависимые эффекты, действующие в ходе имплантации.
Уровень экспрессии мезенхимальных, эпителиальных маркеров и генов-маркеров ЭМП в культуре эпителиальных клеток эндометрия при различных гормональных режимах культивирования
Для оценки влияния гормонов на изменение эпителиального фенотипа клеток эпителия эндометрия со временем культивирования был проведен ПЦР-РВ генов, кодирующих маркеры эпителия, мезенхимы и факторы транскрипции ЭМП. В качестве образцов для анализа экспрессии выбранных генов были использованы культуры эпителия эндометрия, которые находились в средах с гормонами в течение 2 и 5 сут.
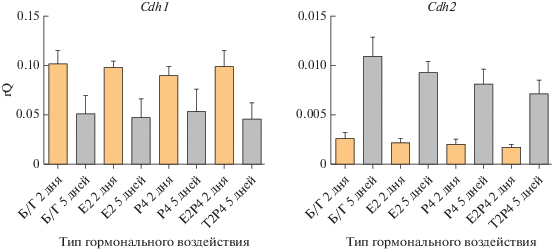
На первом этапе была исследована экспрессия генов Cdh1 и Cdh2, кодирующих Е-кадгерин и N-кадгерин, соответственно (рис. 5). Экспрессия эпителиального маркера, Cdh1, достоверно уменьшалась в эпителии к 5 сутками культивирования (p < 0.01). В то же время экспрессия мезенхимного маркера, Cdh2, увеличивалась (p < 0.01). Однако уровень экспрессии этих генов не зависел от типа гормонального воздействия.
Рис. 5.
Анализ экспрессии генов эпителиального (Cdh1) и мезенхимального (Cdh2) типов кадгеринов в культурах клеток эпителия, выделенных из эндометрия матки и культивируемых при разных гормональных режимах в течение 2 и 5 сут. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
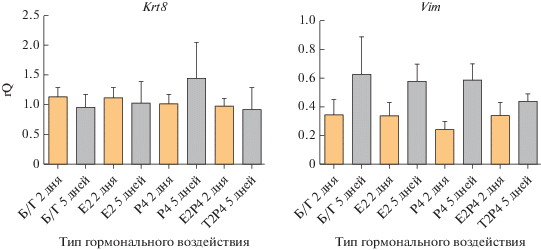
На втором этапе была изучена экспрессия следующей пары генов: Krt8 и Vim (рис. 6). Эти гены также кодируют маркеры эпителия (кератин-8) и мезенхимы (виментин). В отличие от Cdh1 экспрессия Krt8 в целом не зависела от времени культивирования. При этом экспрессия Vim аналогично Cdh2 достоверно увеличивалась на 5 сут культивирования (p < 0.01). Достоверных различий в экспрессии этих генов между типами гормональных режимов культивирования не наблюдалось.
Рис. 6.
Анализ экспрессии генов эпителиальных (Krt8) и мезенхимальных (Vim) маркеров в культурах клеток эпителия, выделенных из эндометрия матки и культивируемых при разных гормональных режимах в течение 2 и 5 сут. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
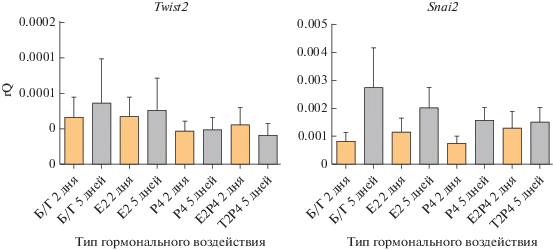
Далее была проведена оценка уровней экспрессии генов Twist2 и Snai2, кодирующих факторы транскрипции ЭМП (рис. 7). Их экспрессия также не зависела от типа гормонального воздействия, при этом уровень Snai2 достоверно увеличивался к 5 дню культивирования (p < 0.01), а Twist2 – практически не менялся со временем.
Рис. 7.
Анализ экспрессии генов маркеров ЭМП (Twist2, Snai2) в культурах клеток эпителия, выделенных из эндометрия матки и культивируемых при разных гормональных режимах в течение 2 и 5 сут. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
Процесс ТЦМ сходен с эпителио-мезенхимным переходом (ЭМП), свойственным опухолевым клеткам. Например, в ходе обоих процессов происходит разборка фокальных контактов, что способствует индивидуализации клеток (Lamouille et al., 2014; Kaneko et al., 2011, 2011). Также апикальная поверхность эпителиальных клеток теряет микроворсинки (Chávez et al., 1985). В ремоделировании актинового цитоскелета как при ЭМП, так и при ТЦМ участвуют малые ГТФазы семейства RhoA, в дополнение к этому происходит диссоциация актина от белкового комплекса ERM (Ezrin, Radixin, Moesin), связывающего актин с белками цитоплазматической мембраны. Весомым аргументом в пользу гипотезы о ЭМП ЛЭ является результат, полученный в работах по анализу экспрессии генов, которые кодируют факторы транскрипции ЭМП. Экспрессия генов Snai2 и Twist2 увеличивается в эндометрии беременных мышей к моменту имплантации, при этом их белковые продукты при иммуногистохимическом окрашивании были преимущественно локализованы в эпителии эндометрия (Du et al., 2009; Gou et al., 2019).
Однако существует ряд отличий между ЭМП и ТЦМ. При ЭМП происходит разборка плотных контактов между клетками эпителия, что облегчает их миграцию. При подготовке к окну имплантации плотные соединения, наоборот, выявляются на латеральных мембранах клеток ЛЭ эндометрия, также присутствуют десмосомы, хотя и в меньшем количестве, чем до наступления рецептивности эпителия (Illingworth et al., 2000). В то же время при ЭМП белковые комплексы десмосом полностью разбираются для обеспечения миграции клеток (Whitby et al., 2020). На поверхности опухолевых клеток в процессе ЭМП образуются небольшие выпячивания цитоплазматической мембраны – блебы, а клетки эндометрия во время имплантации формируют пиноподии. Несмотря на то, что обе эти структуры – это богатые актином выступы на поверхности клеток, они имеют некоторые различия. Блебы участвуют в экзоцитозе везикул, несущих металлопротеиназы, тогда как на поверхности пиноподий происходит экзоцитоз LIF (Leukemia Inhibitory Factor), что способствует имплантации. Таким образом, природа процесса ТЦМ и его роль в имплантации не до конца выяснены.
Исходя из полученных нами результатов, можно заключить, что клетки эпителия в ходе культивирования могут претерпевать “кадгериновое переключение”, что свойственно для проходящих ЭМП клеток. При этом клетки не теряют эпителиальные свойства, что отражается в поддержании экспрессии Krt8 на высоком уровне. Мы предполагаем, что эпителий в условиях 2D культуры может отчасти терять эпителиальный фенотип за счет измененной морфологии и поляризации клеток, перераспределения межклеточных соединений. Похожий результат был получен в 2D культуре клеток ретинального эпителия, который после первого пассажа приобретает черты мезенхимных клеток (Зурина, 2017; Tian et al., 2018). Вероятно, в условиях 2D культивирования эпителий эндометрия может проходить частичный ЭМП, при котором клетки могут приобретать мезенхимные маркеры без потери эпителиальных свойств (Nieto et al., 2016). Важно отметить, что влияние половых стероидных гормонов на изменение экспрессии генов-маркеров эпителия, мезенхимы и генов ЭМП не показано в нашей работе. Однако в исследовании на клетках аденокарциномы эндометрия человека были выявлены гормон-зависимые эффекты на культуру. Так, было выявлено, что клетки Ишикава в среде с обоими гормонами проходят “кадгериновое переключение”, формируют стресс-фибриллы актина, приобретают способность к миграции и начинают экспрессировать виментин (Uchida et al., 2012). Несмотря на то, что авторы работы приводят аналогии с процессами, происходящими перед инвазией, мы считаем, что поддержание клеток Ишикава в среде с эстрадиолом активирует ER-зависимый путь ЭМП, не связанный с имплантацией (Liu et al., 2016). Следовательно, клетки Ишикава могут реагировать на действие гормонов не как нативные клетки люминального эпителия эндометрия во время имплантации, а как опухолевые клетки эндометрия на стимулирующие ЭМП сигналы. Из этого можно заключить, что использование опухолевых клеток для исследования влияния гормонов на полярность эпителия эндометрия может привести к получению ложноположительного результата. Наша модель также имеет ограничения, так как условия культивирования могут нести преобладающий эффект на изменение поляризации клеток эпителия, чем гормональные воздействия. Для более точного изучения влияния половых гормонов на клетки эпителия эндометрия необходимо создание 3D систем культивирования, например, органоидов, где эпителиальные клетки сохраняют свою нативную морфологию в условиях, приближенных к in vivo (Luddi et al., 2020).
Уровень экспрессии рецепторов к эстрогену и прогестерону в культурах клеток эпителия и стромы эндометрия при различных гормональных режимах
Гормональная стимуляция мышей вызывала наступление фазы эструса, во время которой происходит оплодотворение и наступает беременность. Далее выделенные клетки содержались при гормональных режимах, в которых, помимо контрольной группы, клетки подвергались воздействию гормонов в концентрациях, соответствующих “окну имплантации” (Ye et al., 2012).
Уровень экспрессии Esr1 в клетках эпителия эндометрия снижался во всех экспериментальных группах со временем культивирования. При этом, гормон-зависимые отличия между экспериментальными группами клеток эпителия были заметны только на второй день культивирования и практически полностью нивелировались к 5 дню. В литературе также описано снижение чувствительности эпителия эндометрия к гормонам в 2D культуре (Olalekan et al., 2017). Мы предполагаем, что полученный результат может быть связан с необходимостью совместного культивирования эпителиальных клеток со стромой, так как ответ на гормональную стимуляцию в эндометрии in vivo во многом определяется взаимодействиями стромального и эпителиального компартментов.
Р4 ингибировал экспрессию Esr1 в клетках эпителия по сравнению с контролем уже на 2 сут культивирования (p = 0.028). Этот эффект сохранялся и к 5 сут (p = 0.023) (рис. 8). Наши результаты укладываются в концепцию того, что исходно высокий уровень Esr1 в эпителии снижается за счет гормонального воздействия, обусловленного увеличением секреции P4 перед имплантацией, что необходимо для снижения E2-зависимой пролиферации и снижения полярности клеток люминального эпителия (Zhang et al., 2013). Также мы показали, что процесс Р4-зависимого ингибирования экспрессии ER не зависел от стромы и происходил в эпителии, культивируемом отдельно от стромальных клеток.
Рис. 8.
Анализ экспрессии гена рецептора к эстрогену в культурах клеток эпителия и стромы, выделенных из эндометрия матки и культивируемых при разных гормональных режимах в течение 2 и 5 сут. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
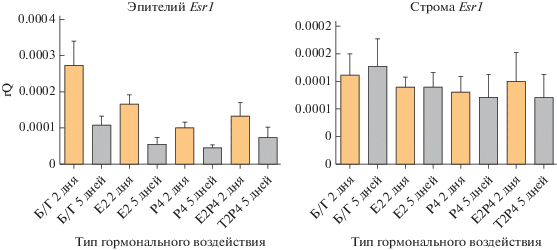
Экспрессия Esr1 в строме не изменялась со временем культивирования, также не было выявлено гормон-зависимых эффектов (рис. 8). По имеющимся данным, в начале беременности уровень экспрессии ER возрастает на 3–4 день в подэпителиальном регионе стромы, что предполагает влияние эпителия на этот процесс. Дальнейшие изменения уровня экспрессии ER в строме происходят на 5–7 сут и связаны с образованием первичной и вторичной децидуальных зон (Tan et al., 1999). С этим согласуются полученные нами результаты: в отсутствие в культуральной системе эпителия и без моделирования децидуализации стромы уровень Esr1 в ней закономерно не изменяется.
В работе, посвященной изучению зависимости экспрессии рецепторов к половым гормонам от стадий эстрального цикла, было показано, что интенсивность иммуногистохимической окраски ER была максимальной и в эпителии, и в строме во время диэструса и проэструса. Для этих стадий характерно высокое содержание Е2 в сыворотке крови (Mote et al., 2006). Мы не обнаружили прямой связи между воздействием Е2 и повышением уровня экспрессии Esr1 в эпителии и строме. Однако стоит учитывать, что в этой работе уровень экспрессии рецепторов оценивали при помощи иммуногистохимических методов, которые не являются оптимальными для точной оценки уровня экспрессии ядерных рецепторов. Измерения проводили с интервалами 12–24 часа, эстральный цикл мыши нерегулярен и длится 4–5 дней, поэтому для измерения уровня экспрессии рецепторов желательны более короткие интервалы между измерениями.
В строме как на 2, так и на 5 сут, уровень экспрессии Pgr был значительно выше, чем в эпителии (p < 0.05). Это ожидаемый результат, так как строма эндометрия в большей степени является Р4 зависимой тканью, чем эпителий.
И в эпителии, и в строме экспрессия Pgr имела схожую динамику. На 2 сут уровень экспрессии Pgr не изменялся вне зависимости от режима гормонального воздействия. На пятые сутки экспрессия Pgr возрастала, как в эпителии (p < 0.01), так и в строме (p < 0.01).
Для мыши было показано, что Pgr экспрессировался в ЛЭ в околоимплантационные сроки, уровень его экспрессии снижался с началом децидуализации стромы. При этом сигнальный путь, индуцируемый Р4 через PR был необходим для прохождения имплантации. На этапе, когда децидуальная зона была сформирована, экспрессия PR в эпителии уже не детектировалась. В то же время у псевдобеременных мышей снижение уровня экспрессии PR в эпителии проходило только, если искусственно была индуцирована децидуальная реакция. Таким образом, прекращение экспрессии PR в эпителии эндометрия регулируется локальными факторами, продуцируемыми в матке, а также за счет молекулярного диалога между стромальным и эпителиальным компартментами (Honglu et al., 2012). Этот факт согласуется с нашими результатами: в изолированном в культуре и разобщенном с децидуализирующейся стромой ЛЭ не происходило снижение уровня экспрессии PR, которое in vivo обусловлено взаимодействием со стромой.
В работе, посвященной изучению экспрессии рецепторов к половым гормонам на протяжении стадий эстрального цикла, показали, что в строме интенсивность окраски обеих изоформ PR изменялась в течение эстрального цикла с пиком интенсивности в раннем проэструсе и эструсе, что соотвествует максимальной секреции Е2 (Mote et al., 2006). В позднем проэструсе интенсивность окраски была минимальной, а концентрация P4 в плазме крови максимальной (Mote et al., 2006).
Несмотря на то, что статистически значимых отличий выявлено не было, мы также обнаружили тенденцию к тому, что Р4 в большей степени, чем другие гормональные режимы, ингибирует рост уровня экспрессии PR к 5 сут в обеих культурах (рис. 9).
Рис. 9.
Анализ экспрессии гена рецептора к прогестерону в культурах клеток эпителия и стромы, выделенных из эндометрия матки и культивируемых при разных гормональных режимах в течение 2 и 5 сут. Уровень экспрессии нормализован на экспрессию референсного гена ActinB.
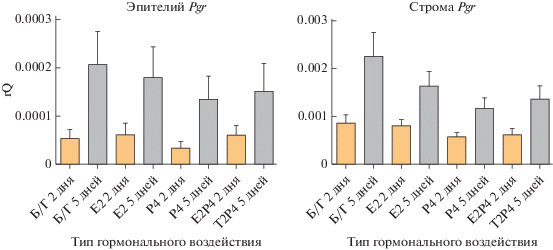
В другом исследовании подтверждается результат работы Мота с соавторами, полученный уже при изучении матки мыши в начале беременности. В околоимплантационный период фолликулярный Е2 обеспечивал подготовку клеток стромы к децидуализации и активировал экспрессию PRs в эндометрии (Zhang et al., 2013). Мы не наблюдали такого эффекта. В группе Е2 не происходило роста уровня экспрессии рецепторов на 5 день, превышающего рост в контрольной группе без добавления гормонов. Этот результат может объясняться тем, что Е2-зависимый рост PR в клетках стромы in vivo обусловлен взаимодействием с эпителием. Возможно также в среде не хватало других про-децидуальных факторов, необходимых для увеличения уровня экспрессии PR в строме.
ЗАКЛЮЧЕНИЕ
Суммируя полученные результаты и проведенный анализ литературы, можно заключить, что контроль экспрессии рецепторов к половым гормонам в большинстве случаев не сводится к простой положительной или отрицательной обратной связи между гормональным сигналом и изменением уровня экспрессии его рецептора. Не все результаты объясняются также и влиянием E2 на экспрессию PR и Р4 на экспрессию ЕR. Почти точно можно заключить, что молекулярный диалог между эпителием и стромой эндометрия играет роль в регуляции экспрессии ЕR и PR (Honglu et al., 2012). Также на это влияют и другие факторы: сигналы, поступающие от эмбриона, децидуализация стромы. Показано, что различается регуляция экспрессии разных изоформ рецепторов (Mote et al., 2006).
Решение этого уравнения со множеством неизвестных необходимо для разработки адекватных моделей имплантации и для разработки терапевтических подходов для заболеваний, ассоциированных с бесплодием. Затрудняет работу в этом направлении то, что часть более ранних результатов получена с использованием устаревших методов и может считаться достоверной лишь отчасти (Tan et al., 1999; Mote et al., 2006). Наши результаты в целом согласуются с полученными ранее. Однако, они ясно показывают необходимость экспериментов, в которых гормональное влияние будет изучаться на системах с сокультивированием эпителия и стромы. Также расширить понимание вопроса может помочь применение методов секвенирования для оценки изменений транскриптома, вызванных гормональной стимуляцией. Кроме того, более достоверные данные могут быть получены путем анализа 3D культуральных систем, в которых клетки находились бы в более привычных им условиях.
Результаты по изучению полярности клеток эпителия эндометрия также говорят в пользу применения системы 3D культивирования для более точной оценки влияния гормонов на ТЦМ. При этом для исследования подвижности клеток возможно применение 2D моделей ввиду выраженного ответа эпителиальных клеток на гормональное воздействие. В дополнение к этому, для исследования механизмов ТЦМ необходимо использовать нативные клетки эпителия эндометрия, но не опухолевые клетки, для которых свойственен ЭМП.
Список литературы
Зурина И.М. Сравнительное исследование эпителио-мезенхимной пластичности соматических клеток человека в условиях 3D культивирования: Автореф. дис. ... канд. биол. наук. М.: Ин-т общей патологии и патофизиологии, 2017. 176 с.
Aguilera-Castrejon A., Oldak B., Shani T. et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis // Nature. 2021. V. 593. P. 119–124.
Bedzhov I., Leung C.Y., Bialecka M., Zernicka-Goetz M. In vitro culture of mouse blastocysts beyond the implantation stages // Nat. Protoc. 2014. V. 9. № 12. P. 2732–2739.
Chávez D.J., Anderson T.L. The Glycocalyx of the mouse uterine luminal epithelium during estrus, early pregnancy, the peri-implantation period, and delayed implantation. acquisition of ricinus communis binding sites during pregnancy // Biol. Reprod. 1985. V. 32. № 1135. P. 42.
Clercq K. De, Hennes A., Vriens J. Isolation of mouse endometrial epithelial and stromal cells for in vitro decidualization // J. Vis. Exp. 2017. V. 2017. № 121. P. 1–10.
Du F., Yang R., Ma H.L. et al. Expression of transcriptional repressor SNAI2 gene in mouse endometrium and its effect during embryo implantation // Appl. Biochem. Biotechnol. 2009. V. 157. P. 346–355.
Gou J., Hu T., Li L. et al. Role of epithelial-mesenchymal transition regulated by twist basic helix-loop-helix transcription factor 2 (Twist2) in embryo implantation in mice // Reprod. Fertil. Dev. 2019. V. 31. № 5. P. 932–940.
Hamidi H., Lilja J., Ivaska J. Using xCELLigence RTCA Instrument to Measure Cell Adhesion // Bio-Protocol. 2017. V. 7. № 24. P. 1–17
Hantak A.M., Bagchi I.C., Bagchi M.K. Role of uterine stromal-epithelial crosstalk in embryo implantation // Int. J. Dev. Biol. 2014. V. 58. № 2–4. P. 139–146.
Honglu D., Paria B.C., Xiao S. et al. Temporal expression pattern of progesterone receptor in the uterine luminal epithelium suggests its requirement during early events of implantation // Bone. 2012. V. 23. № 1. P. 1–7.
Illingworth I.M., Kiszka I., Bagley S. et al. Desmosomes are reduced in the mouse uterine luminal epithelium during the preimplantation period of pregnancy: a mechanism for facilitation of implantation // Biol. Reprod. 2000. V. 63. P. 1764–1773.
Kallen A.N., Haines K., Taylor H.S. HOXA10 regulates expression of cytokeratin 15 in endometrial epithelial cytoskeletal remodeling // Reprod. Sci. 2014. V. 21. № 7. P. 892–897.
Kaneko Y., Day M.L., Murphy C.R. Integrin β3 in rat blastocysts and epithelial cells is essential for implantation in vitro: Studies with Ishikawa cells and small interfering RNA transfection // Hum. Reprod. 2011. V. 26. № 7. P. 1665–1674.
Kaneko Y., Lecce L., Day M.L. et al. B1 and B3 integrins disassemble from basal focal adhesions and b3 integrin is later localised to the apical plasma membrane of rat uterine luminal epithelial cells at the time of implantation // Reprod. Fertil. Dev. 2011. V. 23. № 3. P. 481–495.
Kubaczka C., Senner C., Araúzo-Bravo M.J. et al. Derivation and maintenance of murine trophoblast stem cells under defined conditions // Stem Cell Reports. 2014. V. 2. № 2. P. 232–242.
Lamouille S., Xu J., Derynck R. Molecular mechanisms of epithelial-mesenchymal transition // Nat. Rev. Mol. Cell Biol. 2014. V. 15. № 3. P. 178–196.
Lin P. F., Lan X.Li., Chen F.L. et al. Reference gene selection for real-time quantitative PCR analysis of the mouse uterus in the peri-implantation period // PLoS One. 2013. V. 8. № 4. P. 4–11.
Liu, Z., Qi, S., Zhao, X. et al. Metformin inhibits 17β-estradiol-induced epithelial-to-mesenchymal transition via βKlotho-related ERK1/2 signaling and AMPKα signaling in endometrial adenocarcinoma cells // Oncotarget. 2016. V. 7. № 16. P. 21315–21331.
Luddi A., Pavone V., Semplici B. et al. Organoids of human endometrium: A powerful in vitro model for the endometrium-embryo cross-talk at the implantation site // Cells. 2020. V. 9. № 5. P. 1121.
Mote P.A., Arnett-Mansfield R.L., Gava N. et al. Overlapping and distinct expression of progesterone receptors A and B in mouse uterus and mammary gland during the estrous cycle // Endocrinology. 2006. V. 147. № 12. P. 5503–5512.
Nieto M.A., Huang R.Y.J., Jackson R.A. et al. // Cell. 2016. V. 166. № 1. P. 21–45.
Olalekan S.A., Burdette J.E., Getsios S. et al. Development of a novel human recellularized endometrium that responds to a 28-day hormone treatment // Biol. Reprod. 2017. V. 96. № 5. P. 971–981.
Quinn C.E., Matson B.C., Wetendorf M. et al. Pinopodes: Recent advancements, current perspectives, and future directions // Mol. Cell Endocrinol. 2019. V. 5. P. 501. P. 110644.
Shakya S., Asosingh K., Mack J.A. et al. Optimized protocol for the preparation of single cells from cutaneous wounds for flow cytometric cell sorting and analysis of macrophages // Methods. X. 2020. V. 7. P. 101027.
Tan J., Paria B.C., Dey S.K. et al. Differential uterine expression of estrogen and progesterone receptors correlates with uterine preparation for implantation and decidualization in the mouse // Endocrinology. 1999. V. 140. № 11. P. 5310–5321.
Tian H., Xu J.Y., Tian Y. et al. A cell culture condition that induces the mesenchymal-epithelial transition of dedifferentiated porcine retinal pigment epithelial cells // Experimental Eye Research. 2018. V. 177. P. 160–172.
Uchida H., Maruyama T., Oda H. Studies using an in vitro model show evidence of involvement of epithelial-mesenchymal transition of human endometrial epithelial cells in human embryo implantation // J. Biol. Chem. 2012. V. 287. P. 4441–4450.
Vasquez Y.M., DeMayo F.J. Role of nuclear receptors in blastocyst implantation // Semin. Cell Dev. Biol. 2013. V. 24. № 10–12. P. 724–735.
Wang H., Dey S.K. Roadmap to embryo implantation: Clues from mouse models // Nat. Rev. Genet. 2006. V. 7. № 3. P. 185–199.
Whitby S., Zhou W., Dimitriadis E. Alterations in epithelial cell polarity during endometrial receptivity: A systematic review // Front. Endocrinol. (Lausanne). 2020. V. 11. P. 1–14.
Wilcox A.J., Weinberg C.R., O’Connor J.F. et al. Incidence of early loss of pregnancy // N. Engl. J. Med. 1988. V. 319. № 4. P. 189–194.
Ye T.M., Pang R.T.K., Leung C.O.N. et al. Development and characterization of an endometrial tissue culture model for study of early implantation events // Fertil. Steril. 2012. V. 98. № 6. P. 1581–1589.
Ye X. Uterine luminal epithelium as the transient gateway for embryo implantation // Trends Endocrinol. Metab. 2020. V. 31. № 2. P. 165–180.
Zhang S., Lin H., Kong S. et al. Physiological and molecular determinants of embryo implantation // Mol. Aspects Med. 2013. V. 34. № 5. P. 939–980.
Дополнительные материалы отсутствуют.