Онтогенез, 2021, T. 52, № 6, стр. 467-475
Гипотеза об эндокринной системе мозга: доказательства регулируемого поступления нейрогормонов из мозга в ликвор и обратно у крыс в неонатальном и препубертатном периодах онтогенеза
А. Р. Муртазина a, Т. С. Пронина a, К. И. Чандран a, Л. К. Дильмухаметова a, Н. С. Бондаренко a, В. Е. Блохин a, В. В. Богданов a, М. В. Угрюмов a, *
a Федеральное государственное бюджетное учреждение науки Институт биологии развития
им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: michael.ugrumov@mail.ru
Поступила в редакцию 16.06.2021
После доработки 21.07.2021
Принята к публикации 26.07.2021
Аннотация
Накопленная в последние несколько десятилетий обширная информация о важной роли ликвора во многих физиологических процессах в норме и при патологии позволила авторам статьи сформулировать гипотезу о том, что мозг обладает собственной эндокринной системой, представленной: (а) нейронами мозга, секретирующими нейрогормоны в желудочки, (б) ликвором – гуморальной средой, обеспечивающей доставку нейрогормонов в отделы мозга – мишени и (в) нейронами перивентрикулярной области мозга – мишенями для содержащихся в ликворе нейрогормонов. Согласно этой гипотезе, функциональное значение эндокринной системы мозга в онтогенезе смещается от регуляции развития нейронов и мозга в перинатальном периоде к участию в объемной нейротрансмиссии у взрослых животных. Данная работа направлена на проверку этой гипотезы. Так, у неонатальных (5-й день жизни) и взрослых (30-й день жизни) крыс показано, что вещества, содержащиеся в ликворе, участвуют в регуляции секреции моноаминов нейронами мозга в ликвор. Эти данные были получены при перфузии желудочков мозга искусственным ликвором с повышенным содержанием K+. Однако стимуляция секреции моноаминов была обнаружена не у всех животных в пределах каждой возрастной группы, что объясняется индивидуальными и возрастными особенностями проницаемости ликвор-энцефалического барьера. Действительно, перфузия срезов мозга в среде с повышенным содержанием K+, т.е в отсутствие ликвор-энцефалического барьера, неизменно приводила к стимуляции секреции моноаминов у всех животных в обеих возрастных группах. Вторым аргументом в пользу правомочности нашей гипотезы была демонстрация захвата веществ из ликвора в моноаминергические нейроны мозга, которые рассматриваются как потенциальные мишени для эндокринных факторов ликвора. Доказательства этого были получены при введении в желудочки мозга 4-[4-(диметиламино)стирил]-N-метилпиридиниум иодида, обладающего высоким сродством к транспортерам моноаминов. Этот маркер после внутрижелудочкового введения включался в нейроны перивентрикулярной области мозга. Таким образом, получены доказательства того, что вещества, содержащиеся в ликворе у неонатальных и взрослых крыс, участвуют в регуляции секреции моноаминов в желудочки мозга, а моноамины, содержащиеся в ликворе, поступают в мозг и захватываются потенциальными нейронами-мишенями.
ВВЕДЕНИЕ
В течение многих лет в нейробиологии и неврологии активно обсуждается вопрос о роли ликвора как гуморальной среды в регуляции функционирования мозга и целостного организма. Так, с начала 80-х годов в литературе получены данные, свидетельствующие о том, что: (а) в желудочки мозга прорастают отростки нейронов, (б) в ликвор из мозга поступают физиологически активные вещества – классические нейротрансмиттеры и нейропептиды, (в) физиологически активные вещества, содержащиеся в ликворе, способны влиять на функциональную активность нейронов мозга и участвовать в эндокринных регуляциях у взрослых животных, (г) физиологически активные вещества, содержащиеся в ликворе, способны влиять на развитие нейронов и мозга в целом в онтогенезе (Ugrumov, Mitskevich, 1980, 1981; Black, 1982; Ugrumov et al., 1985; Ugrumov, 1991; Sakka et al., 2011; Bjorefeldt et al., 2018; Ghersi-Egea et al., 2018; Jalavand et al., 2018; Bothwell et al., 2019; Gato et al., 2019; Shapey et al., 2019). Несмотря на то, что накоплено обилие данных по указанной проблеме, они в каждой работе носят фрагментарный характер и получены на разных объектах с помощью разных методических подходов.
Настало время для обобщения приведенных выше данных и их представления в виде концепции аутоэндокринной регуляции функционирования мозга на различных этапах онтогенеза, которая должна пройти последовательную экспериментальную проверку на одной и той же модели. В этом контексте данная работа посвящена продолжению проверки нашей гипотезы о том, что мозг имеет собственную эндокринную систему, включающую три взаимосвязанных структурно-функциональных блока: нейроны мозга, секретирующие нейрогормоны в желудочки мозга, ликвор – гуморальная среда, обеспечивающая депонирование нейрогормонов и транспорт вдоль желудочков мозга в рострокаудальном направлении, и нейроны, расположенные в перивентрикулярной области мозга – мишени для нейрогормонов, содержащихся в ликворе (Муртазина и др., 2021). В рамках этой гипотезы подчеркивается, что роль эндокринной системы мозга качественно меняется в онтогенезе – от участия в регуляции развития нейронов и мозга в целом в перинатальном периоде до “объемной нейротрансмиссии” у взрослых животных, т.е. нейромодуляторном действии на рецепторы, распределенные по мембране всего нейрона, а не только в области синапсов (Fuxe, Borroto-Escuela, 2016). Важно отметить, что при системной оценке функционального значения эндокринной системы мозга следует иметь в виду, что она не полностью автономна, а сообщается с общей эндокринной и нейроэндокринной системой, в основном в области хориоидного сплетения в боковых желудочках мозга и в “циркумвентрикулярных органах” мозга (Bueno et al., 2019).
В нашей предыдущей (Муртазина и др., 2021) и в этой работе в качестве маркеров эндокринной функции мозга по ряду причин были выбраны моноамины. Во-первых, моноамины – в основном дофамин, норадреналин и серотонин, широко распространены по мозгу, участвуя у взрослых животных в синаптической и объемной нейротрансмиссии, а в перинатальном периоде в регуляции развития нейронов и мозга в целом (Ugrumov, 1997; Gaspar et al., 2003; Fuxe, Borroto-Escuela, 2016). Во-вторых, в предыдущих работах показано, что моноаминергические нейроны проецируют аксоны в желудочки мозга, а в ликворе выявляются моноамины и их метаболиты (Ugrumov et al., 1985; Shaywitz et al., 1985).
В нашей предыдущей работе, посвященной проверке гипотезе о том, что мозг имеет собственную эндокринную систему, показано, что: (1) в ликворе у взрослых крыс и в перинатальном периоде содержатся наиболее функционально значимые моноамины – дофамин, норадреналин и серотонин, (2) моноамины, содержащиеся в ликворе, имеют нейрональное (мозговое) происхождение, а не поступают из общей системы циркуляции, (3) моноамины содержатся в ликворе в физиологически активной концентрации, в которой они способны участвовать в регуляции развития нейронов в перинатальном периоде, а у взрослых животных – в объемной нейротрансмиссии (Муртазина и др., 2021).
Целью данной работы явилось получение дополнительных доказательств гипотезы о существовании эндокринной системы мозга. В рамках первой задачи предполагалось проверить, могут ли изменения в составе ликвора приводить к изменению поступления нейротрансмиттеров (моноаминов) из мозга в ликвор. В качестве такого рода неспецифического регулятора предполагалось использовать повышенное содержание K+ в ликворе и в межклеточной среде в мозге, имитирующее деполяризацию мембраны и, таким образом, стимулирующее выделение нейротрансмиттеров экзоцитозом (Ait Ouares et al., 2019). В рамках второй задачи предполагалось получить доказательство того, что циркулирующие в ликворе физиологически активные вещества (моноамины) поступают в мозг и захватываются нейронами, что является необходимым условием для их эндокринной регуляции.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования
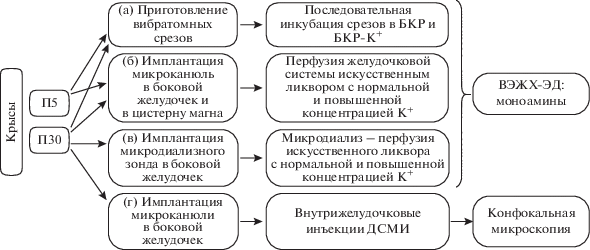
В работе использованы крысы Вистар – самцы на 5-й постнатальный день (П5) и на П30 (рис. 1). Для получения датированного потомства были использованы беременные самки Вистар весом 250–350 г. Животных содержали в стандартных условиях вивария при свободном доступе к пище и воде и 12-ти часовом режиме день-ночь. Манипуляции с животными проводили под наркозом. В одних опытах использовали хлоралгидрат (Sigma, США) в дозе 100 мг/кг на П5 и в дозе 400 мг/кг на П30, а в других 1% изофлуран (Laboratorios Karizoo, Испания).
Рис. 1.
Схема экспериментов на крысах: (а) определение влияния повышенного содержания K+ в буфере Кребса-Рингера (БКР) на выделение моноаминов из срезов мозга на П5 и П30, (б) определение влияния повышенного содержания K+ в искусственном ликворе на поступление моноаминов из мозга в желудочковую систему на П5 и П30, (в) микродиализное определение влияния повышенного содержания K+ в ликворе на состав моноаминов в боковых желудочках мозга на П30, (г) оценка поступления из желудочков мозга в клетки мозга 4-[4-(диметиламино)стирил]-N-метилпиридиниум иодида (ДСМИ). ВЭЖХ-ЭД, высокоэффективная жидкостная хроматография с электрохимической детекцией; П, постнатальный день.
Приготовление и инкубация перфузией срезов мозга
Крыс на П5 (n = 8) и П30 (n = 4) наркотизировали изофлураном, декапитировали и выделяли мозг (рис. 1). Затем на вибратоме (Vibratome 1000 plus, Sectioning System, Германия) в буфере Кребса-Рингера (БКР) (мМ: NaCl 120, KCl 4.8, CaCl2 2, MgSO4 1.3, NaHCO3 25, d-глюкоза 10, HEPES 20, аскорбиновая кислота 0.1, pH 7.4) при 4°С приготавливали серийные фронтальные срезы мозга толщиной, в зависимости от возраста животного, от 300 до 600 мкм. В качестве ориентиров на вентральной поверхности мозга использовали оптическую хиазму – рострально, и стебель гипофиза – каудально.
Из полученных вибратомных срезов вырезали перивентрикулярную область гипоталамуса. На П5 в качестве одной пробы (образца) для инкубации использовали срезы от одного животного. На П30 вибратомные срезы разрезали по 3-му желудочку и в качестве каждой пробы использовали половинки срезов от одного животного. Пробы инкубировали в проточных термостатируемых камерах объемом 400 мкл при 37°C со скоростью 100 мкл/мин. В течение первых 40 минут срезы инкубировали (стабилизировали) в БКР, а затем последовательно по 30 минут в БКР и в БКР с повышенным содержанием K+ (мМ: NaCl 68.8, KCl 56, CaCl2 2, MgSO4 1.3, NaHCO3 25, d-глюкоза 10, HEPES 20, аскорбиновая кислота 0.1, pH 7.4). В течение последнего часа собирали 10-минутные фракции. После окончания инкубации срезов в отобранные фракции инкубационной среды добавляли по 100 мкл 1 М HClO4 и по 2 пмоль/мл 3,4-дигидроксибензиламина (ДГБА) в качестве внутреннего стандарта для высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ-ЭД). Полученные образцы замораживали в жидком азоте и хранили при ‒70°C до определения моноаминов – дофамина, норадреналина и серотонина методом ВЭЖХ-ЭД.
Перфузия желудочков мозга
Крыс (рис. 1) на П5 (n = 8) и П30 (n = 9) наркотизировали хлоралгидратом, голову фиксировали в стереотаксической установке (Narishige Lab, Япония) и высверливали отверстие в черепе над боковыми желудочками по следующим координатам: на П5 – 1.2 мм латеральнее брегмы и каудально – на уровне брегмы, а на П30 – 1.4 мм латеральнее брегмы и на 0.4 мм каудальнее брегмы. После этого в мозг вводили стеклянную микроканюлю на П5 на глубину 2.5 мм, а на П30 на глубину 3 мм. Вторую микроканюлю вводили в цистерну магна через атланто-затылочную соединительнотканную мембрану для обеспечения пассивного оттока ликвора. Через первую микроканюлю, соединенную с гамильтоновским шприцом, перфузировали желудочки мозга с постоянной скоростью – 5 мкл/мин на П5 и 10 мкл/мин на П30 с помощью микронасоса CMA 4004 (CMA, Швеция). Первые 20 минут желудочки мозга перфузировали искусственным ликвором (126 мМ NaCl, 26 мМ NaHCO3, 3 мМ KCl, 1.2 мМ NaH2PO4, 2.4 мМ CaCl2, 1.2 мМ MgCl2, 10 мМ d-глюкоза), а последующие 20 мин – искусственным ликвором с повышенным содержанием K+ (73 мМ NaCl, 26 мМ NaHCO3, 56 мМ KCl, 1.2 мМ NaH2PO4, 2.4 мМ CaCl2, 1.2 мМ MgCl2, 10 мМ d-глюкоза). В процессе перфузии собирали 10-минутные фракции в пробирки, содержащие 0.1 М НClO4 и 25 пмоль/мл ДГБА. Полученные перфузаты замораживали в жидком азоте и хранили при –70°С до определения моноаминов с помощью ВЭЖХ-ЭД.
Микродиализ ликвора в боковых желудочках мозга на П30
Помимо перфузии через всю желудочковую систему мозга, у крыс на П30 (n = 4) проводили микродиализ в боковых желудочках (рис. 1). Для этого крысам под наркозом хлоралгидратом в боковой желудочек мозга вводили направляющую канюлю для микродиализного зонда (CMA-11 Guide Cannula, CMA, Швеция). Канюлю фиксировали на кости черепа с помощью микроболтов и стоматологического полимера (Протакрил-М, Украина). Через 48 ч в направляющую канюлю вводили микродиализный зонд (CMA 11 55 kDa Microdialysis Probe, CMA, Швеция), заполненный искусственным ликвором. Зонд с помощью силиконовых трубочек подсоединяли к насосу CMA 4004 (CMA, Швеция). Через 3 ч после введения зонда боковые желудочки перфузировали со скоростью 2 мкл/мин сначала 60 мин искусственным ликвором, а затем 60 мин искусственным ликвором с повышенным содержанием K+, собирая в обоих случаях 20-минутные фракции. К полученным диализатам добавляли 4 мкл 1 М НClO4, замораживали в жидком азоте и хранили при –70°С до определения моноаминов и в ряде случаев продуктов их деградации на ВЭЖХ-ЭД.
Внутрижелудочковое введение 4-[4-(диметиламино)стирил]-N- метилпиридиниум иодида
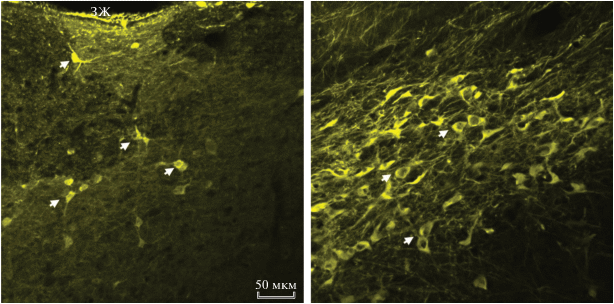
В один из боковых желудочков мозга у крыс на П30 (n = 4) под наркозом хлоралгидрата имплантировали стеклянную микроканюлю, заполненную БКР с 4-[4-(диметиламино)стирил]-N-метилпиридиниум иодид (ДСМИ) (Sigma, США) в конечной концентрации 10 мкМ (рис. 1). Далее 10 мкл этого раствора вводили с помощью гамильтоновского шприца со скоростью 2 мкл/мин. Через 30 мин после окончания инъекции приготавливали вибратомные срезы диэнцефалона толщиной 150 мкм, которые анализировали в конфокальном микроскопе Leica TCS SP5 или LSM 880 Airyscan (Leica, Германия).
РЕЗУЛЬТАТЫ
Концентрация моноаминов в перфузате при проточной инкубации срезов мозга БКР с обычным и повышенным содержанием K+
При проточной инкубации срезов, полученных у крыс на П5 и П30, с БКР дофамин определяется только на П30 (рис. 2). При последующей инкубации этих же срезов в БКР с повышенным содержанием K+ дофамин определяется на П5, а на П30 его концентрация достоверно возрастает по сравнению с контролем (обычный БКР).
Рис. 2.
Концентрация моноаминов в перфузате при проточной инкубации срезов мозга крыс на 5-й постнатальный день (П5) и П30 сначала буфером Кребс-Рингера (БКР), а затем БКР с повышенным содержанием K+ (БКР + К). * P < 0.05, при сравнении групп инкубированных в БКР с повышенным содержанием K+ и БКР. ДА, дофамин; НА, норадреналин; нд, не детектируется.
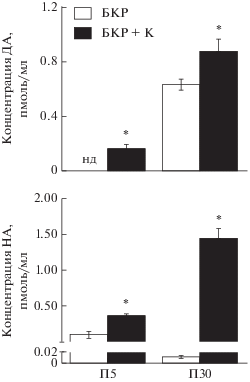
При проточной инкубации срезов, полученных у крыс на П5 и П30, с БКР норадреналин определяется как на П5, так и на П30. При последующей инкубации этих же срезов в БКР с повышенным содержанием K+ концентрация норадреналина достоверно возрастает на П5 и П30.
Концентрация моноаминов в перфузате при перфузии желудочковой системы мозга искусственным ликвором с обычным и повышенным содержанием K+
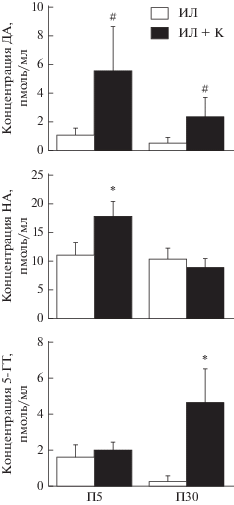
У крыс на П5 и П30 обнаружена отчетливая тенденция (П5: р = 0.066; П30: р = 0.067) к увеличению концентрации дофамина в ликворе с повышенным содержанием K+ по сравнению с его концентрацией при перфузии желудочков мозга обычным искусственным ликвором (рис. 3). Более того, перфузия желудочковой системы мозга ликвором с повышенным содержанием K+ приводила к достоверному увеличению концентрации норадреналина на П5 и серотонина на П30. Однако при таком же воздействии отсутствовало достоверное повышение концентрации норадреналина у крыс на П30 и серотонина у крыс на П5 (рис. 3). Это объясняется тем, что при перфузии желудочков мозга искусственным ликвором с повышенным содержанием K+ в отдельных возрастных группах не у всех животных повышалась концентрация упомянутых моноаминов. Так, например, при перфузии искусственным ликвором с повышенным содержанием K+ на П30 у 6-ти животных концентрация норадреналина была повышена в 1.35 раза, а у остальных трех животных изменения концентрации норадреналина не было обнаружено.
Рис. 3.
Концентрация моноаминов в искусственном ликворе (ИЛ) и в искусственном ликворе с повышенным содержанием K+ (ИЛ + К) в процессе перфузии этими растворами желудочковой системы мозга у крыс на 5-й постнатальный день (П5) и П30. * P < 0.05, при сравнении групп инкубированных в ИЛ с повышенным содержанием K+ и ИЛ; #0.5 < P < 0.1, при сравнении групп, инкубированных в ИЛ с повышенным содержанием K+ и в ИЛ. 5-ГТ, 5-гидрокситриптамин (серотонин); ДА, дофамин; НА, норадреналин.
Состав моноаминов в ликворе боковых желудочков мозга при микродиализной перфузии искусственным ликвором с обычным и повышенным содержанием K+
У всех четырех крыс, которым на П30 проводили микродиализную перфузию боковых желудочков искусственным ликвором, в диализате определялись только продукты деградации моноаминов, 3,4-дигидроксифенилуксусная кислота – продукт деградации дофамина, и 5-гидроксииндолуксусная кислота – продукт деградации серотонина. При микродиализной перфузии искусственным ликвором с повышенным содержанием калия у двух животных из четырех в диализате дополнительно определялся дофамин, а у одного из этих животных еще и адреналин.
Включение 4-[4-(диметиламино)стирил]-N-метилпиридиниум иодида, введенного в желудочки мозга крысам на П30, в нейроны перивентрикулярной области диэнцефалона
После введения ДСМИ в БКР (10 мкМ) в течение 5 мин в боковые желудочки мозга крысам на П30 наблюдается избирательное окрашивание би- и мультиполярных нейронов – тел нейронов и их отростков, содержащихся в основном в перивентрикулярной области мозга (рис. 4). Одни нейроны мозаично рассредоточены по нервной ткани, а другие – образуют ядерные скопления.
ОБСУЖДЕНИЕ
Данная работа является вторым исследованием, посвященном проверке нашей гипотезы о том, что мозг имеет собственную эндокринную систему, представленную: (а) нейронами мозга, секретирующими нейрогормоны в желудочки мозга, (б) ликвором – гуморальной средой, обеспечивающей доставку нейрогормонов в отделы мозга – мишени и (в) нейронами перивентрикулярной области мозга – мишенями для содержащихся в ликворе физиологически активных веществ. Более того, согласно этой гипотезе, функциональное значение эндокринной системы мозга в онтогенезе смещается от регуляции развития нейронов и мозга в перинатальном периоде к участию в объемной нейротрансмиссии у взрослых животных (Муртазина и др., 2021).
После того, как в первой работе было показано, что в ликворе у неонатальных крыс (П5) – в период морфогенеза, и у крыс в препубертатном периоде (П30) – после окончания морфогенеза, содержатся моноамины, причем в физиологически активной концентрации (Муртазина и др., 2021), встал вопрос, является ли поступление нейрогормонов из мозга в ликвор процессом, регулируемым веществами, входящими в состав ликвора. Для того, чтобы прояснить этот вопрос, в данной работе была проведена перфузия всей желудочковой системы мозга, а также локальная микродиализная перфузия в боковых желудочках сначала искусственным ликвором, а затем искусственным ликвором с повышенным содержанием K+. Ожидалось, что перфузия желудочков мозга искусственным ликвором с повышенным содержанием K+ стимулирует выделение экзоцитозом моноаминов из моноаминергических нейронов мозга и усилит поступление моноаминов в ликвор. Однако по результатам проведенных экспериментов картина оказалась не такой однородной. Так, при перфузии желудочковой системы мозга на П5 и П30 искусственным ликвором с повышенным содержанием K+ у одних животных в пределах одной и той же возрастной группы наблюдалось ожидаемое достоверное повышение концентрации моноаминов в перфузате, а у других – нет. Поэтому, в зависимости от соотношения животных с различной реакцией на калиевую стимуляцию, в каждой возрастной группе в оттекающем ликворе наблюдалось либо достоверное увеличение концентрации моноаминов (норадреналин на П5, серотонин на П30), либо тенденция к увеличению концентрации моноаминов (дофамин на П5 и П30), либо отсутствие изменений в концентрации моноаминов (норадреналин на П30, серотонин на П5). Одним из объяснений этих различий могут быть возрастные и индивидуальные особенности в проницаемости ликвор-энцефалического барьера, основным структурно-функциональным звеном которого является слой эпендимных клеток. Хотя этот вопрос крайне мало изучен, имеются доказательства того, что ликвор-энцефалический барьер избирательно проницаем, причем его проницаемость существенно изменяется в онтогенезе (Saunders, 2013; Shapey et al., 2019).
Дополнительные опыты с микродиализом ликвора в боковых желудочках у крыс на П30 были проведены для того, чтобы проверить поступают ли моноамины из мозга или из сосудов хориоидного сплетения в ликвор в самой ростральной области желудочковой системы мозга – на начальном этапе образования ликвора. На этот вопрос был получен отрицательный ответ – при перфузии боковых желудочков искусственным ликвором моноамины в перфузате не были обнаружены. Однако при микродиализной перфузии искусственного ликвора с повышенным содержанием калия в перфузате у двух животных из четырех были обнаружены моноамины – дофамин и адреналин. Из сопоставления данных, полученных при перфузии всей желудочковой системы мозга и только боковых желудочков, следует, что моноамины поступают из мозга в ликвор в более каудальных отделах по отношению к боковым желудочкам.
Для того, чтобы понять, действительно ли в ряде наших экспериментов ликвор-энцефалический барьер препятствует поступлению искусственного ликвора с повышенным содержанием K+ из желудочков в мозг, было изучено влияние инкубационной среды (БКР) с повышенным содержанием K+ на выделение моноаминов из срезов перивентрикулярной области мозга, полученных у крыс в тех же возрастных группах (П5 и П30). Такой сравнительный подход in vivo и in vitro к оценке проницаемости ликвор-энцефалического барьера был успешно использован ранее (Bjorefeldt et al., 2018). По нашим данным, воздействие на срезы БКР с повышенной концентрацией K+ – в отсутствие ликвор-энцефалического барьера, стимулировало выделение дофамина и норадреналина из срезов мозга в обеих возрастных группах. В этих же экспериментах в инкубационной среде ни в опыте, ни в контроле не определялся серотонин, что, очевидно, объясняется гораздо более низкой плотностью иннервации гипоталамуса серотонинергическими нервными волокнами по сравнению с дофаминергическими и норадренергичскими.
Полученные данные о калий-стимулированном выделении катехоламинов из срезов гипоталамуса подтверждают наше предположение о том, что наблюдаемые индивидуальные и возрастные различия в изменении концентрации моноаминов в перфузате при перфузии желудочков мозга искусственным ликворов с повышенным содержанием К+ объясняются индивидуальными и возрастными особенностями проницаемости ликвор-энцефалического барьера.
Второй задачей данной работы было получение доказательств того, что содержащиеся в ликворе вещества могут поступать в мозг и захватываться нейронами. Для доказательства такого транспорта в качестве маркера был использован ДСМИ – лиганд многих клеточных транспортеров, который, однако, имеет особенно высокое сродство к транспортерам моноаминов, особенно к мембранному транспортеру дофамина (Inyushin et al., 2013; Urra et al., 2014). В нашей работе было показано, что через 30 мин после введения ДСМИ в боковые желудочки крысам на П30, флуоресцирующие меченые нейроны мозаично распределены в перивентрикулярной области диэнцефалона или даже образуют крупные ядерно-подобные скопления. По всей вероятности, это дофаминергические нейроны, поскольку норадренергические и серотонинергические нейроны располагаются в гораздо более каудальных отделах мозга. Полученные данные подтверждают представления о том, что содержащиеся в ликворе вещества могут участвовать в регуляции нейронов, расположенных в перивентрикулярной области мозга (Bothwell et al., 2019).
Таким образом, на примере моноаминов было показано, что у неонатальных и взрослых крыс вещества, содержащиеся в ликворе, поступают в мозг и могут оказывать эндокринное влияние на секрецию нейротрансмиттеров нейронами мозга.
Список литературы
Муртазина А.Р., Бондаренко Н.С., Пронина Т.С. и др. Ликвор как гуморальная среда эндокринной системы мозга в онтогенезе // Acta Naturae. 2021. Т. 13. № 4. В печати.
Ait Ouares K., Filipis L., Tzilivaki A. et al. Two distinct sets of Ca2+ and K+ channels are activated at different membrane potentials by the climbing fiber synaptic potential in purkinje neuron dendrites // J. Neurosci. 2019. V. 39. № 11. P. 1969–1981.
Bjorefeldt A., Illes S., Zetterberg H. et al. Neuromodulation via the cerebrospinal fluid: Insights from recent in vitro studies // Front. Neural. Circuits. 2018. V. 12. Art. 5.
Black P.M. Neuropeptides in cerebrospinal fluid // Neurosurgery. 1982. V. 11. № 4. P. 550–555.
Bothwell S.W., Janigro D., Patabendige A. Cerebrospinal fluid dynamics and intracranial pressure elevation in neurological diseases // Fluids Barriers CNS. 2019. V. 16. № 1. Art. 9.
Bueno D., Parvas M., Nabiuni M. et al. Embryonic cerebrospinal fluid formation and regulation // Semin. Cell Dev. Biol. 2020. V. 102. P. 3–12.
Fuxe K., Borroto-Escuela D.O. Volume transmission and receptor-receptor interactions in heteroreceptor complexes: understanding the role of new concepts for brain communication // Neural. Regen. Res. 2016. V. 11. № 8. P. 1220–1223.
Gaspar P., Cases O., Maroteaux L. The developmental role of serotonin: news from mouse molecular genetics // Nat. Rev. Neurosci. 2003. V. 4. № 12. P. 1002–1012.
Gato A., Alonso M.I., Lamus F. et al. Neurogenesis: A process ontogenically linked to brain cavities and their content, CSF // Semin. Cell. Dev. Biol. 2020. V. 102. P. 21–27.
Ghersi-Egea, J.F., Strazielle, N., Catala, M. et al. Molecular anatomy and functions of the choroidal blood-cerebrospinal fluid barrier in health and disease // Acta Neuropathol. 2018. V. 135. P. 337–361.
Inyushin M.U., Arencibia-Albite F., de la Cruz A. et al. New method to visualize neurons with DAT in slices of rat VTA using fluorescent substrate for DAT, ASP+ // J. Neurosci. Neuroeng. 2013. V. 2. № 2. P. 98–103.
Jalalvand E., Robertson B., Tostivint H. et al. Cerebrospinal fluid-contacting neurons sense pH changes and motion in the hypothalamus // J. Neurosci. 2018. V. 38. № 35. P. 7713–7724.
Sakka L., Coll G., Chazal J. Anatomy and physiology of cerebrospinal fluid // Eur. Ann. Otorhinolaryngol. Head. Neck. Dis. 2011. V. 128. № 6. P. 309–316.
Saunders N.R., Daneman R., Dziegielewska K.M. et al. Transporters of the blood-brain and blood-CSF interfaces in development and in the adult // Mol. Aspects. Med. 2013. V. 34. № 2–3. P. 742–752.
Shapey J., Toma A., Saeed S.R. Physiology of cerebrospinal fluid circulation // Curr. Opin. Otolaryngol. Head. Neck. Surg. 2019. V. 27. № 5. P. 326–333.
Shaywitz B.A., Anderson G.M., Cohen D.J. Cerebrospinal fluid (CSF) and brain monoamine metabolites in the developing rat pup // Brain Res. 1985. V. 349. № 1–2. P. 225–232.
Ugrumov M.V, Mitskevich M.S. The adsorptive and transport capacity of tanycytes during the perinatal period of the rat // Cell Tiss. Res. 1980. V. 211. № 3. P. 493–501.
Ugrumov M.V, Taxi J., Mitskevich M.S. et al. Immunocytochemical and radioautographic study of serotonin projections to cerebral ventricles of perinatal rats // Brain Res. 1985. V. 350. P. 225–230.
Ugrumov M.V. Developing hypothalamus in differentiation of neurosecretory neurons and in establishment of pathways for neurohormone transport // Int. Rev. Cytol. 1991. V. 129. P. 207–267.
Ugrumov M.V. Hypothalamic monoaminergic system in ontogenesis: development and functional significance // Int. J. Dev. Biol. 1997. V. 41. № 6. P. 809–816.
Ugrumov M.V., Mitskevich M.S. Interrelations between neural elements and tanycytes during the perinatal period of the rat // Cell Tiss. Res. 1981. V. 215. № 3. P. 633–641.
Ugrumov M.V., Taxi J., Mitskevich M.S. et al. Immunocytochemical and radioautographic study of serotonin projections to cerebral ventricles of perinatal rats // Brain Res. 1985. V. 350. № 1–2. P. 225–230.
Urra J.A., Villaroel-Espíndola F., Covarrubias A.A. et al. Presence and function of dopamine transporter (DAT) in stallion sperm: dopamine modulates sperm motility and acrosomal integrity // PLoS One. 2014. V. 9. № 11. Art. e112834.
Дополнительные материалы отсутствуют.