Онтогенез, 2022, T. 53, № 1, стр. 46-57
Каким образом развитие тонкого кишечника крысы связано с изменениями в пуле протеасом?
Н. С. Карпов a, П. А. Ерохов a, Н. П. Шарова a, *, Т. М. Астахова a
a ФГБУН Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: npsharova@bk.ru
Поступила в редакцию 19.07.2021
После доработки 04.08.2021
Принята к публикации 11.08.2021
- EDN: TJKHGL
- DOI: 10.31857/S0475145022010049
Аннотация
Цель настоящей работы – исследовать, каким образом различные периоды раннего развития тонкого кишечника крысы связаны с изменениями в пуле протеасом. Показано, что к 21-му эмбриональному дню (Э21) и до 30-го дня постнатального развития (П30) на фоне постоянного количества протеасом изменяется их химотрипсинподобная и каспазаподобная активность, проявляемая субъединицами β5 + LMP7 и β1 + LMP2 соответственно, а также индивидуальная активность иммунных субъединиц LMP7 и LMP2. Причем выявлены как сходные характеристики, так и различия в динамике этих типов активности. Сходство проявляется в следующем. Во-первых, вся исследованная активность значительно повышается после Э18 и достигает максимума на П5–П15. Эти изменения соответствуют периоду ускоренного роста кишечника, заселения его микробиотой, развития адаптационных процессов и пищеварительной и иммунной функций. Во-вторых, сходство заключается в уменьшении всех исследованных типов активности к П22. Разница касается следующего. Во-первых, химотрипсинподобная и LMP7 активность падает к П22 в существенно меньшей степени по сравнению с каспазаподобной и LMP2 активностью. Во-вторых, к П30 (период изоляции от матери) только химотрипсинподобная и LMP7 активность вновь возрастает до максимальных уровней, что указывает на возможную ее роль в адаптации к внешнему питанию. Период повышения активности сопровождался увеличением доли активатора PA28αβ и иммунных протеасом с субъединицами LMP7 и/или LMP2 в общем протеасомном пуле. Наиболее значимый “скачок” в содержании иммунных субъединиц в тонком кишечнике выявлен на Э21 и П0 (день рождения, изменение условий питания). Таким образом, дополнительная наработка иммунных протеасом может быть одним из факторов, способствующих существенному повышению активности в перинатальный период. Дальнейшее развитие тонкого кишечника с П1 по П30 сопровождалось менее значительным увеличением содержания иммунных субъединиц. Все исследованные типы активности и количество субъединиц протеасом и активаторов в переломные периоды (Э21, П0, П30) не зависели от пола крыс. Активность иммунных субъединиц детектирована в нескольких формах протеасом, 20S-19S, 20S-PA28αβ и 20S, различающихся наличием или отсутствием того или иного активатора. Можно полагать, что множественные формы иммунных протеасом образуют биологически активные пептиды в несколько этапов. По-видимому, протеасомы 20S-19S, содержащие иммунные субъединицы, на первом этапе продуцируют из полноразмерных убиквитинированных белков полипептиды меньшего размера со специфической структурой, которые служат субстратами для 20S-PA28αβ и/или 20S протеасом. Последние на заключительном этапе, вероятно, образуют пептиды, непосредственно участвующие в межклеточных взаимодействиях и развитии иммунной функции, а также в адаптации к микробиоте и изменяющимся условиям питания.
ВВЕДЕНИЕ
Исследование молекулярных механизмов развития органов млекопитающих является актуальной задачей современной биологии. Решение этой задачи перспективно не только для фундаментальной науки, но и для выявления причин возникновения различных патологий (Sassin, 2018, 2020). В связи с этим все более важным становится изучение тонких механизмов функционирования протеасом, мультисубъединичных протеаз, участвующих в поддержании гомеостаза белков и регулирующих многочисленные клеточные процессы. Протеасомы образуют биологически активные пептиды, гидролизуют факторы роста, рецепторы, транскрипционные факторы, компоненты сигнальных путей и другие белки (Abramova et al., 2002; Spirina et al., 2013; Kondakova et al., 2020). Многообразие функций протеасом обеспечивается множественностью их форм, основанной на структурных различиях и способах гидролиза белков.
Наименьшей функциональной структурой является 20S коровая субчастица протеасом, доступ в которую для белковых субстратов, как правило, заблокирован. Тем не менее, 20S субчастица сама по себе способна утилизировать белки, поврежденные окислительным стрессом, и ряд иных белков (Davies, Shringarpure, 2006; Voigt et al., 2007; Raynes et al., 2016). Проникновение большинства белков в протеолитическую камеру протеасом обеспечивают активаторы 19S (PA700), 11S (PA28αβ, PA28γ), PA200, образующие крупные комплексы при соединении с 20S субчастицей (Tanaka, 2009; Stadtmueller, Hill, 2011; Kish-Trier, Hill, 2013). Активатор 19S способен распознавать, захватывать и пропускать в протеолитическую камеру белки, меченные убиквитиновой цепочкой, за счет своей многофункциональной мультисубъединичной структуры. В отличие от активатора 19S, регуляторы 11S и РА200, как правило, не пропускают в протеолитическую камеру полноразмерные убиквитинированные белки, но открывают вход для полипептидов среднего и малого размеров без предварительного их убиквитинирования.
По набору протеолитически активных субъединиц пул протеасом можно разделить на конститутивные протеасомы или протеасомы “домашнего хозяйства”, содержащие субъединицы β1, β2 и β5, и несколько субтипов иммунных протеасом, встраивающих иммунные субъединицы LMP2 (β1i), LMP10 (MECL1, β2i) и LMP7 (β5i) вместо конститутивных субъединиц либо полностью, либо в различных сочетаниях с ними (Groettrup et al., 1997; Griffin et al., 1998; Guillaume et al., 2010; Dahlmann, 2016). Конститутивные субъединицы β1, β2 и β5 проявляют соответственно каспазаподобную (КП), трипсинподобную и химотрипсинподобную (ХТП) активность, при замене конститутивных субъединиц на иммунные увеличивается ХТП и трипсинподобная активность и уменьшается КП активность. Если основная функция конститутивных протеасом заключается в выполнении рутинного белкового обмена и устранении поврежденных белков, то иммунные протеасомы, образуя специфические пептиды, регулируют развитие и подавление иммунных реакций, клеточную пролиферацию, адаптивные процессы (Caudill et al., 2006; Sharova, 2006; Tanaka, 2009; Lyupina et al., 2013; Erokhov et al., 2017; Astakhova et al., 2019).
Иммунные протеасомы настолько важны для развития организма, что образование их начинается уже в эмбриональный период в тимусе, селезенке, печени (Melnikova et al., 2008; Sharova et al., 2009; Melnikova et al., 2010; Karpova et al., 2013). Динамика экспрессии иммунных протеасом в развитии этих органов различна, что обусловлено разницей в их клеточном составе и функциях. В тимусе крысы экспрессия иммунных протеасом выходит на максимальный уровень уже на 21-й эмбриональный день в связи с обеспечением ими начинающегося в этот период процесса отрицательной селекции тимоцитов (Melnikova et al., 2008, 2010). В развивающихся селезенке и печени крысы уровень иммунных протеасом увеличивается в течение трех постнатальных недель. В селезенке этот процесс осуществляется последовательно в тесной связи с постепенным формированием белой пульпы. В печени нарастание экспрессии иммунных протеасом носит волнообразный характер: первая волна совпадает с функционированием печени как первичного лимфоидного органа, а вторая – с экспрессией иммунных протеасом в гепатоцитах (Sharova et al., 2009; Karpova et al., 2013). Очевидно, что низкое количество иммунных протеасом в гепатоцитах в первые две постнатальные недели неспособно обеспечить эффективное образование антигенных эпитопов для молекул главного комплекса гистосовместимости класса I в случае инфицирования и инициировать полноценный иммунный ответ. Согласно полученным данным, такой ответ возможен на третьей постнатальной неделе, когда, во-первых, гепатоциты уже обладают базовым уровнем иммунных протеасом и, во-вторых, сформирована белая пульпа селезенки клетками иммунной системы, обогащенными иммунными протеасомами. Начиная с этого периода клетки печени способны сигнализировать иммунной системе о синтезе ими чужеродных белков, а клетки белой пульпы селезенки способны реагировать на эти сигналы.
Несмотря на достигнутые успехи в выявлении протеасомных механизмов развития ряда органов, не изучен пул протеасом, включающий различные структурные формы, в эмбриональном и раннем постнатальном онтогенезе кишечника, выполняющего важнейшие функции не только в пищеварении, но и в иммунных процессах. Цель настоящей работы – исследовать, каким образом различные периоды раннего развития тонкого кишечника крысы связаны с изменениями в пуле протеасом.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Работу выполняли на крысах породы Вистар в соответствии с положениями Комиссии по биоэтике ФГБУН Института биологии развития им. Н.К. Кольцова РАН. Для исследования использовали целый кишечник плодов на 18-й день эмбрионального развития (Э18), тонкий кишечник самок на Э21 и постнатальные дни П0 (день рождения), П1, П5, П8, П12, П15, П18, П22, П30, а также тонкий кишечник самцов на Э21, П0, П30.
Антитела и основные реактивы. Для Вестерн-блоттинга использовали моноклональные антитела мыши к субъединицам α1,2,3,5,6,7 протеасом, иммунным субъединицам LMP2 и LMP7 протеасом, субъединице Rpt6 активатора РА700 протеасом, поликлональные антитела кролика к субъединице РА28α активатора РА28αβ протеасом (Enzo Life Sciences, США), моноклональные антитела мыши к β-актину (Santa Cruz Biotechnology, США), антитела козы к IgG мыши и кролика, конъюгированные с пероксидазой (Amersham Biosciences, Великобритания).
Для определения ХТП активности протеасом использовали субстрат N-succinyl-leu-leu-val-tyr-7-amido-4-methyl coumarin (Suc-LLVY-AMC), КП активности – субстрат Z-Leu-Leu-Glu-7-amido-4-methyl coumarin (Z-LLE-AMC) (Sigma-Aldrich, США), LMP2 и LMP7 активности – субстраты Ac-Pro-Ala-Leu-AMC (Ac-PAL-AMC) и Ac-Ala-Asn-Trp-AMC (Ac-ANW-AMC) (Boston Biochem, США) соответственно. Наличие примесных протеаз выявляли с помощью ингибитора протеасом Z-leucyl-leucyl-leucinal (MG132) (Sigma-Aldrich, США).
Препарирование кишечника и приготовление осветленных гомогенатов. Выделенный орган (целый кишечник или тонкий кишечник) погружали в фосфатный солевой буфер (PBS, рН 7.4), содержащий 1 мМ фенилметилсульфонил фторид (PMSF) для ингибирования активности протеаз внутрикишечной полости. Все дальнейшие процедуры, связанные с очисткой кишечника от соединительнотканных пленок и внутриполостного содержимого, проводили в PBS с 1 мМ PMSF. Образцы очищенного кишечника обсушивали на фильтровальной бумаге, взвешивали и замораживали при температуре −70°С.
Для определения активности протеасом in vitro и Вестерн-блоттинга запасенные образцы размораживали, гомогенизировали в буфере, содержащем 50 мМ Трис-HCl, рН 7.5, 100 мМ NaCl, 1 мМ ЭДТА, 1 мМ дитиотреитол, 1 мМ АТФ, 1 мМ PMSF, лейпептин (0.5 мкг/мл), пепстатин (1 мкг/мл), апротинин (1 мкг/мл), в соотношении 1 : 6 (вес : объем) при 0°С и осветляли центрифугированием при 15400 g и 4°С в течение 30 мин. Надосадочную жидкость (осветленные гомогенаты) использовали для дальнейших исследований.
Для нативного электрофореза образцы гомогенизировали в буфере, содержащем 50 мМ Na-HEPES, pH 7.5, 200 мМ NaCl и 10 мМ ЭДТА, в соотношении 1 : 3 (вес : объем).
Определение активности протеасом in vitro. Реакцию проводили в 100 мкл реакционной смеси, содержащей 20 мМ Трис-HCl, рН 7.5, 1 мМ дитиотреитол, 5 мМ MgCl2, 1 мМ АТФ, 30 мкМ соответствующего флуорогенного субстрата и 2 мкл осветленного гомогената, при 37°С в течение 20 мин и останавливали 1%-ным SDS. В данных условиях зависимость количества образующегося продукта от времени соответствовала прямолинейному участку графика (Erokhov et al., 2017). Интенсивность флуоресценции регистрировали на флуориметре (Bio-Rad, США) при длине волны возбуждения 380 нм и длине волны испускания 440 нм. Для оценки активности примесных протеаз использовали ингибитор активности протеасом MG132 в концентрации 5–10 мкМ.
Определение активности протеасом в неденатурирующем геле. Активность протеасом в градиентном 4–10% полиакриламидном геле (5 мкл осветленного гомогената или 70–90 мкг белка на дорожку) в нативных условиях определяли с использованием 300 мкМ флуорогенного субстрата в 200 мM Na-HEPES буфере, pH 7.5 (1/20 от объема геля) после электрофореза при 60 В в течение 14 ч, 140 В в течение 10 ч и 260 В в течение 20 ч (Erokhov et al., 2017). Следует отметить, что описанные в литературе протоколы нативного электрофореза применяются, как правило, для очищенных фракций протеасом или для разделения протеасом клеточных линий (Lyupina et al., 2013). При использовании грубых фракций, полученных из целых органов, содержащиеся в них нуклеиновые кислоты, микросомы, мелкие фрагменты соединительной ткани препятствуют проникновению белков с высокой молекулярной массой в гель и представляют собой основную проблему электрофореза. В условиях стандартного начального напряжения 140 В протеасомы, неспецифически связанные с нуклеиновыми кислотами или микросомами, “размываются” по гелю, начиная со стартовой позиции. Мы решили эту проблему главным образом путем снижения начального напряжения до 60 В и поэтапным его увеличением до 260 В (Erokhov et al., 2017).
Флуоресцентные полосы в геле фотографировали при 365 нм. Анализ активности протеасом в геле осуществляли с помощью стандартной программы ImageJ.
Вестерн-блоттинг. После электрофореза в денатурирующих условиях в 13% полиакриламидном геле (10 мкл осветленного гомогената или 60–78 мкг белка на дорожку), полипептиды переносили из геля на нитроцеллюлозную мембрану с помощью полусухого блоттинга. Обработку мембраны осуществляли стандартным методом с использованием первых антител к субъединицам α1,2,3,5,6,7, LMP7, LMP2, β-actin (1 : 1000), Rpt6 или PA28α (1 : 1500) и соответствующих вторых антител, конъюгированных с пероксидазой (1 : 2000). Изображение анализировали с помощью стандартной программы ImageJ, как описано ранее (Astakhova et al., 2018).
Результаты нормализовали на содержание β-актина. Несмотря на добавление коктейля ингибиторов протеаз в гомогенизирующий буфер, β-актин не детектировался во фракциях тонкого кишечника на П3–П8, но в них выявлялся полипептид меньшей молекулярной массы, который взаимодействовал с антителами к β-актину. Этот результат указывал на отщепление части молекулы β-актина в приготовленных образцах. Добавление ингибитора протеасом MG132 в концентрации 5 мкМ к гомогенизирующему буферу подавляло расщепление β-актина. Очевидно, при приготовлении образцов тонкого кишечника на П3–П8 имела место модификация молекулы β-актина, которая делала ее доступной для протеасом. Поэтому протокол определения количества β-актина предусматривал введение в гомогенизирующий буфер ингибитора протеасом MG132 в концентрации 5 мкМ.
Статистический анализ. Статистический анализ проводился в пакете программ GraphPad Prism 8.0 с использованием статистических методов: Brown-Forsythe ANOVA, Welch ANOVA, Kruskal-Wallis тест и two-way ANOVA.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность протеасом в раннем онтогенезе тонкого кишечника крыс. Исследована ХТП и КП активность протеасом, проявляемая в совокупности конститутивными и иммунными субъединицами β5 + LMP7 и β1 + LMP2 соответственно, а также индивидуальная активность иммунных субъединиц LMP7 и LMP2 в раннем онтогенезе тонкого кишечника. Проведено детальное исследование этих типов активности у самок крыс в эмбриональный период (на Э21) и в первый месяц постнатального развития. На Э18 половую принадлежность у плодов идентифицировать невозможно, так же как и вычленить тонкий кишечник. Поэтому на Э18 анализировали активность протеасом целого кишечника плодов крыс безотносительно пола.
Выявлено, что все исследуемые типы активности протеасом изменяются в раннем развитии, при этом обнаруживаются как сходные характеристики, так и различия (рис. 1). Сходство проявляется в следующем. Во-первых, вся исследуемая активность повышались после Э18 и достигала максимума на П5–П15. Такая динамика логична, так как переход организма от in utero к ex-utero сопровождается значительными перестройками в кишечнике: изменением кровотока и роста, развитием пищеварительной и иммунной функций, колонизацией микроорганизмами и адаптационными процессами (Nanthakumar et al., 2000; Claud et al., 2003). Во-вторых, сходство заключается в уменьшении всей исследуемой активности к П22. Очевидно, в этот период нет потребности кишечника в высокоактивных протеасомах. Разница касается следующего. Во-первых, ХТП и LMP7 активность падала к П22 в существенно меньшей степени по сравнению с КП и LMP2 активностью. Во-вторых, к П30 только ХТП и LMP7 активность вновь возрастала до максимальных уровней. Отметим, что к П30 животные были изолированы от матери и адаптировались к внешнему питанию. Очевидно, эта адаптация требует высокой ХТП и LMP7 активности.
Рис. 1.
Динамика активности протеасом в раннем онтогенезе тонкого кишечника самок крыс. Активность приведена для 100 мкл осветленных гомогенатов и представлена как среднее ± стандартное отклонение, n = 6, * p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001. ХТП активность – химотрипсинподобная активность, КП активность – каспазаподобная активность, Э – эмбриональный день, П – постнатальный день. На Э18 использовали целый кишечник плодов крыс безотносительно пола.
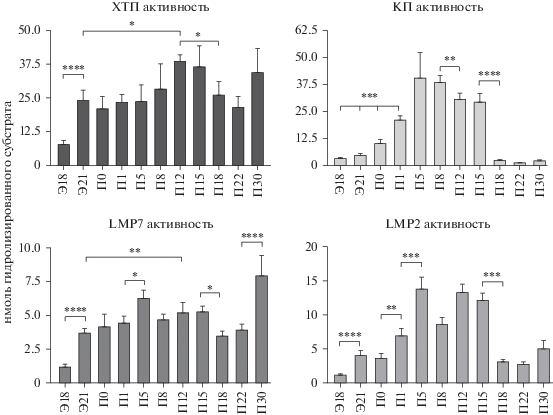
Особый вопрос в исследовании кишечника касается вклада в детектируемую активность протеасом активности бактериальных протеасом. Несмотря на проводимую нами обязательную процедуру отмывания внутренней полости кишечника, следует учитывать наличие в ней несмываемой части бактериальной флоры. В отличие от клеток эукариот прокариоты проявляют всего лишь один тип активности протеасом, бортезомиб-чувствительную активность (Risa et al., 2020). Поскольку бортезомиб – ингибитор ХТП активности протеасом эукариот, нельзя полностью исключить, что бактерии могут вносить вклад в эту активность, хотя используемый в данной работе субстрат для них не оптимален. Тем не менее, если этот вклад и имеет место, он незначителен и не может существенно исказить выявленную динамику, подтверждением чему служит сходство графиков для ХТП и LMP7 активности (рис. 1), последняя из которых присуща только млекопитающим.
Таким образом, выявлены переломные временные точки в динамике активности протеасом тонкого кишечника самок крыс. Для всех исследованных типов активности это перинатальный период, Э21 и/или П0. Кроме того, для ХТП и LMP7 активности детектирована дополнительная переломная точка, П30 (рис. 1). К П30 у самок крыс изменяется гормональный фон, и к П32–П33 наступает стадия первого проэструса (Vidal, 2017). Для оценки влияния фактора пола на образование переломных точек проведено сравнительное исследование активности протеасом тонкого кишечника самок и самцов крыс на Э21, П0 и П30. Оказалось, что фактор пола не оказывает влияния на активность протеасом в указанные переломные периоды (рис. 2).
Рис. 2.
Активность протеасом тонкого кишечника самцов и самок крыс в разные периоды раннего онтогенеза. Активность приведена для 100 мкл осветленных гомогенатов и представлена как среднее ± стандартное отклонение, n = 5. ХТП активность – химотрипсинподобная активность, КП активность – каспазаподобная активность, Э – эмбриональный день, П – постнатальный день.

Что в таком случае обеспечивает выявленную нами сложную динамику протеасомной активности в развивающемся кишечнике крысы? Ранее было показано, что активность протеасом может определяться различными факторами, к числу которых относятся общее количество протеасом, сочетание протеолитических субъединиц, наличие того или иного регулятора, окислительный стресс и др. (Tanaka, 2009; Astakhova et al., 2018; Erokhov et al., 2021). В настоящей работе мы исследовали уровень тотального пула протеасом и динамику содержания в нем иммунных субъединиц и активаторов в сравнении с динамикой активности протеасом.
Содержание субъединиц протеасом и активаторов в раннем онтогенезе тонкого кишечника крыс. Уровень тотального пула протеасом оценивали по содержанию субъединиц α1,2,3,5,6,7, входящих в состав всех субтипов протеасом. Изменение количества активатора 19S изучали по содержанию входящей в его состав субъединицы Rpt6, а активатора PA28αβ – по содержанию субъединицы PA28α. Изменение количества иммунных протеасом исследовали по содержанию иммунных субъединиц LMP7 и LMP2. Иммунная субъединица LMP10 встраивается в протеасомы, как правило, совместно с субъединицей LMP2 (Groettrup et al., 1997; Griffin et al., 1998), поэтому отдельно уровень LMP10 субъединицы не изучали.
Уровень тотального пула протеасом тонкого кишечника самок крыс достоверно не изменялся в перинатальный период и на протяжении первого месяца постнатального развития (рис. 3, 4) и не мог повлиять на активность протеасом. Вместе с тем, на фоне постоянного количества протеасом произошли перестройки в их структуре за счет увеличения содержания протеолитических иммунных субъединиц LMP7 и LMP2 (рис. 3, 4) и, следовательно, LMP10, замещающих протеолитические конститутивные субъединицы. Причем наиболее значимый “скачок” в содержании иммунных субъединиц, подобно протеасомной активности, выявлен на Э21 и П0. Таким образом, дополнительная наработка иммунных протеасом может быть одним из факторов, способствующих существенному повышению активности в перинатальный период. Дальнейшее развитие кишечника с П1 по П30 сопровождалось более плавным повышением количества иммунных субъединиц с достоверным “провалом” на П22 в графике для LMP7 (рис. 4). Эта динамика похожа на динамику ХТП и LMP7 активности и может служить ее обоснованием.
Рис. 3.
Вестерн-блоты субъединиц протеасом и активаторов в разные периоды раннего развития тонкого кишечника самок и самцов крыс с использованием соответствующих антител. Указана локализация в геле маркеров молекулярной массы. В качестве внутреннего контроля использован β-актин. Э – эмбриональный день, П – постнатальный день. На Э18 использовали целый кишечник плодов крыс безотносительно пола.

Рис. 4.
Динамика содержания субъединиц протеасом и активаторов в тонком кишечнике самок крыс в раннем развитии. За 100% принимали значения на П30. Данные нормализованы на содержание β-актина и представлены как среднее ± стандартное отклонение, n = 5, * p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001. Э – эмбриональный день, П – постнатальный день. На Э18 использовали целый кишечник плодов крыс безотносительно пола.

Отметим, что замена конститутивных протеолитических субъединиц иммунными субъединицами приводит к увеличению ХТП активности и уменьшению КП активности (Tanaka, 2009). Возможно, количество субъединицы LMP2 на П18–П30 стало достаточно высоким для того, чтобы объяснить падение КП активности в этот период. Нельзя исключить в данном случае и наличие иных регуляторов. Вместе с тем, остается непонятным падение LMP2 активности на П18–П30 по сравнению с П15, динамика которой именно в эти дни не соответствует динамике количества самой субъединицы. Очевидно, в кишечнике существуют дополнительные факторы, подавляющие LMP2 активность. Мы полагаем, что к ним можно причислить выявленное в данной работе уменьшение содержания активатора PA28αβ после П18 (рис. 3, 4).
Динамика содержания активатора PA28αβ (но не активатора 19S) в раннем развитии тонкого кишечника крысы оказалась разнонаправленной. С Э18 до П15 количество этого активатора четырехкратно увеличилось, что может быть связано с его участием в развитии адаптивных процессов и образовании регуляторных пептидов. Содержание активатора 19S, напротив, не менялась (рис. 3, 4). Очевидно, исходный уровень 19S активатора, свойственный эмбриональному периоду, достаточен для осуществления основных его функций – обеспечения устранения поврежденных убиквитинированных белков и убиквитинзависимого рутинного белкого обмена в тонком кишечнике в течение первого месяца постнатального развития.
Количество всех исследуемых субъединиц протеасом и активаторов в переломные временные точки, Э21, П0 и П30, выявленные для активности, было одинаково у самок и самцов (рис. 3), что указывает на независимость протеасомной системы в целом от половых различий, по крайней мере, в указанные периоды.
Следует отметить, что ранее были обнаружены иммунные субъединицы протеасом в кишечнике крысы, начиная с 3-й недели постнатального развития (Claud et al., 2014). Нам же удалось детектировать их, начиная с эмбрионального периода. Такая разница в результатах связана, на наш взгляд, с анализом разных фракций протеасом. Авторы приведенной работы исследовали очищенную фракцию 26S протеасом. Мы изучали грубую фракцию протеасом – осветленный гомогенат, обогащенный цитоплазматическими формами протеасом, в том числе формами, включающими иммунные субъединицы. На следующем этапе работы мы разделили формы протеасом развивающегося кишечника и проанализировали активность, с ними связанную.
Распределение активности протеасом тонкого кишечника крыс в неденатурирующем геле. Протеасомы разделяли с помощью метода нативного электрофореза, разработанного нами для грубых фракций (Erokhov et al., 2017). Для исследования выбрали два периода: П3 – один из первых дней развития животных вне материнского организма и П15 – период высокой активности протеасом и содержания иммунных субъединиц и активатора PA28αβ. Формы протеасом идентифицировали по их локализации в геле в соответствии с опубликованными ранее результатами (Erokhov et al., 2017).
Как на П3, так и на П15 в кишечнике выявлены три формы протеасом, 20S-19S, 20S-PA28αβ и 20S, которые проявляли все четыре исследуемые типа активности, но в разной степени (рис. 5). ХТП активность в большей мере была связана со структурами 20S-19S и 20S-PA28αβ, активность субъединицы LMP7 была распределена между всеми структурами протеасом равномерно (рис. 5, табл. 1). Вместе с тем, КП и LMP2 активность детектировалась, в основном, во фракции 20S (рис. 5, табл. 1). Можно полагать, что такое распределение активности важно для образования биологически активных пептидов в несколько этапов. По-видимому, протеасомы 20S-19S, содержащие иммунные субъединицы, на первом этапе образуют из полноразмерных убиквитинированных белков полипептиды меньшего размера со специфической структурой, которые служат субстратами для 20S-PA28αβ и/или 20S протеасом. Последние на заключительном этапе, вероятно, образуют пептиды, непосредственно участвующие в межклеточных взаимодействиях и развитии адаптационных процессов и иммунной функции. Особая роль при этом, очевидно, принадлежит наиболее выраженной КП и LMP2 активности 20S протеасом.
Рис. 5.
Распределение активности протеасом тонкого кишечника самок крыс в неденатурирующем геле на П3 и П15. Тироглобулин (670 кДа), меченный красителем Cy-3.5, использован как маркер (М) молекулярной массы. ХТП активность – химотрипсинподобная активность, КП активность – каспазаподобная активность, П – постнатальный день.

Таблица 1.
Активность протеасом тонкого кишечника самок крыс во фракциях, разделенных в неденатурирующем геле
| Активность | Активность протеасом, % (a) | |||
|---|---|---|---|---|
| Фракция 20S-PA28 | Фракция 20S | |||
| П3 | П15 | П3 | П15 | |
| ХТП | 127 ± 14 | 122 ± 8 | 65 ± 7* | 55 ± 9* |
| LMP7 | 96 ± 11 | 90 ± 12 | 97 ± 15 | 77 ± 21 |
| КП | 69 ± 10 | 51 ± 8 | 522 ± 49*** | 498 ± 65*** |
| LMP2 | 125 ± 10 | 136 ± 19 | 288 ± 22** | 212 ± 27** |
(a) За 100% принята активность во фракции 20S-19S. Активность представлена как среднее ± стандартное отклонение, n = 5. Достоверное отличие от соответствующих значений во фракциях 20S-19S и 20S-PA28 при * p < 0.05, ** p < 0.01 и *** p < 0.001. ХТП активность – химотрипсинподобная активность, КП активность – каспазаподобная активность, П – постнатальный день.
ЗАКЛЮЧЕНИЕ
Итак, в настоящей работе впервые показано, что в конце эмбрионального развития и на протяжении первого месяца постнатального развития в пуле протеасом тонкого кишечника крысы происходит смещение баланса в сторону увеличения доли иммунных протеасом. Если сравнить динамику уровня иммунных протеасом в развивающемся кишечнике с опубликованными ранее данными по развивающимся тимусу и селезенке (Melnikova et al., 2008; Karpova et al., 2013), то можно заключить, что кишечник занимает промежуточное положение между этими органами. В тимусе, первичном лимфоидном органе, содержание иммунных протеасом достигает максимума уже на Э21, что свидетельствует о начале процесса отрицательной селекции тимоцитов с участием иммунных протеасом в эмбриональном развитии. В селезенке, вторичном лимфоидном органе, основной прирост количества иммунных протеасом приходится на третью постнатальную неделю и совпадает с завершением формирования белой пульпы Т-лимфоцитами, обогащенными иммунными протеасомами. Кишечник является не только органом пищеварения, но и выполняет иммунную функцию за счет лимфоидной ткани слизистой оболочки. Функцию пищеварения кишечник приобретает сразу после рождения, что сопровождается его адаптацией к пищевым антигенам и заселяющей его микробиоте. К тому же, в этот период начинается формирование иммунной функции. Неудивительно, что резкий подъем количества иммунных протеасом, участвующих в адаптивных процессах и иммунных реакциях, обнаружен при переходе от in utero к ex-utero, на Э21 и П0 (рис. 3, 4). За этим подъемом следует менее значительное увеличение содержания иммунных протеасом в первый постнатальный месяц, что отличает кишечник и от тимуса, и от селезенки.
В настоящей работе обнаружены различные формы протеасом, 20S-19S, 20S-PA28αβ и 20S, проявляющие активность иммунных субъединиц, в развивающемся тонком кишечнике крысы (рис. 5). Не исключено, что каждая из этих форм объединяет субтипы иммунных протеасом с разным сочетанием протеолитически активных иммунных и конститутивных субъединиц. Иммунные протеасомы, по-видимому, экспрессируются в различных клетках тонкого кишечника, включая клетки эпителия и клетки лимфоидных скоплений, что обусловлено разнообразием функций множественных субтипов иммунных протеасом. Так, протеасомы, содержащие все иммунные субъединицы, образуют антигенные эпитопы для молекул главного комплекса гистосовместимости класса I. Субъединицы LMP7 и LMP10 важны для контроля клеточной пролиферации (Caudill et al., 2006). Протеасомы с субъединицами LMP2 и/или LMP7 играют роль в межклеточных взаимодействиях и адаптационных процессах (Lyupina et al., 2013; Erokhov et al., 2017).
Следует подчеркнуть, что баланс в клеточном пуле протеасом смещается в сторону увеличения количества иммунных протеасом и в опухолевом процессе, в том числе в развитии опухолей кишечника (Astakhova et al., 2017, 2020; Erokhov et al., 2021). Однако при опухолевом росте экспрессия LMP2-содержащих субтипов возрастает гораздо более значительно, чем экспрессия LMP7-содержащих субтипов. В развивающемся кишечнике динамика экспрессии LMP2 и LMP7 субъединиц, выявленная в настоящей работе, в основном, сходна (рис. 4), что является признаком нормального процесса.
Таким образом, можно заключить, что различные структуры протеасом с иммунными субъединицами, формирующиеся в раннем онтогенезе тонкого кишечника, играют важную роль в адаптации к микробиоте и изменяющимся условиям и рациону питания, а также в обеспечении нормальной клеточной пролиферации и становлении иммунной функции.
Список литературы
Abramova E.B., Sharova N.P., Karpov V.L. The proteasome: Destroy to live // Mol. Biol. 2002. V. 36. № 5. P. 613–624.
Astakhova T.M., Bozhok G.A., Alabedal’karim N.M., Karpova Y.D., Lyupina Yu.V., Ushakova E.M., Legach E.I., Bondarenko T.P., Sharova N.P. Proteasome expression in ovarian heterotopic allografts of Wistar and August rats under induction of donor specific tolerance // Russ. J. Dev. Biol. 2019. V. 50. № 5. P. 261–267.
Astakhova T.M., Ivanova E.V., Rodoman G.V., Sumedi I.R., Afanas’ev S.G., Goncharov A.L., Kondakova I.V., Sharova N.P. Effect of neoadjuvant chemoradiation therapy on proteasome pool in rectal cancer // Bull. Exp. Biol. Med. 2017. V. 164. № 8. P. 191–194.
Astakhova T.M., Moiseeva E.V., Sharova N.P. Features of the proteasome pool in spontaneously occurring malignant tumors of the mammary gland in mice // Russ. J. Dev. Biol. 2020. V. 51. № 5. P. 317–322.
Astakhova T.M., Morozov A.V., Erokhov P.A., Mikhailovskaya M.I., Akopov S.B., Chupikova N.I., Safarov R.R., Sharova N.P. Combined effect of bortezomib and menadione sodium bisulfite on proteasomes of tumor cells: The dramatic decrease of bortezomib toxicity in a preclinical trial // Cancers. 2018. V. 10. № 10. pii: E351.
Caudill C.M., Jayarapu K., Elenich L., Monaco J.J., Colbert R.A., Griffin T.A. T cells lacking immunoproteasome subunits MECL-1 and LMP7 hyperproliferate in response to polyclonal mitogens // J. Immunol. 2006. V. 176. № 7. P. 4075–4082.
Claud E.C., McDonald J.A.K., He S.-M., Yu Y., Duong L., Sun J., Petrof E.O. Differential expression of 26S proteasome subunits and functional activity during neonatal development // Biomolecules. 2014. V. 4. P. 812–826.
Claud E.C., Savidge T., Walker W.A. Modulation of human intestinal epithelial cell IL-8 secretion by human milk factors // Pediatr. Res. 2003. V. 53. P. 419–425.
Dahlmann B. Mammalian proteasome subtypes: Their diversity in structure and function // Arch. Biochem. Biophys. 2016. V. 591. P. 132–140.
Davies K.J., Shringarpure R. Preferential degradation of oxidized proteins by the 20S proteasome may be inhibited in aging and in inflammatory neuromuscular diseases // Neurology. 2006. V. 66. P. S93–S96.
Erokhov P.A., Kulikov A.M., Karpova Y.D., Rodoman G.V., Sumedi I.R., Goncharov A.L., Razbirin D.V., Gorelova V.S., Sharova N.P., Astakhova T.M. Proteasomes in patient rectal cancer and different intestine locations: Where does proteasome pool change? // Cancers. 2021. V. 13. № 5. P. 1108.
Erokhov P.A., Lyupina Yu.V., Radchenko A.S., Kolacheva A.A., Nikishina Yu.O., Sharova N.P. Detection of active proteasome structures in brain extracts: Proteasome features of August rat brain with violations in monoamine metabolism // Oncotarget. 2017. V. 8. № 41. P. 70941–70957.
Groettrup M., Standera S., Stohwasser R., Kloetzel P.-M. The subunits MECL-1 and LMP2 are mutually required for incorporation into the 20S proteasome // Proc. Natl. Acad. Sci. USA. 1997. V. 94. P. 8970–8975.
Griffin T.A., Nandi D., Cruz M., Fehling H.J., van Kaer L., Monaco J.J., Colbert A. Immunoproteasome assembly: cooperative incorporation of interferon gamma (IFN-gamma)-inducible subunits // J. Exp. Med. 1998. V. 187. P. 97–104.
Guillaume B., Chapiro J., Stroobant V., Colau D., van Holle B., Parvizi G., Bousquet-Dubouch M.P., Théate I., Parmentier N., van den Eynde B.J. Two abundant proteasome subtypes that uniquely process some antigens presented by HLA class I molecules // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 18599–18604.
Karpova Ya.D., Lyupina Yu.V., Astakhova T.M., Stepanova A.A., Erokhov P.A., Abramova E.B., Sharova N.P. Immune proteasomes in the development of rat immune system // Bioorg. Khim. 2013. V. 39. P. 400–410.
Kish-Trier E., Hill C.P. Structural biology of the proteasome // Annu. Rev. Biophys. 2013. V. 42. P. 29–49.
Kondakova I.V., Shashova E.E., Sidenko E.A., Astakhova T.M., Zakharova L.A., Sharova N.P. Estrogen receptors and ubiquitin proteasome system: mutual regulation // Biomolecules. 2020. V. 10. № 4. pii: E500.
Lyupina Yu.V., Abaturova S.B., Erokhov P.A., Orlova O.V., Beljelarskaya S.N., Mikhailov V.S. Proteotoxic stress induced by Autographa californica nucleopolyhedrovirus infection of Spodoptera frugiperda Sf9 cells // Virology. 2013. V. 436. № 1. P. 49–58.
Lyupina Yu.V., Bogatyrev M.E., Orlova A.S., Marjukhnich E.V., Kazansky D.B., Sharova N.P. Proteasomes in the brain of β2-microglobulin knockout mice // Biochemistry (Moscow). 2013. V.78. № 10. P. 1124–1133.
Melnikova V.I., Afanasieva M.A., Dmitrieva S.B., Karpova Ya.D., Sharova N.P., Zakharova L.A. Immune proteasomes in the developing rat thymus // Biochemistry (Moscow). 2008. V. 73. № 4. P. 451–457.
Melnikova V.I., Sharova N.P., Maslova E.V., Voronova S.N., Zakharova L.A. Ontogenesis of rat immune system: Proteasome expression in different cell populations of the developing thymus // Cell. Immunol. 2010. V. 266. P. 83–89.
Nanthakumar N.N., Fusunyan R.D., Sanderson I., Walker W.A. Inflammation in the developing human intestine: A possible pathophysiologic contribution to necrotizing enterocolitis // Proc. Natl. Acad. Sci. USA. 2000. V. 97. P. 6043–6048.
Raynes R., Pomatto L.C., Davies K.J. Degradation of oxidized proteins by the proteasome: Distinguishing between the 20S, 26S, and immunoproteasome proteolytic pathways // Mol. Aspects Med. 2016. V. 50. P. 41–55.
Risa G.T., Hurtig F., Bray S., Hafner A.E., Harker-Kirschneck L., Faull P., Davis C., Papatziamou D., Mutavchiev D.R., Fan C. et al. The proteasome controls ESCRT-III-mediated cell division in an archaeon // Science. 2020. V. 369. № 6504: eaaz2532.
Sassin W. Zu den Grenzen menschlicher Erkenntnis // Beacon J. Stud. Ideol. Ment. Dimens. 2018. V. 1. Art. 010310202. https://hdl.handle.net/20.500.12656/thebeacon.1.010310202
Sassin W. Der Konflikt zwischen Ideologien und einer nüchternen und umfassenden Sichtweise: Nachhaltig gegen Resilient? // Beacon J. Stud. Ideol. Ment. Dimens. 2020. V. 3. Art. 020440211. https://hdl.handle.net/20.500.12656/thebeacon.3.020440211
Sharova N.P. Immune proteasomes and immunity // Russ. J. Dev. Biol. 2006. V. 37. P. 139–145.
Sharova N.P., Zakharova L.A., Astakhova T.M., Karpova Ya.D., Melnikova V.I., Dmitrieva S.B., Lyupina Yu.V., Erokhov P.A. New approach to study of T cellular immunity development: Parallel investigation of lymphoid organ formation and changes in immune proteasome amount in rat early ontogenesis // Cell. Immunol. 2009. V. 256. P. 47–55.
Spirina L.V., Kondakova I.V., Choynzonov E.L., Chigevskaya S.Y., Shishkin D.A., Kulbakin D.Y. Expression of vascular endothelial growth factor and transcription factors HIF-1, NF-κB in squamous cell carcinoma of head and neck; association with proteasome and calpain activities // J. Cancer Res. Clin. Oncol. 2013 V. 139. P. 625–633.
Stadtmueller B.M., Hill C.P. Proteasome activators // Mol. Cell. 2011. V. 41. P. 8–19.
Tanaka K. The proteasome: Overview of structure and function // Proc. Jpn. Acad. Ser. B. 2009. V. 85. № 1. P. 12–36.
Vidal J.D. The impact of age on the female reproductive system: A pathologist’s perspective // Toxicologic Pathology. 2017. V. 45. № 1. P. 206–215.
Voigt A., Salzmann U., Seifert U., Dathe M., Soza A., Kloetzel P.-M. 20S proteasome-dependent generation of an IEpp89 murine cytomegalovirus-derived H-2L(d) epitope from a recombinant protein // Biochem. Biophys. Res. Commun. 2007. V. 355. P. 549–554.
Дополнительные материалы отсутствуют.


