Онтогенез, 2022, T. 53, № 1, стр. 19-30
Ганглиозиды в развитии организмов, организации прямых межклеточных взаимодействий, патологии нервной системы, канцерогенезе
В. Я. Бродский *
Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: brodsky.idb@bk.ru
Поступила в редакцию 07.07.2021
После доработки 18.10.2021
Принята к публикации 21.10.2021
- EDN: KUTULE
- DOI: 10.31857/S0475145022010074
Аннотация
Гликосфинголипиды – ганглиозиды – одни из существенных факторов прямых межклеточных взаимодействий и развития организмов. Они вовлечены в патогенез ряда болезней, таких как болезнь Паркинсона и злокачественные опухоли, проявляясь как дефицит или избыток содержания определенных ганглиозидов сравнительно с нормальными тканями. Изменения ганглиозидов можно исправить, влияя на их синтез или секрецию (шеддинг). При влияниях на ганглиозиды облегчаются симптомы болезней.
ВВЕДЕНИЕ
Ганглиозиды – обычные компоненты плазматической мембраны бактерий, клеток растений и животных, включая человека (лит. Hakomori, 1981; Ledeen, Yu, 1982; Tettamanti, Riboni, 1994; Kong et al., 1998; Proia, 2003; Schengrund, 2015). Впервые ганглиозиды идентифицированы в начале 1940-х гг. в мозге (отсюда название), затем они обнаружены во всех органах, во всех клетках. У животных ганглиозиды – постоянный компонент не только плазматической мембраны, но также и крови.
В основе ганглиозидов находится церамид – сфинголипид, состоящий из сфингозина и жирной кислоты. Церамид синтезируется в эндоплазматическом ретикулуме под действием церамидсинтазы и затем перемещается в аппарат Гольджи. Там к церамиду присоединяются углеводы и сиаловая кислота при действии синтаз и трансфераз. По числу остатков сиаловой кислоты различают разные типы ганглиозидов – моно- (GM), ди- (GD) или трисиаловые (GT). Внутри типа различают варианты – GD1, GD2 … и их подразделения – GD1a, GD1b… . Варианты ганглиозидов обладают разными физиологическими свойствами. Выделено около 200 ганглиозидов, но в определенном органе в заметном количестве всего 3–5.
Из аппарата Гольджи ганглиозиды перемещаются на поверхность клетки, где входят в состав плазматической мембраны. Церамид является компонентом внешней мембраны клеточной оболочки, а углеводная часть направлена в межклеточную среду и способна соединяться с разными лигандами. Ганглиозиды кожи могут служить барьером от проникновения в организм внешней воды и, с другой стороны, защищают от потерь воды, от обезвоживания организма. Часть ганглиозидов используется и в гиалоплазме для транспорта различных веществ, в частности ферментов, к органеллам. Утилизируются ганглиозиды в лизосомах.
Ганглиозиды могут быть рецепторами токсинов, например, холерного. Они изменяют активность ряда рецепторов – факторов роста, серотонина, инсулина. Ганглиозиды влияют на синтез белка и активность многих ферментов, а также на транспорт ионов. Они участвуют в адгезии клеток. Дефекты метаболизма ганглиозидов – одна из причин нарушений функций органов. Описаны болезни, совпадающие с недостаточностью ганглиозидов. При некоторых болезнях, напротив, наблюдают избыток ганглиозидов.
В экспериментах используют или препарат полной смеси ганглиозидов из мозга крупного рогатого скота (BBG, bovine brain gangliosides) или один определенный ганглиозид.
ГАНГЛИОЗИДЫ В МЕЖКЛЕТОЧНЫХ КОММУНИКАЦИЯХ
В конце 1990-х гг. выяснилось, что бактерии и протисты не беспорядочные скопления клеток, а некие их сообщества. Стало понятно, что прямые межклеточные взаимодействия – первые регуляции в эволюции. Нервная система – позднее приобретение. Исследование межклеточных взаимодействий у млекопитающих началось задолго до бактерий. В таких работах используют клеточные культуры. Очевидно, что прямые взаимодействия клеток в культуре – единственный способ их общения.
Маркером прямых межклеточных взаимодействий стали околочасовые (ультрадианные) клеточные ритмы. Открытые случайно в конце 1950-х гг. околочасовые ритмы присущи основным свойствам клеток: синтезу белка, активности ферментов, дыханию (последний обзор: Brodsky, 2014).
Околочасовые (ультрадианные) ритмы исследуют в плотных или редких культурах; первым маркером был ритм синтеза белка (Brodsky et al., 2000). В плотных культурах с близкорасположенными клетками ритм обнаруживается через несколько минут после перенесения культур в свежую среду. В редких культурах с далеко отстоящими клетками ритм находят лишь через несколько часов. Добавление в среду с отмытыми редкими культурами некоторых веществ приводит к выявлению ритма синтеза белка через несколько минут. Первым выявленным веществом-синхронизатором были ганглиозиды. Потом нашли и другие синхронизаторы, например трансмиттеры крови.
Сначала апробировали смесь ганглиозидов BBG, как известно, содержащую 20% GM1, 40% GD1a, 16% GD1b, 20% GT1b и еще 4% ганглиозидов в минорных концентрациях. Исследование влияний разных доз BBG на редкие культуры гепатоцитов выявило ритм синтеза белка в концентрациях BBG 0.2–0.4 мкМ (Brodsky et al., 2000). Позже такой эффект BBG нашли также для кератиноцитов, и для мезенхимных стромальных клеток (Brodsky et al., 2011, 2012).
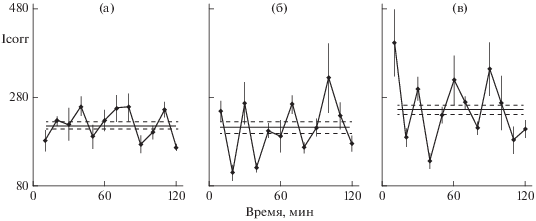
В печени в заметных концентрациях содержится пять разных ганглиозидов (Senn, Sellin, 1992). Мы исследовали все – GM3, GM1, GD1a, GD1b, GT1b в разных дозах (Brodsky et al., 2000). Эффективными в организации прямых межклеточных взаимодействий оказались два ганглиозида – GM1 и GD1a (рис. 1). Остальные изученные ганглиозиды не влияли на кинетику синтеза белка в редких культурах. Среди не эффективных был GM3, один из основных ганглиозидов в печени.
Рис. 1.
Влияние ганглиозидов на кинетику синтеза белка в культурах гепатоцитов. Два опыта, каждый на одной крысе. (a) и (в) – отмытые плотные культуры в нормальной среде (бессывороточная среда 199 с добавлением альбумина и инсулина; (б) и (г) – редкие культуры тех же крыс в такой среде; справа вверху в среду таких редких культур ввели 0.06 мкМ GM1 на 30 мин до исследования синтеза белка; справа внизу в среду культур этого опыта ввели 0.15 мкМ GD1a на 30 мин. Пробы по 3 культуры каждая брали каждые 10 мин в течение 2 ч. По оси абсцисс – время (мин); по оси ординат включение 3H-лейцина с поправкой на пул лейцина Icorr. Прямая на каждом графике – среднее для данного варианта опыта; пунктирные прямые ±ошибка этого среднего (по: Brodsky et al., 2000, с изменениями).

Для определения динамики накопления GM1 в клетках и в межклеточной среде флуоресцентным иммуноцитохимическим методом определено накопление этого ганглиозида в культурах гепатоцитов (Звездина и др., 2000; Brodsky et al., 2000). В плотных группах гепатоцитов GM1 ярко светился через 60 мин после отмывания культуры. Ритм синтеза белка мы находили и раньше, то есть критичная концентрация ганглиозида в среде образуется быстрее, чем за час. Анализ GM1 в среде обнаружил ганглиозид уже через 5 мин. Существенна не средняя концентрация синхронизатора в среде, а локальная вблизи клетки, что было показано Н.Д. Звездиной и др. (2000) в опытах с механической качалкой. В норме в плотных культурах ритм синтеза белка обнаруживают практически сразу после смены среды. Но если свежую среду в чашке с культурами перемешивать, ритм не виден даже через час.
Затем было исследовано влияние торможения синтеза ганглиозидов на прямые межклеточные взаимодействия. PPPP (1-phenyl-2-hexadecanoylamino-3-pyrrolidino-1-propanol) тормозил синтез гликозилцерамидсинтазы, ключевого фермента синтеза ганглиозидов (Inokuchi, Radin, 1987; Abe et al., 1995).
В микромолярных дозах PPPP значительно тормозит, по данным Лэдиша и сотрудников, как синтез ганглиозидов, так и их отделение от клеток (шеддинг) в среду (Li, Ladisch, 1996; Olshefski, Ladisch, 1998; Kong et al., 1998). С помощью ELISA мы оценивали действие разных доз PPPP (от 0.5 до 10 мкМ) на содержание ганглиозида-организатора GM1 в культурах гепатоцитов и нашли эффективным уже 1 мкМ PPPP (Brodsky et al., 2003). После PPPP в клетках оставалось примерно половина GM1, а в среде лишь 10% (табл. 1). В плотных культурах, обработанных PPPP, не нашли ритм синтеза белка (рис. 2). Действие 1 мкМ PPPP обратимо. Ингибитор не повреждает клетки. Через сутки в нормальной среде в культурах гепатоцитов, предобработанных PPPP, обнаружили ритм синтеза белка.
Таблица 1.
Изменение концентрации GM1 (пМ/106 клеток/1 ч) через сутки действия 1 мкМ PPPP на плотные культуры гепатоцитов (по: Brodsky et al., 2003)
| Oбъект | Kонтроль | PPPP |
|---|---|---|
| Гепатоциты | 53 | 29 |
| Среда | 2 | 0.2 |
Рис. 2.
Кинетика синтеза белка в плотных культурах гепатоцитов; действие ингибитора синтеза и шеддинга ганглиозидов PPPP. Контроль – суточные культуры отмыты, перенесены в свежую среду, и через сутки в них определен синтез белка. Справа – такие же отмытые культуры перенесли в среду с 1 мкМ PPPP и через сутки в них определили синтез белка (по: Brodsky et al., 2003, с изменениями).

Об организующей функции ганглиозидов говорили и наши опыты с действием среды, кондиционированной плотными культурами, на редкие культуры. Среду редких культур заменяли на кондиционированную плотными культурами, нормальными или предобработанными PPPP. Ритм синтеза белка организовала только нормальная среда. Об организующей роли ганглиозидов говорило и быстрое восстановление ритма синтеза после введения в среду с плотными культурами, предобработанными PPPP, ганглиозидов.
Высокую активность в наших опытах проявили липосомы с GM1 (рис. 3). Ритм синтеза белка в редких культурах был выявлен при концентрации GM1 в суспензии липосом 0.0003 мкМ, тогда как минимальная эффективная концентрация свободного экзогенного GM1 0.06 мкМ (Бродский и др., 2003).
Рис. 3.
Кинетика синтеза белка в редких культурах гепатоцитов: (a) – в нормальной среде; (б) – в среде с 0.01 мкМ свободного экзогенного GM1 или (в) – в среде с 0.0003 мкМ GM1 в липосомах (по: Бродский и др., 2003, с изменениями).

Как долго сохраняется синхронизирующий эффект ганглиозидов? Из опытов на редких культурах молодой крысы следует, что ганглиозиды работают, как триггер (Brodsky et al., 2005). После однократного их сигнала, когда в среде давно (4 дня) нет BBG, клетки все еще организуют ритм синтеза белка. Особое внимание уделили реакции старых крыс. В плотных культурах гепатоцитов старых крыс ритм синтеза белка определяется, но амплитуды ритма в клетках старых крыс вдвое ниже, чем у молодых. То же показано и на рис. 4. BBG значительно увеличил амплитуды ритма – с 34 до 63%. Средний уровень синтеза белка в каждом варианте опыта принят за 100%. Такой высокоамплитудный ритм сохранялся и после содержания культур, обработанных BBG, еще сутки в свежей нормальной среде. То есть и в этом случае сигнал действовал как триггер.
Рис. 4.
Сохранение влияния ганглиозидов (BBG) на кинетику синтеза белка в плотных культурах старой крысы: (a) – контроль, суточные культуры в нормальной среде; (б) – такие культуры в среде с 0.3 BBG 30 мин, отмыты и перенесены в нормальную среду, и исследован синтез белка; (в) – культуры, предобработанные BBG, отмыты, и через сутки в нормальной среде в таких культурах исследован синтез белка (по: Brodsky et al., 2005, с изменениями).
С возрастом снижается концентрация ганглиозидов-организаторов GM1 и GD1a (рис. 5). Выше отмечено снижение межклеточных взаимодействий у старых животных. Введение ганглиозидов в среду с клетками старых животных или им самим in vivo нормализует взаимодействия (Brodsky, 2020).
Рис. 5.
Изменения с возрастом мышей четырех ганглиозидов. WT – нормальные мыши, HT – гетерозиготные мутанты по гену синтеза GM1 (см. в тексте). Ось абсцисс – возраст мышей (дни), ось ординат – концентрация ганглиозидов, пМоль/мг белка (по: Wu et al., 2012, с изменениями).

К предположению об участии ганглиозидов в межклеточных взаимодействиях пришли более тридцати лет назад (обзор Hakomori, 1981). Гипотезу обосновывали всеобщее распространение ганглиозидов, их способность отделяться от одних клеток и встраиваться в другие клетки. Позже вывод был далее подтвержден убедительными, хотя и косвенными данными о постоянном присутствии ганглиозидов в межклеточной среде, их влиянием на транспорт ионов и активность ряда ферментов, и воздействием на состояние некоторых рецепторов. Мы обосновали вывод прямыми экспериментами. Выделены конкретные ганглиозиды и трансмиттеры организаторы, определена цепь процессов, включающих синхронизацию клеточной популяции (обзор Brodsky, 2018). Обосновано сохранение какое-то время эффекта синхронизации в памяти клеток.
ГАНГЛИОЗИДЫ И РАЗВИТИЕ
Влияние ганглиозидов на развитие организма, особенно нервной системы, показано в генно-инженерных исследованиях (Sheikh et al., 1999; Proia, 2003; Furukawa et al., 2004; Ohmi et al., 2012).
Первая ступень биосинтеза гликосфинголипидов, включая ганглиозиды, катализируется гликоцерамидсинтазой; к церамиду присоединяется глюкоза. Фермент кодируется геном Ugcg. Повреждение гена приводит к гибели эмбрионов; они не способны пройти гаструляцию. Мутанты по гену GalNAcT, кодирующего фермент синтеза ганглиозидов из лактатцерамида, следующего деривата церамида, живут меньше нормальных мышей, хотя и становятся взрослыми. Самцы таких мышей стерильны; в семенниках блокирован мейоз и не образуются спермии. У мутантов преобладают простые ганглиозиды – GM3 и GD3. Практически нет ганглиозидов, основных в нормальном мозге, таких как GM1, GD1a, GD1b и GT1b.
Ганглиозиды GD1a и GT1b являются лигандами для гликопротеина, связанного с миелином, названного MAG. Этот белок синтезируется в глие и является одним из ведущих факторов взаимодействия нейронов и глии. MAG участвует в миелинизации аксонов, у MAG-дефицитных мышей с возрастом демиелинизируются некоторые нервы (Sheikh et al., 1999). Такой эффект наблюдали и при дефиците GD1a и GT1b в нервной системе после мутации гена GalNAcT. У таких мутантов нарушено поведение и иммунитет. Периферические нервы этих мышей не способны к регенерации.
Мутанты с поражением многих ганглиозидных генов, но сохранившие нормальное содержание и активность ганглиозидов GM1 и GD1a, по жизнеспособности и поведению мало отличаются от нормы. Вновь отмечу, что эти два ганглиозида участвуют в регуляции прямых межклеточных взаимодействий (см. выше).
Среди многих исследований ганглиозидов при разных патологиях отмечу, прежде всего, два цикла работ. Они обращают внимание на возможность стимуляции активности ганглиозидов или, наоборот, на необходимость торможения их синтеза и шеддинга (секреции) для улучшения состояния больного человека.
ГАНГЛИОЗИДЫ И НЕВРОПАТОЛОГИЯ. ДРУГИЕ ПАТОЛОГИИ
В ряде работ отмечается дефицит ганглиозидов GM1 и GD1a при некоторых невропатологиях и, прежде всего, при болезни Паркинсона (рис. 6). Основные сведения опубликованы группой Ledeen et al. (Wu et al., 2012, 2020; Hadaczek et al., 2015; Ledeen, Wu, 2015, 2017). Напомню еще раз, что по нашим данным именно эти два ганглиозида из изученных нами пяти мажорных для печени и нервной системы регулируют прямые межклеточные взаимодействия, организующие ритм синтеза белка.
Рис. 6.
Концентрация ганглиозидов в затылочной коре мозга мышей в норме (Ctl, белые кружки) и у мышей-мутантов с симптомами болезни Паркинсона (PD, черные кружки). Ось ординат – концентрация в нмоль/мг белка (по: Hadaczek et al., 2015, с изменениями).

GM1 один из главных ганглиозидов рафтов, лабильных структур плазматической мембраны. Рафты способствуют перемещению белков в мембране, в частности, некоторых иммуноглобулинов и рецепторов. Теперь показано, что ганглиозиды регулируют функции рафтов. У мышей мутантов по гликозилтрансферазе и синтазам ганглиозидов показаны драматические изменения рафтов в клетках in vitro и in vivo (Furukawa et al., 2004; Ohmi et al., 2012).
Связываясь с гликопротеинами и протеогликанами среды, GM1 образует вблизи клеток гидрофильный слой, влияя на адгезию клеток, сигнальные функции и межклеточные взаимодействия. GM1 влияет на транспорт ионов кальция через плазматическую мембрану и потоки кальция внутри клетки (Sano et al., 2009). Показано влияние GM1 на активность аденилатциклазы в плазматической мембране. Это один из путей регуляции содержания АТФ и цАМФ. По нашим данным при этом активируются протеинкиназы, ключевой процесс межклеточной кооперации.
Некоторые исследования относятся к генетическим инженерным моделям болезни Паркинсона (Wu et al., 2012; Hadaczek et al., 2015). В одной мутантной мышиной линии разрушены оба аллеля гена B4galnt1, и такие мыши полностью лишены GM1. В другой гетерозиготной линии разрушен лишь один аллель (рис. 6). У таких мутантов концентрация GM1 снижена на 45–60%. Не менее снижена концентрация GD1a, тогда как GD1b и GT1b изменены мало сравнительно с нормальными мышами. У мышей обеих мутантных линий проявляются разные симптомы болезни Паркинсона: нарушения моторики и координации движений, гибель дофаминовых нейронов и т.д.
Нейротрофическая роль ганглиозидов предполагалась еще Хакомори (Hakomori, Igarashi, 1993). Вскоре экспериментально было показано, что GM1 усиливает активность фактора роста нервов (Rabin, Mocchetti, 1995). Показано, что экспонирование клеток глиомы с НФР значительно повышает фосфорилирование рецепторов НФР. К такому эффекту приводит и экспонирование клеток с GM1, т.е. нейротрофический эффект этого ганглиозида может быть связан с воспроизведением им действия НФР, активируя его рецепторы.
Позже показаны и другие значимые роли GM1 в нервной системе (Ledeen et al., 1998; Ledeen, Wu, 2010). GM1 модулирует активность некоторых рецепторов, включая Na/K-АТФ-азы и опиоидные. Влияет на кальциевые каналы и тем самым на все функции нейрона. Этот ганглиозид регулирует действие нейротрофического фактора (GDNF), выделяемого глиальными клетками (Hadaczek et al., 2015). Сигнальный фактор необходим для выживания катехоламинэргических нейронов. При дефиците GM1 и активности фактора GDNF в болезни Паркинсона происходит гибель дофаминовых нейронов.
Повышение концентрации GM1 необходимо для регенерации периферических нервов (Kappagantula et al., 2014). В опытах на крысах показано, что после перерезки седалищного нерва происходит конверсия GD1a и GT1b в GM1 с помощью Neu3-сиалидазы. После перерезки нерва концентрация GM1 возрастает в несколько раз в течение 6 ч и остается высокой 12 ч. У мутантов с инактивированной сиалидазой регенерация не происходит. Инъекция сиалидазы крысе стимулирует регенерацию.
Участие GM1 в этиологии болезни Паркинсона обосновано положительным влиянием GM1 на симптомы этой болезни. Первые наблюдения на животных моделях относятся к 1980-м годам. Известны современные данные о положительном эффекте GM1 на людей с болезнью Паркинсона. Больным людям ежедневно вводили GM1 (Schneider et al., 2010, 2015). После 16-недельного курса значительно снизились моторные и другие симптомы болезни. 26 пациентов наблюдали 5 лет после курса GM1. Симптомы болезни оставались сниженными.
Фармакологический аналог GM1, названный LIGA20 (Kharlamov et al., 1993), значительно эффективнее GM1 в подавлении симптомов болезни Паркинсона. В отличие от самого ганглиозида, LIGA20 проникает через гематоэнцефалический барьер и затем через плазматическую мембрану нейронов. Его внутрибрюшинное введение мышам-моделям значительно облегчало их состояние и продлевало жизнь. К сожалению, в клинической практике LIGA20 не может использоваться из-за токсического его действия при длительном применении (личное сообщение профессора Ledeen; проводится поиск других аналогов GM1). Одна из возможностей использования LIGA20 – ввести его в липосомы; эффективная концентрация может быть снижена в сотни раз (рис. 3). Странно, что эти данные и результаты Шнейдеров не привлекли внимания врачей- практиков. Болезнь Паркинсона пока не лечится. Любая попытка снизить хотя бы симптомы этой болезни интересна.
Дефицит ганглиозидов свойственен и такой нейродегенеративной болезни как хроническая хорея, или болезнь Хантингтона (Desplats et al., 2007). Болезнь характеризуется моторными, психиатрическими и когнитивными нарушениями. Показано нарушение метаболизма ганглиозидов при этой болезни, ненормальная экспрессия гликозилтрансфераз. Снижена концентрация ганглиозидов GD1a, GD1b, GT1b и более всего концентрация GM1.
Недавно выделен особый класс нервных болезней – ганглиозидозы, обусловленные ненормальным катаболизмом ганглиозидов, избыточным их накоплением в клетках (Sandhoff, Harzer, 2013). Болезни обусловлены врожденными дефектами гидролаз и некоторых белков. Ганглиозидозы ведут к слепоте и идиотизму молодых людей. Пока лечения нет. Надежду внушает создание мышиных моделей.
В последнее время определили изменения сфинголипидов при сердечно-сосудистых заболеваниях (обзор: Алесенко и др., 2019). Инсульты и инфаркты – основная причина смерти людей. Нарушения липидного обмена давно считают одними из основных рисков возникновения таких болезней. Теперь, кроме изменений холестерина и триглицеридов, отметили нарушения метаболизма и сфинголипидов, включая ганглиозиды, причем важную роль имеет базовый их компонент – церамид. Уровень сфинголипидов меняется при ишемии, гипертонии, инфаркте миокарда. Предлагается измерять уровень сфинголипидов в плазме крови, как дополнительный тест в диагностике и прогнозе сердечно-сосудистых заболеваний и прежде всего инфаркта.
ИЗМЕНЕНИЯ ГАНГЛИОЗИДОВ В КАНЦЕРОГЕНЕЗЕ
Давно известно увеличение содержания ганглиозидов в злокачественных опухолях (Mora et al., 1969). Дальнейшие исследования подтвердили первые наблюдения, и при этом была показана корреляция между содержанием ганглиозидов и частотой метастазов опухоли (Itaya et al., 1976; Skipski et al., 1981). Кроме различных клеточных линий, такая корреляция отмечена и для некоторых опухолей. Показательные примеры – клеточные линии мышиной меланомы и лимфомы человека. В опухолях наиболее распространены простые ганглиозиды – GD3 и GM3, исходные в двух линиях превращений (рис. 7). Высокая концентрация GD3 и активность фермента его синтеза особенно характерна для нейробластомы крысы и рака прямой кишки человека, а для GM3 ганглиозида типично повышение концентрации в меланоме и в раке мочевого пузыря, где много и GD2. Некоторые ганглиозиды, минорные в нормальных клетках, начинают экспрессироваться в опухолях (Fredman, 1994). В быстро растущих метастазах ганглиозидов больше, чем в медленно растущих метастазах. Моноклональные антитела к “опухолевым” ганглиозидам тормозят рост опухоли (обзор по этому циклу работ см. Segui et al., 2006).
Рис. 7.
Ганглиозиды в разных состояниях организма (синим). Опыт нормализации (красным). PPPP – ингибитор синтеза ганглиозидов.

Выделение (шеддинг) ганглиозидов опухолевыми клетками в среду – важный маркер прогрессии опухоли. Среди многих работ этого направления отмечу исследования группы С. Лэдиша (Stephan Ladisch); одно из первых опубликовано уже в 1983 году (Ladisch et al., 1983). Было показано, что концентрация ганглиозидов в высокотуморогенной линии клеток лимфомы мыши более чем в 100 раз выше, чем в линии, клетки которой слабо прививаются (Ladisch et al., 1987). Клетки второй линии выделяют в 90 раз меньше ганглиозидов, чем высокотуморогенные. Клетки этой линии прививаются намного хуже, чем клетки с высоким содержанием ганглиозидов и высоким шеддингом; требуется в 1000 раз большее число клеток. Интересно: клетки низкотуморогенной линии можно преобразовать в высокотуморогенные, добавив в их среду ганглиозиды, выделенные из высокотуморогенного клона. Наблюдения пациентов с нейробластомой показали отрицательную корреляцию выживания людей с уровнем ганглиозида GD2 в опухоли (Valentino et al., 1990).
Показано влияние ганглиозидов на иммунную систему (Ladisch et al., 1983; Gonwa et al., 1984; Shaposhnikova et al., 1989; Bergelson et al., 1995; Bergelson, 1995; Li et al., 1996a, 1996b). Так, ганглиозиды, выделенные из линии клеток нейробластомы, сильно подавляют иммунный ответ аллогенных нормальных клеток мыши in vivo (Li et al., 1995). Затем это было показано для основного ганглиозида нейробластомы – GD2 (Li et al., 1996). Восстановление иммунных клеток и некоторых других свойств нормальных тканей достигалось подавлением ключевого фермента синтеза всех ганглиозидов гликозилцерамидсинтазы препаратом PPPP (см. выше). По данным Р. Ли и С. Ладиша (Li, Ladisch, 1996) синтез ганглиозидов тормозится PPPP в разных опухолях примерно в 20 раз и шеддинг – 7–20 раз. В наших работах при обработке культур нормальных гепатоцитов PPPP их шеддинг подавлялся на 90% при использовании в 10 раз меньшей дозы PPPP (табл. 2).
Шеддинг ганглиозидов раковыми клетками и усвоение этих ганглиозидов нормальными клетками изящно показаны в опытах на двойных культурах (Olshefski, Ladish, 1998). Меченые ганглиозиды клеток медуллобластомы были обнаружены в нормальных фибробластах, отделенных от раковой культуры мембранным фильтром. После обработки раковых клеток ингибитором PPPP переход ганглиозидов полностью подавлялся. При этом структура фибробластов не страдала, и в этой культуре находили митозы.
Таблица 2.
Изменения интенсивности синтеза и шеддинга ганглиозидов по данным радиоактивности меченых ганглиозидов после 3-дневной обработки линии клеток нейробластомы человека ингибитором PPPP; расчет на чашку с клетками (Li, Ladisch, 1996)
| PPPP, млМ | Синтез, dpm | Шеддинг, dpm |
|---|---|---|
| 0 контроль | 61152 | 1454 |
| 10 | 3308 | 208 |
| 20 | 2700 | 120 |
Выше отмечено туморогенное действие ганглиозидов, выделенных из лимфомы, на клетки низкораковой линии (Ladisch et al., 1987). Затем показали подавление шеддинга клеток эпидермоидной карциномы (Barbour et al., 1992) и нейро-бластомы (Li, Ladisch, 1996, 1997), а также клеток меланомы после обработки их PPPP. В последнем случае синтез ганглиозидов снижался на 86–90%. Деления лимфоцитов в органах иммунитета не страдали. Индуктор дифференцировки – ретиноевая кислота стимулировала рост нейритов в клетках нейробластомы. Если обработать культуры холерным токсином, блокирующим рецепторы ганглиозида GM1, или ввести в среду антитела к GM1, ретиноевая кислота не стимулирует рост нейритов. Вновь отмечу универсальную роль GM1 в разных функциях и в патологии.
Мышам вводили подкожно клетки меланомы (Wen Deng et al., 2000). У всех образовались опухоли с метастазами. Другие мыши той же линии получали клетки, обработанные PPPP в условиях, не тормозящих пролиферацию клеток. У таких мышей опухоли возникли лишь у 40% животных, и метастазы были лишь у 25%. Среди многих исследований, показавших положительное влияние PPPP для профилактики и терапии опухолей, отмечу еще два (Inokuchi et al., 1990; Kyogashima et al., 1996).
Работы разных авторов позволили классику исследования ганглиозидов Й. Хакомори (Hakomori, 1991) рассмотреть новую стратегию терапии опухолей. Подобные отношения рассмотрены и в другом обзоре (Radin, 1994).
ЗАКЛЮЧЕНИЕ
Казалось бы, вывод о значимости ганглиозидов в жизни организма тривиален: как часть плазматической мембраны, ганглиозиды участвуют во всех функциях и в проявлениях патологии. Однако, современные данные определили специфическое, хотя и не уникальное участие именно ганглиозидов в разных жизненно важных процессах. Рис. 7 обобщает эти сведения. Красным выделены факторы улучшения состояний старого или больного человека.
Отмечены свойства ганглиозидов, неизвестные даже в 1980-е годы, а некоторые и в 2010-е. Так выяснилось участие некоторых ганглиозидов в организации прямых межклеточных взаимодействий. GM1 и GD1a из пяти изученных, основных в печени и в мозге, организуют ритм синтеза белка в разных клетках in vitro и in vivo. Ганглиозиды не единственный фактор-организатор. Таков же эффект трансмиттеров крови – норадреналина и серотонина, а также мелатонина и некоторых лекарств модуляторов кальция. Но организующая функция ганглиозидов обоснована экспериментами впервые, хотя гипотез об этом хватало, начиная с классических работ 1980-х гг.
Исследование генноинженерных мутантов показало необходимость ганглиозидов для развития. Повреждение гена первого процесса превращения церамида в ганглиозиды приводит к остановке гаструляции при ненарушенной проницаемости мембран бластомеров и не остановленных делениях дробления. Мутации поздних в становлении ганглиозидов генов ведут к нарушениям нервной системы, сокращению продолжительности жизни и изменениям поведения животных. Некоторые нарушения удается исправить, введя ганглиозиды. Отмечено, что мутанты с ненарушенным содержанием GM1 и GD1a по когнитивным показателям и некоторым другими параметрам нервной системы не отличаются от нормальных животных.
Среди многих изменений свойств организма и клеток при старении нашли и нарушения прямых межклеточных взаимодействий. Маркер процесса – амплитуда ритма синтеза белка – вдвое уменьшается у старых животных. При старении в организме наблюдали дефицит ганглиозидов-организаторов GM1 и GD1a, тогда как другие ганглиозиды, обычные в нервной системе и в печени, не изменялись. Ситуацию с организацией прямых межклеточных взаимодействий можно исправить, добавляя в среду с культурами клеток старых крыс или инъецируя старым животным ганглиозиды. Таков же эффект обогащения сыворотки крови старых крыс ганглиозидом-организатором GM1.
Дефицит GM1 и GD1a, ганглиозидов-организаторов прямых межклеточных взаимодействий наблюдали при болезни Паркинсона. Показано положительное влияние ганглиозида GM1 на симптомы болезни. Еще эффективнее действовал фармакологический аналог GM1. Инъекции людям ганглиозида GM1 снижали тяжелые симптомы болезни – нарушения моторики и координации движений, тремора, когнитивных сбоев. Поскольку эффективных методов лечения болезни Паркинсона пока нет, удивительно, что работы с ганглиозидами не привлекли широкого внимания врачей.
Противоположный феномен – избыток ганглиозидов – сопровождает канцерогенез. Влияния на ганглиозиды могут облегчать течение злокачественных опухолей. В злокачественных опухолях содержание ганглиозидов и особенно GM3 и GD2 может быть намного больше, чем в аналогичных нормальных тканях. Показано туморогенное действие ганглиозидов, торможение ими иммунитета организма хозяина. В опухолях часто ненормально высокая активность фермента синтеза ганглиозидов гликозилцерамидсинтазы. Ингибитор этого фермента – PPPP – тормозит прогрессию опухоли.
В последнее время определили изменения содержания сфинголипидов в процессе сердечно-сосудистых заболеваний, основной причины смерти людей. Предлагается измерять уровень сфинголипидов в плазме крови, как дополнительный тест в диагностике и прогнозе сердечно-сосудистых заболеваний и прежде всего инфаркта.
Итак, ганглиозиды – важный фактор развития и функционирования организма, влияющий на основополагающие генетические и эпигенетические механизмы в течение всего онтогенеза. Как можно представить эффекты ганглиозидов? Как компоненты плазматической мембраны, ганглиозиды могут влиять на активность многих рецепторов: факторов роста, инсулина, серотонина, нейротрофических и других. Ганглиозиды и сами могут быть рецепторами, и их недостаток или избыток может сказываться на биологии клеток. Как сигнальные молекулы, ганглиозиды могут влиять на многие процессы в клетках, такие как синтез белка, активность ферментов, ионный транспорт. Они могут модулировать действие других сигналов. Значимость ганглиозидов отмечалась давно, но обосновывалась лишь всеобщим их распространением в клетках и способностью отделяться от клеток и встраиваться в мембрану других клеток. Результат последних 20 лет – доказательство роли ганглиозидов прямыми физиологическими экспериментами, а в последние годы и генноинженерными методами. Для медицины существенны все более широкие данные о вовлеченности ганглиозидов в этиологию некоторых нервных болезней, и прежде всего болезни Паркинсона, а также в прогрессию опухолей.
Список литературы
Алесенко А.В., Затейщиков Д.А., Лебедев А.Т., Курочкин И.Н. Участие сфинголипидов в патогенезе атеросклероза // Кардиология. 2019. Т. 59. № 8. С. 77–87.
Бродский В.Я. Околочасовые сигналы, метаболизм, функции. М.: Научный мир, 2021.
Бродский В.Я., Нечаева Н.В., Звездина Н.Д., Новикова Т.Е., Гвазава И.Г., Фатеева В.И., Мальченко Л.А. Кооперация гепатоцитов in vitro в ритме синтеза белка интенсифицируется ганглиозидом GM1 в везикулах и липосомах // Известия РАН. 2003. № 6. 650–657.
Звездина Н.Д., Грачева Е.В., Голованова Н.К., Проказова Н.В., Нечаева Н.В., Гвазава И.Г., Фатеева В.И., Бродский В.Я. Накопление ганглиозида GM1 в среде, кондиционированной культурой гепатоцитов крысы // Известия РАН. 2000. № 6. С. 410–419.
Abe A., Radin N., Shayman J., Worting L., Zipkin R., Canem B. Structural and stereochemical studies of potent inhibitors of glycosylceramide synthase and tumor cell growth // J. Lipid Res. 1995. V. 36. P. 611–621.
Barbour S., Edidin M., Felding-Habermann B., Taylor-Norton J., Radin N.S., Fenderson B.A. Glycolipid depletion using a ceramide analogue (PDMP) alters growth, adhesion, and membrane lipid organization in human A431 cells // J. Cell Physiol. 1992. V. 150. P. 610–619.
Bergelson L.D. Serum gangliosides as endogenous immunomodulators // Immunol. Today. 1995. V. 16. P. 483–486.
Bergelson L.D., Dyatlovitskaya E.V., Klyuchareva T.E., Kryukova E.V., Lemenovskaya A.F., Matveeva V.A., Sinitsyna E.V. The role of glycosphingolipids in natural immunity. Gangliosides modulate the cytotoxicity of natural killer cells // Eur. J. Immunol. 1989. V. 19. P. 1979–1983.
Brodsky V.Y. Circahoralian (Ultradian) metabolic rhythms // Biochemistry (Moscow). 2014. V. 79. P. 483–495.
Brodsky V.Y. Biochemistry of direct cell-cell interactions. Signaling factors regulating orchestration of cell populations // Biochemistry (Moscow). 2018. V. 83. P. 890–906.
Brodsky V.Y. Cell-cell interaction disorders associated with senescence can be repaired // Russ. J. Dev. Biol. 2020. V. 51. № 4. P. 261–266.
Brodsky V.Y., Nechaeva N.V., Zvezdina N.D., Prokazova N.V., Golovanova N.K., Novikova T.E., Gvasava I.G., Fateeva V.I. Gangliodide-mediated synchronization of the protein synthesis activity in cultured hepatocytes // Cell Biol. Internat. 2000. V. 24. P. 211–222.
Brodsky V., Zvezdina N., Nechaeva N., Novikova T., Gvasava I., Fateeva V., Gracheva H. Loss of hepatocyte co-operative activity after inhibition of ganglioside GM1 synthesis and shedding // Cell Biol. Internat. 2003. V. 27. P. 935–942.
Brodsky V.Y., Nechaeva N.V., Zvezdina N.D., Novikova T.E., Gvasava I.G., Fateeva V.I., Malchenko L.A. Small cooperative activity of old rat’s hepatocytes may depend on composition of the intercellular medium // Cell Biol. Internat. 2004. V. 28. P. 311–316.
Brodsky V.Y., Zvezdina N.D., Nechaeva N.V., Novikova T.E., Gvasava I.G., Fateeva V.I., Malchenko L.A. Single short-term signal that enhances cooperative activity of the old rat hepatocytes acts for several days // Cell Biol. Int. 2005. V. 29. P. 971–975.
Brodsky V.Y., Terskikh V.V., Vasilyev A.V., Zvezdina N.D., Vorotelyak E.A., Fateeva V.I., Malchenko L.A. Self-synchronization of the protein synthesis rhythm in HaCaT cultures of human keratinocytes // Rus. J. Dev. Biol. 2011. V. 42. № 4. P. 272–291.
Brodsky V.Y., Vasiliev A.V., Terskikh V.V., Zvezdina N.D., Fateeva V.I., Malchenko L.A., Kiseleva E.V., Bueverova E.I. Mesenchymal stromal cells synchronize the rhythm of protein synthesis under the effect of an exogenous signal // Rus. J. Dev. Biol. 2012. V. 43. № 3. P. 196–198.
Brodsky V.Y., Terskikh V.V., Vasilyev A.V., Zvezdina N.D., Vorotelyak E.A., Fateeva V.I. Malchenko L.A. Self-synchronization of the protein synthesis rhythm in HaCaT cultures of human keratinocytes // Rus. J. Dev. Biol. 2011. V. 42. № 4. P. 272–291.
Brodsky V.Y., Vasiliev A.V., Terskikh V.V., Zvezdina N.D., Fateeva V.I., Malchenko L.A., Kiseleva E.V., Bueverova E.I. Mesenchymal stromal cells synchronize the rhythm of protein synthesis under the effect of an exogenous signal // Rus. J. Dev. Biol. 2012. V. 43. № 3. P. 196–198.
Desplats P.A., Denny C.A., Kass K.E., Gilmartin T., Head S.R., Sutcliffe J.G., Seyfried T.N., Thomas E.A. Glycolipid and ganglioside metabolism imbalances in Huntington disease // Neurobiol. Dis. 2007. V. 27. P. 265–277.
Fredman P. Gangliosides associated with primary brain tumors and their expression in cell lines established from these tumors // Progress Brain Res. 1994. V. 101. P. 225–240.
Furukawa K., Tokuda N., Okuda T., Tajima O., Furukawa R. Glycosphingolipids in engineered mice: insights into function // Seminars Cell and Develop. Biol. 2004. V. 15. P. 389–396.
Gonwa T.A., Westrick M.A., Macher B.A. Inhibition of mitogen- and antigen-induced lymphocyte activation by human leukemia cell gangliosides // Cancer Res. 1984. V. 44. P. 3467–3470.
Hadaczek P., Wu G., Sharma N., Ciesielska A., Bankiewicz K., Davidow A.L., Llu Z.-H., Forsayeth J., Ledeen R.W. GDNF signaling implemented by GM1 ganglioside: failure in Parkinson’s disease and GM1-deficient murine model // Exp. Neurol. 2015. V. 263. P. 177–189.
Hakomori S.-I. Glycosphingolipids in cellular interaction, differentiation and oncogenesis // Ann. Rev. Biochem. 1981. V. 50. P. 733–750.
Hakomori S.-I. New directions in cancer therapy based on aberrant expression of glycosphingolipids // Cancer Cells. 1991. V. 3. P. 461–470.
Hakomori S.-I., Igarashi Y. Gangliosides and glycosphingolipids as modulators of cell growth, adhesion and transmembrane signaling // Adv. Lipid Res. 1993. V. 25. P. 147–162.
Inokuchi I.-I., Radin N.S. Preparation of the active isomer of 1-phenyl-2-decanoylamino-3-morpholino-l-propanol, inhibitor of murine glycoceramide synthetase // J. Lipid Res. 1990. V. 28. P. 565–571.
Itaya K., Hakomori S., Klein G. Long-chain neutral glycolipids and gangliosides of murine fibroblast lines and their low- and high-tumorigenic hybrids // Proc. Natl. Acad. Sci. USA. 1976. V. 73. P. 1568–1571.
Kappagantula S., Andrews M.R., Cheah M., José Abad-Rodriguez J., Dotti C.G., Fawcett J.W. Neu3 sialidase-mediated ganglioside conversion is necessary for axon regeneration // J. Neurosci. 2014. V. 34. P. 2477–2492.
Kharlamov A., Guidotti A., Costa E., Hayes R., Armstrong D. Semi synthetic sphingolipids prevent protein kinase C translocation and neuronal damage in the perifocal area following a photochemically induced thrombotic brain cortical lesion // Neuroscience. 1993. V. 13. P. 2483–2494.
Kong Y., Li R., Ladish S. Natural form of shed gangliosides // Biochem. Biophys. Acta. 1998. V. 1394. P. 43–56.
Kyogashima M., Inouea M., Setoa A., Inokuchi J. Glucosylceramide synthetase inhibitor, D-threo-1-phenyl-2-decanoylamino-3-morpholino-1-propanol exhibits a novel decarcinogenic activity against Shope carcinoma cells // Cancer Letters. 1996. IOt. P. 25–30.
Ladisch S., Gillard B., Wong C., Ulsh L. Shedding and immunoregulatory activity of YAC-1 lymphoma cell gangliosides // Cancer Res. 1983. V. 43. P. 3808–3813.
Ladisch S., Kitada S., Hays E.F. Gangliosides shed by tumor cells enhance tumor formation in mice // J. Clin. Invest. 1987. V. 79. P. 1879–1882.
Ledeen R.W., Wu G. In search of a solution to the sphinx-like riddle of GM1 // Neurochem. Res. 2010. V. 35. P. 1867–1874.
Ledeen R.W., Wu G. The multi-tasked life of GM1 ganglioside, a true factotum of nature // Trends Biochem. Sci. 2015. V. 40. P. 407–418.
Ledeen R.W., Wu G., Gangliosides, α-synuclein, and Parkinson’s disease // In: Progress in Molecular Biology and Translational Science V. 156. Gangliosides in Health and Disease / Eds. Schnaar R.L., Lopez P.H.H. Academic Press, 2017. P. 435–454.
Ledeen R., Yu R. Gangliosides: structures, isolation and analysis // Methods Enzymol. 1982. V. 83. P. 139–191.
Ledeen R.W., Wu G., Lu Z.H., Kozireski-Chuback D., Fang Y. The role of GM1 and other gangliosides in neuronal differentiation // Ann. N.Y. Acad. Sci. 1998. V. 845. P. 161–175.
Li R., Villacreses N., Ladisch S. Human tumor gangliosides inhibit murine immune responses in vivo // Cancer Res. 1995. V. 55. P. 211–214.
Li R., Gage D., McKallip R., Ladisch S. Structural characterization and in vivo immunosuppressive activity of neuroblastoma GD2 // Glycoconj. J. 1996a. V. 13. P. 385–389.
Li R., Ladisch S. Abrogation of shedding of immunosuppressive gangliosides // Cancer Res. 1996b. V. 56. P. 4602–4605.
Li R., Ladisch S. Inhibition of endogenous ganglioside synthesis does not block neurite formation by retinoic acid-treated neuroblastoma cells // J. Biol. Chem. 1997. V. 272. P. 1349–1354.
Mora P.T., Brady R., Bradley R.M., McFarland V.W. Gangliosides in DNA virus-transformed and spontaneously transformed tumorigenic mouse cell lines // Proc. Natl. Acad. Sci. USA. 1969. V. 63. P. 1290–1296.
Ohmi Y., Ohkawa Y., Yamauchi Y., Furukawa K. Essential roles of gangliosides in the formation and maintenance of membrane microdomains in brain tissues // Neurochem. Res. 2012. V. 37. P. 1185–1191.
Olshefski R., Ladisch S. Synthesis, shedding, and intercellular transfer of human medulloblastoma gangliosides: abrogation by a new inhibitor of glucosylceramide synthase // J. Neurochem. 1998. V. 70. P. 467–472.
Proia R.L. Glycosphingolipid functions: insights from engineered mouse models // Phil. Trans. R. Soc. Lond. B. 2003. V. 358. P. 879–883.
Rabin S.J., Mocchetti I. GM1 ganglioside activates the high-affinity nerve growth factor receptor trkA // J. Neurochem. 1995. V. 65. P. 3347–3354.
Radin N.S. Rationales for cancer chemotherapy with PDMP, a specific inhibitor of glucosylceramide synthase // Mol. Chem. Neuropathol. 1994. V. 21. P. 111–127.
Sandhoff K., Harzer K. Gangliosides and gangliosidoses // J. Neuroscience. 2013. V. 33. 25. P. 10195–10208.
Sano R., Annunziata I., Peterson A., Moshiach S., Gomero E., d’Azzo A. GM1-ganglioside accumulation at the mitochondria-associated ER membranes links ER stress to Ca(2+)-dependent mitochondrial apoptosis // Mol. Cell. 2009. V. 36. P. 500–511.
Schengrund C.L. Gangliosides: glycosphingolipids essential for normal neural development and function // Trends Biochem. Sci. 2015. V. 40. P. 397–406.
Schneider J.S., Sendek S., Daskalakis C., Cambi F. GM1 ganglioside in Parkinson’s disease: results of a five year open study // J. Neurological. Sci. 2010. V. 292. P. 45–51.
Schneider Jay. S., Cambi F., Gollomp S.M., Hiroto Uwabara H., Brašić J.R., Benjamin L.B., Endek S., Wong D.F. GM1 ganglioside in Parkinson’s disease: pilot study of effects on dopamine transporter binding // J. Neurol. Sci. 2015. V. 356. P. 118–123.
Segui B., Abadie N., Jaffrezou J., Benoist H., Levade T. Sphingolipids as modulators of cancer cell death: Potential therapeutic targets // Biochem. Biophys. Acta. 2006. V. 1758. P. 2104–2120.
Senn N.J., Sellin S. Biosynthesis and excretion of gangliosides by isolated perfused rat liver // Europ. J. Biochem. 1992. V. 205. P. 809–814.
Senn H.J., Orth M., Fitzke E., Wieland H., Gerok W. Gangliosides in normal human serum. Concentrations, pattern and transport by lipoproteins // Europ. J. Biochem. 1989. V. 181. P. 657–662.
Shaposhnikova G.I., Prokazova N.V., Buznikov G.A., Zvezdina N.D., Teplitz N.A., Bergelson L.D. Shedding of gangliosides from tumor cells depends on cell density // Europ. J. Biochem. 1984. V. 140. P. 567–570.
Sheikh K.A., Sun J., Liu Y., Kawai H., Gradford T.O., Proia R.L., Griffin J.W., Schaar R.L. Mice lacking complex gangliosides develop Wallerian degeneration and myelination defects // Proc. Natl. Acad. Sci. USA. 1999. V. 90. P. 7532–7537.
Skipski V.P., Carter S.P., Terebus O.I., Podlaski F.J., Peterson R.H., Stock C.C. Ganglioside profiles of metastases and of metastasizing and nonmetastasizing rat primary mammary carcinomas // J. Natl. Cancer Inst. 1981. V. 67. P. 1251–1258.
Tettamanti G., Riboni L. Gangliosides turnover and neural functions // Prog. Brain Res. 1994. V. 101. P. 77–100.
Valentino L., Moss T., Olson E., Wang H.J., Elashoff R., Ladisch S. Shed tumor gangliosides and progression of human neuroblastoma // Blood. V. 75. P. 1564–1567.
Wen Deng, Li R., Ladisch S. Influence of cellular ganglioside depletion on tumor formation // J. Natl. Cancer Inst. 2000. V. 92. P. 912–917.
Wu G., Lu Z.-H., Kulkarni N., Ledeen R.W. Deficiency of ganglioside GM1 correlates with Parkinson’s disease in mice and humans // Neurosci. Res. 2012. V. 90. P. 1997–2008.
Wu G., Lu Z.-H., Ho Seo J., Alselehdar S.K., DeFrees S., Ledeen R.W. Mice deficient in GM1 manifest both motor and non-motor symptoms of Parkinson’s disease; successful treatment with synthetic GM1 ganglioside // Exper. Neurol. 2020. V. 329. P. 1–12.
Дополнительные материалы отсутствуют.


