Онтогенез, 2022, T. 53, № 2, стр. 129-135
Повышение уровня внутриклеточного серотонина в бластомерах приводит к нарушениям паттерна спирального дробления у моллюска Lymnaea stagnalis
А. И. Богомолов a, b, Е. Е. Воронежская b, *
a Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра эмбриологии
119934 Москва, ул. Ленинские Горы, 1, стр. 12, Россия
b Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: elena.voronezhskaya@idbras.ru
Поступила в редакцию 19.11.2021
После доработки 27.11.2021
Принята к публикации 03.12.2021
- EDN: IQUEUD
- DOI: 10.31857/S0475145022020033
Аннотация
Серотонин (5-НТ) известен как вещество c широким спектром физиологического действия. При этом его присутствие в клетках развивающегося эмбриона показано уже с самых ранних стадий развития. Однако влияние повышения уровня внутриклеточного серотонина на процессы дробления у представителей Spiralia подробно не изучалось. Мы впервые исследовали изменения в паттерне спирального дробления у пресноводного моллюска Lymnaea stagnalis после инкубации яиц в растворе предшественника серотонина ‒ 5-HTP (со стадии зиготы/2 бластомеров в течение 24 ч). В ходе дробления у всех экспериментальных эмбрионов нарушалось взаимное расположение бластомеров, начиная со стадии апикальной розетки вплоть до ранней гаструлы. Задержка цитотомии бластомеров квадрантов А и С приводила к смещению бластомеров во всех квадрантах, включая B и D, в результате чего бластомеры приобретали несвойственные им в норме контакты. Впоследствии у 80% эмбрионов экспериментальной группы происходило необратимое нарушение гаструляции и формирование экзогаструлы. У эмбрионов, успешно прошедших гаструляцию, наблюдались мальформации глаз и раковины в 10–15% случаев. Наши результаты показывают, что повышение уровня внутриклеточного серотонина приводит к нарушению взаимного расположения бластомеров у представителя Spiralia, а также может приводить к нарушениям дальнейшего развития.
ВВЕДЕНИЕ
Серотонин (5-HT) – широко распространенный моноамин, который обычно ассоциируется с передачей сигнала между нервными клетками. Кроме этого, 5-HT является гормоном, модулирующим нейрогенез у позвоночных, начиная с дифференцировки нервных клеток до формирования цитоархитектоники зрелого мозга (Vitalis et al., 2003; Whitaker-Azmitia, 2010; Farrelly et al., 2019). Однако, серотонин выявляется в эмбрионе уже на самых ранних, донервных стадиях, а эффекты модуляции его активности сказываются на различных процессах в развитии (Buznikov et al., 2001; Бузников, 2007). В яйцеклетку, зиготу и бластомеры серотонин попадает из материнского организма, благодаря активности мембранных транспортeров (Murphy et al., 2004; Cote et al., 2007). 5-HT внутри бластомеров обнаруживается как у позвоночных, так и у беспозвоночных животных, и выявляется как в цитоплазме, так и в ядрах эмбриональных клеток (Ivashkin et al., 2019). В клетках взрослого организма серотонин может служить субстратом для трансглутаминаз – ферментов, с помощью которых происходит специфическая модификация белков – серотонилирование (Walther et al., 2011).
Серотонилирование белков существенно для регуляции долговременных, отложенных или циклических процессов (Bader, 2019). В развитии большого прудовика серотонилирование белков у эмбрионов на стадиях раннего дробления приводило к изменению локомоторной активности развивающихся зародышей и ювенильных особей и, при определенных условиях, к возникновению необратимых нарушений гаструляции (Ivashkin et al., 2015). События в развитии большого прудовика, предшествующие нарушению гаструляции в случае повышения уровня серотонина в бластомерах, остались невыясненными. В частности, не были прослежены изменения, происходящие в паттерне спирального дробления.
В нашей работе мы использовали раннее развитие большого прудовика Lymnaea stagnalis в качестве модели для анализа влияния внутриклеточного серотонина на паттерн спирального дробления. Большой прудовик является классическим модельным объектом эмбриологии и биологии развития и его нормальное развитие достаточно хорошо изучено. В своих экспериментах мы повышали уровень внутриклеточного серотонина на ранних стадиях дробления за счет инкубации яиц в непосредственном предшественнике серотонина – 5-НТР. Расположение бластомеров на анимальном полюсе было детально картировано, отслежено их взаимное расположение у эмбрионов контрольной и экспериментальной групп. Процесс развития эмбрионов прослеживали до момента завершения метаморфоза, обращали внимание на прохождение гаструляции, формирование раковины и глаз.
МАТЕРИАЛЫ И МЕТОДЫ
Получение и культивирование эмбрионов
В работе использовали эмбрионы большого прудовика – Lymnaea stagnalis из лабораторной культуры. Содержание животных и получение кладок проводилось согласно описанной методике (Ivashkin et al., 2015). Для синхронизации эмбриональных стадий проводился индуцированный нерест путем переноса половозрелых особей из отсеков с избытком корма (салат) в чистую отстоянную воду. Через 5 ч нахождения в чистой воде, моллюски обычно откладывали кладки практически одновременно, разница в развитии между разными кладками составляла не более 30 мин. Стадии развития эмбрионов определяли по таблице развития для большого прудовика по Мещерякову (Meshcheryakov, 1990).
Экспериментальное повышение уровня серотонина
Яйца извлекали из слизистого кокона и инкубировали 24 ч в 2 мл соответствующих свежеприготовленных растворов. Все растворы готовили на основе кипяченой и профильтрованной через бумажный фильтр водопроводной воды. Контрольную группу инкубировали в 0.1 мM растворе аскорбиновой кислоты, а экспериментальную группу в растворе, содержащем 0.1 мM аскорбиновой кислоты и 1 мM предшественника серотонина (5-HTP). Аскорбиновая кислота необходима для предотвращения окисления 5-HTP (Voronezhskaya et al., 2004). После 24 ч инкубации при 25°С яйца тщательно отмывали кипяченой фильтрованной водопроводной водой. Для последующего анализа использовали зародышей трех ранних стадий развития: на стадии формирования апикальной розетки, плоской бластулы и ранней гаструлы (стадия 13, 15++ и 16 по Мещерякову, соответственно). Также выделяли стадию поздней гаструлы (стадия 18) и стадию завершения метаморфоза (стадия 27).
Иммунохимическое и гистохимическое маркирование
Для иммунохимического и гистохимического маркирования часть контрольных и экспериментальных эмбрионов, достигших соответствующих стадий развития (стадии 13‒18) извлекали из яйцевых капсул путем сдавливания между двумя предметными стеклами и последующим промыванием фосфатным буфером (PBS 0.01 M, рН 7.4) через сетку с ячеей 100 мкм. Эмбрионы фиксировали в 4% параформальдегиде на 0.01 M PBS в течение ночи при 4°С, а затем несколько раз промывали 5% раствором Triton X-100 на 0.01 M PBS. Оставшихся эмбрионов доращивали до ювенильных стадий. Морфологию зародышей, прошедших метаморфоз, изучали под бинокуляром (Olympus, SZ 60), аномалии развития документировали с помощью окулярной камеры (DCM 500, China).
Повышение внутриклеточного уровня 5-HT контролировали маркированием эмбрионов антителами к серотонину (rabbit polyclonal antibody against 5-HT, Immunostar, Hudson, WI, #20080, разведение 1 : 1000), с дальнейшим выявлением вторичными антителами (goat anti-rabbit Alexa 488 conjugated IgG, Molecular Probes, 1 : 800). Все антитела разводили на блокирующем растворе, содержащем 0.01 M PBS, 5% BSA, 0.5% Triton X-100. Границы клеток маркировали фаллоидином (phalloidin-Alexa 488 conjugated, Sigma). Ядра клеток докрашивали DAPI. Тотальные препараты эмбрионов разных стадий развития просветляли в 80% глицерине, а затем монтировали на предметные стекла в 80% глицерине.
Анализ препаратов
Анализ препаратов проводили с помощью конфокального микроскопа (Leica TCS SP5). Полученные серии оптических срезов использовали для построения 3D изображений с помощью программного обеспечения микроскопа. 2D изображения максимальных проекций строили с помощью программы для анализа изображений ImageJ (v 1.53) и графического редактора GIMP (v 2.10.18), компоновку рисунков проводили в программе Adobe Photoshop CS 8. Положения бластомеров описывали в соответствии с таблицами нормального развития L. stagnalis (Meshcheryakov, 1990).
На каждой стадии раннего развития было проанализировано не менее 25 контрольных и 30 экспериментальных эмбрионов. На стадии гаструлы было проанализировано 27 контрольных и 32 экспериментальных эмбриона. До ювенильной стадии было прослежено 220 экспериментальных эмбрионов из 18 кладок. На рисунках представлены наиболее характерные эмбрионы каждой стадии развития для контрольной и экспериментальной групп.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Распределение внутриклеточного серотонина
Инкубация в 5-НТР приводила к равномерному повышению уровня серотонина во всех бластомерах у ранних эмбрионов большого прудовика. Яркость маркирования антителами к серотонину была одинаковой в макро- и микромерах, не наблюдалось концентрации положительной реакции в каких-либо зонах бластомеров (рис. 1). Эти данные отличаются от полученных ранее результатов по инкубации эмбрионов морского брюхоногого моллюска тритонии (Tritonia diomedea) в 5-НТР. У эмбрионов тритонии 5-НТ в сходных условиях инкубации обнаруживался на анимальном полюсе на стадии 1–8 бластомеров и в микромерах анимального полюса на стадии морулы (Buznikov et al., 2003).
Рис. 1.
Выявление внутриклеточного серотонина в эмбрионах большого прудовика на стадии 8 бластомеров. (а) Положительная реакция иммунохимического маркирования антителами к серотонину во всех бластомерах у контрольного эмбриона. (а') Равномерное повышение яркости иммунохимического маркирования после инкубации яйца в предшественнике серотонина (5-HTP, 1 мМ). Зеленый – антитела к 5-НТ, синий – DAPI. Масштабная линейка 20 мкм.

Анализ паттерна дробления на последовательных стадиях развития
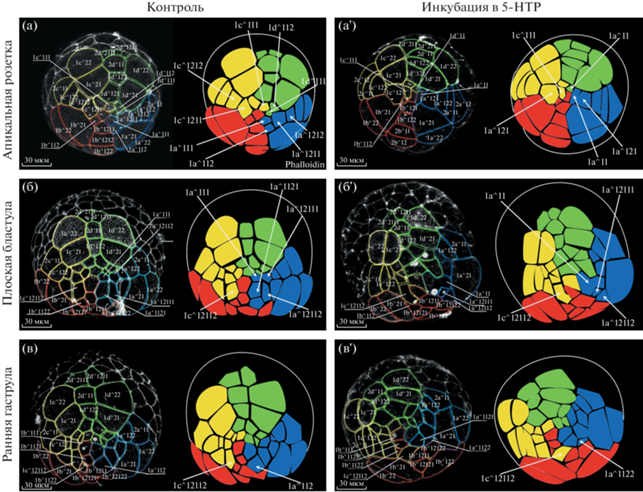
При анализе паттерна расположения бластомеров на анимальном полюсе обнаружены повторяющиеся отклонения в паттерне расположения бластомеров у эмбрионов экспериментальной группы по сравнению с контрольной. Различия начинали проявляться на стадии формирования апикальных клеток розетки (стадия 13). При сравнении паттерна расположения бластомеров обнаружено, что у экспериментальных эмбрионов бластомеры 1c121, 1a121, 1d11 и 1a11 не претерпевают цитотомии, что приводит к смещению бластомера с111. В результате с111 начинает контактировать с 1b112, чего не наблюдается в контроле (рис. 2а, 2а'). Разница в расположении бластомеров усиливается при достижении стадии плоской бластулы (стадия 15++). У экспериментальных эмбрионов всe ещe не происходит цитотомии бластомера 1a11. В результате чего бластомеры 1a12112 и 1a12111, смещаются к клетке прототроха 1а21, а бластомер 1c12112 начинает контактировать с 1b1211 (рис. 2б'). Подобные контакты между описанными бластомерами никогда не наблюдаются в контрольной группе (рис. 2б). Максимально заметными изменения становятся на стадии ранней гаструлы (стадия 16). На данной стадии у эмбрионов экспериментальной группы наблюдается ряд смещений клеток, приводящий к изменению контактов внутри квадрантов. Так, бластомер 1c12112 сдвигается в область потомков квадранта В и начинает контактировать с 1a1121. При этом бластомер 1b1121 не может контактировать с бластомером 1a1121 (в норме 1b1121 всегда контактирует с 1a1121); а бластомер 1a1122 контактирует с клеткой прототроха ‒ 1а21, чего не встречается в контроле (рис. 2в, 2в'). После стадии ранней гаструлы (стадия 16) смещения бластомеров могут варьировать из-за увеличивающегося числа клеток. При этом во всех случаях произошедшие ранее задержки в цитотомии в квадрантах С и А (бластомеры 1c121 и 1a121 соответственно), из-за чего смещаются отдельные бластомеры, финально приводят к существенному нарушению взаимного расположения бластомеров уже во всех квадрантах на анимальном полюсе у зародышей экспериментальной группы.
Рис. 2.
При повышении внутриклеточного уровня серотонина нарушается взаимное расположение бластомеров во время спирального дробления Lymnaea stagnalis. Все эмбрионы представлены с анимального полюса, границы клеток промаркированы фаллоидином (белый). Синяя прорисовка – квадрант А, красная прорисовка – квадрант В, желтая прорисовка – квадрант С, зеленая прорисовка – квадрант D. (а, а') Сбой паттерна дробления начинается на стадии формирования апикальных клеток розетки (ст. 13). Стрелками указаны: задержка цитотомии бластомеров 1a121 и 1a11 (в квадранте А); не разделившийся бластомер 1c121 и смещение положения бластомера с111 (в квадранте С); запаздывающий в прохождении цитотомии бластомер 1d11 (в квадранте D). (б, б') Нарушения в расположении бластомеров более четко видны на стадии плоской бластулы (ст. 15++). Стрелками указаны: все еще не поделившийся бластомер 1a11; 1a12112 и 1a12111, сместившиеся к клетке прототроха 1a21; бластомер 1c12112, сдвигающийся в сторону квадранта В. (в, в') Выраженные нарушения паттерна расположения клеток анимального полюса на стадии ранней гаструлы (ст. 16). Стрелками указаны: бластомер 1a1122, сместившийся и контактирующий с клеткой прототроха 1a21; бластомер 1c12112, внедрившийся в квадрант В. Масштабная линейка 30 мкм.
Спиральный паттерн дробления консервативен, детерминирован и устойчив. Четко определены как положения каждого нового бластомера, так и его контакты с соседними клетками. Такое взаимодействие в случае спирального дробления принципиально, поскольку изменения в контактах или взаимном расположении бластомеров на стадиях дробления приводят к различным изменениям или нарушениям в дальнейшем развитии у гастропода, в том числе у большого прудовика (Arnolds et al., 1983). Ярким примером влияния расположения бластомеров на дальнейшее развитие являетcя изменение генетически детерминированной закрученности раковины у большого прудовика. Механическим смещением оси поворота микромеров относительно макромеров после третьего деления дробления можно добиться получения левозакрученных улиток в генетически правозакрученной линии. Аналогичные нарушения наблюдаются также при изменении экспрессии материнских генов (maternal effect gene), таких как Lsdia1 and Lsdia2. Доказано, что ген Lsdia1 ассоциирован с перестройкой актинового цитоскелета (Kuroda, Abe, 2020). В свою очередь, повышение уровня внутриклеточного серотонина может приводить к долговременным изменениям в структуре актинового цитоскелета, что было показано для гладкомышечных клеток (Watts et al., 2009). Также высокий уровень серотонина оказывает влияние на свойства внеклеточного матрикса (Hummerich, Schloss, 2010) и плотность контактов между клетками (Li et al., 2016). Изменения в состоянии цитоскелета бластомеров и плотности контактов между клетками эмбриона при воздействии серотонина может быть одним из вероятных механизмов, лежащих в основе нарушения перемещений бластомеров во время дробления у большого прудовика. Однако это предположение требует дополнительных экспериментальных исследований.
Нарушения гаструляции и мальформации
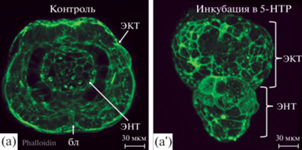
При достижении стадии гаструлы, у 80% зародышей экспериментальных групп возникает необратимая летальная аномалия развития. На этой стадии у контрольных зародышей формируется двуслойная гаструла с хорошо выраженным бластопором (рис. 3а). В это же время экспериментальные зародыши представляют собой две плотные шарообразные клеточные массы: эктодерму и энтодерму, скрепленные между собой в области формирования бластопора (рис. 3a'). Такую аномалию развития у большого прудовика ранее описывали как экзогаструлу (Raven, 1966). Формирование подобных нарушений развития было описано при кратковременной инкубации эмбрионов на стадии зиготы или 2 бластомеров в растворах LiCl (Holland et al., 2005) или азакенпауллона (Kunick et al., 2003). В обоих случаях авторы предполагают вовлеченность канонического Wnt-сигнального пути в возникновение данной необратимой аномалии развития. Вопрос о влиянии серотонина на Wnt-каскад на данный момент остается открытым. Предложенная нами модель может оказаться удобной для исследований возможного взаимодействия между этими двумя регуляторными путями в процессе развития.
Рис. 3.
Эмбрионы контрольной и экспериментальной групп на стадии поздней гаструлы. Границы клеток промаркированы фаллоидином (зеленый). (а) По истечении 36 ч после появления первой борозды делений дробления эмбрионы контрольной группы проходят стадию поздней гаструлы с хорошо выраженным бластопором. (а') Зародыши экспериментальной группы на той же стадии развития представляют собой две плотные шарообразные клеточные массы, скрепленные между собой в области формирования бластопора. Обозначения: бл – бластопор, энт – энтодерма, экт – эктодерма. Масштабная линейка 20 мкм.
После стадии гаструлы эмбрионы проходят в развитии стадии велигера и великонхи, претерпевают метаморфоз и ещe некоторое время проводят в яйце до стадии вылупления. После прохождения метаморфоза эмбрион напоминает миниатюрную взрослую улитку: у контрольных зародышей формируются голова с щупальцами и парными темными глазами, четко выделяется нога, сформированные органы висцерального комплекса закрыты завитками раковины (рис. 4а). У 10–15% зародышей экспериментальной группы, продолживших свое развитие и успешно прошедших гаструляцию, наблюдаются мальформации двух видов. В первом случае нарушения связаны с формированием глаз. Возможно, как формирование одного асимметричного глаза (циклопия) (рис. 4г), так и появление непарных глаз (рис. 4д), или множества глаз только на одной стороне головы (рис. 4е). Вторым типом нарушений были изменение формы раковины. Формирующаяся раковина может терять завитки, при этом завиток может быть как удлиненным (рис. 4б), так и широким (рис. 4в). Наблюдалось также расхождение витков раковины между собой при сохранении нормального числа завитков. Следует отметить, что мальформации глаз и раковины могут встречаться как раздельно, так и у одного и того же зародыша.
Рис. 4.
Примеры мальформаций, наблюдающихся у эмбрионов экспериментальной группы после завершения метаморфоза. (a) Зародыш контрольной группы с парными темными глазами и завитками раковины. (б, в) Мальформации раковины: вытянутая раковина без завитков (б), широкая раковина без завитков (в). (г–е) Мальформации глаз: циклопия (г), формирование непарных глаз (д), формирование глаз на одной стороне (е). Масштабная линейка 50 мкм. Обозначения: черная стрелка – глаза, р – раковина, н – нога.

Ранее подобные мальформации были описаны после манипуляций с микромерами, потомками 3D-организатора, а также при изменениях в положении бластомеров на цефалической пластинке у Lymnaea stagnalis (Arnolds et al., 1983; Martindale et al., 1985). Авторы связывают подобные мальформации с нарушениями в дифференцировке мезодермальных и эктодермальных производных.
ЗАКЛЮЧЕНИЕ
Мы показали, что инкубация в предшественнике серотонина со стадии зиготы до 24 ч развития приводит к равномерному повышению уровня внутриклеточного серотонина во всех бластомерах у эмбрионов Lymnaea stagnalis. При этом наблюдается отклонение от классического паттерна спирального дробления, связанное с задержкой цитотомии у части бластомеров и смещением взаимного расположения бластомеров анимального полюса относительно друг друга. В последующем развитии у части эмбрионов возникают необратимые нарушения гаструляции, мальформации глаз и раковины.
Список литературы
Бузников Г.А. Донервные трансмиттеры как регуляторы эмбриогенеза. Современное состояние проблемы // Онтогенез. 2007. Т. 38. № 4. С. 262–270.
Arnolds W.J.A., Biggelaar J.A.M. van den, Verdonk N.H. Spatial aspects of cell interactions involved in the determination of dorsoventral polarity in equally cleaving gastropods and regulative abilities of their embryos, as studied by micromere deletions in Lymnaea and Patella // Wilhelm Roux’s Archives of Developmental Biology. 1983. № 2(192). P. 75–85.
Bader M. Serotonylation: Serotonin signaling and epigenetics // Frontiers in Molecular Neuroscience. 2019. № 12.
Buznikov G.A., Lambert W.H., Lauder J.M. Serotonin and serotonin-like substances as regulators of early embryogenesis and morphogenesis // Cell and Tissue Research. 2001. № 2(305). P. 177–186.
Buznikov G.A., Nikitina L.A., Voronezhskaya E.E., Bezuglov V.V., Dennis Willows A.O., Nezlin L.P. Localization. Localization of serotonin and its possible role in early embryos of Tritonia diomedea (Mollusca: Nudibranchia) // Cell and Tissue Research. 2003. № 2(311). P. 259–266.
Côté F., Fligny C., Bayard E. Maternal serotonin is crucial for murine embryonic development // Proc. Natl. Acad. Sci. U.S.A. 2007. № 1(104). P. 329–334.
Farrelly L.A., Thompson R.E., Zhao S., Lepack A.E., Lyu Y., Bhanu N.V., Zhang B., Loh Y.-E.E., Ramakrishnan A., Vadodaria K.C., Heard K.J., Erikson G., Nakadai T., Bastle R.M., Lukasak B.G., Zebroski H., Alenina N., Bader M., Berton O., Roeder R.G., Molina H., Gage F.H., Shen L., Garcia B.A., Li H., Muir T.W., Maze I. Histone serotonylation is a permissive modification that enhances TFIID binding to H3K4me3 // Nature. 2019.
Holland L.Z., Panflio K.A., Chastain R., Schubert M., Holland N.D. Nuclear β-catenin promotes non-neural ectoderm and posterior cell fates in amphioxus embryos // Developmental Dynamics. 2005. № 4(233). P. 1430–1443.
Ivashkin E., Khabarova M.Y., Melnikova V., Kharchenko O., Voronezhskaya E.E., Adameyko I. Serotonin mediates maternal effects and directs developmental and behavioral changes in the progeny of snails // Cell Reports. 2015. № 7(12). P. 1144–1158.
Ivashkin E., Melnikova V., Kurtova A., Brun N., Obukhova A., Khabarova M.Y., Yakusheff A., Adameyko I., Gribble K., Voronezhskaya E.E. Transglutaminase activity determines nuclear localization of serotonin immunoreactivity in the early embryos of invertebrates and vertebrates // ACS Chemical Neuroscience. 2019. № 8(10). P. 3888–3899.
Kunick C., Lauenroth K., Leost M., Maijer L., Lemcke T. 1‑Azakenpaullone is a selective inhibitor of glycogen synthase kinase-3β // Bioorganic and Medicinal Chemistry Letters. 2004. № 2(14). P. 413–416.
Kuroda R., Abe M. The pond snail Lymnaea stagnalis // EvoDevo. 2020. № 1(11). P. 1–10.
Martindale M.Q., Doe C.Q., Morrill J.B. The role of animal-vegetal interaction with respect to the determination of dorsoventral polarity in the equal-cleaving spiralian, Lymnaea palustris // Wilhelm Rouxs Archives of Developmental Biology. 1985. № 5(194). P. 281–295.
Meshcheryakov V.N. The common pond snail Lymnaea stagnalis // Animal Species for Developmental studies. Springer, Boston, MA, 1990. P. 69–132.
Murphy D.L., Lerner A., Rudnick G., Lesch K.P. Serotonin transporter: gene, genetic disorders, and pharmacogenetics // Mol. Interv. 2004. V. 4(2). P. 109–123.
Raven C.P. Morphogenesis in Lymnaea stagnalis and its disturbance by lithium // J. Experimental Zoology. 1952. P. 121, 1–78.
Vitalis T., Parnavelas J.G. The role of serotonin in early cortical development // Developmental Neuroscience. 2003. № 2–4(25). P. 245–256.
Voronezhskaya E.E., Khabarova M.Y., Nezlin L.P. Apical sensory neurones mediate developmental retardation induced by conspecific environmental stimuli in freshwater pulmonate snails // Development. 2004. № 131(15). P. 3671–3680.https://doi.org/10.1242/dev.01237
Whitaker-Azmitia, Patricia M. Serotonin and Development // Elsevier B.V. 2010. P. 309–323.
Walther D.J., Stahlberg S., Vowinckel J. Novel roles for biogenic monoamines: From monoamines in transglutaminase-mediated post-translational protein modification to monoaminylation deregulation diseases // FEBS J. 2011. № 24(278). P. 4740–4755.
Дополнительные материалы отсутствуют.


