Онтогенез, 2022, T. 53, № 2, стр. 94-111
Отклонения в строении эфир при химической индукции стробиляции у Aurelia aurita (Scyphozoa, Cnidaria)
П. С. Мостовщикова a, *, Д. М. Саидов b, И. А. Косевич b
a Образовательный центр Сириус Краснодарский край
354349 Сочи, Олимпийский проспект, 40, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, д. 1, стр. 12, Россия
* E-mail: etonemoimail@gmail.com
Поступила в редакцию 14.08.2021
После доработки 24.10.2021
Принята к публикации 30.10.2021
- EDN: CPUDJL
- DOI: 10.31857/S0475145022020082
Аннотация
Aurelia aurita – представитель сцифоидных, одного из классов Стрекающих (Cnidaria), развитие и жизненный цикл которого достаточно хорошо изучены. В последние годы A. aurita часто выступает в качестве объекта изучения процессов развития Cnidaria, включая специфический вариант бесполого размножения путем стробиляции – формирование эфир (личинок медуз) за счет поперечного деления полипа. Естественным стимулом для начала стробиляции в большинстве случаев служит продолжительное снижение температуры. Необходимость длительной индукции и непредсказуемость результата затрудняет работу с этим модельным объектом. Поэтому для индукции стробиляции в лабораторных условиях часто используются различные синтетические химические соединения, строение которых приближено к таковому предполагаемого “гормона стробиляции”. В настоящей работе представлены данные об обнаруженных отклонениях в процессе отделения эфир и в их внешней морфологии при использовании 5-метокси-2-метилиндола для индукции стробиляции у A. aurita в лабораторных условиях. Впервые проведено сравнение наблюдавшихся в эксперименте отклонений в морфологии эфир с описанными в литературе отклонениями в морфологии эфир и медуз из природных популяций. Высказано предположение, что химическая индукция приводит к возрастанию частоты появления морфологических отклонений у формируемых в процессе стробиляции эфир на основе нарушения пространственной разметки и процессов дифференцировки зачатков.
ВВЕДЕНИЕ
Для решения вопросов регуляции процессов формообразования и развития многоклеточных животных все чаще обращают внимание на представителей низших многоклеточных (Догель, 1981; Brusca, Brusca, 2003; Technau et al., 2015; Zimmermann et al., 2019). Это связано с надеждами на то, что простота организации таких организмов облегчит понимание сложной системы регуляции, базовые принципы которой одинаковы для всех организмов (Technau, Steele, 2011; Genikhovich, 2019). Сцифомедуза Aurelia aurita является одним из наиболее изученных видов среди стрекающих, который в последнее время используется как модельный объект биологии развития (напр., Spangenberg, 1965a, 1965b, 1991; Yuan et al., 2008; Nakanishi et al., 2008, 2010; Gold et al., 2015; Khalturin et al., 2019).
Внимание биологов развития в последнее время привлекает процесс трансформации сцифополипов в личинки медуз – эфиры, которые в дальнейшем постепенно развиваются в ювенильных медуз. Процесс трансформации начинается стробиляцией (терминальным почкованием) – подразделением тела полипа на фрагменты, из которых затем формируются личинки медуз – эфиры (рис. 1) (Иванова-Казас, 1977; Догель, 1981; Straehler-Pohl et al., 2011). Поиску генетических регуляторных механизмов этого процесса уделяется особое внимание (Kroiher et al., 2000; Fuchs et al., 2014; Brekhman et al., 2015; Gold et al., 2019).
Рис. 1.
Стробиляция Aurelia aurita. Верхний ряд – схемы, нижний ряд – фотографии соответствующих стадий. (а) Полип до начала стробиляции, (б) стробила с первыми перетяжками; процесс подразделения тела полипа на зачатки эфир начинается в оральной части полипа и распространяется по направлению к аборальной части, (в) особь, переходящая на стадию средней стробилы, у зачатков, расположенных ближе к оральной части полипа, начинают формироваться лопасти, (г) средняя стробила; зачатки эфир, расположенные ближе к оральной части полипа, приобретают красный оттенок, продолжается развитие лопастей эфир, (д) поздняя стробила, полностью сформированные эфиры отделились, развитие личинок медуз продолжается в орально-аборальном направлении, (е) полип после стробиляции. з – зачаток эфиры, п – перетяжки, отделяющие зачатки эфир, р – ропалий, щ – щупальце полипа. Масштабные линейки равны 1 мм.

Aurelia aurita относится к видам с полидискоидной стробиляцией, в результате которой один полип дает начало нескольким эфирам (Berrill, 1949; Сухопутова, 2013; Sukhoputova et al., 2019). Для эфир данного вида характерно наличие восьми отростков – лопастей (рис. 2). На конце каждого такого отростка эфиры имеется развилка из двух краевых лопастей, в промежутке между которыми формируется комплекс органов чувств – ропалий. В норме ропалии первой (самой орально расположенной) эфиры закладываются в основании каждого второго щупальца полипа, начавшего стробиляцию, и который чаще всего имеет 16 щупалец (Browne, 1901; Spangenberg, 1991; Su-khoputova et al., 2019).
Рис. 2.
Строение эфиры Aurelia aurita. гф – гастральные филаменты, кр – краевая лопасть, л – лопасть эфиры, м – манубриум, р – ропалий. Масштабная линейка 1 мм.

Отклонения в строении эфир, медуз и других стадий жизненного цикла A. aurita привлекали внимание в основном в конце 19–начале 20 вв. (Browne, 1895, 1901; обсуждение и ссылки в работах Hargitt, 1901; Berrill, 1949; Gershwin, 1999). По настоящее время отклонения в строении эфир должным образом не систематизированы, и отсутствует их подробный анализ. Одни авторы рассматривали только отклонения в числе ропалиев или лопастей у эфир и медуз от обычных восьми (Browne, 1895, 1901; Berrill, 1949); другие – обращали внимание на нарушение тетрамерной симметрии медуз и эфир (Gershwin, 1999), лишь упоминая другие отклонения. Встречаются описания отдельных необычных отклонений в строении вновь отделившихся эфир (Browne, 1895; Vannucci, 1957). Неисследованным остается и вопрос о влиянии тех или иных отклонений в строении эфир на дальнейшее формирование медуз (Uchida, Nagao, 1963; Hamner, Jenssen, 1974; Kakinuma, 1975; Miyake et al., 1997; Chernyshev, Isaeva, 2002; Заика, 2005; Straehler-Pohl et al., 2011).
Наиболее вероятным естественным фактором, который вызывает начало стробиляции у A. aurita, считается продолжительное снижение температуры окружающей среды, связанное со сменой времен года. Исследования показали, что искусственное снижение температуры на несколько градусов в лабораторных условиях может индуцировать стробиляцию по прошествии от нескольких недель до нескольких месяцев (Berrill, 1949; Spangenberg, 1965a, 1965b; Kakinuma, 1975; Sukhoputova, Kraus, 2017). Чувствительность полипов к снижению температуры может значительно отличаться у культур, которые перед индукцией долгое время содержались в разных температурных условиях, в том числе при индукции клональных культур (Сухопутова, Краус, 2017). Это ведет к необходимости подбора условий индукции для каждой отдельной группы полипов, что значительно затрудняет работу.
Изучение молекулярных механизмов регуляции стробиляции позволило выявить ген CL390, который активно транскрибируется при стробиляции (Fuchs et al., 2014; Wang, 2017). Белок, кодируемый данным геном, имеет сложное строение, в теле полипа он распадается на части, одна из которых, по-видимому, и играет основную роль в запуске каскада биохимических реакций, контролирующих протекание стробиляции. На основе строения этого вещества было предложено использование ряда синтетических гомологичных молекул – производных индола и триптофана, которые способны индуцировать стробиляцию в короткие сроки: от двух дней до нескольких недель (Spangenberg, 1967, 1971; Kuniyoshi et al., 2012; Fuchs et al., 2014; Cabrales-Arellano et al., 2017; Wang, 2017). Одно из таких веществ – 5-метокси-2-метилиндол.
Как было указано выше, индукция стробиляции за счет вариации естественных факторов среды (снижение температуры содержания) требует значительного времени и результат остается достаточно непредсказуемым. Поэтому в настоящей работе была поставлена цель провести сравнительный анализ процесса стробиляции и разнообразия отклонений во внешней морфологии эфир при химической индукции стробиляции. Описано и классифицировано значительное число отклонений, в том числе ранее не описанных, в строении эфир, сформировавшихся в процессе стробиляции клональных полипов A. aurita из Черного моря, индуцированных растворами 5-метокси-2-метилиндола различных концентраций от 5 нМ до 5 мМ. Полученные данные свидетельствуют об определенном влиянии химического индуктора на процесс стробиляции. Это позволит в дальнейшем провести анализ закономерностей отклонений, наблюдающихся у различных представителей сцифоидных как при развитии в естественных условиях, так и при химической индукции стробиляции полипов.
МАТЕРИАЛЫ И МЕТОДЫ
При проведении экспериментов использовали полипов Aurelia aurita (Linnaeus, 1758) из клональной культуры, полученной от полипов из Черного моря (рис. 1). Культура состоит из потомков одного полипа, видовая принадлежность которого подтверждена молекулярно-филогенетическим анализом, проведенным по генам CO1 и 28S, с использованием последовательностей из Генбанка (Бондарь, 2019). Использование генетически однородных полипов исключает влияние генетических различий на результаты экспериментов. Культура содержится на биологическом факультете МГУ им. М.В. Ломоносова при постоянных условиях при 18°C, в искусственной морской воде (Coral Pro, Red Sea, Израиль) соленостью 18 промилле. Кормление полипов осуществляется науплиусами Artemia sp. два раза в неделю. Культура, а также все полипы во время проведения экспериментов содержались в темной комнате. Полипы этой культуры никогда не приступали к спонтанной стробиляции.
Индукция стробиляции
В экспериментах по индукции использовали полипов примерно равных размеров, так как известно, что количество эфир (но не их размер) и время стробиляции зависят от размеров полипа (Kroiher et al., 2000). Эксперименты начинали не ранее, чем через сутки после последнего кормления. В течение эксперимента полипов не кормили. Для индукции по 5 полипов помещали в пластиковые емкости с 10 мл искусственной морской воды с индуктором заданной концентрации. Воду с индуктором не меняли.
Были проведены четыре серии экспериментов с различными концентрациями индуктора 5-метокси-2-метилиндола (#M15451, Sigma-Aldrich) (далее – индола): 5 нМ, 25 нМ, 1 мкМ, 5 мкМ. Минимальная и максимальная концентрации индуктора в 5 нМ и 5 мкМ были выбраны исходя из данных, приведенных в работе Фучса с соавт. (Fuchs et al., 2014), где было показано, что эти концентрации вызывают 100%-ю стробиляцию индуцированных полипов A. aurita линии “Роскоф” в течение 48–96 ч.
Наблюдение за ходом стробиляции одновременно проводили после индукции индолом в одной емкости с 5-ю полипами для каждой из указанных концентраций. Все эксперименты проведены в трехкратной повторности. Первая повторность была проведена отдельно. Вторая и третья повторность эксперимента – после завершения первой повторности и практически одновременно (параллельно) – с разницей в один день. Таким образом, в каждой серии экспериментов с определенной концентрацией индуктора было использовано 15 полипов (три повтора по одной емкости с 5-ю полипами), и всего в 4-х сериях – 60 полипов, которые дали начало 640 эфирам.
Для получения заданной концентрации индуктора использовали маточный раствор концентрацией 50 мМ, приготовленный на ДМСО (DMSO – диметилсульфоксид) (#D8418, Sigma-Aldrich). Как показали предварительные эксперименты, ДМСО в максимальной конечной концентрации 0.01% не оказывает влияние на функционирование и жизнеспособность полипов: интенсивность бесполого размножения в контроле и в эксперименте (с добавление 0.01% ДМСО) в течение 14 дней не отличалась. Полипы находились в растворе индуктора до стадии средней стробилы (когда цвет верхних зачатков эфир изменялся на красный) – в среднем 11–12 дней. Как правило, все пять полипов, индуцированных в одной группе, развивались с одинаковой скоростью и, соответственно, достигали стадии средней стробилы одновременно. В некоторых случаях скорость развития стробилы в одной группе отличалась. В таких случаях промывку и перенос полипов осуществляли, ориентируясь на время перехода к стадии средней стробилы первого полипа в группе. По достижении этой стадии, стробилы после трехкратной отмывки в 30 мл чистой морской воды переносили по одной в емкости с чистой искусственной морской водой до завершения отделения эфир.
Регистрация
Наблюдение за процессом стробиляции проводили ежедневно один раз в день. Поэтому полученные данные соответствуют “моментальному” состоянию полипов в момент изучения. Если количественные признаки между пятью полипами в одной емкости различались, то приводятся лимиты разброса этих признаков.
Наблюдение и съемку стробил и эфир проводили под бинокуляром МСП-1 (АО ЛОМО, Россия), оборудованным цифровой окулярной камерой DCM310 (Shangrao TeleView Optical Instruments, China) с использованием программного обеспечения ScopePhoto V. 3.1. Обработку изображений проводили в программе AdobePhotoshop (Adobe Inc.). Коррекция яркости, контраста осуществлялась применительно ко всему изображению.
При подсчете встречаемости отклонений в строении эфир, каждый из выделенных признаков учитывался один раз для каждой особи, даже если у нее данный признак повторялся. Например, если у эфиры сформировались две лопасти без ропалиев, то признак “отсутствие ропалия на лопасти” учитывался один раз. В то же время, если у одной эфиры наблюдалось несколько разных отклонений, то каждое из них учитывалось независимо от наличия других отклонений.
Сканирующая электронная микроскопия
Для изучения методом сканирующей электронной микроскопии стробилы фиксировали в 4% растворе параформальдегида на фосфатном буферном растворе (PBS). Перед фиксацией стробилы анестезировали в 3.5% растворе MgCl2 · 6Н2О в соотношении 1 : 1 с искусственной морской водой. После фиксации образцы постепенно обезвоживали в серии этанолов возрастающей концентрации и постепенно переводили в ацетон. Затем образцы высушивали в критической точке с помощью Hitachi Critical Point Dryer HCP-2 (Hitachi, Japan), напыляли золотом и платиной. Изучение проводили с помощью сканирующего электронного микроскопа Camscan-S2 (Jeol, Japan). Система оцифровки изображений: АЦП LCard под управлением программы MicroCapture (ООО “СМА”).
Статистическая обработка данных
Статистический анализ проведен в программной среде R (R Core Team, 2021) c использованием базового пакета “Stats” ver. 4.1.1 (R Core Team, 2021). Для оценки различия в соотношении аномалий использовали критерий независимости χ‑квадрат (Chi-Square test of independence). Для оценки зависимости общего количества эфир и количество отклонений на эфиру от концентрации был проведен регрессионный анализ. Эксперименты проведены в трех повторностях, по пять особей в каждом повторе. Всего проанализировано 640 эфир и 1264 аномалии.
Часть расчетов на основании первичных количественных данных были обработаны в программе для работы с электронными таблицами Microsoft Excel (Miscosoft).
РЕЗУЛЬТАТЫ
При проведении экспериментов по индукции стробиляции раствором индола полипов Aurelia aurita был выявлен ряд различий в процессе развития стробиляции, формирования эфир и последующего их отделения от материнских полипов при различных концентрациях использованного индуктора.
Процесс стробиляции
При индукции полипов растворами с минимальной концентрацией индуктора 5 нМ во всех повторностях экспериментов появление первых перетяжек – начало формирования зачатков эфир – наблюдали на четвертый день индукции. При повышении концентрации до 25 нМ–5 мкМ первая перетяжка закладывалась на третий день после начала индукции. Скорость закладки перетяжек, отделяющих последующие зачатки эфир, также различалась при изменении концентрации индуктора. На пятый день индукции у полипов, индуцированных растворами с концентрацией 5 нМ, формировались одна–две перетяжки; с концентрацией 25 нМ и выше – три–четыре перетяжки. На десятый день экспозиции отличие в скорости формирования зачатков эфир у полипов, индуцированных раствором с концентрацией 5 нМ, и у полипов, индуцированных растворами с более высокими концентрациями индуктора, усиливается. Так, в первой повторности экспериментов на десятый день индукции при концентрации индуктора 5 нМ у стробил сформировалось 5–7 перетяжек, при 25 нМ – 11–13 перетяжек, при 1 мкМ – 13–14 перетяжек, и при концентрации 5 мкМ – 14–16 перетяжек (табл. 1).
Таблица 1.
Сравнение развития процесса стробиляции при разных концентрациях индуктора (С) в трех сериях экспериментов. Числа соответствуют числу зачатков эфир в соответствующий день (Т) с начала индукции. Перекрестие обозначает завершение процесса отделения эфир. к – с образованием конгломератов неразделяющихся эфир

Во второй и третьей повторности экспериментов скорость закладки перетяжек у полипов при индукции раствором концентрацией 5 нМ была несколько ниже. На 10 день индукции при этой концентрации разброс в количестве перетяжек у разных полипов увеличился и составил от 3 до 7. При остальных концентрациях индуктора число формируемых у полипов перетяжек во второй и третьей серии экспериментов осталось таким же, как и в первой повторности эксперимента.
Стоит отметить, что при проведении второй и третьей повторностей экспериментов при индукции раствором индола 5 нМ один из десяти полипов не приступил к стробиляции. Еще три полипа приступили к стробиляции, но формирование эфир приостановилось до перехода на стадию средней стробилы (после формирования первых 3–4 перетяжек), то есть до начала формирования зачатков лопастей эфир и изменения цвета тканей. В итоге сформировавшиеся зачатки эфир отделились от указанных трех материнских полипов и трансформировались в дочерние полипы, которые сформировали щупальца и манубриумы (рис. 3). У остальных шести полипов переход к стадии средней стробилы растянулся от 13 до 15/16 сут с момента начала индукции. При этом у двух полипов наблюдали ситуацию, когда зачатки 3–5 первых эфир, сформированные на начальных стадиях стробиляции, дифференцировались гораздо быстрее, чем последующие зачатки. В результате стробила выглядела подразделенной на 2 части (рис. 4). Проксимальные зачатки в дальнейшем дифференцировались в эфиры с существенной задержкой.
Рис. 3.
Результат незавершенной стробиляции и отделения недоразвитых зачатков эфир от стробилы при индукции стробиляции 5 нМ 5-метокси-2-метилиндолом в третьем повторе эксперимента. (а) Начало формирования стробилы; стрелкой обозначена оральная часть стробилы с зачатками эфир; красноватые ткани верхней эфиры преобразуются в белые ткани полипа. (б) Материнский и дочерний полип, образовавшийся из зачатка эфиры. (в) дочерние полипы, образовавшиеся из зачатков эфир, отделившихся от стробилы. д – дочерние полипы, образовавшиеся в результате отделения зачатков эфиры, м – материнский полип. Длина масштабной линейки – 1 мм.
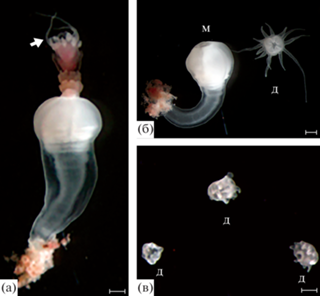
Рис. 4.
Варианты развития стробил, индуцированных раствором с концентрацией 5 нМ 5-метокси-2-метил-инлола во второй и третьей серии экспериментов. Часть эфир, расположенные ближе к оральной части полипа, развиваются быстрее, в то время как зачатки эфир, расположенные ближе к аборальной части тела полипа, развиваются с существенной задержкой. Скобками обозначены эфиры, находящиеся на поздних стадиях развития. Длина масштабной линейки – 1 мм.

На одиннадцатый день все полипы, индуцированные с помощью растворов с концентрациями от 25 нМ и выше, а также полипы, индуцированные с помощью раствора с концентрацией 5 нМ в первой серии экспериментов, достигали стадии средней стробилы: у верхних зачатков эфир начинали формироваться лопасти, ткани зачатков приобретали красно-оранжевый оттенок. Полипы, индуцированные раствором 5 нМ во второй и третьей серии экспериментов, развивались медленнее, оставаясь на 11-й день на стадии ранней стробилы. Стадии средней стробилы полипы при этой концентрации индуктора достигали на 13–15/16 день. Развитие зачатков эфир происходило по очереди, с сохранением тенденции орально-аборального направления развития стробилы. Полностью сформированные верхние эфиры отделялись от материнской особи еще до окончательного развития эфир, расположенных ближе к аборальной части тела стробилы.
Завершением стробиляции считалось отделение последней эфиры от материнской особи. В первой повторности экспериментов при индукции раствором концентрации 5 нМ стробиляция завершилась на 22 день, при концентрациях 25 нМ, 1 мкМ и 5 мкМ – на 19–20 день (табл. 1). В последующих двух повторностях экспериментов шесть полипов, индуцированные раствором с концентрацией 5 нМ, завершили процесс отделения эфир на 26–27 день, а полипы, индуцированные раствором с концентрацией индуктора 25 нМ и 1 мкМ – на 24 день, 5 мкМ – на 22 день.
При самой низкой концентрации индуктора (5 нМ) отмечено наименьшее среднее число отделившихся эфир во всех повторах – 35.3 ± 16.17 эфиры. При более высоких использованных концентрациях общее число сформированных и отделившихся эфир почти в два раза выше: при концентрации индуктора в 25 нМ в среднем было сформировано 59.3 ± 2.89 эфиры, при 1 мкМ – 63.6 ± 11.59 эфиры, и при 5 мкМ – 55 ± 8.89 эфиры. Однако, проведенный анализ показал отсутствие значимой зависимости общего числа эфир от используемой концентрации (p = 0.617) (рис. 5).
Эфиры
Во всех проведенных экспериментах при всех концентрациях индуктора наблюдалось формирование эфир с отклонениями от нормы. Доля эфир с теми или иными отклонениями, сформированных при индукции растворами различных концентраций, варьировала от 86 до 100%. Проанализировав строение эфир, полученных в результате химической индукции стробиляции в настоящих экспериментах, мы выделили 17 различных отклонений во внешней морфологии отделившихся эфир (рис. 6):
Рис. 6.
Отклонения в строении эфир, сформировавшихся в результате индукции стробиляции Aurelia aurita растворами 5-метокси-2-метилиндола различных концентраций. Цифры на рисунке соответствуют отклонениям в списке, приведенном в тексте. 1 – эфира с увеличенным количеством лопастей; 2 – эфира с уменьшенным количеством лопастей; 3 – эфира с лопастями, на которых отсутствуют ропалии; 4 – эфира с лопастью, на которой располагается два ропалия; 5.0, 5.1, 5.2 – эфира с лопастью с дополнительной, третьей краевой лопастью, расположенной между ее основными краевыми лопастями; данное отклонение разделяется на три типа: без ропалиев, с одном ропалием, с двумя ропалиями; 6.0, 6.1, 6.2 – эфира с лопастью с дополнительной краевой лопастью, раздвоенной на конце; данное отклонение так же разделено на три типа: без ропалиев, с одним ропалием, с двумя ропалиями; 7 – сдвоенная лопасть меньшего размера с ропалиями или без них; 8 – недоразвитая лопасть (меньшего размера), с ропалием или без него; 9 – основание недоразвитой лопасти: широкое короткое образование между двумя лопастями; 10 – длинный тонкий отросток между лопастями эфиры; 11 – эфира – манубриум, то есть эфира без лопастей (летальное отклонение); 12 – бесформенная эфира (летальное отклонение); 13 – эфира, постоянно находящаяся в “сжатом” состоянии (летальное отклонение). Стрелками на фотографиях указаны отклонения, соответствующие изображенным на схеме. Масштабная линейка – 1 мм.

1 – количество лопастей превышает 8;
2 – количество лопастей меньше 8;
3 – отсутствует ропалий на лопасти;
4 – два ропалия на одной лопасти, расположенные рядом друг с другом;
5 – лопасть с дополнительной, третьей краевой лопастью, расположенной между ее основными краевыми лопастями; данное отклонение мы разделили на три варианта: по двум сторонам от дополнительной краевой лопасти формируется два (5.2), один (5.1) либо ни одного ропалия (5.0);
6 – лопасть с дополнительной краевой лопастью, раздвоенной на конце, и расположенной между ее основными краевыми лопастями; в данном случае мы так же выделили три варианта: по двум сторонам от дополнительной раздвоенной краевой лопасти формируется два (6.2), один (6.1) либо ни одного (6.0) ропалия;
7 – сдвоенная лопасть меньшего размера, с ропалиями или без них;
8 – недоразвитая лопасть (меньшего размера) с ропалием или без него; как правило, такая лопасть лишена одной из краевых лопастей и имеет неправильную форму;
9 – основание недоразвитой лопасти: широкое короткое образование между двумя лопастями, без ропалиев и краевых лопастей; такая структура напоминает “оплавленные” лопасти, которые иногда упоминаются в литературе;
10 – длинный тонкий отросток между лопастями эфиры; данное образование имеет форму тонкого вытянутого конуса и не имеет ропалия или расширения на конце, в котором мог бы располагаться ропалий.
Вышеперечисленные отклонения, судя по всему, не могут служить препятствием к дальнейшему развитию эфир, в соответствие с наблюдениями Брауне (Browne, 1895), который утверждал, что изменение числа ропалиев и числа лопастей у эфир не мешает им благополучно вырастать во взрослых медуз. Поэтому эфиры с вышеперечисленными отклонениями (№№ 1–10) рассматривались нами как “жизнеспособные”.
Еще три наблюдавшихся отклонения в строении эфир выделяются среди остальных, поскольку существенно изменяли общий вид эфир. Такие отклонения мы рассматривали как летальные, делающие невозможным дальнейшее развитие эфир:
11 – эфира-манубриум: личинка, не имеющая ни одной лопасти, состоящая только из манубриума, слепо заканчивающегося зачатком зонтика;
12 – бесформенная эфира: “комок” тканей, не имеющий сколько-нибудь оформленных лопастей или манубриума;
13 – эфира, постоянно находящаяся в “сжатом” состоянии; такие эфиры не сокращались и не передвигались в толще воды.
Другие наблюдавшиеся отклонения от нормы при индукции стробиляции индолом выражались в нарушении процесса отделения эфир от материнского полипа. Такие нарушения стробиляции можно рассматривать и как вариант отклонения в строении эфир, однако точно определить варианты отклонений в строении самих эфир затруднительно. Все обнаруженные нарушения процесса стробиляции мы разделили на три варианта (рис. 6):
1от – от материнской особи отделялась группа эфир; четких границ между отдельными эфирами определить невозможно; такие эфиры не разделялись в дальнейшем и имели неправильное строение; некоторые полипы давали начало нескольким группам эфир, не отделившихся друг от друга;
2от – последняя сформировавшаяся на стробиле эфира (т.е., расположенная ближе всего к аборальному концу тела полипа) не отделялась от материнского полипа;
3от – последняя сформировавшаяся на стробиле эфира отделялась от материнского полипа вместе с частью тканей формирующейся оральной части тела полипа.
Нарушение в виде последней эфиры, которая не отделяется от материнского полипа, встречалось чаще при повышении концентрации индуктора. Так, при индукции раствором с концентрацией 5 нМ в среднем 26.6% полипов не отделяли последнюю эфиру, однако с повышением концентрации индола доля таких полипов возрастала и составляла 60, 66.6 и 86% при индукции растворами 25 нМ, 1 мкМ и 5 мкМ соответственно. Также при повышении концентрации индуктора с 5–25 нМ до 1–5 мкМ доля стробил, которые отделяли конгломераты эфир, возрастала с 13 до 53–66.6%. Эфиры, отделявшиеся вместе с частью тканей оральной части тела полипа, встречались только при индукции раствором с концентрацией 1 мкМ, и доля полипов с таким отклонением составила 20%.
Отделение группы эфир от материнской особи наблюдалось только во второй и третьей повторностях экспериментов, причем подобные конгломераты формировались во всех группах вне зависимости от концентрации индуктора в воде (рис. 7а). Такие конгломераты всегда формировались либо в самой нижней части стробилы, либо перед несколькими самыми аборальными зачатками эфир.
Рис. 7.
Нарушения процесса отделения эфир от стробилы. (а) Отделение группы эфир, которые в последующем не отделяются друг от друга; (б) стробила, не отделившая последнюю эфиру; (в) эфира, отделившаяся от материнского полипа с частью тканей оральной части тела материнской особи. Стрелками указаны оральные части тела материнского полипа. Масштабная линейка – 1 мм.

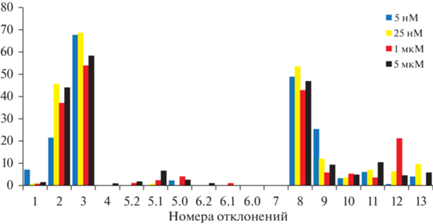
Во всех экспериментах наиболее часто встречающимся отклонением было отсутствие ропалия на лопасти (№ 3). Общее количество эфир с данным отклонением при различных концентрациях индуктора составило от 54 до 68.6% от всех эфир. Другими наиболее часто встречаемыми “жизнеспособными” отклонениями были меньшее количество лопастей (№ 2) и недоразвитые лопасти (№ 8) – от 21.76 до 46% и от 42.92 до 53.83% соответственно (рис. 8). Интересно, что увеличение числа лопастей наблюдалось редко. Вместе с тем начавшееся, но незавершенное развитие лопасти (№ 9), и лопасть измененной формы в виде тонкого выроста (№ 10), встречались достаточно часто. Остальные варианты отклонений, не приводящих к резкому снижению жизнеспособности эфир, встречались крайне редко.
Рис. 8.
Средняя частота встречаемости тех или иных отклонений (по оси абсцисс – номера отклонений) в строении эфир и в отделении эфир от стробилы при различных концентрациях индуктора.
Результат проведенного анализа показал, что доля наиболее часто встречавшихся типов отклонений (№№ 2, 3, 8 и 9) значимо различается при использовании различных концентраций индуктора (χ2 = 39.564, p < 0.01) (рис. 9). Наибольший вклад в формирование различий демонстрирует распределение долей при концентрации 5 нМ, при которой доля нормальных эфир и эфир с отклонением № 9 значимо больше, а доля эфир с отклонением № 2 – значимо меньше, чем при остальных используемых концентрациях. При этом три остальные концентрации по соотношению долей данных типов отклонений между собой не различаются (χ2 = 7.15, p = 0.52).
Рис. 9.
Распределение соотношений наиболее часто встреченных отклонений в строении эфир в зависимости от концентрации индуктора. По оси абсцисс – средняя доля данного отклонения (показана высотой столбика) в общем пуле отклонений для данной концентрации. По оси ординат – номера отклонений (0 – норма). Цветом выделены значения отклонений от ожидаемого распределения.

Анализ распределения частот отклонений по параметру жизнеспособности дал похожие результаты: при концентрации индуктора в 5 нМ наблюдалось значимо больше нормальных эфир и меньше эфир с нежизнеспособными отклонениями (χ2 = 39.092, p < 0.01), тогда как доля наблюдавшихся эфир с жизнеспособными отклонениями при всех использованных концентрациях индуктора оказалась сходной (рис. 10). В каждой серии экспериментов наблюдали некоторое увеличение доли эфир с летальными отклонениями (отклонения №№ 11–13) при повышении концентрации индуктора, однако разница была статистически недостоверна (рис. 11).
Рис. 10.
Распределение долей нормальных эфир, суммы долей эфир с нежизнеспособными отклонениями и суммы долей эфир с жизнеспособными в зависимости от концентрации индуктора. По оси абсцисс – доля данных отклонений (показана высотой столбика) в общем пуле отклонений для данной концентрации. По оси ординат – концентрации индуктора. Цветом выделены значения отклонений от ожидаемого распределения.

Рис. 11.
Соотношение долей (среднее значение по трем повторностям) эфир с нормальным строением
(◼), эфир с отклонениями ( ) и нежизнеспособных эфир (с летальными отклонениями) (
) и нежизнеспособных эфир (с летальными отклонениями) ( ) при индукции стробиляции различными концентрациями 5-метокси-2-метилиндола. Цифрами
над столбиками указано среднее число сформированных эфир в данной группе эксперимента.
) при индукции стробиляции различными концентрациями 5-метокси-2-метилиндола. Цифрами
над столбиками указано среднее число сформированных эфир в данной группе эксперимента.

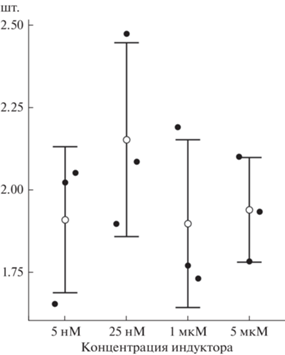
В большинстве случаев у одной эфиры одновременно наблюдали более одного отклонения, но среднее количество аномалий на эфиру для всех концентраций индуктора значимо не отличалось (p = 0.669) и близко к двум (рис. 12). Среди жизнеспособных эфир с отклонениями чаще в среднем наблюдали 2.60 ± 0.306 отклонения эфиру-1, что также не зависело от концентрации индуктора.
Рис. 12.
Сравнение количества отклонений на одну эфиру (по оси ординат, шт.) в зависимости от концентрации индуктора (по оси абсцисс). Светлые кружки – среднее значение по всем повторностям, черные кружки – среднее значение для каждой повторности, значения приведены с учетом стандартного отклонения.
Отклонения, заметные до начала отделения эфир от материнского полипа
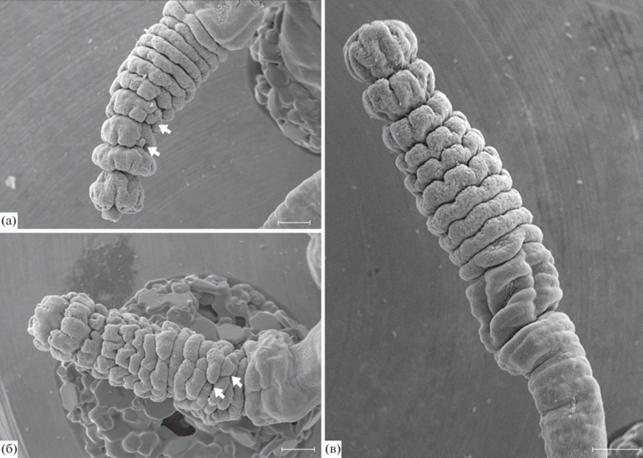
Внимательное наблюдение за процессом стробиляции показало, что нарушения формирования зачатков эфир становятся заметными уже на стадии средней стробилы, в тот момент, когда начинается формирование лопастей будущих эфир. Нарушения возникали независимо в разных частях стробилы, и у разных особей они носили индивидуальный характер. На рис. 13 видно, что зачатки эфир хаотично покрыты глубокими бороздами, придающими им неправильную форму.
Рис. 13.
Стробилы на стадии закладки лопастей эфир. СЭМ. (а, б) Разные стробилы на стадии средней стробилы с заметными отклонениями. (в) Стробила на стадии средней стробилы без заметных отклонений (норма). Стрелками указаны нарушения закладки лопастей, проявляющиеся в разных частях стробилы. Масштабная линейка – 0.3 мм.
ОБСУЖДЕНИЕ
“Естественная” индукция стробиляции Aurelia aurita требует продолжительного снижения температуры, не дает 100%-ый результат, и стробиляция полипов начинается не одновременно (Fuchs et al., 2014; Сухопутова, Краус, 2017). Поэтому в большинстве работ, посвященных вопросам регуляции жизненного цикла A. aurita, применяют индукцию с использованием различных концентраций 5-метокси-2-метилиндола, которые варьируют от 0.1 нМ до 50 мМ (Kuniyoshi et al., 2012; Helm, Dunn, 2017; Wang, 2017; Yamamori et al., 2017), что вызывает почти 100%-ю стробиляцию в течение 1–2-х дней (Kuniyoshi et al., 2012; Helm, Dunn, 2017; Wang, 2017; Yamamori et al., 2017). Однако практически ничего не известно о возможном влиянии данного индуктора на морфологию формирующихся эфир. В литературе также практически отсутствуют упоминания о возможном изменении процесса стробиляции при использовании химических индукторов. Лишь в одной работе указано, что при продолжительной инкубации полипов A. aurita в растворе 5-метокси-2-метилиндола стробиляция не останавливалась вплоть до полного подразделения тканей на зачатки эфир, которые на завершающей стадии имели неправильное строение из-за нехватки тканей. В этой же работе также указано, что у представителей подкласса Коронамедуз (Coronamedusae) 5-метокси-2-метилиндол вызывает стрессовую реакцию без последующего развития стробилы, а у некоторых представителей класса Кубомедуз (Cubozoa) высокие концентрации индуктора приводят к формированию эфир неправильного строения, что может свидетельствовать о токсическом воздействии 5-метокси-2-метилиндола (Helm, Dunn, 2017).
Как и сам процесс стробиляции в лабораторных условиях (Custance, 1964; Berking et al., 2005; Holst, 2012), воздействие индола как индуктора оказывается очень вариабельным и зависит от множества “неизвестных” факторов – индивидуального полипа, времени, температуры и т.п. Вполне возможно, что существенные отличия в частоте наблюдаемых отклонений от нормы в строении эфир и в самом процессе стробиляции при индукции индолом, выявленные в нашей работе, и в работе Хелм и Дана (Helm, Dunn, 2017), объясняются разным происхождением культур полипов. В нашей работе использована культура полипов, происходящая из Черного моря, содержащаяся в морской воде соленостью 18 промилле, в то время как в работе Хелм и Дана использована южно-японская культура, содержавшаяся в морской воде соленостью 35 промилле в университете г. Гамбурга. Другие известные работы, в которых использовали химическую индукцию стробиляции с применением 5-метокси-2-метилиндола, и в которых не было упоминаний о его токсическом влиянии, также проводили преимущественно на культурах A. aurita, полученных из разных мест. На культуре A. aurita из Роскофа была показана способность индола индуцировать стробиляцию с одинаковой вероятностью в диапазоне концентраций от 5 нМ до 50 мкМ (Fuchs et al., 2014; Wang, 2017). Не были отмечены отклонения в строении эфир и в работе с культурой полипов, полученных из Аквариума “Берч” (Сан Диего, Калифирния) (Gold et al., 2019), и отнесенных к виду Aurelia sp. 1 (на самом деле более близкому к виду A. limbata (Dawson, Jacobs, 2001; Dawson, 2003)). Индукцию стробиляции индолом использовали в работе по анализу транскриптомов различных стадий жизненного цикла культуры Aurelia, происходящей от полипов, собранных в бухте города Киль (Германия), Балтийское море (Khalturin et al., 2019). В этой же работе был отмечен высокий уровень генетического разнообразия внутри рода Aurelia по всему миру.
Полученные в настоящем исследовании данные об отклонениях в морфологии эфир A. aurita сложно сравнивать с имеющимися немногочисленными литературными данными. Каждый из исследователей анализировал отдельный определенный вариант наблюдаемых отклонений. В одном случае – это было отклонение в числе ропалиев и лопастей у эфир и числе ропалиев у молодых медуз от типичных восьми, проанализированное на двух больших выборках эфир в 359 и 1116 экземпляров, и двух выборках медуз в 383 и 3000 экземпляров (Browne, 1895, 1901). Сходные данные о вариациях в числе лопастей у эфир других авторов упоминаются в работе Беррилла (Berrill, 1949). Отклонения в строении лопастей эфир направленно не изучались, но есть отдельные упоминания об этом в работах Харгитта (Hargitt, 1901), и рисунки некоторых обнаруженных отклонений приводятся в работе Гершвин, где были проанализированы отклонения от 4-х-мерной симметрии на выборке эфир в 227 экземпляров, полученных в лаборатории, и 4-х выборках взрослых медуз из 4-х разных географических мест сбора объемом в 386, 108, 501 и 241 экземпляр (Gershwin, 1999).
Сравнение показывает, что из описанных в настоящей работе отклонений в строении эфир в литературных данных есть указания на отклонения №№ 1, 2, 3, 4, 5.2 и 7 (уменьшение или увеличение числа ропалиев и лопастей у эфиры, сдвоенные лопасти). Из этого можно сделать два вывода. Первый – отмеченные отклонения в строении эфир относятся к разряду отклонений, существенно не влияющих на “жизнеспособность” эфир. Соответствующие им отклонения в числе ропалиев обнаруживаются в естественных условиях и у медуз старшего возраста. Второй – появление данных отклонений не связано с химической индукцией, так как наблюдается и при естественной индукции стробиляции. Однако частота встречаемости указанных отклонений существенно различается в результатах наших лабораторных исследований (химическая индукция стробиляции), и в природных популяциях (естественная индукция стробиляции). Так, в природной популяции в окрестностях Плимут-Саунта (Англия) увеличение или уменьшение числа ропалиев встречается в среднем у 21% эфир A. aurita, при том, что 16.1% эфир имели больше восьми ропалиев (Browne, 1901). В настоящей работе чаще встречалось уменьшение числа ропалиев (рис. 8), а с учетом того, что уменьшение числа лопастей (при индукции различными концентрациями индола число эфир с числом лопастей менее восьми варьировало в пределах от 21.6 до 46%), так же значительно превалировало над увеличением числа лопастей (число эфир с увеличенным количеством лопастей ни разу не превысило 7.3%), доминирующим отклонением можно считать число ропалиев меньше восьми. Если согласиться с Брауне, что число ропалиев у эфиры соответствует числу ропалиев у медузы (оно не увеличивается при росте медузы) (Browne, 1895), то результаты наших экспериментов принципиально отличаются от данных, полученных на материале из естественных условий (без учета естественной летальности в процессе последующего развития эфир).
Другие “жизнеспособные” отклонения, часть из которых редко встречалась в эксперименте (№№ 5 и 6 – разные варианты дополнительных разделений лопастей на дистальных концах), а часть – достаточно часто (№№ 8–11 – различные варианты “недоразвитости” лопастей у эфиры) (рис. 6 и 8) не были отмечены в природных популяциях. Одна из возможных причин – эти отклонения встречаются у эфир крайне редко, и в процессе развития медузы “исчезают”. Рост зонтика медузы Aurelia происходит за счет “зарастания” промежутков между лопастями (Uchida, Nagao, 1963), поэтому подобные отклонения в строении лопастей просто сглаживаются, и могут “переходить” в разряд отклонений, связанных с числом и расположением ропалиев у медузы.
Еще две группы существенных отклонений в морфологии эфир, выявленные в настоящей работе при химической индукции стробиляции – это “нежизнеспособные” отклонения (№№ 11–13), и нарушение процесса стробиляции, приводящее к отделению “конгломератов” сросшихся зачатков эфир трех различных комбинаций (№№ 1от–3от). Первая из указанных групп, естественно, не может быть обнаружена в естественных популяциях, так как не ведет к дальнейшему развитию эфир. Случаи отклонений из второй группы – “конгломераты” сросшихся зачатков, в большинстве случаев также ведут к гибели зачатков. Но в некоторых случаях, на наш взгляд, такие “конгломераты” могут сохранять некоторое время жизнеспособность, и их развитие может приводить к появлению описанных в литературе “монстров”: эфир с дополнительными лопастями на верхней стороне эфиры (Browne, 1895) или эфир со спиральным краем зонтика (Vannucci, 1957).
Интересно, что отклонение в виде отделения от материнской особи группы эфир, которые не отделялись друг от друга в дальнейшем, было отмечено только у полипов во второй и третьей серии экспериментов. Существуют исследования, показывающие изменение реакции полипов A. aurita на температурную индукцию при изменении условий содержания культуры полипов (Сухопутова, Краус, 2017). Известно так же, что полипы во время стробиляции выделяют в воду вещества, способные оказывать влияние на протекание стробиляции других полипов. В разных лабораторных культурах полипов также отмечены случаи спонтанной стробиляции, а также изменения эффективности отработанных методов индукции стробиляции, которые не всегда удавалось связать с условиями содержания культур (см. обзор (Sukhoputova, Kraus, 2017)). В связи с этим можно предположить, что отличия результатов разных серий наших экспериментов могут быть следствием изменения физиологического состояния полипов вследствие изменения неконтролируемых факторов среды.
О зависимости влияния химической индукции стробиляции индолом от состояния полипов может свидетельствовать и полученный в данной работе факт, что результаты первой серии индукции отличаются от второй и третьей. Все серии экспериментов по индукции проводили последовательно, то есть в разное время. При этом между первой и второй повторами серий временной интервал был значительно более протяженным, в то время как второй и третий повторы серий были проведены практически одновременно. Как результат – различия в полученных данных между вторым и третьим повторами значительно меньше, чем между ними и первой серией. В первую очередь стоит отметить разницу в скорости развития стробиляции: во втором и третьем повторе экспериментов отделение эфир продолжилось во всех группах полипов на 2–5 дней дольше, чем в первой (табл. 1).
Более того, определенное значение в формировании эфир могут играть индивидуальные особенности отдельных полипов. Так, при индукции 1 мкМ раствором индола в первом повторе экспериментов полипы, индуцированные вместе в одной емкости, дали начало 18 эфирам с летальными отклонениями, 16 из которых оказались потомками одной стробилы. Эти данные в определенной степени подтверждают ранее высказанное предположение, что соседние полипы одного клона могут стробилировать одновременно рядом с разной и независимой степенью вариабельности (Gershwin, 1999). В этой же работе приводится пример того, что клональная культура из одного родительского организма показывала повышенную вариабельность. В своей работе Гершвин приводит данные, свидетельствующие о возможном влиянии “генетической компоненты” на вариабельность строения эфир и медуз: разброс вариабельности не одинаков в разных географических популяциях A. aurita (Gershwin, 1999).
Полученные в настоящей работе данные позволяют сделать предварительный вывод, что большинство “жизнеспособных” отклонений в морфологии эфир, формирующихся при химической индукции индолом в исследованном диапазоне, соответствуют отмеченным отклонениям, обнаруженным в естественных популяция Aurlia aurita, которые сформировались в результате естественной индукции стробиляции. Вместе с тем, при химической индукции наблюдалось возрастание частоты встречаемости отклонений по сравнению с естественными популяциями. Следовательно, можно предположить, что химическая индукция повышает частоту “естественных” ошибок процесса стробиляции. Происходит возрастание частоты нарушений пространственной разметки развивающегося зачатка (изменяется количество одинаковых частей (лопастей, ропалиев)), нарушаются процессы формообразования при трансформации тканей полипа в эфиры. Можно также предположить, что при химической индукции стробиляции увеличивается частота формирования “нежизнеспособных” отклонений, однако проверка этого утверждения требует проведения дополнительных лабораторных сравнительных экспериментов с химической и “естественной” индукцией стробиляции на однородном материале.
Вопрос о возможной зависимости эффекта воздействия индола от его концентрации остается открытым. В большинстве случаев наблюдаемые различия статистически недостоверны. Однозначно можно только утверждать, что при минимальной из испытанных концентраций индола (5 нМ) доля нормальных эфир без отклонений была статистически выше, чем при более высоких концентрациях индуктора, а доля эфир с “нежизнеспособными” отклонениями – минимальна.
Возможный дозо-зависимый эффект воздействия индола на процесс стробиляции проявляется в том, что при самой низкой концентрации индуктора стробиляция в ряде случаев начинается, но не заканчивается отделением нормальных эфир. При наименьшей испытанной концентрации процесс сегментации полипа иногда приводил к формированию неполного числа возможных зачатков, которые отделялись от материнского полипа, но дифференцировались в полипы, а не в эфиры (рис. 3). С возрастанием концентрации индола такой эффект исчезал при одновременном увеличении числа формируемых эфир (табл. 1). С другой стороны, при продолжительной инкубации полипов A. aurita в растворе индола концентрацией 50 мкM, стробиляция может не останавливаться до полного подразделения тканей на зачатки эфир; в результате зачатки эфир на завершающей стадии имели неправильное строение из-за нехватки тканей (Helm, Dunn, 2017).
То, что в большинстве случаев каждая эфира имела в среднем более двух вариантов отклонений, может указывать на взаимосвязь развития таких отклонений. То есть, формирование разных вариантов морфологических отклонений может быть связано либо с одними и теми же регуляторными механизмами, либо формирование одной структуры зависит от правильности развития предшествующей структуры. Однако достоверный анализ таких корреляций и выявление механизмов взаимосвязанного развития структур требует проведения экспериментов на значительно более многочисленной выборке с тщательной и детальной регистрацией всей истории развития каждой из эфир. Тем более, что ранее высказывалось мнение, что, по крайней мере, некоторые отклонения (изменение числа ропалиев), не оказывают влияние на другие части тела, которые могут варьировать независимо друг от друга (Browne, 1895).
Характер развития процесса стробиляции при химической индукции индолом подтвердил выявленный ранее факт, что индуцирующий сигнал распространяется от орального полюса к аборальному (Kroiher et al., 2000; Berking et al., 2005), а не проявляется одновременно по всей длине тела полипа. Вполне возможно, что сила индукции меняется “пропорционально” концентрации индуктора и времени экспозиции в растворе индуктора. При этом существует некоторая пороговая величина концентрации использованного индуктора (с учетом времени экспозиции). Воздействие индуктора в концентрации, превышающей пороговую, однозначно вызывает запуск процесса стробиляции (по принципу “все или ничего”). При концентрациях индуктора ниже пороговой – вероятность нормального (полноценного) развития процесса стробиляции снижается из-за ослабления индуцированного эндогенного сигнала. Полученные в данной работе данные в определенной мере подтверждают это предположение: число сформированных и отделившихся эфир при длительном воздействии индола в концентрации 5 нМ оказалось наименьшим, то есть данная концентрация использованного индуктора находится на уровне порогового значения. При увеличении концентрации индола число формируемых эфир увеличивается, но не существенно и не пропорционально концентрации. То есть экзогенный индуцирующий сигнал определенной величины или однозначно вызывает запуск процесса стробиляции всего полипа, или величина индуцированного эндогенного сигнала оказывается достаточной только для запуска процесса стробиляции на ограниченном участке, и процесс “затухает” без дополнительной стимулирующей экзогенной поддержки. Более того, воздействие индуктора в низкой концентрации вызывало “сегментацию” полипа, но не вызывало дифференцировки тканей полипа в эфиры. Это, на наш взгляд, служит подтверждением тому, что процессы подразделения тела материнского полипа на зачатки (диски) и дифференцировка зачатков в эфиры – это процессы, жестко не связанные друг с другом. Возможно, что и полноценное развитие эфиры зависит от “суммарной величины и продолжительности воздействия” экзогенного индуцирующего сигнала. То, что процессы “сегментации” полипа и дифференцировки тканей полипа в ткани эфиры – это различные явления, было показано еще в работах Кроэра с коллегами (Kroiher et al., 2000), которые показали, что “запуск” программы трансдифференцировки свойств тканей опережает видимую сегментацию полипа примерно на сутки. Возможно также, что процесс подразделения на диски и процесс дифференцировки в эфиры могут идти практически независимо друг от друга; по крайней мере – заключительная часть “сегментации” тела полипа – отделение – не зависит от того, начался и прошел ли процесс дифференцировки тканей. Так, ряд исследований показывает, что полипы, приступившие к сегментации после непродолжительного снижения температуры воды, могут не завершить ее, если их вернуть в привычные условия до начала формирования ропалиев у эфир. В таком случае, те ткани, которые уже были обособлены перетяжками, могут отделиться и превратиться в полипы (Berrill, 1949; Spangenberg, 1965a; Kakinuma, 1975). Однако, это возможно только до определенного критического момента, после которого даже искусственно отделенные от материнской особи диски завершают превращение в эфир.
Сравнивая эти данные с полученными результатами, можно выдвинуть предположение, что развитие тех или иных отклонений в процессе отделения эфир от стробилы зависит от времени ослабления сигнала, индуцирующего развитие стробиляции. Например, если полип находится на стадии ранней стробилы, то есть формирование зачатков лопастей эфир еще не началось, и упомянутый сигнальный фактор теряет свою силу (например, в результате деградации индуктора), то зачатки эфир отделяются от материнского полипа и превращаются в полипы. Такая ситуация наблюдалась при индукции стробиляции 5 нМ раствором индола во второй и третьей серии экспериментов. При чуть более высокой, но не пороговой концентрации индуктора, индуцирующий сигнал может ослабевать в момент перехода полипа к стадии средней стробилы. К этому моменту зачатки эфир, расположенные в верхней части стробилы, уже приступают к развитию лопастей, в то время как нижние зачатки остаются на начальных стадиях развития. В таком случае возможно формирование эфир с неправильным развитием, которые отделяются от материнской особи, но не отделяются друг от друга. Такая ситуация наблюдалась при индукции полипов во второй и третьей серии экспериментов. Стоит отметить, что при индукции стробиляции 5–25 нМ раствором индуктора такие группы эфир формировались у 20–40% полипов в двух сериях экспериментов. При индукции стробиляции 1–5 мкМ раствором индуктора подобное отклонение встретилось у 80–100% индуцированных полипов. Если же сигнал затухает ближе к аборальной части стробилы, последняя эфира оказывается неспособной завершить свое нормальное развитие из-за ослабления сигнала – дифференцировка тканей эфиры запускается, но не завершается полноценно. В результате она либо не отделяется от полипа, либо отделяется вместе с частью тканей материнского полипа.
ЗАКЛЮЧЕНИЕ
В результате проведенной работы проанализированы разнообразные отклонения в морфологии эфир, сформированных в результате химической индукции разными концентрациями 5-метокси-2-метилиндола клональных полипов Aurelia aurita из Черного моря. Полученные данные свидетельствуют, что большинство выявленных “жизнеспособных” отклонений соответствуют таковым, описанным в литературе. Однако, применение химической индукции повышает вероятность формирования эфир с отклонениями. Кроме того, показано формирование “нежизнеспособных” отклонений, обнаружение которых в естественных условиях практически невозможно. В подавляющем большинстве случаев у каждой из эфир наблюдался комплекс отклонений в строении, что может свидетельствовать о взаимосвязи формируемых отклонений. Высказано предположение, что влияние использованного химического индуктора на частоту формирования отклонений в морфологии эфир может иметь доза-зависимый эффект.
Список литературы
Бондарь Н.И. Сравнение становления полярности главной оси тела при бесполом размножении Aurelia sp. и Cassiopea sp. (Scyphozoa, Cnidaria) / Дипломная работа. МГУ им. М.В. Ломоносова. М., 2019. 67 с.
Догель В.А. Зоология беспозвоночных: Учебник для ун-тов. 7-е изд., перераб. и доп. / Под ред. Полянского Ю.И. М.: Высшая школа, 1981. 603 с.
Заика В.Е. Частота морфологических аномалий у медуз Aurelia aurita (L.) в Черном море // Морской экологический журн. 2005. Т. 4. № 2. С. 51–57.
Иванова-Казас О.М. Бесполое размножение животных. Ленинград: Издательство Ленинградского Университета, 1977. 240 с.
Сухопутова А.В. Гистологическое исследование способов бесполого размножения у Aurelia aurita (Scyphozoa) / Дипломная работа. МГУ им. М.В. Ломоносова. М., 2013. 71 с.
Сухопутова А.В., Краус Ю.А. Пластичность реакции полипов Aurelia aurita (Cnidaria, Scyphozoa) на сигнальный фактор, регулирующий их жизненный цикл // Зоологический журн. 2017. Т. 96. № 11. С. 1309–1318.
Berking S., Czech N., Gerharz M., Herrmann K., Hoffmann U., Raifer H., Sekul G., Siefker B., Sommerei A., Vedder F. A newly discovered oxidant defense system and its involvement in the development of Aurelia aurita (Scyphozoa, Cnidaria): reactive oxygen species and elemental iodine control medusa formation // Int. J. Dev. Biol. 2005. V. 49. № 8. P. 969–976.
Berking S., Herrmann K. Compartments in Scyphozoa // Int. J. Dev. Biol. 2007. V. 51. № 3. P. 221–228.
Berrill N.J. Developmental analysis of scyphomedusae // Biol. Rev. 1949. V. 24. № 4. P. 393–410.
Brekhman V., Malik A., Haas B., Sher N., Lotan T. Transcriptome profiling of the dynamic life cycle of the scypohozoan jellyfish Aurelia aurita // BMC Genomics. 2015. V. 16. № 1. P. 74.
Browne E.T. Memoirs: On the variation of the tentaculocysts of Aurelia aurita // J. Cell Sci. 1895. V. 2. № 147. P. 245–251.
Browne E.T. Variation in Aurelia aurita // Biometrika. 1901. V. 1. № 1. P. 90–108.
Brusca R.C., Brusca G.J. Invertebrates. Sunderland: Sinauer, 2003. 936 p.
Cabrales-Arellano P., Islas-Flores T., Thome P.E., Villa-nueva M.A. Indomethacin reproducibly induces metamorphosis in Cassiopea xamachana scyphistomae // PeerJ. 2017. V. 5. P. e2979.
Chernyshev A.V., Isaeva V.V. Formation of chaotic patterns of the gastrovascular system in the ontogenesis of the medusa Aurelia aurita // Russian J. Marine Biology. 2002. V. 28. № 5. P. 347–351.
Custance D.R.N. Light as an inhibitor of strobilation in Aurelia aurita // Nature. 1964. V. 204. № 4964. P. 1219–1220.
Dawson M.N. Macro-morphological variation among cryptic species of the moon jellyfish, Aurelia (Cnidaria: Scyphozoa) // Mar. Biol. 2003. V. 143. № 2. P. 369–379.
Dawson M.N., Jacobs D.K. Molecular evidence for cryptic species of Aurelia aurita (Cnidaria, Scyphozoa) // Biol. Bull. 2001. V. 200. № 1. P. 92–96.
Fuchs B., Wang W., Graspeuntner S., Li Y., Insua S., Herbst E.-M., Dirksen P., Böhm A.-M., Hemmrich G., Sommer F., Domazet-Loao T., Klostermeier Ulrich C., Anton-Erxleben F., Rosenstiel P., Bosch Thomas C.G., Khalturin K. Regulation of polyp-to-jellyfish transition in Aurelia aurita // Cur.Biol. 2014. V. 24. № 3. P. 263–273.
Genikhovich G. How do developmental programs evolve? // Old Questions and Young Approaches to Animal Evolution / Eds. Martin-Duran J.M., Vellutini B.C. Cham: Springer International Publishing, 2019. P. 73–106.
Gershwin L.A. Clonal and population variation in jellyfish symmetry // J. Marine Biol. Assoc. UK. 1999. V. 79. P. 993–1000.
Gold D.A., Katsuki T., Li Y., Yan X., Regulski M., Ibberson D., Holstein T., Steele R.E., Jacobs D.K., Greenspan R.J. The genome of the jellyfish Aurelia and the evolution of animal complexity // Nature Ecology & Evolution. 2019. V. 3. № 1. P. 96–104.
Gold D.A., Nakanishi N., Hensley N.M., Cozzolino K., Tabatabaee M., Martin M., Hartenstein V., Jacobs D.K. Structural and developmental disparity in the tentacles of the moon jellyfish Aurelia sp. 1 // PLoS One. 2015. V. 10. № 8. P. e0134741.
Hamner W.M., Jenssen R.M. Growth, degrowth, and irreversible cell differentiation in Aurelia aurita // Amer. Zool. 1974. V. 14. № 2. P. 833–849.
Hargitt C.W. Variation among hydromedusae // Biol. Bull. 1901. V. 2. № 5. P. 221–255.
Helm R.R., Dunn C.W. Indoles induce metamorphosis in a broad diversity of jellyfish, but not in a crown jelly (Coronatae) // PLoS One. 2017. V. 12. № 12. P. e0188601.
Holst S. Effects of climate warming on strobilation and ephyra production of North Sea scyphozoan jellyfish // Jellyfish Blooms IV. Developments in Hydrobiology / Eds. Purcell J. et al. Dordrecht: Springer, 2012. P. 127–140.
Kakinuma Y. An experimental study of the life cycle and organ differentiation of Aurelia aurita Lamarck // Bull. Mar. Biol. Stat. Asamushi. 1975. V. 15. № 3. P. 101–113.
Khalturin K., Shinzato C., Khalturina M., Hamada M., Fujie M., Koyanagi R., Kanda M., Goto H., Anton-Erxleben F., Toyokawa M., Toshino S., Satoh N. Medusozoan genomes inform the evolution of the jellyfish body plan // Nature Ecology & Evolution. 2019. V. 3. № 5. P. 811–822.
Kroiher M., Siefker B., Berking S. Induction of segmentation in polyps of Aurelia aurita (Scyphozoa, Cnidaria) into medusae and formation of mirror-image medusa anlagen // Int. J. Dev. Biol. 2000. V. 44. № 5. P. 485–490.
Kuniyoshi H., Okumura I., Kuroda R., Tsujita N., Arakawa K., Shoji J., Saito T., Osada H. Indomethacin induction of metamorphosis from the asexual stage to sexual stage in the moon jellyfish, Aurelia aurita // Bioscience, Biotechnology, and Biochemistry. 2012. V. 76. № 7. P. 1397–1400.
Miyake H., Iwao K., Kakinuma Y. Life history and environment of Aurelia aurita // South Pacific Study. 1997. V. 17. № 2. P. 273–285.
Nakanishi N., Yuan D., Hartenstein V., Jacobs D.K. Evolutionary origin of rhopalia: insights from cellular-level analyses of Otx and POU expression patterns in the developing rhopalial nervous system // Evol. Dev. 2010. V. 12. № 4. P. 404–415.
Nakanishi N., Yuan D., Jacobs D.K., Hartenstein V. Early development, pattern, and reorganisation of the planula nervous system in Aurelia (Cnidaria, Scyphozoa) // Dev. Genes Evol. 2008. V. 218. P. 511–524.
R Core Team R: A language and environment for statistical computing / R Foundation for Statistical Computing, Vienna, Austria. 2021. URL https://www.R-project.org/.
Spangenberg D.B. A study of strobilation in Aurelia aurita under controlled conditions // J. Exp. Zool. 1965a. V. 160. № 1. P. 1–9.
Spangenberg D.B. Cultivation of the life stages of Aurelia aurita under controlled conditions // J. Exp. Zool. 1965b. V. 159. № 3. P. 303–318.
Spangenberg D.B. Iodine induction of metamorphosis in Aurelia // J. Exp. Zool. 1967. V. 165. № 3. P. 441–449.
Spangenberg D.B. Thyroxine induced metamorphosis in Aurelia // J. Exp. Zool. 1971. V. 178. № 2. P. 183–194.
Spangenberg D.B. Rhopalium development in Aurelia aurita ephyrae // Coelenterate Biology: Recent Research on Cnidaria and Ctenophora / Eds. Williams R.B., Cornelius P.F.S., Hughes R.G., Robson E.A. Hydrobiologia. 1991. № 216. P. 45–49.
Straehler-Pohl I., Widmer C.L., Morandini A.C. Characterizations of juvenile stages of some semaeostome Scyphozoa (Cnidaria), with recognition of a new family (Phacellophoridae) // Zootaxa. 2011. V. 2741. № 1. P. 1–37.
Sukhoputova A.V., Kraus Y.A. Environmental factors inducing the transformation of polyp into medusae in Aurelia aurita (Scyphozoa) // Russian J. Developmental Biology. 2017. V. 48. № 2. P. 106–116.
Sukhoputova A.V., Kraus Y.A., Kirillova A.O., Markov A.V. Differentiation of the oral-aboral axis and body parts during life cycle transitions in Scyphozoa // Biol. Bull. Rev. 2019. V. 9. № 5. P. 412–431.
Technau U., Genikhovich G., Kraus J.E.M. Cnidaria // Evolutionary developmental biology of invertebrates. Springer. 2015. V. 1. P. 115–163.
Technau U., Steele R.E. Evolutionary crossroads in developmental biology: Cnidaria // Development. 2011. V. 138. № 8. P. 1447–1458.
Uchida V., Nagao Z. The metamorphosis of the scyphomedusa, Aurelia limbata (Brandt) // Annotationes Zoologicae Japonenses. 1963. V. 36. № 2. P. 83–91.
Vannucci M. Double monster ephyrae of Aurelia aurita // Nature. 1957. V. 179. № 4554. P. 326–327.
Wang W. Regulation of metamorphosis and the evolution of life cycles: insights from the common moon jelly Aurelia aurita: Dissertation / Bosch E.G.P.D.D.h.c.T., Khalturin Z.G.P.D.K. Universitatsbibliothek Kiel. Kiel, 2017. 116 p.
Yamamori L., Okuizumi K., Sato C., Ikeda S., Toyohara H. Comparison of the inducing effect of indole compounds on medusa formation in different classes of Medusozoa // Zool. Sci. 2017. V. 34. № 3. P. 173–178.
Yuan D., Nakanishi N., Jacobs D.K., Hartenstein V. Embryonic development and metamorphosis of the scyphozoan Aurelia // Dev. Genes Evol. 2008. V. 218. P. 525–539.
Zimmermann B., Robert N.S.M., Technau U., Simakov O. Ancient animal genome architecture reflects cell type identities // Nature Ecology & Evolution. 2019. V. 3. № 9. P. 1289–1293.
Дополнительные материалы отсутствуют.



