Онтогенез, 2022, T. 53, № 2, стр. 77-93
Эволюционная и индивидуальная пластичность консервативных сигнальных путей в развитии животных
a Московский государственный университет имени М.В. Ломоносова, биологический факультет,
кафедра эмбриологии
119923 Москва, ул. Ленинские Горы, 1, стр. 12, Россия
b Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: s.kremnyov@gmail.com
Поступила в редакцию 02.07.2021
После доработки 06.12.2021
Принята к публикации 10.12.2021
- EDN: CPJPUN
- DOI: 10.31857/S0475145022020112
Аннотация
В эволюционной биологии развития (EvoDevo) господствует представление о том, что сигнальные каскады, участвующие в регуляции ключевых процессов развития (становление осей тела, спецификация зародышевых листков, эмбриональная индукция), высоко консервативны. В то же время, имеются данные о том, что сигнальные пути, участвующие в регуляции процессов развития, крайне пластичны. В данном обзоре мы рассматриваем эволюционную и индивидуальную пластичность сигнальных каскадов, регулирующих некоторые онтогенетические процессы. Исследования пластичности молекулярных механизмов регуляции онтогенеза необходимы для понимания основных закономерностей эволюции животных, а также для внедрения и совершенствования прикладных биомедицинских технологий. Наш обзор позволит читателям с разных сторон взглянуть на концепцию “консервативности” молекулярных механизмов регуляции развития животных в онтогенезе и в эволюции.
ВВЕДЕНИЕ
Молекулярная разметка основных осей тела во время развития животных является основой для всех последующих событий, включая дифференцировку клеток, образование тканей и органов, а также правильное функционирование всех систем взрослого организма. Удивительным является тот факт, что животные с разным планом строения используют в ходе развития один и тот же инструментарий сигнальных каскадов. Каким образом Metazoa “научились” регулировать работу эволюционно консервативных сигнальных путей при формировании разных планов строения? Сравнительное изучение закономерностей молекулярной разметки плана строения у представителей разных таксонов Metazoa может пролить свет на поставленный вопрос (Willmore, 2012; Ereskovsky et al., 2013).
В ходе исследований в области эволюционной биологии развития (EvoDevo) было обнаружено, что большинство животных, находящихся далеко друг от друга на эволюционном древе, имеют общие семейства генов, регулирующие разметку плана строения в ходе эмбрионального развития. К таким генам относятся лиганды канонического Wnt каскада, вовлеченные у билатерий в спецификацию передне-задней оси, а у книдарий – в становление орально-аборальной оси (Petersen, Reddien, 2009). Также было показано наличие у книдарий генов-компонентов BMP-Chordin регуляторного молекулярного контура. Оказалось, что эти гены не только являются ортологами генов позвоночных. Их продукты у книдарий и позвоночных выполняют схожие функции: они вовлечены в становление второй оси тела, дорзовентральной у позвоночных и направительной у книдарий из класса Anthozoa (Bier, De Robertis, 2015; Genikhovich, Technau, 2017). В то же время, выявлены случаи, когда паттерны экспрессии гомологичных генов заметно различаются даже у представителей близких таксонов. Ярким примером этого являются различия в молекулярных механизмах определения осей конечности у разных тетрапод (Christen, Slack, 1998).
В недавнем прошлом большая часть усилий исследователей, работающих в области EvoDevo, была направлена на поиск таксон-специфических генов, которые были бы ответственны за возникновение таксон-специфических эволюционных новшеств. Однако, мнение о том, что новые таксоны животных возникали благодаря появлению новых генов, подвергается сомнению (Peterson, Davidson, 2000; Levine, Tjian, 2003). Появилось большое количество свидетельств того, что эволюция плана строения и молекулярная разметка зачатков отдельных органов основаны на пластичности генных регуляторных сетей и “внедрении” новых контуров регуляции активности уже имеющихся генов и сигнальных путей. Такие эволюционные изменения могут быть более значимыми, чем появление новых генов или изменение функций белков (Carroll, 2000; Levine, Tjian, 2003; Kherdjemil et al., 2016; Cary, Hinman, 2017; Seki et al., 2017; Genikhovich, 2019).
ЭВОЛЮЦИОННАЯ ПЛАСТИЧНОСТЬ BMP-CHORDIN МОЛЕКУЛЯРНОГО КОНТУРА ПРИ СТАНОВЛЕНИИ ВТОРОЙ ОСИ ТЕЛА
Как в эволюции появилось огромное разнообразие таксонов Metazoa – один из фундаментальных вопросов биологии. Появление билатеральности у животных было важным эволюционным переходом, который мог послужить предпосылкой диверсификации планов строения (Genikhovich, Technau, 2017). Все животные, кроме четырех типов (Porifera, Ctenophora, Placozoa и Cnidaria) составляют кладу, отличительной чертой которых является двусторонняя симметрия тела. Билатеральная симметрия достигается за счет пересечения двух ортогональных осей тела: передне-задней (А-Р) и дорзально-вентральной (D-V). Система координат, задаваемая молекулярной разметкой тела эмбриона вдоль этих осей, а также расстоянием от средней линии тела, позволяет точно контролировать формирование плана строения, в том числе взаимное расположение отдельных структур и органов.
Среди базальных групп Metazoa, тип Cnidaria уникален тем, что он включает животных как с двусторонней, так и радиальной симметрией. Представители подтипа Medusozoa, состоящего из классов Hydrozoa, Scyphozoa, Cubozoa и Staurozoa, обладают радиальной симметрией и единственной орально-аборальной (О-А) осью тела. В то же время представители класса Anthozoa имеют вторую (направительную) ось, ориентированную вдоль щелевидной глотки. Билатеральность плана строения Anthozoa также проявляется в расположении продольных септ (мезентериев) гастральной полости. Становление дорзо-вентральной оси у билатеральных животных и направительной оси у Anthozoa регулируется молекулярным контуром BMP-Chordin. Так как книдарии являются сестринской группой билатерий, возникает вопрос, функционировал ли регуляторный контур BMP-Chordin уже у общего предка книдарий и билатерий или такой способ установления билатеральности тела появился независимо в эволюции Anthozoa и Bilateria (Genikhovich, Technau, 2017).
Рассмотрим особенности работы сигнального каскада BMP при становлении оси тела. Ключевым моментом для понимании механизмов разметки тела билатерий вдоль D-V оси стала идентификация гомологичных белков Short gastrulation (Sog) у дрозофилы и Chordin у шпорцевой лягушки. Функцией данных белков оказалась инактивация BMP лигандов, предотвращающая их взаимодействие с рецепторами. Крайне важной особенностью этих BMP-связывающих белков, которая отличает их от других антагонистов BMP (Gremlin или Noggin), является способность комплексов BMP-Chordin и BMP-Sog к диффузии на большие расстояния. Однако такой комплекс может быть разрушен металлопротеазой Tolloid, в результате чего высвобождается лиганд BMP. Если расщепление комплекса происходит рядом с источником Chordin (или Sog), то высвобождаемый BMP опять будет связан. Однако если расщепление происходит на расстоянии от источника Chordin (или Sog), то лиганд BMP может связаться со своим рецептором прежде, чем будет инактивирован. Таким образом, Chordin у шпорцевой лягушки и Sog у дрозофилы ингибируют BMP сигнальный каскад в области своей экспрессии, но активируют его на расстоянии. Работа белков Chordin (или Sog) по созданию максимума сигнала BMP в области, удаленной от источника Chordin (Sog), получила название “челночной функции” (“shuttling”) (Wang, Ferguson, 2005; Shilo et al., 2013; Bier, De Robertis, 2015).
В данном разделе мы рассматриваем разнообразие роли BMP сигнального каскада в становлении D-V оси у беспозвоночных животных. Поэтому мы сосредоточимся на описании разметки D-V оси у дрозофилы, а не у другого модельного объекта – амфибии Xenopus laevis. У дрозофилы вентро-дорзальная разметка тела инициируется материнским морфогеном Dorsal (Dl). На вентральной стороне эмбриона, в самой высокой точке своей концентрации, Dl индуцирует спецификацию мезодермы. Нейроэктодерма дифференцируется при средней концентрации Dl, а эмбриональный эпидермис – при самой низкой концентрации Dl. При отсутствии Dl на дорзальной стороне эмбриона формируются внезародышевые ткани. Dl транспортируется в ядра на вентральной стороне эмбриона под действием Toll сигнального каскада. Гены “первичного ответа” на Dl в дорзальной и латеральной областях эмбриона активируют гены, участвующие в создании градиента BMP. Внутриклеточная часть BMP сигнального каскада дрозофилы аналогична таковой у позвоночных. Компонентами этого сигнального каскада у дрозофилы являются два рецептора BMP типа I и один рецептор BMP типа II, продукт гена Punt. Внутри клетки, к нижестоящим генам-мишеням, сигнал передается фосфорилированными молекулами Mad (ортолог белка SMAD1/5 позвоночных) и Medea (ортолог белка SMAD4 позвоночных). Важно отметить, что в отличие от позвоночных, в процессе формирования D-V оси у дрозофилы участвуют только два лиганда BMP. Это упомянутый выше Dpp (ортолог BMP2/4), экспрессирующийся на дорзальной стороне, и Screw (ортолог BMP5-8), равномерно экспрессирующийся по всему эмбриону (рис. 1а). У дрозофилы Sog (ортолог белка Chordin) – единственный секретируемый антагонист BMP каскада. Надо отметить, что BMP регуляторный контур шпорцевой лягушки имеет более сложную структуру, хотя и содержит такой же центральный модуль Chordin-BMP, как у дрозофилы. Chordin-BMP система шпорцевой лягушки включает в себя четыре типа лигандов BMP. Два из них экспрессируются вентрально (BMP4 и BMP7), а два – дорзально (BMP2 и ADMP) (Bier, De Robertis, 2015) (рис. 1б).
Рис. 1.
(а) Схема BMP сигнального каскада у дрозофилы (по Bier, De Robertis, 2015). Пояснения в тексте. (б, в) Молекулярные контуры BMP-Chordin у шпорцевой лягушки Xenopus и книдарии Nematostella соответственно. Синими линиями отмечены регуляции на транскрипционном уровне, черными линиями отмечены белок-белковые взаимодействия, красной линией отмечена функция переносчика Chordin (по Genikhovich et al., 2015).

Регуляторный контур Chordin-BMP не является уникальным признаком Bilateria. Такой вывод можно сделать на основе анализа доступных геномных и траскриптомных баз данных. Дело в том, что ортологи Chordin, BMP2/4 и BMP5-8, а также все внутриклеточные компоненты сигнального пути BMP присутствуют у всех изученных видов двусторонне-симметричных книдарий (класс Anthozoa). Регуляция становления второй (направительной) оси у них зависит от активности сигнального каскада BMP, точно так же как у билатерий, (Hayward et al., 2002; Finnerty et al., 2004; Rentzsch et al., 2006; Saina et al., 2009; Genikhovich et al., 2015). К сожалению, единственной моделью, доступной для изучения становления взаимно перпендикулярных осей тела у книдарий, является Nematostella vectensis. У Nematostella, в отличии от дрозофилы и шпорцевой лягушки, BMP4 и Chordin сначала формируют радиально симметричный паттерн экспрессии (Rentzsch et al., 2006). Однако челночная функция Chordin способствует становлению направительной оси тела, на каждом из полюсов которой формируются два сигнальных центра со своим собственным набором лигандов и антагонистов каскада BMP. BMP4 и BMP5-8 экспрессируются вместе с Chordin на одной стороне эмбриона, а GDF5-подобный белок вместе с Gremlin экспрессируется на противоположной стороне (Saina, et al., 2009; Genikhovich et al., 2015) (рис. 1в). Как и у билатерий, эти секретируемые факторы организуют регуляторный молекулярный контур, участвующий в формировании градиента активности BMP каскада вдоль направительной оси. Функциональные эксперименты на эмбрионах Nematostella четко указывают на то, что Chordin перемещает лиганды BMP из областей, экспрессирующих Chordin, на противоположную сторону эмбриона, где формируется максимум активности BMP каскада (Genikhovich et al., 2015). Экспериментальное подавление передачи сигналов BMP у Nematostella приводит к нарушению формирования направительной оси и радиализации тела на молекулярном и морфологическом уровне. Важно отметить, что радиализация тела может быть достигнута не только с помощью нокаута любого из двух ключевых генов лигандов BMP (BMP4 и BMP5-8). К такому же результату приводит нокаут Chordin, который предотвращает челночный перенос лигандов BMP (Genikhovich et al., 2015). Однако до сих пор остается неясно, появились ли молекулярные контуры BMP-Chordin, связанные со становлением второй оси тела, но различающиеся структурой, независимо у билатерий и книдарий. Можно предположить, что две оси тела имел уже их общий предок, а структура молекулярных контуров BMP-Chordin дивергировала позднее, в ходе независимой эволюции этих групп. Для прояснения этого вопроса необходимо выяснить как эволюционировал план строения радиально-симметричных представителей книдарий из группы Medusozoa, а также какова роль BMP каскада в определении главных осей тела у Medusozoa (Genikhovich, Technau, 2017).
Книдарии из группы Medusozoa (классы Hydrozoa, Scyphosoa, Cubozoa, Staurozoa) имеют радиально симметричный план строения и только одну – орально-аборальную (О-А) – ось тела. К настоящему времени доступны несколько транскриптомов и два генома представителей Medusozoa (Hydra и Clytia) (Chapman et al., 2010; Leclère et al., 2019). Их анализ указывает на наличие у Medusozoa лигандов BMP, секретируемых антагонистов BMP, протеаз Tolloid, рецепторов BMP и всех внутриклеточных компонентов каскада BMP. Однако мы пока не знаем, какие функции выполняет каскад BMP в развитии этой группы книдарий. Более того, мы очень мало знаем о том, каков паттерн активности BMP каскада в развитии эмбриона и у взрослых Medusozoa. У взрослых полипов Hydra и Clytia BMP5-8 экспрессируется в области формирования щупалец (Reinhardt et al., 2004; Kraus et al., 2015), кроме того, у гидры BMP5-8 экспрессируется в области почкования и регенерации орального конца (Reinhardt et al., 2004). BMP2/4 также был идентифицирован у Hydra (Watanabe et al., 2004), Podocoryne (Reber-Muller et al., 2006) и Clytia (Leclère et al., 2019). Однако детальный филогенетический анализ ставит под сомнение тот факт, что BMP2/4 гидроидов является настоящим ортологом BMP2/4 Anthozoa (Genikhovich, Technau, 2017). Любопытно, что только у гидры был найден Chordin-подобный белок (HyChdl). Однако у HyChdl отсутствует (возможно, был потерян) N-концевой участок молекулы с цистеин богатым доменом, который присутствует у белков Chordin других животных. Кроме того, у HyChdl присутствует дополнительный домен связывания инсулинподобного фактора роста (IGFBP) и фоллистатиновый домен (Rentzsch et al., 2007). Оверэкспрессия HyChdl приводит к дорсализации эмбрионов костистой рыбы Danio rerio, а это значит, что HyChdl обладает свойствами антагониста BMP сигнального каскада. Однако филогенетический анализ белков Chordin показал, что Chordin Nematostella группируется с белками Chordin/Sog билатерально-симметричных животных, в то время как HyChdl формирует сестринскую группу к ним и другим Chordin-подобным молекулам билатерий (Genikhovich, Technau, 2017). Ортологи Chordin не были обнаружены и в геноме гидроида Clytia (Leclère et al., 2019). Среди представителей Scyphozoa, настоящий Chordin был идентифицирован в транскриптоме Aurelia (Genikhovich, Technau, 2017; Brekhman et al., 2015). Однако, в отличие от гидроидных, у Aurelia в ходе эволюции был утерян BMP2/4 (Kraus et al., 2015).
Суммируя эмпирические данные и данные компьютерного моделирования (Gaikovich et al., 2015), можно предположить, что функциональная активность молекулярного контура Chordin-BMP является ключевой для появления в эволюции второй оси тела. Тогда потеря одного из компонентов данного молекулярного контура могла привести к потере билатерального плана строения, что мы и наблюдаем у книдарий из группы Medusozoa (Genikhovich, Technau, 2017). Однако не все так очевидно. Встречаются представители билатерально симметричных животных, которые в ходе эволюции потеряли один из компонентов Chordin-BMP каскада, но сохранили билатеральный план строения.
Например, в геноме пиявки Helobdella был утерян Chordin, центральный участник Chordin-BMP молекулярного контура. Однако пиявки обладают некоторыми уникальными особенностями развития. Важную роль в их эмбриогенезе играет упорядоченное расположение клеточных клонов. Сегментарная эктодерма и мезодерма формируются из зоны роста, расположенной на заднем конце тела. Зона роста состоит из пяти пар стволовых клеток (телобласты M, N, O/P, O/P и Q). Каждый телобласт многократно и асимметрично делится, давая начало ряду клеток-основателей (первичные бластоциты). В дорзо-постериорной области эмбриона латеральные ряды клеток начинают формировать левую и правую зародышевую полоски (рис. 2). По мере того, как телобласты продолжают добавлять бластоциты с заднего конца, зародышевые полоски смещаются в вентро-вегетативном направлении, объединяясь вдоль будущей вентральной средней линии и формируя зародышевую пластинку. Сегментарная эктодерма формируется из четырех эктодермальных клонов (N, O, P, и Q) (Weisblat, Shankland, 1985). Четыре эктодермальных ряда клеток (обозначены буквами q, p, o и n соответственно) располагаются друг за другом вдоль D-V оси каждой зародышевой полоски в соответствии с их проспективным значением (Weisblat et al., 1984) (рис. 2в). Несмотря на общую детерминированность развития Helobdella, имеются экспериментальные данные о том, что именно контакт с самым дорсальным рядом клеток q определяет судьбу соседних бластоцитов, возникающих из стволовых клеток O/P (Huang, Weisblat, 1996; Kuo, Shankland, 2004). Авторы одной из работ предположили, что по аналогии с формированием D-V разметки тела у других первичноротых животных, BMP каскад может участвовать в этом процессе и у Helobdella, а источники сигнала в данном случае – клетки-производные телобласта Q (Kuo, Weisblat, 2011). Авторы сначала исследовали паттерны экспрессии BMP лигандов и их антагонистов в ходе развития Helobdella. На стадиях, когда у Helobdella предположительно происходит разметка D-V оси экспрессируются четыре лиганда BMP (Hau-admp, Hau-bmp2/4a, Hau-bmp2/4b, Hau-bmp5–8) и один антагонист (Hau-gremlin). Ген Chordin отсутствует в геноме Helobdella. Исследование паттернов экспрессии идентифицированных компонентов BMP каскада с помощью гибридизации in situ показало, что ADMP, BMP2/4a и BMP2/4b экспрессируются равномерно вдоль обоих зародышевых полосок. Напротив, BMP5–8 экспрессируется только в ряде q, самом дорзальном ряде клеток зародышевой полоски. Полученные результаты позволили предположить, что BMP5–8 является основным лигандом, участвующем в D-V разметке сегментарной эктодермы пиявок, хотя у большинства других исследованных видов BMP2/4 является центральным BMP лигандом, участвующем в установлении D-V оси тела. Более того, и у позвоночных, и у плоских червей, ADMP и BMP2/4 экспрессируются на одном из полюсов D-V оси тела. Полярная экспрессия этих генов поддерживается за счет авторегуляторной обратной связи (Reversade, De Robertis, 2005; Gavino, Reddien, 2011; Molina et al., 2011) (рис. 1б, 1в). Так как в зародышевых полосках Hellobdella паттерны экспрессии этих генов колокализованы, авторегуляторная обратная связь в развитии пиявок работать не может.
Рис. 2.
Схема развития пиявки Helobdella. (а) Спецификация дорзо-вентральной оси происходит в результате сегрегации телоплазмы (серый цвет) в бластомерах квдранта D (стадии 1–6), а затем в пяти симметрично расположенных пар телобластов (стадия 7). Телобласты дают начало левой и правой зародышевым полоскам, покрытым эпителием, который в свою очередь формируется из микромеров (ранняя стадия 8). Впоследствии зародышевые полоски сливаются, формируя зародышевую пластинку (поздняя стадия 8). (б) Эмбрион на ранней стадии 8. Стрелки указывают на движения зародышевых полосок при формировании зародышевой пластинки. Красным прямоугольником выделена часть зародышевой полоски, показанной на (в) (из Kuo, Weisblat, 2011, лицензия 5197760854830 от 28 ноября 2021 г.).

Неожиданным оказался факт, что Gremlin на высоком уровне специфически экспрессируется в ряду клеток p, а не в вентральных клетках зародышевой полоски. Ряд p является соседом дорзального ряда q и плотно к нему прилегает (рис. 2в). Надо отметить, до этой работы не были известны примеры участия Gremlin в определении D-V оси у других животных.
На основе экспериментальных данных авторы предложили следующую модель D-V разметки зародышевых полосок у Helobdella (рис. 3) (Kuo, Weisblat, 2011). Экспрессия BMP5–8 в дорзальном ряду клеток q приводит к активации BMP сигнального каскада в соседнем ряду p. Активация каскада BMP приводит к активации экспрессии BMP антагониста Gremlin в клетках ряда p. В свою очередь, Gremlin, за счет связывания BMP2/4, понижает активность BMP каскада в клетках ряда о. Активность BMP каскада в клетках ряда р, несмотря на экспрессию в них Gremlin, все равно остается высокой, так как Gremlin специфично инактивирует только BMP2/4, но не BMP5–8. Такая последовательность событий приводит к дифференцировке клеток рядов p и o. Например, в клетках ряда p этот процесс приводит к запуску экспрессии Six1/2a, а в клетках ряда о – Pax6a. Интересно отметить, что в данной системе антагонист BMP, Gremlin, способен инактивировать специфический лиганд BMP. В то же время, Chordin, антагонист BMP, участвующий в разметке D-V оси большинства изученных животных, не имеет специфичности, и способен инактивировать все лиганды BMP (Gline et al., 2009). Таким образом, специфичность взаимодействий лиганд-антагонист является ключевой для формирования D-V разметки сегментарной эктодермы пиявки.
Рис. 3.
Схема спецификации дорзо-вентральной оси зародышевой полоски у пиявки Helobdella. (1) Близкодействующее взаимодействие клеточного ряда q на клеточный ряд p опосредованное BMP5–8; (2) BMP5–8 запускает спецификацию клеток ряда p (красный), включая повышение экспресии Gremlin; (3) активность Gremlin определяет судьбу клеток в ряду o (yellow) путем ингибирования BMP2/4 (из Kuo, Weisblat, 2011, лицензия 5197760854830 от 28 ноября 2021 г.).

Остается нерешенным вопрос, что именно привело к перестройке молекулярного контура BMP-Chordin у пиявок. Скорее всего, молекулярный каскад BMP в данном случае подстраивался в ходе эволюции к изменениям эмбрионального развития и пространственного расположения эмбриональных зачатков. В какой-то момент топология эмбриональных зачатков у пиявок изменилась настолько, что механизмы разметки с помощью дальнодействующих взаимодействий стали утрачивать эффективность. Это сделало возможной потерю ключевых компонентов сигнального каскада, обеспечивающего такие взаимодействия. В данном случае это произошло с Chordin. Таким образом, мы можем наблюдать эволюционные изменения в архитектуре молекулярного контура в ответ на изменение морфогенезов эмбрионального развития. Радикальная перестройка каскада BMP-Chordin у пиявок не привела к потере признака, определяющего план строения данной группы – билатеральности.
Надо отметить, что потеря BMP-Chordin регуляторного контура характерна не для всех представителей Lophotrochozoa: компоненты данного каскада были выявлены у моллюсков Crassostrea gigas (Tan et al., 2017) и Lottia gigantea (Kuo, Weisblat, 2011). У C. gigas была выявлена экспрессия ортолога BMP2/4 на дорзальной стороне, а Chordin на вентральной. Функциональных исследований работы данного сигнального каскада у представителей Lophotrochozoa проведено не было. Однако данных уже достаточно для того, чтобы отвергнуть гипотезу об уникальном механизме дорзовентральной разметки у Lophotrochozoa. Полученных данных также достаточно для поддержки гипотезы о том, что BMP2/4 и Chordin использовались для становления D-V оси тела у общего предка всех билатерий.
Более загадочным случаем является модификация BMP-Chordin контура у осы Nasonia vitripennis. Было показано, что Nasonia использует уникальный способ формирования и уточнения градиента BMP, который отличается от характерного для Drosophila (Özüak et al., 2014a). Отличительной чертой BMP регуляторного контура у Nasonia является отсутствие компонента Sog (ортолога Chordin). Ген Sog отсутствует в геноме Nasonia (Özüak et al., 2014b). Ортологи Sog/Chordin присутствуют в геномах большинства животных и важны для формирования градиентов BMP на различных стадиях развития организма. В настоящее время остается открытым вопрос о том, как у Nasonia динамика передачи сигналов BMP регулируется в отсутствие транспортной системы Sog. Для решения этого вопроса важна идентификация фактора, который необходим для первичного становления дорзовентральной асимметрии Nasonia. Напомним, что у Drosophila становление этой асимметрии обеспечивается фактором Toll, который регулирует экспрессию Sog, Dpp и Tld. Поскольку у Nasonia активность BMP каскада абсолютно не зависит от Toll, вероятно используется другой, еще не открытый, способ первоначального нарушения D-V симметрии. Таким образом, у Nasonia роль сигнальной системы BMP в регуляции становления дорзовентральной разметки тела кардинально отличается от той, которая характерна для других модельных объектов.
У пиявки движущим фактором модификации регуляторного контура BMP каскада стало изменение эмбрионального развития. Это не могло быть причиной эволюции молекулярных механизмов дорзовентральной разметки тела у Nаsonia. Nasonia относится к группе насекомых, которые, как и Drosophila, имеют длинную зародышевую полоску. Топология эмбриональных зачатков, а также клеточные механизмы раннего развития Nasonia и Drosophila мало чем различаются.
В ходе недавних исследований была найдена еще одна группа насекомых, у которых отсутствует ген Sog. Это сверчки рода Gryllus. Никаких антагонистов BMP, которые могли бы выполнять роль, аналогичную роли Sog, на данный момент, у сверчков не найдено. Самым неожиданным является тот факт, что у сверчков, в отличие от Nasonia, фактор Toll участвует в активации BMP каскада. Данные результаты позволяют предположить, что у сверчков в дорзовентральной разметке тела все-таки может участвовать антагонист BMP, однако до сих пор его не смогли идентифицировать (Pechmann et al., 2021).
Интересно отметить, что у мышей, мутантных по гену Chrd, D-V ось устанавливается, если только эмбрион не погибает на ранних стадиях развития. Это может свидетельствовать о наличии “подстраховочных” механизмов, обеспечивающих функционирование BMP-Chordin регуляторного контура. Однако у выживших мышей генотипа Chrd–/– наблюдаются нарушения формирования глоточного региона (Bachiller et al., 2003). Можно предположить, что система Chordin-BMP является примером “глубокой гомологии” механизмов формирования глоточного региона: у книдарий из класса Anthozoa становление направительной оси определяет в первую очередь морфогенез глотки.
Разнообразие исследованных видов животных и полученные данные о структуре и функционировании регуляторного контура BMP, участвующего у них в дорзовентральной разметке, указывают на наличие “подстраховочных” механизмов и/или альтернативных способах регуляции. Таким образом, потеря одного из компонентов данного регуляторного контура не обязательно приводит к утрате билатеральности.
Имеющиеся данные позволяют усомниться в том, что модификация BMP сигнального каскада – первопричина перехода от радиального-симметричного плана строения к билатеральному (и обратно). Модификации BMP каскада могут являться следствием давления естественного отбора, направленного на поддержание того или иного плана строения (например, радиального у Medusozoa). Некоторые авторы предполагают, что симметрия тела является адаптивным признаком (Hollo, 2017). Соответственно, устойчивое формирование адаптивного плана строения поддерживается отбором. Это означает, что в ходе эволюции отбираются те механизмы развития (морфогенезы, молекулярная разметка осей тела), которые позволяют стабильно формировать билатеральный план строения (или переходить к радиальному плану строения). Таким образом, отбор в ходе эволюции плана строения идет по морфологическим признакам, но не по отдельным генам, а пластичность генетического инструментария является предпосылкой, обеспечивающей устойчивое формирование признаков в развитии.
ЭВОЛЮЦИОННАЯ ПЛАСТИЧНОСТЬ РАЗМЕТКИ НЕРВНОЙ ТРУБКИ ПОЗВОНОЧНЫХ: SHH СИГНАЛЬНЫЙ КАСКАД
Для головного и спинного мозга позвоночных характерны региональные функциональные и структурные различия, проявляющиеся вдоль дорзовентральной оси тела. Эти различия формируются в развитии в результате уникальной комбинаторной экспрессии генов в клетках-предшественниках нервной трубки, что, в свою очередь, приводит к дифференцировке различных типов нейронов (Goulding et al., 2002). Предполагается, что паттерн экспрессии генов вдоль D-V оси нервной трубки позвоночных является результатом тонкой настройки работы сигнальных каскадов, связанной с градиентами секретируемых морфогенов (Briscoe, Blassberg, 2013). В центральной нервной системе морфоген Sonic Hedgehog (Shh) формирует вентро-дорзальный градиент и экспрессируется в клетках дна нервной пластинки и хорде. Первичная разметка нервной трубки является классическим примером индукционного процесса в развитии животных. По общепринятым представлениям, хорда, расположенная под нервной трубкой, продуцирует Shh, который, в свою очередь, индуцирует производство Shh в клетках дна нервной трубки. Таким образом, устанавливается дорзовентральный градиент распределения этого морфогена с максимальной концентрацией в области его экспрессии. Данная классическая модель сформировалась на основе результатов экспериментов по пересадкам фрагментов уже сформированной хорды, в которых была выявлена ее способность индуцировать морфологическую дифференцировку дна нервной трубки (van Straaten et al., 1988; Smith, Schoenwolf, 1989). После открытия Shh (Riddle et al., 1993) и его индуцирующей способности (Echelard et al., 1993), сложилось представление о том, что именно хорда является индуктором дифференцировки дна нервной трубки, а индуцирующим агентом является Shh.
Если рассматривать события с точки зрения классической модели, градиент Shh индуцирует формирование дорзовентрального градиента активности транскрипционных факторов семейства Gli, которые вместе с Sox2 участвуют в дальнейшей разметке нервной трубки (Peterson et al., 2012). Морфогены Wnt и BMP формируют противоположно направленный дорзовентральный градиент, экспрессируясь в крыше нервной трубки и покровной эктодерме (Liem et al., 1995; Megason, McMahon, 2002; Chizhikov, Millen, 2005) (рис. 4а).
Рис. 4.
Становление градиента Shh в вентральной части нервной трубки позвоночных определяет поэтапную активацию регуляторных транскрипционных факторов в прогенеторных клетках нейронов разных типов. (а) Вдоль дорзо-вентральной оси вентральной части нервной трубки расположены шесть доменов прогениторных клеток FP, p3, pMN, p2, p1 и p0, из которых развиваются нейроны V0–V3 и MN. Пространственная организация прогениторных доменов в вентральной части нервной трубки устанавливается градиентом Shh, который секретируется хордой и дном нервной трубки. За разметку дорзальной части нервной трубки отвечают противонаправленный градиент BMP и Wnt. Каждый прогенеторный домен экспрессирует уникальную комбинацию транскрипционных факторов Nkx2.2, Olig2, Nkx6.1, Nkx6.2, Dbx1, Dbx2, Irx3, Pax6 и Pax7. (б) Транскрипционные факторы Olig2 и Nkx2.2, а также сам Shh определяют три самых вентральных прогенеторных домена (pMN, p3 и FP соответственно). Экспрессия каждого из этих маркеров запускается в последовательные моменты времени развития нервной трубки по средней линии. Экспрессия каждого маркера сдвигается в дорзальном направлении при активации экспрессии следующего маркера на средней линии. Данные события происходят вследствие накопления и расширения градиента морфогена Shh в вентральной части нервной трубки. Nc – хорда, FP – дно нервной пластинки, RP – крыша нервной трубки.

Комбинация активности морфогенов и их мишеней (напр. Pax7, Pax6, Nkx2.2, Olig2, Ddx1, Nkx6.2 и др.), приводят к высокоточной разметке нервной трубки на отдельные регионы вдоль дорзовентральной оси, в которых происходит спецификация определенных подтипов нейронов (Jessell, 2000). Ключевым морфогеном в данном процессе считается именно Shh. Выделяют шесть регионов-предшественников разных подтипов нейронов, расположенных вдоль дорзовентральной оси нервной трубки: дно нервной трубки (FP), pMN, p2, p1, и p0 домены (рис. 4а). Эти домены возникают последовательно в ходе развития нервной трубки в зависимости от накопления и распределения сигнала Shh (Jeong, McMahon, 2005), изначальным источником которого является хорда (рис. 4б).
Исследование индукционных свойств хорды и ее способности формировать молекулярную разметку соседних тканей является крайне важным для понимания основополагающих принципов эмбриональной индукции (Anderson, Stern, 2016) и развития нервной системы позвоночных. Однако универсальность роли хорды как организатора ставится под сомнение некоторыми авторами (Le Douarin, Halpern, 2000; Patten et al., 2003). Например, у особей D. rerio, мутантных по гену no tail (ортолог brachyury), нарушено развитие хорды, но дно нервной трубки развивается у них нормально (Halpern, 1993). Точно так же, развитие дна нервной трубки не было нарушено у эмбрионов, у которых была механически удалена прогениторная область хорды (Shih, Fraser, 1996). Более того, на D. rerio было показано, что активность сигнального каскада Shh не существенна для индукции дифференцировки клеток дна нервной трубки, а эктопическая оверэкспрессия Shh не приводит к их эктопической дифференцировке (Schauerte et al., 1998). На эмбрионах Xenopus было показано, что у бесхвостых амфибий активность Shh слабо регулирует экспрессию генов дна нервной трубки, но при этом оказывает сильное влияние на экспрессию латеральных транскрипционных факторов, таких как Nkx2.2 (Peyrot et al., 2011).
Наконец, пластичность механизмов индукции дифференцировки дна нервной трубки подтверждается в экспериментах на органоидах, полученных из эмбриональных стволовых клеток мыши. Было показано, что обработка ретиноевой кислотой дорзализованных органоидов приводит к спонтанному нарушению симметрии органоида и формированию дорзовентрального паттерна экспрессии Shh, а также транскрипционных факторов, размечающих дно нервной трубки. Таким образом, продемонстрирована возможность автономной разметки нервной трубки в отсутствии внешних организаторов, в частности хорды (Ranga et al., 2016; Ishihara et al., 2017).
Несмотря на наличие противоречивых данные о хорде, как источнике сигнала, необходимого для дифференцировки дна нервной трубки, начальные стадии экспрессии Shh в развитии позвоночных до недавнего времени не были подробно исследованы. Данный пробел был заполнен в нашей работе (Kremnyov et al., 2018), посвященной сравнительному исследованию начальных этапов экспрессии Shh в развитии трех позвоночных: кролика, курицы и шпорцевой лягушки.
Было показано, что паттерн экспрессии Shh в ходе развития кролика полностью согласуется с классическими взглядами на дорсовентральную разметку нервной трубки позвоночных. Сначала экспрессия Shh детектируется в хорде, а позже экспрессия Shh начинается в клетках дна нервной пластинки. Такая динамика экспрессии Shh дает основания предполагать, что в хорда выступает организатором, запускающим экспрессию Shh в дне нервной трубки.
Однако динамика экспрессии Shh в ходе развития цыпленка и кролика имеет существенные различия. У эмбрионов цыпленка на стадии 5 HH (таблица нормального развития; Hamburger, Hamilton, 1951), которые начинают формирование хорды, экспрессия Shh образует полосу вдоль срединной линии эмбриона, впереди от гензеновского узелка, а экспрессия в гензеновском узелке имеет лево-правую асимметрию (рис. 5а). При подробном исследовании паттернов экспрессии на срезах, было показано, что задние Shh-положительные ткани лежат непосредственно над Shh-негативной хордой (рис. 5б). В серединной области тела эмбриона осевая мезодерма, и нейроэктодерма Shh-позитивны. В передней области Shh экспрессируется только в прехордальной пластинке, а передняя нейроэктодерма остается негативной. Таким образом, формирующаяся хорда не экспрессирует Shh, его экспрессия запускается позже в процессе развития хорды. Shh в нервной пластинке детектируется на высоком уровне в задней области, там, где не наблюдается экспрессии Shh в подлежащей хорде. Такой паттерн экспрессии Shh у эмбриона курицы ставит под сомнение представления классической модели дорсовентральной разметки нервной трубки.
Рис. 5.
Пространственная динамика экспрессии Shh в развитии курицы. (а, в): тотальные препараты эмбрионов на стадии 5 (а), и 2+/3– (в); сагиттальный срез эмбриона на стадии 5 (б); (г, д) поперечные срезы эмбрионов на стадии 2+/3– HH на уровнях указанных на (в). На (а) стрелка указывает на положение гензеновского узелка; на (в) стрелкой указана антериорная граница первичной полоски. Обозначения: fp – дно нервной трубки, am – осевая мезодерма, n – узелок, pm – прехордальная мезодерма (из Kremnyov et al., 2018, используется по лицензии CC BY 4.0).

Shh экспрессируется в презумптивной области дна нервной трубки с самого начала формирования хорды. Поэтому встает вопрос, начинается ли экспрессия Shh до формирования гензеновского узелка и прехордальной пластинки? Удивительно, но сигнал Shh детектируется уже со стадии 2–3 HH (рис. 5в–5д). На данной стадии первичная полоска представляет собой сгущение клеток, вытянутое в направлении от заднего полюса к середине бластодиска. Ранее было показано, что на этой стадии область перед первичной полоской является областью презумптивного дна нервной трубки (Lopez-Sanchez et al., 2001). Именно в этой области выявляется сильная экспрессия Shh. Детальное исследование экспрессии Shh на этих стадиях было проведено на срезах (рис. 5г, 5д). Полученные данные говорят о том, что экспрессия Shh в области дна нервной трубки начинается еще до формирования хорды и, возможно, в данном случае, дно нервной трубки индуцирует экспрессию Shh в хорде (рис. 6). Таким образом, классическая модель дорзовентральной разметки нервной трубки не может быть применена к развитию птиц в той форме, в которой она представлена в учебниках для всех позвоночных (рис. 6а).
Рис. 6.
(а) Классическая универсальная модель становления дорзовентрального градиента Shh в нервной трубке у позвоночных. Согласно данной модели, хорда, расположенная под нервной трубкой, продуцирует Shh, который в свою очередь индуцирует выработку Shh в клетках дна нервной трубки. (б) Модификация модели молекулярной разметки нервной трубки у птиц, предложенная в работе Kremnyov et al., 2018. Согласно данной модели для экспрессии Shh в дне нервной трубке у птиц не требуется получения индукционного сигнала от подлежащей хорды. Экспрессия Shh у птиц в хорде наблюдается уже после ее активации в дне нервной трубки. Можно предположить, что если в данной модели имеются индукционные взаимодействия между клетками дна нервной трубки и хорды, то индукция идет в обратном направлении в сравнении с классической моделью: клетки дна нервной трубки индуцируют экспрессию Shh хорде (по Kremnyov et al., 2019).

Безусловно, полученные недавно результаты ставят новый вопрос: имеется ли вероятность того, что у птиц индукцию разметки нервной трубки осуществляет другой представитель семейства морфогенов Hedgehog. Однако оказалось, что на исследованных стадиях развития (4–17 HH) экспрессия Ihh (Indian Hedgehog) и Dhh (Desert Hedgehog) не детектируется ни в хорде, ни в дне нервной трубки.
У шпорцевой лягушки экспрессия Shh в нервной пластинке детектируется уже на стадии поздней гаструлы. Следовательно, индукция экспрессии Shh в дне нервной трубки лягушки начинается рано, задолго до сворачивания нервной трубки. Однако до сих пор остается неизвестным, индуцируется ли ранняя экспрессия Shh в дне нервной трубки амфибий дорсальной мезодермой. Имеются свидетельства того, что экспрессия Shh в дне нервной пластинки лягушки активируется по умолчанию. Это происходит даже на фоне подавления активности Shh с помощью морфолино олигонуклеотидов или циклопомина (Peyrot et al., 2011). Эти данные являются весомым аргументом в пользу первичной активации экспрессии Shh в клетках дна нервной пластинки. В этой же работе имеются дополнительные свидетельства в пользу первичной активации Shh в нервной пластинке. В экспериментах по активации Notch сигнального каскада в развитии Xenopus были получены эмбрионы с нарушениями формирования осевого комплекса, у которых отсутствовала корреляция между экспрессией Shh в клетках дна нервной трубки и подлежащей хорды. Так, у эмбрионов, хорда которых не была сформирована, а мезодермальные источники сигналов Shh отсутствовали, в нервной пластинке наблюдалась экспрессия Shh. В то же время, у тех эмбрионов, у которых экспрессия Shh наблюдалась в хорде, экспрессия Shh в нервной пластинке отсутствовала (Peyrot et al., 2011).
Данные по пространственному паттерну экспрессии Shh, полученные на шпорцевой лягушке, позволяют предположить, что разметка нервной трубки у амфибий идет в планарной плоскости, вдоль медио-латеральной оси, а не вдоль дорзовентральной, как описывает классическая модель, вероятно справедливая для развития млекопитающих. Такой вариант разметки нервной трубки может быть связан с особенностями еe формирования у амфибий. У них она формируется только путем сворачивания нервной пластинки. В отличии от амфибий, у млекопитающих нейруляция идет как путем сворачивания эпителиального пласта в более передних областях эмбриона (первичная нейруляция), так и путем кавитации (вторичная нейруляция). Таким образом, можно предположить, что топографические особенности развития нервной системы амфибий определяют особенности ее молекулярной разметки.
Имеется небольшое количество данных по динамике экспрессии генов Hedgehog у представителей низших хордовых. У ланцетника был описан один ген этого семейства (Shimeld et al., 1999), в то время как у асцидии Ciona intestinalis было обнаружено два паралога Hedgehog (Ci-hh1 and Ci-hh2), которые появились в результате независимой дупликации (Takatori et al., 2020). Анализ пространственной экспрессии этих генов в развитии Ciona показал, что транскрипты Ci-hh1 присутствуют в зиготе, но на стадии гаструлы уже не детектируются методом гибридизации in situ. Ci-hh2 экспрессируется в вентральных клетках нервной трубки, а в хорде его экспрессия не детектируется ни на одной стадии развития. Экспрессия гена Hedgehog у асцидий в вентральных клетках нервной трубки может быть связана с ранней детерминацией клеточных клонов и уменьшением роли индукционных взаимодействий в их развитии. У ланцетника экспрессия Hedgehog наблюдается сначала в эндодерме и хорде, а уже потом в дне нервной трубки. С учетом филогенетического положения ланцетника, именно таким мог быть предковый механизм индукции дифференцировки дна нервной трубки (Shimeld et al., 1999). Однако, данные для ланцетника были получены методом гибридизации in situ на целых эмбрионах. Для подтверждения полученных данных должно быть проведено исследование паттерна экспрессии Hedgehog на срезах.
Сравнительный анализ паттернов экспрессии гена Hedgehog в развитии хордовых указывает на эволюционные различия в свойствах хорды как организатора, участвующего в разметке нервной трубки и дифференцировке ее дна (рис. 7). Некоторые авторы предполагают, что тип спецификации дна нервной трубки у хордовых подстраивается под изменяющуюся топографию тканей, взаимодействующих в процессе гаструляции и формирования хорды. Это свидетельствует об эволюционной пластичности процессов ранней эмбриональной индукции (Kremnyov et al., 2018).
Рис. 7.
Паттерн экспрессии Shh в ходе развития осевых структур хордовых в контексте эволюции. 1 – Kremnyov et al., 2019, 2 – Chamberlain et al., 2008, 3 – Krauss et al., 1993, 4 – Takatori et al., 2002, 5 – Shimeld, 1999 (по Kremnyov et al., 2019).
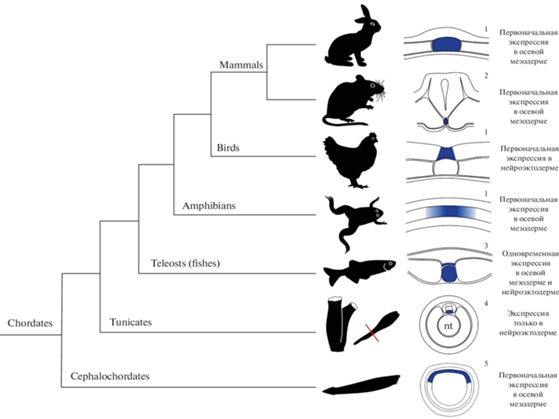
Большинство исследований, посвященных молекулярным механизмам дорзовентральной разметки нервной трубки, проводят на эмбрионах курицы. Выявленные закономерности экстраполируют на всех позвоночных животных, считая их архетипическими. Полученные результаты даже пытаются применять при исследовании регенерации спинного мозга млекопитающих (Demers et al., 2016). Однако анализ имеющихся данных позволяет сделать вывод, что механизмы разметки нервной трубки принципиально различаются у птиц и млекопитающих, хотя конечный результат развития практически совпадает (Kremnyov et al., 2018).
ИНДИВИДУАЛЬНАЯ ПЛАСТИЧНОСТЬ СИГНАЛЬНЫХ ПУТЕЙ ПРИ ДИФФЕРЕНЦИРОВКЕ ЭНДОДЕРМЫ
Структура генных регуляторных сетей в развитии животных должна обладать достаточной эволюционной пластичностью. Это необходимая предпосылка для возникновения эволюционных инноваций, ответа на давление отбора и генетического дрейфа (Félix, Wagner, 2008; Peter, Davidson, 2011). Предполагается, что именно генетическая изменчивость, чаще всего нейтральная по отношению к приспособленности организма, обеспечивает пластичность структуры и работы генных регуляторных сетей (Félix, Wagner, 2008). Исследования лабораторных линий и штаммов модельных организмов внесли огромный вклад в понимание работы ключевых узлов генных регуляторных сетей в разнообразных процессах развития (Oliveri et al., 2008; Peter et al., 2017). Однако такой подход не позволяет раскрыть эволюционную роль пластичности этих сетей. Изменчивость функций и архитектуры генных регуляторных сетей может быть выявлена путем анализа фенотипических различий, которые являются результатом естественной генетической изменчивости, присутствующей в отдельных изолятах того или иного вида (Phinchongsakuldit et al., 2004; Milloz et al., 2008; Nunes et al., 2013). Как должны быть устроены генные регуляторные сети, чтобы обеспечивать устойчивость процессов развития? Структура каких узлов этих сетей является пластичной, а каких – “закреплена” более жестко?
Свойства генных регуляторных сетей наиболее перспективно изучать на модельных системах, которые возникли на ранних этапах эволюции. Одной из таких удачных моделей может служить процесс дифференцировки эндодермы, которая возникла еще до появления билатерально симметричных животных, около 600 млн лет назад (Peterson et al., 2004). Несомненно, генные регуляторные сети, участвующие в спецификации эндодермы у современных животных, претерпели существенные модификации за долгий период эволюции. Однако транскрипционный аппарат дифференцировки эндодермы имеет общие черты у представителей всех ветвей филогенетического древа Metazoa. Например, каскады факторов транскрипции семейства GATA участвуют в развитии эндодермы не только у трехслойных животных, но и у большинства остальных Metazoa, включая книдарий (Davidson et al., 2002; Martindale et al., 2004; Boyle, Seaver, 2010). Одно из исследований, подтверждающих консервативность регуляторного механизма спецификации энтодермы, показало, что фактор из семейства GATA нематоды C. elegans, END-1, способен активировать развитие эндодермы из клеток презумптивной эктодермы шпорцевой лягушки (Shoichet et al., 2000). Эти результаты указывают на то, что транскрипционные факторы GATA участвовали в формировании эндодермы еще у общего предка нематод и позвоночных.
Нематода C. elegans имеет детерминированное развитие. В ходе дробления, в результате нескольких асимметричных делений, возникает несколько клеток предшественников: AB, MS, E, C, D и P4 (рис. 8). Кишечник C. elegans полностью формируется из бластомера Е (Sulston et al., 1983). Детерминированное развитие представляет собой высоко воспроизводимую систему. Этот тип развития предоставляет уникальные возможности для изучения спецификации и дифференцировки эндодермы. На сегодняшний день мы достаточно подробно представляем картину генных регуляторных сетей участвующих в дифференцировке эндодермы лабораторной линии N2. Каскад дифференцировки начинается с того, что материнский фактор SKN-1/Nrf активирует экспрессию GATA-подобных факторов MED (MesEnDoderm)-1 и MED-2, а также канонических GATA факторов END-3 и END-1. Далее этот процесс приводит к активации ELT-7 и ELT-2 в бластомере Е, которые участвуют в морфогенезe кишечника и дифференцировке его клеток (Sommermann et al., 2010; Dineen et al., 2018). Однако факторы SKN-1 и MED-1/2 активируются не только в бластомере Е, но и в сестринском бластомере MS, в котором они участвуют в дифференцировке мезодермы (рис. 8).
Рис. 8.
Асимметричные деления дробления эмбриона Caenorhabditis elegans и генная регуляторная сеть дифференцировки эндодрмы. (а) В ходе асимметричных делений дробления эмбриона C. elegans возникают шесть клеток-основателей, каждая из которых дает начало определенным типам тканей. На четырехклеточной стадии SKN-1 активирует гены MED-1,2, инициируя спецификацию мезэндодермальной клетки (EMS). Соседний к ней бластомер P2 поляризует клетку EMS (индукция показана стрелкой) за счет сигналов Wnt/MAPK/Src. (б) На антериорном полюсе EMS клетки POP-1 подавляют экспрессию генов END-1 и END-2, а MED-1,2 включает Tbx-35, который в свою очередь определяет судьбу дочерней мезодермальной клетки MS. На постериорном полюсе EMS клетки киназа LIT-1 в ответ на индукционные сигналы бластомера P2 фосфолирирует POP-1*, превращая его из репрессора в активатор дифференцировки эндодермы из дочернего бластомера E. Далее, факторы дифференцировки ELT-7 и ELT-2 регулируют экспрессию генов, ответственных за спецификацию эндодермы (по Ewe et al., 2020).

Для запуска механизма дифференцировки бластомера E по пути эндодермы необходима работа сигнального каскада Wnt/MAPK/Src. Активация этого механизма происходит в тот момент, когда бластомер P2 индуцирует поляризацию мезэндодермальной клетки EMS, а в результате происходит регион-специфическая активация POP-1/TCF (Phillips et al., 2007; Owraghi et al., 2010). Далее в клетке MS POP-1 подавляет экспрессию END-1 и END-2, блокируя дифференцировку этой клетки в направлении эндодермы. В то же время, индукционный сигнал, исходящей от клетки P2, приводит к фосфорилированию POP-1 в более задней клетке E, превращая POP-1 из ингибитора эндодермы в активатора.
Регуляторные взаимодействия между SKN-1 и POP-1, который является эффекторной молекулой Wnt каскада, демонстрируют значительное разнообразие у видов нематод рода Caenorhabditis, которые разошлись около 30 млн лет назад. Таким образом, для ключевого узла генной регуляторной сети дифференцировки эндодермы характерна высокая эволюционная пластичность. Было показано, что нокдаун гена SKN-1 у С. elegans приводит к подавлению дифференцировки производных бластомера MS и отсутствию кишечника у развивающихся эмбрионов. При нокдауне гена POP-1 происходит дифференцировка второго эктопического кишечника из клетки MS. Совершенно другую картину можно наблюдать при нокдауне этих генов у C. briggsae. Подавление экспрессии гена SKN-1 приводит у нее к отсутствию формирования кишечника и не влияет на формирование производных бластомера MS. В то же время подавление экспрессии POP-1 приводит к трансформации E бластомера в MS и отсутствию кишечника. Полученные результаты ярко демонстрируют, что у видов рода Caenorhabditis интеграция Wnt-зависимых и Wnt-независимых траекторий определения судьбы клеток может идти разными путями (Lin et al., 2009).
Каковы генетические механизмы, регулирующие пластичность генных регуляторных сетей эндодермы у представителей одного вида? Авторы одного из исследований попытались ответить на этот вопрос используя методы количественной генетики в сочетании с методами молекулярной биологии развития (Cleuren et al., 2019). Для этого они создали широкую коллекцию изотипов (инбредных вариантов) C. elegans, что позволило получить платформу для анализа эволюции сложных признаков и модификации генных регуляторных сетей в развитии С. elegans.
Эти авторы показали, что у С. elegans имеется высокая внутривидовая изменчивость механизмов активации генной регуляторной сети спецификации эндодермы. Они начали работу с исследования роли центрального узла генной регуляторной сети SKN-1 у разных линий С. elegans. Для этого использовались методы интрогрессии мутантых аллелей генов и РНК интерференции (RNAi). RNAi SKN-1 приводит к 100% смертности эмбрионов стандартной лабораторной линии N2. Однако у 30% эмбрионов успевал дифференцироваться кишечник. Оценку количества эмбрионов с дифференцированным кишечником проводили по наличию специфичных для кишечника гранул рабдитина, экспрессии специфических маркеров elt-2::GFP и промежуточных филаментов IFB-2. Далее авторы проверили необходимость SKN-1 для спецификации эндодермы у большого количества изолятов С. elegans. У всех изолятов, кроме гавайского штамма CB4852 RNAi SKN-1 приводила к 100% смертности эмбрионов, однако количество эмбрионов с развитым кишечником сильно различалось и варьировало от 0.9 до 60% для разных линий. При интрогрессии мутантного аллеля SKN-1 авторы получали сходный результат. Также в работе было показано, что доля особей, у которых успевает дифференцироваться кишечник после RNAi SKN-1, не зависит от филогенетического положения и географического происхождения линий. Полученные результаты показывают, что сигнальные системы активации генной регуляторной сети спецификации эндодермы у С. elegans подвержены крайне быстрой дивергенции, то есть обладают высокой эволюционной пластичностью.
Итак, было показано, что роли SKN-1 и Wnt в генной регуляторной сети эндодермы различаются у C. elegans и C. briggsae, а SKN-1 имеет разное значение для спецификации эндодермы в разных изолятах C. elegans. Эти данные позволяют предположить, что и активность Wnt каскада при дифференцировке эндодермы может различаться между изолятами C. elegans. Следующим шагом данного исследования было выяснение роли лиганда MOM-2/Wnt в дифференцировке эндодермы у тех же диких изолятов, которые были протестированы в экспериментах с подавлением экспрессии SKN-1. При RNAi MOM-2 кишечник формировался у 40–99% эмбрионов, в зависимости от изолята. Корреляций между наборами фенотипов, полученных в результате RNAi MOM-2, и филогенетическим положением/географическим распределением изолятов C. elegans также выявлено не было. То есть у филогенетически (географически) удаленных друг от друга линий могли наблюдаться одинаковые наборы фенотипов. Подавление экспрессии POP-1, хоть и было летальным для всех изолятов, не влияло на подавление процесса спецификации эндодермы. Количественный генетический анализ природных и рекомбинантных популяций выявил множественные локусы, лежащие в основе изменчивости потребности в SKN-1 и MOM-2 для спецификации эндодермы. Весь комплекс полученных данных позволил предложить модель компенсаторных отношений между SKN-1 и MOM-2.
Архитектура генных регуляторных сетей изменяется в том числе и при эволюции цис-регуляторных последовательностей (Peter, Davidson, 2011). Поэтому анализ изменчивости последовательностей мишеней SKN-1 и Wnt/POP-1 у диких изолятов C. elegans поможет понять, как генетические изменения подстраиваются к генетической сети без ущерба для процесса развития в микро-эволюционном масштабе времени.
Результаты данного исследования позволяют понять, что информация, полученная в ходе изучения молекулярных механизмов развития на одной лабораторной линии животных, не должна переноситься на весь вид. Только исследования на популяционном уровне позволят раскрыть универсальные принципы регуляции развития, а не только роль отдельных регуляторных белков у отдельных лабораторных линий животных.
ЗАКЛЮЧЕНИЕ
В данном обзоре мы продемонстрировали эволюционную и индивидуальную пластичность сигнальных каскадов на примере нескольких процессов, наблюдающихся в развитии позвоночных и беспозвоночных животных.
Имеющиеся данные позволяют усомниться в том, что эволюционные изменения сигнальных каскадов – первопричина появления новых планов строения. Модификации каскадов могут являться следствием давления естественного отбора, направленного на поддержание того или иного плана строения в условиях изменившегося эмбрионального развития. Индивидуальная и эволюционная пластичность генных регуляторных сетей является необходимой предпосылкой для устойчивого формирования признаков в онто- и филогенезе. Несомненно, описанный феномен индивидуальной пластичности сигнальных каскадов имеет большое значение и для медицины. Именно это явление может приводить к тому, что два человека с одним и тем же заболеванием, или унаследовавшие одну и ту же мутацию, проявляют разные симптомы и по-разному реагируют на лечение.
Анализ представленных данных показывает, что редукционистский подход к изучению сигнальных каскадов, не позволяет выявить универсальные для Metazoa принципы регуляции развития. Прогресс в изучении регуляции развития ограничивается небольшим набором модельных объектов, искажающим наши представления о разнообразии и пластичности сигнальных каскадов. Активные исследования в областях эволюционной биологии развития (EvoDevo) и экологической биологии развития (EcoEvoDevo), связанные с использованием широкого круга филогенетически репрезентативных моделей, позволят преодолеть эти ограничения.
Список литературы
Anderson C., Stern C.D. Organizers in development // Curr. Top. Dev. Biol. 2016. V. 117. P. 435–454.
Bachiller D., Klingensmith J., Shneyder N., Tran U., Anderson R., Rossant J., De Robertis E.M. The role of chordin/Bmp signals in mammalian pharyngeal development and DiGeorge syndrome // Development. 2003. V. 130. № 15. P. 3567–3578.
Bier E., De Robertis E.M. BMP gradients: A paradigm for morphogen-mediated developmental patterning // Science. 2015. V. 348. № 6242. P. 1–12.
Boyle M.J., Seaver E.C. Expression of FoxA and GATA transcription factors correlates with regionalized gut development in two lophotrochozoan marine worms: chaetopterus (Annelida) and Themiste lageniformis (Sipuncula) // EvoDevo. 2010. V. 1. P. 1–18.
Brekhman V., Malik A., Haas B., She N., Lotan T. Transcriptome profiling of the dynamic life cycle of the scypohozoan jellyfish Aurelia aurita // BMC genomics. 2015. V. 16. № 1. P. 1–15.
Carroll S.B. Endless forms: the evolution of gene regulation and morphological diversity // Cell. 2000. V. 101. № 6. P. 577–580.
Cary G.A., Hinman V.F. Echinoderm development and evolution in the post-genomic era // Dev. Biol. 2017. V. 427. № 2. P. 203–211.
Chapman J.A., Kirkness E.F., Simakov O., Hampson S.E., Mitros T., Weinmaier T., Rattei T., Balasubramanian P.G., Borman J., Busam D., Disbennett K. The dynamic genome of Hydra // Nature. 2010. V. 464. № 7288. P. 592–596.
Chizhikov V.V., Millen K.J. Roof plate-dependent patterning of the vertebrate dorsal central nervous system // Dev. Biol. 2005. V. 277. P. 287–295.
Christen B., Slack J.M. All limbs are not the same // Nature. 1998. V. 395. № 6699. P. 230.
Cohen M., Briscoe J., Blassberg R. Morphogen interpretation: the transcriptional logic of neural tube patterning // Curr. Opin. Genet. Dev. 2013. V. 23. P. 423–428.
Cleuren Y.N.T., Ewe C.K., Chipman K.C., Mears E.R., Wood C.G., Al-Alami C.E.A., Alcorn M.R., Turner T.L., Joshi P.M., Snell R.G., Rothman, J.H. Extensive intraspecies cryptic variation in an ancient embryonic gene regulatory network // Elife. 2019. V. 8. P. e48220.
Davidson E.H., Rast J.P., Oliveri P., Ransick A., Calestani C., Yuh C.H., Minokawa T., Amore G., Hinman V., Arenas-Mena C., Otim O., Brown C.T., Livi C.B., Lee P.Y., Revilla R., Schilstra M.J., Clarke P.J., Rust A.G., Pan Z., Arnone M.I., Rowen L., Cameron R.A., McClay D.R., Hood L., Bolouri H. A provisional regulatory gene network for specification of endomesoderm in the sea urchin embryo // Dev. Biol. 2002. V. 246. P. 162–190.
Demers C.J., Soundararajan P., Chennampally P., Cox G.A., Briscoe J., Collins S.D., Smith R.L. Development-on-chip: in vitro neural tube patterning with a microfluidic device // Development. 2016. V. 143. № 11. P. 1884–1892.
Dineen A., Osborne N.E., Goszczynski B., Rothman J.H., McGhee J.D. Quantitating transcription factor redundancy: the relative roles of the ELT-2 and ELT-7 GATA factors in the C. elegans endoderm // Dev. Biol. 2018. V. 435. P. 150–161.
Echelard Y., Epstein D.J., St-Jacques B., Shen L., Mohler J., McMahon J.A., McMahon A.P. Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity // Cell. 1993. V. 75. № 7. P. 1417–1430.
Ereskovsky A.V., Renard E., Borchiellini C. Cellular and molecular processes leading to embryo formation in sponges: evidences for high conservation of processes throughout animal evolution // Dev. Gen. Evol. 2013. V. 223. № 1–2. P. 5–22.
Ewe C.K., Torres Cleuren Y.N., Rothman J.H. Evolution and developmental system drift in the endoderm gene regulatory network of Caenorhabditis and other nematodes // Frontiers in Cell and Developmental Biology. 2020. V. 8. P. 170.
Félix M.A., Wagner A. Robustness and evolution: concepts, insights and challenges from a developmental model system // Heredity. 2008. V. 100. P. 132–140.
Finnerty J.R., Pang K., Burton P., Paulson D., Martindale M.Q. Origins of bilateral symmetry: Hox and dpp expression in a sea anemone // Science. 2004. V. 304. № 5675. P. 1335–1337.
Gavino M.A., Reddien P.W. A Bmp/Admp regulatory circuit controls maintenance and regeneration of dorsal-ventral polarity in planarians // Current Biology. 2011. V. 21. № 4. P. 294–299.
Genikhovich G. How Do Developmental Programs Evolve? Old Questions and Young Approaches to Animal Evolution. Springer, Cham., 2019. P. 73–106.
Genikhovich G., Fried P., Prünster M.M., Schinko J.B., Gilles A.F., Fredman D., Meier K., Iber D., Technau U. Axis patterning by BMPs: cnidarian network reveals evolutionary constraints // Cell Reports. 2015. V. 10. № 10. P. 1646–1654.
Genikhovich G., Technau U. On the evolution of bilaterality // Development. 2017. V. 144. № 19. P. 3392–3404.
Gline S.E., Kuo D.H., Stolfi A., Weisblat D.A. High resolution cell lineage tracing reveals developmental variability in leech // Dev. Dyn. 2009. V. 238. № 12. P. 3139–3151.
Goulding M., Lanuza G., Sapir T., Narayan S. The formation of sensorimotor circuits // Curr. Opin. Neurobiol. 2002. V. 12. P. 508–515.
Halpern M.E., Ho R.K., Walker C., Kimmel C.B. Induction of muscle pioneers and floor plate is distinguished by the zebrafsh no tail mutation // Cell. 1993. V. 75. P. 99–111.
Hamburger V., Hamilton H.L. A series of normal stages in the development of the chick embryo // J. Morphol. 1951. V. 88. № 1. P. 49–92.
Hayward D.C., Samuel G., Pontynen P.C., Catmull J., Saint R., Miller D.J., Ball E.E. Localized expression of a dpp/ BMP2/4 ortholog in a coral embryo // PNAS. 2002. V. 99. № 12. P. 8106–8111.
Huang F.Z., Weisblat D.A. Cell fate determination in an annelid equivalence group // Development. 1996. V. 122. № 6. P. 1839–1847.
Jeong J., McMahon A.P. Growth and pattern of the mammalian neural tube are governed by partially overlapping feedback activities of the hedgehog antagonists patched 1 and Hhip1 // Development. 2005. V. 132. № 1. P. 143–154.
Jessell T.M. Neuronal specification in the spinal cord: inductive signals and transcriptional codes // Nature Reviews Genetics. 2000. V. 1. № 1. P. 20–29.
Ishihara K., Ranga A., Lutolf M.P., Tanaka E.M., Meinhardt A. Reconstitution of a patterned neural tube from single mouse embryonic stem cells / Organ Regeneration. Humana Press. N.Y., 2017. P. 43–55.
Kherdjemil Y., Lalonde R.L., Sheth R., Dumouchel A., de Martino G., Pineault K.M., Wellik D.M., Stadler H.S., Akimenko M.A., Kmita M. Evolution of Hoxa11 regulation in vertebrates is linked to the pentadactyl state // Nature. 2016. V. 539. № 7627. P. 89.
Kraus J.E., Fredman D., Wang W., Khalturin K., Technau U. Adoption of conserved developmental genes in development and origin of the medusa body plan // EvoDevo. 2015. V. 6. № 1. P. 1–15.
Kremnyov S., Henningfeld K., Viebahn C., Tsikolia N. Divergent axial morphogenesis and early shh expression in vertebrate prospective floor plate // EvoDevo. 2018. V. 9. № 1. P. 1–17.
Kuo D.H., Shankland M. Evolutionary diversification of specification mechanisms within the O/P equivalence group of the leech genus Helobdella // Development. 2004. V. 131. № 23. P. 5859–5869.
Kuo D.H., Weisblat D.A. A new molecular logic for BMP-mediated dorsoventral patterning in the leech Helobdella // Current Biology. 2011. V. 21. № 15. P. 1282–1288.
Liem K.F. Jr., Tremml G., Roelink H., Jessell T.M. Dorsal differentiation of neural plate cells induced by BMP-mediated signals from epidermal ectoderm // Cell. 1995. V. 82. P. 969–979.
Lin K.T.H., Broitman-Maduro G., Hung W.W., Cervantes S., Maduro M.F. Knockdown of SKN-1 and the Wnt effector TCF/POP-1 reveals differences in endomesoderm specification in C. briggsae as compared with C. elegans // Dev. Biol. 2009. V. 325. № 1. P. 296–306.
Martindale M.Q., Pang K., Finnerty J.R. Investigating the origins of triploblasty: ‘mesodermal’ gene expression in a diploblastic animal, the sea anemone Nematostella vectensis (phylum, Cnidaria; class, Anthozoa) // Development. 2004. V. 131. P. 2463–2474.
Megason S.G., McMahon A.P. A mitogen gradient of dorsal midline Wnts organizes growth in the CNS // Development. 2002. V. 129. P. 2087–2098.
Milloz J., Duveau F., Nuez I., Félix M.A. Intraspecific evolution of the intercellular signaling network underlying a robust developmental system // Genes & Development. 2008. V. 22. P. 3064–3075.
Molina M.D., Neto A., Maeso I., Gómez-Skarmeta J.L., Saló E., Cebrià F. Noggin and noggin-like genes control dorsoventral axis regeneration in planarians // Current Biology. 2011. V. 21. № 4. P. 300–305.
Nunes M.D., Arif S., Schlötterer C., McGregor A.P. A perspective on micro-evo-devo: Progress and potential // Genetics. 2013. V. 195. P. 625–634.
Leclère L., Horin C., Chevalier S., Lapébie P., Dru P., Péron S., Jager M., Condamine T., Pottin K., Romano S., Steger J. The genome of the jellyfish Clytia hemisphaerica and the evolution of the cnidarian life-cycle // Nature Ecology & Evolution. 2019. V. 3. № 5. P. 801–810.
Le Douarin N.M., Halpern M.E. Discussion point. Origin and specification of the neural tube floor plate: insights from the chick and zebrafsh // Curr. Opin. Neurobiol. 2000. V. 10. P. 23–30.
Levine M., Tjian R. Transcription regulation and animal diversity // Nature. 2003. V. 424. № 6945. P. 147.
Lopez-Sanchez C., Garcia-Martinez V., Schoenwolf G.C. Localization of cells of the prospective neural plate, heart and somites within the primitive streak and epiblast of avian embryos at intermediate primitive-streak stages // Cells, Tissues, Organs. 2001. V. 169. P. 334–346.
Oliveri P., Tu Q., Davidson E.H. Global regulatory logic for specification of an embryonic cell lineage // PNAS. 2008. V. 105. P. 5955–5962.
Özüak O., Buchta T., Roth S., Lynch J.A. Dorsoventral polarity of the Nasonia embryo primarily relies on a BMP gradient formed without input from Toll // Current Biology. 2014. V. 24. № 20. P. 2393–2398.
Özüak O., Buchta T., Roth S., Lynch J.A. Ancient and diverged TGF-β signaling components in Nasonia vitripennis // Development Genes and Evolution. 2014. V. 224. № 4–6. P. 223–233.
Owraghi M., Broitman-Maduro G., Luu T., Roberson H., Maduro M.F. Roles of the Wnt effector POP-1/TCF in the C. elegans endomesoderm specification gene network // Dev. Biol. 2010. V. 340. P. 209–221.
Patten I., Kulesa P., Shen M.M., Fraser S., Placzek M. Distinct modes of floor plate induction in the chick embryo // Development. 2003. V. 130. P. 4809–4821.
Pechmann M., Kenny N.J., Pott L., Heger P., Chen Y.T., Buchta T., Özüak O., Lynch J., Roth S. Striking parallels between dorsoventral patterning in Drosophila and Gryllus reveal a complex evolutionary history behind a model gene regulatory network // Elife. 2021. V. 10. P. e68287.
Peter I.S., Davidson E.H. Evolution of gene regulatory networks controlling body plan development // Cell. 2011. V. 144. P. 970–985.
Peter I.S., Davidson E.H. Assessing regulatory information in developmental gene regulatory networks // PNAS. 2017. V. 114. P. 5862–5869.
Peterson K.J., Lyons J.B., Nowak K.S., Takacs C.M., Wargo M.J., McPeek M.A. Estimating metazoan divergence times with a molecular clock // PNAS. 2004. V. 101. P. 6536–6541.
Peterson K.J., Davidson E.H. Regulatory evolution and the origin of the bilaterians // PNAS. 2000. V. 97. № 9. P. 4430–4433.
Petersen C.P., Reddien P.W. Wnt signaling and the polarity of the primary body axis // Cell. 2009. V. 139. № 6. P. 1056–1068.
Peterson K.A., Nishi Y., Ma W., Vedenko A., Shokri L., Zhang X., McFarlane M., Baizabal J.M., Junker J.P., van Oudenaarden A., Mikkelsen T., Bernstein B.E., Bailey T.L., Bulyk M.L., Wong W.H., McMahon A.P. Neural-specific Sox2 input and differential Gli-binding affinity provide context and positional information in Shh-directed neural patterning // Genes Dev. 2012. V. 26. P. 2802–2816.
Peyrot S.M., Wallingford J.B., Harland R.M. A revised model of Xenopus dorsal midline development: diferential and separable requirements for Notch and Shh signaling // Dev. Biol. 2011. V. 352. P. 254–256.
Phinchongsakuldit J., Mac Arthur S., Brookfield J.F. Evolution of developmental genes: molecular microevolution of enhancer sequences at the ubx locus in Drosophila and its impact on developmental phenotypes // Molecular Biology and Evolution. 2004. V. 21. P. 348–363.
Phillips B.T., Kidd A.R., King R., Hardin J., Kimble J. Reciprocal asymmetry of SYS-1/beta-catenin and POP-1/TCF controls asymmetric divisions in Caenorhabditis elegans // PNAS. 2007. V. 104. P. 3231–3236.
Ranga A., Girgin M., Meinhardt A., Eberle D., Caiazzo M., Tanaka E.M., Lutolf M.P. Neural tube morphogenesis in synthetic 3D microenvironments // PNAS. 2016. V. 113. № 44. P. E6831–E6839.
Reber-Muller S., Streitwolf-Engel R., Yanze N., Schmid V., Stierwald M., Erb M., Seipel K. BMP2/4 and BMP5-8 in jellyfish development and transdifferentiation // International J. Developmental Biology. 2004. V. 50. № 4. P. 377–384.
Reinhardt B., Broun M., Blitz I.L., Bode H.R. HyBMP5-8b, a BMP5-8 orthologue, acts during axial patterning and tentacle formation in hydra // Dev. Biol. 2004. V. 267. № 1. P. 43–59.
Rentzsch F., Anton R., Saina M., Hammerschmidt M., Holstein T.W., Technau U. Asymmetric expression of the BMP antagonists chordin and gremlin in the sea anemone Nematostella vectensis: implications for the evolution of axial patterning // Dev. Biol. 2006. V. 296. № 2. P. 375–387.
Rentzsch F., Guder C., Vocke D., Hobmayer B., Holstein T.W. An ancient chordin-like gene in organizer formation of Hydra // PNAS. 2007. V. 104. № 9. P. 3249–3254.
Reversade B., De Robertis E.M. Regulation of ADMP and BMP2/4/7 at opposite embryonic poles generates a self-regulating morphogenetic field // Cell. 2005. V. 123. № 6. P. 1147–1160.
Riddle R.D., Johnson R.L., Laufer E., Tabin C. Sonic hedgehog mediates the polarizing activity of the ZPA // Cell. 1993. V. 75. № 7. P. 1401–1416.
Seki R., Li C., Fang Q., Hayashi S., Egawa S., Hu J., Xu L., Pan H., Kondo M., Sato T., Matsubara H. Functional roles of Aves class-specific cis-regulatory elements on macroevolution of bird-specific features // Nature Communications. 2017. V. 8. P. 14229.
Saina M., Genikhovich G., Renfer E., Technau U. BMPs and chordin regulate patterning of the directive axis in a sea anemone // PNAS. 2009. V. 106. № 44. P. 18592–18597.
Schauerte H.E., van Eeden F.J., Fricke C., Odenthal J., Strahle U., Hafter P. Sonic hedgehog is not required for the induction of medial foor plate cells in the zebrafsh // Development. 1998. V. 125. P. 2983–2993.
Shih J., Fraser S.E. Characterizing the zebrafsh organizer: microsurgical analysis at the early-shield stage // Development. 1996. V. 122. P. 1313–1322.
Shilo B.Z., Haskel-Ittah M., Ben-Zvi D., Schejter E.D., Barkai N. Creating gradients by morphogen shuttling // Trends in Genetics. 2013. V. 29. № 6. P. 339–347.
Shimeld S.M. The evolution of the hedgehog gene family in chordates: insights from amphioxus hedgehog // Dev. Genes Evol. 1999. V. 209. P. 40–47.
Shoichet S.A., Malik T.H., Rothman J.H., Shivdasani R.A. Action of the Caenorhabditis elegans GATA factor END-1 in Xenopus suggests that similar mechanisms initiate endoderm development in ecdysozoa and vertebrates // PNAS. 2000. V. 97. P. 4076–4081.
Smith J.L., Schoenwolf G.C. Notochordal induction of cell wedging in the chick neural plate and its role in neural tube formation // Journal of Experimental Zoology. 1989. V. 250. № 1. P. 49–62.
Sommermann E.M., Strohmaier K.R., Maduro M.F., Rothman J.H. Endoderm development in Caenorhabditis elegans: the synergistic action of ELT-2 and -7 mediates the specification→differentiation transition // Dev. Biol. 2010. V. 347. P. 154–166.
Sulston J.E., Albertson D.G., Thomson J.N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures // Dev. Biol. 1980. V. 78. P. 542–576.
Takatori N., Satou Y., Satoh N. Expression of hedgehog genes in Ciona intestinalis embryos // Mech. Dev. 2002. V. 116. P. 235–238.
Tan S., Huan P., Liu B. Expression patterns indicate that BMP2/4 and Chordin, not BMP5-8 and Gremlin, mediate dorsal–ventral patterning in the mollusk Crassostrea gigas // Development Genes and Evolution. 2017. V. 227. № 2. P. 75–84.
Van Straaten H.W.M., Hekking J.W.M., Wiertz-Hoes-sels E.J.L.M., Thors F., Drukker J. Effect of the notochord on the differentiation of a floor plate area in the neural tube of the chick embryo // Anatomy and Embryology. 1988. V. 177. № 4. P. 317–324.
Wang Y.C., Ferguson E.L. Spatial bistability of Dpp–receptor interactions during Drosophila dorsal–ventral patterning // Nature. 2005. V. 434. № 7030. P. 229–234.
Watanabe H., Schmidt H.A., Kuhn A., Höger S.K., Kocagöz Y., Laumann-Lipp N., Özbek S., Holstein T.W. Nodal signalling determines biradial asymmetry in Hydra // Nature. 2014. V. 515. № 7525. P. 112–115.
Weisblat D.A., Kim S.Y., Stent G.S. Embryonic origins of cells in the leech Helobdella triserialis // Dev. Biol. 1984. V. 104. № 1. P. 65–85.
Weisblat D.A., Shankland M. Cell lineage and segmentation in the leech // Philosophical Transactions of the Royal Society of London. B, Biological Sciences. 1985. V. 312. № 1153. P. 39–56.
Willmore K.E. The body plan concept and its centrality in evo-devo // Evolution: Education and Outreach. 2012. V. 5. № 2. P. 219–230.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


