Онтогенез, 2022, T. 53, № 3, стр. 163-172
Особенности регуляции гормональной чувствительности стволовых клеток
В. И. Чечехин a, К. Ю. Кулебякин a, П. А. Тюрин-Кузьмин a, *
a МГУ им. М.В. Ломоносова, факультет фундаментальной медицины, кафедра биохимии и молекулярной медицины
119991 Москва, Ломоносовский пр-т., 27-1, Россия
* E-mail: tyurinkuzmin.p@gmail.com
Поступила в редакцию 02.12.2021
После доработки 17.01.2022
Принята к публикации 20.01.2022
Аннотация
В основе нормального функционирования взрослого организма лежат механизмы поддержания гомеостаза, регуляции процессов репарации и регенерации тканей. Важную роль в регуляции этих процессов играет особая группа постнатальных стволовых клеток – мультипотентные мезенхимные стромальные клетки (МСК). Функциональная активность МСК находится под строгим нейроэндокринным контролем. В данном обзоре рассмотрены особенности механизмов регуляции гормональной чувствительности МСК. Поскольку большинство эндокринных гормонов и нейромедиаторов действует на МСК через G-белок-ассоциированные рецепторы (семидоменные рецепторы), в данной работе фокус делается именно на рассмотрении механизмов регуляции чувствительности с участием таких рецепторов. Механизмы регуляции гормональной чувствительности клеток выстроены в последовательность от самых простых и наиболее хорошо изученных – путем фосфорилирования рецептора – до таких сложных механизмов как регуляция гетерогенной популяции клеток ткани как целого, где выделяются клетки-сенсоры и клетки-эффекторы сигнала.
ВВЕДЕНИЕ
В основе поддержания нормального функционирования тканей человека лежит способность большинства тканей и органов к постоянному обновлению и регенерации возникающих повреждений. В целом, появление новых клеток ткани может происходить по одному из трех механизмов: пролиферация уже дифференцированных клеток, деление и дифференцировка стволовых клеток ткани и трансдифференцировка клеток, дифференцированных в другом направлении (Clevers, 2015). Разные ткани организма отличаются преимущественной представленностью одного или другого способа обновления и регенерации. Например, печень регенерирует преимущественно за счет деления терминально дифференцированных клеток паренхимы (Duncan et al., 2009), новые клетки эндотелия в процессе ангиогенеза появляются в результате частичной дедифференцировки и пролиферации имеющихся эндотелиальных клеток (Patan, 2004). Тем не менее, большинство тканей организма обновляется и регенерирует за счет функциональной активности стволовых клеток.
Классически понятие стволовой клетки определяется возможностью дифференцироваться в другие клетки и способностью к самообновлению (Clevers, 2015; Slack, 2018). Более точное определение стволовой клетки включает в себя помимо этих двух признаков также способность к самоподдержанию в течение длительного времени и функционирование в контексте локального микроокружения, которое регулирует активность стволовой клетки (ниша) (Li, Xie, 2005; Терских и др., 2007; Nimiritsky et al., 2019). Тем не менее, и это определение в настоящее время подвергается некоторому пересмотру в связи с тем, что для ряда стволовых клеток, например, нейрональной, стало понятно, что понятие самообновление к ней не применимо. Нейрональные стволовые клетки находятся в покое и практически не делятся. После активации стволовой клетки и начала ее пролиферации и самообновления она превращается в прогениторную клетку, способную к самоподдержанию лишь ограниченное время (Song et al., 2012). Более того, для ряда тканей, например, для крипт тонкого кишечника (в случае стволовых клеток основания крипты) или яичка (в случае смерматогониальной стволовой клетки), невозможно говорить о конкретной физически существующей стволовой клетке, а можно говорить о группе клеток, обладающей стволовой функцией (Klein et al., 2010; Clevers, 2013, 2015).
Важной группой стволовых клеток взрослого организма (постнатальных стволовых клеток) являются мультипотентные мезенхимные стромальные клетки (МСК). МСК выявляются в большинстве тканей организма и выполняют две ключевые функции. Во-первых, это непосредственно стволовая функция – возможность дифференцироваться в ряд направлений. Во-вторых, крайне важная регуляторная функция. МСК выступают важными регуляторами и координаторами функций ткани, в которой они находятся, формируя и поддерживая строму ткани. Понятие строма в широком смысле включает в себя не только формирование внеклеточного матрикса, окружающего дифференцированные клетки ткани. Под стромой понимается также набор паракринных и контактных регуляторных воздействий, контролирующих функции этих клеток, процессы репарации, регенерации и обновления ткани. МСК ответственны за поддержание гомеостаза, регуляцию процессов ангиогенеза и нейрогенеза, регуляцию иммунных реакций (Калинина и др., 2011).
Функциональная активность стволовых клеток находится под строгим регуляторным контролем нервной и эндокринной систем организма. Действуя через рецепторы, представленные на поверхности клеток, гормоны и нейромедиаторы регулируют такие функции стволовых клеток как пролиферация, миграция, перестройки метаболизма, дифференцировка. Это, в свою очередь, ведет к изменению функционального состояния ткани. С другой стороны и сама гормональная чувствительность клеток и тканей в целом является предметом регуляции, что важно для адаптации систем организма к изменяющимся условиям внешней среды. В настоящее время показано множество различных механизмов регуляции чувствительности клеток к гормонам, однако большинство из них ограничивается модельными объектами, такими как стабильные клеточные линии. Непосредственно на стволовых клетках ведется мало исследований механизмов регуляции гормональной чувствительности в связи с тем, что эти клетки крайне трудны в работе. Постнатальные стволовые клетки в культуре имеют ограниченное время пассирования, при выходе из ниши эти клетки быстро меняют фенотип и коммитируются. Стволовые клетки эффективно защищены от введения в них чужеродного генетического материала. Это ограничивает возможность экспрессии в них экзогенных белков, в частности, генетически-кодируемых биосенсоров для изучения внутриклеточных сигнальных процессов. В связи с этим в настоящее время существует мало работ, фокусирующихся на изучении регуляторных механизмов внутриклеточной синализации именно в постнатальных стволовых клетках. Тем не менее, имеющиеся работы показывают существование в этих клетках уникальных регуляторных механизмов, которые не встречаются в дифференцированных клетках организма.
В данном обзоре будут рассмотрены механизмы регуляции гормональной чувствительности постнатальных стволовых клеток, в первую очередь, МСК. Осознавая, что рецепторы цитокинов и факторов роста, а также внутриклеточные рецепторы представляют огромное множество путей изменения их активности, мы ограничимся рассмотрением механизмов регуляции МСК к гормонам, активирующим G-белок ассоциированные рецепторы (семидоменные рецепторы). Механизмы регуляции гормональной чувствительности клеток мы выстроили в последовательность от самых простых и наиболее хорошо изученных – путем фосфорилирования рецептора – до таких сложных механизмов как регуляция гетерогенной популяции клеток и ткани как целого, где выделяются клетки-сенсоры и клетки-эффекторы сигнала.
ФОСФОРИЛИРОВАНИЕ-ДЕФОСФОРИЛИРОВАНИЕ РЕЦЕПТОРА
В группу процессов, описываемых регуляцией гормональной чувствительности на молекулярном уровне, мы отнесли механизмы, для реализации которых может быть достаточно одной молекулы рецептора в комплексе с активируемыми ею внутриклеточными сигнальными каскадами. Эта группа включает в себя процессы изменения сродства рецептора к гормону, механизмы регуляции сопряжения рецептора и активируемых им внутриклеточных сигнальных каскадов, изменение доступности компонентов сигнальных каскадов для активированного рецептора, а также взаимодействие с другими рецепторами путем гетеро- и гомо-олигомеризации рецепторов.
Давно известным и наиболее хорошо изученным механизмом регуляции сродства семидоменных рецепторов к их лигандам является фосфорилирование их С-концевого цитоплазматического домена. Лиганд-связанный рецептор активирует тримерный G-белок, результатом чего является запуск либо фосфоинозитидного обмена, кальциевой сигнализации и протеинкиназы С (ПКС), либо аденилатциклазы и циклического аденозин-монофосфата (цАМФ), который активирует протеинкиназу А (ПКА). ПКС и ПКА могут фосфорилировать цитоплазматический С-концевой домен семидоменных рецепторов, что приводит к снижению сродства рецептора к тримерному G‑белку. Как следствие, происходит уменьшение интенсивности активируемых сигнальных каскадов при неизменной концентрации гормона. Поскольку ПКС и ПКА могут активировать как гормон-связанные молекулы рецептора, так и свободные от гормона, этот тип десенситизации называют “независимая от агониста десенситизация” (non-agonist-specific desensitization). Кроме того, этот тип десенситизации часто относят к типу гетерологической десенситизации, поскольку активированные протеинкиназы могут фосфорилировать не только ту молекулу рецептора, которая привела к их активации, но и другие семидоменные рецепторы (Rockman et al., 2002; Gurevich, Gurevich, 2019). Альтернативным путем фосфорилирования активного рецептора является путь гомологической десенситизации, по-иному, “зависимая от агониста десенситизация” (agonist-specific desensitization). При этом активный лиганд-связанный рецептор привлекает киназу G-белок-ассоциированных рецепторов (GRK), которая фосфорилирует только гормон-связанные молекулы рецептора, снижая их сродство к G-белку (Rockman et al., 2002; Gurevich, Gurevich, 2019).
После прохождения десенситизации молекулы рецепторов могут вернуться в исходное состояние путем дефосфорилирования. Протеин-фосфатазы (PP), осуществляющие дефосфорилирование рецепторов, могут находиться как в растворимой форме, так и входить в состав сигнальных супер-комплексов, собирающихся на каркасных белках для проведения сигнала от рецептора. Многие каркасные белки, связывающие цАМФ-зависимую ПКА, (A-kinase-anchoring protein, AKAP), например, AKAP250 Gravin, содержат также и PP2A, дефосфорилирующую рецепторы (Lin et al., 2000). Таким образом, процессы фосфорилирования и дефосфорилирования рецептора осуществляются в связке для тонкой настройки чувствительности рецептора и интенсивности проведения сигнального каскада в соответствии с изменяющимися внешними условиями.
Фосфорилирование семидоменных рецепторов исторически считается ассоциированным с быстрой десенситизацией. Тем не менее, показан ряд механизмов, связанных с фосфорилированием рецепторов, которые приводят к переключению внутриклеточного пути передачи сигнала (рис. 1). В норме β-адренорецепторы взаимодействуют с тримерным Gs-белком и активируют сигнальный каскад аденилат-циклаза/цАМФ/ПКА. Однако в кардиомиоцитах избыточная стимуляция β-адренорецепторов и длительная активация ПКА приводит к фосфорилированию рецептора. Фосфорилированные β-адренорецепторы проявляют повышенное сродство к тримерному Gi-белку (Daaka et al., 1997), что ведет к ингибированию цАМФ-зависимого сигнального каскада, то есть эффекту, противоположному обычному клеточному ответу на стимуляцию β-адренорецепторов. Считается, что в кардиомиоцитах данный феномен участвует в регуляции выживаемости кардиомиоцитов. Избыточная активация цАМФ-зависимого сигнального пути может привести к гибели кардиомиоцитов, тогда как Gi-опосредованная сигнализация компенсирует эти негативные эффекты и повышает выживаемость клеток (Pönicke et al., 2006).
Рис. 1.
Схематическое изображение ключевых механизмов регуляции функциональной активности семидоменных рецепторов. G-белок ассоциированный рецептор (GPCR) связывает агонист и запускает внутриклеточную сигнализацию посредством активации ассоциированного с ним G-белка (G-белок 1). При этом запускается внутриклеточный сигнал 1 типа. Фосфорилирование рецептора по его цитоплазматическому С-концу может приводить к нескольким различным последствиям. Во-первых, десенситизации рецептора – снижению или полному выключению передачи сигнала. Во-вторых, переключению активируемого рецептором G-белка и, соответственно, изменению активируемого сигнального каскада (Внутриклеточный сигнал 2). В-третьих, ассоциации с рецептором β-аррестина, который также может запускать сигнальные каскады (Внутриклеточный сигнал 3). β-Аррестин, в свою очередь, инициирует интернализацию рецептора. В составе эндосом рецептор может деградировать, рециклировать обратно на плазматическую мембрану; сигнал может усилиться или переключиться на Внутриклеточный сигнал 4.
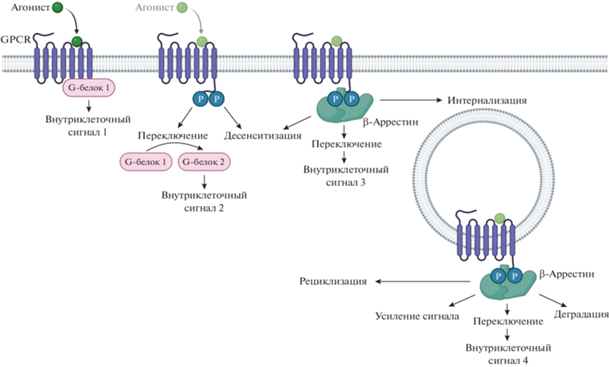
ИНТЕРНАЛИЗАЦИЯ РЕЦЕПТОРОВ
Фосфорилированный С-концевой домен рецептора связывает каркасный белок β-аррестин, который выполняет несколько функций (рис. 1). Первая – он стерически мешает тримерному G‑белку связываться с рецептором, благодаря чему вероятность активации сигнального каскада рецептора становится еще ниже. Вторая – он привлекает белок клатрин, который инициирует процесс интернализации рецептора. Третья – β-аррестин связывает протеинкиназу Raf-1 и активирует МАР-киназный сигнальный каскад, в результате чего происходит переключение сигнализации с классических для семидоменных рецепторов Са2+-зависимого и цАМФ-зависимого сигнальных каскадов на МАР-киназный, который более характерен для рецепторов факторов роста (Luttrell et al., 2001; Shenoy, Lefkowitz, 2011; Zang et al., 2021). Таким образом, классические механизмы десенситизации на молекулярном уровне включают в себя фосфорилирование рецептора и его уход с поверхности клетки по β-аррестин-зависимому механизму.
МСК широко используют классические способы десенситизации рецепторов, но при этом для разных рецепторов характерна различная чувствительность к стимулам, вызывающим десенситизацию. Так, ранее мы показали, что при действии ангиотензина 2 на МСК происходит крайне быстрая интернализация ангиотензиновых рецепторов AT1R сразу после активации кальциевой сигнализации (Sysoeva et al., 2017). Регистрация кальциевой сигнализации на уровне одиночных клеток показала, что первичная добавка гормона приводит к активации кальциевой сигнализации более чем в 50% клеток популяции. На повторную добавку ангиотензина 2 способны ответить лишь 2–5% клеток популяции. Это связано с тем, что AT1R интернализуется сразу после связывания лиганда (Sysoeva et al., 2017). Более того, в качестве индуктора интернализации рецептора могут выступать и антитела к этому рецептору (Ageeva et al., 2018). β-Адренорецепторы также подвержены интернализации в МСК при избыточном действии норадреналина, но процесс этот осуществляется на протяжении нескольких часов (Tyurin-Kuzmin et al., 2016). α1- и α2-адренорецепторы в МСК не подвергаются десенситизации на протяжении нескольких часов, поскольку повторяющаяся стимуляция индивидуальных клеток норадреналином или агонистами адренорецепторов приводит к воспроизводимым кальциевым ответам на протяжении нескольких часов (Kotova et al., 2014).
Интернализация рецепторов не всегда приводит к десенситизации. Известны случаи, когда интернализация рецептора является необходимым условием для повышения его активности. Например, для рецептора паратиреоидного гормона показано, что интернализация гормон-рецепторного комплекса приводит к значительному усилению амплитуды и продолжительности продукции цАМФ (Ferrandon et al., 2009; Воронцова и др., 2021).
ГЕТЕРОДИМЕРИЗАЦИЯ РЕЦЕПТОРОВ
Способом регуляции гормональной чувствительности на молекулярном уровне является димеризация и олигомеризация семидоменных рецепторов – объединение нескольких рецепторов в комплекс для проведения сигнала. Димеризация впервые показана и лучше всего изучена для рецепторных тирозинкиназ, таких как рецептор эпидермального фактора роста EGFR или рецептор тромбоцитарного фактора роста PDGFR (Weiss, Schlessinger, 1998). Тем не менее, в настоящее время показано, что гомо- и гетеродимеризация является распространенным механизмом регуляции чувствительности и для семидоменных рецепторов. CXCR4 является классическим GPCR, связанным с Gi-белком, активация которого ингибирует аденилат-циклазу и продукцию цАМФ. CXCR4 в высокой степени склонен к гетеродимеризации. Так, α1-адренорецепторы, которые являются ключевыми медиаторами вазоконстрикторного действия симпатической нервной системы, гетеродимеризуется с CXCR4 на гладкомышечных клетках сосудов, что важно для осуществления их функций (Tripathi et al., 2015; Pozzobon et al., 2016). С каждым годом накапливается все больше сведений, указывающих на то, что многие GPCR располагаются в мембране в виде димеров. Например, GPCR класса С формируют постоянные гомо- и гетеродимеры (mGluR, GABAb). Олигомеризация рецепторов в настоящее время рассматривается, во-первых, как способ повышения вероятности проведения сигнала в клетку при связывании с лигандом. Во-вторых, как повышение чувствительности молекулы рецептора за счет увеличения числа сайтов связывания гормона. В-третьих, гетеро-олигомеризация может служить способом переключения сигнального каскада, который активирует рецептор.
В МСК гетеродимеризация рецепторов способна перенаправлять активируемые рецептором сигнальные каскады, регулируя функциональную активность клеток. Как было сказано выше, стимуляция ангиотензином II рецептора AT1R приводит к его быстрой интернализации (Sysoeva et al., 2017). Однако в популяции МСК при изучении кальциевых ответов на гормон на уровне одиночных клеток была обнаружена небольшая субпопуляция МСК, которая отвечает на добавление ангиотензина II повторяющимися кальциевыми ответами. Эти МСК отличаются от большинства клеток популяции, во-первых, экспрессией других изоформ рецепторов группы ангиотензина. Во-вторых, повышенной способностью вступать в адипогенную дифференцировку. Согласно нашей гипотезе, AT1R гетеродимеризуется с AT2R или другими рецепторами ангиотензина, что препятствует его интернализации. Кроме того, AT2R активирует PI3-киназный сигнальный каскад, усиливающий адипогенную дифференцировку этой малой субпопуляции МСК (Tyurin-Kuzmin et al., 2020a).
ДАУНРЕГУЛЯЦИЯ
Регуляция гормональной чувствительности на уровне целой клетки включает в себя такие механизмы, при которых меняется чувствительность клетки как целого, даже при неизменности параметров отдельных молекул рецептора. В эту группу входят механизмы изменения количества рецепторов, представленных на поверхности клетки, изменение изоформного состава и ряд других. Даунрегуляция – это механизм десенситизации клеток, при котором происходит комплексное снижение представленности рецептора в клетке в целом. При этом происходит, во-первых, интернализация и последующая деградация рецептора в лизосомах. Во-вторых, снижается уровень мРНК рецептора. В отличие от десенситизации путем фосфорилирования и интернализации данный механизм приводит к долговременной десенситизации. Одним из первых изученных и наиболее известных примеров является даунрегуляция β2-адренергических рецепторов (Jockers et al., 1999; Qasim, McConnell, 2020). В МСК β-адренорецепторы также подвергаются даунрегуляции, но происходит это не во всех клетках. Изучение на уровне одиночных клеток изменения представленности β-адренорецепторов в МСК показало, что стимуляция норадреналином в течение 1 ч приводит к сокращению числа клеток, экспрессирующих β-адренорецепторы, но не изменяет уровень экспрессии рецепторов на оставшихся клетках. Например, среднее число клеток, экспрессирующих β2-адренорецепторы, сокращалось в 5 раз, а число клеток, экспрессирующих β1- и β3-адренорецепторы, уменьшалось слабее, от 1.5 до 5 раз в зависимости от донора (Tyurin-Kuzmin et al., 2016, 2018). При этом средняя представленность β-адренорецепторов на отдельных клетках, оцененная при помощи проточного цитометра по интенсивности флуоресценции клеток, меченных антителами к этим рецепторам, у большинства доноров не изменялась (Tyurin-Kuzmin et al., 2018). Таким образом, β-адренорецепторы в МСК демонстрируют два варианта ответа на избыточную стимуляцию гормоном – либо полная даунрегуляция рецептора, либо устойчивое сохранение представленности рецептора на поверхности клеток.
Выход рецепторов на поверхность клетки
Помимо снижения представленности рецепторов в клетках гормоны могут вызывать обратный процесс повышения числа молекул рецептора. В тех случаях, когда стимуляция одного рецептора приводит к увеличению экспрессии или выходу на поверхность других рецепторов, говорят о пермиссивном действии первого рецептора на второй. Наиболее широкоизвестный пример пермиссивного действия являют собой внутриклеточные рецепторы глюкокортикоидов, которые оказывают пермиссивное действие на адренорецепторы. Эстрогены повышают экспрессию β1- и β3-адренорецепторов на клетках эндотелия, что приводит к более выраженной вазодилатации при действии норадреналина. Более выраженная вазодилатация может обусловливать более низкие цифры артериального давления у женщин по сравнению с мужчинами (Riedel et al., 2019).
ГЕТЕРОЛОГИЧЕСКАЯ СЕНСИТИЗАЦИЯ
Все описанные выше регуляторные процессы могут взаимодействовать друг с другом, формируя комплексный ответ на внешние воздействия. Это особенно хорошо видно на примере явления гетерологической сенситизации (ГС), описанного нами в МСК. ГС представляет собой уникальный феномен повышения чувствительности к действующему на клетку гормону с параллельным переключением активируемого пути внутриклеточной сигнализации в ответ на действие норадреналина. Мы обнаружили, что при продолжительном воздействии на МСК норадреналина, эти клетки, с одной стороны, снижают чувствительность к гормону через β-адренорецепторы, но, с другой, повышают чувствительность за счет существенного повышения экспрессии α1А-адренорецепторов (Tyurin-Kuzmin et al., 2016). Как было сказано выше, в большинстве терминально дифференцированных клеток длительная активация β-адренорецепторов приводит к десенситизации клеток и, в некоторых случаях, к даунрегуляции. Однако в МСК при действии норадреналина происходит увеличение уровня α1А-адренорецепторов через 6 часов после действия гормона. Дополнительное количество молекул рецептора синтезируется и выходит на поверхность клеток, следствием чего является общее повышение чувствительности МСК к норадреналину более чем в 5 раз. Данный эффект опосредуется активацией β-адренорецепторов или добавлением активатора аденилат-циклазы форсколина. Сами β-адренорецепторы, запускающие этот механизм, подвергаются даунрегуляции (Tyurin-Kuzmin et al., 2016). Таким образом, гетерологическая сенситизация МСК является комплексным механизмом регуляции гормональной чувствительности, при котором происходит одновременно даунрегуляция одних рецепторов, сенситизация других и, как следствие, переключение сигнализации, активируемой норадреналином в этих клетках.
ОБРАТИМАЯ ПОТЕРЯ ГОРМОНАЛЬНОЙ ЧУВСТВИТЕЛЬНОСТИ ЦЕЛОЙ КЛЕТКОЙ
Помимо уникального явления гетерологической сенситизации, на МСК был обнаружен еще один крайне интересный феномен регуляции чувствительности клеток к действующим гормонам. Мы изучали на уровне одиночных клеток чувствительность МСК к гормонам, активирующим цАМФ-зависимый сигнальный каскад гормонов (Tyurin-Kuzmin et al., 2020b), при помощи генетически-кодируемого биосенсора, который регистрирует активацию ПКА на уровне одиночных клеток (Zhang et al., 2018). Мы обнаружили, что на действующие гормоны способны отвечать только около 40% клеток популяции. Эти отвечающие клетки реагируют на различные гормоны без выраженной специфичности, одна и та же индивидуальная клетка формирует ответ на разные гормоны. Что интересно, вторая часть клеток популяции не отвечает ни на один из действующих гормонов (Tyurin-Kuzmin et al., 2020b). Добавление форсколина, активатора аденилат-циклаз, не приводит к существенному увеличению числа отвечающих клеток, а прямая активация ПКА при помощи проникающего в клетку аналога цАМФ, 6-Bnz-cAMP, активирует ответ биосенсора во всех клетках популяции. Эти результаты можно интерпретировать так: в клетках, не отвечающих на форсколин, не экспрессируются аденилат-циклазы, что мы и проверили при помощи анализа транскриптома одиночных клеток single-cell RNAseq. Действительно, по данным single-cell RNAseq, более чем в половине клеток популяции МСК не экспрессируется ни одной из десяти изоформ аденилат-циклаз. Кроме того, мы проверили, способны ли МСК изменять восприимчивость к действию гормонов путем регуляции экспрессии аденилат-циклазы. Для этого мы получили колонии МСК из потомков одной клетки. Колонии были получены как из клеток, способных отвечать на действие гормона, так и не способных. Оказалось, что уже через две недели после пассирования клеток в полученных колониях вновь формируется гетерогенность по ответу на гормоны и форсколин – часть клеток популяции способна формировать ответ, часть – нет (Tyurin-Kuzmin et al., 2020b). Таким образом, МСК способны снижать чувствительность индивидуальных клеток к действию гормонов за счет обратимого подавления экспрессии ключевого участника сигнального каскада.
РЕГУЛЯЦИЯ ГОРМОНАЛЬНОЙ ЧУВСТВИТЕЛЬНОСТИ ЗА СЧЕТ СПЕЦИАЛИЗИРОВАННЫХ ГОРМОН-ЧУВСТВИТЕЛЬНЫХ ПОПУЛЯЦИЙ КЛЕТОК
К группе процессов, описываемых регуляцией гормональной чувствительности на тканевом уровне, относятся механизмы, для реализации которых необходимо взаимодействие между различными функциональными группами клеток в составе одной ткани. В организме стволовые клетки располагаются в клеточной нише. Этот термин описывает особое микроокружение, необходимое для поддержания жизнеспособности стволовой клетки, а также регуляции ее активности в зависимости от потребностей организма (Schofield, 1978; Raz, Yamashita, 2021). Подобная регуляция может осуществляться при помощи изменения чувствительности стволовой клетки к различным гормональным сигналам. В конечном счете это определяет выбор между поддержанием ее в состоянии покоя, запуском пролиферации, покиданием ниши, инициации дифференцировки и др. Тем не менее, чаще всего стволовая клетка в нише не обладает сигнальной и регуляторной автономностью и не способна самостоятельно реагировать на сигналы, приходящие из организма (Kulebyakin et al., 2020). Особенностью регуляции гормональной чувствительности клеток в нише является то, что она часто реализуется через процессы межклеточной передачи информации при участии особой субпопуляции клеток, называемой регуляторные клетки (рис. 2). Задачей этих клеток является восприятие системных организменных сигналов и их передача стволовым клеткам, расположенным в нише.
Рис. 2.
Механизмы регуляции гормональной чувствительности клеток за счет специализированных клеточных субпопуляций. Системные гормональные сигналы из кровотока, а также сигналы симпатической нервной системы воспринимаются не всеми клетками ткани, а особой активирующей регуляторной клеткой, которая, в свою очередь, паракринно регулирует процессы, проходящие в ткани. Кроме того, в жировой ткани показано наличие “гомеостатической” ингибирующей популяции клеток.
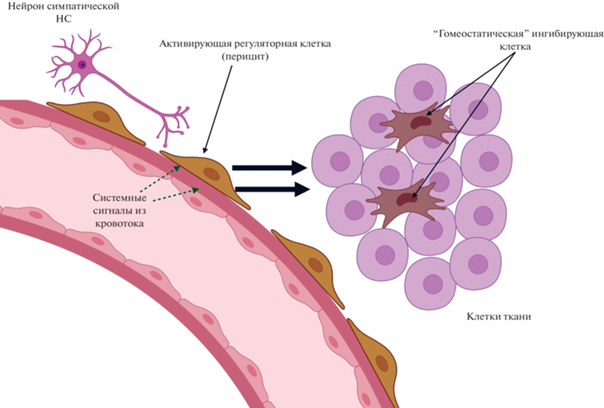
Этот принцип хорошо прослеживается при рассмотрении взаимодействия между нишей гемопоэтической стволовой клетки и симпатической нервной системой. Симпатическая сигнализация играет ключевую роль в мобилизации стволовых клеток из ниши, что реализуется через активацию β3-адренорецепторов. Однако нервные волокна не взаимодействуют напрямую с гематопоэтическими стволовыми клетками. В костном мозге симпатические нервные волокна ассоциированы с сосудами и с перицитами, с которыми они формируют щелевые контакты (Yamazaki, Allen, 1990), образуя нейро-ретикулярный комплекс. Таким образом, сигналы от симпатических нейронов передаются сначала на специализированные стромальные клетки, которые в свою очередь транслируют этот сигнал стволовым клеткам – регулируя их активацию и чувствительность к гормональным сигналам (Mendez-Ferrer et al., 2010).
РЕГУЛЯЦИЯ ГОРМОНАЛЬНОЙ ЧУВСТВИТЕЛЬНОСТИ ЗА СЧЕТ “ГОМЕОСТАТИЧЕСКИХ” ПОПУЛЯЦИЙ КЛЕТОК
Для нормального функционирования ниши стволовой клетки недостаточно наличия только субпопуляций клеток, активирующих гормональную чувствительность стволовых клеток и стимулирующих процессы их мобилизации и дифференцировки. Важной задачей ниши является долговременное сохранение стволовой клетки в нативном состоянии, необходимом для сохранения регенеративного потенциала ткани. В составе ниши стволовой клетки могут присутствовать регуляторные популяции клеток, функцией которых является подавление гормональной чувствительности и сохранение недифференцированного состояния стволовых клеток (рис. 2).
Не так давно подобные клетки были описаны для депо стволовых клеток жировой ткани. В ее составе была охарактеризована малая субпопуляция клеток, несущая поверхностные маркеры CD142 и ABCG1. Эти клетки оказались способны снижать чувствительность МСК к проадипогенным гормональным стимулам и подавлять адипогенную дифференцировку (Schwalie et al., 2018, Ferrero et al., 2020). Поскольку в течение жизни рост жировой ткани может обеспечиваться либо за счет увеличения количества адипоцитов (гиперплазия), либо за счет увеличения объема адипоцитов (гипертрофия) (Muir et al., 2016), эта регуляторная субпопуляция может играть важную роль в определении способа роста жировой ткани.
ЗАКЛЮЧЕНИЕ
Регуляция гормональной чувствительности стволовых клеток взрослого организма крайне важна для их правильного участия в процессах репарации и регенерации тканей, поддержания гомеостаза и запуска дифференцировки. Большое разнообразие механизмов и форм регуляции обеспечивает гармоничное взаимодействие между организмом и стволовой клеткой, тонко подстраивая ее функционирование под динамически изменяющиеся потребности. При этом, помимо обычных для дифференцированных клеток механизмов, в стволовых клетках можно встретить уникальные формы регуляции чувствительности к гормонам. Например, феномен гетерологической сенситизации известен в процессе эмбрионального развития (Zeiders et al., 1999; Slotkin et al., 2003), но во взрослом организме встречается крайне редко. С другой стороны, стволовые клетки демонстрируют механизмы снижения или даже полной потери чувствительности к гормонам, что также очевидно диктуется особенностями их функционирования – необходимостью поддерживать некоторый пул стволовых клеток в недифференцированном состоянии в качестве регенеративного потенциала организма. Уникальность стволовых клеток с точки зрения механизмов регуляции особенно актуальна в свете развития нового направления биомедицинской науки – регенеративной медицины, стремящейся к лечению заболеваний за счет управления собственными регенеративными процессами в организме. Изучение особенностей регуляции гормональной чувствительности стволовых клеток находится еще только в самом начале развития, но не вызывает никаких сомнений, что именно в этой области предстоит обнаружить еще много нового, что может значительно изменить наше представление о том, как организованы клеточные системы передачи информации.
Список литературы
Воронцова М.В., Кулебякин К.Ю., Маказан Н.В. и др. Паратиреоидный гормон в регуляции процессов роста и резорбции кости в норме и патологии // Вестник РАМН. 2021. Т. 76. № 5. С. 506–517.
Калинина Н., Сысоева В., Рубина К. и др. Мезенхимальные стволовые клетки в процессах роста и репарации тканей // Acta Naturae. 2011. Т. 3. № 4. С. 32–39.
Терских В., Васильев А., Воротеляк Е. Ниши стволовых клеток // Известия российской академии наук. Серия биологическая. 2007. Т. 3. С. 261–272.
Ageeva L.V., Sysoeva V.Y., Tyurin-Kuzmin P.A. et al. Data supporting that adipose-derived mesenchymal stem/stromal cells express angiotensin II receptors in situ and in vitro // Data Brief. 2018. V. 16. P. 327–333.
Clevers H. The intestinal crypt, a prototype stem cell compartment // Cell. 2013. V. 154. № 2. P. 274–284.
Clevers H. What is an adult stem cell? // Science. 2015. V. 350. № 6266. P. 1319–1320.
Daaka Y., Luttrell L.M., Lefkowitz R.J. Switching of the coupling of the beta2-adrenergic receptor to different G proteins by protein kinase A // Nature. 1997. V. 390. № 6655. P. 88–91.
Duncan A.W., Dorrell C., Grompe M. Stem cells and liver regeneration // Gastroenterology. 2009. V. 137. № 2. P. 466–481.
Ferrandon S., Feinstein T.N., Castro M. et al. Sustained cyclic AMP production by parathyroid hormone receptor endocytosis // Nat. Chem. Biol. 2009. V. 5. № 10. P. 734–742.
Ferrero R., Rainer P., Deplancke B. Toward a consensus view of mammalian adipocyte stem and progenitor cell heterogeneity // Trends Cell Biol. 2020. Dec. V. 30. № 12. P. 937–950.
Gurevich V.V., Gurevich E.V. GPCR signaling regulation: the role of GRKs and arrestins // Frontiers in Pharmacology. 2019. V. 10. P. 1–11.
Jockers R., Angers S., Da Silva A. et al. Beta(2)-adrenergic receptor down-regulation. Evidence for a pathway that does not require endocytosis // J. Biol. Chem. 1999. V. 274. № 41. P. 28900–28908.
Klein A.M., Nakagawa T., Ichikawa R. et al. Mouse germ line stem cells undergo rapid and stochastic turnover // Cell Stem Cell. 2010. V. 7. № 2. P. 214–224.
Kotova P.D., Sysoeva V.Y., Rogachevskaja O.A. et al. Functional expression of adrenoreceptors in mesenchymal stromal cells derived from the human adipose tissue // Biochim. Biophys. Acta. 2014. V. 1843. № 9. P. 1899–1908.
Kulebyakin K.Y., Nimiritsky P.P., Makarevich P.I. Growth factors in regeneration and regenerative medicine: “the cure and the cause” // Frontiers in Endocrinology. 2020. V. 11. № 384. P. 1–6.
Li L., Xie T. Stem cell niche: structure and function // Annu. Rev. Cell Dev. Biol. 2005. V. 21 P. 605–631.
Lin F., Wang H.-Y., Malbon C.C. Gravin-mediated formation of signaling complexes in β2-adrenergic receptor desensitization and resensitization // J. Biol. Chem. 2000. V. 275. № 25. P. 19025–19034.
Luttrell L.M., Roudabush F.L., Choy E.W. et al. Activation and targeting of extracellular signal-regulated kinases by beta-arrestin scaffolds // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 5. P. 2449–2454.
Mendez-Ferrer S., Michurina T.V., Ferraro F. et al. Mesenchymal and haematopoietic stem cells form a unique bone marrow niche // Nature. 2010. V. 466. № 7308. P. 829–834.
Muir L.A., Neeley C.K., Meyer K.A. et al. Adipose tissue fibrosis, hypertrophy, and hyperplasia: Correlations with diabetes in human obesity // Obesity. 2016. V. 24. № 3. P. 597–605.
Nimiritsky P.P., Eremichev R.Y., Alexandrushkina N.A. et al. Unveiling mesenchymal stromal cells’ organizing function in regeneration // Int. J. Mol. Sci. 2019. V. 20. № 4. Article 823.
Patan S. Vasculogenesis and angiogenesis // Angiogenesis in Brain Tumors. 2004. V. 117. P. 3–32.
Pönicke K., Gröner F., Heinroth-Hoffmann I. et al. Agonist-specific activation of the β2-adrenoceptor/Gs-protein and β2-adrenoceptor/Gi-protein pathway in adult rat ventricular cardiomyocytes // Br. J. Pharmacol. 2006. V. 147. № 7. P. 714–719.
Pozzobon T., Goldoni G., Viola A. et al. CXCR4 signaling in health and disease // Immunol. Lett. 2016. V. 177. P. 6–15.
Qasim H., McConnell B.K. AKAP12 Signaling complex: Impacts of compartmentalizing cAMP-dependent signaling pathways in the heart and various signaling systems // J. Am. Heart. Assoc. 2020. V. 9. № 13. Article e016615.
Raz A.A., Yamashita Y.M. Stem cell niche signaling goes both ways // Dev. Cell. 2021. V. 56. № 16. P. 2267–2268.
Riedel K., Deussen A.J., Tolkmitt J. et al. Estrogen determines sex differences in adrenergic vessel tone by regulation of endothelial β-adrenoceptor expression // American J. Physiology-Heart and Circulatory Physiology. 2019. V. 317. № 2. P. H243–H254.
Rockman H.A., Koch W.J., Lefkowitz R.J. Seven-transmembrane-spanning receptors and heart function // Nature. 2002. V. 415. № 6868. P. 206–212.
Schofield R. The relationship between the spleen colony-forming cell and the haemopoietic stem cell // Blood Cells. 1978. V. 4. № 1–2. P. 7–25.
Schwalie P.C., Dong H., Zachara M. et al. A stromal cell population that inhibits adipogenesis in mammalian fat depots // Nature. 2018. V. 559. № 7712. P. 103–108.
Shenoy S.K., Lefkowitz R.J. β-Arrestin-mediated receptor trafficking and signal transduction // Trends Pharmacol. Sci. 2011. V. 32. № 9. P. 521–533.
Slack J.M. What is a stem cell? // Wiley Interdisciplinary Reviews: Developmental Biology. 2018. V. 7. № 5. Article e323. P. 1–15.
Slotkin T.A., Auman J.T., Seidler F.J. Ontogenesis of beta-adrenoceptor signaling: implications for perinatal physiology and for fetal effects of tocolytic drugs // J. Pharmacol. Exp. Ther. 2003. V. 306. № 1. P. 1–7.
Song J., Zhong C., Bonaguidi M.A. et al. Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision // Nature. 2012. V. 489. № 7414. P. 150–154.
Sysoeva V.Y., Ageeva L.V., Tyurin-Kuzmin P.A. et al. Local angiotensin II promotes adipogenic differentiation of human adipose tissue mesenchymal stem cells through type 2 angiotensin receptor // Stem. Cell. Res. 2017. V. 25. P. 115–122.
Tripathi A., Vana P.G., Chavan T.S. et al. Heteromerization of chemokine (CXC motif) receptor 4 with α1A/B-adrenergic receptors controls α1-adrenergic receptor function // Proc. Natl. Acad. Sci. 2015. V. 112. № 13. P. E1659–E1668.
Tyurin-Kuzmin P.A., Dyikanov D.T., Fadeeva J.I. et al. Flow cytometry analysis of adrenoceptors expression in human adipose-derived mesenchymal stem/stromal cells // Sci. Data. 2018. V. 5. Article 180196. P. 1–8.
Tyurin-Kuzmin P.A., Fadeeva J.I., Kanareikina M.A. et al. Activation of beta-adrenergic receptors is required for elevated alpha1A-adrenoreceptors expression and signaling in mesenchymal stromal cells // Sci. Rep. 2016. V. 6. Article 32835. P. 1–9.
Tyurin-Kuzmin P.A., Kalinina N.I., Kulebyakin K.Y. et al. Angiotensin receptor subtypes regulate adipose tissue renewal and remodelling // FEBS J. 2020a. V. 287. № 6. P. 1076–1087.
Tyurin-Kuzmin P.A., Karagyaur M.N., Kulebyakin K.Y. et al. Functional heterogeneity of protein kinase a activation in multipotent stromal cells // International J. Mol. Sci. 2020b. V. 21. № 12. Article 4442.
Weiss A., Schlessinger J. Switching signals on or off by receptor dimerization // Cell. 1998. V. 94. № 3. P. 277–280.
Yamamoto R., Wilkinson A.C., Nakauchi H. Changing concepts in hematopoietic stem cells // Science. 2018. V. 362. № 6417. P. 895–896.
Yamazaki K., Allen T.D. Ultrastructural morphometric study of efferent nerve terminals on murine bone marrow stromal cells, and the recognition of a novel anatomical unit: The “neuro-reticular complex” // American J. Anatomy. 1990. V. 187. № 3. P. 261–276.
Zang Y., Kahsai A.W., Pakharukova N. et al. The GPCR-β-arrestin complex allosterically activates C-Raf by binding its amino terminus // J. Biol. Chem. 2021. V. 297. № 6. Article 101369. P. 1–7.
Zeiders J.L., Seidler F.J., Slotkin T.A. Agonist-induced sensitization of beta-adrenoceptor signaling in neonatal rat heart: expression and catalytic activity of adenylyl cyclase // J. Pharmacol. Exp. Ther. 1999. V. 291. № 2. P. 503–510.
Zhang Q., Huang H., Zhang L. et al. Visualizing dynamics of cell signaling in vivo with a phase separation-based kinase reporter // Mol. Cell. 2018. V. 69. № 2. P. 334–346.
Дополнительные материалы отсутствуют.
Инструменты
Онтогенез


