Онтогенез, 2022, T. 53, № 3, стр. 173-195
Резидентные ниши нейральных стволовых клеток и регенерация: блеск и нищета взрослого нейрогенеза
В. П. Баклаушев a, b, *, Г. М. Юсубалиева a, b, Е. М. Самойлова a, b, В. В. Белопасов c
a Федеральный научно-клинический центр специализированных видов медицинской помощи
и медицинских технологий ФМБА России
115682 Москва, Ореховый бульвар 28, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, ул. Вавилова 32, Россия
c Астраханский государственный медицинский университет
414000 Астрахань, ул. Бакинская 121, Россия
* E-mail: Baklaushev.vp@fnkc-fmba.ru
Поступила в редакцию 09.12.2021
После доработки 28.01.2022
Принята к публикации 05.02.2022
Аннотация
Открытие нейрогенеза во взрослом состоянии, выделение и культивирование нейральных стволовых клеток (NSC) взрослого мозга и последующее получение из них аутологичных нейронов in vitro наполнили ученых надеждой на то, что вскоре будут созданы новые регенеративные технологии, позволяющие восстанавливать утраченные вследствие болезней и травм функции ЦНС. Однако в течение последующих тридцати лет ажиотаж и очарование новым открытием сменились осмыслением функций NSC и их критической оценкой. Новейшие данные по функционированию стволовых ниш во взрослом мозге и клональные исследования дериватов взрослых NSC позволяют заключить, что их функции во взрослом мозге скорее всего не связаны с репаративной регенерацией структур ЦНС. Молодые нейроны, образующиеся в субвентрикулярной и субгранулярной зонах взрослого мозга, встраиваясь в нейронные сети, выполняют вполне конкретные функции – модуляция распознавания запахов и функционирование обучения и памяти, соответственно. У высших приматов и человека нейрогенез в субвентрикулярной зоне не определяется, а уровень нейрогенеза в зубчатой извилине сопоставим с уровнем у мышей лишь в раннем постнатальном периоде, когда образующиеся молодые нейроны принимают участие в когнитивной пластичности, модулировании памяти и других функциях развивающегося гиппокампа. Наличие нейрогенеза у взрослого человека в новейших исследованиях не подтверждается. В условиях патологии в стволовых нишах взрослого мозга происходят глобальные изменения гомеостаза, сопровождающиеся активацией спящих NSC, усилением пролиферации выживших NSC и всех последующих клонов прогениторов, однако, в случае выраженной гибели клеток даже близлежащих структур мозга, эпиформной регенерации с участием вновь образованных нейробластов не происходит даже у низших млекопитающих. У человека, с учетом выраженной возрастной инволюции нейрогенеза в зубчатой извилине, восстановление церебральных функций осуществляется лишь посредством нейрональной пластичности. Понимание биологической роли взрослых NSC позволяет сделать вывод о том, что создание технологий клеточной регенерации заболеваний и травм ЦНС человека, если и возможно, то возможно только путем репрограммирования взрослых соматических клеток.
ВВЕДЕНИЕ
Обнаружение нейральных стволовых клеток (NSC) взрослого мозга и доказательства нейрогенеза во взрослом состоянии породили новое научное направление – исследования совокупности клеточных субпопуляций и внеклеточного микроокружения, образующих ниши стволовых клеток взрослого мозга.
Интерес к этим исследованиям подогревался и подогревается прежде всего предположением о том, что понимание механизмов функционирования взрослых NSC откроет путь для создания новых регенеративных технологий восстановления функций ЦНС, утраченных вследствие заболеваний или травм. Обоснованием возможности создания таких технологий служили данные о возможностях регенерации ЦНС у более древних животных. Например, низшие позвоночные – рыбы и амфибии продолжают расти на всем протяжении жизни и сохраняют активные NSC во многих отделах ЦНС (Urbán et al., 2019). Эти животные во взрослом состоянии обладают способностью к регенерации структур нервной системы. Так, костистые рыбы, например, Danio rerio способны полностью восстановить поврежденную сетчатку глаза (Goldman, 2014) и структуры ЦНС после тяжелых повреждений, даже таких, как полный анатомический перерыв спинного мозга (Mokalled et al., 2016). При этом глиальный рубец, который у млекопитающих является патологическим блоком, препятствующим прорастанию регенерирующих нейронов, у Danio rerio не формируется. Наоборот, глиальные клетки в области очага травмы активируются экспрессирующимся там ctgfa и формируют мостик, по которому в область травмы прорастают регенерирующие аксоны (Mokalled et al., 2016).
“Чемпионом регенерации”, безусловно, является ювенильная форма саламандры – мексиканский аксолотль, который может регенерировать de novo не только конечности, но и теленцефалон (Maden et al., 2013), глаз (Suetsugu-Maki et al., 2012) и анатомически прерванный спинной мозг (Demircan, 2020). В регенерации теленцефалона у аксолотля участвуют NSC субвентрикулярной зоны, мигрирующие в зону повреждения (Maden et al., 2013). При регенерации сетчатки у рыб и амфибий происходит очень интересный феномен – дифференцированные глиальные клетки Мюллера репрограммируются и подвергаются асимметричному делению, в результате которого образуются стволовые клетки, дающие начало нейронам сетчатки (Goldman, 2014). При регенерации удаленного фрагмента спинного мозга у аксолотля процесс регенерации начинается с массивного ремоделирования внеклеточного матрикса, путем преимущественной даун-регуляция экспрессии генов, обеспечивающих межклеточную адгезию, а также даун-регуляцией генов, связанных с воспалением и иммунным ответом, в частности сигнальных путей IL-17, TNF, NF-kappa В, а также рецепторов, обеспечивающих цитокин-цитокиновое взаимодействие (Demircan, 2020). Ремоделирование матрикса и локальная иммуносупрессия, судя по всему, приводят к репрограммированию клеток в зоне формирования бластемы и восстановлению структур спинного мозга – без участия резидентных стволовых клеток.
В процессе эволюции виды, начиная от низших млекопитающих, значительно утрачивают способность к клеточной регенерации ЦНС и у млекопитающих постнатальный пул стволовых клеток сохраняется лишь в небольших зонах вокруг боковых желудочков мозга и в области зубчатой извилины (gyrus dentatus, GD). При этом у грызунов наиболее интенсивный нейрогенез наблюдается в субвентрикулярной зоне, где образуется до 10 000 нейробластов в сутки (Obernier, Alvarez-Buylla, 2019). У человека наличие взрослого нейрогенеза можно исследовать только постмортально, на момент смерти – по количеству клеток, экспрессирующих маркеры нейробластов, а на протяжении жизни – только с помощью радиоуглеродного анализа. Определение возраста ольфакторных нейронов по включению 14С в их ДНК показало, что более 99% этих клеток имеют такой же возраст, как и сам исследуемый пациент на момент смерти, т.е. уровень нейрогенеза в субвентрикулярной зоне у взрослого человека совершенно незначителен, если вообще присутствует (Bergmann et al., 2012). Радиоизотопный анализ 14С в ДНК нейронов GD позволил зарегистрировать нейрогенез и даже определить приблизительное количество новообразованных в течение жизни нейронов, которое для человека среднего возраста составило около 700 в сутки (Spalding et al., 2013). Согласно другим данным, основанным на иммуногистохимическом анализе, пролиферирующие прогениторные клетки в GD обнаруживаются лишь у детей в возрасте до 3 лет, при этом наиболее активен нейрогенез в первый год жизни, и затем интенсивность его резко падает, вплоть до исчезновения. Некоторое количество молодых нейронов было выявлено у детей от 7 до 13 лет, а у взрослых пациентов (18–77 лет), как у здоровых, так у больных эпилепсией юные нейроны в GD не обнаружены (Sorrells et al., 2018). Другая группа исследователей, наоборот, обнаружила большое количество молодых нейронов в гиппокампе у взрослых пациентов (Boldrini et al., 2018), однако более поздние исследования с помощью транскриптомного анализа не подтвердили наличие нейрогенеза в мозге у взрослого человека (Franjic et al., 2021). Взятые вместе эти данные ставят под сомнение наличие активного нейрогенеза в субгранулярной зоне (SGZ) GD гиппокампа у взрослых. Подтверждают рудиментарный характер нейрогенеза у приматов и исследование на макаках резусах, позволившее обнаружить пролиферацию нейрональных прогениторов в SGZ только в раннем постнатальном периоде (Sorrells et al., 2018).
Прогрессивное снижение уровня взрослого нейрогенеза от рыб и амфибий к грызунам и от грызунов к приматам и человеку, прямо коррелирующее со способностью к восстановлению ЦНС, говорит о возможной взаимосвязи взрослого нейрогенеза с регенеративным потенциалом нервной ткани. В этой связи, становится очевидным, что рудиментарный характер взрослого нейрогенеза у высших приматов и человека не может самостоятельно обеспечить регенерацию ЦНС. Спустя более чем 30 лет исследований взрослых NSC у лабораторных животных и человека, несмотря на существенные успехи в понимании организации стволовых ниш, регуляции покоя, пролиферации и дифференцировки NSC, регенеративные технологии восстановления ЦНС пока не созданы. Цель данного обзора – на основании современных представлений о биологии взрослых NSC обосновать точку зрения о том, почему функционирование ниш стволовых клеток взрослого мозга млекопитающих не может само по себе обеспечить эффективную регенерацию ЦНС.
ОНТОГЕНЕЗ НЕЙРАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК
NSC взрослого мозга – самообновляющийся пул покоящихся и/или пролиферирующих клеток, образующих непрерывный континуумом переходящих друг в друга форм, объединенных под общим термином “радиальная глия” и обеспечивающих нейрогенез в SGZ и вентрикулярно-субвентрикулярной (V-SVZ) зонах головного мозга на протяжении всей жизни млекопитающих, включая человека (Gross, 2000). В последние десятилетия нейрогенез обнаружен и в других отделах головного мозга, в частности в гипоталамусе, ядрах нигростриарной системы, амигдале и некоторых отделах коры, однако, доказательств того, что там существуют свои резидентные NSC, а не NSC, мигрирующие из V-SVZ и SGZ пока недостаточно (для обзора см. – Li et al., 2018; Obernier, Alvarez-Buylla, 2019; Jurkowski et al., 2020). Тремя основными характеристиками NSC взрослого мозга является возможность длительного пребывания в состоянии пролиферативного покоя, способность к самоподдержанию пула стволовых клеток на протяжении всей жизни, а также способность генерировать популяции промежуточных прогениторов, из которых затем образуются молодые нейроны и глиальные клетки.
Первооткрывателем нейрогенеза во взрослом мозге можно считать Joseph Altman, который еще в 1962-м году на основании данных радиоизотопных исследований предположил, что в гиппокампе и обонятельной луковице головного мозга млекопитающих во взрослом состоянии образуются новые нейроны (Altman, 1962). Лишь два десятилетия спустя Gail D. Burd и Fernando Nottebohm в исследованиях на канарейках доказали, что вновь образованные в ядре, контролирующем пение, клетки формируют синапсы и генерируют нейрональную электрофизиологическую активность, т.е. действительно являются возникшими de novo нейронами (Burd et al., 1985). Окончательные доказательства существования взрослых NSC были получены Brent Reynolds и Samuel Weiss в начале 90-х гг. прошлого века, когда их удалось выделить из стриатума взрослой мыши и в экспериментах in vitro вырастить EGF-индуцированные нейросферы и продемонстрировать их способность к дифференцировке в нейрональном и астроглиальном направлении (Reynolds et al., 1992).
ПРОИСХОЖДЕНИЕ NSC
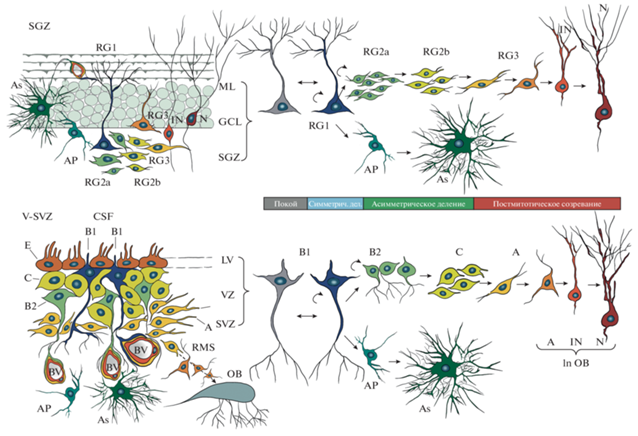
Взрослые NSC или клетки радиальной глии из V-SVZ и SGZ взрослого мозга имеют много общих черт как с дифференцированными астроцитами – экспрессия нестина и GFAP, так и с пренатальными клетками радиальной глии – экспрессия CD133, Sox2, BLBP, GLAST и др., а также апико-базальная эпителиальная структура (рис. 1) (Fuentealba et al., 2015). Исследования с применением секвенирования РНК в режиме single-cell показали, что взрослые NSC происходят из эмбриональных радиальных предшественников (радиальная глия), которые, в свою очередь являются потомками нейроэпителиальных стволовых клеток (Yuzwa et al., 2017). Эмбриональные радиальные предшественники впервые появляются в мозге у мышей в срок Е11.5, а в период с E13.5 до E15.5 формирование их популяции заканчивается (Fuentealba et al., 2015). К концу пренатального периода часть этих клеток переходят в покоящееся состояние, в котором могут пребывать довольно долго, вплоть до активации нейрогенеза в V‑SVZ и SGZ в постнатальном периоде (Obernier et al., 2019). Эти клетки (которые в переднем мозге еще называют пре-B1) экспрессируют негативный регулятор клеточного цикла p57kip2 (Cdkn1c) (Fuentealba et al., 2015). Профиль транскрипции этих покоящихся GFAP-позитивных клеток соответствует транскриптому покоящихся взрослых NSC (qNSC, от англ. quiescence Neural Stem Cells), что позволяет предполагать, что это одна и та же субпопуляция NSC (Yuzwa et al., 2017). В постнатальном периоде qNSC активируются и, вероятно, проходят несколько промежуточных делений, прежде чем в V-SVZ превратиться в клетки B1, или в их аналоги в SGZ – клеткам радиальной глии (РГ) первого типа, которые формируют нишу стволовых клеток взрослого мозга.
Рис. 1.
Схематическая структура организации ниш стволовых клеток в головном мозге. Взрослые нейральные стволовые клетки (NSC) располагаются в двух нишах головного мозга – субгранулярной зоне зубчатой извилины (SGZ) и желудочково-субвентрикулярной зоне (V-SVZ). NSC (клетки B1) в V-SVZ напрямую контактируют ресничкой c цереброспинальной жидкостью (CSF) через стенку боковых желудочков (LV). Клетки B2 располагаются более базально и получают внешние сигналы только от микрососудов (BV). Нейробласты и молодые нейроны V-SVZ (клетки А), образуясь из промежуточных прогениторов (С), мигрируют по ростральному миграционному пути (RMS) в обонятельную луковицу (ОВ), где происходит их постмитотическое созревание. В SGZ NSC (клетки RG1) получают системные сигналы только через кровеносные сосуды (BV). Весь путь от NSC, через промежуточные прогениторы, имеющие глиальный (RG2a) и пронейрональный (RG2b) фенотип до нейробласта (RG3), молодого нейрона (IN) и постмитотического нейрона (N) проходит в пределах ниши. В процессе постмитотического созревания клетки RG3 из SGZ перемещаются в слой гранулярных клеток GCL и выпускают отростки в молекулярный слой (ML) и затем, в процессе постмитотического созревания — в CA3 и CA2 зоны гиппокампа. В V-SVZ и SGZ также всегда присутствуют астроцитарные прогениторы (Ap) и астроциты (As).
ГЕТЕРОГЕННОСТЬ NSC ВЗРОСЛОГО МОЗГА
NSC взрослого мозга происходят из клеток эмбриональной радиальной глии, которые в раннем эмбриональном периоде генерируют все разнообразие нейронов переднего мозга. NSC проявляют гетерогенность в зависимости от локализации в ростро-каудальном и дорсо-вентральном направлениях, что, вероятно, обусловлено конкретными подтипами родительской радиальной глии (Chaker et al., 2016; Obernier et al., 2019). Клональный трекинг подтвердил, что NSC из различных отделов ниши V-SVZ производят различные типы ольфакторных нейронов (Merkle et al., 2014). В ростральных отделах V-SVZ генерируются кальретинин позитивные (CalR+) гранулярные нейроны (granule cells, GCs) и CalR+ перигломерулярные нейроны. Там же, но вентрально производится несколько подтипов интернейронов. В латеральных отделах V-SVZ на всем протяжении в рострокаудальном направлении генерируются гранулярные клетки глубоких слоев. В каудальных отделах V-SVZ вентрально расположенные NSC производят кальбиндин-позитивные (CalB+) перигломерулярные нейроны, а дорсолатеральные NSC генерируют дофаминергические (TH+) нейроны и поверхностные гранулярные нейроны (Fuen-tealba et al., 2015; Chaker et al., 2016; Obernier et al., 2019). Важно отметить, что эта гетерогенность NSC обусловлена их клональными особенностями, а не сигналами локального микроокружения – пересадка NSC в другие зоны V-SVZ не меняет фенотипа генерируемых ими нейронов (Merkle et al., 2007).
Генетический трекинг клонов стволовых клеток с помощью Cre-рекомбиназы (CreERT) позволил обнаружить функциональную гетерогенность NSC в V-SVZ и SGZ. Некоторые клоны NSC в SGZ оказались активно пролиферирующими и коротко живущими, другие наоборот – длительно сохраняют мультипотентность, периодически уходя в состояние покоя, и обновляют cвою популяцию в течение долгого времени (Ibrayeva et al., 2021). Если первый тип – короткоживущие клоны NSC однажды активировавшись, никогда не возвращаются в состояние покоя, то вторые – длительно существующие NSC, судя по всему, способны неоднократно переключаться между покоем и пролиферацией (Urbán et al., 2019).
ОБЩИЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ В НИШАХ СТВОЛОВЫХ КЛЕТОК ВЗРОСЛОГО МОЗГА
В механизмах регуляции покоя/пролиферации/дифференцировки NSC в стволовых нишах можно выделить внешние сигналы (факторы из кровотока и цереброспинальной жидкости (CSF), импульсы внешних ГАМК-, серотонин-, дофаминергических и др. нейронов и внутренние/локальные сигналы – продукция белков внеклеточного матрикса, локальная экспрессия факторов роста и др. локальный сигналинг в нише стволовых клеток (Kjell et al., 2020).
Несомненную роль в активности нейрогенеза играют интегральные физиологические факторы, такие как общая физическая и когнитивная активности, стресс, голод, поисковое поведение, тренировка и пр. Однако исследование таких интегральных факторов сопряжено с методическими трудностями, так как их реализация осуществляется через конкретные системные и локальные механизмы (Urbán et al., 2019). Например, показано, что произвольная физическая активность, в частности, регулярные занятие бегом, активирует нейрогенез в субгранулярной зоне. Этот эффект, судя по всему, является результирующим ответом на мультимодальные изменения, обусловленные как внешними факторами (изменения перфузии/оксигенации, метаболические изменения, модуляция активности гипоталамических нейронов и пр.), так внутренними факторами, включающими повышения уровня IGF1, VEGF (Kjell et al., 2020), а также ряда нейротрансмиттеров, в частности – серотонина в гипокампе в ответ на физическую активность (Han et al., 2015).
Системные сигналы, регулирующие нейрогенез подвержены влияниям возраста, пола, метаболического статуса, циркадных ритмов и пр. факторов, которые невозможно полностью учесть и стандартизовать при различных исследованиях. Физиологический статус может влиять на нейрогенез опосредованно через активность гипоталамических нейронов, иннервирующих ниши стволовых клеток. В частности, чувство голода/насыщения соответственно стимулирует или угнетает активность proopiomelanocortin-позитивных нейронов, которые селективно иннервируют V-SVZ и активируют пролиферацию определенных субпопуляций NSC (Klempin et al., 2013).
Следует понимать, что все опубликованные исследования по регуляции ниш стволовых клеток изучают отдельные сигналы (ГАМКергическая стимуляция, ACSL1, Notch, BMP, Wnt, EGF, LRIG1 и др.). В реальности же происходит одновременный мультимодальный сигналинг, причем как синергических, так и антагонистических сигналов и каждая конкретная клетка, вероятно, реализует некий результирующий регуляторный импульс (Urbán et al., 2019). О синергизме/антагонизме различных сигнальных каскадов известно много, но далеко не все. Так сигналы EGF и PEDF (pigmented epithelium-derived factor) синергичны пути Notch и WNT в активации пролиферации NSCs в V-SVZ (Paul et al., 2017). Синергическую активность Notch и WNT даже остроумно назвали “WNTCH” (Aguirre et al., 2010). Практически все локальные сигналы в нишах стволовых клеток имеют отношение либо к активации пролиферации NSC, либо к аресту клеточного цикла и переходу в состояние покоя (табл. 1), поэтому подробнее будут рассмотрены в следующем разделе.
Таблица 1.
Факторы, регулирующие переход NSCs в состояние покоя
| Активация NSC (вывод из покоящегося состояния) | Перевод в покоящееся состояние/арест клеточного цикла |
|---|---|
| Внутренние сигналы ниши | |
| LRIG1 (Marqués-Torrejón et al., 2021) | Itgb1 (интегрин b1) (Shen et al., 2008; Tavazoie et al., 2008) |
| FGFR3 (Basak et al., 2018) | MFGE8 (Brooker et al., 2016; Zhou et al., 2018) |
| FGF 2 (Douet et al., 2012; Douet et al., 2013; Mercier et al., 2014) | PTEN (Brooker et al., 2016; Zhou et al., 2018) |
| EGFR (Artegiani et al., 2017) | ID2, 3, 4 (Bai et al., 2007; Brooker et al., 2016; Zhou et al., 2018) |
| PEDF (Andreu-Agulló et al., 2009) | Aqp4 (Marqués-Torrejón et al., 2021) |
| ACSL1 (Urbán et al., 2016; Pilz et al., 2018) | E3 убиквитин лигаза HUWE1 (Urbán et al., 2016) |
| Sox2 (Baser et al., 2019) | ApoE3 (Marqués-Torrejón et al., 2021) |
| Pax6 (Baser et al., 2019) | Aldoc (Marqués-Torrejón et al., 2021) |
| Notch1-сигналинг (Delta1 или Jagged1) (Ottone et al., 2014) | Notch2 и Notch3-сигналинг (Basak et al., 2012; Kawai et al., 2017; Zhang et al., 2019) |
| RBPJK (Urbán et al., 2019; Obernier et al., 2019) | Sox9 (Llorens-Bobadilla et al., 2015) |
| DII1, 3 (Llorens-Bobadilla et al., 2015) | Hes1, 5 (Urbán et al., 2019; Obernier et al., 2019) |
| WNT (Lie et al., 2005; Bowman et al., 2013) | FoxO3 (Schaffner et al., 2018) |
| Noggin (Lim et al., 2000) (ингибирует BMP) | BMP1, 6, 4/7 (Llorens-Bobadilla et al., 2015; Basak et al., 2018; Marqués-Torrejón et al., 2021) |
| SHH (Zappaterra et al., 2012) | REST (Mukherjee et al., 2016) |
| CD9 (Urbán et al., 2019; Obernier et al., 2019) | NT-3 (Delgado et al., 2014) |
| TLX (Zhao et al., 2009) | EFNB2 (EPHRIN B2) (Ottone et al., 2014) |
| CDK4 (Chirivella et al., 2017) | SFRP3 (Jang et al., 2013; Seib et al., 2013) |
| Циклин D1 (Ccnd1) (Artegiani et al., 2011) | DKK1 (Jang et al., 2013; Seib et al., 2013) |
| AKT-mTOR1-сигналинг (Bonaguidi et al., 2011) | p27 (Andreu et al., 2015) |
| BMP5 (Silva-Vargas et al., 2016) | p57 (Furutachi et al., 2013) |
| IGF (Lehtinen et al., 2011; Silva-Vargas et al., 2016) | p21 (Marqués-Torrejón et al., 2013) |
| LIF (Bauer et al., 2006) | IL1 beta (Kokovay et al., 2010) |
| GDF11/BMP11 (Katsimpardi et al., 2014) | Сфингозин-1-фосфат (Sato et al., 2007; Kondabolu et al., 2011; Codega et al., 2014) |
| Бетацеллюлин (BTC) (Gómez-Gaviro et al., 2012) | Постагландин D2 (Urbán et al., 2019; Obernier et al., 2019) |
| Mki67 (Llorens-Bobadilla et al., 2015) | Интегрин-связанная киназа (Ilk) (Porcheri et al., 2014) |
| Myc (Leeman et al., 2018) | BMPR1b (Llorens-Bobadilla et al., 2015) |
| Внешние сигналы (нейротрансмиттеры и гормоны) | |
| Diazepam binding inhibitor (DBI) (подавляет ответ на ГАМК) (Alfonso et al., 2012) | ГАМК (Song et al., 2012) |
| Дофамин (Baker et al., 2004; Höglinger et al., 2004; Lennington et al., 2011) | Дофамин (Kippin et al., 2005) |
| Каиновая кислота (агонист глутаматных рецепторов) (Urbán et al., 2019; Obernier et al., 2019) | |
| Серотонин (Tong et al., 2014a) | |
| Глутамат (Song et al., 2017) | |
| Ацетилхолин (Paez-Gonzalez et al., 2014) | |
| Проприомеланокортин (POMC) (Paul et al., 2017) | |
| Пролактин (Shingo et al., 2003) | Системные глюкокортикоиды (Anacker et al., 2017) |
СОСТОЯНИЕ ПОКОЯ NSC – КЛЮЧЕВАЯ ТОЧКА РЕГУЛЯЦИИ ВЗРОСЛОГО НЕЙРОГЕНЕЗА
Состояние покоя – одно из важнейших свойств взрослых резидентных NSC, обеспечивающее сохранность “наивного” пула NSC на протяжении всей жизни. Доля qNSC в нишах стволовых клеток взрослого мозга довольно высока на всем протяжении онтогенеза; есть данные о том, что большинство взрослых NSC бóльшую часть времени находятся в состоянии обратимого ареста клеточного цикла в фазе G0 или G2 (Otsuki et al., 2018). В этой связи, одной из ключевых точек регуляции взрослого нейрогенеза является выход qNSC из состояния покоя, который обеспечивается различными сигналами микроокружения ниши стволовых клеток (для обзора см. Urbán et al., 2019) (табл. 1). Состояние покоя сопровождается пониженной метаболической активностью и уменьшением синтеза РНК и белка. Вместе с тем, последние исследования показали, что состояние покоя – динамически регулируемый процесс, включающий генетическую программу, предотвращающую дифференцировку и обеспечивающую обратимость ареста клеточного цикла (Codega et al., 2014; Otsuki et al., 2018; Basak et al., 2018; Ibrayeva et al., 2021).
qNSC в V-SVZ и SGZ экспрессируют GFAP и CD133/проминин и идентифицируются по отсутствию маркеров пролиферации (Ki67, MCM2); активированные NSC сохраняют GFAP и становятся EGFR позитивными, т.е. главным митогеном, запускающим пролиферацию NSC, является EGF (Pastrana et al., 2009). Эти клетки, вступая в клеточный цикл, генерируют быстро пролиферирующие промежуточные прогениторы или транзиторно амплифицирующиеся прогениторы (TAPs, transit-amplifying progenitors) – C клетки в V-SVZ или клетки 3 типа в SGZ. Они теряют GFAP и маркеры стволовости и могут быть идентифицированы по включению BrdU/EdU, экспрессии Ki67 и MCM2, а также по высокому уровню экспрессии EGFR (Codega et al., 2014; Marqués-Torrejón et al., 2021) (табл. 2). Сравнения транскриптома qNSC и пролиферирующих прогениторов выявило отличия, затрагивающие не только гены, ассоциированные с разными фазами клеточного цикла. У пролиферирующих NSC активно экспрессируются гены, связанные с транскрипцией, трансляцией и репарацией ДНК, в то время как у qNSC в транскриптоме превалируют гены, продукты которых вовлечены в межклеточный сигналинг, клеточную адгезию и функционирование межклеточного матрикса (Codega et al., 2014; Basak et al., 2018; Urbán et al., 2019). Эти данные свидетельствуют о том, что состояние пролиферативного покоя для NSC не является неким анабиозом, но характеризуется активным участием в межклеточном взаимодействии в пределах стволовой ниши.
Выше мы уже упоминали, что одним из интегральных регуляторов нейрогенеза является межклеточный матрикс. Большое значение белки внеклеточного матрикса имеют и в регуляции пролиферативной активности NSC. В частности, сигналы, передающиеся через интегриновый рецептор b1 способствуют переходу NSC в состояние покоя (табл. 1). С другой стороны, qNSC являются основными продуцентами белков внеклеточного матрикса (ECM) и регуляторами его ремоделирования, которое, в частности, осуществляется посредством экспрессии qNSC мультифункционального фермента трансглутаминазы 2, также участвующего в регуляции нейрогенеза (Kjell et al., 2020). Эта активность qNSC и активируемых ими локальных клеток, обеспечивает существенные отличия ECM в нишах стволовых клеток мозга по сравнению с другими структурами мозга.
Переход из состояния покоя в пролиферирующее состояние сопровождается перестройкой метаболизма клетки, в частности переключением с гликолиза на окислительное фосфорилирование в качестве основного источника энергии, активацией экспрессии рибосомальных генов, генов клеточного цикла, транскрипционных факторов, увеличением синтеза РНК (Merkle et al., 2014; Basak et al., 2018). Здесь следует отметить, что в поддержании состояния покоя NSC важную роль играет транскрипционный репрессор REST (RE1-Silencing Transcription factor), напрямую подавляющий экспрессию рибосомальных генов, генов клеточного цикла и нейрональной дифференцировки (Mukherjee et al., 2016). Нокаут гена REST приводит к преждевременной активации qNSC и последующему истощению нейрогенеза. Экспрессия гена REST в NSC препятствует их переходу в пролиферирующее состояние. Наоборот, оверэкспрессия мишеней REST, необходимых для биогенеза рибосом и активации клеточного цикла выводит клетку из состояния покоя (Mukherjee et al., 2016).
Важную роль в поддержании состояния покоя NSC так же, как и в активации нейрональной дифференцировки, играет регуляция трансляции факторов поддержания мультипотентности и пронейрональной дифференцировки. Так, в покоящихся qNSC инактивирован транскрипционный фактор нейрональной дифференцировки ASCL1 (achaete-scute family bHLH transcription factor 1) с помощью посттрансляционных механизмов с участием E3 убиквитин лигазы HUWE1 и репрессорного белка ID4 (Urbán et al., 2016). Репрессия пост-трансляционной активации ASCL1 возвращает NSC в покоящееся состояние, а ее включение, наоборот, способствует пролиферации и нейрональной дифференцировке. Трансляция транскриптов двух других важнейших в судьбе NSC генов – SOX2 и PAX6 также репрессирована в покоящемся состоянии и дерепрессируется при активации пролиферации и дифференцировки (Baser et al., 2019). Таким образом, посттранскрипционная модификация ключевых факторов нейрогенеза является еще одной важной петлей регуляции, участвующей в поддержании динамического равновесия между покоем и пролиферацией NSC.
Отслеживание судьбы клонов NSC, экспрессирующих Ascl1 в SGZ взрослого мозга показало, что они проходят некое ограниченное количество симметричных и ассиметричных делений, вызывая всплеск нейрогенеза, после которого исчезают, вероятно, претерпевая глиальную дифференцировку (Pilz et al., 2018). Это напоминает процессы, проходящие при эмбриональном развитии головного мозга, когда активно пролиферирующие прогениторы прогрессивно теряют свою способность к самообновлению и полностью уходят в дифференцировку (Urbán et al., 2019). Выключение гена Ascl1 останавливает процесс истощения пула NSC. Наоборот, выключение поддерживающих состояние покоя генов, таких как Itgb1 (integrin β1), Pten, или Mfge8, так же, как введение агониста рецепторов глутамата – каиновой кислоты или инактивация E3 убиквитин лигазы HUWE1, приводящая к активации ASCL1, ускоряет истощение пула NSC и их астроцитарную дифференцировку (Brooker et al., 2016; Zhou et al., 2018). Таким образом, ASCL1, является одним из основных активаторов нейрогенеза в SGZ, в результате действия которого NSC, вероятно, уже не возвращаются в состояние покоя, а полностью используют свой нейрогенный потенциал.
КЛЕТОЧНЫЙ КОНТИНУУМ В НИШАХ СТВОЛОВЫХ КЛЕТОК ВЗРОСЛОГО МОЗГА
Транскриптомный анализ отдельных клеток позволил сделать заключение о том, что в стволовых нишах взрослого мозга существует почти непрерывный континуум переходных состояний NSC – от глубокого покоя до активной пролиферации (Llorens-Bobadilla et al., 2015; Urbán et al., 2019; Marqués-Torrejón et al., 2021). Глубина покоя qNSC характеризуется, в частности, более высоким уровнем экспрессии ApoE3 (ApoE), Aldoc, или Id1–Id3 в более глубоко покоящихся клетках. Регуляция покоя/активности NSC осуществляется тремя основными сигнальными путями: BMP, FGF и EGF. Активация сигнального пути BMP-4 опосредованно через экспрессию негативного эффектора Id1, запускает выход NSC из клеточного цикла и образование популяции “спящих” d-qNSC (от англ. dormant non-cycling quiescent state, d-qNSCs) (Marqués-Torrejón et al., 2021). При уменьшении “глубины покоя” и переходе в пролиферирующую стадию в qNSC постепенно нарастает экспрессия генов сигнального пути FGF, в частности, Fgfr3 (Basak et al., 2018) и пути EGF (Artegiani et al., 2017). Комбинированный сигналинг BMP-4/FGF-2 индуцирует образование особой субпопуляции qNSC, готовой для входа в клеточный цикл, названной “праймированные покоящиеся клетки” или p-qNSC (от англ. primed quiescent neural stem cells) (Basak et al., 2018; Marqués-Torrejón et al., 2021).
Новейшие исследования показали, что наиболее важная для возвращения в клеточный цикл субпопуляция p-qNSC характеризуется высоким уровнем экспрессии негативного регулятора RTK сигналинга LRIG1 и CD9. Для субпопуляции p‑qNSC было показано, что меченные геном eGFP эти клетки могут быть успешно трансплантированы в субвенрикулярную зону сингенным мышам, где они активно включаются в нейрогенез (Marqués-Torrejón et al., 2021).
Выключение гена Lrig1 в пределах SVZ in vivo приводит к увеличению уровня пролиферации NSC в этой нише. Таким образом, LRIG1 является важнейшим регулятором выхода p-qNSC из состояния покоя, “привратником”, от которого зависит чувствительность клетки к сигналам EGFR и возвращение в пролиферирующее состояние.
СПОСОБЫ ДЕЛЕНИЯ NSC – СИММЕТРИЧНОЕ И АСИММЕТРИЧНОЕ
Выходя из состояния покоя, NSC могут вступить в ассиметричное деление, при котором образуется стволовая клетка и нейрональная прогениторная клетка либо астроцит или в симметричное деление, в результате которого могут образоваться две стволовых клетки (дупликативное или амплифицирующее деление) или две дифференцированных клетки (дифференцировочное деление) (Pilz et al., 2018). Клональный трекинг NSC с помощью ретровирусной трансдукции репортерных генов показал, что в SGZ зубчатой извилины преимущественно наблюдается асимметричное деление, в то время как в V-SVZ превалирует симметричное деление (Basak et al., 2018; Obernier et al., 2019). При этом, в большинстве случаев происходит дифференцировочное симметричное деление и лишь небольшая часть NSC в V-SVZ (20–30%) подвергаются дупликативному делению, восполняя пул стволовых клеток (Obernier et al., 2019). Таким образом, симметричное деление позволяет независимо регулировать два процесса – самоподдержание популяции NSC, а также дифференцировку и создание пула молодых нейронов.
Выбор режима деления определяется сигналами стволовой ниши, в частности ГАМКергической импульсацией. Выключение тонических ГАМКергических сигналов в зубчатой извилине путем делеции gamma2 субъединицы GABAA рецептора сопровождается преждевременным выходом NSC из состояния покоя и увеличением доли симметричного деления (Urbán et al., 2019).
СТРУКТУРА НИШ СТВОЛОВЫХ КЛЕТОК В ГОЛОВНОМ МОЗГЕ
Ниши стволовых клеток взрослого мозга – V‑SVZ и SGZ организованы похоже и состоят из собственно стволовых клеток (покоящихся и/или пролиферирующих), имеющих фенотип радиальной глии (GFAP+, Nestin+) и признаки стволовости (Sox2+, CD133+), нескольких многочисленных субпопуляций промежуточных прогениторных клеток (обозначаемых в разных источниках TAP или IPC), которые в процессе деления постепенно теряют мультипотентность и последовательно становятся нейральными прогениторами, нейробластами и молодыми нейронами, или глиальными прогениторами и астроцитами (Urbán et al., 2019; Obernier et al., 2019) (табл. 2).
Несмотря на общие принципы организации, ниши стволовых клеток в V-SVZ и SGZ имеют и принципиальные различия. В V-SVZ нейробласты и молодые нейроны покидают нишу, мигрируя в обонятельную луковицу, в то время как в SGZ молодые нейроны располагаются в непосредственной близости от ниши – занимая свое место в слоях гранулярных нейронов зубчатой извилины. Это отличие позволяет предполагать различный уровень пронейрональных локальных факторов. Кроме того, принципиальным отличием V-SVZ является непосредственный контакт NSC с эпендимой и через нее – с CSF, что обеспечивает ответы V-SVZ на изменения в ликворной системе и секреторной активности хориоидного сплетения (Urbán et al., 2019; Obernier et al., 2019).
V-SVZ
Расположенная перивентрикулярно и субэпендимально вокруг боковых желудочков зона V-SVZ содержит большое количество NSC, называемых клетками радиальной глии типа В1, которые морфологически и иммунофенотипически напоминают взрослые радиальные астроциты (рис. 1, табл. 2). Аналогично астроцитам, клетки В1 окружают своими базальными отростками капилляры, с помощью апикальных отростков контактируют с ликворной системой (Mich et al., 2014; Obernier et al., 2019; Jurkowski et al., 2020). В результате асимметричного деления клетки B1 воспроизводят себя, образуют клетки В2, также имеющие астроглиальный фенотип, но лишенные апикальных контактов, а также промежуточные прогениторные клетки типа С (или TAPs), которые начинают активно пролиферировать, накапливая экспрессию пронейрональных генов Ascl1 и Dlx. После 3–4 делений клетки типа С приобретают достаточный пронейрональный потенциал, чтобы в результате следующего деления образовать нейробласты (клетки типа А). Последние образуют ростральный миграционный путь, по которому они мигрируют в обонятельные луковицы, где в дальнейшем подвергаются постмитотическому созреванию (Mich et al., 2014; Obernier et al., 2019; Jurkowski et al., 2020). Для нейробластов V-SVZ характерна экспрессия пронейрональных генов, таких как Dcx, collapsin-response mediator protein-4 (CRMP-4), ганглиозид 9-O-ацетил GD3, NCAM и других белков клеточной адгезии и интегринов, обеспечивающих эффективную миграцию клеток в обонятельную луковицу (OB), которая дополнительно регулируется белками ECM, такими как тенасцин-2 и прокинетицин-2 (Jurkowski et al., 2020).
Таблица 2.
Характеристика основных клеточных субпопуляций в церебральных нишах стволовых клеток
| Тип клеток | Название | Маркеры | Функции | |
|---|---|---|---|---|
| V-SVZ | SGZ | |||
| Покоящиеся NSC | qNSC | qNSC | Nestin, GFAP, CD133, Vimentin, Itgb1, Pten, Mfge8, Aqp4, Id3, Aldoc, ApoE3, FoxO3, Hes1, Spot14, Ilk | Сохранение пула NSC на протяжении жизни |
| Пролиферирующие NSC | В1 | RG1 (тип 1) | Nestin, GFAP, CD133, Vimentin, Sox2, Pax6, Ascl1, BLBP, GLAST, CD133, LewisX (Lex)/CD15/SSEA-1, Egfr, Fgfr, LRIG1, VCAM1, Ki67, MCM2 | Самоподдержание пула NSC; создание пула промежуточных нейрональных и глиальных предшественников и нейробластов |
| NSC/глиальные прогениторы | В2 | RG2 (тип 2a) | Nestin, GFAP, Vimentin, Ascl1, Sox2, BLBP, Shh, IGF1, Tlx | Не известна, возможно – генерация астроцитов и олигодендроглиоцитов |
| Промежуточные прогениторы | С, TAPs |
RG2 (тип 2b) | Nestin, Sox2, Pax6, BLBP, EGFR, Dcx, Dlx, GLAST, NT-3, Tbr2, Ascl1, NeuroD1, Prox1, Wnt, Shh, Igf1, Fgf2 | Поддержание пула нейрональных предшественников, формирование пула нейробластов |
| Нейробласты | А | Тип 3 | NeuroD1, Prox1, Dcx, NCAM, βIII-tubulin, Prox-1, NeuN, CRMP-4, GD3, BDNF, CREB, Dlx1, Dlx2, MAP2, Wnt, Notch, AP-1 | V-SVZ: Миграция по ростральному миграционному пути, постмитотическое созревание и
формирование пула зрелых нейронов обонятельной луковицы. SGZ: Перемещение в гранулярном слое, организация связей с СА3 и CA2 в фазе постмитотического созревания |
| Молодые нейроны | NCAM, βIII-tubulin, NeuN, GD3, BDNF, CREB, MAP2, AP-1, CalR, CalB, GABA, D2/D3, 5-HT | |||
| Клетки эпендимы | Е1 и Е2 | – | S100β, CD133, α-tubulin (C3B9), CD24, GLAST, mCD24, Sox2, Nestin, FoxJ1 | Поддерживающая функция, формирование ниши стволовых клеток |
| Астроциты | GFAP, Vimentin, BLBP, s100β | Поддерживающая функция, формирование ниши стволовых клеток | ||
Интенсивность продукции нейробластов регулируется внешними и внутренними стимулами, зависит от возраста, физической активности, голодания и др. факторов. У молодых мышей продуцируется до 10 000 мигрирующих нейробластов (клеток типа А) в сутки; при том, что общее количество клеток В1 в V-SVZ у них составляет около 7000 (Obernier et al., 2019), это намного больше, чем количество NSC в SGZ, т.е. V-SVZ является самой крупной герминативной зоной взрослого мозга.
SGZ
Мультипотентные NSC в SGZ зубчатой извилины называют клетками радиальной глии (RG) I типа. Эти клетки имеют астроглиальный фенотип (GFAP+, нестин+) и экспрессируют маркеры стволовости Sox2+ и CD133+ (табл. 2). Аналогично фибриллярным астроцитам и клеткам B1, клетки 1 типа оплетают своими отростками микрососуды, что делает их чувствительными к сигналам из микроциркуляторного русла и от церебральных эндотелиоцитов, в частности, к VEGF, который считается одним из индукторов нейрогенеза в SGZ (Kempermann et al., 2015). Получая активирующие сигналы, клетки I типа делятся преимущественно ассиметрично и дают начало прогениторным клеткам II типа, которые в свою очередь подразделяются на прогениторы 2а, имеющие астроглиальный фенотип и прогениторы 2b, которые дают начало молодым гранулярным нейронам (Kempermann et al., 2015; Ampuero et al., 2017). Прогениторные клетки 2 типа экспрессируют Sox2, Shh, Wnts, IGF1, FGF2 и ядерный белок Tlx (Abbott et al., 2020). Активация сигнальных путей Shh, Wnt, IGF1 и FGF2 способствует их дальнейшей дифференцировке, в то время как градиент концентрации IGF1 определяет направление их миграции (Nieto-Estevez et al., 2016).
Нейральные прогениторы типа 2b запускают экспрессию генов пронейрональных транскрипционных факторов Ascl1 Dcx, Nt-3, Tbr2, NeuroD1 и Prox 1 (Abbott et al., 2020) и в дальнейшем дифференцируются в клетки 3 типа (нейробласты), которые затем останавливают клеточный цикл и подвергаются постмитотическому созреванию (Kempermann et al., 2015). В процессе постмитотического созревания нейробласты (клетки III типа) приобретают полярную форму, выпуская дендриты в молекулярный слой GD, а аксоны – к нейронам CA3 зоны гиппокампа и меняют свою пространственную ориентацию, располагаясь более вертикально в гранулярном слое зубчатой извилины (Danzer et al., 2008). При дальнейшем созревании эти клетки формируют дендритные шипики в молекулярном слое зубчатой извилины, и удлиняют аксональные проекции в зону CA2 (Abbott et al., 2020).
В процессе постмитотического созревания, экспрессия ранних пронейрональных генов, характерных для клеток 3 типа (Dcx, Wnt, Notch, NeuroD1 и Prox1) заменяется экспрессией генов более зрелых нейронов, таких как MAP2, BDNF, рилин, CREB, NeuN, кальретинин, активирующий белок 1 (AP-1) (табл. 2) (Gonçalves et al., 2016). Гликопротеин внеклеточного матрикса рилин важен для формирования дендритных шипиков, а также для миграции и позиционирования молодых нейронов в гранулярном слое зубчатой извилины (Ampuero et al., 2017). Фосфорилирование CREB активирует транскрипцию генов c-Fos, Jun-B, Bcl-2, GDNF, экспрессия которых важна для ветвления дендритов и дальнейшего выживания нейронов (Zhang et al., 2016). Белки c-Fos и c-Jun гетеродимеризуясь, образуют AP-1, активирующийся сигнальным каскадом Wnt и в свою очередь, регулирующий пролиферацию, дифференцицировку и апоптоз нейронов зубчатой извилины гиппокампа (Salvi et al., 2016).
В регуляции нейрогенеза в GD большое значение имеет нейротрансмиттерный вход и состояние мембраны созревающего нейрона. Начиная с клеток радиальной глии 2 типа, все последующие субпопуляции прогениторов и нейронов SGZ оверэкспрессируют гены рецепторов ГАМК, что определяет их реакцию на ГАМКергические сигналы, генерируемые локальными интернейронами GD и другими структурами гиппокампа (Kempermann et al., 2015). Помимо ГАМК, пролиферацию и постмитотическое созревание NSC II типа регулируют серотонин и дофамин опосредованно через экспрессируемые ими гены дофаминовых (D2/D3) и серотониновых (5-HT) рецепторов (Salvi et al., 2016; Kohl et al., 2016). SGZ получает множество нейротрансмиттерных сигналов: дофаминергические из VTA (ventral tegmental area), серотонинергические из ядер шва (raphe nuclei), а также ацетилхолинергические из ядер перегородки.
В результате взрослого нейрогенеза в SGZ у грызунов генерируется только один тип нейронов – возбуждающие гранулярные нейроны зубчатой извилины, которые получают сигналы из энторинальной коры и передают возбуждающие импульсы нейронам в CA3 и CA2 зоны гиппокампа (Kempermann et al., 2015). Активируя тормозные интернейроны, вновь образованные гранулярные нейроны ингибируют общую активность GD, что имеет значение в когнитивной пластичности, в частности в улучшении различения близких паттернов (Anacker et al., 2017) (подробнее см. в разделе “Функции NSC взрослого мозга”).
КЛЮЧЕВЫЕ ОСОБЕННОСТИ НЕЙРОГЕНЕЗА ВО ВЗРОСЛОМ МОЗГЕ
Нейрогенез во взрослом мозге не является уменьшенной копией эмбрионального нейрогенеза, но имеет свои особенности и ограничения. Несмотря на то, что и в позднем эмбриональном периоде и во взрослом состоянии молодые нейроны образуются из нейроглиальных радиальных предшественников (Ponti et al., 2017), взрослый нейрогенез принципиально отличается как микроокружением ниш стволовых клеток, так и молекулярными механизмами регуляции (Lugert et al., 2012).
Транскриптомные исследования показали, что паттерн экспрессии нейроэпителиальных радиальных предшественников в эмбриональном периоде наиболее близок к паттерну промежуточных нейрональных прогениторов (IPC или TAPs), в то время как транскриптом клеток радиальной глии V-SVZ и SGZ взрослого мозга ближе всего к транскриптому дифференцированных астроцитов и эпендимальных клеток (Gouti et al., 2015). Астроглия и эпендима в V-SVZ и астроглия в SGZ играют важную роль в функционировании взрослых ниш стволовых клеток, определяя ее преимущественную “глиогенность” (Paez-Gonzalez et al., 2011; Taverna et al., 2014). Эта особенность взрослого микроокружения приводит к тому, что в отличие от эмбриональных NSC, которые дифференцируются преимущественно в нейрональном направлении, взрослые NSC никогда не дифференцируются в нейроны напрямую и достаточно легко дифференцируются в астроциты (Taverna et al., 2014; Götz et al., 2016).
Примечательно, что при культивировании in vitro, в присутствии пронейрональных факторов, как эмбриональные, так и взрослые NSC достаточно легко дифференцируются в нейрональном направлении. Однако, при трансплантации NSC в паренхиму головного мозга взрослого животного как эмбриональные, так и взрослые NSC преимущественно дифференцируются в глиальном направлении (Götz et al., 2016; Samoilova et al., 2021). Исключение составляет трансплантация NSC в зубчатую извилину, в результате которой наблюдается нейрональная дифференцировка пересаженных клеток (Lugert et al., 2012; Fuentealba et al., 2012). Трансплантация нейрональных прогениторов в другие структуры взрослого мозга, в которых естественный нейрогенез отсутствует, приводит к торможению нейрональной дифференцировки, вследствие чего прогениторы либо сохраняют свой исходный фенотип, либо дифференцируются в глиальном направлении (Mira et al., 2010). При этом экспрессия пронейрональных генов, таких как Pax6, Ascl1 и Ngn2, которая активно осуществляется у NSC in vitro, после трансплантации резко снижается, что и обусловливает потерю нейрональной дифференцировки in vivo во взрослом мозге (Barnabé-Heider et al., 2010; Torper et al., 2013).
Приведенные выше результаты и понимание организации ниш стволовых клеток во взрослом мозге позволяет сделать заключение, что взрослые NSC исходно “глиогенны” и способны к нейрогенезу только через промежуточные формы с постепенной активацией пронейрональных транскрипционных факторов и без этой транскрипционной поддержки могут легко сменить направление дифференцировки на глиогенез (Grande et al., 2013). Транскрипционная пронейрональная поддержка при взрослом нейрогенезе осуществляется теми же факторами, что и в эмбригенезе – Pax6, Gsx2, Dlx, Ascl1, Ngn2 и NeuroD1 (Lugert et al., 2012; Ninkovic et al., 2013). Однако, если эмбриональная радиальная глия исходно мультипотентна и способна к прямой пронейрональной дифференцировке, то взрослым NSC необходима серия промежуточных делений для наработки необходимого уровня пронейрональных транскрипционных факторов (Haubst et al., 2004; Costa et al., 2011; Grande et al., 2013; López-Juárez et al., 2013).
Еще одной важной особенностью взрослых NSC является продолжительный клеточный цикл. Эмбриональные NSC до позднего неонатального периода не переходят в состояние покоя и их клеточный цикл длится 10–18 ч, в то время как взрослые NSC, периодически переходя в покоящееся состояние, могут иметь продолжительность клеточного цикла от нескольких суток до двух недель и более (Arai et al., 2011; Bonaguidi et al., 2011; Sohn et al., 2015).
Таким образом, взрослые NSC – специальный, обосабливающийся еще в пренатальном периоде развития пул клеток, имеющий свои особые функции и механизмы регуляции покоя, пролиферации и дифференцировки. В довершении к уже перечисленным свойствам взрослых NSC (пребывание в состоянии покоя, способность к самоподдержанию, способность генерировать промежуточные прогениторные формы из которых развиваются нейроны и глия), можно добавить еще одну ключевую характеристику – это неспособность к прямой нейрональной дифференцировке (Lugert et al., 2012; Götz et al., 2016), которая, вероятнее всего обусловливается глиогенным влиянием микроокружения. Эту исходную “глиогенность” микроокружения взрослого мозга необходимо учитывать при разработке всех нейрорегенеративных технологий, включающих нейрональную дифференцировку.
ФУНКЦИИ NSC ВЗРОСЛОГО МОЗГА
В нише стволовых клеток в V-SVZ в течение жизни мелких млекопитающих образуются сотни миллионов молодых ольфакторных нейронов, которые затем мигрируют оттуда в обонятельную луковицу, формируя ростральный миграционный путь (Jurkowski et al., 2020). Десятки тысяч молодых нейронов, образующихся в SGZ, занимают свое место в гранулярном слое зубчатой извилины. Логично предположить, что и в V-SVZ и в SGZ новые нейроны замещают функции по тем или иным причинам деградирующих нейронов, однако это не совсем так. В последние двадцать лет, с развитием генетических технологий появились новые инструменты для исследования функций новообразованных нейронов. Были, например, получены трансгенные мыши, у которых можно произвести субтотальную деплецию пролиферирующих NSC. Так, у трансгенных мышей Gfap-tk в геном встроен ген тимидинкиназы вируса простого герпеса под контролем промотора GFAP, вследствие чего все пролиферирующие взрослые NSC становятся чувствительны к противовирусному препарату Valganciclovir (VGCC). Если во взрослом состоянии трансгенным мышам Gfap-tk ввести этот препарат, все пролиферирующие NSC подвергаются массированному апоптозу и нейрогенез в церебральных нишах стволовых клеток полностью останавливается (Snyder et al., 2011).
В V-SVZ около 95% новых нейронов дифференцируются в гранулярные клетки (GCs). Подавляющее большинство из оставшихся 5% клеток становятся перигломерулярными клетками (Lledo et al., 2006). И те, и другие являются ГАМКергическими ингибиторными нейронами. Посредством дендрит-дендритных реципрокных связей GCs ингибируют митральные клетки, главные нейроны обонятельной луковицы (Li et al., 2018). Эксперименты с выключением нейрогенеза во взрослом состоянии у трансгенных мышей показали, что животные, у которых нарушено образование молодых ольфакторных нейронов, в целом не отличаются от здоровых мышей, но перестают различать похожие запахи вследствие обеднения паттернов распознавания в митральных клетках OB, обусловленного, вероятно, уменьшением супрессивного воздействия на них ингибиторных гранулярных и перигломерулярных ГАМКергических нейронов, популяция которых обновляется за счет молодых нейронов (Li et al., 2018).
Образованные в результате взрослого нейрогенеза в SGZ молодые нейроны дифференцируются в возбуждающие нейроны и занимают место в гранулярном слое зубчатой извилине. Аксоны этих клеток образуют моховидные волокна, идущие в СА3 и CA2 зоны гиппокампа, где они заканчиваются в виде “синаптических бляшек” в зонах, богатых интернейронами. В течение нескольких недель после образования эти нейроны можно обнаружить по усиленному синаптогенезу и нейрональной пластичности, затем, примерно после 8 недели они становятся неотличимы от взрослых нейронов гранулярного слоя GD (Sailor et al., 2016). Основная функция нейронов гранулярного слоя – передача импульсов в пирамидные клетки СА3 зоны гиппокампа. Эти нейроны передают импульсы довольно редко и их активность реципрокно модулируется большим количеством интернейронов гиппокампа (Kempermann et al., 2015). Результирующим влиянием новообразованных нейронов, вследствие активации локальных тормозных интернейронов является торможение общей активности GD (Anacker et al., 2017). Консолидацию новообразованных нейронов GD в функции гиппокампа, связывают с общей нейрональной пластичностью в процессе когнитивной деятельности, имеющей важное значение при распознавании близких паттернов в процессе обучения, функционировании памяти, а также при адаптивной регуляции эмоциональной сферы (Lledo et al., 2006; Snyder et al., 2011; Sailor et al., 2016; Li et al., 2018; Anacker et al., 2017; Ruddy et al., 2018; Fares et al., 2019; Toda et al., 2019; Jurkowski et al., 2020).
Эксперименты с выключением взрослого нейрогенеза у трансгенных мышей обнаружили, что новообразованные нейроны играют важную роль не только в решении когнитивных задач, но и в реципрокной инактивации гипоталамо-гипофизарно-надпочечниковой системы, активирующейся в ответ на стресс. Так, у трансгенных мышей с деплецией нейрогенеза обнаружили более продолжительное повышение уровня кортикостерона – основного глюкокортикоидного гормона у грызунов – в ответ на острый стресс. Эти мыши показали повышенное пищевое избегание в новом окружении, повышенное истощение в тесте принудительного плавания и другие эквиваленты депрессивного поведения. Это позволило сделать вывод о том, что новообразованные нейроны GD играют важную роль в антистрессорной адаптации организма (Snyder et al., 2011). Важно отметить, что в том же исследовании было показано, что ни циркадные колебания уровня кортикостерона, ни исходный максимум его повышения в ответ на стресс у мышей с деплецией нейрогенеза и диких мышей не отличаются, что еще раз свидетельствует о том, что взрослый нейрогенез не является жизненно необходимым, а относится к механизмам “тонкой настройки” нейроэндокринной системы к окружающей среде. Адаптационная роль взрослого нейрогенеза подчеркивается поведенческими и эмоциональными нарушениями, возникающими при его нарушениях (Anacker et al., 2017).
Как мы уже отмечали выше, радиоуглеродный анализ показал наличие нейрогенеза в SGZ GD гиппокампа взрослого человека (Spalding et al., 2013), однако, иммуногистохимические исследования не подтвердили наличие сколь-либо заметного нейрогенеза у детей старше 13 лет и аналогичных по возрасту нечеловекообразных приматов (Sorrells et al., 2018). В другой работе с иммуногистохимическим исследованием препаратов мозга человека показано, что молодые нейроны обнаруживаются в гиппокампе только у детей до трех лет, в дальнейшем в SGZ пролиферирует только микроглия (Dennis et al., 2016). В этой связи, говорить о функции нейрогенеза у приматов и человека справедливо, по крайней мере применительно к раннему детскому возрасту. В этом возрасте активный нейрогенез связывают с развитием когнитивных функций, способностей обучения и памяти. В то же время, до сих пор всерьез обсуждается роль постнатального нейрогенеза в развитии нейродегенеративных и психических нарушений у взрослых, включая депрессию, и даже болезнь Альцгеймера (Anacker et al., 2017; Berger et al., 2020).
Резюмируя данные исследований у лабораторных животных, можно заключить, что функция новых нейронов, образующихся в процессе взрослого нейрогенеза – участие в процессинге новой информации, поступающей в течение жизни, обеспечивающее когнитивную пластичность и тонкую адаптацию к условиям окружающей среды.
Можно предположить, что именно с выполнением специализированных функций, характерных для определенных нейронных систем мозга связана малоэффективная реакция взрослых NSC в условиях патологии.
РОЛЬ РЕЗИДЕНТНЫХ NSC ПРИ ПАТОЛОГИИ
Роль взрослых NSC при патологии ЦНС в подавляющем большинстве опубликованных работ исследовалась на моделях патологии головного мозга у мелких лабораторных грызунов. Наиболее изучены в этом отношении четыре модели самых частых церебральных катастроф: 1) модель неонатальной гипоксии, воспроизводящей гипоксико-ишемическую энцефалопатию новорожденных; 2) различные варианты травматического повреждения головного мозга (механическая травма, химическая деплеция, лучевое поражение) и различные модели ишемии во взрослом состоянии (фототромбоз, окклюзия средней мозговой артерии и др.), воспроизводящих ишемический инсульт у взрослых (Ruddy et al., 2018).
При заболеваниях и травмах ЦНС происходят глобальные изменения церебрального гомеостаза, затрагивающие в том числе и ниши стволовых клеток мозга. Системные воспалительные сигналы при патологии ЦНС достигают V-SVZ и SGZ через микрососудистое русло, или выделяются в нише реактивной микроглией и инфильтрирующими иммунными клетками. Ряд провоспалительных цитокинов, в частности интерлейкин-6 напрямую воздействует на NSC через соответствующие рецепторы (Storer et al., 2018). Универсальной реакцией стволовой ниши в ответ на любые патологические изменения является активация нейрогенеза. Такая активация во взрослом мозге мышей показана в ответ на массивную гибель нейронов при инсультах, черепно-мозговых травмах, нейродегенеративных заболеваниях, эпилепсии и пр. (Lledo et al., 2006; Snyder et al., 2011; Sailor et al., 2016; Ruddy et al., 2018; Fares et al., 2019; Toda et al., 2019; Jurkowski et al., 2020). Облучение стволовых ниш, хирургическая резекция или химическая деплеция нейрогенеза цитозин-арабинозидом или 5-фторурацилом также неизбежно приводят к активации уцелевших qNSC, усилению пролиферации активированных NSC, а также всех промежуточных прогениторов (Urbán et al., 2019).
Гипоксико-ишемическая энцефалопатия (ГИЭ) у новорожденных мышей характеризуется массированным повреждением в области стриатума, расширением боковых желудочков, нарушениями секреторной функции хориодного сплетения, массивным апоптозом нейробластов в пределах стволовой ниши (Ruddy et al., 2018). Вместе с тем, уже через неделю после экспериментальной ГИЭ наблюдается значительное увеличение количества BrdU+ и Dcx+ положительных пролиферирующих нейробластов – как в V-SVZ на стороне ГИЭ, так и в V-SVZ на контралатеральной стороне (Ong et al., 2005). В активации пролиферации нейробластов в ответ на ГИЭ определенную роль играет оверэкспрессия Notch1, Delta-like 1, и Jagged1 (Felling et al., 2016). Примечательно, что активацию сигналлинга Notch1 может запускать фактор, ингибирующий лейкемию (LIF, leukemia-inhibitory factor), который активируется в реактивных астроцитах в результате травмы. Мы еще будем упоминать этот фактор ниже, при рассмотрении протоколов репрограммирования.
Транскриптомный анализ показал, что в ответ на гипоксико-ишемическое повреждение qNSC кардинально меняют метаболизм, усиливают синтез белка и индуцируют экспрессию транскрипционных факторов (Llorens-Bobadilla et al., 2015). Примечательно, что паттерн экспрессии NSC в ответ на ишемию очень похож на паттерн экспрессии сателлитных стволовых клеток мышечной ткани, что свидетельствует о том, что в qNSC, вероятно, включается универсальная программа генетической экспрессии, одинаковая для различных тканей в условиях тканевой гипоксии (Llorens-Bobadilla et al., 2015). Очевидно, что данная программа имеет непосредственное отношение к репаративной клеточной регенерации, однако, не менее очевидно, что эффективность ее реализации при патологии головного мозга млекопитающих низка. Большое количество исследований посвящено различным подходам по улучшению репаративной регенерации за счет NSC путем дополнительной активации их выживания, пролиферации и миграции с помощью различных биологически активных факторов, таких, как уже упомянутый LIF, малых молекул (метформин, ионы лития), клеточной терапии и пр. (Dadwal et al., 2015; Felling et al., 2016; Ruddy et al., 2018). У мелких грызунов подобные подходы подчас способствуют эффективному восстановлению утраченных функций, однако вероятность их успешной трансляции на патологию человека минимальна.
Обсуждая регенерацию у рыб и амфибий, мы упоминали о репрограммировании с дедифференцировкой и приобретением стволовости, которому подвергаются резидентные клетки в очаге патологии, что вместе с ремоделированием ECM создает уникальные условия для восстановления структур ЦНС de novo (Maden et al., 2013; Goldman et al., 2014). Примечательно, что в стриатуме и медиальной коре у мышей также наблюдали феномен дедифференцировки астроцитов с образованием Ascl1-позитивных нейрональных прогениторов, способных к генерации молодых нейронов (Nato et al., 2015; Magnusson et al., 2020). Обязательным условием такой трансформации является супрессия сигнального пути Notch, что свидетельствует о том, что активность этого пути не только обеспечивает состояние покоя NSC, но и препятствует дедифференцировке астроглии (Magnusson et al., 2020).
СТАРЕНИЕ NSC – ОСОБЕННОСТИ МИКРООКРУЖЕНИЯ?
Старение – процесс, характеризующийся постепенно нарастающими нарушениями гомеостаза, затрагивающими все ниши резидентных стволовых клеток, в том числе и в головном мозге (Samoilova et al., 2021). Вместе с тем, старение NSC имеет свои уникальные особенности. Несмотря на то, что нейрогенез сохраняется в мозге на протяжении всей жизни, интенсивность его в процессе старения мозга заметно снижается вследствие уменьшения пула пролиферирующих NSCs (Basak et al., 2018). Новейшие исследования показали, что в процессе старения мозга, в V-SVZ и SGZ происходят два параллельных процесса – уменьшение общего количества Nestin+ Mcm2+ NSC и увеличение доли qNSC (Nestin+ Mcm2–) (Ibrayeva et al., 2021). То есть, снижение нейрогенеза с возрастом может быть обусловлено переходом большой доли NSC в покоящееся состояние, вследствие снижения с возрастом активирующих сигналов (Urbán et al., 2019). Было обнаружено, что NSC в V-SVZ старых мышей становятся менее чувствительны к сигналам активации при травме мозга, однако, активировавшись старые NSC не отличаются от юных по уровню пролиферации и дифференцировки (Kalamakis et al., 2019); возрастные изменения транскриптома активированных старых NSC также не были обнаружены, что позволяет предположить, что старение ниш стволовых клеток в меньшей степени затрагивает покоящиеся на протяжении жизни NSC по сравнению с их окружением. Старение микроокружения ниши стволовых клеток проявляется снижением сывороточного уровня важных сигнальных молекул, таких как инсулин и IGF, снижением секреторной активности хориоидного сплетения, локальным изменением активности сигнальных путей, в частности, инактивацией пути Wnt его антагонистом sFRP5 (Kalamakis et al., 2019), изменением соотношения IGF-1/BMP5 и др., что суммарно приводит к увеличению доли покоящихся NSC (Urbán et al., 2019; Kalamakis et al., 2019; Ibrayeva et al., 2021).
В отличие от других резидентных стволовых клеток, функции “старых” NSCs могут быть быстро нормализованы до состояния “молодых” при стимуляции in vitro. Так, кондиционированная среда от клеток хориоидного сплетения молодых мышей стимулирует пролиферацию старых NSC и наоборот – среда от клеток хориоидного сплетения старых мышей инактивирует пролиферацию юных NSC, вследствие изменения соотношения BMP5 и IGF1 (Smith et al., 2015). Эксперименты с гетерохронным парабиозом (объединением кровеносных систем молодых и старых мышей) показали, что перфузия мозга старых мышей кровью молодых приводит к восстановлению уровней IGF-1, GH, Wnt3, TGF-β или GDF11 у старых мышей до “молодого” уровня, что существенно активирует нейрогенез и когнитивные функции (Okamoto et al., 2011; Pineda et al., 2013; Katsimpardi et al., 2014; Villeda et al., 2014). Интересно, что ряд ассоциированных с возрастом факторов так или иначе связаны с иммунным ответом и воспалением. Помимо уже упомянутого TGF-β, которые наряду с влиянием на нейрогенез является индуктором Т-клеток, отмечается роль β2-микроглобулина в старении ниш NSC и возрастном ухудшении когнитивных функций (Smith et al., 2015). Интересные результаты были обнаружены Dulken и соавт., которые провели секвенирование 14 685 отдельных клеток в стволовых нишах молодых и старых мышей (Dulken et al., 2019). Это прецизионное исследование подтвердило предположение о том, что с возрастом уменьшается количество активированных NSC. Были также обнаружены возрастные изменения транскриптома эндотелиальных клеток и микроглии, а также, что интересно – увеличение T-клеточной инфильтрации в стареющих нишах стволовых клеток. Обнаруженные в мозге T-клетки по репертуару Т-клеточных рецепторов отличались от Т-клеток в периферической крови тех же старых мышей, что позволило авторам предположить, что возможно, они активированы какими-то церебральными антигенами (Dulken et al., 2019). Т-клетки в старом мозге экспрессировали γ-интерферон, при этом субпопуляции NSC, отвечающие на интереферон, характеризовались сниженным уровнем пролиферации in vivo. Эксперименты in vitro также показали, что Т‑клетки могут ингибировать пролиферацию NSC при кокультивировании, в т.ч. посредством секреции интерферона. Таким образом, иммунные механизмы могут играть свою особую роль в старении церебральных ниш стволовых клеток и в возрастном снижении когнитивных функций (Dulken et al., 2019).
Несмотря на то, что транскриптомные исследования не обнаружили обусловленных возрастом изменений генетической экспрессии в старых NSC, старение затрагивает и непосредственно NSC, что проявляется биохимическими нарушениями, в частности, дисфункцией лизосом, проявляющейся нарушением деградации белков и внутриклеточной аккумуляцией белковых агрегатов (Kalamakis et al., 2019). Различные субпопуляции NSC в V-SVZ имеют кардинальные различия в белковом гомеостазе. Так, активированные NSC характеризуются наличием активных протеасом, в то время как qNSC аккумулируют белковые агрегаты в крупных лизосомах. Лизосомальная активность NSC снижается c возрастом, что приводит к аккумуляции белковых агрегатов и потери способности к активации. Стимуляция функции лизсосом предотвращает это связанное со старением снижение активности (Leeman et al., 2018).
Ibrayeva et al., продемонстрировавшие, что популяция активированных гипокампальных NSC у мышей значительно уменьшается с возрастом, обнаружили определенные молекулярные признаки старения, в числе которых было увеличение экспрессии Abl1 (Ibrayeva et al., 2021). Ингибитор Abl иматиниб может, по мнению авторов, частично восстанавливать функцию стареющих NSC и замедлить процесс их старения.
Изменения в нишах NSC при старении человека гораздо менее изучены, вместе с тем, подавляющее большинство исследователей считают, что взрослый нейрогенез драматически снижается с возрастом, начиная от первого года постнатальной жизни (Spalding et al., 2013; Dennis et al., 2016; Sorrells et al., 2018). Таким образом, и без того низкий регенеративный потенциал головного и спинного мозга человека с возрастом, на который приходится дебют подавляющего большинства нейродегенеративных заболеваний, становится еще меньше. Это обстоятельство побуждает ученых искать альтернативные источники нейральных стволовых клеток для регенеративной терапии.
АЛЬТЕРНАТИВНЫЕ ИСТОЧНИКИ НЕЙРАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ДЛЯ РЕГЕНЕРАТИВНОЙ ТЕРАПИИ ПОРАЖЕНИЙ ЦНС
Среди альтернативных подходов к получению аутологичных нейральных стволовых и прогениторных клеток, обладающих бóльшим регенераторным потенциалом, чем резидентные NSC, особое место занимает прямое репрограммирование соматических клеток в пронейрональном направлении (Ahlfors et al., 2019). Идея прямого репрограммирования дифференцированных аутологичных соматических клеток до уровня стволовых и прогениторных клеток с целью создания регенеративных технологий также заимствована у природы. При изучении регенерации у данио рерио и аксолотля был обнаружен феномен репрограммирования и дедифференцировки клеток в зоне повреждения с образованием мультипотентных стволовых клеток. Примером для регенерации нервной системы являются уже упомянутые клетки Мюллера, которые при повреждении сетчатки репрограммируются в нейрональные прогениторы и восстанавливают таким образом нейроны сетчатки (Goldman et al., 2014). У млекопитающих глия Мюллера теряет способность к репрограммирование in vivo, однако, в экспериментах in vitro можно создать такие условия, при которых глиальные клетки образуют нейрональные прогениторы и затем – нейроны (Goldman et al., 2014).
Эпоха клеточного репрограммирования началась в 2006 году, когда Yamanaka и Takahashi (Takahashi et al., 2006) впервые продемонстрировали технологию создания плюрипотентных клеток из фибробластов мыши посредством ретровирусной трансдукции генов четырех транскрипционных факторов: Oct4, Sox2, Klf4 и c-Myc. Эти четыре транскрипционных фактора с тех пор известны как “факторы Яманаки” или факторы OSKM. Вместе с тем, репрограммирование до состояния плюрипотентной стволовой клетки сопровождается “обнулением” эпигенетического статуса клетки, возникновением геномной нестабильности и терратогенности. Технология прямого репрограммирования до уровня нейральных стволовых/прогениторных клеток лишена этих недостатков (для обзора см. Samoylova et al., 2020; Samoilova et al., 2021). C помощью прямого репрограммирования нейральные прогениторы, способные дать начало специализированным нейронам, могут быть получены из легко доступных аутологичных соматических клеток (Mall et al., 2017; Tanabe et al., 2018; Ahlfors et al., 2019). Прямое репрограммирование, позволяющее миновать потенциально небезопасную стадию индуцированной плюрипотентности, сохраняет эпигенетический “портрет” исходной клетки (Victor et al., 2018). Сохранение возраста репрограммированных клеток обусловливает предпочтительное применение прямого репрограммирования для создания моделей возрастных нейродегенеративных заболеваний, таких как болезни Альцгеймера и Гентингтона (Victor et al., 2018).
Прямое репрограммирование в нейрональном направлении проводят с помощью трансдукции генами первичных и вторичных транскрипционных факторов, опосредующих эмбриональный и/или взрослый нейрогенез (Samoilova et al., 2021). Это такие факторы, как Sox2, Pax6, Msi1, Ascl1, Brn2, Neurogenins, NeuroD1, Myt1l, Gsx2, Dlx. При этом в результате прямого репрограммирования могут быть получены любые клеточные типы из онтогенетического ряда от мультипотентных нейральных стволовых клеток и комитированных нейрональных и глиальных прогениторных клеток до нейробластов и “молодых” нейронов, экспрессирующих базовые нейрональные маркеры. Важным аспектом прямого репрограммирования является инактивация супрессии нейрон-специфических генов у исходных соматических клеток, а также преодоление исходной “глиогенности” микроокружения взрослого мозга (Samoilova et al., 2021). Полученные в результате репрограммирования клетки способны к нейрональной дифференцировке.
Дальнейшее развитие технологии репрограммирования, возможно, позволит создать универсальный протокол, объединяющий в себе положительные черты как репрограммирования через стадию индуцированной плюрипотентности (IPS) (“обнуление” связанного с возрастом паттерна ДНК-метилирования, высокий регенераторный потенциал) так и прямого репрограммирования (отсутствие генетической нестабильности и повышенного риска хромосомных аберраций, быстрота, приемлемая стоимость). Уже сейчас описано получение индуцированных нейронов без стадии IPS (т.е. по сути – методом прямого репрограммирования) без экспрессии OCT-4 приводящего к промежуточной стадии плюрипотентности (Sheng et al., 2018). Репрограммирование клеток периферической крови (эритробласты) выполняли с помощью неинтегрирующихся векторов на основе вируса Сендай с генами SOX2 и c-MYC. Для облегчения репрограммирования в среду добавляли ингибитор GSK3β – CHIR99021, активатор пути SHH – purmorphamine, ингибитор ALK-5 – A83-01, рекомбинантный LIF и tranylcypromine. Полученные в результате этого протокола индуцированные нейроны в течение двух недель от начала репрограммирования оверэкспрессировали пронейрональные гены SOX2, NES, PAX6 и CDH2, при этом экспрессия главного гена плюрипотентности – OCT4 отсутствовала, что свидетельствовало о том, что репрограммирование из гемопоэтической клетки в нейральную прошло без промежуточной IPS-подобной стадии. Через три недели спонтанной дифференцировки полученные молодые нейроны экспрессировали TUJ1+, через 6 недель MAP2 и NeuN, затем была показана их возможность дифференцироваться в глутаматергические, ГАМКергические и серотонинергические нейроны с формированием соответствующих электрофизиологических паттернов. Уникальность этого исследования заключается в том, что авторы показали, что их протокол сопровождается “стиранием” возраст-зависимого профиля метилирования ДНК и омоложением клеток при оценки с помощью эпигенетических часов Horvath (Sheng et al., 2018). Последний факт немаловажен для создания регенеративных технологий, поскольку приближает репрограммированные клетки к фетальным НСК, способным к активному нейрогенезу.
Многочисленные экспериментальные исследования прямо репрограммированных нейроглиальных прогениторных клеток (drNPC) на мелких лабораторных животных показали, что их трансплантация может быть эффективна в терапии экспериментального инсульта (Vonderwalde et al., 2019; Namestnikova et al., 2021) и спинальной травмы (Nagoshi et al., 2018; Nori et al., 2018). При этом drNPC способствовали синаптогенезу, ремиелинизации и функциональному восстановлению неврологического дефицита. Поскольку на мелких лабораторных животных применялась ксеногенная трансплантация drNPC человека, факт нейрональной дифференцировки пересаженных клеток зарегистрирован не был. Частичная нейрональная дифференцировка была показана в экспериментах на крупных лабораторных животных – нечеловекообразных приматах при трансплантации drNPC в составе тканеинженерных конструктов (Baklaushev et al., 2019). Эффективность трансплантированных drNPC была также подтверждена в экспериментах на нечеловекообразных приматах с экспериментальной спинальной травмой, у которых также было показано восстановление соматосенсорных и двигательных вызванных потенциалов, хотя нейрональная дифференцировка пересаженных drNPC в этом исследовании и не обнаруживалась (Baklaushev et al., 2021).
Новой эпохой в регенеративной терапии заболеваний и травм нервной системы может стать репрограммирование in situ, когда, с помощью различных подходов, может быть запущена трансдифференцировка в нейрональном направлении резидентных глиальных и/или мезенхимальных клеток непосредственно в структурах головного мозга. Уже сейчас получены первые доказательства того, что такой подход в принципе возможен. В частности, показано, что деплеция РНК-связывающего белка PTB, через который реализуется блокирующее действие REST на нейрональные транскрипционные факторы запускает программу нейрональной дифференцировки астроцитов у крыс с 6-OHDA гемипаркинсонизмом (Qian et al., 2020). В будущем технология прямого репрограммирования in situ до терминально дифференцированных нейронов (дофаминергических, ацетилхолинергических, серотонинергических и пр.) может позволить решить проблему болезни Паркинсона и других нейродегенеративных заболеваний, характеризующихся прогрессивной нейрональной гибелью (Arenas, 2020).
Таким образом, в дополнение к технологии получения клеток с индуцированной плюрипотентностью, прямое репрограммирование соматических клеток в нейроглиальном направлении открывает новые возможности для развития персонализированной медицины, от разработки in vitro моделей наследственных и дегенеративных неврологических заболеваний в случае репрограммирования с сохранением эпигенетического возраста, до создания нейрорегенеративных технологий – при репрограммировании с “омоложением” паттерна метилирования ДНК.
ЗАКЛЮЧЕНИЕ
У млекопитающих взрослые NSC выполняют специализированные функции: в V-SVZ это генерация определенных типов ольфакторных нейронов, необходимых для различения похожих запахов, в зубчатой извилине – это генерация гранулярных нейронов для включения в нейральные цепи, осуществляющие запоминание образов и обучение на протяжении всей жизни. У мелких лабораторных млекопитающих взрослые NSC не приспособлены обеспечивать регенерацию за пределами зон их компетенции, несмотря на выраженную активацию их пролиферации в условиях патологии. У высших приматов и человека многими исследователями ставится под сомнение возможность сколь-либо заметного нейрогенеза во взрослом состоянии. Отсутствие активного нейрогенеза во взрослом мозге человека делает бесперспективными все попытки активации клеточной регенерации за счет резидентных NSC, в той или иной степени эффективные у крыс и мышей. Альтернативой взрослым NSC могут быть трансплантаты репрограммированных нейральных прогениторных клеток, которые, в отличие от первых, характеризуются повышенной способностью к нейрональной дифференцировке, несмотря на воспалительное микроокружение взрослого мозга, и потенциально способны восстановить утраченные в результате заболеваний и травм ЦНС популяции нейронов.
БЛАГОДАРНОСТИ
Авторы признательны чл.-корр. РАН, д. б. н., профессору А.В. Васильеву за идею написания обзора. Работа выполнена при финансовой поддержке Российского научного фонда (грант № 21-74-20110).
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
При выполнении данного исследования люди и животные не использовались в качестве объектов.
ИНФОРМАЦИЯ О ВКЛАДЕ АВТОРОВ
В.П. Баклаушев, В.В. Белопасов – идея обзора, написание рукописи, Е.М. Самойлова – сбор материала, оформление рукописи, подготовка рисунка. Г.М. Юсубалиева – сбор материала, подготовка рукописи. Все авторы приняли участие в редактировании рукописи.
СПИСОК СОКРАЩЕНИЙ
| ACSL1 | Acyl-CoA Synthetase Long Chain Family Member 1 |
| BLBP | Brain lipid-binding protein |
| BMP | Bone morphogenetic protein |
| BrdU | Bromodeoxyuridine |
| CalB | Calbindin |
| CalR | Calreticulin |
| CD | Claster of Differentiation |
| CSF | Cerebrospinal fluid |
| CRMP-4 | Collapsin-response mediator protein-4 |
| ctgf | Connective tissue growth factor |
| drNPC | Directly reprogrammed neural precursor cell |
| ECM | Extracellular matrix |
| EGF | Epidermal growth factor |
| EGFR | Epidermal growth factor receptor |
| FGF | Fibroblast growth factor |
| FGFR | Fibroblast growth factor receptor |
| GC | Granule cell |
| GD | Gyrus dentatus |
| GFAP | Gliofibrillar acidic protein |
| GLAST | GLutamate ASpartate Transporter |
| GSK3β | Glycogen synthase kinase 3 beta |
| IGF1 | Insulin like growth factor 1 |
| IL | Interleukin |
| IPC | Intermediate progenitor cells |
| IPS | Induced pluripotent stem cell |
| LIF | Leukemia-inhibitory factor |
| LRIG1 | Leucine Rich Repeats and Immunoglobulin Like Domains 1 |
| LV | Lateral ventricle |
| MCM | Mini-chromosome maintenance proteins |
| NCAM | Neural cell adhesion molecule |
| NSC | Neural stem cell |
| OB | Olfactory bulb |
| p-qNSC | Primed quiescent neural stem cells |
| PTB | Polypyrimidine-tract-binding protein |
| PTEN | Phosphatase and tensin homolog deleted on chromosome 10 |
| qNSC | Quiescence Neural Stem Cells |
| REST | RE1-Silencing Transcription factor |
| sFRP5 | Secreted Frizzled Related Protein 5 |
| SGZ | Subgranular zone |
| SHH | Sonic hedgehog |
| TAP | Transit-amplifying progenitor |
| TGF-β | Transforming growth factor beta |
| TNF | Tumor necrosis factor |
| VEGF | Vascular endothelial growth factor |
| V-SVZ | Ventricular-subventricular zone |
| ГАМК | Гамма аминомасляная кислота |
| ГИЭ | Гипоксико-ишемическая энцефалопатия |
| РГ | Радиальная глия |
| ЦНС | Центральная нервная система |
Список литературы
Abbott L.C., Nigussie F. Adult neurogenesis in the mammalian dentate gyrus // Anat. Histol. Embryol. 2020. V. 49. № 1. P. 3–16.
Aguirre A., Rubio M.E., Gallo V. Notch and EGFR pathway interaction regulates neural stem cell number and self-renewal // Nature. 2010. V. 467. № 7313. P. 323–327.
Ahlfors J.E., Azimi A., El-Ayoubi R. et al. Examining the fundamental biology of a novel population of directly reprogrammed human neural precursor cells // Stem Cell Res. Ther. 2019. V. 10. № 1. P. 166.
Alfonso J., Le Magueresse C., Zuccotti A. et al. Diazepam binding inhibitor promotes progenitor proliferation in the postnatal SVZ by reducing GABA signaling // Cell Stem Cell. 2012. V. 10. P. 76–87.
Altman J. Are new neurons formed in the brains of adult mammals? // Science. 1962. V. 135. № 3509. P. 1127–1128.
Ampuero E., Jury N., Hartel S. et al. Interfering of the Reelin/ApoER2/PSD95 signaling axis re-activates dendritogenesis of mature hippocampal neurons // J. Cell. Physiol. 2017. V. 232. № 5. P. 1187–1199.
Anacker C, Hen R. Adult hippocampal neurogenesis and cognitive flexibility – linking memory and mood // Nat. Rev. Neurosci. 2017. V. 18. № 6. P. 335–346.
Andreu Z., Khan M.A., González-Gómez P. et al. The cyclin-dependent kinase inhibitor p27 kip1 regulates radial stem cell quiescence and neurogenesis in the adult hippocampus // Stem Cells. 2015. V. 33. P. 219–229.
Andreu-Agulló C., Morante-Redolat J.M., Delgado A.C. et al. Vascular niche factor PEDF modulates Notch-dependent stemness in the adult subependymal zone // Nat. Neurosci. 2009. V. 12. P. 1514–1523.
Arai Y., Pulvers J.N., Haffner C. et al. Neural stem and progenitor cells shorten S-phase on commitment to neuron production // Nat. Commun. 2011. V. 2. P. 154.
Arenas E. Method to combat Parkinson’s disease by astrocyte-to-neuron conversion // Nature. 2020. V. 582(7813). P. 489–490.
Artegiani B., Lindemann D., Calegari F. Overexpression of cdk4 and cyclinD1 triggers greater expansion of neural stem cells in the adult mouse brain // J. Exp. Med. 2011. V. 208. P. 937–948.
Artegiani B., Lyubimova A., Muraro M. et al. Single-cell RNA sequencing study reveals cellular and molecular dynamics of the hippocampal neurogenic niche // Cell Rep. 2017. V. 21. № 11. P. 3271–3284.
Bai G., Sheng N., Xie Z. et al. Id sustains Hes1 expression to inhibit preco cious neurogenesis by releasing negative autoregulation of Hes1 // Dev. Cell. 2007. V. 13. P. 283–297.
Baker S.A., Baker K.A., Hagg T. Dopaminergic nigrostriatal projections regulate neural precursor proliferation in the adult mouse subventricular zone // Eur. J. Neurosci. 2004. V. 20. P. 575–579.
Baklaushev V.P., Bogush V.G., Kalsin V.A. et al. Tissue engineered neural constructs composed of neural precursor cells, recombinant spidroin and prp for neural tissue regeneration // Sci. Rep. 2019. V. 9. № 1. P. 3161.
Baklaushev V.P., Durov O.V., Kalsin V.A. et al. Disease modifying treatment of spinal cord injury with directly reprogrammed neural precursor cells in non-human primates // World J. Stem Cells. 2021. V. 13. № 5. P. 452–469.
Barnabé-Heider F., Göritz C., Sabelström H. et al. Origin of new glial cells in intact and injured adult spinal cord // Cell Stem Cell. 2010. V. 7. № 4. P. 470–482.
Basak O., Giachino C., Fiorini E. et al. Neurogenic subventricular zone stem/progenitor cells are Notch1-dependent in their active but not quiescent state // J. Neurosci. 2012. V. 32. P. 5654–5666.
Basak O., Krieger T.G., Muraro M.J. et al. Troy+ brain stem cells cycle through quiescence and regulate their number by sensing niche occupancy // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 4. P. E610–E619.
Baser A., Skabkin M., Kleber S. et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells // Nature. 2019. V. 566. № 7742. P. 100–104.
Bauer S., Patterson P.H. Leukemia inhibitory factor promotes neural stem cell self-renewal in the adult brain // J. Neurosci. 2006. V. 26. P. 12089–12099.
Berger T., Lee H., Young A.H. et al. Adult hippocampal neurogenesis in major depressive disorder and alzheimer’s disease // Trends Mol. Med. 2020. V. 26. № 9. P. 803–818.
Bergmann O., Liebl J., Bernard S. et al. The age of olfactory bulb neurons in humans // Neuron. 2012. V. 74. № 4. P. 634–639.
Boldrini M., Fulmore C.A., Tartt A.N. et al. Human hippocampal neurogenesis persists throughout aging // Cell Stem Cell. 2018. V. 22 № 4. P. 589–599. e5.
Bonaguidi M.A., Wheeler M.A., Shapiro J.S. et al. In vivo clonal analysis reveals self-renewing and multipotent adult neural stem cell characteristics // Cell. 2011. V. 145. P. 1142–1155.
Bowman A.N., van Amerongen R., Palmer T.D. et al. Line age tracing with Axin2 reveals distinct developmental and adult populations of Wnt/b-catenin-responsive neural stem cells // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 7324–7329.
Brooker S.M., Bond A.M., Peng C.Y. et al. β1-Integrin restricts astrocytic differentiation of adult hippocampal neural stem cells // Glia. 2016. V. 64. P. 1235–1251.
Burd G.D, Nottebohm F. Ultrastructural characterization of synaptic terminals formed on newly generated neurons in a song control nucleus of the adult canary forebrain // J. Comp. Neurol. 1985. V. 240. № 2. P. 143–152.
Chaker Z., Codega P., Doetsch F. A mosaic world: puzzles revealed by adult neural stem cell heterogeneity // Wiley Interdiscip. Rev. Dev. Biol. 2016. V. 5. № 6. P. 640–658.
Chirivella L., Kirstein M., Ferrón S.R. et al. Cyclin-dependent kinase 4 regulates adult neural stem cell proliferation and differentiation in response to insulin // Stem Cells. 2017. V. 35. P. 2403–2416.
Codega P., Silva-Vargas V., Paul A. et al. Prospective identification and purification of quiescent adult neural stem cells from their in vivo niche // Neuron. 2014. V. 82. № 3. P. 545–559.
Costa M.R., Ortega F., Brill M.S. et al. Continuous live imaging of adult neural stem cell division and lineage progression in vitro // Development. 2011. V. 138. № 6. P. 1057–1068.
Dadwal P., Mahmud N., Sinai L. et al. Activating endogenous neural precursor cells using metformin leads to neural repair and functional recovery in a model of childhood brain injury // Stem Cell Rep. 2015. V. 5. № 2. P. 166–173.
Danzer S.C., Kotloski R.J., Walter C. et al. Altered morphology of hippocampal dentate granule cell presynaptic and postsynaptic terminals following conditional deletion of TrkB // Hippocampus. 2008. V. 18. № 7. P. 668–678.
Delgado A.C., Ferrón S.R., Vicente D. et al. Endothelial NT-3 delivered by vasculature and CSF promotes quiescence of subependymal neural stem cells through nitric oxide induction // Neuron. 2014. V. 83. P. 572–585.
Demircan T. Dissecting the molecular signature of spinal cord regeneration in the axolotl model // Cureus. 2020. V. 12. № 2. P. 7014.
Dennis C.V., Suh L.S., Rodriguez M.L. et al. Human adult neurogenesis across the ages: An immunohistochemical study // Neuropathol. Appl. Neurobiol. 2016. V. 42. № 7. P. 621–638.
Douet V., Arikawa-Hirasawa E., Mercier F. Fractone-heparan sulfates mediate BMP-7 inhibition of cell proliferation in the adult subventricular zone // Neurosci. Lett. 2012. V. 528. P. 120–125.
Douet V., Kerever A., Arikawa-Hirasawa E. et al. Fractone-heparan sulphates mediate FGF-2 stimulation of cell proliferation in the adult subventricular zone // Cell Prolif. 2013. V. 46. P. 137–145.
Dulken B.W., Buckley M.T., Navarro Negredo P. et al. Single-cell analysis reveals T cell infiltration in old neurogenic niches // Nature. 2019. V. 571. № 7764. P. 205–210.
Fares J., Bou Diab Z., Nabha S. et al. Neurogenesis in the adult hippocampus: history, regulation, and prospective roles // Int. J. Neurosci. 2019. V. 129. № 6. P. 598–611.
Felling R.J., Covey M.V., Wolujewicz P. et al. Astrocyte-produced leukemia inhibitory factor expands the neural stem/progenitor pool following perinatal hypoxia-ischemia // J. Neurosci. Res. 2016. V. 94. № 12. P. 1531–1545.
Franjic D., Skarica M., Ma S. et al. Transcriptomic taxonomy and neurogenic trajectories of adult human, macaque, and pig hippocampal and entorhinal cells // Neuron. 2021. S0896-6273(21)00866-7. https://doi.org/10.1016/j.neuron.2021.10.036
Fuentealba L.C., Obernier K., Alvarez-Buylla A. Adult neural stem cells bridge their niche // Cell Stem Cell. 2012. V. 10. № 6. P. 698–708.
Fuentealba L.C., Rompani S.B., Parraguez J.I. et al. Embryonic origin of postnatal neural stem cells // Cell. 2015. V. 161. № 7. P. 1644–1655.
Furutachi S., Matsumoto A., Nakayama K.I. et al. p57 controls adult neural stem cell quiescence and modulates the pace of lifelong neu rogenesis // EMBO J. 2013. V. 32. P. 970–981.
Goldman D. Müller glial cell reprogramming and retina regeneration // Nat. Rev. Neurosci. 2014. V. 15. № 7. P. 431–442.
Gómez-Gaviro M.V., Scott C.E., Sesay A.K. et al. Betacellulin promotes cell proliferation in the neural stem cell niche and stimulates neurogenesis // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 1317–1322.
Gonçalves J.T., Schafer S.T., Gage F.H. Adult neurogenesis in the hippocampus: From stem cells to behavior // Cell. 2016. V. 167. № 4. P. 897–914.
Götz M., Nakafuku M., Petrik D. Neurogenesis in the developing and adult brain-similarities and key differences // Cold Spring Harb. Perspect. Biol. 2016. V. 8. № 7. P. a018853.
Gouti M., Metzis V., Briscoe J. The route to spinal cord cell types: a tale of signals and switches // Trends. Genet. 2015. V. 31. № 6. P. 282–289.
Grande A., Sumiyoshi K., López-Juárez A. et al. Environmental impact on direct neuronal reprogramming in vivo in the adult brain // Nat. Commun. 2013. V. 4. P. 2373.
Gross C.G. Neurogenesis in the adult brain: death of a dogma // Nat. Rev. Neurosci. 2000. V. 1. № 1. P. 67–73.
Han J., Calvo C.F., Kang T.H. et al. Vascular endothelial growth factor receptor 3 controls neural stem cell activation in mice and humans // Cell Rep. 2015. V. 10. № 7. P. 1158–1172.
Haubst N., Berger J., Radjendirane V. et al. Molecular dissection of Pax6 function: the specific roles of the paired domain and homeodomain in brain development // Development. 2004. V. 131. № 24. P. 6131–6140.
Höglinger G.U., Rizk P., Muriel M.P. et al. Dopamine depletion impairs precursor cell proliferation in Parkinson disease // Nat. Neurosci. 2004. V. 7. P. 726.
Ibrayeva A., Bay M., Pu E. et al. Early stem cell aging in the mature brain // Cell Stem Cell. 2021. V. 28. № 5. P. 955–966. e7.
Jang M.H., Bonaguidi M.A., Kitabatake Y. et al. Secreted frizzled-related protein 3 regulates activity-dependent adult hippocampal neurogenesis // Cell Stem Cell. 2013. V. 12. P. 215–223.
Jurkowski M.P., Bettio L., K Woo E. et al. Beyond the hippocampus and the SVZ: adult neurogenesis throughout the brain // Front. Cell Neurosci. 2020. V. 14. № 576444.
Kalamakis G., Brüne D., Ravichandran S. et al. Quiescence modulates stem cell maintenance and regenerative capacity in the aging brain // Cell. 2019. V. 176. № 6. P. 1407–1419.
Katsimpardi L., Litterman N.K., Schein P.A. et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors // Science. 2014. V. 344. P. 630–634.
Kawai H., Kawaguchi D., Kuebrich B.D. et al. Area-specific regulation of quiescent neu ral stem cells by Notch3 in the adult mouse subependymal zone // J. Neurosci. 2017. V. 37. P. 11867–11880.
Kempermann G., Song H., Gage F.H. Neurogenesis in the adult hippocampus // Cold Spring Harb. Perspect. Biol. 2015. V. 7. № 9. P. a018812.
Kippin T.E., Kapur S., Van Der Kooy D. Dopamine specifically inhibits forebrain neural stem cell proliferation, suggesting a novel effect of antipsychotic drugs // J. Neurosci. 2005. V. 25. P. 5815–5823.
Kjell J., Fischer-Sternjak J., Thompson A.J. et al. Defining the adult neural stem cell niche proteome identifies key regulators of adult neurogenesis // Cell Stem Cell. 2020. V. 26. № 2. P. 277–293.
Klempin F., Beis D., Mosienko V. et al. Serotonin is required for exercise-induced adult hippocampal neurogenesis // J. Neurosci. 2013. V. 33. № 19. P. 8270–8275.
Kohl Z., Ben Abdallah N., Vogelgsang J. et al. Severely impaired hippocampal neurogenesis associates with an early serotonergic deficit in a BAC alpha-synuclein transgenic rat model of Parkinson’s disease // Neurobiol. Dis. 2016. V. 85. P. 206–217.
Kokovay E., Goderie S., Wang Y. et al. Adult SVZ lineage cells home to and leave the vascular niche via differential responses to SDF1/CXCR4 signaling // Cell Stem Cell. 2010. V. 7. № 2. P. 163–173.
Kondabolu S., Adsumelli R., Schabel J. et al. Evaluation of prostaglandin D2 as a CSF leak marker: implications in safe epidural anesthesia // Local Reg. Anesth. 2011. V. 4. P. 21–24.
Leeman D.S., Hebestreit K., Ruetz T. et al. Lysosome activation clears aggregates and enhances quiescent neural stem cell activation during aging // Science. 2018. V. 359. № 6381. P. 1277–1283.
Lehtinen M.K., Zappaterra M.W., Chen X. et al. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells // Neuron. 2011. V. 69. № 5. P. 893–905.
Lennington J.B., Pope S., Goodheart A.E. et al. Midbrain dopamine neurons associated with reward processing innervate the neurogenic subventricular zone // J. Neurosci. 2011. V. 31. P. 13078–13087.
Li W.L., Chu M.W., Wu A. et al. Adult-born neurons facilitate olfactory bulb pattern separation during task engagement // Elife. 2018. V. 7. № e33006.
Lie D.C., Colamarino S.A., Song H.J. et al. Wnt signalling regulates adult hippocampal neurogenesis // Nature. 2005. V. 437. P. 1370–1375.
Lim D.A., Tramontin A.D., Trevejo J.M. et al. Noggin antagonizes BMP signaling to create a niche for adult neurogenesis // Neuron. 2000. V. 28. P. 713–726.
Lledo P.M., Alonso M., Grubb M.S. Adult neurogenesis and functional plasticity in neuronal circuits // Nat. Rev. Neurosci. 2006. V. 7. P. 179–193.
Llorens-Bobadilla E., Zhao S., Baser A. et al. Single-cell transcriptomics reveals a population of dormant neural stem cells that become activated upon brain injury // Cell Stem Cell. 2015. V. 17. № 3. P. 329–340.
López-Juárez A., Howard J., Ullom K. et al. Gsx2 controls region-specific activation of neural stem cells and injury-induced neurogenesis in the adult subventricular zone // Genes Dev. 2013. V. 27. № 11. P. 1272–1287.
Lugert S., Vogt M., Tchorz J.S. et al. Homeostatic neurogenesis in the adult hippocampus does not involve amplification of Ascl1 (high) intermediate progenitors // Nat. Commun. 2012. V. 3. P. 670.
Maden M., Manwell L.A., Ormerod B.K. Proliferation zones in the axolotl brain and regeneration of the telencephalon // Neural Dev. 2013. V. 8. № 1. https://doi.org/10.1186/1749-8104-8-1
Magnusson J.P., Zamboni M., Santopolo G. et al. Activation of a neural stem cell transcriptional program in parenchymal astrocytes // eLife. 2020. V. 9. P. e59733.
Mall M., Wernig M. The novel tool of cell reprogramming for applications in molecular medicin // J. Mol. Med. (Berlin, Germany). 2017. V. 95. № 7. P. 695–703.
Marqués-Torrejón M.A., Porlan E., Banito A. et al. Cyclin-dependent kinase inhibitor p21 controls adult neural stem cell expansion by regulating Sox2 gene expression // Cell Stem Cell. 2013. V. 12. P. 88–100.
Marqués-Torrejón M.Á., Williams C.A.C., Southgate B. et al. LRIG1 is a gatekeeper to exit from quiescence in adult neural stem cells // Nat. Commun. 2021. V. 12. № 1. P. 2594.
Mercier F., Douet V. Bone morphogenetic protein-4 inhibits adult neurogenesis and is regulated by fractone-associated heparan sulfates in the subventricular zone // J. Chem. Neuroanat. 2014. V. 57–58. P. 54–61.
Merkle F.T., Fuentealba L.C., Sanders T.A. et al. Adult neural stem cells in distinct microdomains generate previously unknown interneuron types // Nat. Neurosci. 2014. V. 17. № 2. P. 207–214.
Merkle F.T., Mirzadeh Z. Alvarez-Buylla A. Mosaic organization of neural stem cells in the adult brain // Science. 2007. V. 317. P. 381–384.
Mich J.K., Signer R.A.J., Nakada D. et al. Prospective identification of functionally distinct stem cells and neurosphere-initiating cells in adult mouse forebrain // eLife. 2014. V. 3. P. e02669.
Mira H., Andreu Z., Suh H. et al. Signaling through BMPR-IA regulates quiescence and long-term activity of neural stem cells in the adult hippocampus // Cell Stem Cell. 2010. V. 7. № 1. P. 78–89.
Mokalled M.H., Patra C., Dickson A.L. et al. Injury-induced ctgfa directs glial bridging and spinal cord regeneration in zebrafish // Science. 2016. V. 354. № 6312. P. 630–634.
Mukherjee S., Brulet R., Zhang L. et al. REST regulation of gene networks in adult neural stem cells // Nat. Commun. 2016. V. 7. № 13360.
Nagoshi N., Khazaei M., Ahlfors J.E. et al. Human spinal oligodendrogenic neural progenitor cells promote functional recovery after spinal cord injury by axonal remyelination and tissue sparing // Stem Cells Transl. Med. 2018. V. 7. № 11. P. 806–818.
Namestnikova D.D., Gubskiy I.L., Revkova V.A. et al. Intra-arterial stem cell transplantation in experimental stroke in rats: Real-Time MR visualization of transplanted cells starting with their first pass through the brain with regard to the therapeutic action // Front. Neurosci. 2021. V. 15. № 641970.
Nato G., Caramello A., Trova S. et al. Striatal astrocytes produce neuroblasts in an excitotoxic model of Huntington’s disease // Development. 2015. V. 142. P. 840–845.
Nieto-Estevez V., Oueslati-Morales C.O., Li L. et al. Brain insulin-like growth factor-I directs the transition from stem cells to mature neurons during postnatal/adult hippocampal neurogenesis // Stem Cells. 2016. V. 34. № 8. P. 2194–2209.
Ninkovic J., Steiner-Mezzadri A., Jawerka M. et al. The BAF complex interacts with Pax6 in adult neural progenitors to establish a neurogenic cross-regulatory transcriptional network // Cell Stem Cell. 2013. V. 13. № 4. P. 404–408.
Nori S., Khazaei M., Ahuja C.S. et al. Human oligodendrogenic neural progenitor cells delivered with chondroitinase ABC facilitate functional repair of chronic spinal cord injury // Stem Cell Reports. 2018. V. 11. № 6. P. 1433–1448.
Obernier K., Alvarez-Buylla A. Neural stem cells: origin, heterogeneity and regulation in the adult mammalian brain // Development. 2019. V. 146. № 4. P. 156059.
Okamoto M., Inoue K., Iwamura H. et al. Reduction in paracrine Wnt3 factors during aging causes impaired adult neurogenesis // FASEB J. 2011. V. 25 № 10. P. 3570–3582.
Ong J., Plane J.M., Parent J.M. et al. Hypoxic-ischemic injury stimulates subventricular zone proliferation and neurogenesis in the neonatal rat // Pediatr. Res. 2005. V. 58. № 3. P. 600–606.
Otsuki L., Brand A.H. Cell cycle heterogeneity directs the timing of neural stem cell activation from quiescence // Science. 2018. V. 360. № 6384. P. 99–102.
Ottone C., Krusche B., Whitby A. et al. Direct cell-cell contact with the vascular niche maintains quiescent neural stem cells // Nat. Cell Biol. 2014. V. 16. P. 1045–1056.
Paez-Gonzalez P., Abdi K., Luciano D. et al. Ank3-dependent SVZ niche assembly is required for the continued production of new neurons // Neuron. 2011. V. 71. № 1. P. 61–75.
Paez-Gonzalez P., Asrican B., Rodriguez E. et al. Identification of distinct ChAT+ neurons and activity-dependent control of postnatal SVZ neurogenesis // Nat. Neurosci. 2014. V. 17. P. 934–942.
Pastrana E., Cheng L.-C., Doetsch F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 6387–6392.
Paul A., Chaker Z., Doetsch F. Hypothalamic regulation of regionally distinct adult neural stem cells and neurogenesis // Science. 2017. V. 356. № 6345. P. 1383–1386.
Pilz G.A., Bottes S., Betizeau M. et al. Live imaging of neurogenesis in the adult mouse hippocampus // Science. 2018. V. 359. № 6376. P. 658–662.
Pineda J.R., Daynac M., Chicheportiche A. et al. Vascular-derived TGF-β increases in the stem cell niche and perturbs neurogenesis during aging and following irradiation in the adult mouse brain // EMBO Mol. Med. 2013. V. 5. № 4. P. 548–562.
Ponti G., Obernier K., Alvarez-buylla A. et al. Lineage progression from stem cells to new neurons in the adult brain ventricular-subventricular zone // Cell Cycle. 2017. V. 12. № 11. P. 1649–1650.
Porcheri C., Suter U., Jessberger S. Dissecting integrin-dependent regulation of neural stem cell proliferation in the adult brain // J. Neurosci. 2014. V. 34. P. 5222–5232.
Qian H., Kang X., Hu J. et al. Reversing a model of Parkinson’s disease with in situ converted nigral neurons // Nature. 2020. V. 582(7813). P. 550–556.
Reynolds B.A., Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system // Science. 1992. V. 255. № 5052. P. 1707–1710.
Ruddy R.M., Morshead C.M. Home sweet home: the neural stem cell niche throughout development and after injury // Cell Tissue Res. 2018. V. 371. № 1. P. 125–141.
Sailor K.A., Valley M.T., Wiechert M.T. et al. Persistent structural plasticity optimizes sensory information processing in the olfactory bulb // Neuron. 2016. V. 91. P. 384–396.
Salvi R., Steigleder T., Schlachetzki J.C. et al. Distinct effects of chronic dopaminergic stimulation on hippocampal neurogenesis and striatal doublecortin expression in adult mice // Front.Neurosci. 2016. V. 10. P. 77.
Samoilova E.M., Belopasov V.V., Baklaushev V.P. Transcription factors of direct neuronal reprogramming in ontogenesis and ex vivo // Mol. Biol. (Moscow). 2021. V. 55. № 5. P. 707–733.
Samoilova E.M., Belopasov V.V., Ekusheva E.V. et al. Epigenetic clock and circadian rhythms in stem cell aging and rejuvenation // J. Pers. Med. 2021. V. 11. № 1050.
Samoylova E.M., Baklaushev V.P. Cell reprogramming preserving epigenetic age: advantages and limitations // Biochemistry (Moscow). 2020. V. 85. № 9. P. 1035–1047.
Sato K., Malchinkhuu E., Horiuchi Y. et al. HDL-like lipoproteins in cerebrospinal fluid affect neural cell activity through lipoprotein-associated sphingosine 1-phosphate // Biochem. Biophys. Res. Commun. 2007. V. 359. № 3. P. 649–654.
Schaffner I., Minakaki G., Khan M.A. et al. FoxO function is essential for maintenance of autophagic flux and neuronal morphogenesis in adult neurogenesis // Neuron. 2018. V. 99. P. 1188–1203. e6.
Seib D.R., Corsini N.S., Ellwanger K. et al. Loss of Dickkopf-1 restores neu rogenesis in old age and counteracts cognitive decline // Cell Stem Cell. 2013. V. 12. P. 204–214.
Shen Q., Wang Y., Kokovay E. et al. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions // Cell Stem Cell. 2008. V. 3. P. 289–300.
Sheng C., Jungverdorben J., Wiethoff H. et al. A stably self-renewing adult blood-derived induced neural stem cell exhibiting patternability and epigenetic rejuvenation // Nat. Commun. 2018. V. 9. № 1. P. 4047.
Shingo T., Gregg C., Enwere E. et al. Pregnancy-stimulated neurogenesis in the adult female forebrain mediated by prolactin // Science. 2003. V. 299. P. 117–120.
Silva-Vargas V., Maldonado-Soto A.R., Mizrak D. et al. Age-dependent niche signals from the choroid plexus regulate adult neural stem cells // Cell Stem Cell. 2016. V. 19. № 5. P. 643–652.
Smith L.K., He Y., Park J.S. et al. β2-Microglobulin is a systemic pro-aging factor that impairs cognitive function and neurogenesis // Nat. Med. 2015. V. 21. P. 932–937.
Snyder J.S., Soumier A., Brewer M. et al. Adult hippocampal neurogenesis buffers stress responses and depressive behavior // Nature. 2011. V. 476. № 7361. P. 458–461.
Sohn J., Orosco L., Guo F. et al. The subventricular zone continues to generate corpus callosum and rostral migratory stream astroglia in normal adult mice // J. Neurosci. 2015. V. 35. № 9. P. 3756–3763.
Song J., Zhong C., Bonaguidi M.A. et al. Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision // Nature. 2012. V. 489. P. 150–154.
Song M., Yu S.P., Mohamad O. et al. Optogenetic stimulation of glutamatergic neuronal activity in the striatum enhances neurogenesis in the subventricular zone of normal and stroke mice // Neurobiol. Dis. 2017. V. 98. P. 9–24.
Sorrells S.F., Paredes M.F., Cebrian-Silla A. et al. Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults // Nature. 2018. V. 555. № 7696. P. 377–381.
Spalding K.L., Bergmann O., Alkass K. et al. Dynamics of hippocampal neurogenesis in adult humans // Cell. 2013. V. 153. № 6. P. 1219–1227.
Storer M.A., Gallagher D., Fatt M.P. et al. Interleukin-6 regulates adult neural stem cell numbers during normal and abnormal post-natal development // Stem Cell Reports. 2018. V. 10. P. 1464–1480.
Suetsugu-Maki R., Maki N., Nakamura K. et al. Lens regeneration in axolotl: new evidence of developmental plasticity // BMC Biol. 2012. V. 10. № 103.
Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors // Cell. 2006. V. 126. P. 663–676.
Tanabe K., Ang C.E., Chanda S. et al. Transdifferentiation of human adult peripheral blood T cells into neurons // Proc. Natl. Acad. of Sci. U. S. A. 2018. V. 115. № 25. P. 6470–6475.
Tavazoie M., Van Der Veken L., Silva-Vargas V. et al. A specialized vascular niche for adult neural stem cells // Cell Stem Cell. 2008. V. 3. P. 279–288.
Taverna E., Götz M., Huttner W.B. The cell biology of neurogenesis: Toward an understanding of the development and evolution of the neocortex // Annu. Rev. Cell Dev. Biol. 2014. V. 30. P. 465–502.
Toda T., Parylak S.L., Linker S.B. et al. The role of adult hippocampal neurogenesis in brain health and disease // Mol. Psychiatry. 2019. V. 24. № 1. P. 67–87.
Tong C.K., Chen J., Cebrián-Silla A. et al. Axonal control of the adult neural stem cell niche // Cell Stem Cell. 2014a. V. 14. P. 500–511.
Torper O., Pfisterer U., Wolf D.A. et al. Generation of induced neurons via direct conversion in vivo // Proc. Natl. Acad. Sci. 2013. V. 110. № 17. P. 7038–7043.
Urbán N., Blomfield I.M., Guillemot F. Quiescence of adult mammalian neural stem cells: a highly regulated rest // Neuron. 2019. V. 104. № 5. P. 834–848.
Urbán N., van den Berg D.L., Forget A. et al. Return to quiescence of mouse neural stem cells by degradation of a proactivation protein // Science. 2016. V. 353. № 6296. P. 292–295.
Victor M.B., Richner M., Olsen H.E. et al. Striatal neurons directly converted from Huntington’s disease patient fibroblasts recapitulate age-associated disease phenotypes // Nat. Neurosci. 2018. V. 21. № 3. P. 341–352.
Villeda S.A., Plambeck K.E., Middeldorp J. et al. Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice // Nat. Med. 2014. V. 20. № 6. P. 659–663.
Vonderwalde I., Azimi A., Rolvink G. et al. Transplantation of directly reprogrammed human neural precursor cells following stroke promotes synaptogenesis and functional recovery // Transl. Stroke Res. 2019. V. 11. № 1. P. 93–107.
Yuzwa S.A., Borrett M.J., Innes B.T. et al. Developmental emergence of adult neural stem cells as revealed by single-cell transcriptional profiling // Cell Rep. 2017. V. 21. № 13. P. 3970–3986.
Zappaterra M.W., Lehtinen M.K. The cerebrospinal fluid: regulator of neurogenesis, behavior, and beyond // CMLS. 2012. V. 69. № 17. P. 2863–2878.
Zhang D., Wang X., Lu X.Y. Adiponectin exerts neurotrophic effects on dendritic arborization, spinogenesis, and neurogenesis of the dentate gyrus of male mice // Endocrinology. 2016. V. 157. № 7. P. 2853–2869.
Zhang R., Boareto M., Engler A. et al. Id4 downstream of Notch2 maintains neural stem cell quiescence in the adult hippocampus // Cell Rep. 2019. V. 28. P. 1485–1498. e6.
Zhao C., Sun G., Li S. et al. A feedback regulatory loop involving microRNA-9 and nuclear receptor TLX in neural stem cell fate deter mination // Nat. Struct. Mol. Biol. 2009. V. 16. P. 365–371.
Zhou Y., Bond A.M., Shade J.E. et al. Autocrine Mfge8 signaling prevents developmental exhaustion of the adult neural stem cell pool // Cell Stem Cell. 2018. V. 23. № 3. P. 444–452. e4.
Дополнительные материалы отсутствуют.


