Онтогенез, 2022, T. 53, № 3, стр. 228-238
Генетика атавизма
В. П. Корж a, *, Е. В. Гасанов a
a Институт молекулярной и клеточной биологии в Варшаве
02-109 Варшава, ул. Князя Тройдена, 4, Польша
* E-mail: vkorzh@iimcb.gov.pl
Поступила в редакцию 15.12.2021
После доработки 24.01.2022
Принята к публикации 30.01.2022
Аннотация
Атавизмы с давних времен привлекали внимание людей. Сперва они будили воображение и представляли плодотворную почву для мифов и суеверий. С развитием науки они стали предметом научного интереса, и вскоре результаты исследования атавизмов вошли в виде доказательств в теорию эволюции. И все же на молекулярном уровне их появление оставалось недостаточно исследованным. Недавний прогресс сравнительной геномики и молекулярной биологии развития привел к пониманию процесса, лежащего в основе проявления одного из атавизмов человека – рудиментарного хвоста.
“We are all mutants. But some of us are more mutant than others”. Armand Marie Leroi, Mutants: On Genetic Variety and the Human Body
ВВЕДЕНИЕ
По определению Вильгельма Ру, в биологии термин “атавизм” определяет возрождение биологической структуры, которая была утрачена предшественниками в ходе эволюции (Correns et al., 1912). Термин “атавизм”, введенный в 1766 г. французским ботаником Дюшеном, происходит от латинского atavis, что примерно соответствует такому понятию как “предшественник” (Hall, 2010; Zanni, Opitz, 2013). У человека известен ряд атавизмов: дальтонизм, лишние соски, увеличенные зубы, удлиненный копчик – “хвост”, избыток волос и т.д. Существование атавизмов является большой проблемой для креационистов, оспаривающих эволюцию. Атавизмы – это тот непреодолимый аргумент теории эволюции, который противоречит основной идее креационизма о том, что животные и растения существуют в неизменном виде с момента создания.
Атавизм следует отличать от рудимента – признака или органа, постепенно в процессе эволюции теряющего ту функцию, что он выполнял у предков. Рудимент, хоть и имеет проявление недоразвитого признака или органа, но в противовес атавизму в норме широко представлен у особей данного вида. Примерами рудимента могут служить так называемые “зубы мудрости” человека – задние коренные зубы, большую часть жизни не несущие функциональной нагрузки и отстающие в развитии, остатки волосяного покрова на теле, несмотря на разную степень выраженности в популяции, нигде не несущие теплоизоляционной функции шерсти, и мышцы головы, ответственные за движения ушных раковин. Все эти органы и признаки как-то использовались давними предками, но утратили свою функцию в ходе эволюции человека. При этом термин “рудимент” трактуется шире, обозначая любой, не обязательно присутствующий в норме, недоразвитый и нефункциональный признак или орган. Ниже этот термин используется именно в таком значении.
Выше уже упоминалось, что атавизмы известны не только у человека, но и у растений и животных. Некоторые авторы полагают, что даже рак может быть своеобразной формой клеточного атавизма, поскольку представляет собой возврат клеток в их более примитивную форму предкового квази-одноклеточного фенотипа (Lineweaver et al., 2021). Эта довольно экзотичная идея, как нам кажется, незаслуженно популярна в современной научной литературе. Что касается публикаций на тему эволюции на клеточном уровне, то среди них можно найти и концептуально противоположную точку зрения, согласно которой опухоли выступают в качестве испытательного полигона для эволюции новых генов (Kozlov, 2010; Matyunina et al., 2019). Тем не менее, мы предпочитаем рассматривать атавизм с точки зрения биологии развития. Этот подход был детально исследован авторами, следующими по стопам Вильгельма Ру, и определяющими атавизм как “возникновение биологической структуры” (Zanni, Opitz, 2013; Tubbs et al., 2016).
Далеко не все аномалии развития, часто называемые атавизмами, таковыми являются. Примером может служить гипердонтия – появление дополнительного зуба или зубов, чаще всего постоянных (Rallan et al., 2013; Belmehdi et al., 2018). Однако у предков человека дополнительных, тем более непарных зубов не было. Именно поэтому данная аномалия развития, являющаяся следствием повышенной активности факторов роста в дентальной пластинке, не может быть признана проявлением утраченной в ходе эволюции вида биологической структуры, т.е. атавизмом.
Тот факт, что биологическая структура или функция были утрачены, не обязательно означает, что вместе с ней были утрачены гены, ответственные за формирование этой структуры. Часто утрата биологической функции связана с изменением регуляция экспрессии этих генов. Например, экспрессия гена может быть полностью или частично выключена из-за эпигенетического влияния на регуляторную область, определяющую экспрессию гена, например, на уровне энхансеров или посредством вставки мобильных генетических элементов, таких как транспозоны, в регуляторную часть генома. Известный американский изобретатель Т.А. Эдисон (1847–1931) однажды сказал: “Чтобы изобретать, нужно иметь хорошее воображение и кучу хлама”. Очевидно, у природы было в достатке хорошего воображения и хватало времени на то, чтобы, покопавшись в большой куче некодирующей ДНК (98.5% генома человека), состоящей в основном из транспозонов, регуляторных и повторяющихся последовательностей, найти некоторым из них какое-то, полезное с точки зрения эволюции, применение. Например, один из неавтономных мобильных элементов – Alu-элемент существует в более чем 1 млн копий, что по оценкам составляет 11% генома человека. В связи с этим было высказано предположение, что размножение в геноме мобильных элементов играет важную роль в видообразовании (Kazazian, 2004). В процессе эволюции многие транспозоны приобрели функциональную роль регуляторных элементов. В частности, они используются в качестве энхансеров (Oliver, Green, 2009).
В доказательство того, что Эдисон был прав, после детального исследования транспозонов, их выделения и модификации они превратились в эффективные векторы для доставки ДНК в геномы модельных животных. В настоящее время именно таким образом транспозоны широко используются при создании трансгенных животных и мутантов. Встраивание такого транспозона в геном не только вносит новую наследственную информацию. Этот процесс зачастую нарушает структуру ДНК и функцию генов в месте встраивания транспозона (инсерции; Корж, 2008; Korzh, 2007; Kawakami, 2007; Sivasubbu et al., 2007). Удаление такого транспозона под воздействием активной транспозазы (белка, инициирующего транспозицию мобильного элемента) или геномного стресса часто приводит к перемещению (ремобилизации) транспозона, что может восстановить функцию гена, утраченную в результате инсерции (Parinov et al., 2004; Urasaki et al., 2006; Kondrychyn et al., 2009). Такая ремобилизация могла бы вернуть клетки, ткань, орган в состояние, близкое тому, что существовало в организме предков до того, как интеграция транспозона в геном предка вызвала нарушение функции гена и запустила эволюционные изменения.
Намеки на существование причинно-следственных связей между атавизмами и генами начали появляться еще до того, как стала ясна молекулярная природа гена. Хуже было с пониманием молекулярных механизмов. Во-первых, количество атавизмов довольно ограничено даже у относительно хорошо изученного вида, такого как человек (Gaskill, Marlin, 1989). Во-вторых, генетические модификации могут происходить в некодирующих участках генома, которые, по сравнению с кодирующими участками, гораздо менее изучены. И все же, эта ситуация постепенно начинает меняться и, прежде всего, потому что число видов и особей одного и того же вида, геномы которых секвенированы, лавинообразно растет.
Рис. 1.
Редукция хвоста в процессе эволюции произошла несколько раз, первый раз у амфибий, а среди млекопитающих у грызунов и человекообразных обезьян.

Принимая во внимание принцип канализации развития Уоддингтона, вполне вероятно, что подобные атавистические фенотипы могут возникнуть в результате изменений экспрессии или мутаций более чем одного гена. Например, хорошо известно, что естественная мутация или экспериментальная инактивация функции нескольких генов позвоночных животных и насекомых, которые регулируют развитие глаз (Pax6, Eya, Six3, Hh), приводят к одному и тому же результату – отсутствию глаз (Gehring, 2011; Shaham et al., 2012). Таким образом, результат сверхэкспрессии “мастера-регулятора” Pax6/eyeless, который вызывает развитие эктопических глаз у позвоночных и беспозвоночных (Holder et al., 1995; Chow et al., 1999), хорошо вписывается в предполагаемую схему развития, согласно которой экспрессия одного гена может определять набор регуляторных взаимодействий, приводящих к образованию функционального органа, в данном случае глаза. Логично, что мутация с потерей функции таких генов могла бы приводить к редукции или утрате органа (рис. 1), а восстановление функции гена или генов – если не к полному, то хотя бы частичному восстановлению органа.
В процессе развития один и тот же результат может быть достигнут различными способами. Например, слепота у пещерной рыбы может быть вызвана увеличением экспрессии гена Shh во время эмбриогенеза за счет эпигенетической регуляции, вызванной повышенным метилированием регуляторных областей этого гена (Yamamoto et al., 2004; Gore et al., 2018). Известно, что увеличение активности Shh влечет за собой увеличение экспрессии Pax2 за счет экспрессии Pax6, критически важного мастера-регулятора развития глаза (Macdonald, Wilson, 1996). У слепого голого землекопа тот же результат, по-видимому, достигается комбинацией нескольких инактивирующих мутаций, влияющих на иные гены, такие как Cryba4 и Crybb3 (Kim et al., 2011).
Чтобы придать некий порядок сложной и весьма запутанной паутине молекулярных взаимодействий, ответственных за образование специфических тканей и органов, было предложено понятие сети регуляции генов (СРГ). СРГ состоит “в основном из функциональных связей между регуляторными генами, которые продуцируют факторы транскрипции, и их целевыми цис-регуляторными модулями в других регуляторных генах вместе с генами, которые экспреcсируют пространственно важные сигнальные компоненты” (Davidson, Erwin, 2006). Pax6 относится к одной из таких эволюционно консервативных СРГ: Pax-Six-Eya-Dach (PSEDN; Bessarab et al., 2004; Galli-Tsinopoulou et al., 2014). По всей вероятности, потеря в эволюции функции генов, от которых зависит активность СРГ, может выражаться посредством формирования рудимента – уменьшения и последующего исчезновения органа (рис. 1), а восстановление активности СРГ – в форме атавизма.
Этот пример иллюстрирует то, что современная биология развития достигла важного рубежа. Накоплено достаточно знаний о структурах, представляющих различные атавизмы, и генах, участвующих в этом процессе, для того чтобы исследователи могли не только предположить какие из изменений экспрессии генов могут вызвать атавизм, но и проверить эти предположения в эксперименте. Возможно, результаты этих экспериментов помогут более глубоко осознать молекулярные механизмы, лежащие в основе проявления атавизмов? Может быть, они представят собой отправную точку дальнейшего анализа истории эволюции живого на этой планете? А может предоставят дополнительные аргументы в долгом споре эволюционистов и креационистов? Ответы на эти вопросы каждый может попытаться сформулировать сам. И если иметь в виду последствия упомянутой выше “канализации” Уоддингтона, становится ясно, что проверка всех потенциальных генов-кандидатов даже при использовании современных методов высокопроизводительного анализа может занять значительное время. Тем не менее, в последнее время наблюдается прогресс в установлении причинно-следственных связей между атавизмами и изменениями экспрессии некоторых генов, что и является предметом дальнейшего обсуждения на примере трех различных атавизмов.
Рис. 2.
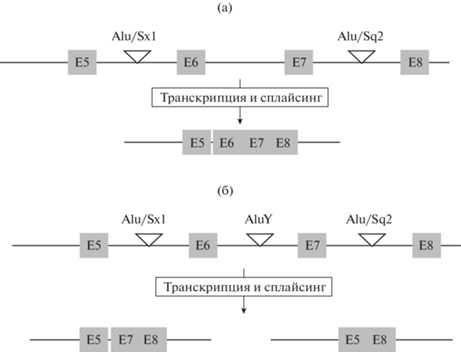
Вставка мобильного элемента AluY в интрон между 6 и 7 экзонами гена BRACHYURY (TBXT) у предков человекообразных обезьян вызвала нарушение сплайсинга и понижение уровня трансляции TBXT, что в свою очередь запустило процесс редукции хвоста у потомков этой группы животных и в том числе у человека. (а) – предковое состояние, (б) – гоминиды.
ПОЛИТЕЛИЯ (ДОПОЛНИТЕЛЬНЫЕ СОСКИ)
В отличие от большинства млекопитающих, имеющих несколько сосков (до 25–27 у опоссумов), у приматов, в том числе у человека, обычно имеется только два соска. Поэтому появление дополнительных сосков у людей рассматривается как возврат к более примитивной эволюционной форме, т.е. как атавизм. Следует отметить, что множественные соски у людей проявляются не так уж редко (от 0.2 до 5.6%; 31) (Galli-Tsinopoulou, Stergidou, 2014).
Анализ раннего этапа формирования молочных желез был проведен Борисом Балинским в лаборатории Уоддингтона в конце 1940-х годов (Balinsky, 1949–1950, 1950), а роль наследственных факторов в этом процессе была продемонстрирована Литтлом и Макдональдом (Little, McDonald, 1965). У мышей линии A/J количество молочных желез (и сосков) отличается от 5 пар, канонических для мышей. Генетический локус, ответственный за эту вариацию, был назван scaramanga (Ska, в честь одного из персонажей фильма о Джеймсе Бонде – “Человек с золотым пистолетом”). Этот локус был связан с активностью лиганда Erbb4–Nrg3, который, как известно, действует в качестве сигнала клеточной дифференцировки для зачатков молочной железы у млекопитающих (Howard et al., 2005). Nrg3 и компоненты связанного с Nrg3 сигнального каскада могут претендовать на роль фактора или факторов развития, регулирующих полителию у человека, но это еще предстоит доказать экспериментально.
ГИПЕРТРИХОЗ (ЧРЕЗМЕРНОЕ КОЛИЧЕСТВО ВОЛОС)
У людей иногда развивается избыток волос – состояние, известное как гипертрихоз. У некоторых индивидуумов образуются эктопические участки оволосения, у других волосы покрывают все тело настолько впечатляюще, что изображение одной из особ – Тогнины Гонсалвус – было использовано в качестве первой страницы популярной книги “Мутанты” А.М. Леруа, переделанной в 2004 г. в документальный фильм Би-би-си “Мутанты человека”. Леруа перефразировал известный афоризм Джорджа Оруэлла “Все животные равны, но некоторые из них более равны, чем остальные”, для демонстрации того, что все человечество является мутантами. Именно версия Леруа, использованная в качестве эпиграфа к этому обзору, отражает роль мутаций в формировании генетической разнородности популяции человека.
Гипертрихоз может быть вызван различными наследственными факторами, начиная от тех, что ответственны за аномальную нейруляцию (Pax3), и заканчивая сохранением рудиментарных (эмбриональных) волос “лануго” (Sales et al., 2021). С гипертрихозом связаны несколько генетических аномалий, и среди них большие внутрихромосомные вставки в интервале в 1.8 × 106 пар нуклеотидов между генами FGF13 и SOX3 на Х-хромосоме (Zhu et al., 2011; DeStefano et al., 2013). Учитывая, что один и тот же фенотип может быть вызван разными вставками, вполне вероятно, что область места вставки, а не сама вставка, имеет решающее значение для возникновения такого фенотипа. Принимая во внимание половой диморфизм по этому признаку у человека (усы, борода у мужчин и т.п.), кажется закономерным, что элементы регуляции уровня оволосения расположены именно на половой X-хромосоме. В данной области содержится несколько генов, кодирующих различные белки и микроРНК. Некоторые из этих генов (SOX3, SPANXB1, SPANXC) регулируют развитие мужских зародышевых клеток, тогда как другие (MCF2) связаны с развитием опухоли гранулярных клеток кожи (https://www.uniprot.org/uniprot/).
У костистых рыб гомолог одного из этих генов – zic3 существует в виде пары генов с родственным zic6, потеря которого в процессе эволюции иллюстрирует точку разрыва хромосомы между этими двумя генами (Parinov et al., 2004; Kondrychyn et al., 2013; Winata et al., 2018). Это может быть одной из причин отсутствия Zic6 у наземных животных. Все эти факты наводят на мысль о том, что участок генома между FGF13 и SOX3 представляет собой “горячую” точку хромосомных перестроек, включая внутрихромосомные инсерции, хромосомные деления и слияния. Следует иметь в виду, что некоторые гены, находящиеся в этом интервале, играют важную роль в формировании общего плана тела или в поддержании жизненно важных функций. FGF13 действует в качестве регулятора сердечных натриевых каналов Nav1.5, Nav 1.6 и, как таковой, вероятно, участвует в регуляции сердечного ритма (Poon et al., 2016; Wang et al., 2017; Minhas et al., 2021), а ZIC3 регулирует асимметрию тела (Purandare et al., 2002; Bellchambers et al., 2021). Как эти функции сочетаются с регуляцией паттерна волосяного покрова, пока неясно. Посему природа генов и механизм их действия, вызывающие гипертрихоз, все еще остаются загадочными.
РУДИМЕНТАРНЫЙ ХВОСТ ЧЕЛОВЕКА
Эта статья не имела бы смысла, если бы в ней не нашлось места для примера, четко доказывающего связь между восстановлением эволюционно архаичной структуры (или атавизмом) и генетической активностью. Таким примером может служить рудиментарный (нефункциональный) хвост человека. В отношении этого атавизма вот-вот должны быть опубликованы новые данные. При этом следует отметить, что в отношении хвоста связь с некоторыми из генов уже давно была довольно очевидна. Однако потребовались усилия нескольких поколений биологов-эволюционистов и невероятные возможности, предоставленные секвенированием всего генома у разных видов, чтобы эту связь доказать.
Эта история началась в 1921 г., когда Надежда Добровольская-Завадская (1878–1954) начала работать под руководством профессора Клода Рего (1870–1940) в лаборатории Пастера института Кюри в Париже. Она провела первый в истории эксперимент по радиационному мутагенезу млекопитающих (мышей), в котором были получены несколько наследственных мутаций с определенным фенотипом. Одна из мутаций, представленная делецией, в гомозиготном состоянии вызывала летальный исход, а у гетерозигот формировался укороченный хвост. Отсюда название мутации – Brachyury (из греческого, “короткий хвост”; Dobrovolskaїа-Zavadskaїa, 1927). История этого открытия была описана в деталях (Корж, 2001; Korzh and Grunwald, 2001). Напомним, что суммируя свои исследования мутантов Brachyury, Добровольская-Завадская писала в 1934 г., что анализ мутанта позволил сформулировать вопрос о генетическом механизме, ответственном за развитие хвоста. Морфологические исследования этого отклонения от нормы привели ее к предположению о существовании генов, ответственных за развитие хвоста. Такие гены действуют как основные специфические регуляторы развития хвоста, которые инструктируют процесс формирования этого органа. В процессе органогенеза гены, подобные Brachyury, взаимодействуют и сотрудничают с дополнительными генами-модификаторами (Dobrovolskaїа-Zavadskaїa et al., 1934). Легко заметить, как подставив в это утверждение вместо Brachyury Pax6, получаем гипотезу о роли Pax6 в качестве основного регулятора развития другого органа – глаза.
В своих выводах, сделанных на основании серии исследований Brachyury, Добровольская-Завадская значительно опередила развитие науки того времени. Насколько ценным было открытие этого мутанта для формирования биологии развития как науки, можно судить из следующего. Понадобилось еще 10 лет дальнейших исследований Brachyury, прежде чем были сформулированы основополагающие принципы биологии развития (Gluecksohn-Schoenheimer, 1944). Исследования Brachyury всегда находились на переднем крае радиационной и молекулярной биологии, генетики, биологии развития, кристаллографии. Brachyury был позиционно клонирован первым из генов, регулирующих развитие млекопитающих (Herrmann et al., 1990). Brachyury был одним из первых транскрипционных факторов млекопитающих, для которых с помощью рентгено-структурного анализа была определена пространственная структура (Müller, Herrmann, 1997). У рыбки данио первой из мутаций, для которой была показана связь с геном, оказалась делеционная мутация no tail (ntl), которая затрагивает ген данио tbxta, гомологичный Brachyury (Schulte-Merker et al., 1994). Естественные мутанты Brachyury выявлены также у домашних животных, таких как мэнские кошки (Buckingham et al., 2013), многие породы собак (bobbed-tailed dogs), например, собственно, бобтейл и корги (Hytönen et al., 2009). Значительная редукция или полное отсутствие хвоста показаны и у диких животных, например, тенрека (Tenrec ecaudatus), крылана Темминка (Megaerops ecaudatus), грызунов капибары (Hydrochoerus hydrochaeris), агути (Dasyprocta), хомяков (Cricetinae) и морской свинки (Cavia porcellus). Можно ожидать, что в ближайшее время причина бесхвостости может быть проанализирована именно у морских свинок, последовательность генома которых известна. Также следует отметить, что не у всех пород собак с врожденным укорочением хвоста найдена мутация в гене tbxt/Brachyury (Hytönen et al., 2009). Это лишний раз подтверждает разветвленность СРГ и возможность достижения схожего фенотипа при мутации различных, входящих в еe состав генов.
Исследуя формирование каудальной области позвоночника у человека, анатомы развития показали, что в развитии человека количество сомитов достигает максимума на 16-ой стадии Карнеги – 39–41 пара сомитов. Позже это число уменьшается вследствие запрограммированной клеточной гибели (апоптоза) пяти пар сомитов в хвостовой области (Tojima et al., 2018). Таким образом была подготовлена почва для того, чтобы связать биологические предпосылки развития хвоста у млекопитающих с эволюционными теориями и подкрепить эти материалы молекулярными доказательствами.
Представим себе на мгновение, что в наше время студент биоинформатики пишет диплом и решил изучить все гены, связанные с нарушениями развития хвоста. Это сравнительно несложно с учетом того, что известны многие мутации, нарушающие эволюционно консервативные элементы молекулярного механизма развития хвоста у модельных животных, таких как данио и мышь. Оказалось, что такой студент может легко идентифицировать все эти гены (Tickey-McCrane et al., 2017). В этом списке: Wnt3a, Tbx6, T/Brachyury (TBXT), Msgn1, Tbx16, Hox10, Hox11, Hox13, Ptf1a, Cyp26a1, CXCR2, Ets1/2, Fgfr1, Fgf8, Fgf24, Cdx1, Dld, Ph2-alfa, Noggin. Первые четыре гена являются наиболее вероятными кандидатами на роль генов, дефицит функции которых вызывает отсутствие хвоста. Wnt3a, Tbx6 и Msgn1 – три критически важных фактора, которые инициируют образование параксиальной мезодермы, из которой развиваются позвонки, тогда как T или Brachyury (в 2018 году переименованный в TBXT для удобства биоинформатиков) действует в индукции пролиферации и дифференцировки клеток мезодермы хвоста и туловища. Мутант мыши Wnt3a, который фенокопирует Brachyury, был даже назван vestigial tail (или “рудиментарный хвост”), что дает достаточно точное представление о том, что автор этой статьи думал о роли мутированного гена в развитии хвоста (Heston, 1951). В ту пору этот ген был все еще гипотетическим. Wnt3a вновь переоткрыли как int-4 (Nurse, Varmus, 1982), а клонировали в начале 1990х (Roelink, Nurse, 1991; Krauss et al., 1992; Nusse, Varmus, 2012).
Судя по всему, авторы диплома Tickey-McCrane 2017 г. были на правильном пути, сославшись на исследования хвостов обезьян Фуденом (Fooden, 1997) и предположив, что “макаки могут владеть ключом” к тайне хвоста человека. В отсутствие надежных данных, связывающих развитие рудиментарных хвостов человека с генами, принимающими участие в развитии, в статьях, посвященных этой теме, велась несколько умозрительная дискуссия на тему о том, какие из хвостов считать настоящими (содержащими позвонки), а какие псевдохвостами. Возможно, в своем анализе авторы дипломной работы следовали взглядам Дао и Нетски (Dao, Netsky, 1984) на природу хвоста человека, которые считали, что рудиментарные хвосты человека не содержат позвоночных структур в отличие от хвостов у хвостатых приматов. Напротив, детальный морфологический анализ показал, что некоторые рудиментарные хвосты человека содержат “дополнительные позвонки и соединены с кончиком копчика” (Sugamata et al., 1988). В любом случае, строгое определение “истинного” хвоста человека в последнее время было подвергнуто ревизии и предложено считать, что любой хвост является истинным (Tubbs et al., 2016).
И уж совсем недавно оказалось, что для ответа на вопрос о том, какой из генов ответственен за формирование рудиментарного хвоста у человека, понадобилось сравнить эволюцию генов, участвующих в развитии хвоста у хвостатых и бесхвостых (человекообразных) обезьян. Недавний препринт, который, вероятно, будет опубликован ко времени публикации этого текста, связал рудиментарный хвост человека с эволюционными изменениями в экспрессии Tbxt (T, Brachyury), вызванными вставкой AluY – одного из наиболее распространенных мобильных элементов в геноме человека – в интрон 6 между экзонами 6 и 7 TBXT предка всех человекообразных обезьян, включая людей (рис. 2). Именно это событие, по всей вероятности, положило начало цепи эволюционных адаптаций, которые привели к отсутствию хвоста у человекообразных обезьян и человека (Xia et al., 2021). В процессе транскрипции AluY, вероятно, образует пару со вторым мобильным элементом AluSx1 в противоположной ориентации, присутствующим в соседнем 5-м интроне. Это приводит к формированию пространственного комплекса мРНК TBXT, состоящего из стебля и петли. Петля заключает в себе экзон 6 TBXT, что вызывает формирование альтернативного транскрипта TBXT-Δexon6 с частичной потерей активности TBXT. После того как вставка AluY запустила процесс эволюционной адаптации, короткий хвост мог, с одной стороны, оказаться неблагоприятным фактором для обитания в трехмерной среде, а с другой – поспособствовать передвижению на двух ногах. Дополнительные модификации этого механизма, вероятно, вызвали не только закрепление этого признака, но и дальнейшее уменьшение хвоста.
В данном случае пролить свет на роль укорочения хвоста в эволюции может сравнение собакоголовых (Cercopithecoidea) и человекообразных (Hominoidea) обезьян. Разделение этих групп произошло, вероятно, незадолго до или сразу после перехода к преимущественно наземному образу жизни, связанному с возникновением саванн и разреженных лесов вместо части джунглей Африки около 25 млн лет назад (Andrews, 1992; Senup, 2016). При этом собакоголовые обезьяны (например, павианы) сохранили как хвост, так и квадрупедальную локомоцию, тогда как человекообразные, даже вернувшись к преимущественно древесному образу жизни (гиббоны, шимпанзе, орангутанги), используют брахиацию (лазание с помощью рук) и несут другие признаки первичной бипедальности. Вероятно, отсутствие хвоста и двуногое хождение имеют прямую связь, возникнув в линии человекообразных на заре их формирования, однако не являются ограничением для древесного образа жизни, лишь меняя характер используемой для этого локомоции.
Предлагаемый молекулярный механизм редукции хвоста был успешно воспроизведен у трансгенных мышей после введения AluY в Brachyury мышей в то же самое положение, что у приматов. Это не только предоставило необходимое экспериментальное доказательство того, что интеграция AluY в TBXT отвечает за редукцию хвоста, но и значительно расширило наши представления о роли транспозонов в эволюции. Таким образом исследования Brachyury, первого гена, изменение экспрессии которого, вероятно, запустило эволюционные изменения редукции хвоста у млекопитающих, вновь оказались на переднем фронте биологии развития – науки, которая возникла в значительной степени благодаря открытию Brachyury в 1927 г. Надеждой Добровольской-Завадской.
Важно отметить, что исследование Xia et al. (2021) наводит на мысль о роли дополнительных факторов развития, таких как гормон щитовидной железы (тиреоидный гормон, ТГ) и ретиноевая кислота (РК) в развитии задней части тела. Для этого необходимо в комплексе рассмотреть несколько вопросов. Не исключено, что роль AluY не ограничивается нарушением сплайсинга. Возможно, такие мобильные элементы выполняют дополнительные регуляторные функции. Известно, что ТГ вызывает резорбцию хвоста во время метаморфоза у шпорцевой лягушки (Tata, 1968, 2006), тогда как РК несет ответственность за снижение экспрессии Wnt-3a, еще одного потенциального регулятора развития хвоста, мутации которого приводят к укорачиванию хвоста мышей, что напоминает синдром каудальной регрессии (Padmanabhan et al., 1998; Iulianella et al., 1999; Shum et al., 1999). Известно также, что Alu-повторы содержат сайты связывания факторов транскрипции, зависимых от ТГ и РК (ядерных рецепторов гормонов) (hormone-response elements, HRE). Каноническим HRE для ТГ-РК является нуклеотидная последовательность AGGTCA, которая часто присутствует в Alu-элементах в двух или более копиях, разделенных промежутком из двух или четырех нуклеотидов. Многие встречающиеся в природе HRE отличаются от этого мотива одним или несколькими нуклеотидами (Vansant et al., 1995; Piedrafita et al., 1996). Возможно, инсерция AluY не только нарушает сплайсинг TBXT, но также, посредством дополнительной регуляции на уровне связывания ядерных рецепторов, изменяет характер ТГ-РК-зависимых процессов развития, например, резорбцию тканей под действием ТГ или экспрессию Wnt-3a в зоне действия TBXT, что вносит дополнительный уровень регуляции редукции хвоста.
По всей вероятности, ответы на эти интригующие вопросы будут даны в ближайшем будущем. Учитывая мощь современной биоинформатики, легко предсказать, что публикация (Xia et al., 2021) запустит процесс активного пересмотра данных в области биологии развития, относящихся к мутантным фенотипам, напоминающим те или иные атавизмы. В сочетании с применением сравнительной геномики это позволит расшифровать молекулярные механизмы разных атавизмов. Само же изучение генетики атавизмов позволяет, как видно из примеров выше, лучше понять пути эволюции видов, включая наиболее для нас интересный – человека. И, хотя проявление атавизмов явление довольно редкое, однако наводит на мысль, что, несмотря на то, что все мы мутанты, некоторые из нас, незначительное меньшинство, по крайней мере морфологически чуть менее мутанты, чем большинство.
Список литературы
Корж В.П. H.А. Добровольская-Завадская и открытие гена Т // Онтогенез. 2001. Т. 32. № 3. С. 234–237.
Корж В. Поиск тканеспецифических регуляторных элементов с помощью транспозона Tol2 как пример эволюционного синтеза геномики и биологии развития // Онтогенез. 2008. Т. 39. № 2. С. 94–99.
Andrews P. Evolution and environment in the Hominoidea // Nature. 1992. V. 360. P. 641–646. https://doi.org/10.1038/360641a0
Balinsky B. On the developmental processes in mammary glands and other epidermal structures // Transactions of the Royal Society Edinburgh. 1949–1950. V. 62. P. 1–31.
Balinsky B.I. On the prenatal growth of the mammary gland rudiment in the mouse // J. Anat. 1950. V. 84. P. 227–235. PMID: 15436328.
Bellchambers H.M., Ware S.M. Loss of Zic3 impairs planar cell polarity leading to abnormal left-right signaling, heart defects and neural tube defects // Hum. Mol. Genet. 2021. V. 30. P. 2402–2415. PMID: https://doi.org/10.1093/hmg/ddab195
Belmehdi A., Bahbah S., El Harti K. et al. Non syndromic supernumerary teeth: management of two clinical cases // Pan Afr. Med. J. 2018. V. 29. P. 163. PMID: 30050627; PMCID: PMC6057571.https://doi.org/10.11604/pamj.2018.29.163.14427
Buckingham K.J., McMillin M.J., Brassil M.M. et al. Multiple mutant T alleles cause haploinsufficiency of Brachyury and short tails in Manx cats // Mamm. Genome. 2013. V. 24. P. 400–408. Epub 2013 Aug 15. PMID: 23949773; PMCID: PMC3848309.https://doi.org/10.1007/s00335-013-9471-1
Chow R.L., Altmann C.R., Lang R.A. et al. Pax6 induces ectopic eyes in a vertebrate // Development. 1999. V. 126(19). P. 4213–4222. PMID: 10477290.
Correns C., Fischel A., Kuster E. Terminologie der Entwicklungsmechanik der Tiere und Pflanzen / Ed. Roux W. Leipzig: Wilhelm Engelmann, 1912.
Davidson E.H., Erwin D.H. Gene regulatory networks and the evolution of animal body plans // Science. 2006. V. 311. P. 796–800. PMID: 16469913https://doi.org/10.1126/science.1113832
Dao A.H., Netsky M.G. Human tails and pseudotails // Hum Pathol. 1984. V. 15. P. 449–453. PMID: 6373560.https://doi.org/10.1016/s0046-8177(84)80079-9
DeStefano G.M., Fantauzzo K.A., Petukhova L. et al. Position effect on FGF13 associated with X-linked congenital generalized hypertrichosis // Proc. Natl. Acad. Sci. USA. 2013. V. 110. P. 7790–7795. PMID: 23603273; PMCID: PMC3651487.https://doi.org/10.1073/pnas.1216412110
Dobrovolskaïa-Zavadskaïa N. Etudes sur les effets produits par les rayons X dans le testicule de la Souris // Arch. de Anat. Micr. 1927. V. 23. P. 396–438.
Dobrovolskaïa-Zavadskaïa N., Kobozieff N., Veretennikoff S. Etude morphologique et genetique de la brachyourie chez les descendants de souris a testicules irradies // Arch de Zool. Exp. 1934. V. 76. P. 249–358.
Fooden J. Tail length variation in Macaca fascicularis and M. mulatta // Primates. 1997. V. 38. P. 221–231. https://doi.org/10.1007/BF02381611
Halder G., Callaerts P., Gehring W.J. Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila // Science. 1995. V. 267. P. 1788–1792. PMID: 7892602.https://doi.org/10.1126/science.7892602
Hall B.K. Atavisms // Curr Biol. 2010. V. 20:R871. PMID: 20971424.https://doi.org/10.1016/j.cub.2010.07.002
Heston W.E. The “vestigial tail” mouse; a new recessive mutation // J. Hered. 1951. V. 42. P. 71–74. PMID: 14832454.https://doi.org/10.1093/oxfordjournals.jhered.a106167
Howard B., Panchal H., McCarthy A. et al. Identification of the scaramanga gene implicates Neuregulin3 in mammary gland specification // Genes Dev. 2005. V. 19. P. 2078–2090. PMID: 16140987; PMCID: PMC1199577.https://doi.org/10.1101/gad.338505
Galli-Tsinopoulou A., Stergidou D. Polythelia: simple atavistic remnant or a suspicious clinical sign for investigation? // Pediatr. Endocrinol. Rev. 2014. V. 11. P. 290–297. PMID: 24716395.
Gaskill S.J., Marlin A.E. Neuroectodermal appendages: the human tail explained // Pediatr. Neurosci. 1989. V. 15. P. 95–99. PMID: 2635301.https://doi.org/10.1159/000120450
Gehring W.J. Chance and necessity in eye evolution // Genome Biol. Evol. 2011. V. 3. P. 1053–1066. PMID: 21979158; PMCID: PMC3227406.https://doi.org/10.1093/gbe/evr061
Gore A.V., Tomins K.A., Iben J. et al. An epigenetic mechanism for cavefish eye degeneration // Nat. Ecol. Evol. 2018. V. 2. P. 1155–1160. PMID: 29807993; PMCID: PMC6023768.https://doi.org/10.1038/s41559-018-0569-4
Gluecksohn-Schoenheimer S. The development of normal and homozygous Brachy (T/T) mouse embryos in the extraembryonic coelom of the chick // Proc. Nat. Acad. Sci. USA. 1944. V. 30. P. 134–140.
Iulianella A., Beckett B., Petkovich M. et al. A molecular basis for retinoic acid-induced axial truncation // Dev. Biol. 1999. V. 205. P. 33–48. PMID: 9882496.https://doi.org/10.1006/dbio.1998.9110
Kawakami K., Sato S., Ozaki H. et al. Six family genes–structure and function as transcription factors and their roles in development // Bioessays. 2000. V. 22. P. 616–626. PMID: 10878574.https://doi.org/10.1002/1521-1878(200007)22:7<616:: AID-BIES4>3.0.CO;2-R
Kawakami K. Tol2: a versatile gene transfer vector in vertebrates // Genome Biol. 2007. V. 8. Suppl. 1:S7. PMID: 18047699; PMCID: PMC2106836.https://doi.org/10.1186/gb-2007-8-s1-s7
Kazazian H.H. Jr. Mobile elements: drivers of genome evolution // Science. 2004. V. 303. P. 1626–32. PMID: 15016989.https://doi.org/10.1126/science.1089670
Kim E.B., Fang X., Fushan A.A. et al. Genome sequencing reveals insights into physiology and longevity of the naked mole rat // Nature. 2011. V. 479. P. 223–227. PMID: 21993625; PMCID: PMC3319411.https://doi.org/10.1038/nature10533
Kondrychyn I., Garcia-Lecea M., Emelyanov A. et al. Genome-wide analysis of Tol2 transposon reintegration in zebrafish // BMC Genomics. 2009. V. 10. P. 418. PMID: 19737393; PMCID: PMC2753552.https://doi.org/10.1186/1471-2164-10-418
Kondrychyn I., Teh C., Sin M. et al. Stretching morphogenesis of the roof plate during coordinated formation of the central canal // PLoS One. 2013. V. 8. P. e56219. https://doi.org/10.1371/journal.pone.0056219
Korzh V., Grunwald D. Nadine Dobrovolskaïa-Zavadskaïa and the dawn of developmental genetics // Bioessays. 2001. V. 23. P. 365–371. PMID: 11268043.https://doi.org/10.1002/bies.1052
Korzh V. Transposons as tools for enhancer-trap screens in vertebrates // Genome Biol. 2007. V. 8 (Suppl. 1): S8. https://doi.org/10.1186/gb-2007-8-S1-SN
Kozlov A.P. The possible evolutionary role of tumors in the origin of new cell types // Med. Hypotheses. 2010. V. 74. P. 177–185. PMID: 19665850.https://doi.org/10.1016/j.mehy.2009.07.027
Krauss S., Korzh V., Fjose A. et al. Expression of four zebrafish wnt-related genes during embryogenesis // Development. 1992. V. 116. P. 249–259. PMID: 1483391.
Lineweaver C.H., Bussey K.J., Blackburn A.C. et al. Cancer progression as a sequence of atavistic reversions // Bioessays. 2021. V. 43. e2000305. Epub 2021 May 13. PMID: 33984158.https://doi.org/10.1002/bies.202000305
Little C.C., McDonald H. Abnormalities of the mammae in the house mouse // J. Hered. 1965. V. 36. P. 285–288.
Matyunina E.A., Emelyanov A.V., Kurbatova T.V. et al. Evolutionarily novel genes are expressed in transgenic fish tumors and their orthologs are involved in development of progressive traits in humans // Infect Agent Cancer. 2019. V. 14:46. https://doi.org/10.1186/s13027-019-0262-5
Macdonald R., Wilson S.W. Pax proteins and eye development // Curr. Opin. Neurobiol. 1996. V. 6. P. 49–56. PMID: 8794051.https://doi.org/10.1016/s0959-4388(96)80008-0
Minhas R., Loeffler-Wirth H., Siddiqui Y.H. et al. Transcriptome profile of the sinoatrial ring reveals conserved and novel genetic programs of the zebrafish pacemaker // BMC Genomics. 2021. V. 22. P. 715. PMID: 34600492; PMCID: PMC8487553.https://doi.org/10.1186/s12864-021-08016-z
Müller C.W., Herrmann B.G. Crystallographic structure of the T domain-DNA complex of the Brachyury transcription factor // Nature. 1997. V. 389. P. 884–888. PMID: 9349824.https://doi.org/10.1038/39929
Nusse R., Varmus H.E. Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome // Cell. 1982. V. 31. P. 99–109. PMID: 6297757.https://doi.org/10.1016/0092-8674(82)90409-3
Nusse R., Varmus H. Three decades of Wnts: a personal perspective on how a scientific field developed // EMBO J. 2012. V. 31. P. 2670–2684. PMID: 22617420; PMCID: PMC3380217. https://doi.org/10.1038/emboj.2012.146
Oliver K.R., Greene W.K. Transposable elements: powerful facilitators of evolution // Bioessays. 2009. V. 31. P. 703–714. PMID: 19415638.https://doi.org/10.1002/bies.200800219
Padmanabhan R. Retinoic acid-induced caudal regression syndrome in the mouse fetus // Reprod. Toxicol. 1998. V. 12. P. 139–151. PMID: 9535508.https://doi.org/10.1016/s0890-6238(97)00153-6
Parinov S., Kondrichin I., Korzh V. et al. Tol2 transposon-mediated enhancer trap to identify developmentally regulated zebrafish genes in vivo // Dev. Dyn. 2004. V. 231. P. 449–459. PMID: 15366023.https://doi.org/10.1002/dvdy.20157
Piedrafita F.J., Molander R.B., Vansant G. et al. An Alu element in the myeloperoxidase promoter contains a composite SP1-thyroid hormone-retinoic acid response element // J. Biol. Chem. 1996. V. 271. P. 14412–14420. PMID: 8662930.https://doi.org/10.1074/jbc.271.24.14412
Poon K.L., Liebling M., Kondrychyn I. et al. Development and properties of the cardiac conduction system in zebrafish // Gene Expression Patterns. 2016. V. 21. P. 89–96. Epub 2016 Sep 1. PMID: 27593944.https://doi.org/10.1016/j.gep.2016.08.003
Purandare S.M., Ware S.M., Kwan K.M. et al. A complex syndrome of left-right axis, central nervous system and axial skeleton defects in Zic3 mutant mice // Development. 2002. V. 129. P. 2293–2302. PMID: 11959836.
Rallan M., Rallan N.S., Goswami M. et al. Surgical management of multiple supernumerary teeth and an impacted maxillary permanent central incisor // BMJ Case Rep. 2013. V. 2013:bcr2013009995. PMID: 23704467; PMCID: PMC3670037.https://doi.org/10.1136/bcr-2013-009995
Roelink H., Nusse R. Expression of two members of the Wnt family during mouse development–restricted temporal and spatial patterns in the developing neural tube // Genes Dev. 1991. V. 5. P. 381–388. PMID: 2001840.https://doi.org/10.1101/gad.5.3.381
Saleh D., Yarrarapu S.N.S., Cook C. Hypertrichosis. 2021. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan. PMID: 30521275.
Schulte-Merker S., van Eeden F.J., Halpern M.E. et al. no tail (ntl) is the zebrafish homologue of the mouse T (Brachyury) gene // Development. 1994. V. 120. P. 1009–1015. PMID: 7600949.
Senut B. Morphology and environment in some fossil Hominoids and Pedetids (Mammalia) // J. Anat. 2016. V. 228. P. 700–715. PMID: 26712383; PMCID: PMC4804138.https://doi.org/10.1111/joa.12427
Shaham O., Menuchin Y., Farhy C. et al. Pax6: a multi-level regulator of ocular development // Prog. Retin. Eye Res. 2012. V. 31. P. 351–376. PMID: 22561546.https://doi.org/10.1016/j.preteyeres.2012.04.002
Shum A.S., Poon L.L., Tang W.W. Retinoic acid induces down-regulation of Wnt-3a, apoptosis and diversion of tail bud cells to a neural fate in the mouse embryo // Mech. Dev. 1999. V. 84. P. 17–30. PMID: 10473117.https://doi.org/10.1016/s0925-4773(99)00059-3
Sivasubbu S., Balciunas D., Amsterdam A. et al. Insertional mutagenesis strategies in zebrafish. Genome Biol. 2007. V. 8. Suppl. 1 (Suppl. 1):S9. PMID: 18047701; PMCID: PMC2106850.https://doi.org/10.1186/gb-2007-8-s1-s9
Sugamata A., Sato M., Ikeda J. et al. Two cases of a true human tail // Jpn. J. Plast. Reconstr. Surg. 1988. V. 31. P. 1072.
Tata J.R. Early metamorphic competence of Xenopus larvae // Dev. Biol. 1968. V. 18. P. 415–440. PMID: 5704418.https://doi.org/10.1016/0012-1606(68)90050-x
Tata J.R. Amphibian metamorphosis as a model for the developmental actions of thyroid hormone // Mol. Cell. Endocrinol. 2006. V. 246. P. 10–20. PMID: 16413959.https://doi.org/10.1016/j.mce.2005.11.024
Tickey-McCrane S., Dunsworth H., Wegener J. Investigating the Genetic Basis for Hominoid Taillessness. Senior Honors Projects. 2017. P. 533.
http://digitalcommons.uri.edu/srhonorsprog/533
Tojima S., Makishima H., Takakuwa T., Yamada S. Tail reduction process during human embryonic development // J. Anat. 2018. V. 232. P. 806–811. PMID: 29315541; PMCID: PMC5879970.https://doi.org/10.1111/joa.12774
Tubbs R.S., Malefant J., Loukas M. et al. Enigmatic human tails: A review of their history, embryology, classification, and clinical manifestations // Clin. Anat. 2016. V. 29. P. 430–438. PMID: 26990112.https://doi.org/10.1002/ca.22712
Vansant G., Reynolds W.F. The consensus sequence of a major Alu subfamily contains a functional retinoic acid response element // Proc. Natl Acad. Sci. USA. 1995. V. 92. P. 8229–3823. PMID: 7667273; PMCID: PMC41130.https://doi.org/10.1073/pnas.92.18.8229
Urasaki A., Morvan G., Kawakami K. Functional dissection of the Tol2 transposable element identified the minimal cis-sequence and a highly repetitive sequence in the subterminal region essential for transposition // Genetics. 2006. V. 174. P. 639–649. PMCID: 16959904; PMCID: PMC1602067.https://doi.org/10.1534/genetics.106.060244
Wang X., Tang H., Wei E.Q. et al. Conditional knockout of Fgf13 in murine hearts increases arrhythmia susceptibility and reveals novel ion channel modulatory roles // J. Mol. Cell. Cardiol. 2017. V. 104. P. 63–74. PMID: 28119060; PMCID: PMC5637556.https://doi.org/10.1016/j.yjmcc.2017.01.009
Winata C.L., Korzh V. Zebrafish Zic genes mediate developmental signaling // Adv. Exp. Med. Biol. 2018. V. 1046. P. 157–177. Jun Aruga (Eds): Zic family. 429143_ 1_En, (9) Springer.https://doi.org/10.1007/978-981-10-7311-3_9
Xia B., Zhang W., Wudzinska A. et al. The genetic basis of tail-loss evolution in humans and apes // bioRxiv. 2021.09.14.460388. https://doi.org/10.1101/2021.09.14.460388
Yamamoto Y., Stock D.W., Jeffery W.R. Hedgehog signalling controls eye degeneration in blind cavefish // Nature. 2004. V. 431. P. 844–847. PMID: 15483612.https://doi.org/10.1038/nature02864
Zanni G., Opitz J.M. Annals of morphology. Atavisms: phylogenetic Lazarus? // Am. J. Med. Genet. A. 2013. V. 161A. P. 2822–2835. PMID: 24166815.https://doi.org/10.1002/ajmg.a.36234
Zhu H., Shang D., Sun M. et al. X-linked congenital hypertrichosis syndrome is associated with interchromosomal insertions mediated by a human-specific palindrome near SOX3 // Am. J. Hum. Genet. 2011. V. 88. P. 819–826. PMID: 21636067; PMCID: PMC3113246.https://doi.org/10.1016/j.ajhg.2011.05.004
Дополнительные материалы отсутствуют.


