Онтогенез, 2022, T. 53, № 3, стр. 224-227
Моделирование регенерации кожи и волосяных фолликулов человека в полнослойном ксенотрансплантате
О. Л. Черкашина a, *, А. В. Косых a, Е. И. Моргун a, А. Л. Риппа a, А. А. Цитрина a, А. П. Эттингер b, Э. С. Чермных a, Е. П. Калабушева a, Е. А. Воротеляк a
a Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: olgalcher@gmail.com
Поступила в редакцию 19.11.2021
После доработки 14.12.2021
Принята к публикации 18.12.2021
Аннотация
Ксенотрансплантация кожи человека мышам с иммунодефицитом является одной из наиболее адекватных моделей для изучения механизмов регенерации и, таким образом, открывает широкие перспективы для исследований в областях современной клеточной биологии и регенеративной медицины. Разработанная в нашей лаборатории модель ксенотрансплантации полнослойного кожного лоскута позволила нам впервые описать динамику восстановления дермы и подкожной жировой клетчатки человека. Исследована экспрессия и активация белка YAP1 в ходе регенерации эпидермиса, волосяных фолликулов (ВФ), папиллярной дермы (ПД), на основе чего были сделаны предположения о характере некоторых клеточных и молекулярных процессов в ходе регенерации кожи человека.
ВВЕДЕНИЕ
Ксенотрансплантация кожи человека делает возможным изучение процессов регенерации в норме, при моделировании заболеваний или тестировании лекарственных препаратов. В работе была использована ранее разработанная нашим коллективом модель ксенотрансплантации полнослойного кожного лоскута человека (Kalabusheva et al., 2020). Подобный ксенотрансплантат позволяет изучать не только регенерацию эпидермиса, которая подробно рассмотрена в ранее опубликованных работах (например, Kappes et al., 2004), но и исследовать динамику восстановления дермы и подкожной жировой клетчатки, а также морфологию волосяных фолликулов, которые ранее изучались преимущественно на клетках и тканях лабораторных животных (например, Chermnykh et al., 2018; Vsevolodov et al., 2021). Отдельной областью интереса в нашем исследовании было изучение активации сигналинга YAP1 в различных структурах кожи человека в ходе регенерации. Повышенный процент клеток с ядерной локализацией YAP1 коррелирует с гиперпролиферативным и воспалительным фенотипом (Jia et al., 2018), в то же время снижение его экспрессии связывают с хроническими незаживающими ранами (Yu et al., 2017). Применение модели ксенотрансплантации полнослойного лоскута кожи человека позволит исследовать экспрессию и активность YAP1 как в эпидермисе и ВФ, так и в различных слоях дермы.
МАТЕРИАЛЫ И МЕТОДЫ
Биоптаты кожи волосистой части головы были получены из МНИОИ им. П.А. Герцена с информированного согласия пациентов. Полнослойные кожные лоскуты трансплантировали мышам линии NOD/SCID (Charles River Laboratories); всего в работе использовали 15 животных, мышей содержали в SPF-условиях. Операции проводили по ранее разработанному и описанному в нашей лаборатории протоколу (Kalabusheva et al., 2020). Забор материала проводили на 40, 75 и 110 сут после трансплантации для получения криосрезов. Криосрезы использовали для окрашивания гематоксилин-эозином (BioVitrum), а также иммуногистохимического окрашивания (используемые антитела: cytokeratin 14, ab181595, Abcam, 1 : 1000; keratin 10, MA1-06319, Thermofisher, 1 : 200; YAP1, ab52771, Abcam, 1 : 300, Human Nuclei, MAB1281A4, Merck, 1 : 100). Фотографии получали на микроскопе Keyence BZ-9000 и Leica DMI 6000. Измерения проводили с использованием программного обеспечения ImageJ и Cell Profiler. Для проведения попарных сравнений в программе GraphPad Prism использовали непараметрический критерий Краскела–Уоллиса с поправкой Данна на множественные сравнения. Данные на графиках представлены в виде медианы с разбросом в виде 95% доверительного интервала.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трансплантат успешно интегрируется в ткани мыши, сохраняются эпидермис, дерма и подкожная жировая клетчатка кожи человека (рис. 1а–1г).
Рис. 1.
Морфология кожи человека после ксенотрансплантации на 40 (а), 75 (б) и 110 (в) сут (скобками отмечены границы трансплантата), (г) – интактная кожа, стрелками отмечены ВФ, масштабный отрезок – 500 мкм. (д–з) – увеличенные фрагменты препаратов (а–г) соответственно, масштабный отрезок – 500 мкм. (и–м) – окрашивание на Кератин 10 (красный), Кератин 14 (синий), Human Nuclei (зеленый), масштабный отрезок – 100 мкм. (н–п) – измерение морфологических параметров трансплантированной кожи, ** – p < 0.01, **** – p < 0.0001 относительно интактной кожи. (р–с) – YAP1 в эпидермисе и ПД человека. Стрелками отмечены примеры YAP1-положительных ядер. Масштабный отрезок – 100 мкм.
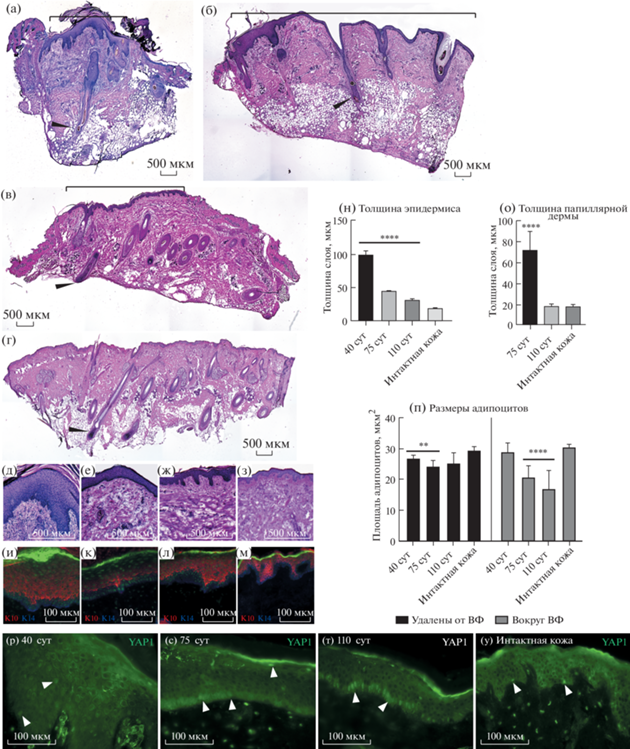
Эпидермис в ксенотрансплантате утолщен (рис. 1д–1з), особенно в течение первого месяца после трансплантации. Хотя его толщина значительно уменьшается от 40 сут к 110-м, она не достигает толщины эпидермиса интактной кожи (рис. 1н). Такая тенденция наблюдается как при измерении его общей толщины, так и при анализе базального и шиповатого слоев на основе иммуногистохимического выявления кератина 10 и 14 (рис. 1и–1м). Низкая скорость регенерации эпидермиса может быть обусловлена нарушением микроокружения, в норме формируемого иммунными клетками.
ВФ на 40 сут находятся на стадии раннего анагена, на 110 сут они продуцируют стержни волоса и морфологически соответствуют стадии среднего анагена. Регенерация фолликулов несколько замедленна в сравнении с моделью трансплантации единичных ВФ (Oh et al., 2016), что объясняется большим размером трансплантата в нашей работе.
Дерма на 40 сут теряет морфологическое разделение на папиллярный и ретикулярный слои, содержит воспалительный инфильтрат (рис. 1а). Папиллярный слой выявляется на 75 сут, к 110 сут морфология дермы полностью соответствует интактной коже (рис. 1в, 1г, 1о). В исследованиях на мышах показали, что фибробласты ретикулярной дермы формируют пул миофибробластов на ранних этапах регенерации, далее фибробласты ПД мигрируют в область повреждения, взаимодействуют с эпидермальными кератиноцитами и контролируют ремоделиривание внеклеточного матрикса (Woodley, 2017), что соответствует динамике восстановления дермы человека, выявленной в нашей работе.
Исследования, проведенные на лабораторных животных, выявили вовлеченность клеток жировой ткани в миграцию фибробластов в область повреждения (Schmidt et al., 2013), а также в регуляцию цикла ВФ (Rivera-Gonzalez et al., 2014). В ксенотрансплантате размер адипоцитов подкожной жировой клетчатки меньше значений, полученных для интактной кожи. В области, прилежащей к ВФ, наблюдается выраженная тенденция к уменьшению размера адипоцитов от 40 суток к 110 (рис. 1п). Аналогичные изменения наблюдали на мышах при переходе от стадии цикла ВФ от раннего анагена к среднему (Rivera-Gonzalez et al., 2014), что воспроизводится в нашей модели. В интактной коже фолликулы находятся на стадии позднего анагена, поэтому адипоциты обладают большим размером.
Экспрессию YAP1 выявили на всех анализируемых сроках в эпидермисе, дерме и ВФ. В фолликулах он имел выраженную активную ядерную локализацию во внешнем корневом влагалище независимо от стадии цикла, что соответствует ранее опубликованным результатам (Elbediwy et al., 2016). В эпидермисе и ПД ядерная локализация YAP1 встречалась в единичных клетках на 40 и 75 сут после трансплантации (рис. 1р, 1с). В ходе регенерации при эпителизации раны YAP1 имеет преимущественно ядерную локализацию в эпидермисе. Поскольку наша модель не имеет оформленного раневого ложа, мы наблюдаем единичные клетки в эпидермисе, однако повышенную экспрессию YAP1 в ПД на 40 сут (рис. 1р). На 110 сут кератиноциты базального слоя эпидермиса имеют активную форму YAP1 с ядерной локализацией, в то время как папиллярные фибробласты обладают только неактивной формой с цитоплазматической локализацией. Интересно, что подобный паттерн распределения встречается именно на поздних сроках регенерации, и его появление вероятно коррелирует с завершением стадии ремоделинга ксенотрансплантата и активацией резидентных иммунных клеток человека.
ЗАКЛЮЧЕНИЕ
В ходе работы была описана динамика восстановления эпидермиса, дермы, подкожной жировой клетчатки человека в ксенотрансплантате в течение длительного срока – 110 сут. Выявлено, что динамика восстановления дермы и подкожной жировой клетчатки соответствует процессам, описанным ранее на лабораторных животных. Выявленный паттерн экспрессии и активности YAP1 указывает на значительные отличия ксенотрансплантированной кожи от интактной, что следует исследовать в дальнейшем в контексте иммунного статуса ксенотрансплантированной кожи.
Список литературы
Chermnykh E.S., Kiseleva E. V., Rogovaya O.S., Rippa A.L., Vasiliev A. V., Vorotelyak E.A. Tissue-engineered biological dressing accelerates skin wound healing in mice via formation of provisional connective tissue // Histol. Histopathol. 2018. V. 33. № 11. P. 1189–1199.
Elbediwy A., Vincent-Mistiaen Z.I., Spencer-Dene B. et al. Integrin signalling regulates YAP and TAZ to control skin homeostasis // Development. 2016. V. 143. № 10. P. 1674.
Jia J., Li C., Yang J. et al. Yes-associated protein promotes the abnormal proliferation of psoriatic keratinocytes via an amphiregulin dependent pathway // Sci. Rep. 2018. V. 8. № 1. P. 1–11.
Kalabusheva E.P., Rippa A.L., Tsitrina A.A. et al. Xenotransplantation of a full-layer human skin strip as a model for studying skin regeneration and the hair follicle cycle // Russ. J. Dev. Biol. 2020. V. 52. № 1. P. 42–52.
Kappes U., Schliemann-Willers S., Bankova L. et al. The quality of human skin xenografts on SCID mice: a noninvasive bioengineering approach // Br. J. Dermatol. 2004. V. 151. № 5. P. 971–976.
Oh J.W., Kloepper J., Langan E.A. et al. A guide to studying human hair follicle cycling in vivo // J. Invest. Dermatol. 2016. V. 136. № 1. P. 34.
Rivera-Gonzalez G., Shook B., Horsley V. Adipocytes in skin health and disease // Cold Spring Harb. Perspect. Med. 2014. V. 4. № 3.
Schmidt B.A., Horsley V. Intradermal adipocytes mediate fibroblast recruitment during skin wound healing // Development. 2013. V. 140. № 7. P. 1517–1527.
Vsevolodov E.B., Mussayeva A.S., Latypov I.F. et al. Some paradoxical phenomena in hair follicle histophysio-logy // Russ. J. Dev. Biol. 2021 521. 2021. V. 52. № 1. P. 9–15.
Woodley D.T. Distinct fibroblasts in the papillary and reticular dermis: Implications for wound healing // Dermatol. Clin. 2017. V. 35. № 1. P. 95–100.
Yu J., Choi S., Um J. et al. Reduced expression of YAP in dermal fibroblasts is associated with impaired wound healing in type 2 diabetic mice // Tissue Eng. Regen. Med. 2017. V. 14. № 1. P. 49–55.
Дополнительные материалы отсутствуют.


