Онтогенез, 2022, T. 53, № 5, стр. 375-387
Экспрессия гена половой плазмы germes в фолликулярных клетках ооцита X. laevis
В. В. Кондукторова a, *, Н. Н. Лучинская a, А. В. Белявский b
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
b Институт молекулярной биологии им. В.А. Энгельгардта РАН
119991 Москва, Вавилова, 32, Россия
* E-mail: virgo584@yandex.ru
Поступила в редакцию 25.04.2022
После доработки 06.07.2022
Принята к публикации 12.07.2022
- EDN: WCAOBA
- DOI: 10.31857/S0475145022050032
Аннотация
Во время оогенеза большая часть мРНК локализуется на вегетативном полюсе ооцита в особой области, называемой половой плазмой. Половая плазма играет существенную и необходимую роль в спецификации первичных половых клеток. Ген germes прежде охарактеризован нами как ранний маркер первичных половых клеток. В настоящей работе с помощью полученной нами иммунной сыворотки исследован синтез белка Germes в яичниках и раннем развитии шпорцевой лягушки. Мы также обнаружили белок в фолликулярных клетках, окружающих растущие ооциты. Факт наличия белка Germes в фолликулярных клетках требовал дальнейшего исследования наличия мРНК в них. Для этого была применена in situ гибридизация фолликулов c зондом к germes, совмещенная с электронной микроскопией. Было установлено присутствие мРНК germes в фолликулярных клетках. Транскрипт находился в цитоплазме и ядрах самих фолликулярных клеток как больших, так и малых фолликулов, а также в пространстве между ооцитом и фолликулярными клетками. Сравнительный анализ экспрессии мРНК germes в фолликулярных клетках и ооцитах показал, что уровни экспрессии в фолликулярном слое и ооцитах больших стадий сопоставимы. Содержание транскрипта в фолликулярных клетках малых ооцитов превышало таковое в самих ооцитах. Доказано наличие непроцессированной мРНК в фолликулярном слое в течение всего оогенеза, что говорит о самостоятельной экспрессии гена половой плазмы germes в них.
ВВЕДЕНИЕ
Линия половых клеток у Xenopus выделяется благодаря наследованию специальных детерминант, локализующихся на вегетативном полюсе ооцита в виде островков половой плазмы (ПП). В состав ПП входят специфические матричные и нетранслируемые РНК и белки: XСat-2 (Mosquera et al., 1993), vegT (Zhang, King, 1996), XDazl (Houston et al., 1998), Xpat (Hudson, Woodland, 1998), DEADSouth (MacArthur et al., 2000), Dead end (Weidinger et al., 2003), Hermes (Zearfoss et al., 2004), Xotx1 (Pannese at al., 2000), fatvg (Chan et al., 2001), syntabulin (Colozza, De Robertis, 2014), grip2.1 (Tarbashevich, 2007), rtn3.1, gptl1, exd2 (Cuykendall, Houston, 2010), sox7 (Butler et al., 2018) и др. Открытый ранее нашей группой germes дополнил этот ряд (Berekelya et al., 2003). Было показано, что экспрессия РНК germes начинается уже на I стадии развития ооцита. На стадиях I–II транскипт распределен диффузно. На стадии II–III РНК локализуется в митохондриальном облаке, однако часть сохраняет диффузное распределение в цитоплазме. С распадом митохондриального облака РНК заякоревается в вегетативном кортексе ооцитов вместе с другими маркерами ПП, локализующимися по раннему пути (Berekelya et al., 2003). Далее, начиная с первых суток развития и до стадии гаструлы, содержание транскрипта в зародышах постепенно падает по сравнению с уровнем экспрессии в зрелых ооцитах. К стадии средней нейрулы (ст. 15) материнский транскрипт не детектируется. Такое снижение количества мРНК после оплодотворения характерно для материнских транскриптов (Yang et al., 2015). Функция Germes в составе ПП остается во многом неизвестной, однако ранее нам удалось показать, что оверэкспрессия белка дикого типа и одной из мутантных форм оказывает негативное влияние на формирование первичных половых клеток (ППК) (Berekelya et al., 2007). Нарушается их миграция, уменьшается количество и нарушается поздняя локализация маркеров ПП в клетках. С помощью двугибридной дрожжевой системы нам также удалось выявить белки-партнеры Germes. Ими оказались легкие цепи динеина Dlc8a и Dlc8b. На основании этого было выдвинуто предположение о возможной транспортной функции белка Germes в составе половой плазмы.
Наши знания о маркерах половой плазмы большей частью опираются на результаты исследования содержания и локализации их матричных РНК. Данных о содержании и локализации белков в ооцитах и зародышах меньше. Задачей данной работы было исследовать экспрессию белка Germes в оогенезе и раннем развитии. С помощью окраски сывороткой/антителами белок был обнаружен в течение оогенеза и раннем развитии, а также в ППК в процессе их миграции в половую железу. Неожиданно белок и мРНК были обнаружены в фолликулярных клетках (ФК), окружающих растущие ооциты. Ни для одного из генов ПП экспрессия в ФК не была установлена ранее. Известно, что ФК являются производными эпителиального компартмента яичника, т.е. имеют соматическое происхождение (Ogielska, Kotusz, 2004). Макровилли (МВ) фолликулярных клеток пронизывают желточную оболочку и формируют щелевые контакты с микровиллями ооцита, осуществляя прямой транспорт веществ. МВ образуются в центральной части клетки в количестве до 50–70 шт. (Konduktorova, Luchinskaya, 2013). Закономерно, встал вопрос о происхождении белка: транспорт из ооцита мРНК или белка Germes или экспрессия в самих ФК. Методами ПЦР-РВ и гибридизацией in situ в сочетании с электронной микроскопией была показана экспрессия мРНК в ФК.
МАТЕРИАЛЫ И МЕТОДЫ
Получение проб из ооцитов разных стадий роста и оболочек с них
Ооциты X. laevis были выделены вручную диссекцией из яичников. Ооциты стадий I–III и фолликулярные оболочки с них были изолированы друг от друга путем инкубации в растворе коллагеназы (2 µg/ml, crude collagenase IA, Sigma С2674) в бескальциевом 1× МMR. Фолликулы инкубировались на горизонтальном шейкере 2–3 часа при 37°С до полной диссоциации. Оболочки ооцитов V–VI стадии (50–70 шт.) были сняты вручную с помощью пинцетов в растворе MMR (с 2x кратной концентрацией NaCl). Полученные таким образом образцы малых ооцитов и клеток оболочек с них были использованы для выделения тотальной РНК с помощью TRIZOL (Invitrogen) согласно рекомендациям производителя. Все образцы были обработаны ДНКазой для удаления гДНК. кДНК была синтезирована с помощью M-MuLV ревертазы (набор компании Евроген # SK021) с использованием рандомных гексануклеотидов (Silex).
Эмбрионы были получены с помощью оплодотворения in vitro стандартным методом (Newport, Kirschner, 1982), и поэтапно собраны необходимые стадии развития в соответствии с таблицами нормального развития X. laevis (Nieuwkoop, Faber, 1956).
Для вестерн-блоттинга ооциты и эмбрионы (15 шт.), соответствующих стадий, гомогенизировали в 400 мкл буфера EBC (50 mM Tris-HCl pH 8.0, 150 mM NaCl, 1.0% NP-40) с добавлением коктейля ингибиторов протеаз (Roche #11 836 153 001). Центрифугировали и отбирали среднюю фракцию для последующего анализа.
Получение и очистка антител
Кроличьи поликлональные антитела были получены против рекомбинантного белка (GenBank accession number NP_001082512.1), состоящего из растворимой части Germes (aк 378-502; всего 125 ак), слитого с GST. Белок был экспрессирован в Rosetta штамме E. coli, а затем хроматографически очищен с использованием глутатион-сефарозы (Liu et al., 2014). Иммунизация кроликов проводилась 5 раз согласно стандартному протоколу (Wang et al., 2015). Сыворотка была проверена на специфичность с помощью вестерн-блоттинга против рекомбинантных белков, слитых с концевыми метками: His-Germes, Myc-Germes и GFP-Germes, синтезированных в ооцитах X. laevis. В качестве отрицательного контроля использовали преиммунную сыворотку.
Иммунная сыворотка против Germes была очищена согласно протоколу для Xpat антител (Machado et al., 2005), используя рекомбинантный белок, состоящий из растворимой части белка Germes, кодирующей две гидрофильные области белка (всего 338 ак) и 6xHis. Для получения большего количества рекомбинантного белка, конструкт His-Germes был клонирован в pET-21d-2c вектор (любезно предоставленный А.В. Ивановым; Ivanov et al., 2006). Около 1 мг рекомбинантного белка переносили с ПААГ (PROTEAN® II xi cell, Bio-Rad laboratories) на PVDF мембрану (Bio-Rad laboratories, 1620177). Позицию полосы определяли с помощью Ponceau S (Sigma, P7170-1L), вырезали и проводили блокировку в 4% обезжиренном молоке в PBS 1 ч при комнатной температуре с ротацией. Далее полоску мембраны с рекомбинантным белком нарезали на более мелкие и отмывали в PBS 3 раза по 10 мин и инкубировали ночь при 4°С с 2 мл сыворотки. После 5-кратной отмывки PBS–Tween-20 (0.05%) антитела элюировали 1 мл 200 мМ глицина (pH 2.3) в течение 1 минуты 5 раз. К каждому образцу элюции добавляли 150 мкл 1 М Tris pH 8.8 для нейтрализации.
Иммунологические техники
Процедуру вестерн-блоттинга выполняли по протоколу Sambrook и Russell (Sambrook, Russell, 2001) с использованием системы Bio Rad. Перенос белков осуществляли на PVDF мембрану (Immune-blot BioRad). Использованные первичные антитела: anti-Germes (поликлональные антитела, полученные нами, 1 : 1500), anti-Actin (Cell Signaling Technology, #3700, 1 : 3000) и Anti-GapDH (Cell Signaling Technology #2118; 1 : 5000) для нормировки количества нанесенного общего белка в каждую лунку PAAG. Вторичные антитела: HRP goat anti-rabbit (Santa Cruz # sc-2004, 1 : 10 000), HRP goat anti-mouse (Jackson ImmunoResearch # 10015289, 1 : 50 000). Для визуализации сигнала использовали набор Thermo Fisher (Thermo Scientific™ Pierce™ ECL Western Blotting Substrate, #PI32106). Детекцию полос проводили с использованием ChemiDoc Bio Rad, а интенсивность количественно определяли с помощью программного обеспечения Image Lab Bio Rad. Полученные количественные значения интенсивности полос по белку Germes делили на значения, полученные для актина/GapDH в том же образце. По оси Y (рис. 1) отложены относительные нормированные уровни для каждой стадии развития.
Рис. 1.
Белок Germes в ооцитах и эмбрионах X. laevis. Вестерн-блоттинг анализ уровней экспрессии белка Germes (ось Y на графиках) лизатов ооцитов I–II и IV стадии со всеми оболочками (a) и зародышей ранних стадий развития (б), нормированных по экспрессии Actin/GapDH. OoI-IV – ооциты стадий I–IV со всеми оболочками, Z – неоплодотворенные ооциты VI стадии; 2–48 – стадии развития по Nieuwkoop and Faber. Белку Germes соответствует полоса около 70 кДа.

Для иммуногистохимического анализа связки ооцитов разных стадий фиксировали в смеси метанол/1% формальдегид при –20°C 2 ч. Проводку и иммуноокраску проводили согласно протоколу, описанному ранее (Chang et al., 2004). Использованные первичные и вторичные антитела и красители: anti-Germes (1 : 100), anti-Xpat (1 : 100) (любезно предоставленные Dr H.R. Woodland, University of Warwick), AF 488 anti-rabbit (1 : 200, Invitrogen, #A-11034), AF 594 donkey anti-sheep (1 : 200, Invitrogen, #A-11016), phalloidin (Sigma #P1951), Cy2 donkey anti-rabbit (1 : 100, Jackson ImmunoResearch, AB_2340612), Cy5 anti-mouse (1 : 100, Jackson ImmunoResearch AB_2340820), propidium iodide (Sigma, P4170) и DAPI (Sigma, #D9542). Для достоверности, что между вторичными флуоресцентными антителами нет кросс-реакции, параллельно проводили иммуноокрашивание, при котором в ходе эксперимента исключались первичные антитела. Визуализацию проводили с помощью конфокального микроскопа Leica SP5 или Olimpus FluoView FV10i.
Для сканирующей электронной микроскопии ооциты, со снятыми двумя способами оболочками, фиксировали в 2.5% глутаральдегиде на 0.1 М какодилатном буфере рН 7.3, постфиксировали в 1% тетрооксиде осмия и дегидратировали в этаноле возрастающих концентраций и 100% ацетоне. Образцы анализировали при помощи CamScan S-2 микроскопа.
Для визуализации ППК эмбрионы 29–31 стадий фиксировали в 4% парафармальдегиде/PBS при 4°C (ночь). Далее эмбрионы переносили в 0.1% раствор TPBS на 20 мин (PBS-Tween-20), экстрагировали 0.25% Triton X-100 на PBS 30 мин, промывали 3 раза TPBS и инкубировали в блокирующем буфере (10% козья сыворотка на TPBS) при комнатной температуре 2 ч. Образцы обрабатывали anti-Germes антителами 1 : 250 в блокирующем буфере при 4°C 4 дня, промывали буфером TPBS 5 раз и инкубировали с goat anti-rabbit 568 антителами (1 : 200, Sigma, SAB4600310) в блокирующем буфере при 4°C в течение ночи, и затем промывали TPBS 5 раз. Детекцию проводили с помощью конфокального лазерного сканирующего микроскопа Olimpus FluoView FV10i.
ПЦР и ПЦР-РВ (полимеразная цепная реакция с детекцией в реальном времени)
0.5 или 1 мкг тотальной РНК использовали для синтеза кДНК с помощью M-MuLV ревертазы (Fermentas #K1691) по протоколу, рекомендованному производителем. Количество мРНК germes определяли с помощью ПЦР-РВ. Нормализацию количества мРНК germes проводили по уровням экспрессии мРНК ODC. ПЦР-РВ проводили с помощью 7500 Real-Time PCR System (Applied Biosystems) с использованием системы SYBR Green/ROX. Относительные уровни экспрессии определяли ΔΔСt методом (Bookout et al., 2006).
Олигонуклеотиды подбирали к последовательностям из базы NCBI GenBank с помощью програмы Oligo Analyzer (Integrated DNA technologies). В реакции ПЦР-РВ использовали следующие праймеры (Synthol):
Germes: прямой – AAATGGCAGAATGTACACAGG,
обратный – GTGTAGTTATGAATGCAACAGATAA,
ODC (Nandadasa et al., 2009): прямой – GCCATTGTGAAGACTCTCTCCATTC,
обратный – TTCGGGTGATTCCTTGCCAC.
Специфичный обратный олигонуклеотид для синтеза кДНК germes – TGTGCTCAGTGAATCA.
Для оценки наличия интрона 152 пн в несплайсированной форме мРНК germes в ооцитах и клетках фолликулярных оболочек с них использовали следующие олигонуклеотиды (Synthol):
прямой – GCAAGACTGGGATGTGAAGGAACAAAAT,
обратный – TAAAAAAAATGAAAAACAAAAA-TAACT.
ПЦР выполняли с использованием полимеразы KAPA HiFi на амплификаторе Eppendorf Mastercycler gradient (39 циклов).
In situ гибридизация, совмещенная с электронной микроскопией
Для получения плазмиды pCS2+-Germes последовательность ORF Germes была вырезана по рестрикционным сайтам NcoI–NotI из плазмиды Germes-pGEMT (Berekelya et al., 2003) и легирована в pCS2+, линеаризованную по StuI по совместимым концам с потерей рестрикционных сайтов. Конструкт pCS2+-Germes, линеаризовали рестриктазой NotI и использовали для синтеза дигоксигенин-меченой рибопробы c T7 промотора, используя mMESSAGE mMACHINE T7kit (Ambion/ThermoFisher scientific). В качестве отрицательного контроля использовали рибопробу смысловой последовательности germes, синтезированную с SP6 промотора (mMESSAGE mMACHINE SP6 kit Ambion/ThermoFisher scientific). In situ гибридизацию c последующей иммуноокраской ультратонких срезов антителами против дигоксигенина, содержащими нанозолото 1 нм (Amersham Biosciences, сняты с продажи), проводили согласно протоколу (Bilinski et al., 2010). Визуализацию образцов проводили с помощью JEM-1011 электронного микроскопа с моделью камеры Gatan ES500W Model 782.
РЕЗУЛЬТАТЫ
Динамика синтеза белка Germes в ооцитах и зародышах шпорцевой лягушки
Хотя известно, что мРНК germes экспрессируется в течение всего оогенеза и раннего развития шпорцевой лягушки, данных о синтезе и локализации белка нет. Поэтому мы поставили цель исследовать наличие белка Germes как в ооцитах, так и в раннем развитии Xenopus laevis. Была получена кроличья сыворотка, содержащая поликлональные антитела к растворимой части белка Germes.
С помощью полученных поликлональных анти-Germes антител провели анализ наличия белка Germes в ооцитах и эмбрионах X. laevis методом вестерн-блоттинга. Полоса, соответствующая целевому белку, выявляется на уровне примерно 68 кДа, что соответствует предсказанной массе белка (587 ак).
Для получения ооцитов ранних стадий взяли лягушат 5–6 мес. после метаморфоза, яичники которых содержат ооциты до IV стадии роста. Вручную отобрали прозрачные ооциты I–II стадии цитоплазматического роста и пигментированные ооциты IV стадии с оболочками. Белок Germes выявлен в обеих группах ооцитов в сходных количествах (рис. 1a).
Белок Germes появляется в ранних ооцитах (I‒II стадии) и сохраняется во время роста ооцитов. Белок присутствует в зиготе, в период дробления, гаструляции и нейруляции. Далее наблюдается плавное снижение количества белка Germes в зародышах вплоть до последней изученной нами стадии 48, однако он не исчез полностью (рис. 1б).
Для изучения локализации белка в оогенезе были иммуногистохимически окрашены целые фолликулы. Как и РНК-транскрипт, белок также имел диффузное распределение на I–II стадиях ооцитарного роста (рис. 2а) с последующей локализацией в островках с III стадии. Окрашивание ооцитов V–VI cтадии антителами против Germes также выявило характерные островки половой плазмы (ПП) в вегетативном кортексе. В островках ПП наблюдалась колокализация паттернов окраски антителами против Germes и другого маркера половой плазмы Xpat, окрашенным специфическими антителами к нему (любезно предоставлены Dr. H.R. Woodland, Warwick University) (рис. 2б). Можно заключить, что мРНК germes начинает сразу транслироваться в начале роста ооцитов. Для мРНК маркеров половой плазмы и, в том числе для germes, детально изучен способ последующей транспортировки мРНК в вегетативный кортекс ооцита. На II стадии роста около ядра с вегетативного полюса ооцита формируется т.н. митохондриальное облако, в котором локализуются мРНК маркеров. За локализацию мРНК Germes отвечают особые последовательности в 3'‑нетранслируемой области (Ponomarev et al., 2021). К стадии III облако теряет шаровидную форму и “растекается” на вегетативном полюсе ооцита, а маркеры формируют островки ПП, закрепленные в кортикальном слое. Как осуществляется локализация белков ПП не известно. Однако мы показали, что и белок Germes меняет локализацию. Возможно, диффузно распределенный белок постепенно деградирует, но впоследствии синтезируется вновь с локализованной в островки мРНК. Сделать заключение о длительности периода трансляции и времени жизни белка в оогенезе на основании полученных данных не предоставляется возможным и требует дальнейшего исследования.
Рис. 2.
Иммуноокрашивание на белок Germes ооцитов и зародышей в период миграции половых клеток. (а) Оoцит стадии I. Белок Germes распределен в цитоплазме ооцита. (б) Ооцит стадии VI. Белок Germes локализован в островках ПП вегетативного полюса. Иммуноокрашивание на Xpat (красный), Germes (зеленый), колокализация (желтый). (в) ППК зародыша на стадии 32, выявленные путем in situ гибридизации с зондом к Xpat (указаны стрелками). (г) Бок зародыша на стадии 30, рамкой отмечена зона, представленная на рис. (д) (фазовый контраст). (д) Иммуноокрашивание на белок Germes выявляет группу мигрирующих первичных половых клеток (z-stack). (е) Иммуноокрашивание преиммунной сывороткой (отрицательный контроль). Масштаб: (а) 25, (б) 10, (г, е) 150, (д) 15 мкм.

При окраске зародышей на стадии хвостовой почки (29–32) антителами против белка Germes, на боковой поверхности зародыша выявлялась группа клеток, аналогичная той, что выявляется с помощью гибридизации in situ к маркерам ПП (Tarbashevich et al., 2007). На рис. 2в видны группы ППК, визуализированные с зондом к xpat. На рис. 2г, 2д иммуноокрашивание на белок Germes выявило похожие клетки в той же области зародыша. Сходным образом антителами против других генов ПП (Nanos и Xiwi) выявляли ППК (Lai et al., 2012). Мы полагаем, что выявленные нами клетки являются первичными половыми и содержат белок Germes, хотя мРНК гибридизацией in situ уже не выявляется.
Белок Germes в фолликулярных клетках ооцита
Исследуя экспрессию и локализацию белка Germes в яичниках шпорцевой лягушки иммуноокрашиванием, мы неожиданно обнаружили, что антитела окрашивают не только ооциты, но и фолликулярные клетки (ФК) больших и малых фолликулов.
Фолликулярный эпителий однослойный, и его клетки формируют макровилли (МВ) на поверхности, обращенной к ооциту, для прямой связи с ним (рис. 7а). Антитела к Germes окрашивали не описанные ранее линейные структуры длиной около 5.5 мкм в области контактных зон и перекрывания соседних ФК. Эти структуры обнаружены в фолликулярных клетках ооцитов как малого роста, так и выросших ооцитов (рис. 3а, 3б, 3е, 3ж). Белок обнаружен также в зоне макровиллей фолликулярных клеток (рис. 3а, 3в–3е). Окрашенные структуры имели 0.3–0.4 мкм в диаметре. Диаметр макровиллей, как они видны в сканирующий микроскоп, совпадает с размерами структур, выявленных антителами против Germes с помощью конфокальной микроскопии (рис. 7а). Способность Germes связываться с легкими цепями динеина (Berekelya et al., 2007) и локализация его в отростках ФК может говорить о его участии в транспортных процессах.
Рис. 3.
Иммуноокрашивание на белок Germes фолликулярных клеток. (а, б, г, д) Ооцит стадии V–VI. (а, б) Оптический срез фолликулярных клеток. Белок Germes (зеленый) обнаруживается в виде линейных структур в контактных зонах соседних фолликулярных клеток (острая стрелка), где колокализуется с F-актином (phalloidin-красный); ядра окрашены DАPI (голубой). (г, д) Макровилли на поверхности фолликулярных клеток (треугольная стрелка), обращенной к ооциту, содержат Germes. Ядра окрашены propidium iodide (PI-красный). (в, е) На поперечном оптическом срезе белок Germes обнаруживается в контактных зонах соседних фолликулярных клеток, а также в области макровиллей. (ж) Ооцит стадии I–II. Начало образования линейных структур в контактных зонах. (з, и) Отрицательный контроль с преимунной сывороткой (и), а также отрицательный контроль на вторичные антитела (з). Fc – фолликулярные клетки, Оo-ооцит. Масштаб: (а, г, ж) 25, (д, в, и) 10, (б, е) 5, (з) 15 мкм.

Фолликулярные клетки распластаны по поверхности ооцита, кое-где накрывая друг друга, как черепица (Konduktorova, Luchinskaya, 2013). ФК не являются потомками клеток зародышевой линии, а ведут начало из эпителия формирующейся гонады. Встает очевидный вопрос о происхождении обнаруженного белка Germes в фолликулярной оболочке. Возможные варианты – это транспорт белка или мРНК germes из ооцита в ФК c последующей трансляцией, либо экспрессия и трансляция в самих ФК.
Исследование экспрессии мРНК germes в ФК
Синтез РНК germes в ооцитах начинается в яичниках Xenopus уже к концу метаморфоза (стадии 65–66). Яичник уже имеет дольчатую структуру, в дольках идет формирование цист и ооцитов I порядка (рис. 4). мРНК germes распределена в виде проксимально-дистального градиента в дольке яичника. Такое градиентное распределение объяснимо, т.к. при росте дольки в дистальной части находятся более зрелые ооциты (Coggins, 1973). Затем картина локализации и экспрессии мРНК germes, выявленная при помощи in situ гибридизации на всех стадиях оогенеза, характерна для поведения маркеров половой плазмы, что мы установили ранее (Berekelya, 2003).
Рис. 4.
Проксимо-дистальное градиентное распределение мРНК germes в яичнике шпорцевой лягушки стадии 66 (конец метаморфоза), выявленное путем in situ гибридизации. (а) Растущий яичник, лежащий на почке. Oo – ооциты, P – проксимальная часть, D – дистальная часть. (б, в) Дольки яичника. В проксимальной части экспрессия мРНК germes отсутствует, в дистальной части видно начало локализации диффузно распределенной мРНК в митохондриальное облако (Мс). Масштаб: (а) 6000; (б, в) 1000 мкм.
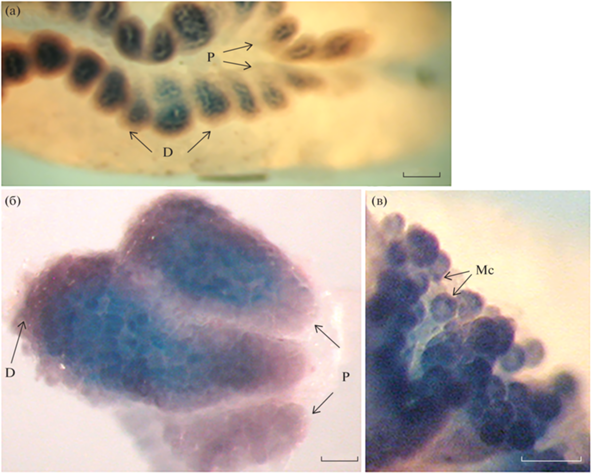
Качественный анализ экспрессии РНК germes в ФК проводили с помощью варианта метода in situ гибридизации, при котором РНК детектируется в результате хромогенной реакции со щелочной фосфатазой. На парафиновых срезах фолликулярные клетки окрашены темно-сиреневым цветом, однако малая толщина фолликулярных клеток всего 0.7–1 мкм (Konduktorova, Luchinskaya, 2013), не позволяла точнее исследовать локализацию зонда (data not shown).
Электронная микроскопия фолликулов, подвергнутых in situ гибридизации c зондом к germes c последующим окрашиванием антителами с коллоидным золотом (1 нм), позволила уточнить локализацию РНК в ФК и ооцитах. Золотая метка, обнаруженная в островках половой плазмы на вегетативном полюсе ооцита на V–VI cтадии, а также по всему объему малых ооцитов стадий II–III (рис. 5а, 5б) служила доказательством успешно прошедшей гибридизации и окраски антителами с коллоидным золотом. В перинуклеарной области ооцитов II–III стадий, зоне, где формируется митохондриальное облако, метка была особенно массовой. Частицы коллоидного золота были обнаружены в пространстве между ооцитом и фолликулярными клетками, в зоне макро- и микровиллей на вегетативном полюсе, а также в ядрах и цитоплазме самих ФК как больших, так и малых фолликулов (рис. 5г–5е). Причем отмечено, что плотность частиц коллоидного золота на срезе внутри фолликулярной клетки выше, чем поблизости в ПП или цитоплазме ооцита. Это наблюдение подтвердит результаты оценки удельного содержания мРНК germes в тонком фолликулярном слое клеток к содержанию в ооците. В соединительнотканной теке, как и ожидалось, РНК germes обнаружена не была.
Рис. 5.
Гибридизация in situ с зондом к мРНК germes с окраской ультратонких срезов антителами, меченными наночастицами золота. (а) Вегетативный полюс ооцита стадии VI. Транскрипт-Au – в половой плазме (Gp) и макровиллях (MV). (б) Граница ядра (N) и цитоплазмы (C) малого ооцита стадии II в процессе формирования митохондриального облака. Транскрипт-Au в околоядерной цитоплазме. (в, г) Фолликулярная оболочка ооцита стадии VI. Транскрипт-Au в цитоплазме фолликулярной клетки (Fc) и макровиллях (MV) (в), а также в ядре (nFc) (г). (д) Отрицательный контроль с использованием смыслового зонда germes. Масштаб: 0.5 мкм.

Количественное соотношение мРНК germes в ооцитах и фолликулярных оболочках
Было проведено сравнение относительного количества содержания мРНК germes в двух группах ооцитов стадий I–III и стадий V–VI и фолликулярных оболочек с них. Ооциты I–III стадий и фолликулярные оболочки получали из яичников взрослых лягушек, разделяя их путем инкубации с коллагеназой. С ооцитов V–VI стадий из яичников половозрелых лягушек оболочки снимали мануально. Полученные двумя способами препараты оболочек для последующего ПЦР-РВ помимо фолликулярных клеток содержали клетки теки. Однако ранее ни методом in situ гибридизации, ни иммуноокрашиванием на белок Germes экспрессию в клетках теки зарегистрировать не удалось.
Результаты, полученные методом ПЦР-РВ подтвердили наличие транскипта мРНК germes в фолликулярных клетках (рис. 6). Содержание мРНК germes в фолликулярном слое было сопоставимо с уровнем в ооцитах V–VI стадий, а количество транскрипта в ФК малых ооцитов превышало количество в самих ооцитах примерно в 3 раза.
Рис. 6.
Относительные уровни экспрессии мРНК germes в ооцитах и фолликулярных клетках, полученные с помощью ПЦР-РВ. Относительные уровни экспрессии (RQ) рассчитывали с помощью метода ΔΔCt. В качестве референсного гена использовали ODC. Экспрессия в ооцитах стадии V–VI (bOo) принята за 1. bOo – ооциты стадии V–VI, bFc – фолликулярные оболочки с ооцитов стадии V–VI, sOo – ооциты стадии I–III, SFc – фолликулярные оболочки с ооцитов стадии I–III.

Для оценки качества снятия оболочек, мы проанализировали поверхность ооцита с использованием сканирующего микроскопа. Выяснилось, что при мануальном снятии может остаться до трети слоя фолликулярных клеток на поверхности ооцитов V–VI стадий (рис. 7б), тогда как с помощью коллагеназы фолликулярные оболочки отделяются полностью (рис. 7в).
Рис. 7.
Сканирующая электронная микроскопия поверхности ооцита стадии IV–V и фолликулярных оболочек ооцита. (а) Макровилли (MV) на поверхности фолликулярных клеток, обращенной к ооциту (указаны стрелкой). (б) Ооцит после мануального снятия оболочек. Фолликулярный слой (Fс) частично сохраняется на поверхности. в. Коллагеназа полностью снимает фолликулярные клетки с поверхности ооцита. Масштаб: (а) 3, (б, в) 150 мкм.

Если учесть, что лизат ооцитов большого роста содержит некоторое количество ФК, то можно заключить, что экспрессия germes ФК превышает экспрессию в ооцитах еще значительнее. Таким образом, метод ПЦР-РВ подтвердил результаты in situ гибридизации о наличии мРНК маркера клеток половой линии в фолликулярных клетках, имеющих соматическое мезодермальное происхождение.
Экспрессия germes в фолликулярных клетках
При помощи in situ гибридизации на целых эмбрионах, совмещенной с электронной микроскопией, было показано наличие РНК germes не только в цитоплазме и зоне отростков ФК, но и в ядре, что с высокой долей вероятности указывало на синтез этой РНК именно фолликулярными клетками. Однако этот неожиданный результат требовал дополнительных доказательств, поскольку ни для одного специфического маркера половой плазмы не показана экспрессия в ткани яичника. При экспрессии лизат ФК должен содержать непроцессированную РНК, содержащую интроны, что можно было проверить. Для этого в геномной последовательности germes был выбран короткий интрон длиною 152 пн. Для качественной оценки наличия РНК germes при помощи ПЦР использовались следующие праймеры: прямой олигонуклеотид, комплементарный концу последовательности экзона, обратный – концу последовательности интрона (рис. 8а). По присутствию ПЦР-продукта длиною 219 пн можно судить о наличии данного интрона в непроцессированной мРНК из лизатов ооцитов малого и большого роста и фолликулярных оболочек с них. Для контроля ложноположительного результата с гДНК использовались образцы тотальной РНК из ФК в пересчете на то же количество кДНК, которое использовалось для постановки ПЦР-реакции.
Рис. 8.
Выявление непроцессированной мРНК germes в ооцитах и фолликулярных клетках с них с помощью ПЦР. (а) Схема расположения экзонов и интрона в последовательности germes и схема подбора олигонуклеотидов (S, AS) для эксперимента. (б) Методом ПЦР показано наличие интрона в составе тотальной мРНК. Непроцессированная мРНК обнаружена в фолликулярных оболочках как больших (bFc), так и малых ооцитов (sFc), а в ооцитах только малого роста (sOo). Стрелкой указано положение ПЦР-продукта. sOo – oоциты стадии I–III, bOo – oоциты V–VI стадии, Z – зрелые неоплодотворенные ооциты, RNA sFc и RNA bFc – отрицательный контроль для исключения контаминации геномной ДНК образцов тотальной РНК фолликулярных клеток малых и больших ооцитов.

Наличие непроцессированной мРНК, содержащей последовательность интрона, удалось показать в лизатах фолликулярных оболочек как больших, так и малых ооцитов, а в самих ооцитах только малого роста (рис. 8б). Отсюда следует, транскрипция мРНК germes растущих ооцитов короткая, только в течение I–II стадий роста. В ооцитах большого роста РНК сохраняется, но не транскрибируется.
Обнаружение непроцессированной РНК germes в фолликулярных клетках больших и маленьких фолликулов доказывает экспрессию маркера половой плазмы germes в них на протяжении всего оогенеза.
ОБСУЖДЕНИЕ
Несмотря на длительное исследование генов ПП пока довольно мало сведений о трансляции эндогенных белков во время роста ооцитов и раннего развития эмбрионов.
В нашей работе были получены кроличьи поликлональные антитела против белка Germes, с помощью которых исследована трансляция белка в течение всего оогенеза и развития до личиночной стадии. Белок был обнаружен в ооцитах на протяжении всего оогенеза. Белок локализовался в ранних ооцитах диффузно, в ооцитах поздних стадий в вегетативном кортексе в составе ПП. Сравнение количества белка в ооцитах малого и большого роста с помощью вестерн-блоттинга при нормировании по актину не показало существенных различий. Однако, следует учесть, что объем ооцитов на исследованных стадиях возрастает в 40–200 раз, что скорее всего ведет к увеличению содержания актина. Сохранение отношения количества белка Germes к актину указывает на продолжение трансляции Germes в процессе большого роста ооцитов. Со стадии зиготы до конца гаструляции количество белка сохранялось, как это было в предыдущий период. Возможно, вместе с компактизацией гранул ПП на вегетативном полюсе после оплодотворения и образованием крупных агрегатов трансляция белка снижается или прекращается вовсе. Агрегаты половой плазмы при дроблении зиготы распределяются случайно и попадают в несколько клеток-предшественников клона первичных половых клеток. Количество ППК на стадии миграции может различаться на правой и левой половине одного зародыша, а также варьировать от зародыша к зародышу. По-видимому, белок Germes сохраняется только в этих клетках. Это может объяснять вариабельность полученных относительных значений белка после вестерн-блоттинга на последовательных стадиях развития.
Перед гаструляцией ПП в первичных половых клетках, в ее составе и мРНК germes, меняет свою локализацию с полярной гранулярной на диффузную околоядерную (Butler et al., 2017). Ранее нами было показано, что такая транслокация идет с участием Germes (Berekelya et al., 2007; Yamaguchi et al., 2013). Транслокация предшествует появлению способности к активной миграции ППК.
Неожиданным оказалось обнаружение белка Germes в окружающих ооцит фолликулярных клетках на всех стадиях роста. ФК образуются из эпителиального компартмента формирующегося яичника лягушки, а потому их происхождение никак не связано с половой линией. Ни для одного из генов ПП до настоящего времени не была установлена экспрессия в ФК. Белок может быть транслирован внутри ФК, либо транспортироваться из ооцита. Дополнительные эксперименты выявили наличие мРНК germes в фолликулярных оболочках малых и больших ооцитов, причем удельное содержание мРНК в ФК с малых ооцитов в 3 раза превышало содержание мРНК в них. Количество мРНК в больших ооцитах и ФК с них сходно.
Далее была исследована локализация обнаруженной мРНК germes с помощью in situ гибридизации, совмещенной с электронной микроскопией. Транскрипт был обнаружен в ядре, цитоплазме и зоне макро- и микровиллей. Точку в доказательстве экспрессии germes фолликулярными клетками поставило обнаружение непроцессированной формы мРНК в ФК на протяжении всего оогенеза.
Выяснилось также, что транскрипция germes в самих ооцитах непродолжительная и заканчивается к III стадии. Таким образом, выявляемая методом гибридизации in situ мРНК germes, которую мы видим в кортексе на вегетативном полюсе и ПП при дроблении и гаструляции была синтезирована еще в ооцитах I–II стадии и сохранялась на протяжении нескольких месяцев.
Функция Germes в составе ПП остается до конца неясной. мРНК germes содержит в 3'-НТО мотивы локализации в митохондриальное облако (Ponomarev et al., 2021), а белковая последовательность имеет мотивы белок-белкового связывания лейциновые молнии, кальций-связывающий домен, а также мотив связывания с легкими цепями динеина в C-концевой области (Berekelya, 2007). Легкие цепи могут входить в комплекс динеинового мотора, или связываться напрямую с другими белками, функция которых не связана с моторами цитоскелета, и просто регулировать взаимодействие белков (Rapali et al., 2011). Отсюда можно предположить участие Germes в процессах транспорта. Окрашивание белка Germes, выявленного антителами, в зоне макровиллей, а также в приграничных зонах самих ФК может служить подтверждением этого. Нарушение транслокации ПП, содержащей специфические РНК и белки в околоядерную область предшественников ППК на стадии гаструлы при оверэкспрессии как нативной, так и мутантных форм Germes также подтверждает предположение о транспортной функции белка (Berekelya et al., 2007). Для ФК транспортные функции являются одной из важнейших, однако в каких процессах может участвовать Germes, можно пока только гадать. Чем индуцируется транскрипция и трансляция белка в ооцитах и фолликулярных клетках – вопрос пока также открытый. Недавно было показано, что Sox7 может напрямую влиять на экспрессию Germes (Butler et al., 2018). Является ли Sox7 индуктором экспрессии Germes, пока неизвестно.
Список литературы
Berekelya L.A., Ponomarev M.B., Luchinskaya N.N. et al. Xenopus Germes encodes a novel germ plasm-associated transcript // Gene Expr. Patterns. 2003. V. 3. P. 521–524.
Berekelya L.A., Mikryukov A.A., Luchinskaya N.N. et al. The protein encoded by the germ plasm RNA Germes associates with dynein light chains and functions in Xenopus germline development // Differentiation. 2007. V. 75. № 6. P. 546–558.
Bilinski S.M., Jaglarz M.K., Dougherty M.T. et al. Electron microscopy, immunostaining, cytoskeleton visualization, in situ hybridization, and three-dimensional reconstruction of Xenopus oocytes // Methods. 2010. V. 51(1). P. 11–19.
Bookout A.L., Cummins C.L., Mangelsdorf D.J. et al. High-throughput real-time quantitative reverse transcription PCR // Curr. Protoc. Mol. Biol. 2006. Ch. 15. U. 15.8.
Butler A.M., Aguero T., Newman K.M. et al. Primordial germ cell isolation from Xenopus laevis embryos // Methods Mol. Biol. 2017. V. 1463. P. 115–124.
Butler A.M., Owens D.A., Wang L. et al. A novel role for sox7 in Xenopus early primordial germ cell development: mining the PGC transcriptome // Development. 2018. V. 145. № 1.
Chan A.P., Kloc M., Bilinski S. et al. The vegetally localized mRNA fatvg is associated with the germ plasm in the early embryo and is later expressed in the fat body // Mech. Dev. 2001. V. 100. P. 137–140.
Chang P., Torres J., Lewis R.A. et al. Localization of RNAs to the mitochondrial cloud in Xenopus oocytes through entrapment and association with endoplasmic reticulum // Mol. Biol. Cell. 2004. V. 15. P. 4669–4681.
Coggins L.W. An ultrastructure and radioautographic study of early oogenesis in the toad Xenopus laevis // J. Cell. Sci. 1973. V. 12. P. 71–93.
Colozza G., De Robertis E.M. Maternal syntabulin is required for dorsal axis formation and is a germ plasm component in Xenopus // Differentiation. 2014. V. 88. № 1. P. 17–26.
Cuykendall T.N., Houston D.W. Identification of germ plasm-associated transcripts by microarray analysis of Xenopus vegetal cortex RNA // Dev. Dyn. 2010. V. 239. № 6. P. 1838–1848.
Houston D.W., Zhang J., Maines J.Z. et al. A Xenopus DAZ-like gene encodes an RNA component of germ plasm and is a functional homologue of Drosophila boule // Development. 1998. V. 125. P. 171–180.
Hudson C., Woodland H.R. Xpat, a gene expressed specifically in germ plasm and primordial germ cells of Xenopus laevis // Mech. Dev. 1998. V. 73. P. 190–198.
Ivanov A.V., Korovina A.N., Tunitskaya V.L. et al. Development of the system ensuring a high-level expression of hepatitis C virus nonstructural NS5B and NS5A proteins // Protein Expr Purif. 2006. V. 48(1). P. 14–23.
Konduktorova V.V., Luchinskaya N.N. Follicular cells of the amphibian ovary: Origin, structure, and functions // Russ. J. Dev. Biol. 2013. V. 44. P. 232–244.
Lai F., Singh A., King M.L. Xenopus Nanos1 is required to prevent endoderm gene expression and apoptosis in primordial germ cells // Development. 2012. V. 139. P. 1476–1486.
Liu Y., Ren L., Ge L. et al. A strategy for fusion expression and preparation of functional glucagon-like peptide-1 (GLP-1) analogue by introducing an enterokinase cleavage site // Biotechnol. Lett. 2014. V. 36(8). P. 1675–1680.
MacArthur H., Houston D.W., Bubunenko M. et al. DEADSouth is a germ-plasm-specific DEADbox RNA helicase in Xenopus related to eIF4A // Mech. Dev. 2000. V. 95. P. 291–295.
Machado R.J., Moore W., Hames R. et al. Xenopus Xpat protein is a major component of germ plasm and may function in its organisation and positioning // Dev. Biol. 2005. V. 287. P. 289–300.
Mosquera L., Forristall C., Zhou Y. et al. A mRNA localized to the vegetal cortex of Xenopus oocytes encodes a protein with a nanos-like zinc finger // Development. 1993. V. 117. P. 377–386.
Nandadasa S., Tao Q., Menon N.R. et al. N- and E-cadherins in Xenopus are specifically required in the neural and non-neural ectoderm, respectively, for F-actin assembly and morphogenetic movements // Development. 2009. V. 136(8). P. 1327–1338.
Newport J., Kirschner M. A major developmental transition in early Xenopus embryos. I. Characterisation and timing of cellular changes at the midblastula stage // Cell. 1982. V. 30. P. 675–686.
Nieuwkoop P.D., Faber J. Normal table of Xenopus laevis (Daudin). Amsterdam: North-Holland, 1956.
Ogielska M., Kotusz A. Pattern and rate of ovary differention with reference to somatic development in Anuran amphibians // J. Morphol. 2004. V. 259. P. 41–54.
Pannese M., Cagliani R., Pardini C.L. et al. Xotx1 maternal transcripts are vegetally localized in Xenopus laevis oocytes // Mech. Dev. 2000. V. 90. P. 111–114.
Ponomarev M.B., Konduktorova V.V., Luchinskaya N.N. et al. Localization of Germes RNA in Xenopus oocytes // Russ. J. Dev. Biol. 2021. V. 52. P. 1–8.
Rapali P., García-Mayoral M.F., Martínez-Moreno M. et al. LC8 dynein light chain (DYNLL1) binds to the C-terminal domain of ATM-interacting protein (ATMIN/ASCIZ) and regulates its subcellular localization // Biochem. Biophys. Res. Commun. 2011. V. 414(3). P. 493–498.
Sambrook J., Russell D. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY., 2001.
Tarbashevich K., Koebernick K., Pieler T. TXGRIP2.1 is encoded by a vegetally localizing, maternal mRNA and functions in germ cell development and anteroposterior PGC positioning in Xenopus laevis // Dev. Biol. 2007. V. 311. № 2. P. 554–565.
Wang J., Bing X., Yu K. et al. Preparation of a polyclonal antibody against goldfish (Carassius auratus) vitellogenin and its application to detect the estrogenic effects of monocrotophos pesticide // Ecotoxicol Environ Saf. 2015. V. 111. P. 109–116.
Weidinger G., Stebler J., Slanchev K. et al. Dead end, a novel vertebrate germ plasm component, is required for zebrafish primordial germ cell migration and survival // Curr. Biol. 2003. V. 13. № 16. P. 1429–1434.
Yamaguchi T., Taguchi A., Watanabe K. et al. DEADSouth protein localizes to germ plasm and is required for the development of primordial germ cells in Xenopus laevis // Biol. Open. 2013. V. 15. № 2(2). P. 191–199.
Yang J., Aguero T., King M. L. The Xenopus maternal-to-zygotic transition from the perspective of the germline // Curr. Top. Dev. Biol. 2015. V. 113. P. 271–303.
Zearfoss N.R., Chan A.P., Wu C.F. et al. Hermes is a localized factor regulating cleavage of vegetal blastomeres in Xenopus laevis // Dev. Biol. 2004. V. 267. № 1. P. 60–71.
Zhang J., King M.L. Xenopus VegT RNA is localized to the vegetal cortex during oogenesis and encodes a novel T‑box transcription factor involved in mesodermal patterning // Development. 1996. V. 122. P. 4119–4129.
Дополнительные материалы отсутствуют.


