Онтогенез, 2022, T. 53, № 6, стр. 437-453
Критические стадии эмбриогенеза злаков: теоретическое и прикладное значение
Н. Н. Круглова a, *, Г. Е. Титова b, А. Е. Зинатуллина a
a Уфимский институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Россия
b Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова, 2, Россия
* E-mail: kruglova@anrb.ru
Поступила в редакцию 29.03.2022
После доработки 12.09.2022
Принята к публикации 10.10.2022
- EDN: OWTBKB
- DOI: 10.31857/S0475145022060040
Аннотация
Проблема критических периодов/стадий эмбриогенеза цветковых растений детально разработана с позиции системного подхода к дифференциации зародыша, учитывающим значение морфогенетических и морфофизиологических корреляций для развития эмбриональных структур и окружающих тканей семени и плода (цикл работ Т.Б. Батыгиной и В.Е. Васильевой, 1983–2014). Особый интерес вызывают критические стадии эмбриогенеза злаков, поскольку зародыш представителей этого семейства выделяется среди зародышей даже однодольных растений особым Graminad-типом эмбриогенеза и формированием специфических органов (Т.Б. Батыгина, 1968–2014). В статье на примере злаков приведен аналитический обзор литературных и собственных данных по периодизации многоступенчатого процесса эмбриогенеза, проанализированы дискуссионные вопросы, касающиеся как критериев выделения критических стадий эмбриогенеза, так и особенностей критических стадий. Обсуждаются перспективы исследования стадийности эмбриогенеза злаков, а также использования зародышей, находящихся на критических стадиях развития, в биотехнологических и селекционных исследованиях.
ВВЕДЕНИЕ
Зиготический эмбриогенез цветковых растений представляет собой единый многоступенчатый процесс, в результате которого из исходной клетки-зиготы, согласно определенным паттернам клеточных делений, в зрелом семени формируется зародыш со свойственными ему специфическими органами (Эмбриология цветковых…, 1997, 2000; Батыгина, 2014; de Vries, Weijers, 2017; Chen et al., 2021). Сложный интегративный характер эмбриогенеза растений подтверждается данными молекулярно-генетических исследований (Armenta-Medina et al., 2020; Tian et al 2020; Pabon-Mora et al., 2022).
Стадии эмбриогенеза цветковых растений выделяются на основании анализа основных морфогенетических событий, их значения для дальнейшего развития зародыша, а также структурно-функциональных изменений в клетках и органах зародыша под действием генетических, физиологических и иных факторов. Ряд исследователей расценивают некоторые стадии как критические, однако при этом используют различные критерии. Это и независимость зародыша от материнского организма (автономность), и повышенная чувствительность зародыша к воздействию внешних неблагоприятных факторов, и способность зародыша к смене программы развития на альтернативные пути.
Важно подчеркнуть, что и в эмбриогенезе животных критические стадии предложено выделять с позиции повышенной чувствительности эмбриона к неблагоприятным факторам внешней среды. Еще в конце XIX в. А. Вейсман и М.-Р. Штандфус в работах, посвященных изучению повреждающих внешних факторов на развитие некоторых насекомых, выявили, что в их эмбриогенезе имеются периоды развития, характеризующиеся особой чувствительностью к этим факторам (Weismann, 1894; Standfuss, 1896, по: Severtsova, Severtsov, 2011). Такие периоды повышенной чувствительности, во время которых происходит нарушение темпов развития отдельных органов эмбриона, позднее были названы “критическими” (Светлов, 1960 и др.). В современной эмбриологии животных большое внимание уделяется “филотипическим” стадиями развития, которые, по-видимому, соответствуют критическим периодам Светлова (Richardson, 1995, по: Severtsova, Severtsov, 2013). На этих стадиях животные, входящие в филогенетическую группу, демонстрируют наибольшее морфологическое сходство, и именно с ними ассоциирована экспрессия целого ряда генов, определяющих план строения группы. Серьезные аномалии развития также преимущественно возникают на этих стадиях. Разрабатываются эволюционные гипотезы, объясняющие возникновение критических периодов и филотипических стадий развития в эмбриогенезе животных (случайные процессы, эпигенетические процессы, стабилизирующий отбор), предлагаются модели этого феномена (“hour-glass model”, “phylotypic egg-timer model”) (по: Severtsova, Severtsov, 2013). Высказано мнение, что определенные критические фазы существуют и в процессе регенерации животных (Lange et al., 2018).
Таким образом, выявление критических стадий эмбриогенеза различных организмов следует рассматривать как фундаментальную проблему биологии развития.
Значительный вклад в решение этой проблемы внесли Т.Б. Батыгина и В.Е. Васильева (цикл работ 1983–2014). Они применили системный подход к изучению дифференциации зародыша цветковых растений, который базируется на использовании морфогенетических и морфофизиологических корреляций в развитии не только эмбриональных структур, но и окружающих тканей семени и плода. Этот подход далее был детально разработан в работах И.И. Шамрова с соавторами (обобщение: Шамров, 2008) по развитию семязачатка и семени цветковых растений. Кроме того, он был применен в экспериментальных исследованиях по культивированию in vitro пыльников пшеницы (обобщения: Круглова и др., 2005; Батыгина и др., 2010; Круглова, 2019). Использование системного подхода позволило выявить критические стадии развития семязачатка и пыльника, что важно как для понимания общих закономерностей морфогенеза этих структур, так и для биотехнологии.
С этих позиций особый интерес вызывают критические стадии эмбриогенеза злаков. Действительно, представители семейства злаковых характеризуются спецификой прохождения ранних этапов развития зародыша, его строения в зрелом семени и контакта с тканью эндосперма (обобщения: Батыгина, 1997а, 2014), что позволило выделить отдельный Graminad-тип эмбриогенеза (обобщения: Батыгина, 1997б, 2014). Выявление критических стадий эмбриогенеза злаков имеет значение не только для понимания механизмов развития их зародыша, но и для решения ряда теоретических проблем, в частности, для разработки некоторых вопросов систематики и филогении цветковых растений (Цвелёв, 2005; Batygina, 2012; Radoeva et al., 2019; Baskin, Baskin, 2021). Практический интерес к этому вопросу обусловлен бурным ростом биотехнологических исследований хлебных злаков (по: Kruglova, Zinatullina, 2022).
Ранее авторами этой статьи был выполнен обзор данных литературы и собственных исследований, посвященных выявлению и характеристике критической стадии автономности эмбриогенеза злаков (Kruglova et al., 2020b). Цель настоящей работы состоит в аналитическом обзоре данных, связанных с выявлением других возможных критических стадий эмбриогенеза злаков, а также с применением этих данных в биотехнологической практике (в свете развития представлений чл.-корр. РАН Т.Б. Батыгиной по этому вопросу).
КРИТИЧЕСКИЕ СТАДИИ ЭМБРИОГЕНЕЗА ЗЛАКОВ
Структурно-функциональные особенности развивающихся зародышей злаков
Одной из первых обстоятельных работ по эмбриогенезу злаков является работа Р. Суэжа (Souèges, 1924), в которой автор на основании анализа паттернов клеточных делений в ходе ранних стадий развития зародыша у Роа аппиа сделал вывод об отсутствии в них четких закономерностей (иррегулярный тип эмбриогенеза).
Позднее эмбриогенез злаков детальнейшим образом был изучен на примере пшеницы, в том числе с использованием 3D-реконструкций (обобщения: Батыгина, 1997а, 1997б; 2014). Выявлено, что зигота характеризуется полярностью и дорсовентральностью строения: первая проявляется в наличии в клетке морфологической оси с двумя противоположными полюсами (апикальным и базальным), вторая – в асимметрии ее строения. Дорсовентральность строения усиливается в ходе дальнейшего развития зародыша, получая все более яркое морфологическое выражение. Как правило, через сутки после сингамии зигота приступает к первому делению, асимметричному вследствие полярности этой клетки (рис. 1, 1), с образованием двух неравных клеток: меньшей апикальной и более крупной и сильновакуолизированной базальной (рис. 1, 2). В результате серии дальнейших асимметричных делений апикальной и базальной клеток и их производных (рис. 1, 2–8) формируется многоклеточный проэмбрио (рис. 1, 8). Далее в многоклеточном зародыше следуют дифференциация инициальных клеток тканей и органов, формирование зачатков органов и их дифференциация.
Рис. 1.
Схема развития зародыша пшеницы согласно Graminad-типу эмбриогенеза. 1–19 – схема строения зародыша в дорсовентральном сечении; 2а–6а – стереоскопическая схема строения зародыша. Условные обозначения: а – апекс; abd – пазушная почка; aer – придаточный зародышевый корень; cl – колеоптиль; clr – колеориза; em – зародыш; emb r – зародышевый корень; epb – эпибласт; l 1, l 2, l 3 – первые листья плюмулы; lg – лигула; rc – корневой чехлик; sc – щиток; su – суспензор. По: Батыгина, 2014, с изменениями. Пояснения в тексте.
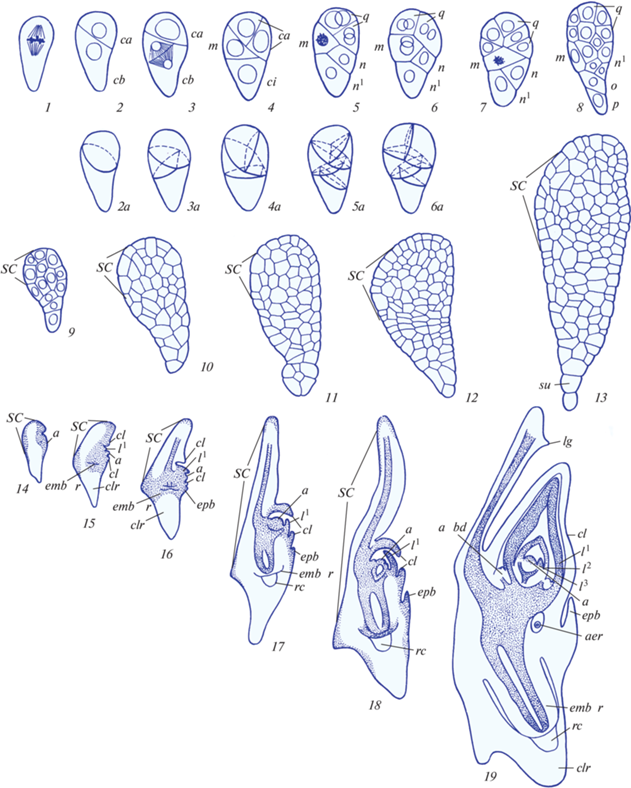
Разрастание апикально-латеральной области приводит к образованию первого органа – щитка (рис. 1, 9–13). В ходе сложных преобразований щиток смещается из латерального в терминальное положение, свойственное зрелому зародышу. В основании щитка дифференцируется прокамбиальный тяж. После начала разрастания щитка наблюдается увеличение количества митотически делящихся клеток в зоне образования апекса побега, который закладывается терминально, но постепенно смещается в боковое положение (рис. 1, 14). Дальнейшее развитие этой области приводит к обособлению колеоптиля и точки роста почечки (плюмулы) (рис. 1, 15). Заложение колеоптиля и дифференциация прокамбиального тяжа в основании щитка совпадают по времени с началом образования первого зародышевого корня эндогенно в базальной части зародыша (рис. 1, 15–16). Корневой чехлик и колеориза (корневое влагалище) возникают и развиваются как единое образование, но по завершении эмбриогенеза колеориза постепенно обособляется от чехлика (рис. 1, 15–19). Эпибласт дифференцируется позднее (рис. 1, 16) и располагается на стороне, противоположной щитку, образуя чешуевидный вырост, лишенной проводящей системы (рис. 1, 17–19).
На апексе побега постепенно формируются зачатки листьев, закладывающиеся валиком; в результате образуется зародышевая почечка (плюмула) (рис. 1, 15). Зачаточный побег зародыша представляет собой ось, состоящую из узлов и междоузлий, и в зрелом зародыше содержит несколько зачатков листьев (рис. 1, 19).
В целом, в ходе эмбриогенеза в результате множественных делений определенных кластеров клеток формируются органы зародыша пшеницы: щиток (с выделяющейся на верхушке лигулой), эпибласт, колеоптиль, колеориза, плюмула (почечка, представленная несколькими примордиями листьев) и корень (рис. 1, 19). Согласно обобщениям Т.Б. Батыгиной, основанным на анализе данных других авторов (Яковлев, 1946, 1950; Brown, 1959, 1960, 1965; Guignard, 1961; Соколовская, 1968; Чеботарь, 1972; Russell, 1979, приведено по: Батыгина, 1997а), эти органы характерны для зародышей большинства других злаков. Выявлено лишь варьирование в числе зачатков листьев на апексе побега зародыша (от 2 до 4), а также отсутствие эпибласта в зародыше кукурузы (присутствует в зародышах пшеницы, ржи, ячменя и овса).
Благодаря анализу данных многих авторов (Eames, 1959, 1961; Guignard, Menstre, 1971; Norstog, 1972; Stoddart et al., 1973; приведено по: Батыгина, 1997а; а также Itoh et al., 2005; Seldimirova et al., 2017b; Xiang et al., 2019; Baskin, Baskin, 2021) удалось выявить следующие функции органов зародыша злаков, уникальных даже среди однодольных. Роль эпибласта состоит в установлении связи зародыша с эндоспермом (резорбция прилегающих клеток эндосперма и поглощение из него питательных веществ), а также транспорте воды к зародышу воды при прорастании. Главной функцией колеоптиля является защита конуса нарастания при “пробивании” почвы прорастающей зерновкой (у некоторых видов злаков может выполнять фотосинтетическую функцию). Функция колеоризы – защита зародышевого корня и, вероятно, поставка воды и питательных веществ при прорастании.
Анализ специфических особенностей эмбриогенеза пшеницы (дорсовентральность строения зародыша, начиная с зиготы, проявляющаяся в закономерном наклонном заложении клеточных перегородок по отношению к оси проэмбрио, раннее обособление щитка, наличие специфических органов, присущих только зрелому зародышу злаков) позволил Т.Б. Батыгиной выделить особый тип эмбриогенеза злаков – Craminad-тип11 (обобщения: Батыгина, 1997б, 2014).
Следует также подчеркнуть, что Т.Б. Батыгина впервые рассмотрела зародыш злаков как единую систему “яйцеклетка–зигота–зародыш–проросток”, развивающуюся в материнских тканях семязачатка и зародышевого мешка, и внесла значительный вклад в понимание вопроса о специфической топографии его органов. В частности, она доказала, что латеральное положение апекса побега и терминальное положение щитка в зрелом зародыше злаков – явление вторичное как в онтогенетическом, так и эволюционном плане. Здесь имеется в виду отсутствие принципиальных различий в происхождении точки роста побега в зародыше двудольных и однодольных растений. Также ею высказано мнение, что щиток, колеориза и эпибласт являются производными единственной семядоли зародыша, приобретшими в процессе эволюции различные функции (Батыгина, 1997а). Следует, однако, отметить, что вопрос об эволюционном происхождении органов зародыша злаков до сих пор остается дискуссионным, и его рассмотрение не входит в задачи данной статьи.
Безусловно, исследования эмбриогенеза злаков с различных позиций проводились и в последующие годы (по: Kruglova et al., 2020а; Baskin, Baskin, 2021). Современные исследования в основном ориентированы на выявление и анализ генов, вовлеченных в последовательные стадии развития зародышей злаков. Так, молекулярно-генетические данные по раннему эмбриогенезу кукурузы используются для решения вопроса об активации зиготического генома растений (“zygotic genome activation”, или ZGA). Используя зародыши кукурузы в качестве модельной системы, исследователи провели секвенирование РНК гамет, зиготы, апикальной и базальной клеток двуклеточного зародыша с целью изучения их транскриптомов. В результате скрупулезного анализа временных паттернов экспрессии множества генов было установлено, что ZGA начинается уже через 12 ч после опыления и происходит очень динамично. Кроме того, анализ уровней экспрессии генов сигнальных путей позволил выявить гены-регуляторы семейства WOX, гомологичные генам зародыша Arabidopsis thaliana. Были также идентифицированы гены семейства MAB (ZmMAB1-3, ZmMAB6 и ZmMAB24), экспрессируемые в базальной клетке двуклеточного зародыша этого злака, и предположительно участвующие в позиционировании веретена деления при первом асимметричном делении зиготы (Chen et al., 2017). Изучение транскриптома активно применяется и по отношению к позднему эмбриогенезу кукурузы. Так, сравнительными исследованиями транскриптомов семян кукурузы дикого типа и мутанта waxy1 с восковидностью зерновки выявлены 2457 генов, дифференциально экспрессируемых в зрелых зародышах мутанта и участвующих в формировании восковидности (Gu et al., 2020). Транскриптомный анализ заложения апекса зародышевого корня в позднем эмбриогенезе кукурузы дикого типа в сравнении с поздним эмбриогенезом мутанта rtcs, лишенного зародышевого корня, позволил установить специфические изменения в динамике активности генов в зародышах каждого генотипа (Tai et al., 2017).
В литературе представлены и результаты молекулярно-генетического анализа развивающихся зародышей риса. Идентифицирован, например, ген OsASGR-BBML1, вовлеченный в самый ранний эмбриогенез, и оценено его влияния на индукцию делений зиготы (Deushi et al., 2021). Также выделен ген GLE4/MPK6, участвующий в ранней клеточной дифференциации зародыша (Ishimoto et al., 2019). У мутантов риса с гигантскими зародышами клонирован ген GE, контролирующий размер зародыша (Hu et al., 2021).
Молекулярно-генетические исследования эмбриогенеза пшеницы усложнены полиплоидностью геномов представителей этого рода (гексаплоидный геном у видов мягкой пшеницы и тетраплоидный геном у видов твердой пшеницы, по: Yu et al., 2020 и мн. др.). Были выполнены сравнительные экспериментальные исследования событий альтернативного сплайсинга у этого растения. По их результатам было высказано мнение, что усложнение геномов в ходе эволюции пшеницы, обусловленное полиплоидизацией, привело к расхождениям в регуляции эмбриогенеза на уровне генов и транскриптов не только между тетра-плоидной и гексаплоидной пшеницами, но и между подгеномами одного вида (Gao et al., 2021). В то же время, несмотря на сложную полиплоидную архитектуру геномов, молекулярные исследования развивающихся зародышей пшеницы также проводятся. Так, изолирован гомеобоксный ген TaWOX5, участвующий в координации событий в ходе раннего эмбриогенеза (Zhao et al., 2014), выявлены гены CD913555, CD905348, AY148491.1 (Yu et al., 2016) и 179 генов группы TaLEA (Liu et al., 2019), принимающие участие в синтезе ряда белков ходе позднего эмбриогенеза.
Не оставлены без внимания исследователей и гены, контролирующие связи между развивающимися зародышем и эндоспермом, например, у кукурузы (Doll et al., 2020; Zheng, 2021; Wang Q. et al., 2022) и пшеницы (Xiang et al., 2019; Gao et al., 2021). Однако анализ этого интересного, но достаточно специфического направления исследований не входит в наши задачи.
Заметим, что авторы рассмотренных выше работ, посвященных выявлению и анализу генов, вовлеченных в развитие зародышей, не выделяют стадии эмбриогенеза изученных злаков. В методической части они сообщают о “незрелом/зрелом зародыше”, “раннем/позднем эмбриогенезе”, без указания каких-либо морфологических или временных показателей. В этой связи проанализировать представленные результаты с позиции критических стадий эмбриогенеза злаков – цели данной статьи – к сожалению, не представляется возможным.
Следует подчеркнуть, что молекулярно-генетические исследования эмбриогенеза злаков все же относительно немногочисленны, в сравнении, например, с аналогичными исследованиями двудольного растения Arabidopsis thaliana (Kao et al., 2021 и мн. др.). В то же время эмбриогенез злаков изучен достаточно хорошо с позиций описательной морфологии и структурно-функциональных особенностей специфических зародышевых органов. Полученные данные позволили разработать несколько периодизаций эмбриогенеза злаков.
Периодизации эмбриогенеза злаков
Одна из первых периодизаций развития зародыша злаков приведена в работе У. Мизушимы с соавторами (Mizushima et al., 1955), выделившими в эмбриогенезе риса два периода. Во время первого периода, приходящегося на 9 сут после оплодотворения (скорее всего, этот временной интервал шире. – Авт.), происходит морфологическая и физиологическая дифференциация органов зародыша, тогда как второй период, приходящийся на 10 сут до созревания зародыша (на наш взгляд, и этот временной интервал шире. – Авт.), связан с проявлением функций дифференцированных и развитых зародышевых органов.
Позднее были предложены более детальные периодизации эмбриогенеза представителей этого семейства. В частности, Т.Б. Батыгина (обобщение: 1997а), следуя терминологии Р. Суэжа (Souèges, 1939), выделила в развитии зародыша злаков две фазы: первичная дифференциация, или бластомеризация (от формирования зиготы до обособления эмбриодермы в многоклеточном зародыше) и органогенез (от дифференциации гистогенов в многоклеточном зародыше и обособления зачатков органов до тканевой дифференциации органов). Следует отметить, что термин “бластомеризация” в эмбриологии растений применяется достаточно условно, поскольку, в отличие от животных (например, Gilbert, 2018), в ходе раннего развития зародыша бластомеры как результат дробления зиготы и производных клеток у растений не формируются. Подчеркнем мнение автора о том, что во всех сложных преобразованиях, происходящих в ходе эмбриогенеза, определяющую роль играют последовательные изменения ритма митотической активности и ориентация клеточных делений в разных областях (кластерах) зародыша, что и обусловливает как дорсовентральность строения, так и формирование специфических органов зрелого зародыша злаков.
Н.Н. Круглова (2012), сопоставив морфометрические и временные показатели (длина зародыша, сутки после опыления), а также морфогистологические данные по развитию зародыша, предложила выделять в эмбриогенезе пшеницы этап недифференцированного зародыша (стадии зиготы, двуклеточного, четырехклеточного, многоклеточного зародыша), этап морфологической дифференциации зародыша (стадии раннего, среднего и завершения органогенеза) и этап дифференцированного зародыша (стадии сформированного зародыша и зрелого зародыша). Следует, однако, отметить, что название стадии “многоклеточный зародыш” не совсем удачно, поскольку на всех последующих стадиях эмбриогенеза зародыши также являются многоклеточными.
Необходимо проанализировать немногочисленные, но очень обстоятельные исследования, связанные с выделением стадий эмбриогенеза ряда злаков при составлении пространственно-временных атласов экспрессии генов развивающихся зерновок. Так, для кукурузы дикого типа был проведен анализ транскриптомов зародышей, эндосперма и тканей семени на нескольких стадиях развития зерновки: ранней (от 0 до 8 сут после опыления), средней (от 10 до 28 сут после опыления) и поздней (от 30 до 38 сут после опыления). Важно отметить, что в пределах стадий развития зерновки авторы выделили фазу морфогенеза зародыша (от 10 до 20 сут после опыления) и фазу созревания зародыша (от 22 до 38 сут после опыления). Исследователи выявили, охарактеризовали и внесли в атлас 26 105 генов, специфически экспрессирующихся на той или иной стадии развития зерновки. При этом было продемонстрировано дифференциальное изменение транскриптома в ходе развития у зародыша, эндосперма и перикарпа. В то же время изучение паттерна активации генов, специфически связанных именно с фазами морфогенеза и созревания зародыша, не входило в задачи авторов. Указывается лишь, что фаза морфогенеза связана с активным синтезом ДНК, клеточными делениями и дифференциацией тканей и органов зародыша, а во время фазы созревания происходит активный синтез запасных веществ (Chen et al., 2014b). Позднее, используя временное разрешение с интервалом в 4–6 ч, атлас был уточнен данными о том, что 22 790 генов экспрессируются в ходе самого раннего развития зерновки, уже в течение первых 6 суток после опыления. При этом определенные гены специфически экспрессируются при двойном оплодотворении (160 генов), образовании ценоцита эндосперма (22 гена), образовании клеток в эндосперме (112 генов), дифференциации органов зародыша (59 генов) (Yi et al., 2019).
Ближе к теме нашего обзора находятся статьи, посвященные разработке атласа экспрессии генов в ходе эмбриогенеза и развития зерновок 2-х видов полиплоидных пшениц (гексаплоидной Triticum aestivum и тетраплоидной T. turgidum var. durum), а также 3-х видов диплоидных злаков (T. monococcum, Aegilops speltoides, Ae. tauschii) – предполагаемых предков полиплоидных пшениц (Xiang et al., 2019; Gao et al., 2021). Основная цель этих работ состояла в выявлении эволюционного расхождения программ экспрессии генов, оценке вклада субгеномов A, B и D в развитие зерновки полиплоидных пшениц, а также анализе альтернативного сплайсинга в развивающихся зерновках. В то же время вызывает интерес разработанная авторами периодизация эмбриогенеза злаков. На основе анализа морфологических признаков зародышей, проведенного методами световой и сканирующей электронной микроскопии, в развитии зародышей выделены семь стадий: двуклеточный зародыш, проэмбрио, переход к органогенезу, “ранний лист”, “средний лист”, “поздний лист”, зрелый зародыш. При этом возраст зародышей исчислялся в сутках после опыления. Для каждого изученного вида авторы выявили не только общее количество генов, экспрессируемых на всех стадиях развития зерновок (от 11 129 до 27 897, в зависимости от вида), но и пул генов, специфичных именно для зародышей (от 271 до 995, в зависимости от вида). Отметим тот интересный, на наш взгляд, факт, что большинство специфичных для зародышей генов выявлены на стадиях двуклеточного и зрелого зародышей. В ходе анализа транскриптомов продемонстрированы достоверные различия в транскрипционных программах во время каждой выделенной стадии эмбриогенеза, в сопоставлении с развитием эндосперма и перикарпа. Как подчеркивают авторы, именно стадия эмбриогенеза (а не конкретный геном/субгеном) важна для паттерна дифференциальной экспрессии генов в развивающихся тканях зерновки изученных злаков. Частично эти работы проанализированы ниже, в связи с выделением критических стадий эмбриогенеза злаков.
Таким образом, стадийность развития зародышей находит свое отражение во всех проанализированных периодизациях эмбриогенеза злаков, различающихся критериями выделения стадий эмбриогенеза.
В целом, среди покрытосеменных растений злаки выделяются особенностями как процесса эмбриогенеза (уникальный Graminad-тип), так и строения зрелого зародыша, органы которого свойственны только представителям этого семейства. Предложены различные периодизации эмбриогенеза злаков, однако единая периодизация отсутствует (в отличие, например, от эмбриогенеза двудольного растения Arabidopsis thaliana, по: Harnvanichvech et al., 2021). По-видимому, во многом это обусловлено не только спецификой эмбриогенеза и оригинальной структурой зародышей злаков, но и использованием различных критериев для выделения стадий их развития: время после опыления, морфометрические параметры, структурные показатели (число клеток и характер делений, гистологические изменения, закладка и дифференциация тех или иных органов), экспрессия транскрипционных факторов и других специфических генов и др. Методическая правомерность использования этих критериев подтверждается экспериментальными данными по структурно-функциональной организации клеток и органов развивающихся зародышей злаков, а также данными по дифференциальной экспрессии генов в ходе развития. Тем не менее, по нашему мнению, более перспективна выработка единого подхода к решению проблемы периодизации эмбриогенеза злаков. Такая периодизация должна учитывать комплекс критериев. Однако базовыми должны стать основные морфогенетические события, происходящие в зародыше на каждой стадии развития и на каждом уровне организации. При этом особое внимание следует уделить такому важному критерию, как последовательные изменения ритмов митотической активности и ориентации клеточных делений в разных кластерах зародыша. Именно этот критерий был положен в основу периодизации эмбриогенеза злаков Т.Б. Батыгиной (обобщения: 1997а, 2014).
Критические стадии эмбриогенеза злаков
Проблема критических стадий эмбриогенеза цветковых растений детально разработана Т.Б. Батыгиной и В.Е. Васильевой в 1983–2014 гг. (обобщения: Batygina, Vasilyeva, 2003; Батыгина, 2014). Исследователи полагали, что в эволюции зародышей цветковых растений можно видеть становление двух общих фаз – проэмбриональной (бластомеризация) и эмбриональной (органогенез) – включающих общие и специфические критические периоды и стадии. Вопрос, чем можно объяснить сходство организации зародыша у всех современных растений (например, результатом параллельной эволюции или общностью происхождения, по: Терехин, 1996), по мнению авторов, остается открытым.
В основу выделения как общих, так и специфических критических периодов эмбриогенеза Т.Б. Батыгиной и В.Е. Васильевой положен подход, учитывающий морфогенетические и морфофизиологические корреляции в развитии зародыша. Критическими стадиями авторы называли отрезки времени, характеризующиеся сменой структурно-функциональных характеристик самого зародыша и окружающих его тканей семени и плода.
Одной из важнейших критических стадий эмбриогенеза цветковых растений Т.Б. Батыгина и В.Е. Васильева считали стадию автономности. В данном случае автономность – это особое структурно-функциональное и морфофизиологическое состояние развивающегося зародыша (нового спорофита), способного к саморегуляции, независимого от окружающих тканей, способного завершить нормальный эмбриогенез вне материнского организма и развиться при этом в нормальное растение (обобщения: Vasilyeva, Batygina, 2006; Батыгина, 2014). В этих работах авторы подняли вопросы эволюции автономности зиготического эмбриогенеза как этапа автономизации онтогенеза (в свете идей И.И. Шмальгаузена, 1982), выделения понятий относительной и полной автономности зародышей цветковых растений. Отметим, что термин “автономность” применительно к зародышу растений был впервые предложен Т.Б. Батыгиной в 1975 г., а в дальнейшем неоднократно обсуждался в литературе (подробнее см.: Vasilyeva, Batygina, 2006).
Подробный анализ этого направления исследований дан в работе Н.Н. Кругловой с соавторами (Kruglova et al., 2020b), в которой на примере злаков проанализированы экспериментальные способы выявления критической стадии автономности зародыша на основе различных критериев, а также морфологический, гистологический и физиологический (гормональный) статус автономных зародышей. В то же время следует еще раз обратить внимание на тот факт, что стадия автономности зародышей представителей этого семейства совпадает со стадией среднего органогенеза (согласно периодизации: Круглова, 2012), что соответствует 15–17-м суткам после опыления. Экспериментально на обширной коллекции пшеницы разных генотипов установлено, что зародыши этой стадии эмбриогенеза в условиях in vitro завершают свое развитие вне донорского растения и формируют полноценные фертильные регенеранты (Круглова, 2014). Гистологическими методами выявлено, что у таких зародышей дифференцированы все органы (Круглова и др., 2018), а методами иммуногистохимии в них выявлена локализация эндогенных гормонов – индолил-3-уксусной (ИУК) и абсцизовой (АБК) кислот (Сельдимирова и др., 2017).
Правомерность выделения стадии среднего органогенеза в качестве автономной и критической косвенно подтверждается данными литературы по молекулярно-генетическим характеристикам зародышей пшеницы на стадии “средний лист” (судя по представленным рисункам, соответствует стадии среднего органогенеза. – Авт.). В таких зародышах выявлена повышенная экспрессия генов семейств MYB, BHLH, NAC, WRKY, MADS и bZIP TF, связанных с синтезом крахмала и запасных белков (Xiang et al., 2019). Это сопровождается повышением частоты событий альтернативного сплайсинга в эндосперме, что также может вносить вклад в регуляцию синтеза крахмала и запасных белков (Yu et al., 2020; Gao et al., 2021), а в целом свидетельствует о повышенном метаболизме на данной стадии развития. Аналогичные данные представлены в работе, посвященной ультраструктурным исследованиям клеток формирующихся зародышей пшеницы. Выявлено, что на стадии среднего органогенеза клетки щитка содержат липидные капли и крупные амилопласты, аккумулирующие крахмал (Seldimirova et al., 2017b).
Важно подчеркнуть, что представления Т.Б. Батыгиной и В.Е. Васильевой о критических стадиях развития зародыша цветковых растений сводились не только к идее об автономизации эмбриогенеза. Они также внесли вклад в развитие теории П.Г. Светлова (1960) о критических периодах эмбриогенеза, в основу выделения которых положен критерий повышенной чувствительности клеток зародыша (у автора – зародыша животных) к воздействию неблагоприятных факторов внешней среды. Разработанное Т.Б. Батыгиной и В.Е. Васильевой положение о смене структурно-функциональных характеристик клеток зародыша растений и детерминации процессов его развития в ходе критических стадий эмбриогенеза логично объясняло особую чувствительность эмбриональных структур к действию неблагоприятных факторов (возникновение аномалий, остановка развития зародыша, переключение программы развития на альтернативные пути).
Это положение получило экспериментальные подтверждения в работах, выполненных на зародышах злаков в условиях как in vivo, так и in vitro. Так, были проведены многолетние исследования воздействия повышенных и пониженных температур на развивающиеся зародыши пшеницы. В результате получены данные о частичном (а при некоторых условиях и полном) блокировании эмбриогенеза на двух стадиях – глобулярного зародыша и инициального органогенеза, которые авторы расценивали как критические (Банникова и др., 1991).
Особая чувствительность зародышей пшеницы на этих стадиях подтверждается и результатами изучения влияния ряда ингибиторов полярного транспорта ауксинов на становление билатеральной симметрии (Fischer et al., 1997; Fischer-Iglesias et al., 2001). Исследователи установили, что воздействие N-1-нафтилфталамовой кислоты и кверцетина на изолированные зародыши в условиях in vitro приводит к формированию зародышей аномальных фенотипов, в том числе с множественными органами различной топографии (“сиамские зародыши спина-к-спине”, “сердечковидные сиамские зародыши” и др.). При этом была выявлена четкая зависимость частоты возникновения аномалий не только от типа и концентрации использованных ингибиторов, но и от глобулярной и переходной к органогенезу стадий развития инокулированных зародышей. Авторы предположили, что физиологический механизм формирования аномальных фенотипов состоит в нарушении полярных потоков ауксинов при становлении билатеральной симметрии зародышей во время перехода от глобулярной стадии к органогенезу. Сходные данные получены Г.Е. Титовой с соавторами (Titova et al., 2016), выявившими образование аналогичных аномальных фенотипов при воздействии in vitro синтетического ауксина 2,4-Д на микроспориальные эмбриоиды пшеницы на глобулярной или переходной к органогенезу стадиях (все эти фенотипы были классифицированы как “полимерные зародыши”, или “полиэмбриоиды”).
“Критичность” глобулярной и переходной к органогенезу стадий развития зародышей в отношении полярного транспорта ауксинов подтверждена и для кукурузы. Был выполнен анализ динамики локализации свободного эндогенного ауксина ИУК и переносчика ауксина – трансмембранного белка ZmPIN1 (использовались специфические моноклональные антитела). Оказалось, что становление активного полярного потока ауксинов в клетках зародыша происходит именно на переходной к органогенезу стадии (при смене радиальной симметрии зародыша на билатеральную), в направлении от базального к апикальному полюсу зародыша. При этом полярный перенос ауксинов коррелирует с дифференциацией тканей зародыша (Forestan et al., 2010; Forestan, Varotto, 2012; Chen et al., 2014а). У мутантов кукурузы Shai1, характеризующихся различными дефектами морфологии зародыша, также во время раннего органогенеза выявлено изменение полярного транспорта ауксина, приводящее к формированию крайне редуцированного щитка, бифуркации оси побега и остановке развития зародыша (к сожалению, авторы не конкретизируют стадию эмбриогенеза) (Mimura et al., 2018). Сходные данные получены для ячменя: содержание эндогенного ауксина в клетках соматических зародышей in vitro повышалось по мере перехода от стадии раннего проэмбрио к стадии закладки органов, что коррелировало с экспрессией гена HvTAR2, участвующего в биосинтезе ауксина (Perez-Perez et al., 2019).
На наш взгляд, одним из важных перспективных направлений в биологии развития является дальнейший анализ различных аномалий в эмбриогенезе цветковых растений при нарушении полярного транспорта ауксинов. Этот анализ целесообразно проводить с позиции теории критических периодов эмбриогенеза. Также перспективны и эксперименты по исследованию нарушений гормональных связей зародыша и эндосперма на критических стадиях эмбриогенеза, проявляющихся. под действием внешних факторов. Значимость для нормального эмбриогенеза координированных связей в системе “зародыш–эндосперм” и их взаимных сигнальных влияний показана как для злаков (An et al., 2020), так и для других цветковых растений (Song et al., 2021).
В свете идей, заложенных в работах Т.Б. Батыгиной и В.Е. Васильевой, особый интерес представляет способность зародышей цветковых растений на критических стадиях к переключению программы развития на альтернативные пути морфогенеза. К таким путям можно отнести каллусогенез in vitro при воздействии адекватных факторов культуральной среды.
Заметим, что в этой статье мы анализируем работы, связанные с изучением именно морфогенных (в том числе эмбриогенных), каллусов, поскольку в различных условиях in vitro из разных эксплантов могут быть получены и неморфогенные каллусы (подробнее см.: Зинатуллина, 2020б).
Каллус традиционно определяется как пролиферирующая масса дедифференцированных клеток (Feher, 2019; Chiam et al., 2019) или как масса плюрипотентных клеток (Wang Y. et al., 2022a). Т.Б. Батыгиной (2014 и ранее) принадлежит более функциональное определение каллуса: это интегрированная система, образующаяся как экзогенно (в результате пролиферации поверхностных клеток различных тканей растения), так и эндогенно (в глубине тканей растения), изначально состоящая из однородных клеток, постепенно преобразующихся в систему групп гетерогенных клеток, которые имеют морфогенетические потенции, реализуемые различными путями морфогенеза.
Многочисленными исследованиями на примере различных видов растений выявлено, что клетки/группы клеток каллуса способны дать начало полноценному растению-регенеранту (по: Kruglova et al., 2018a; Bidabadi, Jain, 2020; Raspor et al., 2021 и мн. др.). Каллусогенез in vitro оценивается как проявление пластичности морфогенеза растений (Christiaens et al., 2021 и др.). Механизмы каллусообразования хорошо изучены на примере Arabidopsis thaliana (подробнее см.: Ikeuchi et al., 2019), однако злаки в этом отношении исследованы пока недостаточно.
В контексте данной статьи необходимо обратить внимание на стадию эмбриогенеза незрелых зародышей злаков, дающих начало каллусам in vitro. Именно эту стадию можно рассматривать как критическую, во время которой происходит переключение программы развития зародыша. Детальными исследованиями растений пшеницы, принадлежащих к разным группам генотипов, установлено, что такие зародыши находились на стадии раннего органогенеза (по периодизации: Круглова, 2012), соответствующей 12–14-м суткам после опыления. Гистологическими методами выявлено, что каллусы формировались из меристематических клеток эпидермиса щитка (Круглова и др., 2019а). Отметим, что данные о формировании каллуса из эпидермальных клеток щитка незрелых зародышей (без указания стадии эмбриогенеза) получены и для кукурузы (Du et al., 2019; Lopez-Ruiz et al., 2019). Установлено, что клетки щитка зародышей пшеницы на стадии раннего органогенеза характеризуются высокой метаболической активностью. Об этом свидетельствуют особенности их ультраструктуры: значительное количество свободных рибосом, амилопластов, единичных развитых хлоропластов, митохондрий с хорошо развитыми внутренними мембранами, активный комплекс Гольджи и гранулярный эндоплазматический ретикулум (Seldimirova et al., 2017b). У ячменя выявлено резкое увеличение содержания эндогенных гормонов – ИУК и цитокининов – в зародышах этой стадии по сравнению с предыдущими стадиями эмбриогенеза (Seldimirova et al., 2019).
Детальные исследования молекулярно-генетических механизмов формирования каллусов in vitro из незрелых зародышей злаков, находящихся на критической стадии эмбриогенеза, проведены на примере кукурузы. Одна из первых работ в этой области выполнена И. Шеном с соавторами (Shen et al., 2012). Исследователи инокулировали незрелые зародыши длиной 1.5–1.8 мм через 12 сут после опыления (стадию эмбриогенеза авторы не указали). В результате анализа дифференциальной экспрессии генов на трех последовательных этапах культивирования in vitro (через 1–5, 6–10, 11–15 сут после инокуляции) авторы выявили экспрессию 251, 324 и 313 генов, специфичных для этих последовательных этапов и влияющих на дедифференциацию зародышей и образование эмбриогенных каллусов. Экспрессируемые гены были связаны главным образом с транспортом и метаболизмом аминокислот и углеводов, а также развитием клеточных оболочек. Позднее был проведен анализ транскриптомов незрелых зародышей кукурузы, инокулированных через 10–12 сут после опыления (авторы этой работы также не указывали стадию эмбриогенеза). В течение первых 8 сут культивирования in vitro были выявлены 7525 генов, индуцированных действием экзогенного ауксина 2,4-Д. Эти гены были связаны преимущественно с трансмиссией и трансдукцией сигналов, влияющих на формирование эмбриогенных каллусов (Du et al., 2019). Кроме того, установлена важнейшая роль некоторых miРНК (miR156, miR160 и miR166) в репрограммировании развития незрелых зародышей кукурузы по пути каллусогенеза in vitro (Lopez-Ruiz et al., 2019).
В последнее время опубликовано немало обзоров, посвященных оценке компетентности клеток различных эксплантов к формированию каллуса in vitro (Kruglova et al., 2018а; Radhakrishnan et al., 2018; Feher, 2019; Gordon-Camm et al., 2019; Ikeuchi et al., 2019; Sugimoto et al., 2019; Bidabadi, Jain, 2020; Kruglova et al., 2021; Raspor et al., 2021; Круглова, 2022). В этой области получены и новые экспериментальные данные по зародышам кукурузы (Du et al., 2019; Lopez-Ruiz et al., 2019; Wang Y. et al., 2022b) и пшеницы (Seldimirova et al., 2017b; Круглова и др., 2019а). Анализ этих работ позволяет высказать мнение о роли экспланта в индукции каллусообразования in vitro. Мы полагаем, что к формированию каллусов in vitro компетентны клетки определенного органа экспланта (в частности, щитка зародыша злаков) на достаточно ранней стадии развития (в частности, ранний органогенез зародыша). Компетентность таких клеток к каллусообразованию in vitro зависит не столько от внешних стимулов, сколько от их статуса в момент инокуляции, а именно – меристематичности, что обусловливает способность к репрограммированию в плюрипотентное состояние на индукционной среде in vitro. Кроме того, меристематические клетки таких эксплантов не только морфогенетически компетентны и плюрипотентны, но и, по-видимому, тотипотентны, поскольку являются исходными для клеток/групп клеток каллусов, реализующих различные пути морфогенеза in vitro на регенерационной среде.
Таким образом, стадию раннего органогенеза можно определить как еще одну критическую в эмбриогенезе злаков, наряду с рассмотренными выше глобулярной стадией и стадией среднего органогенеза. В данном случае критерием “критичности” является способность незрелого зародыша к смене программы развития на альтернативную: формирование каллуса вместо завершения эмбриогенеза.
Следует отметить, что зиготические зародыши злаков критических стадий эмбриогенеза могут переключаться при определенных условиях in vitro не только на каллусогенез, но и на другие альтернативные пути морфогенеза. Примером могут служить упомянутые выше фенотипы половых и микроспориальных “сиамских зародышей” пшеницы, формирующиеся in vitro под действием ингибиторов полярного транспорта ауксинов (Fischer et al., 1997; Fischer-Iglesias et al., 2001; Titova et al., 2016), которые можно рассматривать как результат смены программы развития полового зародыша. С точки зрения Г.Е. Титовой с соавторами (Titova et al., 2016), формирование различных фенотипов “сиамских зародышей” (полимерных зародышей, или полиэмбриоидов) является результатом поздней, незавершенной кливажной полиэмбрионии, сопровождающейся радиальной, линейной и кольцевой фасциациями. При этом проявление кливажной полиэмбрионии именно на глобулярной стадии развития зародыша может быть обусловлено более высокой чувствительностью клеток к различным воздействиям, чем на стадиях зиготы и раннего проэмбрио. Согласно Т.Б. Батыгиной (см. Batygina, Osadtchiy, 2013), кливажная полиэмбриония может рассматриваться как способ образования соматических зародышей (эмбриоидов) на базе дочернего спорофита – из клеток зиготы или многоклеточного зиготического зародыша. Другими словами, это переключение программы развития “эмбриогенез → соматический эмбриогенез (эмбриоидогенез)”. В то же время, наличие непрерывных переходных состояний между разными фенотипами сиамских зародышей и их трактовка как результата перехода от одного типа фасциаций к другому (Titova et al., 2016) может указывать и на более глобальную смену программы развития зиготического зародыша цветковых растений в процессе эволюции. В частности, возникновение двух основных линий эволюции зародыша (дикотилия и монокотилия) может быть связано с процессом незавершенной кливажной полиэмбрионии и образованием разных фенотипов сиамских зародышей, а переход от ди- к монокотилии являться следствием линейной фасциации органов двусемядольного зародыша. При этом так называемая “латеральность”, уникальная для апекса побега однодольного зародыша, по сути, представляет искривление его оси – один из характерных признаков проявления линейных фасциаций у растений (Титова, 2019).
Таким образом, в эмбриогенезе злаков достаточно достоверно можно выделить ряд критических стадий на основании таких критериев, как а) способность зародыша к саморегуляции и его независимость от материнского организма (автономность); б) повышенная чувствительность зародыша к воздействию внешних неблагоприятных факторов, вплоть до индуцирования аномалий, а также частичного или полного блокирования развития; в) способность зародыша к смене программы развития на альтернативные пути. Согласно различным периодизациям, к критическим стадиям эмбриогенеза злаков следует отнести глобулярную стадию и органогенез (включая переход к органогенезу, ранний (инициальный) органогенез и средний органогенез, соответствующий дифференциации органов).
Перспективы использования критических стадий эмбриогенеза злаков в прикладных исследованиях в целях селекции
Выявление и изучение критических стадий развития зародыша злаков важно не только в теоретическом отношении, но и с позиций практического использования в различных селекционных программах.
Перспективное прикладное направление состоит в использовании зародышей злаков на критических стадиях эмбриогенеза в биотехнологии для адаптивной селекции по признаку устойчивости к действию абиотических стрессоров, в частности, к засухе. Важность решения проблемы засухоустойчивости растений трудно переоценить. Физиологическая засуха приводит к значительным потерям урожая хлебных злаков не только в засушливых, но и в полузасушливых регионах, вплоть до возникновения угрозы продовольственной безопасности (Plant life.., 2020). Самими растениями на разных уровнях организации выработаны морфологические, физиологические, биохимические и иные способы стратегической адаптации к этому стресс-фактору (обзоры: Liu et al., 2020; Kandel, 2021; Yadav et al., 2021). Несмотря на это, исследователи активно разрабатывают различные подходы к созданию засухоустойчивых сортов хлебных злаков по способности формировать относительно высокий уровень урожайности в условиях дефицита воды (Зинатуллина, 2020а; Ali et al., 2020; Mao et al., 2021 и др.). Привлекаются и биотехнологические методы культуры in vitro (Maleki et al., 2019; Pykalo et al., 2019 и др.). При этом исследователи, как правило, исходят из того базового принципа, что регенерация в культуре in vitro определяется в первую очередь особенностями генотипа донорского растения (Ibanez et al., 2020 и др.).
Успех адаптивной селекции на устойчивость к физиологической засухе в значительной степени зависит от раннего диагностирования признака “засухоустойчивость” у создаваемых генотипов (Guo et al., 2021). Дать оценку засухоустойчивости вновь созданных гибридных комбинаций на самых ранних этапах их онтогенеза возможно на основе использования эмбриокультуры – метода культивирования in vitro разновозрастных зиготических зародышей (Plant Embryo Culture, 2011). Безусловная перспективность этого метода в выявлении стресс-устойчивых растений определяется, на наш взгляд, тем, что зародыш обладает всеми морфогенетическими потенциями взрослого организма (Батыгина, 2014), в том числе способностью противостоять стрессам.
Многочисленными исследованиями выявлены два пути формирования регенерантов в эмбриокультуре in vitro – прямой (регенеранты формируются непосредственно из зародышей согласно схеме “один зародыш → один регенерант”) и непрямой (регенеранты формируются из зародышевых каллусов согласно схеме “один зародыш → → один каллус → несколько регенерантов”).
По нашему мнению, биотехнологам следует обратить особое внимание на использование прямой эмбриокультуры in vitro именно автономных зародышей злаков. Как показано выше, такие незрелые зародыши, находящиеся на критической стадии эмбриогенеза, по своему морфологическому, гистологическому и гормональному статусу готовы к автономному развитию, не зависимому от материнского организма. В то же время структурная и функциональная дифференциация таких зародышей обусловлена не только их собственным генотипом (тип эмбриогенеза, специфика развития), но и – опосредованно – генотипом всего материнского организма (Vasilyeva, Batygina, 2006), в том числе способностью материнской особи противостоять засухе. Автономные зародыши засухоустойчивых генотипов, инокулированные in vitro во время критической стадии эмбриогенеза на селективные питательные среды, имитирующие дефицит влаги, в оптимальных условиях могут дать начало засухоустойчивым регенерантам. Перспективность использования прямой эмбриокультуры in vitro автономных зародышей злаков определяется и тем, что выявление и селективный отбор толерантных к дефициту воды незрелых зародышей позволяет дать экспресс-оценку засухоустойчивости вновь создаваемого гибрида. Ускорение селекционных разработок в данном случае достигается за счет того, что новый генотип диагностируется на засухоустойчивость на самой ранней стадии онтогенеза – зародыше, а не путем лабораторной оценки зрелых зерновок или полевой оценки растений, как это принято в рутинной селекционной практике.
Несмотря на обоснованность и перспективность культивирования in vitro незрелых зародышей злаков на критической стадии автономности с целью создания засухоустойчивых генотипов, практических результатов таких исследований в литературе представлено сравнительно немного (по: Kruglova, Zinatullina, 2022). В качестве примера можно привести итоги многолетних исследований автономных зародышей обширной коллекции пшеницы родительских сортов и гибридных линий, полученных прямыми и реципрокными скрещиваниями (Круглова и др., 2018, 2019б; Зинатуллина, Никонов, 2021; Круглова, Сельдимирова, 2022). Авторы применили комплексный критерий оценки засухоустойчивости генотипов. Они воздействовали на автономные зародыши, находящиеся на критической стадии среднего органогенеза, условиями, имитирующими дефицит влаги. Это воздействие достигалось введением в состав питательной среды ряда осмотиков сублетальных концентраций. Оценивалась способность таких зародышей дать начало проросткам, развивающимся до фенофазы кущения in vitro и фенофазы полной спелости зерна в почвенных условиях ex vitro. Были проанализированы лабораторная всхожесть полученных зерновок и эмбриональные показатели растений, выращенных из таких зерновок в полевых условиях. В результате выявлены и включены в селекционные программы засухоустойчивые генотипы, характеризующиеся следующими свойствами: их автономные зародыши могут формировать проростки нормальной морфологии в условиях имитации засухи; достаточно высокая лабораторная всхожесть полученных зерновок; отсутствие аномалий в эмбриогенезе полученных растений.
Непрямой путь образования регенерантов злаков в эмбриокультуре in vitro также должен заслуживать внимания биотехнологов. Этот путь состоит в получении каллусов из зародышей на критической стадии раннего органогенеза, переносе каллусов на регенерационную среду, получении из них регенерантов. Несмотря на то, что дополнительный этап формирования зародышевых каллусов и индуцирования в них регенерации приводит к увеличению длительности экспериментов, непрямая эмбриокультура in vitro имеет ряд несомненных преимуществ для оценки засухоустойчивости селекционных образцов. Так, для культуры in vitro можно задать параметры селективных условий (точно так же, как задаются условия засухи), а затем детально проанализировать реакции клеток и тканей каллусов на действие стресс-фактора. Кроме того, в культуре in vitro при добавлении стресс-агента в селективную среду происходит непосредственное взаимодействие со стрессором практически всех клеток каллуса. Тем самым создается возможность исследования механизмов действия стрессоров на тканевом, клеточном и молекулярном уровнях. Важно и то, что культивирование in vitro зародышевых каллусов на регенерационной селективной среде, имитирующей засуху, позволяет не только получить, но и тиражировать засухоустойчивые регенеранты (по: Kruglova et al., 2018b; Зинатуллина, 2020б). Основное же преимущество использования зародышевых каллусов состоит в сходстве морфогенетических процессов, протекающих в растениях in vivo и в культивируемых каллусах in vitro в ответ на действие абиотических факторов. В таком сходстве реакций можно видеть действие принципа универсальности путей морфогенеза растений в естественных и экспериментальных условиях, выдвинутого Т.Б. Батыгиной (2014 и ранее).
В то же время, данное направление биотехнологических исследований – использование каллусных культур зародышевого происхождения для оценки засухоустойчивости получаемых регенерантов злаков – разработано крайне недостаточно. Помимо того, что таких работ сравнительно немного, в качестве эксплантов для получения каллусов используются зародыши, для которых не определена стадия эмбриогенеза (по: Зинатуллина, 2020б). Разработки по получению засухоустойчивых регенерантов злаков в каллусной культуре, в которых имеются сведения о применении в качестве эксплантов незрелых зародышей критических стадий эмбриогенеза, единичны. Так, успешное использование в качестве эксплантов зародышей на критической стадии раннего органогенеза продемонстрировано в работе О.А. Сельдимировой с соавторами (Seldimirova et al., 2017a). Эта работа посвящена исследованию влияния антистрессового регулятора роста растений 24-эпи-брассинолида на формирование и рост каллусов, а также регенерацию из них засухоустойчивых проростков пшеницы.
Безусловно, возможны и другие направления прикладного использования зародышей злаков, находящихся на тех или иных критических стадиях эмбриогенеза. Большой интерес в этом отношении вызывают зародыши на глобулярной и переходной к органогенезу стадиях эмбриогенеза. Как было сказано выше, микроспориальные соматические зародыши пшеницы во время этих стадий в определенных экспериментальных условиях in vitro способны к переключению программы развития на альтернативные пути, ведущие к формированию фенотипов полимерных “сиамских” зародышей с множественными органами и различной топографией их положения (Titova et al., 2016). Как полагают авторы, использование таких полимерных зародышей может оказаться успешным в селекционных разработках новых форм пшеницы с повышенной зерновой продуктивностью.
В целом, применение экспериментальных систем с использованием зародышей злаков, находящихся на различных критических стадиях эмбриогенеза, весьма перспективно для биотехнологических селекционных разработок. Предпосылкой для использования таких систем является сходство ответных реакций растений in vivo и эксплантов/регенерантов in vitro, основанное на универсальности путей морфогенеза (Батыгина, 2014).
ЗАКЛЮЧЕНИЕ
В биологии развития растений проблема критических периодов и стадий эмбриогенеза разрабатывается с позиций системного подхода к дифференциации зародыша, который учитывает наличие морфогенетических и морфофизиологических корреляций в развитии эмбриональных структур и окружающих тканей семени и плода.
Особый интерес вызывают критические стадии эмбриогенеза злаков, поскольку зародыш представителей этого семейства выделяется среди зародышей цветковых растений как особым Graminad-типом эмбриогенеза, так и формированием специфических органов.
Теоретически и экспериментально показано, что в эмбриогенезе злаков можно выделить ряд критических стадий на основании таких критериев, как а) способность зародыша к саморегуляции и его независимость от материнского организма (автономность); б) повышенная чувствительность зародыша к воздействию внешних неблагоприятных факторов, вплоть до индуцирования аномалий, а также частичного или полного блокирования развития (этот критерий во многом совпадает с критерием выделения критических периодов в эмбриогенезе животных); в) способность зародыша к смене программы развития на альтернативные пути.
Согласно периодизациям эмбриогенеза, предложенным разными авторами, к таким критическим стадиям следует отнести глобулярную стадию и органогенез (включая переход к органогенезу, ранний (инициальный) органогенез и средний органогенез, соответствующий дифференциации органов). Теоретически, для злаков, как и представителей других семейств цветковых растений, возможно существование и иных критериев выделения критических стадий, и иных критических стадий эмбриогенеза. Однако при этом важно выработать единый подход к периодизации сложного многоступенчатого процесса эмбриогенеза злаков на основе комплексных критериев и, прежде всего, – морфогенетических событий, происходящих в развивающемся зародыше на каждом уровне организации.
В целом же следует признать, что хотя проблема критических стадий развития зародыша цветковых растений поставлена достаточно давно, единый подход к ее решению, как и единые критерии выделения таких стадий и унифицированная терминология, еще не разработаны. Отсутствуют и сравнительные аналитические исследования критических стадий эмбриогенеза растений и животных, хотя само понятие “критические стадии эмбриогенеза”, по-видимому, следует отнести к общебиологическим. Немногочисленны экспериментальные верификации в этой области исследований. Прикладное применение зародышей на критических стадиях эмбриогенеза только начинает разрабатываться. Сейчас оно ограничено биотехнологическими разработками, в которых используются прямые и непрямые эмбриокультуры in vitro хлебных злаков.
Решение перечисленных вопросов зависит, в первую очередь, от дальнейших исследований последовательных стадий зиготического эмбриогенеза цветковых растений, главным образом с использованием молекулярно-генетических подходов. Однако не менее важно проводить аналогичные исследования соматического эмбриогенеза тех же объектов в контролируемых условиях культуры in vitro. Сравнение стадий развития зиготического и соматического зародышей может способствовать выявлению общих закономерностей и специфических черт этих процессов, а также выделению и дальнейшему изучению критических стадий эмбриогенеза растений.
Список литературы
Банникова В.П., Хведынич О.А., Кравец Е.А. и др. Основы эмбриогенеза злаков / Отв. ред. Яковлев М.С. Киев: Наукова думка, 1991. 176 с.
Батыгина Т.Б. Эмбриогенез злаков // Эмбриология цветковых растений. Терминология и концепции. Т. 2. Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997а. С. 528–538.
Батыгина Т.Б. Graminad-тип эмбриогенеза // Эмбриология цветковых растений. Терминология и концепции. Т. 2: Cемя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997б. С. 520–526.
Батыгина Т.Б. Биология развития растений. СПб.: ДЕАН, 2014. 764 с.
Батыгина Т.Б., Круглова Н.Н., Горбунова В.Ю. и др. От микроспоры – к сорту. М.: Наука, 2010. 174 с.
Зинатуллина А.Е. Модельная система “зародыш–зародышевый каллус” в экспресс-оценке стрессовых и антистрессовых воздействий (на примере злаков) // Экобиотех. 2020а. Т. 3. № 1. С. 38–50.
Зинатуллина А.Е. Цитофизиологические особенности контрастных типов каллусов in vitro // Успехи соврем. биол. 2020б. Т. 140. № 2. С. 183–194.
Зинатуллина А.Е., Никонов В.И. Лабораторная оценка регенерантов гибридных комбинаций пшеницы в условиях in vitro и ex vitro // Экобиотех. 2021. Т. 4. № 2. С. 81–88.
Круглова Н.Н. Периодизация развития зародыша пшеницы как методологический аспект биотехнологических разработок // Изв. Уфимского НЦ РАН. 2012. № 2. С. 21–24.
Круглова Н.Н. Выявление автономности зародыша пшеницы как этап разработки экспресс-диагностической биотехнологии получения засухоустойчивых образцов // Перм. агр. вестн. 2014. № 1(5). С. 38–43.
Круглова Н.Н. Инновационная биотехнология андроклинной гаплоидии пшеницы на основе комплекса эмбриологических и цитофизиологических данных // Экобиотех. 2019. Т. 2. № 3. С. 234–245.
Круглова Н.Н. Каллусообразование и каллусогенез in vitro у злаков: роль гормонального баланса // Изв. Уфимского НЦ РАН. 2022. № 1. С. 52–59.
Круглова Н.Н., Батыгина Т.Б., Горбунова В.Ю. и др. Эмбриологические основы андроклинии пшеницы: атлас. М.: Наука, 2005. 99 с.
Круглова Н.Н., Сельдимирова О.А. Эмбриогенез in vivo засухоустойчивых регенерантов яровой мягкой пшеницы, полученных в эмбриокультуре in vitro // Таврич. вестн. агр. науки. 2022. № 1(29). С. 65–78.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е. Гистологический статус зародыша пшеницы в стадии органогенеза in vivo, оптимальной для получения морфогенного каллуса in vitro // Изв. Уфимского НЦ РАН. 2019а. № 1. С. 25–29.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Никонов В.И. Выявление относительной автономности in planta зиготических зародышей яровой мягкой пшеницы для оптимизации биотехнологических исследований // Изв. Уфимского НЦ РАН. 2018. № 3. С. 28–33.
Круглова Н.Н., Сельдимирова О.А., Зинатуллина А.Е., Никонов В.И. Выявление засухоустойчивых генотипов пшеницы в культуре незрелых зародышей in vitro // Вестник БГАУ. 2019б. Т. 52. № 4. С. 27–41.
Светлов П.Г. Теория критических периодов развития и ее значение для понимания принципов действия среды на онтогенез // Вопросы цитологии и общей физиологии. М.; Л.: АН СССР, 1960. С. 263–285.
Сельдимирова О.А., Галин И.Р., Круглова Н.Н. и др. Распределение ИУК и АБК в развивающихся зародышах пшеницы in vivo // Изв. Уфимского НЦ РАН. 2017. № 3. С. 114–118.
Терёхин Э.С. Семя и семенное размножение. СПб.: Мир и семья, 1996. 376 с.
Титова Г.Е. Проблема монокотилии с позиций данных эмбриологии растений // Тез. докл. Всеросс. науч. конф. с междунар. участием “Инновации и традиции в современной ботанике”. СПб.: БИН РАН, 2019. С. 106.
Цвелёв Н.Н. Проблемы теоретической морфологии и эволюции высших растений: сборник избранных трудов. М.; СПб.: Товарищество научных изданий КМК, 2005. 407 с.
Шамров И.И. Семязачаток цветковых растений: строение, функции, происхождение. М.: Товарищество научных изданий КМК, 2008. 350 с.
Шмальгаузен И.И. Организм как целое в индивидуальном и историческом развитии. М.: Наука, 1982. 383 с.
Эмбриология цветковых растений. Терминология и концепции. Т. 2: Семя / Ред. Батыгина Т.Б. СПб.: Мир и семья, 1997. 830 с.
Эмбриология цветковых растений. Терминология и концепции. Т. 3: Системы репродукции / Ред. Батыгина Т.Б. СПб.: Мир и семья, 2000. 639 с.
Ali M., Hasan H., Bux H. et al. Role of transcription factors in drought mediating pathways in wheat // Climate Change and Food Security with Emphasis on Wheat. Chapter 11 / Eds. Ozturk M., Gul A. Acad. Press, 2020. P. 177–192.
An L., Tao Y., Chen H. et al. Embryo-endosperm interaction and its agronomic relevance to rice quality // Front Plant Sci. 2020. V. 11. https://doi.org/10.3389/fpls.2020.587641
Armenta-Medina A., Gillmor C.S., Gao P. et al. Developmental and genomic architecture of plant embryogenesis: from model plant to crops // Plant Commun. 2020. V. 2. https://doi.org/10.1016/j.xplc.2020.100136
Baskin C., Baskin J. Relationship of the lateral embryo (in grasses) to other monocot embryos: a status up-grade // Seed Sci. Res. 2021. V. 31. P. 199–210.
Batygina T.B. Integrity and reliability system in ontogenesis and evolution // Int. J. Plant Reprod. Biol. 2012. V. 4. P. 107–120.
Batygina T.B., Osadtchiy J.V. Polyembryony: twins – the result of vegetative propagation // Int. J. Plant Reprod. Biol. 2013. V. 5. P. 21–27.
Batygina T.B., Vasilyeva V.E. Periodization of development of reproductive structures. Critical periods // Acta Biol. Cracov. Ser. Bot. 2003. V. 45. P. 27–36.
Bidabadi S.S., Jain S.M. Cellular, molecular, and physiological aspects of in vitro plant regeneration // Plants. 2020. V. 9. https://doi.org/10.3390/plants9060702
Chen H., Miao Y., Wang K., Bayer M. Zygotic embryogenesis in flowering plants // Methods Mol. Biol. 2021. Iss. 2288. P. 73–88.
Chen J., Lausser A., Dresselhaus T. Hormonal responses during early embryogenesis in maize // Biochem. Soc. Trans. 2014a. V. 42. P. 325–331.
Chen J., Strieder N., Krohn N.G. et al. Zygotic genome activation occurs shortly after fertilization in maize // Plant Cell. 2017. V. 29. P. 2106–2125.
Chen J., Zeng B., Zhang M. et al. Dynamic transcriptome landscape of maize embryo and endosperm development // Plant Physiol. 2014b. V. 166. P. 252–264.
Chiam N.C., Fujimura T., Sano R. et al. Nonsense-mediated mrna decay deficiency affects the auxin response and shoot regeneration in Arabidopsis // Plant Cell Physiol. 2019. V. 60. P. 2000–2014.
Christiaens F., Canher B., Lanssens F. et al. Pars pro toto: every single cell matters // Front. Plant Sci. 2021. V. 12. https://doi.org/10.3389/fpls.2021.656825
de Vries S.C., Weijers D. Plant embryogenesis // Curr. Biol. 2017. V. 27. P. 870–873.
Deushi R., Toda E., Koshimura S. et al. Effect of paternal genome excess on the developmental and gene expression profiles of polyspermic zygotes in rice // Plants. 2021. V. 10. https://doi.org/10.3390/plants10020255
Doll N.M., Just J., Brunaud V. et al. Transcriptomics at maize embryo/endosperm interfaces identifies a transcriptionally distinct endosperm subdomain adjacent to the embryo scutellum // Plant Cell. 2020. V. 32. P. 833–852.
Du X., Fang T., Liu Y., Huang L. et al. Transcriptome profiling predicts new genes to promote maize callus formation and transformation // Front Plant Sci. 2019. V. 10. https://doi.org/10.3389/fpls.2019.01633
Feher A. Callus, Dedifferentiation, Totipotency, somatic embryogenesis: what these terms mean in the era of molecular plant biology? // Front. Plant Sci. 2019. https://doi.org/10.3389/fpls.2019.00536
Fischer C., Speth V., Fleig-Eberenz S., Neuhaus G. Induction of zygotic polyembryos in wheat: influence of auxin polar transport // Plant Cell. 1997. V. 9. P. 1767–1780.
Fischer-Iglesias C., Sundberg B., Neuhaus G. et al. Auxin distribution and transport during embryonic pattern formation in wheat // Plant J. 2001. V. 26. P. 115–129.
Forestan C., Meda S., Varotto S. ZmPIN1-mediated auxin transport is related to cellular differentiation during maize embryogenesis and endosperm development // Plant Physiol. 2010. V. 152. P. 1373–1390.
Forestan C., Varotto S. The role of pin auxin efflux carriers in polar auxin transport and accumulation and their effect on shaping maize development // Mol. Plant. 2012. V. 5. P. 787–798.
Gao P., Quilichini T.D., Zhai C. et al. Alternative splicing dynamics and evolutionary divergence during embryogenesis in wheat species // Plant Biotech. J. 2021. V. 19. P. 1624–1643.
Gilbert S.F. Developmental biology. 11th ed. / Ed. Mayers R. 2018. URL: https://www.pdfdrive.com/developmental-biology-e188565455.html
Gordon-Camm B., Sardesai N., Arling M. et al. Using morphogenic genes to improve and regeneration of transgenic plants // Plants. 2019. V. 8. https://doi.org/10.3390/plants8020038
Gu W., Yu D., Guan Y. et al. The dynamic transcriptome of waxy maize (Zea mays L. sinensis Kulesh) during seed development // Genes Genom. 2020. V. 42. P. 997–1010.
Guo J., Gu X., Lu D. Multiomics analysis of kernel development in response to short-term heat stress at the grain formation stage in waxy maize // J. Exp. Bot. 2021. V. 72. P. 6291–6304.
Harnvanichvech Y., Gorelova V., Sprakel J., Weijers D. The Arabidopsis embryo as a quantifiable model for studying pattern formation // Quant. Plant Biol. 2021. V. 2. P. 1–13.
Hu Z., Xiong Q., Wang K. et al. Identification of a new giant emrbryo allele, and integrated transcriptomics and metabolomics analysis of giant embryo development in rice // Front. Plant. Sci. 2021. .https://doi.org/10.3389/fpls.2021.697889
Ibanez S., Carneros E., Testillano P.S., Perez-Perez J.M. Advances in plant regeneration: Shake, rattle and Roll // Plants. 2020. https://doi.org/10.3390/plants9070897
Ikeuchi M., Favero D.S., Sakamoto Y. et al. Molecular mechanisms of plant regeneration // Ann. Rev. Plant Biol. 2019. V. 70. P. 377–406.
Ishimoto K., Sohonahra S., Kishi-Kaboshi M. et al. Specification of basal region identity after asymmetric zygotic division requires mitogen-activated protein kinase 6 in rice // Development. 2019. V. 146. https://doi.org/10.1242/dev.176305
Itoh J.-I., Nonomura K.-I., Ikeda K. et al. Rice plant development: from zygote to spikelet // Plant Cell Physiol. 2005. V. 46. P. 23–47.
Johansen D.A. Plant Embryology. Waltham, MA: Chronica Botanica, 1950. 305 p.
Kandel S. Wheat responses, defence mechanisms and tolerance to drought stress: A review article // Int. J. Res. Appl. Sci. Biotechn. 2021. V. 8. https://doi.org/10.31033/ijrasb.8.5.14
Kao P., Schon M.A., Mosiolek M. et al. Gene expression variation in Arabidopsis embryos at single-nucleus resolution // Development. 2021. V. 148. https://doi.org/10.1242/dev.199589
Kruglova N.N., Titova G.E., Seldimirova O.A. Callusogenesis as a in vitro morphogenesiss pathway in cereals // Russ. J. Dev. Biol. 2018a. V. 49. P. 245–259.
Kruglova N.N., Seldimirova O.A., Zinatulina A.E. In vitro callus as a model system for the study of plant stress-resistance to abiotic factors (on the example of cereals) // Biol. Bull. Rev. 2018b. V. 8. P. 518–526.
Kruglova N.N., Seldimirova O.A., Zinatulina A.E. Structural features and hormonal regulation of the zygotic embryogenesis in cereals // Biol. Bull. Rev. 2020a. V. 10. P. 115–126.
Kruglova N.N., Titova G.E., Seldimirova O.A. et al. Embryo of flowering plants at the critical stage of embryogenesis relative autonomy (by example of cereals) // Russ. J. Dev. Biol. 2020b. V. 51. P. 1–15.
Kruglova N.N., Titova G.E., Seldimirova O.A., Zinatullina A.E. Cytophysiological features of the cereal-based experimental system “embryo in vivo – callus in vitro” // Russ. J. Dev. Biol. 2021. V. 52. P. 199–214.
Kruglova N.N., Zinatulina A.E. In vitro culture of autonomic embryos as a model system for the study of plant stress tolerance to abiotic factors (on the example of cereals) // Biol. Bull. Rev. 2022. V. 12. P. 201–211.
Landge A.N., Radhakrishnan D., Kareem A., Prasad K. Intermediate developmental phases during regeneration // Plant Cell Physiol. 2018. https://doi.org/10.1093/pcp/pcy011
Liu H., Xing M., Yang W. et al. Genome-wide identification of and functional insights into the late embryogenesis abundant (LEA) gene family in bread wheat (Triticum aestivum) // Sci. Rep. 2019. V. 9. https://doi.org/10.1038/s41598-019-49759-w
Liu Y., Zhang M., Meng Z. et al. Research progress on the roles of cytokinin in plant response to stress // Int. J. Mol. Sci. 2020. V. 21. https://doi.org/10.3390/ijms21186574
Lopez-Ruiz B.A., Juarez-Gonzalez V.T., Sandoval-Zapotitla E. et al. Development-related miRNA expression and target regulation during staggered in vitro plant regeneration of tuxpeno VS-535 maize cultivar // Int. J. Mol. Sci. 2019. V. 20. https://doi.org/10.3390/ijms20092079
Maleki M., Ghorbanpour M., Nikabadi S. et al. In Vitro Screening of Crop Plants for Abiotic Stress Tolerance / Ed. Wani S. Recent Approaches in Omics for Plant Resilience to Climate Change. Cham: Springer, 2019. P. 75–91.
Mao H., Li S., Chen B. et al. Variation in cis-regulation of a NAC transcription factor contributes to drought tolerance in wheat // Mol. Plant. 2021. https://doi.org/10.1016/j.molp.2021.11.007
Mimura M., Kudo T., Wu S. et al. Autonomous and non-autonomous functions of the maize Shohai1 gene, encoding a RWP-RK putative transcription factor, in regulation of embryo and endosperm development // Plant J. 2018. https://doi.org/10.1111/tpj.13996
Mizushima U., Murakami K., Hozyo Y. Influence of anomalous environmental conditions upon embryogenesis in the rice plant, Oryza sativa L. II. Abnormal development induced by chemical substances // Tohoku J. Agricult. Res. 1955. V. VI. P. 179–206.
Pabon-Mora N., Goldman M.H.S., Smyth D.R. et al. Molecular mechanisms of flowering plant reproduction // Front. Plant Sci. 2022. V. 12. https://doi.org/10.3389/fpls.2021.828136
Perez-Perez I., El-Tantawy A., Solis M.T. et al. Stress-induced microspore embryogenesis requires endogenous auxin synthesis and polar transport in barley // Front. Plant Sci. 2019. V. 10. https://doi.org/10.3389/fpls.2019.01200
Plant Embryo Culture: Methods and Protocols / Eds. Thorpe T.A., Yeung E.C. N.Y.; London; Dordrecht; Heidelberg: Springer, 2011. 377 p.
Plant Life under Changing Environment: Responses and Management / Ed. Tripathi D.K. Acad. Press (Elsevier), 2020. 1020 p.
Pykalo S., Demydov O., Yurchenko T. et al. Comparative assessment of methods for evaluation of drought tolerance in winter bread wheat varieties // ScienceRise: Biol. Sci. 2019. № 4(19). https://doi.org/10.15587/2519-8025.2019.186813
Radhakrishnan D., Kareem A., Durgaprasad K. et al. Shoot regeneration: a journey from acquisition of competence to completion // Curr. Opin. Plant Biol. 2018. V. 41. P. 23–31.
Radoeva T., Vaddepalli P., Zhang Z., Weijer D. Evolution, initiation, and diversity in early plant embryogenesis // Dev. Cell. 2019. V. 50. P. 533–543.
Raspor M., Motyka V., Kaleri A.R. et al. Integrating the roles for cytokinin and auxin in de novo shoot organogenesis: From hormone uptake to signaling outputs // Int. J. Mol. Sci. 2021. V. 2. https://doi.org/10.3390/ijms22168554
Richardson M. Heterochrony and the phylotypic period // Dev. Biol. 1995. V. 172. P. 412–421.
Seldimirova O.A., Bezrukova M V., Galin I.R. et al. 24-Epibrassinolide effect on in vitro callus tissue formation, growth, and regeneration in wheat varieties with contrasting drought resistance // Russ. J. Plant Physiol. 2017a. V. 64. P. 919–929.
Seldimirova O.A., Kruglova N.N., Titova G.E., Batygina T.B. Comparative ultrastructural analysis of the in vitro microspore embryoids and in vivo zygotic embryos of wheat as a basis for understanding of cytophysiological aspects of their development // Russ. J. Dev. Biol. 2017b. V. 48. P. 185–197.
Seldimirova O.A., Kudoyarova G.R., Katsuhara M. et al. Dynamics of the contents and distribution of ABA, auxins and aquaporins in developing caryopses of an ABA-deficient barley mutant and its parental cultivar // Seed Sci. Res. 2019. V. 29. P. 1–9.
Severtsova E.A., Severtsov A.S. Crucial stages of embryogenesis of R. arvalis: Part 1. Linear measurements of embryonic structures // Russ. J. Dev. Biol. 2011. V. 42. P. 331–341.
Severtsova E.A., Severtsov A.S. Crucial stages of embryogenesis of R. arvalis: Part 3. Modularity of developmental integrity // Russ. J. Dev. Biol. 2013. V. 44. P. 273–278.
Shen Y., Jiang Z., Yao X. et al. Genome expression profile analysis of the immature maize embryo during dedifferentiation // PLoS One. 2012. V. 7. https://doi.org/10.1371/journal.pone.0032237
Song J., Xie X., Cui Y., Zou J. Endosperm–embryo communications: Recent advances and perspectives // Plants. 2021. V. 10. https://doi.org/10.3390/plants10112511
Souèges R. Embryogenie des Graminees, Developpent de l’embryon chez le Poa annua L. // Compt. Rend. Held. Sea. Acad. Sci. 1924. V. 178. P. 1307–1310.
Souèges R. Exposes d’embryologie et de morphologie vègètales. X. Embryogènie et classification. Deuxieme fascicule: Essai d’un systeme embryogènique (Partie gènèrale) // Acta Sci. Industr. 1939. P. 1–85.
Sugimoto K., Temman H., Kadokura S., Matsunaga S. To regenerate or not to regenerate: factors that drive plant regeneration // Curr. Opin. Plant Biol. 2019. V. 47. P. 138–150.
Tai H., Opitz N., Lithio A. et al. Non-syntenic genes drive RTCS-dependent regulation of the embryo transcriptome during formation of seminal root primordia in maize (Zea mays L.) // J. Exp. Bot. 2017. V. 68. P. 403–414.
Tian R., Paul P., Joshi S. et al. Genetic activity during early plant embryogenesis // Biochem. J. 2020. V. 477. P. 3743–3767.
Titova G.E., Seldimirova O.A., Kruglova N.N. et al. Phenomenon of “Siamese embryos” in cereals in vivo and in vitro: Cleavage polyembryony and fasciations // Russ. J. Dev. Biol. Plant. 2016. V. 47. P. 122–137.
Vasilyeva V.E., Batygina T.B. Autonomy of the embryo // Embryology of Flowering Plants. Terminology and Concepts. V. 2. Seed. Science Publishers, Inc. Enfield, NH, USA, 2006. P. 375–382.
Wang Q., Wang M., Chen J. et al. ENB1 encodes a cellulose synthase 5 that directs synthesis of cell wall ingrowths in maize basal endosperm transfer cells // Plant Cell. 2022. V. 34. P. 1054–1074.
Wang Y., Yuan J., Wei X. et al. GhlBDs promote callus initiation and act as selectable markers to increase transformation efficiency // Front. Plant Sci. 2022a. V. 13. https://doi.org/10.3389/fpls.2022.861706
Wang Y., He S., Long Y. et al. Genetic variations in ZmSAUR15 contribute to the formation of immature embryo-derived embryonic calluses in maize // Plant J. 2022b. V. 109. P. 980–991.
Xiang D., Quilichini T.D., Liu Z. et al. The transcriptional landscape of polyploid wheats and their diploid ancestors during embryogenesis and grain development // Plant Cell. 2019. V. 31. P. 2888–2911.
Yadav B., Jogawat A., Rahman M.S. et al. Secondary metabolites in the drought stress tolerance of crop plants: A review // Gene Repts. 2021. V. 23. https://doi.org/10.1016/j.genrep.2021.101040
Yi F., Gu W., Chen J. et al. High temporal-resolution transcriptome landscape of early maize seed development // Plant Cell. 2019. V. 31. P. 974–992.
Yu K., Feng M., Yang G. et al. Changes in alternative splicing in response to domestication and polyploidization in wheat // Plant Physiol. 2020. V. 184. P. 1955–1968.
Yu Y., Zhu D., Ma C. et al. Transcriptome analysis reveals key differentially expressed genes involved in wheat grain development // Crop J. 2016. V. 4. P. 92–106.
Zheng Y. Molecular mechanisms of maize endosperm transfer cell development // Plant Cell Rep. 2021. https://doi.org/10.1007/s00299-021-02807-0
Zhao S., Jiang Q., Ma J. et al. Characterization and expression analysis of WOX5 genes from wheat and its relatives // Gene. 2014. V. 537. P. 63–69.
Дополнительные материалы отсутствуют.


