Онтогенез, 2022, T. 53, № 6, стр. 454-487
Эпителиально-мезенхимальный переход: молекулярные механизмы активации клеток ретинального пигментного эпителия
А. В. Кузнецова *
Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
* E-mail: avkuzn@list.ru
Поступила в редакцию 15.08.2022
После доработки 26.09.2022
Принята к публикации 03.10.2022
- EDN: NRBKHD
- DOI: 10.31857/S0475145022060052
Аннотация
Активированные клетки ретинального пигментного эпителия (РПЭ) человека являются основными эффекторными клетками в процессе фиброза, главного патологического проявления пролиферативных витреоретинальных заболеваний сетчатки. При регматогенной отслойке сетчатки покоящиеся клетки РПЭ активируются и приобретают фенотип фибробластоподобных и миофибробластоподобных клеток, которые усиленно пролиферируют и мигрируют в эпиретинальное пространство, где создают благоприятную микросреду для развития фиброза и/или способствуют его прогрессированию. Повышенная сократимость клеток в конечном итоге приводит к тракционной отслойке сетчатки и потере остроты зрения. На сегодняшний день выявлены различные клеточные сигналы, способствующие активации клеток РПЭ, такие как трансформирующий фактор роста бета, фактор роста фибробластов-2, тромбоцитарный фактор роста, митоген-активируемая протеинкиназа, Smads, NF-кВ и другие. Следовательно, изучение роли этих факторов и сигнальных путей в активации клеток РПЭ будет способствовать разработке терапевтических стратегий и предоставит новые возможности для терапии заболеваний сетчатки. В обзоре обобщены текущие знания о стимулирующих факторах и сигнальных путях в регуляции клеточных и молекулярных механизмов дедифференцировки и эпителиально-мезенхимального перехода (ЭМП) клеток РПЭ, которые в значительной степени были определены путем изучения эффектов различных сигнальных молекул in vitro. Кроме того, обсуждается роль микроРНК в регуляции сигнального пути TGF-β и ЭМП, а также рассматриваются перспективные терапевтические агенты.
ВВЕДЕНИЕ
Ретинальный пигментный эпителий (РПЭ) представляет собой монослой из сильнопигментированных поляризованных клеток, который располагается между фоторецепторами сетчатки и хориокапиллярами сосудистой оболочки глаза. Клетки окончательно дифференцированы и митотически неактивны из-за контактного ингибирования (Chen et al., 2012b). Апикальная поверхность клеток РПЭ плотно прилегает к наружным сегментам фоторецепторов и компонентам межфоторецепторного матрикса, что способствует сохранению тканевой организации (Finnemann, Chang, 2008). РПЭ выполняет ряд важных функций: посредством плотных контактов участвует в формировании гемато-ретинального барьера, участвует в транспортировке питательных веществ к фоторецепторам, регулировании гомеостаза ионов, pH и жидкости в субретинальном пространстве, поглощении световой энергии, удалении свободных радикалов и активных форм кислорода, регенерации зрительного хромофора 11-цис-ретиналя, фагоцитировании наружных сегментов фоторецепторов и секреции факторов роста (Strauss, 2005; Samuel et al., 2017).
Воздействие различных повреждающих факторов на задний отдел глаза приводит к активации покоящихся клеток РПЭ. Например, при пролиферативной витреоретинопатии (ПВР), такие повреждающие факторы, как травма глаза, кровоизлияние в стекловидное тело или внутриглазное воспаление способствуют разрыву и регматогенной отслойке сетчатки (Parapuram et al., 2009; Lei et al., 2010). В результате разрыва сетчатки клетки РПЭ подвергаются воздействию компонентов сыворотки крови: факторов роста, цитокинов и хемокинов. Физическое отделение нейронов сетчатки от РПЭ и/или воздействие различных внешних растворимых или связанных с мембраной факторов запускает в клетках РПЭ каскад реакций, задействованных в пролиферации, в том числе усиление активности внеклеточной сигнал регулируемой киназы (англ. extracellular-signal-regulated kinase, ERK) (Geller et al., 2001; Yasumuro et al., 2017). Клетки РПЭ сокращают свои поверхностные микроворсинки, ослабляют эпителиальные свойства, такие как апико-базальная полярность, ремоделируют соединительные комплексы и приобретают округлую форму (Sheridan et al., 2005). Коллапс микроворсинок РПЭ и перестройка протеогликанов межфоторецепторного матрикса являются ранними обратимыми ответами на регматогенное отслоение сетчатки (Finnemann, Chang, 2008).
Длительная отслойка сетчатки вызывает дегенерацию наружных сегментов фоторецепторов и, как следствие, апоптозную гибель фоторецепторов (Cook et al., 1995; Geller et al., 2001). Так, в течение 3 дней после отслойки сетчатки погибают примерно 20% фоторецепторов, к 28 дню – более 50% фоторецепторов; в результате гибели клеток высвобождаются ангиогенные и воспалительные факторы роста, которые привлекают больше иммунных клеток из хориоидальной сосудистой сети (Stepp, Menko, 2021). Стойкая отслойка сетчатки приводит к пролиферации мюллеровских глиальных клеток и клеток РПЭ. Клетки РПЭ теряют межклеточные контакты и апикально-базальную полярность, экспрессируют маркеры клеточного цикла, отделяются от мембраны Бруха, пролиферируют и образуют пласты клеток под сетчаткой, называемые субретинальными мембранами (Sheridan et al., 2005; Finnemann, Chang, 2008; Zou et al., 2020). В результате эпителиально-мезенхимального перехода (ЭМП) клетки РПЭ трансформируются в веретенообразные клетки, напоминающие фибробласты и макрофаги, которые мигрируют через дефект сетчатки, трансформируются в миофибробласты и аномально секретируют матриксные металлопротеиназы (англ. matrix metalloproteinases, MMPs), тканевые ингибиторы матриксных металлопротеиназ (англ. tissue inhibitor of matrix metalloproteases, TIMPs) и белки внеклеточного матрикса (ВКМ). Трансформированные клетки РПЭ наряду с ретинальной глией и истинными фибробластами на внутренней поверхности отслоенной сетчатки и внутри стекловидного тела образуют листы рубцовой ткани, известные как эпиретинальные мембраны (Sheridan et al., 2005; Zou et al., 2020). Факторы сыворотки крови из поврежденных и негерметичных кровеносных сосудов также высвобождаются в стекловидное тело (Stepp, Menko, 2021). Протеомное исследование 200 цитокинов и хемокинов в стекловидном теле пациентов с ПВР показало их превалирование у пациентов с ранней стадией (A, B) над поздней (С, D) (Roybal et al., 2018). Сокращение фиброзных периретинальных мембран приводит к тракционной отслойке сетчатки и потере остроты зрения (Chung et al., 2011; Huang et al., 2012; Zhu et al., 2013; Fuhrmann et al., 2014).
В патогенезе возрастной макулярной дегенерации (ВМД), основной причины необратимой центральной потери зрения среди пожилых людей, ключевую роль, как известно, играют воспалительные процессы и окислительный стресс (Ambati, Fowler, 2012; Ambati et al., 2013; Kauppinen et al., 2016). При воспалении, лимфоциты и макрофаги, инфильтрирующие заднюю часть глаза, секретируют провоспалительные цитокины, такие как TNFα, IL-1β и IFNγ, которые активируют сигнальные пути в клетках РПЭ, что приводит к дисфункции и гибели РПЭ (Kutty et al., 2016). Как показал транскриптомный (scRNA-seq) и протеомный анализ клеток РПЭ, полученных из индуцированных плюрипотентных стволовых клеток (iPSCs), у пациентов с географической атрофией, поздней стадией ВМД, выявляются нарушения в митохондриальных функциях, метаболических путях и реорганизации ВКМ (Senabouth et al., 2022). Клинические данные, свидетельствующие о том, что клетки РПЭ подвергаются ЭМП при ПВР и ВМД, обсуждены в обзоре Жоу и соавт. (Zhou et al., 2020).
Таким образом, ЭМП клеток РПЭ и функциональная дегенерация этих клеток способствуют развитию ряда заболеваний сетчатки (Friedlander, 2007; Kauppinen et al., 2016; Huang et al., 2017; Ghosh et al., 2018; Shu et al., 2020; Zou et al., 2020). Потенциальным методом лечения влажной формы ВМД на сегодняшний день является замена неблагополучного РПЭ здоровым эпителием. Некоторые исследования продемонстрировали успешное получение зрелых РПЭ из различных линий эмбриональных стволовых клеток (ESCs) и iPSCs человека (Schwartz et al., 2012; Luo, Chen, 2018; Kashani et al., 2018). Однако применение РПЭ для заместительной клеточной терапии в современных клинических подходах чревато его трансформацией в фибробластоподобные клетки, что является фактором риска развития ПВР (Kole et al., 2018). В связи с этим исследование механизмов активации, дедифференцировки и ЭМП клеток РПЭ приобретает первостепенное значение (Kole et al., 2018).
На сегодняшний день считается, что мастер-регулятором профибротических процессов на молекулярном уровне является трансформирующий фактор роста бета (англ. transforming growth factor beta, TGF-β) (Parapuram et al., 2009; Dvashi et al., 2015; Tosi et al., 2018b). TGF-β сверхэкспрессируется в стекловидном теле пациентов с пролиферативными витреоретинальными заболеваниями, а также обнаруживается в сократительных мембранах, в состав которых входят трансформированные клетки РПЭ (Connor et al., 1989; Baudouin et al., 1993; Kita et al., 2007a).
В отличие от TGF-β, действующего на фибробластоподобные клетки и стимулирующего их трансформацию в миофибробласты, белки семейства костных морфогенетических белков (англ. bone morphogenetic protein, BMP) стимулируют в мезенхимальных клетках мезенхимально-эпителиальный переход (МЭП) (Choudhary et al., 2015), необходимый для возвращения РПЭ в исходное стабильное состояние после пролиферации (Casco-Robles et al., 2016). При патологии баланс между ЭМП и обратным переходом может нарушаться за счет повышения уровня TGF-β, что приводит к развитию фиброзных нарушений. Таким образом, средства, способные ингибировать ЭМП клеток РПЭ, могут иметь большое терапевтическое значение для профилактики ПВР после отслойки сетчатки или активного развития хориоидальной неоваскуляризации (CNV) при влажной ВМД. Однако молекулярные механизмы, лежащие в основе запуска ЭМП, и важность TGF-β среди других различных факторов остаются неясными и их еще предстоит уточнить. В обзоре рассмотрена роль TGF-β/BMP и других сигнальных путей, включая путь фактора роста фибробластов-2 (англ. fibroblast growth factor-2, FGF2), Wnt и Notch в регуляции клеточных и молекулярных механизмов дедифференцировки и ЭМП клеток РПЭ, которые в значительной степени были определены путем изучения эффектов различных сигнальных молекул in vitro. Кроме того, обсуждается роль микроРНК в регуляции сигнального пути TGF-β и ЭМП, а также рассматриваются стратегии нацеливания на TGF-β сигнальный путь.
ПРИЗНАКИ ДЕДИФФЕРЕНЦИРОВКИ И ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОГО ПЕРЕХОДА В КЛЕТКАХ РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ IN VITRO
Моделирование ПВР in vitro может привести к пониманию развития ЭМП в клетках РПЭ, а также роли регуляторов транскрипции и сигнальных путей в этом процессе. Культуры клеток РПЭ дают широкие возможности для исследования механизмов патологических процессов in vivo и путей их регуляции на клеточном и молекулярном уровнях. Клетки РПЭ in vitro в зависимости от условий могут менять свой дифференцировочный статус, переходя из состояния эпителиальной дифференцировки в дедифференцированное состояние и обратно (Kuznetsova et al., 2014). В ряде исследований in vitro показано, что потеря межклеточного контакта в клетках РПЭ инициирует дедифференцировку: клетки теряют пигментацию, пролиферируют, теряют экспрессию эпителиальных маркеров и, наоборот, экспрессируют не характерные для РПЭ маркеры, что приводит к изменению фенотипа клеток (Vinores et al., 1993; Amemiya et al., 2004; Engelhardt et al., 2005; Kuznetsova et al., 2011; Milyushina et al., 2011; Chung et al., 2011; Salero et al., 2012; Fuhrmann et al., 2014; Chiba, 2014).
В преконфлюэнтных клетках РПЭ in vitro под влиянием различных компонентов сывороточной среды снижается экспрессия таких эпителиальных маркеров, как E-кадгерина, zonula occludens 1 (ZO-1), окклюдина и цитокератинов, а также снижается экспрессия специфических генов РПЭ (например, RPE65, RLBP1 (CRALBP), BEST1, MITF, OTX2) (Salero et al., 2012) и повышается уровень мезенхимальных маркеров, таких как виментин, N-кадгерин, фибронектин, коллаген I типа, MMP2, MMP9, ламинин, что характерно для развития ЭМП (Mitsuhiro et al., 2003; Lee et al., 2008; Li et al., 2011).
Помимо экспрессии мезенхимальных маркеров, клетки РПЭ in vitro экспрессируют нейральные/ретинальные маркеры, например, нестин, βIII-тубулин (кодируется геном TUBB3), ассоциированный с микротрубочками белок 1В (англ. microtubule associated protein 1B, MAP1B), MAP5, нейрофиламенты 200 кДа (англ. 200-kDa neurofilaments, NF200), Hes1, Musashi, глиальный фибриллярный кислый белок (англ. glial fibrillary acidic protein, GFAP), PAX6 (Vinores et al., 1993; Amemiya et al., 2004; Engelhardt et al., 2005; Kuznetsova et al., 2011; Milyushina et al., 2011; Chung et al., 2011; Salero et al., 2012). Эти нейральные/ретинальные маркеры отсутствуют в нормальных клетках РПЭ in situ (Vinores et al., 1993; Katsetos et al., 2003; Martínez-Morales et al., 2004; Osumi et al., 2008).
К сожалению, очень мало известно об экспрессии нейральных/ретинальных маркеров клетками РПЭ при патологических состояниях in vivo. Только в одном исследовании сообщается об экспрессии βIII-тубулина, белка микротрубочек, в патологических клетках РПЭ, обнаруживаемых в идиопатических эпиретинальных мембранах и эпиретинальных мембранах при ПВР и пролиферативной диабетической ретинопатии (ПДР) (Vinores et al., 1995). Однако нейральные маркеры иногда обнаруживают и в некоторых других ненейрональных тканях, включая семенники, плаценту, тонкий и толстый кишечник (Person et al., 2017). Так, например, сверхэкспрессия βIII-тубулина показана при широком спектре видов рака, а именно при раке легких, аденокарциноме поджелудочной железы, почечно-клеточном раке и злокачественной меланоме, что связано с плохим ответом на противоопухолевые препараты, нацеленные на связывание β-тубулина, изменение динамики микротрубочек и блокирование клеточного деления (Person et al., 2017). Кроме того, экспрессия нестина выявлена в клетках макроглии (клетках Мюллера) на модели дегенеративного заболевания сетчатки у мышей (Moon et al., 2017a).
В то же время, индукторами нейрональной дифференцировки считаются ретиноевая кислота (англ. retinoic acid, RA), продукт метаболизма витамина А, и FGF2, хотя их пути в нейрогенезе являются взаимно ингибирующими (del Corral et al., 2003). В связи с этим FGF2, RA и другие ретиноиды рассматриваются некоторыми исследователями в качестве стимуляторов трансдифференцировки РПЭ в нейроноподобные клетки (Opas, Dziak, 1994; Carr et al., 2011; Khera et al., 2012). Например, обработка клеток ARPE-19, широко используемой клеточной линии РПЭ взрослого человека, фенретинидом (англ. Fenretinide), синтетическим производным витамина А, изменяла морфологию клеток. Изменения заключались в появлении нейроноподобных отростков и сопровождались подавлением экспрессии РПЭ-специфических генов (OTX2 и MITF) и повышением экспрессии нейрональных/ретинальных маркеров (кальбиндина и кальретинина) (Lueck et al., 2017; Lueck et al., 2020). Однако такое лечение на самом деле не превращает клетки РПЭ в нейроны (Khera et al., 2012). Экспрессия в клетках РПЭ нейральных/ретинальных маркеров и потеря РПЭ-специфичных маркеров скорее подразумевает, что в культуре клетки РПЭ, имеющие нейроэпителиальное происхождение, предрасположены к ретинальному состоянию, подобному предшественникам (Carr et al., 2011) и, по всей видимости, свидетельствует о перестройке цитоскелета и дедифференцировке этих клеток. Кроме того, in vitro клетки РПЭ не теряют полностью свои эпителиальные признаки. Эта предполагаемая пластичность свидетельствует о задержке клеток РПЭ на промежуточных стадиях и частичном ЭМП, что наблюдается во время эмбрионального развития, заживлении ран и раке (Nieto et al., 2016; Zhou et al., 2020).
TGF-β/BMP СИГНАЛЬНЫЙ ПУТЬ
Суперсемейство TGF-β у млекопитающих объединяет четыре семейства близких по структуре сигнальных белков: TGF-β, BMP, семейство факторов роста и дифференцировки (англ. growth/differentiation factors, GDFs) и семейство активинов и ингибинов, всего более 30 членов (Yang et al., 2014; Tosi et al., 2018b).
В семействе BMP, основываясь на гомологии последовательностей и известных функциях, выделяют четыре подгруппы: BMP2/4, BMP5/6/7/8a/8b, BMP9/10 и BMP12/13/14. Всего в семействе BMP у человека идентифицировано 20 членов (Bragdon et al., 2011). BMP1, хотя и назван костным морфогенетическим белком, в семейство BMPs не входит. О BMP1 (другое название С-протеиназа проколлагена) известно, что он расщепляет проколлагены и индуцирует накопление ВКМ. Кроме того, BMP1 может быть активатором BMPs, поскольку он высвобождает активные BMPs из неактивных комплексов путем расщепления Chordin, антагониста BMPs. BMP1 также расщепляет латентный белок, связывающий TGF-β, что приводит к последующей активации латентного TGF-β металлопротеиназами, например, MMP2 (Miyazono, Shimanuki, 2008; Yang et al., 2014).
В семействе TGF-β у млекопитающих описано три изоформы: TGF-β1, 2, 3 (Tosi et al., 2018b). Вновь синтезированный TGF-β секретируется из клеток в виде неактивного комплекса, называемым большим латентным комплексом (англ. large latent complex, LLC), что предотвращает связывание TGF-β с его рецепторами. Большой латентный комплекс, помимо самого TGF-β, содержит latency associated peptide (LAP) и latent TGF-β-binding protein (LTBP). Выделение активного TGF-β из латентной формы происходит при активации. Активаторами латентного TGF-β являются изменение pH среды (закисление или защелачивание), кислоты (соляная кислота), активные формы кислорода, протеазы (плазмин, MMP2, MMP9), αV интегрины клеточной поверхности и адгезивные гликопротеины (тромбоспондин-1, англ. thrombospondin-1) (Robertson, Rifkin, 2016).
Различные формы (латентная, активная) и изоформы TGF-β1, 2, 3 обнаруживаются в норме в разных структурах заднего сегмента глаза. При этом их распределение неоднородно (Lutty et al., 1993; Anderson et al., 1995; Tosi et al., 2018b; Tosi et al., 2018a). TGF-β1 выявлен в наружных сегментах фоторецепторов, ганглиозных клетках, микроглии, эндотелии хориокапилляров, гладкомышечных клетках и перицитах поверхностных кровеносных сосудов сетчатки и гиалоцитах стекловидного тела (Anderson et al., 1995; Tosi et al., 2018b). TGF-β2 локализуется в клетках РПЭ (вблизи латеральных границ), наружном сегменте фоторецепторов, микроглии, соединительной ткани крупных сосудов хориоидеи, строме хориоидеи, гладкомышечных клетках и перицитах поверхностных сосудов сетчатки и гиалоцитах стекловидного тела. TGF-β3 обнаружен в клетках РПЭ (апикально), митохондриях фоторецепторов, микроглии, клетках Мюллера, гиалоцитах стекловидного тела и хориоидальных гистиоцитах (Anderson et al., 1995; Tosi et al., 2018b).
Только во внутриглазной жидкости и гиалоцитах стекловидного тела идентифицированы все три изоформы TGF-β (табл. 1) с преобладанием как активной, так и латентной TGF-β2 изоформы (Lutty et al., 1993; Tosi et al., 2018a). Около 87% витреального TGF-β находится в латентной форме, при этом витреальный TGF-β1 определяется только в латентной форме (Tosi et al., 2018b). Отсутствие TGF-β2, но не TGF-β1 или TGF-β3, нарушает морфогенез эмбриональных глаз у мышей, что определяет превалирующую роль TGF-β2 в глазе (Sanford et al., 1997).
Таблица 1.
Определение различных факторов в образцах стекловидного тела (аспиратах) и срезах криоконсервированных задних сегментов глаз
| Фактор | Название | Полное название | Метод определения | Заболевание сетчатки | Ссылка |
|---|---|---|---|---|---|
| Фактор роста | TGF-β1 | Трансформирующий фактор роста-бета 1 (англ. transforming growth factor beta 1) | Радиорецепторный анализ | Отслойка сетчатки (ОС); пролиферативная витреоретинопатия (ПВР) | (Connor et al., 1989) |
| Иммуногистохимия (ИГХ) | Глаза из глазного банка | (Lutty et al., 1993) | |||
| ИГХ | ПВР | (Baudouin et al., 1993) | |||
| TGF-β2 | Transforming growth factor beta 2 | Радиорецепторный анализ | Отслойка сетчатки (ОС); пролиферативная витреоретинопатия (ПВР) | (Connor et al., 1989) | |
| Иммуноферментный анализ (ИФА) | ОС; ПВР; пролиферативная диабетическая ретинопатия (ПДР) | (Kita et al., 2007a) | |||
| ИГХ | Глаза из глазного банка | (Lutty et al., 1993) | |||
| TGF-β3 | Transforming growth factor beta 3 | ИГХ | Глаза из глазного банка | (Lutty et al., 1993) | |
| FGF | Фактор роста фибробластов (англ. fibroblast growth factor) | Мультиплексный анализ с использованием магнитных бусин (англ. multiplex bead analysis) | ПВР | (Banerjee et al., 2007) | |
| FGF1 | Фактор роста фибробластов-1 (англ. fibroblast growth factor-1) | ИГХ | ПВР | (Baudouin et al., 1993) | |
| FGF2 | Фактор роста фибробластов-2 (англ. fibroblast growth factor-2) | ИФА | ОС; ПВР | (La Heij et al., 2002) | |
| EGF | Эпидермальный фактор роста (англ. epidermal growth factor) | ИГХ | ПВР | (Baudouin et al., 1993) | |
| IGF-1 | Инсулиноподобный фактор роста 1 (англ. insulin-like growth factor 1) | ИГХ | ПВР | (Baudouin et al., 1993) | |
| Анализ нейтрализации (англ. neutralization assay) | ОС; ПВР стадии A, B и C | (Hardwick et al., 1997) | |||
| PDGF | Тромбоцитарный фактор роста (англ. platelet-derived growth factor) | Анализ нейтрализации | ОС; ПВР стадии A, B и C | (Hardwick et al., 1997) | |
| HGF | Фактор роста гепатоцитов (англ. hepatocyte growth factor) | ИФА | ПДР | (Katsura et al., 1998) | |
| Фактор роста | CTGF | Фактор роста соединительной ткани (англ. connective tissue growth factor) | ИФА | ОС; ПВР; ПДР | (Kita et al., 2007a) |
| VEGF | Фактора роста эндотелия сосудов (англ. vascular endothelial growth factor) | ИФА | ПДР | (Katsura et al., 1998) | |
| ИФА | ПДР | (Hernández et al., 2001) | |||
| Мультиплексный анализ с использованием магнитных бусин | ПВР; ПДР | (Banerjee et al., 2007) | |||
| ИФА | ОС, ПВР; ПДР | (Kita et al., 2007b) | |||
| Цитокин | TNFα | Фактор некроза опухоли альфа (англ. tumor necrosis factor alpha) | RT-PCR; ИФА | ПВР | (El-Ghrably et al., 2001) |
| Мультиплексный анализ с использованием магнитных бусин | ПВР | (Banerjee et al., 2007) | |||
| IL-1α, IL-1β |
Интерлейкин 1 (англ. interleukin 1) | RT-PCR; ИФА | ПВР | (El-Ghrably et al., 2001) | |
| IL-6 | Интерлейкин 6 (англ. interleukin 6) | RT-PCR; ИФА | ПВР | (El-Ghrably et al., 2001) | |
| ИФА | ОС; ПВР | (La Heij et al., 2002) | |||
| Мультиплексный анализ с использованием магнитных бусин | ПВР; ПДР | (Banerjee et al., 2007) | |||
| IL-10 | Интерлейкин 10 (англ. interleukin 10) | Мультиплексный анализ с использованием магнитных бусин | ПВР | (Banerjee et al., 2007) | |
| IL-12 | Интерлейкин 12 (англ. interleukin 12) | Мультиплексный анализ с использованием магнитных бусин | ПВР; ПДР | ||
| Цитокин | IFNγ | Интерферон гамма (англ. interferon γ) | RT-PCR; ИФА | ПВР | (El-Ghrably et al., 2001) |
| Мультиплексный анализ с использованием магнитных бусин | ПВР | (Banerjee et al., 2007) | |||
| G-CSF | Гранулоцитарный колониестимулирующий фактор (англ. granulocyte-stimulating factor) | Мультиплексный анализ с использованием магнитных бусин | ПВР | (Banerjee et al., 2007) | |
| Хемокин | CXCL8 (также известный как IL-8) | C-X-C Motif Chemokine Ligand 8 (Interleukin 8) | RT-PCR; ИФА | ПВР | (El-Ghrably et al., 2001) |
| Мультиплексный анализ с использованием магнитных бусин | ПВР; ПДР | (Banerjee et al., 2007) | |||
| CCL2 (также известный как MCP-1) | C-C motif ligand 2 (Monocyte chemotactic protein 1) | Мультиплексный анализ с использованием магнитных бусин | ПВР; ПДР | (Banerjee et al., 2007) | |
| CCL4 (также известный как MIP-1β) | C-C motif ligand 4 (Macrophage inflammatory protein 1 beta) | Мультиплексный анализ с использованием магнитных бусин | |||
| CCL5 (также известный как RANTES) | C-C motif ligand 5 | Мультиплексный анализ с использованием магнитных бусин | ПДР | (Banerjee et al., 2007) | |
| miRNAs | miR21 | – | MicroRNA array | ПВР; ПДР | (Usui-Ouchi et al., 2016) |
| Другое | VCAM1 | Vascular cell adhesion molecule 1 | ИФА | ПДР | (Hernández et al., 2001) |
| GS | Глутаминсинтетаза (англ. glutamine synthetase) | ИФА | ОС; ПВР | (La Heij et al., 2002) |
In vitro в нетрансформированных клетках РПЭ взрослого человека также, как и во внутриглазной жидкости и стекловидном теле, показана преобладающая экспрессия TGF-β2 над TGF-β1 и TGF-β3, тогда как в SV40-трансформированных фетальных клетках РПЭ человека – превалирующая экспрессия TGF-β1 над TGF-β3 при отсутствии экспрессии TGF-β2 (Kvanta, 1994). Кроме того, показано, что экспрессия и секреция TGF-β в клетках РПЭ регулируется наличием или отсутствием экзогенных факторов, а также пролиферативной активностью самих клеток РПЭ. При снижении пролиферации и увеличении количества дормантных клеток РПЭ отмечается увеличение уровня секреции TGF-β (Kvanta, 1994).
Белки семейств TGF-β и BMP активируют сходный нисходящий канонический Small mother against decapentaplegic (Smad) и неканонические сигнальные пути.
Канонический TGF-β сигнальный путь/TGF-β/Smad-зависимый сигнальный путь
Каждый лиганд семейства TGF-β связывается со специфической парой рецепторных серин/треонин протеинкиназ, принадлежащих к рецепторам I и II типа, оба из которых необходимы для трансдукции сигнала (рис. 1). Так факторы роста TGF-β связываются с TGFβR-I (другое название activin receptor-like kinase 5, ALK5) и TGFβR-II, а белки семейства BMP – с BMPR-I (BMPR-IА/ALK3, BMPR-IB/ALK6) и BMPR-II рецепторами. Соединение лиганда с рецептором II типа приводит к связыванию рецепторов I и II типа. В этом комплексе рецептор II типа вызывает фосфорилирование и активацию рецептора I типа. Рецептор I типа затем фосфорилирует рецептор-активируемые белки Smads: Smad2 и Smad3 в TGF-β сигнальном пути и Smad1, Smad5 и Smad8 в BMP сигнальном пути (Mitsuhiro et al., 2003; Xu et al., 2009). Фосфорилированные рецепторные белки Smads формируют гетеромерные комплексы с общим белком Smad4, и транслоцируются в ядро, где они взаимодействуют с ДНК-связанными транскрипционными факторами семейств SNAIL, zinc finger E-box-binding homeobox (ZEB) и basic helix-loop-helix (bHLH), которые регулируют ЭМП, активируя экспрессию генов мезенхимальной дифференцировки и подавляя экспрессию генов эпителиальной дифференцировки. ZEB1 и ZEB2 (также известный как SIP1) являются критическими транскрипционными факторами, репрессирующими экспрессию эпителиальных генов для запуска ЭМП. Показано, что избыточная экспрессия ZEB1 в первичных культурах РПЭ мыши приводит к ЭМП (Liu et al., 2010).
Рис. 1.
miRNAs в регуляции TGF-β сигнальных путей и контроле ЭМП при пролиферативных витреоретинальных заболеваниях. ЭМП – эпителиально-мезенхимальный переход; ALK5 – активин рецептор-подобная киназа 5 (англ. activin receptor-like kinase 5, другое название – TGF-β рецептор I типа, англ. TGFβR-I – TGF-β-receptor I); JNK – c-Jun N-терминальная киназа (англ. c-Jun N-terminal kinase); MEK или MKK – другие названия MAPK kinase; PI3K – фосфоинозитид-3-киназа (англ. phosphoinositide 3-kinases); P указывает на фосфорилирование. См. текст для других сокращений.
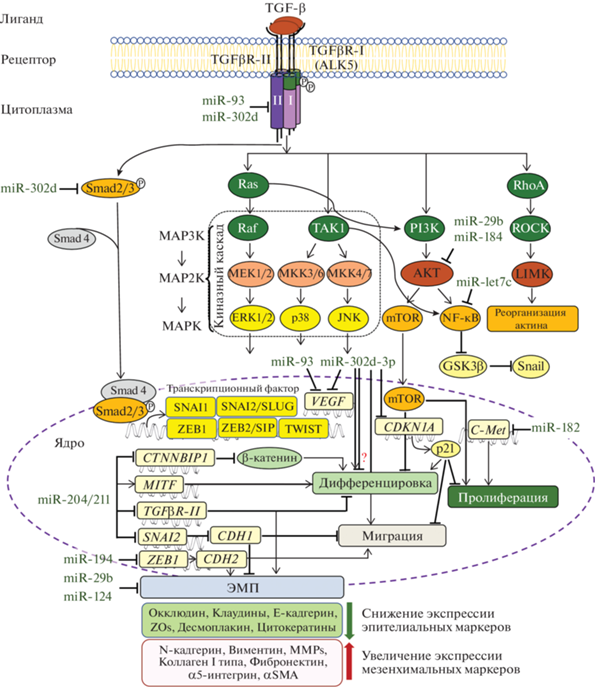
Сигнальные белки семейства TGF-β оказывают регуляторное влияние на ЭМП и могут обратить этот процесс вспять во время эмбрионального развития и нормального заживления ран. Однако повышение уровня TGF-β приводит к нарушению баланса между ЭМП и обратным переходом при патологических состояниях, таких как хроническое воспаление, что приводит к развитию фиброзных нарушений (Xu et al., 2009).
TGF-β и его посредник фактор роста соединительной ткани (англ. connective tissue growth factor, CTGF) – индукторы синтеза и аккумуляции белков ВКМ (фибронектина, ламинина, коллагена I типа) – являются ключевыми медиаторами в развитии ПВР и в трансформации РПЭ в фибробластоподобные клетки in vitro (Grisanti, Guidry, 1995; Zhu et al., 2013). При ПВР в аспиратах стекловидного тела с интраокулярным фиброзом содержится более чем в три раза больше TGF-β по сравнению с неосложненными формами отслоения сетчатки без интраокулярного фиброза (Connor et al., 1989). Кроме того, при ПВР в эпиретинальных мембранах наблюдается активация экспрессии Snail (SNAI1) (Li et al., 2011).
Обработка клеток РПЭ взрослого человека ранних пассажей стекловидным телом приводит к увеличение экспрессии мезенхимальных маркеров, а именно фибронектина и альфа-гладкомышечного актина (англ. alpha-smooth muscle actin, αSMA) (Huang et al., 2012). Воздействие TGF-β1 и CTGF на клетки ARPE-19 способствует схожим изменениям. В клетках увеличивается экспрессия таких компонентов ВКМ, как фибронектина, ламинина, MMP2 и коллагена I типа, что сопровождается снижением экспрессии E-кадгерина и ZO-1, а также усилением экспрессии Snail, как мРНК, так и белка. В самих клетках при этом происходит реорганизация цитоскелета: клетки экспрессируют αSMA и приобретают мезенхимальный фенотип (Lee et al., 2008; Li et al., 2011; Zhu et al., 2013). Подавление Snail значительно ослабляет TGF-β1-индуцированный ЭМП, что выражается в уменьшении экспрессии мезенхимальных маркеров (фибронектина, αSMA) и повышением эпителиальных маркеров (E-кадгерина, ZO-1) (Li et al., 2011).
TGF-β и активин А, кроме реорганизации цитоскелета, стимулируют миграцию клеток линии РПЭ человека D407 (линия получена из глазного яблока 12-летнего ребенка), которая происходит через TGF-β/Smad-зависимый сигнальный путь (Mitsuhiro et al., 2003). Нокдаун Snail приводит к эффективному подавлению миграции клеток ARPE-19 (Li et al., 2011). Таким образом, Snail также как и ZEB1 играет важную роль в TGF-β1-индуцированном ЭМП клеток РПЭ человека и может способствовать развитию ПВР. Специфическое ингибирование Snail может обеспечить новый подход к лечению и предотвращению ПВР.
Во многих работах, выполненных на нокаутных животных, показана существенная роль белков семейства BMP, в частности BMP4 и 7, в морфогенезе глаза (Dudley et al., 1995; Luo et al., 1995; Furuta, Hogan, 1998) и специализации РПЭ (Wordinger, Clark, 2007; Müller et al., 2007). Более подробно механизм передачи сигналов белков семейства BMP – от регуляции секреции, локализации и активации рецепторов до влияния на передачу сигналов – описан в обзоре Брэгдон и соавт. (Bragdon et al., 2011). Однако информации о роли белков BMP и его рецепторах во взрослом РПЭ в норме и патологии существует мало. Матхура и соавт. впервые определили экспрессию мРНК BMP4 и BMPR-II в свежевыделенных клетках РПЭ, в первичных культурах взрослого человека и постоянной линии ARPE-19 (Mathura et al., 2000). Авторами показано также, что экзогенное добавление BMP4 и BMP2 к культивируемым клеткам РПЭ ингибирует их пролиферацию. В последующих работах выявлено, что BMP4 дифференциально экспрессируется в макулярной области РПЭ пациентов с сухой и влажной ВМД, что зависит от микроокружения (Xu et al., 2011). Так при сухой форме ВМД отмечается увеличение экспрессии BMP4, а при влажной – снижение или даже отсутствие белка на иммуногистохимическом уровне в хирургически удаленных хориваскулярных мембранах (Zhu et al., 2009a). При сухой форме ВМД, по мнению авторов, ВМР4 опосредует окислительный стресс-индуцированное старение РПЭ и отвечает за повышенное содержание в них белка p53 (Zhu et al., 2009b). При влажной ВМД, как показано на модели CNV, вызванной лазерным повреждением сетчатки у мышей, уровень BMP4 обратно коррелирует с уровнем основного плейотропного воспалительного цитокина TNFα (Xu et al., 2011). Данный факт указывает на то, что TNFα ингибирует экспрессию BMP4 в клетках РПЭ во время активного развития CNV. Кроме того, добавление TNFα значительно снижало экспрессию BMP4 в культивируемых фетальных клетках РПЭ человека, ARPE-19 и клетках РПЭ в эксплантатах задней чаши глаза мыши (Xu et al., 2011). Таким образом, механизм подавления BMP4, выявленный Сюй и соавт., может быть полезным для определения новых мишеней для лечения ВМД.
Важную роль BMP белков в подавлении фиброза при ПВР показывают работы с использованием их антагонистов. Так, гремлин (англ. gremlin), один из антагонистов BMP белков, способствовал ЭМП в клетках ARPE-19, на что указывает повышение экспрессии αSMA и активности MMP2, подавление экспрессии ZO-1 и повышенная миграционная способность клеток (Lee et al., 2007). В дополнение к этому, недавние исследования демонстрируют важную роль BMP4 и ВМР7 в подавлении фиброза при ПВР (Yao et al., 2016, 2019). Так, добавление экзогенных BMP4 и BMP7 к первичным клеткам РПЭ ингибировало TGF-β-индуцированное подавление эпителиальных маркеров (ZO-1, Е-кадгерина (кодируется геном CDH1)), а также активацию мезенхимальных маркеров (фибронектин, αSMA) как на уровне мРНК, так и на уровне белка. Кроме того, обработка BMP4 ослабляла вызванное TGF-β сокращение коллагенового геля, миграцию клеток и фосфорилирование Smad2/3. Напротив, нокдаун эндогенного BMP4 стимулировал изменения в маркерах ЭМП (Yao et al., 2016, 2019). Результаты Яо и соавт. свидетельствуют о том, что BMP4 и ВМР7 могут ингибировать TGF-β-опосредованный ЭМП в клетках РПЭ и, таким образом, их можно рассматривать в качестве потенциальных терапевтических агентов для лечения ПВР.
Неканонические TGF-β сигнальные пути
Помимо канонического TGF-β/Smad-зависимого сигнального пути выделяют также Smad-независимые сигнальные каскады, которые активируются в ответ на TGF-β (рис. 1).
Сигнальные каскады митоген-активируемой протеинкиназы (англ. mitogen-activated protein kinase, MAPK). На сегодняшний день у млекопитающих идентифицировано 14 членов MAPK, которые разделены на 7 подгрупп. Выделяют четыре обычные подгруппы MAPK (ERK1/2, c-Jun N‑terminal kinase (JNK), p38 MAPK и ERK5), работающие в типичном трехуровневом модуле с двойным фосфорилированием, и три атипичных подгруппы MAPK (ERK3/4, ERK7/8 и nemo-like kinase (NLK)), которые не следуют классической трехуровневой сигнальной структуре с двойным фосфорилированием (Yue, López, 2020). МАРК играют ключевую роль в преобразовании внеклеточных стимулов в широкий спектр клеточных ответов, включая рост, миграцию, пролиферацию, дифференцировку и апоптоз клеток (Nishimoto, Nishida, 2006). В зависимости от типа клеток и стимула МАРК могут действовать как активаторы или ингибиторы клеточных ответов (Yue, López, 2020).
ERK1/2 каскады стимулируются в основном факторами роста, тогда как JNK и p38 MAPK активируются наиболее заметно после воздействия на клетки факторов (физических, химических и биологических), вызывающих стресс. Активируемые стрессом JNK и p38 MAPK играют ключевую роль в балансировании выживания и гибели клеток.
MAPK/ERK сигнальный каскад наиболее изучен среди MAPK каскадов. На клеточной культуре РПЭ мыши показано, что TGF-β активирует белок Ras (Chung et al., 2011), который участвует в различных MAPK каскадах передачи информации от рецепторов плазматической мембраны к ядерным факторам транскрипции (рис. 1). В клетках РПЭ в течении ЭМП ERK1/2 сигнальный путь может перекрестно взаимодействовать с каноническим TGF-β/Smad и Jagged/Notch путями. Так, в клетках ARPE-19 инактивация ERK1/2 с помощью U0126, низкомолекулярного ингибитора фосфорилирования MEK1/2 (mitogen extracellular signal regulated kinases 1/2), предотвращала TGF-β2-индуцированное подавление P-кадгерина и активацию αSMA, коллагена IV типа, N-кадгерина и фибронектина путем ингибирования как канонического TGF-β2/Smad, так и Jagged/Notch сигнальных путей. Кроме того, блокада Notch пути специфическим ингибитором DAPT подавляла индуцированную TGF-β2 активацию пути ERK1/2 (Chen et al., 2014a). В другом исследовании, напротив, активация ERK1/2 сигнального пути с помощью кемпферола (англ. kaempferol), флавоноида с противораковой и антиметастатической активностью, ингибировала экспрессию белка MMP2 и миграцию клеток ARPE-19 (Chien et al., 2019).
Ras-ERK сигнальный путь, помимо индукции мезенхимальной дифференцировки, может участвовать в регуляции нейрональной дифференцировки клеток РПЭ (Chung et al., 2011). При добавлении TGF-β в среду культивирования клеток РПЭ мыши в последних отмечено усиление экспрессия нейрон-ассоциированных генов, в частности TUBB3 (Chung et al., 2011). В то время как, при предобработке клеток U0126 эффективно блокировалось TGF-β-вызванное фосфорилирование ERK и значительно уменьшалась экспрессия TUBB3. Данный факт указывает на то, что TGF-β стимулирует экспрессию TUBB3 через активацию MAPK/ERK сигнального пути. Результаты работы этих авторов согласуются с данными литературы, свидетельствующими об участии MAPK/ERK сигнального пути в трансдифференцировке РПЭ в нейральную сетчатку у куриного эмбриона (Galy et al., 2002). Так в сетчатке куриного эмбриона in ovo эктопическая экспрессия аллели MEK1 (MEKDD), непосредственного активатора ERK в MAPK сигнальном пути, вызывала трансдифференцировку РПЭ в клетки подобные нейроэпителиальному слою сетчатки, что коррелировало c ингибированием экспрессии Mitf в презумптивном РПЭ (Galy et al., 2002). Следовательно, TGF-β через активацию MAPK/ERK сигнального каскада индуцирует и нейрональную и мезенхимальную дифференцировку клеток РПЭ, т.е. их дедифференцировку и ЭМП.
Известно, что в регуляции JNK и p38 MAPK сигнальных каскадов участвует член семейства MAPK киназ-киназ – TGF-β-активированная киназа 1 (англ. TGF-β-activated kinase 1, TAK1, альтернативное имя МАPK kinase kinase 7, MAP3K7) (рис. 1).
В ряде работ, выполненных на линейных клетках РПЭ человека, выявлено участие протеинкиназы p38 MAPK в ЭМП (Saika et al., 2005; Dvashi et al., 2015). Так, использование 5Z-7-оксозеенола, ингибитора TAK1, предотвращало развитие признаков ЭМП, вызванных стимуляцией TGF-β1: миграцию клеток, увеличение экспрессии αSMA и сократительной способности клеток ARPE-19 (Dvashi et al., 2015). В другой работе ингибирование p38 MAPK специфическим ингибитором SB202190 препятствовало стимулирующему действию экзогенного TGF-β2 на миграцию клеток ARPE-19 и на продукцию компонентов ВКМ, такие как коллаген I типа и фибронектин (Saika et al., 2005).
PI3K/AKT/mTOR сигнальный путь. Доказательства того, что TGF-β активирует не только MAPK, но и фосфоинозитид-3-киназный (англ. phosphoinositide 3-kinase, PI3K) сигнальный каскад (рис. 1) находятся в работах Ли и соавт. (Lee et al., 2008) и Хуанг и соавт. (Huang et al., 2012). Они свидетельствуют об увеличение фосфорилирования не только ERK1/2, но и нижестоящей мишени PI3K – AKT (протеинкиназа В, кодируемая AKT), после воздействия TGF-β1 на клетки РПЭ человека. Нижестоящей мишенью AKT является белок механическая мишень рапамицина (англ. mechanistic (formerly “mammalian”) target of rapamycin, mTOR), который регулирует трансляцию многих белков, в том числе тех, которые связаны с ростом клетки и ее размножением. mTOR представляет собой серин/треониновую протеинкиназу из семейства PI3K-родственных киназ (англ. PI3K-related kinase, PIKK), которая образует каталитическую субъединицу двух различных белковых комплексов, известных как mTOR комплекс 1 (англ. mTOR complex 1, mTORС1) и 2 (mTORC2) (Saxton, Sabatini, 2017). Если mTORC1 регулирует рост и метаболизм клеток, способствуя синтезу белков, липидов и нуклеотидов, одновременно подавляя катаболические пути, такие как аутофагия, то mTORC2 контролирует пролиферацию и выживание (Saxton, Sabatini, 2017).
Исследования по ингибированию mTORС1 сигнального пути в культурах клеток РПЭ ведутся с целью регуляции ЭМП. Так, использование рапамицина, ингибитора mTORС1, способствовало снижению в клетках ARPE-19, обработанных TGF-β1, экспрессии NADPH oxidase 4 (NOX4) (Kim et al., 2020). Ингибирование NOX4 в клетках ARPE-19 предотвращало образование активных форм кислорода, TGF-β-индуцированного ЭМП и фиброза. Интересно, что обработка рапамицином полностью блокировала фосфорилирование ERK1/2, указывая на ингибирование петли обратной связи от mTORC1 к ERK1/2. Авторы предполагают, что ось TGF-β1/ERK1/2/mTORC1/NOX4 может быть использована в качестве новой стратегической мишени для предотвращения заболеваний сетчатки, связанных с ЭМП и фиброзом (Kim et al., 2020).
Дедифференцировка клеток РПЭ, опосредованная активацией mTOR в ответ на химическое окислительное повреждение, блокировалась рапамицином в эксперименте на мышах с селективной по отношению к РПЭ постнатальной потерей окислительного фосфорилирования. Ингибирование реакции на стресс путем блокирования активации mTOR оказывало заметное благотворное влияние не только на РПЭ, но и на фоторецепторы (Zhao et al., 2011). В связи с чем, ингибирование mTOR является вполне убедительной терапевтической стратегией для лечения дегенеративных заболеваний сетчатки человека, вызванных повреждением РПЭ (Zhao et al., 2011).
На мышиной модели со специфическим нокаутом в РПЭ гена tuberous sclerosis 1 (Tsc1), который кодирует вышестоящий супрессор mTORC1, подтверждено участие mTORC1 в дегенерации РПЭ (Go et al., 2020). Использовав метаболомный и геномный анализы, исследователи выявили, что гиперактивный mTORC1 приводит к преобразованию метаболического пути в РПЭ за счет увеличения гликолиза (Go et al., 2020). Однако, несмотря на очевидную роль mTORC1 в старении РПЭ и возрастной дегенерации, клинические испытания рапамицина у пациентов с географической атрофией не увенчались успехом (Petrou et al., 2014). Го и соавт. предполагают, что сетчатка и РПЭ имеют разные метаболические пути, а сигнал mTORC1 является фактором выживания фоторецепторных клеток. Соответственно, рапамицин оказался токсичным для клеток сетчатки у пациентов с ВМД. Поскольку mTORC1 находится на вершине сигнальной сети и контролирует несколько направлений клеточных процессов, необходимы дополнительные исследования, направленные на рассечение сигнала ниже по течению, чтобы избежать полного ингибирования эффектов mTORC1 при возрастных заболеваниях (Go et al., 2020).
В работах по изучению изменений цитоскелета клеток РПЭ под действием TGF-β показана активация RhoА/Rho-associated protein kinase (ROCK) сигнального каскада (Lee et al., 2008; Huang et al., 2012; Zhu et al., 2013). Rho-семейство малых ГТФаз – это семейство “малых” клеточных сигнальных белков (около 21 кДа), принадлежащих к суперсемейству Ras-подобных белков. Среди 20 белков млекопитающих наиболее изучены Rac1 и RhoA (Boureux et al., 2007). Показано, что Rac1 белок играет ключевую роль в регуляции полимеризации актина и способствуют формированию ламеллоподий на переднем крае мигрирующих клеток (Bustelo et al., 2007; Huang et al., 2012). Белок RhoA играет важную роль в образовании и стабильности клеточных контактов, он активирует ROCK, относящуюся к типу серин/треониновых протеинкиназ (Bustelo et al., 2007). Известно около 20 субстратов, фосфорилируемых ROCK, включая белки цитоскелета, легкие цепи миозина, фосфатазу миозина, LIM-киназу, которая через фосфорилирование кофилина играет важную роль в полимеризации актина. ROCK вовлечена в различные виды активности клетки, такие как организация цитоскелета, формирование стресс-волокон и фокальных контактов, деление, миграция, апоптоз (Boureux et al., 2007; Bustelo et al., 2007).
Сравнение эффектов TGF-β2 и стекловидного тела, основного источника TGF-β2, выявило разный ответ нетрансформированных клеток РПЭ (Parapuram et al., 2009). Так, только TGF-β2 стимулировал в клетках РПЭ дифференцировку в миофибробласты, которые, как предполагается, вызывают сокращение эпиретинальных мембран. О дифференцировке в миофибробласты свидетельствовали изменения в цитоскелете клеток, проявляющиеся в формировании стресс-волокон с комплексами фокальной адгезии, и повышение экспрессии специфичных для миофибробластов генов αSMA и CTGF. И наоборот, при обработке стекловидным телом отмечено формирование коротких филаментов, которые концентрировались в ламеллоподиях или филоподиях, и снижение экспрессии мРНК αSMA и CTGF (Parapuram et al., 2009). Кроме того, при обработке стекловидным телом, исследователи отметили более выраженную подвижность клеток РПЭ, что, по мнению авторов, не может быть объяснено присутствием в стекловидном теле одного только TGF-β2, а указывает на роль других сигнальных молекул. Исследователи предполагают, что витреальный TGF-β2 играет важную начальную роль в ЭПМ, однако в последующем происходит подавление TGF-β пути (Parapuram et al., 2009). И в этом подавлении может участвовать BMP2 сигнальный путь, активацию которого при обработке клеток РПЭ стекловидным телом наблюдали другие исследователи (Ganti et al., 2007).
Воздействие TGF-β1 на первичные клетки РПЭ взрослого человека ранних пассажей и клетки линии ARPE-19 приводило не только к увеличению фосфорилирования Smad2/3, но и к активации Rac1 и RhoA, что сопровождалось увеличением мезенхимальных маркеров (Lee et al., 2008; Huang et al., 2012). Воздействие на RhoА/ROCK сигнальный каскад как потенциальную мишень ЭМП клеток РПЭ и новый терапевтический подход в лечении ПВР активно разрабатывается in vitro (Zhu et al., 2013). Предобработка специфическими ингибиторами: малой молекулой NSC23766 (ингибитор белка Rac1), гидроксифасудилом (активный метаболит фасудила) или малой молекулой Y-27632 (ингибиторы ROCK) предотвращала фибробластоподобные изменения в цитоскелете клеток РПЭ (Lee et al., 2008; Huang et al., 2012; Zhu et al., 2013). Кроме того, фасудил значительно ингибировал развитие экспериментального ПВР в глазах кроликов, не влияя на жизнеспособность клеток сетчатки по данным электроретинографического и гистологического анализов (Kita et al., 2008).
Помимо специфических ингибиторов ROCK (фасудила и Y-27632) ингибитором ROCK и casein kinase 1 (CK1) является никотинамид, дериват витамина B3 (Meng et al., 2018). С 2009 года никотинамид активно используют в протоколах направленной дифференцировки iPSCs и ESCs человека в РПЭ (Buchholz et al., 2013; Zhao et al., 2017; Saini et al., 2017), когда Идельсон с соавт. показали увеличение эффективности генерации РПЭ из ESCs человека до 33% через 6 недель после добавления никотинамида и активина А (Idelson et al., 2009). Никотинамид подавляет фосфорилирование легкой цепи миозина, подавляет сокращение актомиозина и приводит к повышению выживаемости клеток (Meng et al., 2018). В последнее время роль никотинамида в возврате клеток РПЭ из дедифференцированного при ЭМП в дифференцированное состоянии пристально изучается in vitro (Hazim et al., 2019; Boles et al., 2020; Zhou et al., 2020).
Таким образом, различные исследования TGF-β сигнальных путей, участвующих в патологических процессах в РПЭ, выполненных в основном на клеточной линии РПЭ человека ARPE-19, выявили, что ведущая роль в ЭМП клеток РПЭ принадлежит двум изоформам TGF-β1 (Mitsuhiro et al., 2003; Lee et al., 2008; Li et al., 2011; Dvashi et al., 2015; Kim et al., 2020) и TGF-β2 (Priglinger et al., 2004; Saika et al., 2005; Chen et al., 2014a), тогда как BMP4 и BMP7 противодействуют их эффектам (Yao et al., 2016, 2019). Хотя TGF‑β1 в стекловидном теле обнаруживается лишь в латентной форме, его активация возможна при патологии, чему может способствовать, например, снижение pH среды при воспалении. Поскольку участие TGF-β1 в ЭМП клеток РПЭ продемонстрировано в ряде исследований in vitro, высвобожденный активный TGF-β1 из латентной формы в стекловидном теле также может вызывать ЭМП клеток РПЭ при контакте с компонентами стекловидного тела. В связи со сказанным роли витреальных TGF-β (TGF-β1 и TGF-β2) в ЭМП клеток РПЭ еще предстоит уточнить.
Факторы роста и цитокины в активации неканонических TGF-β сигнальных путей и развитии ЭМП
Хотя TGF-β, по-видимому, играет ключевую роль в стимуляции клеток РПЭ для формирования эпиретинальных мембран, многие другие факторы так же могут быть вовлечены в патогенез витреоретинальных расстройств и других, связанных с ЭМП ретинохориоидальных заболеваний. Так, в аспиратах стекловидного тела при ПВР помимо повышенного содержания TGF-β, обнаружены и такие факторы роста, как фактор роста гепатоцитов (HGF) и эпидермальный фактор роста (EGF), и провоспалительный цитокин TNFα (табл. 1).
Воздействие TNFα на клетки ARPE-19 индуцировало образование фиброзных очагов (Takahashi et al., 2010). Через взаимодействие гиалуроновой кислоты с CD44–моэзином TNFα опосредовал активацию TGF-β сигнального пути. TNFα способствует экспрессии CD44, основного рецептора трансмембранной адгезии для гиалуроновой кислоты, и фосфорилированию моэзина с помощью протеинкиназы C (англ. protein kinase C, PKC), что приводит к перицеллюлярному взаимодействию гиалуроновой кислоты и CD44. Образование комплекса гиалуроновая кислота–CD44–моэзин приводит к нарушению межклеточных контактов и повышению подвижности клеток за счет ремоделирования актина. Кроме того, комплекс гиалуроновая кислота–CD44–моэзин связывается с TGFβR-II и клатрином в актиновых микродоменах с последующей активацией передачи сигналов TGF-β и индукцией мезенхимального фенотипа в клетках РПЭ (Takahashi et al., 2010). Помимо этого, авторы продемонстрировали, что фиброз, индуцированный инъекцией TNFα в сетчатку мыши, заметно подавлялся у мышей, нокаутированных по CD44. Эти данные указывают на то, что взаимодействие гиалуроновой кислоты с CD44 играет ключевую роль в фиброзных расстройствах, ассоциированных с ЭМП. Как показано на клетках ARPE-19, TNFα активирует AKT, mTORC1 и mTORC2. Однако только AKT/mTORC1 сигнальный путь необходим для TNFα-опосредованной миграции клеток РПЭ (Liu et al., 2012) и экспрессии MMP9 в клетках РПЭ in vitro (Wang et al., 2012).
Активация ERK и PKCδ сигнальных путей отмечена и при экзогенном добавлении HGF в сочетании с EGF к линейным ARPE-19 и первичным клеткам РПЭ, синергетическое действие которых стимулировало миграцию клеток (Chen et al., 2012c).
МикроРНК (miRNAs) в регуляции TGF-β сигнального пути и ЭМП
В настоящее время появляется все больше исследований, направленных на изучение роли miRNAs в регуляции дифференцировки и ЭМП клеток РПЭ (Wang et al., 2010; Adijanto et al., 2012; Donato et al., 2018; Shahriari et al., 2020). Так, показано, что при TGF-β2-индуцированном ЭМП в клетках ARPE-19 по-разному экспрессируется 304 miRNAs. Из этих дифференциально экспрессируемых miRNAs регуляция 185 подавлена, тогда как регуляция 119 повышена как минимум в два раза (Chen et al., 2014b). Отмечено, что в клетках ARPE-19 после обработки TGF-β2 резко снижается экспрессия miR-let7c и активируется путь передачи сигнала nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB) (Deji et al., 2020). NF-κB регулирует большое число генов, многие из которых являются критическими для выживания клеток. NF-κB является ключевым регулятором воспалительных сигнальных каскадов, он участвует в индукции и поддержании ЭМП и в неоваскуляризации сетчатки (Yang et al., 2015b; Moon et al., 2017b; Luo et al., 2018). NF-κB стимулирует выработку различных факторов роста, включая TGF-β, и провоспалительных цитокинов (например, IL-8, TNFα), молекул адгезии, ангиогенных факторов (например, фактора роста эндотелия сосудов, англ. vascular endothelial growth factor, VEGF), а также ферментов деградации ВКМ (например, MMP9), активность которых связана с миграцией клеток. В то же время NF-κB активируется в ответ на различные стимулы – воспалительные цитокины, клеточный стресс, а также факторы роста (Yang et al., 2015a). Известно, что NF-κB способствует стабилизации белка Snail, предотвращая его фосфорилирование внутриклеточной киназой гликогенсинтазы-3β (англ. glycogen synthase kinase 3 beta, GSK3β) и последующую деградацию (Thiery et al., 2009). Потеря активности NF-κB снижает экспрессию генов, связанных с ЭМП (Moon et al., 2017b).
В ряде исследований показано, что критическую роль в дифференцировке клеток РПЭ играет семейство miR-204/211 (Wang et al., 2010; Adijanto et al., 2012). MiR-204/211 регулируют MITF, что способствует поддержанию эпителиального фенотипа в фетальных клетках РПЭ человека (Adijanto et al., 2012). Кроме того, прямыми мишенями miR-204 являются TGFβR-II и SNAI2 (также известный как SLUG) (Wang et al., 2010). Помимо miR-204/211 и семейства let7 ряд других miRNAs, такие как miR-29b (Li et al., 2016), miR-93 (Fuchs et al., 2020), miR-124 (Jun, Joo, 2016) и miR-194 (Cui et al., 2019) могут быть молекулярными регуляторами и потенциальными терапевтическими мишенями при развитии ЭМП при ПВР.
Например, ингибирование miR-29b в клетках ARPE-19 напрямую запускает процесс ЭМП, который характеризуется фенотипическими изменениями, активацией αSMA, подавлением E-кадгерина и ZO-1 и повышенной миграцией клеток (Li et al., 2016). Мишенью miR-29b является AKT2, подавление которого ингибирует TGF-β1-индуцированный ЭМП (Li et al., 2016). Сверхэкспрессия miR-194 значительно ингибирует TGF-β1-индуцированный ЭМП клеток ARPE-19, при этом значительно снижается экспрессия CDH2 (ген N‑кадгерина) и других генов, которые регулируются ZEB1 (Cui et al., 2019). При прогрессировании ЭМП в клетках ARPE-19 снижается уровень экспрессии miR-124, а ингибирование эндогенной miR-124 способствует увеличению мезенхимальных и снижению эпителиальных маркеров (Jun, Joo, 2016). Сверхэкспрессия miR-124 увеличивает уровни ZO-1 и окклюдина, подавляет уровни фибронектина, αSMA и виментина, а также подавляет TGF-β1-индуцированное сокращение коллагенового геля клетками РПЭ (Jun, Joo, 2016).
Как показано в исследовании Фукса и соавт., мишенями для miR-302d являются TGFβR-II, SMAD2 и SMAD3, три основных гена TGF-β/Smad сигнального каскада, тогда как miR-93 регулирует только TGFβR-II (Fuchs et al., 2020). После воздействия TGF-β и трансфекции miR-302d или miR-93 в клетках ARPE-19 выявлено значительное снижение секреции VEGF-A, играющего решающую роль в CNV при ВМД. Однако роль miR-302d в дифференцировке клеток РПЭ остается противоречивой. Так, по мнению Фукса и соавт., обе miRNAs (miR-302d и miR-93) могут возвращать TGF-β-индуцированные мезенхимальные клетки ARPE-19 в эпителиоподобное состояние и, следовательно, способствовать МЭП (Fuchs et al., 2020). Однако в другом исследовании показано, что miR-302d-3p индуцирует дедифференцировку клеток ARPE-19, что проявляется снижением характерных маркеров РПЭ и прерыванием фагоцитоза, а также способствует миграции клеток, их пролиферации и прогрессированию клеточного цикла (Jiang et al., 2018). В этом же исследовании потенциальным вышестоящим фактором транскрипции для miR-302d-3p был идентифицирован c-Jun, а нижестоящей мишенью – p21, ингибитор циклинзависимой киназы, кодируемый геном CDKN1A. Данные этой работы свидетельствуют о том, что p21 может способствовать дифференцировке РПЭ, ингибировать его пролиферацию, развитие клеточного цикла и миграцию, тогда как miR-302d-3p подавляет дифференцировку РПЭ посредством прямого нацеливания на p21 (Jiang et al., 2018).
Стратегии воздействия на TGF-β сигнальный путь и ЭМП клеток РПЭ
На сегодняшний день очевидно, что комплекс растворимых факторов, в том числе из сыворотки крови и стекловидного тела, и ВКМ тесно переплетены при развитии ЭМП клеток РПЭ. Результаты работ, выполненных в основном на клеточной линии ARPE-19, свидетельствуют о том, что различные факторы роста и сигнальные молекулы могут запускать ЭМП клеток РПЭ, понижая их уровень дифференцировки и способствуя пролиферации (Yang et al., 2015b; Dvashi et al., 2015; Yao et al., 2016). Рецепторы с высоким сродством к таким факторам роста, как EGF, FGF, IGF, HGF, TGFα и PDGF, которые обнаруживаются в стекловидном теле при пролиферативных витреоретинопатиях (табл. 1), принадлежат к разным подклассам рецепторных тирозинкиназ. Однако все они могут активировать сходные внутриклеточные сигнальные пути, в том числе MAPK/ERK и PI3K/AKT/mTOR (Thiery et al., 2009; Gonzalez, Medici, 2014; Liu et al., 2015).
В отличие от факторов, которые запускают ЭМП, очевидно, что TGF-β является его основным регулятором (Dvashi et al., 2015; Yao et al., 2016). Он способствует миграции клеток РПЭ и активирует в них синтез компонентов ВКМ. Участие двух изоформ TGF-β (TGF-β1 и TGF-β2) в ЭМП клеток РПЭ продемонстрировано в ряде исследований (Mitsuhiro et al., 2003; Priglinger et al., 2004; Saika et al., 2005; Lee et al., 2008; Li et al., 2011; Chen et al., 2014a; Dvashi et al., 2015; Kim et al., 2020).
Учитывая важную роль ЭМП в патогенезе ПВР, таргетная терапия ЭМП считается потенциальным методом лечения этого заболевания. В настоящее время ведутся исследования по блокированию TGF-β сигнального пути на всех уровнях – от его лигандов и рецепторов до ядерных рецепторов. Эти ингибиторы включают как малые молекулы (англ. small molecule drugs), так и большие молекулы или биопрепараты (англ. large molecules or biologics).
Большинство современных ингибиторов передачи сигналов TGF-β, которые нацелены на нейтрализацию всех его изоформ или на прямое ингибирование киназной активности его рецепторов, более подробно рассмотрены в обзорах (Yang et al., 2015b; Györfi et al., 2018; Huynh et al., 2019). Среди них, например, LY-364947, селективный ингибитор TGFβR-I. Так, LY-364947 предотвращал ЭМП клеток РПЭ быка in vitro, а также уменьшал площадь фиброза в месте травмы и предотвращал тракционную отслойку сетчатки на модели ПВР кролика in vivo (Nassar et al., 2014). Другой препарат, глюкозамин (англ. glucosamine), снижающий уровень экспрессии рецептора TGF-β и ингибирующий связывание TGF-β с поверхностью клеток, ослаблял ЭМП в клетках ARPE-19 и уменьшал морфологические изменения на модели ПВР (отслойки сетчатки) мыши (Liang et al., 2011).
Однако стратегии по прямому нацеливанию на TGF-β и его рецепторы ингибируют все функции передачи сигналов семейства TGF-β, что может быть связано с неприемлемыми побочными эффектами (Györfi et al., 2018). Поэтому было разработано множество альтернативных стратегий для воздействия на TGF-β на других уровнях, в том числе на уровне внутриклеточных сигнальных каскадов, задействованных в профибротических эффектах, а также на уровне транскрипционных факторов, ядерных рецепторов и miRNAs. Например, деацетилирование Smad4 при использование биологически активной добавки ресвератрола (англ. resveratrol) приводило к ингибированию ЭМП (подавление пролиферации и миграции клеток и синтеза фибронектина) в фетальных клетках РПЭ, а также к подавлению прогрессирования ПВР в модели кролика (Ishikawa et al., 2015).
Специфическое ингибирование транскрипционного фактора Snail, участника Smad-зависимой передачи сигналов TGF-β, репрессирующего экспрессию адгезивных молекул, и, таким образом, регулирующего переход от эпителия к мезенхиме, может обеспечить новый подход к лечению и предотвращению ПВР (Li et al., 2011).
В дополнение к сказанному, в качестве терапевтических подходов в лечении ПВР предлагают подавлять в клетках РПЭ следующие мишени Smad-независимой передачи сигналов TGF-β: p38 MAPK (Saika et al., 2005; Dvashi et al., 2015), ERK1/2 (Chen et al., 2014a), mTOR (Zhao et al., 2011; Kim et al., 2020) и RhoА/ROCK (Lee et al., 2008; Kita et al., 2008; Zhu et al., 2013).
Важная роль в дифференцировке клеток РПЭ показана в ряде исследований с использованием таких ингибиторов ROCK, как Y-27632 (Zhu et al., 2013), фасудил (Lee et al., 2008; Kita et al., 2008) и никотинамид (Hazim et al., 2019; Boles et al., 2020). Для примера, обработка никотинамидом первичных клеток РПЭ человека предотвращала ЭМП и сократительное поведение, стимулированное комбинированным воздействием TGF-β1 и TNFα (Boles et al., 2020).
В дополнение к этому, ингибирование NF-κB представляет собой многообещающую терапевтическую стратегию для предотвращения или контроля глазных фиброзных заболеваний, возникающих из-за ЭМП (Moon et al., 2017b). Так, обработка клеток ARPE-19, стимулированных TGF-β1, препаратом бортезомиб (англ. bortezomib), применяемым в противоопухолевой терапии, подавляла сигнальный каскад NF-κB и повышала экспрессию ингибитора NF-κB – IκBα (nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor, alpha). Бортезомиб подавлял регуляцию мезенхимальных маркеров (N-кадгерин, виментин, αSMA и β-катенин) и повышал активность эпителиальных маркеров (ZO-1 и окклюдин), что свидетельствует об ингибировании ЭМП в клетках РПЭ и предотвращении развития ПВР путем подавления пути TGF-β (Moon et al., 2017b).
Исследование влияния агониста ядерного рецептора peroxisome proliferator-activated receptor-gamma (PPARγ) троглитазона (англ. troglitazone), препарата из группы пероральных гипогликемических препаратов, на TGF-β2-опосредованные ответы в клетках ARPE-19 показало, что троглитазон эффективно ингибировал продукцию компонентов ВКМ (коллагена I типа и фибронектина) как на уровне мРНК, так и на уровне белка, и подавлял миграцию клеток РПЭ (Cheng et al., 2008). Кроме того, троглитазон подавлял индуцированное TGF-β2 фосфорилирование Smad2 и Smad3 и их последующую ядерную транслокацию, что, возможно, является молекулярным механизмом, объясняющим подавление ЭМП в клетках РПЭ. В дополнение к этому, троглитазон не влиял на индуцированное TGF-β2 фосфорилирование p38 MAPK (Cheng et al., 2008).
В дополнение к сказанному, в настоящее время ряд miRNAs (например, miR-204/211, семейство let7, miR-29b, miR-93, miR-124, miR-194 и miR-302d) и длинные некодирующие (lnc) RNA (lncRNA) рассматриваются в качестве важных модуляторов передачи сигналов TGF-β и ЭМП клеток РПЭ (Wang et al., 2010; Adijanto et al., 2012; Jun, Joo, 2016; Li et al., 2016; Cui et al., 2019; Fuchs et al., 2020; Salmaninejad et al., 2022). Хотя lncRNA менее изучены, они могут быть не менее важными, поскольку могут выполнять свои регуляторные роли через спонжирование miRNA (Salmaninejad et al., 2022). Поскольку miRNAs могут подавлять экспрессию практически всех генов и их транскриптов мРНК, они имеют преимущества над препаратами на основе малых молекул, воздействующих только на определенные классы белков, и препаратов на основе белков, включая высокоспецифичные моноклональные антитела, мишени которых в основном ограничены рецепторами на поверхности клетки или циркулирующими белками (Lam et al., 2015). Возможность локальной доставки miRNAs непосредственно в глаз может быть полезным в качестве новых классов терапевтических агентов для лечения широкого спектра офтальмологических заболеваний.
Помимо таргетной терапии при ПВР, намечены маркерные белки, экспрессия которых изменяется при развитии ПВР и ВМД. В частности, экспрессия компонента Janus kinase (JAK)/Signal transducer and activator of transcription (STAT) сигнального пути, транскрипционного фактора STAT3, и ключевого активатора различных цитокинов и факторов роста, увеличивается в РПЭ при образовании CNV (Fasler-Kan et al., 2005). При влажной форме ВМД отмечается снижение или даже отсутствие белка BMP4 в хориваскулярных мембранах (Zhu et al., 2009a), что связано с ингибирующим влиянием TNFα (Xu et al., 2011).
Кроме сказанного, идентификация и анализ паттерна экспрессии miRNAs во внутриглазной жидкости или стекловидном теле пациентов с различной патологией (диабетической ретинопатией, глаукомой) в настоящее время является предметом многих офтальмологических исследований (Jayaram et al., 2017; Martinez, Peplow, 2019; Chen et al., 2019). Помимо этого, дальнейшие исследования по дифференциально экспрессируемым miRNAs в сетчатке и РПЭ необходимо продолжить, поскольку это поможет как в идентификации биомаркеров пролиферативных и дегенеративных заболеваний сетчатки, так и в установлении потенциальных мишеней для терапии препаратами на основе miRNAs.
FGF/FGFR СИГНАЛЬНЫЙ ПУТЬ
Семейство FGF у человека состоит из 22 членов, которые на основе их различных функций и конечных биологических эффектов, за исключением четырех несекретируемых интракринных факторов (FGF11-14), могут быть подразделены на митогенные/паракринные (FGF1/2, FGF4/5/6, FGF3/7/10/22, FGF8/17/18 и FGF9/16/20) и метаболические/эндокринные FGF (FGF19 (мышиный FGF15)/21/23), явно регулирующие клеточную пролиферацию и субстратный/энергетический метаболизм соответственно (Ornitz, Itoh, 2015; Li, 2019; Ferguson et al., 2021; Loda et al., 2022). Члены семейства FGF играют важную роль на самых ранних стадиях эмбрионального развития и во время органогенеза, они поддерживают клетки-предшественники и опосредуют их рост, дифференцировку и выживание. Во взрослом организме члены семейства FGF поддерживают гомеостаз, участвуют в восстановлении тканей (физиологическая регенерация) и синтезируются в ответ на повреждение (репаративная регенерация) (Ornitz, Itoh, 2015).
У млекопитающих секретируемые FGF (FGF1-10, FGF15-23) опосредуют свои биологические эффекты через связывание с четырьмя специфическими, высокоаффинными рецепторами клеточной поверхности (FGFR1, 2, 3, 4), выраженными в виде ряда вариантов сплайсинга (Ornitz, Itoh, 2015; Li, 2019). FGFRs принадлежат к семейству тирозинкиназных рецепторов и представляют собой трансмембранные белки с тремя IgG-подобными доменами в их эктодомене и двумя тирозинкиназными доменами во внутриклеточной части (Nguyen, Mège, 2016; Ferguson et al., 2021). В зависимости от сплайсинга трех экзонов третьего Ig-подобного домена полученные изоформы рецепторов (IgIIIb и IgIIIc) имеют отчетливые различия в специфичности связывания лиганда. Например, FGFR2 имеет эпителиальную FGFR2-IIIb и мезенхимальную FGFR2-IIIc изоформы (Warzecha et al., 2009; Ferguson et al., 2021).
Связывание канонических FGF лигандов на клеточной поверхности с IgG-подобными эктодоменами родственных им трансмембранных FGFR в комплексе с мотивами гепарансульфат протеогликанов (англ. heparan sulfate proteoglycan, HSPG)/гепарина важно и необходимо для образование двух тройных комплексов FGF–FGFR–HSPG/гепарин и последующей их димеризации и интернализации и активации внутриклеточных тирозинкиназных доменом FGFRs (Li, 2019; Xie et al., 2020). Активация последних запускает многочисленные внутриклеточные сигнальные каскады, управляющие ключевыми клеточными событиями, включая пролиферацию, миграцию и выживание клеток (Nguyen, Mège, 2016). На сегодняшний день известно о четырех внутриклеточных сигнальных путях, передающих сигналы секретируемых FGFs: MAPK/ERK, PI3K/AKT, фосфолипазы Сγ (англ. phospholipase Cγ, PLCγ)/PKC и JAK/STAT. Однако специфика клеточного ответа при связывании FGFs с FGFRs неясна (Ornitz, Itoh, 2015). Ключевым компонентом негативной регуляции FGF-зависимого PI3K/AKT-сигнального пути является GSK3β (Katoh, Katoh, 2006; Ding et al., 2010).
Среди митогенных FGFs, FGF2, ранее известный как основной FGF (англ. basic FGF, bFGF), негликозилированный полипептид, состоящий из 146 аминокислот, с молекулярной массой 18 кДа (Arnaud et al., 1999), связывается со всеми четырьмя FGFRs, за исключением FGFR2-IIIb (Ferguson et al., 2021). FGF2 действует локально при возникновении повреждения, оказывая митогенный эффект на клетки тканей нейроэктодермального и мезодермального происхождения (Schweigerer, 1988). На поверхности клетки FGF2 связывается с HSPG, а именно с мембранными молекулами (например, синдеканы и глипиканы) или с тесно связанными с мембранной молекулами (например, перлекан), которые усиливают или ингибируют активность данного фактора (Nugent, Iozzo, 2000). Также имеется ряд других связывающихся с FGF2 молекул, включая интегрин αvβ3 (рецептор для витронектина), растворимый FGFR1, тромбоспондин, фибриноген, α2-макроглобулин, тромбоцитарный фактор роста (англ. platelet-derived growth factor, PDGF) и другие, а также неканонические партнеры по сигнализации FGFR, включая белки ВКМ, молекулы клеточной адгезии (CAMs), корецепторы и другие тирозинкиназные рецепторы, что тонко настраивает активность FGF2 в зависимости от расположения и количества этих партнеров (Ferguson et al., 2021).
FGF2 участвует в развитии глаза, способствуя специализации нейроэпителия в сетчатку (Bharti et al., 2006). Добавление FGF2 к культивируемым глазным пузырям куриных эмбрионов способствует нейрональной дифференцировке презумптивного РПЭ и образованию двойной сетчатки (Pittack et al., 1997).
В заднем отделе глаза FGF2 выявляется в клетках макроглии (астроциты, клетки Мюллера) и ганглиозных клетках сетчатки, а также в ядрах и цитоплазме клеток РПЭ млекопитающих (Walsh et al., 2001; Yafai et al., 2013) и низших позвоночных (Markitantova et al., 2014). Кроме того, на срезах сетчатки приматов FGF2 выявлен в межфоторецепторном матриксе, что свидетельствует о том, что он секретируется различными типами клеток сетчатки и сосудистой оболочки в межфоторецепторный матрикс и может участвовать в регуляции функций наружных сегментов фоторецепторов и РПЭ (Hageman et al., 1991). Участие FGF2 в предотвращении дегенерации фоторецепторов подтверждает исследование, когда интравитреальные инъекции наночастиц, импрегнированных FGF2, ингибировали апоптоз клеток сетчатки крыс RCS с наследственной дегенерацией сетчатки (Sakai et al., 2007).
FGF2 принимает участие в инициировании самых ранних ответов сетчатки на ее отслойку (Geller et al., 2001; Yasumuro et al., 2017), у взрослых хвостатых амфибий он является ключевым регулятором дедифференцировки РПЭ с высокой способностью к регенерации сетчатки (Markitantova et al., 2014). После ретинэктомии в клетках РПЭ взрослого тритона отмечается временное усиление активности ERK, затем клетки РПЭ теряют свои эпителиальные характеристики, пролиферируют, и, не проявляя классические признаки ЭМП, дифференцируются в нейральном направлении, регенерируя сетчатку (Yasumuro et al., 2017). При экспериментальной отслойке сетчатки у кошек, в клетках Мюллера и РПЭ происходит ряд схожих последовательных событий: FGFR1, высокоаффинный рецептор FGF2, фосфорилируется с последующей дефосфорилизацией, фосфорилируется ERK и увеличивается экспрессия фактора транскрипции AP-1 (англ. activator protein) (Geller et al., 2001), который индуцирует ЭМП клеток путем модулирования экспрессии Zeb1/2 и TGF-β (Bakiri et al., 2015). Следует отметить, что развитие ЭМП у тритонов возможно при нокдауне Pax6. При подавлении экспрессии Pax6 клетки РПЭ трансгенных тритонов дифференцируются в фибробластоподобные клетки, экспрессирующие αSMA, виментин и N-кадгерин, и при этом регенерации сетчатки не происходит (Casco-Robles et al., 2016).
Известно, что N-кадгерин может связываться с первыми двумя внеклеточными IgG-подобными доменами FGFR1 (Suyama et al., 2002). Вследствие этого взаимодействия FGFR1 не интернализуется FGF2 эффективно, вызывая устойчивую экспрессию FGFR1 на клеточной поверхности, что приводит к стойкой активации MAPK/ERK, экспрессии MMP9, развитию ЭМП, включая повышенную регуляцию Snail и Slug (SNAI2), а также снижение экспрессии эпителиальных и повышение экспрессии мезенхимальных генов, инвазии, пролиферации клеток и проявлении ими свойств стволовых/прогениторных клеток (Suyama et al., 2002; Qian et al., 2014). При этом усиливается активность FGFR2-IIIc (Qian et al., 2014). Устойчивая экспрессия FGFR1 приводит к дифференциальной передаче сигналов с помощью ERK и AKT (Suyama et al., 2002; Qian et al., 2014). Возможно, подобный механизм активации FGFR1 существует при ЭМП клеток РПЭ, что требует дополнительных исследований.
Как показали предыдущие исследования, FGF2 обнаруживается в высокой концентрации в неоваскулярной ткани при ВМД и активируется в индуцированных лазером CNV мембранах (Amin et al., 1994). Кроме того, в клетках РПЭ в CNV мембранах обнаружена экспрессия FGFR-1 и FGFR-2 (Rosenthal et al., 2005).
In vitro в клетках РПЭ человека FGF2 выявляется как на транскрипционном, так и на белковом уровнях (Sternfeld et al., 1989; Schwegler et al., 1997). Известно, что транскрипция генов (фактора и его рецепторов) зависит от плотности клеток и адгезии к твердому субстрату. Так, уровень транскрипции FGF2 является самым высоким в культурах с низкой плотностью и, наоборот, мРНК и белок FGF2 снижается при увеличении плотности клеток и в слитом монослое. Предполагается, что сборка межклеточных контактов может переключать клетки РПЭ с синтеза и секреции FGF2 на экспрессию его рецепторов (Bost, Hjelmeland, 1993).
Добавление FGF2 к клеткам ARPE-19 выявило активацию обоих рецепторов FGFR-1 и FGFR-2. При этом стимуляция FGFR-1 приводила к независимому от Са2+-канала изменению экспрессии генов (например, FOS), тогда как стимуляция FGFR-2 – к зависимой от Са2+ канала стимуляции секреции VEGF (Rosenthal et al., 2005). Следует отметить, что c-Fos является членом семейства индуцируемых факторов транскрипции AP‑1, белок c-Fos практически не выявляется в покоящихся клетках, его экспрессия быстро, но лишь временно индуцируется как часть ядерной реакции на множество стимулов, в том числе факторами роста (Caputto et al., 2014).
Считается, что FGF2 является антагонистом TGF-β (Wiedemann, 1992). В исследовании Ханта и соавт. обработка клеток РПЭ человека ранних пассажей стекловидным телом, источника TGF‑β, приводила к морфологическим изменениям сходным с ЭМП, что сопровождалось снижением экспрессии мРНК и белка FGF2. Добавление FGF2 вместе со стекловидным телом предотвращало некоторые эффекты, опосредованные стекловидным телом (Hunt et al., 1998). Однако, как было показано позже, FGF2 действует против TGF-β в субконфлюэнтных культурах, но аддитивно с EGF и TGF-β1 в конфлюэнтных культурах путем активации передачи сигналов Smad/ZEB1/2 (Chen et al., 2012a). Так, обработка FGF2 первичной культуры фетального РПЭ с низкой или высокой (субконфлюэнтность) плотностью посева улучшало морфологию культур и предотвращало потерю клетками эпителиального фенотипа (Radeke et al., 2015). Сохранение морфологии клеток при воздействии FGF2 было схожим с таковым при воздействии ингибитора TGFβR-I (A‑83-01) или ингибитора Rho/ROCK1/2 (Thiazovivin). Напротив, в контрольных культурах и культурах, обработанных антагонистом передачи сигналов WNT (XAV939), который повышает уровень аксина (англ. Axin), ключевого белка, участвующего в деградации β-катенина, или ингибитором BMPR-I (LDN-193189), отмечалась потеря клетками эпителиального фенотипа (Radeke et al., 2015).
Более ранние работы по изучению влияния FGF2 на пролиферацию неиммортализованных клеток РПЭ млекопитающих, главным образом, были связаны с выявлением оптимальной дозы FGF2 и/или процентного содержания эмбриональной телячьей сыворотки в культуральной среде, влияющих на повышение пролиферативной активности клеток. Из этих работ видно, что митотический эффект проявлялся в среднем спустя 3–4 сут после добавления FGF2 в среду культивирования (Esser et al., 1992; Khaliq et al., 1996; Schwegler et al., 1997). При изучении механизмов, участвующих в запуске пролиферации, показано, что FGF2 запускает в клетках РПЭ взрослого человека многоступенчатый механизм дедифференцировки (Kuznetsova et al., 2019a, 2019b), процесса, который у низших позвоночных является одним из основных для осуществления регенерации (Chiba, Mitashov, 2007). Так, через 24–48 ч после добавления FGF2 к клеткам РПЭ, диссоциированным трипсином/ЭДТА, отмечено снижение пролиферации и понижение дифференцировочного статуса клеток (судя по уменьшению площади клеток, снижению транскрипции MITF, KRT18 и BMP4 при повышении транскрипции NES), что было связано с подавлением β-катенина и Notch сигнального пути (снижением экспрессии генов JAG1, NOTCH1 и HES1), тогда как через 72–120 ч после диссоциации и воздействия FGF2 (на преконфлюэнтные клетки) приводило к увеличению пролиферации этих малодифференцированных клеток (судя по увеличению транскрипции OCT4 и NANOG при нарастающем уменьшении площади клеток), что было обусловлено активацией Wnt/β-катенин (снижение транскрипции CTNNB1 (ген β-катенина), снижение транскрипции GSK3β с одновременным увеличением транскрипции CCND1 (ген циклина D1)) и Notch сигнальных путей (увеличение экспрессии JAG1) (Kuznetsova et al., 2019a, 2019b).
Схожие проявления со стороны Wnt/β-катенин сигнального пути были описаны в другом исследовании после воздействия IGF на клетки РПЭ (Steindl-Kuscher et al., 2009). Так, через 48 ч после добавления IGF к клеткам ARPE-19 происходило снижение транскрипции и трансляции β-катенина и GSK3β с одновременным увеличением CCND1 и пролиферации клеток, что, по мнению авторов, связано с транслокацией β-катенина в ядра клеток и говорит об активации Wnt сигналинга (Steindl-Kuscher et al., 2009).
Однако использование антител к транскрипционно активной форме β-катенина (PY-489-β-катенин) показало значительное снижение ядерного β‑катенина в клетках РПЭ цыплят после повреждения сетчатки (ретинэктомии) и добавления к ним FGF2 (Zhu et al., 2014). При этом потеря ядерного β‑катенина поддерживалась до тех пор, пока присутствовал FGF2. Присутствующие β-катенин-позитивные клетки представляли собой BrdU–/p27+, что говорит о том, что ядерный β-катенин препятствует продвижению клеток по G1-фазе и вход в S-фазу. Хотя при этом РПЭ подвергался дедифференцировке и пролиферации. Полученные данные, по мнению авторов, свидетельствуют о том, что подавление β-катенина является необходимым условием регенерации сетчатки цыпленка, которая связана с активацией стволовых клеток или клеток-предшественников (Zhu et al., 2014). Данные Чжу и соавт. согласуются с результатами исследования Фуджимура и соавт., когда блокада Wnt/β-катенин сигнального пути у генетически модифицированных мышей приводила к трансдифференцировке клеток РПЭ в клетки нейральной сетчатки, что подтверждалось снижением РПЭ-специфичных маркеров (в частности, Mitf и Otx2) и эктопической экспрессией маркеров, специфичных для нейральной сетчатки (Chx10 и Rx) (Fujimura et al., 2009).
Напротив, добавлении FGF2 к слитому монослою (конфлюэнтным клеткам) РПЭ человека приводило к увеличению уровня экспрессии мРНК РПЭ-специфичных маркеров RPE65, OTX2 и ВМР4, и к снижение уровня экспрессии мРНК нейронального маркера PAX6 по сравнению с клетками РПЭ, культивируемыми без FGF2, что свидетельствует об участии FGF2 в редифференцировке клеток РПЭ после их пролиферации (неопубликованные данные) (рис. 2).
Рис. 2.
кПЦР. Экспрессия мРНК NES, TUBB3, PAX6, OTX2, MITF, RPE65, BMP2, BMP4 и BMPR-II в конфлюэнтных монослойных (перед пассированием) первичных культур (столбцы 1, 2), 1-ого (3, 4), 2-ого (5, 6) и 3-его (7, 8) пассажей клеток неиммортализованной линии РПЭ, культивированных в ростовой среде с 10% ЭТС без FGF2 (черные столбики) и в присутствии 20 нг/мл FGF2 (серые столбики), относительно экспрессии GAPDH, ×1000. Вертикальные отрезки – стандартное отклонение.

В работах Чен и соавт., добавление FGF2 вместе с EGF к постконфлюэнтным клеткам ARPE-19 (на 7-ой день после слияния) не активировало в последних Wnt сигнальный путь, тогда как добавление этих факторов к клеткам, предварительно обработанным хелатирующим агентом (EGTA), нарушало контактное ингибирование и запускало пролиферацию путем активации канонической передачи сигналов Wnt (судя по активности промотора T cell factor (TCF)/lymphoid enhancer factor (LEF), значительного увеличения уровней ядерного β-катенина и белка LEF1), но не ингибированием передачи сигналов Hippo, и запускало ЭМП за счет активации передачи сигналов Smad/ZEB (судя по увеличению ядерного окрашивания на p-Smad2/3, ZEB1 и ZEB2). О развитии ЭМП свидетельствовала потеря нормального фенотипа РПЭ (изменение цитолокализации RPE65, N-кадгерина, ZO-1 и Na,K-АТФазы) и приобретение мезенхимального фенотипа (повышенная экспрессия виментина, S100A4 и αSMA). Напротив, добавление TGF-β1 к постконфлюэнтным клеткам ARPE-19, предварительно обработанным EGTA, подавляло пролиферацию и передачу сигналов Wnt (Chen et al., 2012a, 2012b).
Использование различных siRNAs и их комбинаций для нарушения компонентов межклеточных соединений, включая p120-катенин, N-кадгерин, α-катенин, β-катенин или ZO-1, в постконфлюэнтных контактно-ингибированных клетках ARPE-19, показало, что только нокдаун p120-катенина разблокировал митотический блок без нарушения их нормального фенотипа; нокдаун p120-катенина активировал p120/Kaiso и RhoA/ROCK сигнальные пути, но не влиял на передачу сигналов Wnt/β-катенина и Smad/ZEB, что предотвращало развитие ЭМП (Chen et al., 2012b). Следует отметить, что только в постконфлюэнтных контактно-ингибированных клетках РПЭ нокдаун p120-катенина активировал пролиферацию, тогда как в диссоциированных трипсином/ЭДТА клетках ARPE-19 он ее снижал (Chen et al., 2012b).
Дальнейшие исследования in vivo по воздействию p120-катенин siRNA на включение и выключение пролиферации клеток РПЭ с контактным ингибированием могут помочь в разработке нового метода лечения заболеваний, характеризующихся дисфункцией или дегенерацией РПЭ вследствие старения и повреждения, при которых пролиферация отсутствует или ее стимуляция может привести к ЭМП (Chen et al., 2012b).
В совокупности данные свидетельствуют о том, что в клетках РПЭ, поддерживающих межклеточный контакт, FGF2 или TGF-β не инициируют пролиферацию или ЭМП. При разрушении адгезионных контактов в зависимости от клеточной плотности FGF2 может вызывать дедифференцировку и/или ЭМП и пролиферацию. Так, в диссоциированных трипсином/ЭДТА клетках РПЭ FGF2 индуцирует дедифференцировку, приводя к активации стволовых клеток/клеток-предшественников при подавлении β-катенина, тогда как в преконфлюэнтных клетках РПЭ FGF2 инициирует их пролиферацию и ЭМП, что связано с активацией канонической передачи сигналов Wnt. TGF-β, в свою очередь, играет важную роль после запуска ЭМП – в индукции перехода к фенотипу миофибробластов (фенотипу, связанному с развитием фиброзных осложнений) – при ингибировании пролиферации.
WNT СИГНАЛЬНЫЙ ПУТЬ
У человека семейство Wnt состоит из 19 секретируемых гидрофобных гликопротеинов, которые путем предоставления пространственной информации в форме градиента концентрации регулируют различные клеточные процессы, включая определение клеточной судьбы, подвижность, полярность, формирование первичной оси и органогенез, синаптическую пластичность и обновление стволовых клеток (Komiya, Habas, 2008; Nusse, Clevers, 2017).
Внеклеточный Wnt лиганд стимулирует несколько внутриклеточных каскадов передачи сигнала, включая канонический или Wnt/β-катенин зависимый путь и неканонический или β-катенин-независимый путь, который можно разделить на путь планарной клеточной полярности (англ. planar cell polarity, РСР) и Wnt/Ca2+ путь (Komiya, Habas, 2008). Wnt белки могут передавать сигналы через один канонический или неканонический путь или оба пути. Принято считать, что белки класса Wnt1 (Wnt1, 3, 3a и 8) преимущественно передают сигнал через канонический сигнальный путь, тогда как класс Wnt5a (Wnt4, 5a и 11) в основном активируют неканонические пути (Lad et al., 2009). Кроме того, принято считать, что каноническая ветвь сигнального пути Wnt задействована в контроле пролиферации и дифференцировки клеток, тогда как неканонические сигнальные пути Wnt, такие как РСР и Wnt/Ca2+ сигнальный путь, влияют на организацию цитоскелета и клеточную подвижность клеток РПЭ.
Канонический Wnt/β катенин сигнальный путь
Канонический Wnt/β катенин сигнальный путь является эволюционно консервативным, он играет центральную роль во время различных стадий развития сетчатки и в гомеостазе во взрослой сетчатки (Lad et al., 2009).
Канонический Wnt лиганд на клеточной поверхности связывается с рецепторным комплексом, состоящим из рецептора Frizzled (Fzd)-1 или -4 (кодируются генами FZD1 и FZD4 соответственно) и ко-рецептором low-density lipoprotein receptor-related protein (LRP)5 или LRP6 (de Jaime-Soguero et al., 2018). В этом комплексе трансмембранная часть Fzd-рецептора взаимодействует с цитоплазматическим белком Dishevelled (Dvl), тогда как внутриклеточный домен LRP5/6 – с белком аксином, что приводит к разборке комплекса деструкции APC–аксин–СК1α и ингибированию внутриклеточной серинтреониновой киназы GSK3β. В результате этого ингибируется фосфорилирование β-катенина, что в свою очередь приводит к его накоплению в цитозоле (Xu, Kimelman, 2007). Далее накопленный β-катенин транслоцируется в ядро, где образует множественные белковые комплексы с ингибиторами или ко-активаторами транскрипции Wnt пути и вступает во взаимодействие с ДНК-связывающими белками семейства TCF/LEF (Xu, Kimelman, 2007; de Jaime-Soguero et al., 2018). Вместе они включают транскрипцию “канонических” (β-катенин-зависимых) генов Wnt ответа: C-MYC, CCND1, AXIN-2, VIMENTIN, SNAIL, MMP2, MMP7, MMP9. Таким образом, β‑катенин инициирует процесс ЭМП (Evans et al., 2010).
В эпителиальных клетках β-катенин локализуется в примембранной области, где входит в комплекс Е-кадгерин–p120-катенин–β-катенин–α-катенин, образующий адгезионные контакты (Katoh, Katoh, 2006). Связь β-катенина с Е-кадгерином свидетельствует о стабильной межклеточной адгезии. GSK3β является ключевым компонентом регуляции канонического Wnt сигнального пути (Katoh, Katoh, 2006; Ding et al., 2010). Подавление экспрессии GSK3β и активирование PI3K/AKT и канонического Wnt сигнальных путей показано на экспериментальной модели травматической ПВР, вызванной у кроликов с помощью интравитреальных инъекций клеток ARPE-19 (Zhang et al., 2018).
В отсутствии Wnt сигнализации GSK3β в комплексе с белками APC–аксин–СК1α связывает и фосфорилирует цитоплазматический β-катенин, что приводит впоследствии к его утилизации при помощи убиквитин-протеасом (Staal, 2016; Nusse, Clevers, 2017). Благодаря этому механизму в отсутствии Wnt стимуляции цитоплазматическая концентрация β-катенина поддерживается на низком уровне (Staal, 2016). Интересным фактом является то, что пул β-катенина адгезионных соединений очень стабилен, тогда как период полураспада сигнального пула β-катенина составляет порядка нескольких минут (Nusse, Clevers, 2017).
При разрушении адгезионных контактов могут активироваться два сигнальных пути: через β-катенин и p120-катенин. Последний может запускать путь p120/Kaiso, в котором транслоцированный в ядро p120-катенин ослабляет репрессорную активность Kaiso (кодируется геном ZBTB33), члена семейства транскрипционных факторов BTB (Broad-Complex, Tramtrack and Bric a brac)/POZ (poxvirus and zinc finger). Известно, что p120-катенин регулирует кадгерин-опосредованные адгезионные контакты, транспортирует кадгерины на мембрану и стабилизирует их на мембране, регулируя динамическую регуляцию актинового цитоскелета, взаимодействует и стабилизирует микротрубочки, а также ингибирует RhoA и другие Rho ГТФазы, тогда как активация передачи сигналов RhoA/ ROCK коррелирует с дестабилизацией микротрубочек, ядерной транслокацией p120 и мечением BrdU (Chen et al., 2012b).
Неконтролируемая передача сигналов Wnt может вызывать заболевания сетчатки, такие как семейная экссудативная витреоретинопатия, пигментный ретинит и болезнь Норри (Lad et al., 2009). Например, причиной семейной экссудативной витреоретинопатии, характеризующейся различными офтальмологическими проявлениями, в том числе развитием рубцов и как следствием отслойкой сетчатки и слепотой, могут быть мутации в генах FZD4 и LRP5 (Xu et al., 2004; Lad et al., 2009). Причиной болезни Норри, при которой наблюдаются такие офтальмологические расстройства, как ретролентальная фиброваскулярная мембрана, тракция и отслоение сетчатки, является мутация в гене NDP. Ген NDP кодирует небольшой секреторный белок норрин (англ. Norrin) (15 кДа), который экспрессируется в сетчатке, головном мозге и обонятельных луковицах и предположительно участвует в нейрогенезе и межклеточном взаимодействии (Rajendran et al., 2021). Norrin взаимодействует с Fzd4, LRP5 и тетраспанином 12 (англ. tetraspanin 12) и может активировать Wnt путь (Xu et al., 2004; Nusse, Clevers, 2017; Rajendran et al., 2021).
Поскольку канонический Wnt путь активируется в глиальных клетках во время повреждения фоторецепторов, возникло предположение об его участии в дегенерации сетчатки (Hackam, 2005). В частности, предполагается, что Wnt сигнальный путь играет роль в поражении сетчатки при ВМД (Tuo et al., 2015). В срезах сетчатки пациентов с ВМД обнаружены более высокие уровни фосфорилирования белка LRP6 и транскриптов генов, нацеленных на Wnt путь, а также более высокий уровень белка β-катенина в макуле ВМД по сравнению с контрольной группой. В сетчатке мышей с моделью ВМД-подобной дегенерации сетчатки также было выше фосфорилированного LRP6 и нефосфорилированного β-катенина, чем у мышей дикого типа. Интравитреальное введение антител против LRP6 замедляло прогрессирование поражений сетчатки у мышей, что может быть полезным для дезактивации канонического пути Wnt у людей (Tuo et al., 2015).
В то же время, в ряде работ, выполненных на взрослых животных, показано, что активация сигнального каскада Wnt путем экзогенного добавления Wnt белков стимулирует заживление различных травм, включая повреждения сетчатки (Whyte et al., 2012). Так, после повреждения или дегенерации сетчатки у мышей активация сигнального пути Wnt способствовала пролиферации клеток Мюллера и регенерации нервной ткани (Osakada et al., 2007). Воздействие Wnt3a на сетчатку с поврежденными фоторецепторами в 20 раз увеличивало пролиферацию дедифференцированных клеток Мюллера (Osakada et al., 2007).
В клетках РПЭ постнатального организма Wnt/β-катенин сигнальный каскад участвует в регуляции экспрессии генов, задействованных в предохранении от окислительного стресса (Burke, 2009; Fragoso et al., 2012). Так, защитная роль Wnt3а-лиганда была продемонстрирована на клеточной линии ARPE-19. Клетки обрабатывали Wnt3а в присутствии и без цитотоксических агентов, таких как перекись водорода и паракват. В результате показана повышенная выживаемость клеток РПЭ, которая опосредовалась еще и активацией STAT3 (Fragoso et al., 2012).
In vitro каноническая передача сигналов Wnt определяет фенотипическую пластичность клеток РПЭ. Как недавно было показано, передача сигналов Wnt регулируется аннексином A8 (ANXA8) (Lueck et al., 2020). Аннексины (англ. Annexins, ANXA1–ANXA11, ANXA13) принадлежат к надсемейству кальций-зависимых белков, связывающих фосфолипиды. Они участвуют в организации и структуре фосфолипидной мембраны и белков цитоскелета и играют важную роль в жизненном цикле клеток, экзоцитозе и апоптозе. В частности, ANXA8 локализуется в мембранных участках, богатых фосфатидилинозитол-4,5-бисфосфатом, где накапливается F-актин. ANXA8 влияет на пролиферацию и миграцию клеток, а также может играть роль в клеточной дифференцировке (Pimiento et al., 2015). Обработка фенретинидом подавляла экспрессию гена ANXA8 и РПЭ-специфических генов (OTX2 и MITF), а также на начальных этапах снижала экспрессию нескольких ключевых генов, участвующих в передаче сигналов Wnt (CTNNB1, FZD1, FZD4, WNT2B и WNT3A), тогда как в последующем их экспрессия повышалась (Lueck et al., 2020). Снижение экспрессии генов Wnt пути сопровождалось повышением экспрессии GSK3β и нейрональных/ретинальных маркеров (кальбиндина и кальретинина) (Lueck et al., 2017, 2020).
Активация передачи сигналов Wnt дополнительно контролируется различными антагонистами, включая фактор ингибирования Wnt1 (англ. WNT inhibitory factor 1, WIF1), Cerberus, Sclerostin, а также членов семейств Dickkopf и secreted Frizzled-related protein (sFRP). Белки Sclerostin и Dickkopf влияют на активность Wnt и противодействуют канонической передаче сигналов, связываясь с LRP5 или LRP6, тогда как WIF1, Cerberus и sFRP могут напрямую взаимодействовать с белками Wnt (Bovolenta et al., 2008).
Семейство sFRP является самым большим семейством ингибиторов Wnt белков, которые не просто связывают Wnt, но и могут противодействовать активности друг друга, а также связываться с Fzd-рецепторами, предотвращая взаимодействие Wnt с этими рецепторами. Более того, sFRP белки могут взаимодействовать с другими рецепторами или молекулами ВКМ (например, фибронектином), действовать в качестве ингибиторов BMP1 (Bovolenta et al., 2008) или влиять на направление аксонов ганглиозных клеток сетчатки (Rodriguez et al., 2005).
У человека семейство sFRP включает пять членов богатых цистеином секретируемых гликопротеинов (около 36 кДа), которые по своей структуре подразделяются на две подгруппы: первая включает sFRP1, sFRP2 и sFRP5, а вторая – sFRP3 и sFRP4 (Esteve et al., 2003; Garcia-Hoyos et al., 2004; Bovolenta et al., 2008). Анализ экспрессии у цыплят, мышей и людей показал, что все члены первой группы экспрессируются как в развивающемся, так и во взрослом глазу. В частности, мРНК sFRP5 локализована в РПЭ человека, тогда как sFRP1 и sFRP2 экспрессируются в недифференцированном нейроэпителии сетчатки цыплят и мышей (Esteve et al., 2003; Garcia-Hoyos et al., 2004; Bovolenta et al., 2008). По мере развития экспрессия sFRP1 специфически поддерживается во внутреннем ядерном и фоторецепторном слоях, по крайней мере, у мыши (Garcia-Hoyos et al., 2004). На основании этого паттерна экспрессии было предположено, что sFRP1 и sFRP5 могут участвовать в определении полярности фоторецепторных клеток. Кроме того, анализ нескольких случаев пигментного ретинита, при котором фоторецепторы дегенерируют путем апоптоза, выявил связь дегенерации фоторецепторов с повышенной регуляцией sFRP1, sFRP2 и sFRP5 (Jones et al., 2000; Garcia-Hoyos et al., 2004). В отличие от этих наблюдений, в исследовании Стива и соавт., проведенном на цыплятах in vitro и in vivo, показано, что sFRP1 модулирует клеточную дифференцировку сетчатки, способствуя образованию ганглиозных и фоторецепторных клеток (колбочек) и, в то же время, уменьшая количество амакриновых клеток (Esteve et al., 2003).
Активация канонического Wnt сигнального пути возможна и при воздействии различных факторов роста, в том числе негативно регулирующих GSK3β. Известно, что TGF-β1 индуцирует протеолитическое отщепление Е-кадгерина, что вызывает ядерную транслокацию β-катенина, индукцию транскрипции Slug и репрессию транскрипции Е-кадгерина в различных типах клеток (Zheng et al., 2009). При воздействии TGF-β1 на клетки ARPE-19 уменьшалась связь между ANXA8 и β-катенином (Lueck et al., 2020).
Механизмы Wnt/β-катенин сигнального пути способны объяснить многие патологические процессы, происходящие при изменении структуры и функции клеток РПЭ. Исследования в этих направлениях активно ведутся, поскольку помогут понять и регулировать не только механизмы ЭМП клеток РПЭ in vivo, но и патологические процессы, происходящих в РПЭ при старении.
Неканонический Wnt сигнальный путь
Интересно, что трансмембранные рецепторные тирозинкиназы ROR2 и RYK, а также Fzd-рецепторы, которые действуют независимо от LRP5 или LRP6, функционируют в качестве рецепторов для Wnt и активируют независимые от β-катенина пути. Это приводит к изменениям в движении и полярности клеток, а также к антагонизму пути β-катенина (Angers, Moon, 2009).
Неканонический Wnt/Ca2+ сигнальный путь активируется лигандами Wnt5a и Wnt11. Связывание Wnt5a с Fzd-2 рецептором активирует G-белки, фосфодиэстеразы и изменяет уровень внутриклеточного кальция, что приводит к активации Ca2+/кальмодулинзависимых киназ (Hackam, 2005). Существуют также доказательства того, что путь Wnt/Ca2+ может противодействовать каноническому пути, повышая интригующие возможности коммуникации и регуляции обратной связи между путями.
Метод “кальциевого выключения” на культуре клеток РПЭ взрослого человека выявил связь между кальций-зависимой адгезией, морфогенезом и пигментацией. Обратимый, зависящий от уровня кальция в ростовой среде, характер изменений в морфологии клеток, заключался в переходе от эпителиального фенотипа с пигментацией к веретенообразным клеткам без пигмента и наоборот (Rak et al., 2006).
Известно, что неканонический Wnt/РСР сигнальный путь стимулируется под действием лигандов Wnt5a, -5b, -7a, -11. В зависимости от клеточного контекста Wnt/РСР путь может активироваться и лигандами Wnt, которые обычно активируют β-катенин-зависимый путь (Daulat, Borg, 2017). Этот путь контролирует активность малых ГТФ-аз семейства Rho (Rac1 и RhoA). Rac-зависимый сигнальный каскад связан с индукцией киназной активности JNK, а Rho-зависимая ветвь сигнального каскада – с активацией ROCK. ROCK вовлечена в регуляцию процесса модификации структур актинового цитоскелета, благодаря чему оказывает значительное влияние на поляризацию и подвижность клеток (Daulat, Borg, 2017).
Однако о влиянии вышеперечисленных Wnt лигандов на клетки РПЭ в настоящее время известно мало. Например, показано, что Wnt5a подавлял каноническую передачу сигналов Wnt в клетках ARPE-19 путем фосфорилирования и деградации β-катенина. Кроме того, Wnt5a снижал уровни VEGF, TNF-α и NF-κB, активированные с помощью Wnt3a. Более того, Wnt5a увеличивал экспрессию E-кадгерина и снижал миграцию клеток за счет подавления экспрессии Snail, тем самым отменяя Wnt3a-индуцированный ЭМП в клетках РПЭ человека (Kim et al., 2015).
Недавно нами на клетках РПЭ взрослого человека ранних пассажей и линии ARPE-19 показано, что среди изученных белков Wnt сигнального пути (Wnt1, Wnt7a и sFRP1) только Wnt7a оказывал видимые биологические эффекты (неопубликованные данные) (рис. 3). Wnt7a ингибировал пролиферативную активность клеток РПЭ по данным МТТ-анализа, способствовал появлению клеток большего размера по данным морфометрического исследования и увеличивал экспрессию мРНК KLF4 (Kuznetsova et al., 2015, 2016) (рис. 4), что вместе свидетельствует в пользу негативной регуляции клеточного цикла после воздействия Wnt7a. Из данных литературы известно, что KLF4 участвует в контроле пролиферации, дифференцировки, миграции и апоптоза клеток (Chen et al., 2003; Tien et al., 2015). Однако сведения об его участии в регуляции пролиферативного ответа клеток противоречивы. По всей видимости, в зависимости от контекста KLF4 может регулировать клеточный цикл либо негативно (Chen et al., 2003; Li et al., 2012), либо позитивно (Tien et al., 2015). Авторы негативной теории предполагают, что конститутивный уровень KLF4 ингибирует пролиферацию, миграцию и адгезию клеток, а потеря KLF4, наоборот, способствует пролиферации (Chen et al., 2003; Li et al., 2012).
Рис. 3.
Неиммортализованные клетки РПЭ взрослого человека 4 пассажа через 24 ч после воздействия 0.4 мкг/мл sFRP1, 2 нг/мл Wnt1 или 60 нг/мл Wnt7a по сравнению с контролем (без добавления факторов). Фазовый контраст, ×100.

Рис. 4.
кПЦР. Уровень экспрессии мРНК ряда генов в клетках ARPE-19 (красные столбики) и неиммортализованных клетках РПЭ взрослого человека 4 пассажа (синие столбики) через 24 ч после воздействия 60 нг/мл Wnt7a относительно соответствующего контроля (в отсутствии Wnt7a), принятого за единицу (штриховая линия). Вертикальные отрезки – стандартное отклонение.

В нашем исследовании, Wnt7a инициировал процесс распластывания клеток РПЭ на пластике, активировал процессы редифференцировки, о чем свидетельствует усиление экспрессии РПЭ-специфичных генов (RPE65, MITF и OTX2) (рис. 4). При этом было отмечено отсутствие окрашивания на MAP1B и βIII-тубулин при одновременном увеличении интенсивности свечения антител к синапсину I и NF 68 и 200 кДа, белкам-маркерам зрелых нейронов, и увеличение экспрессии мРНК PAX6, маркера нейронов сетчатки, что вместе указывает на продвижение нейрональной/ретинальной дифференцировки или понижения уровня дифференцировке клеток (Kuznetsova et al., 2015; Kuznetsova et al., 2016). Отсутствие βIII-тубулина на белковом уровне и сохранение его на транскрипционном уровне согласуется с результатами Хорн и соавт. (Horn et al., 2007). Исследователи на эмбрионах трансгенных мышей показали, что гиперэкспрессия Wnt7a отсрочивает экспрессию белка βIII-тубулина и это способствует контролированию созревания нейрональных прогениторов (Horn et al., 2007). В дополнение к этому, в нашем исследовании, отдельные группки клеток РПЭ окрашивались на нестин, что совместно с увеличением уровней экспрессии мРНК NES, гена-плюрипотентности OCT4 и лиганда Notch сигнального пути JAG1 говорит о поддержании пула нейральных/ретинальных стволовых клеток (Kuznetsova et al., 2016). Повышение BMP1 на транскрипционном уровне в клетках РПЭ под воздействием Wnt7a (рис. 4) не сопровождалось повышением его на уровне белка, что говорит об отсутствии развертывания ЭМП и свидетельствует в пользу данных о редифференцировке клеток РПЭ. Таким образом, на основании полученных данных можно предположить, что in vitro клетки РПЭ оказываются на разных стадиях дедифференцировки и, следовательно, реагируют на воздействие Wnt7a различно: в одних клетках запускается процесс редифференцировки/эпителиальной дифференцировки, тогда как в других – нейральной/ретинальной дифференцировки или дедифференцировки.
Кроме того, под воздействием Wnt7a было отмечено перераспределение синапсина I с перинуклеарного точечного на цитоплазматическое (Kuznetsova et al., 2016) и изменение локализации и снижение интенсивности свечения антител к фокальной адгезивной киназе (англ. focal adhesion kinase, FAK) (неопубликованные данные). Известно, что синапсин I и FAK участвуют в связывании микротрубочек (Valtorta et al., 1992; Schaller, 2010). В исследовании Бустос и соавт. показано, что синапсин I присутствует в эпителиальных клетках ненейронного происхождения, он концентрируется в везикулярном компартменте, прилегающем к транс-элементам комплекса Гольджи, который также обогащен миозином II (Bustos et al., 2001). In vitro синапсин I взаимодействует с различными компонентами цитоматрикса (F-актином, микротрубочками, нейрофиламентами и спектрином), опосредуя прикрепление везикул к цитоскелету и регулируя их движение внутри клетки (Valtorta et al., 1992). Нерецепторная тирозинкиназа FAK играет важную роль в регуляции актинового цитоскелета, клеточной адгезии, миграции, пролиферации и выживания клеток, а также подтверждена роль FAK в контроле микротрубочек и в выполнении важных функций в ядре (Schaller, 2010). Таким образом, отсутствие окрашивания на MAP1B и βIII-тубулин при изменении характера окрашивания на синапсин I и FAK под воздействием Wnt7a в исследовании (Kuznetsova et al., 2016) согласуется с утверждением о деполимеризации микротрубочек при этом.
Как уже было сказано выше, неканонический Wnt/РСР сигнальный путь контролирует RhoA/ ROCK сигнальный каскад, активация которого коррелирует с дестабилизацией микротрубочек (Chen et al., 2012b). Кроме того, как показано в работе Лу и соавт. на клетках HaCaT, деполимеризация микротрубочек способствует увеличению размера ядра (Lu et al., 2012). В нашем исследовании мы также наблюдали увеличение размера ядер клеток РПЭ при воздействии Wnt7a (неопубликованные данные).
Следует отметить, что трансформированные клетки линии ARPE-19 оказались менее чувствительны к воздействию Wnt7a, чем неиммортализованные (собственные наблюдения) (рис. 4). Хотя морфологические и молекулярные изменения в клетках РПЭ взрослого человека, вызванные Wnt7a, носят краткосрочный характер, поскольку белок функционирует как сигнал ближнего действия между соседними клетками, а также из-за отсутствия подходящего микроокружения, Wnt7a можно рассматривать в качестве потенциального терапевтического агента.
Дальнейшее изучение Wnt сигнального пути и механизмов его регулирования даст возможность понять процессы, происходящие с клетками РПЭ при патологии, и использовать эти знания для разработки лекарственных средств нового поколения.
Вышеперечисленные Wnt сигнальные пути являются Fzd-зависимыми, в последнее время стали появляться данные о существовании Fzd-независимых путей.
NOTCH СИГНАЛЬНЫЙ ПУТЬ
Notch сигнальный путь является эволюционно высоко консервативным сигнальным механизмом, который управляет клеточной пролиферацией и решениями клеточной судьбы. В отличие от таких сигнальных путей, как TGF-β/BMP, Wnt и Hh, передача сигналов Notch происходит посредством межклеточной коммуникации, где трансмембранные лиганды на одной клетке активируют трансмембранные рецепторы на расположенной рядом клетке (Siebel, Lendahl, 2017). Известно, что у млекопитающих имеется 5 трансмембранных лигандов (Jagged (Jag) 1 и 2, Delta-like (DLL) 1, 3 и 4) и 4 рецептора Notch (1–4). В нейрогенезе участвует Notch1 и Notch2, в то время как в эндотелиальных клетках сосудов преимущественно экспрессируется Notch4 (Iso et al., 2003).
Рецептор Notch синтезируется в эндоплазматическом ретикулуме и транспортируется к плазматической мембране. Взаимодействие рецептора с трансмембранным лигандом на соседней клетке приводит к двум последовательным протеолитическим реакциям. Первое расщепление производится внеклеточно с помощью металлопротеиназы Tumour necrosis factor-α-converting enzyme (TACE)/ A Disintegrin and Metalloproteinase (ADAM), обеспечивающей удаление внеклеточного домена Notch рецептора (англ. Notch extracellular domain, NECD). Закрепленный в мембране С-терминальный фрагмент, который остается после первого расщепления, подвергается конформационному изменению. В результате этого активируется прилежащая к мембране специфическая протеаза, γ-секретаза (англ. γ-secretase). Такое внутримембранное расщепление высвобождает внутриклеточный домен Notch (англ. Notch intracellular domain, NotchICD), который транслоцируется в ядро клетки (Siebel, Lendahl, 2017). Показано, что апикальный белок CRB2 человека ингибируют расщепление Notch1 и передачу сигналов путем связывания с пресенилиновым комплексом (англ. presenilin complex), ингибируя активность γ-секретазы (Mitsuishi et al., 2010).
В ядре клетки NotchICD взаимодействует с транскрипционным фактором CSL (сокращение от CBF1 (C promoter binding factor 1) у человека, RBP-Jk (Recombining binding protein for immunoglobulin kappa J region) у грызунов, Su(H) (Suppressor of Hairless) у дрозофил и Lag-1 (Longevity-assurance gene-1) у нематод) для регуляции транскрипции нижестоящих генов (MHC I класса, CD23, IL-6, β-глобин, ErbB2, NF-κB2, CCND1, C-MYC, p27KIP1, гены семейств HES (Hairy-enhancer-of-split) и HEY (Hairy-enhancer-of-split related with YRPW motif)) (Andersson et al., 2011; Falo-Sanjuan, Bray, 2020). В результате происходит регуляция пролиферации, дифференцировки, апоптоза и самоподдержания стволовых клеток, что сильно зависит от контекста и типа клеток (Siebel, Lendahl, 2017).
Гены семейств HES и HEY кодируют ядерные белки, относящиеся к классу транскрипционных факторов с основным доменом bHLH. Из семи членов семейства генов HES в поддержании стволовых и прогениторных клеток через ингибирование дифференцировки участвуют гены HES1, HES5 и HES7, из семейства HEY – HEY1, HEY2 и HEYL (Siebel, Lendahl, 2017). Потеря апикальных белков CRB1 и CRB2 в сетчатке мышей, имитирующая врожденный амавроз Лебера человека, приводила к нарушению регуляции генов-мишеней Notch1 (Hey1 и Heyl) и YAP/Hippo сигнальных путей и повышению уровня p120-катенина, что сопровождалось изменением хода клеточного цикла и увеличением числа митотических клеток (Pellissier et al., 2013).
Имеющиеся данные о роли сигнального пути Notch в регуляции дифференцировки РПЭ получены только на модельных животных. Показано, что на ранних стадиях эмбрионального развития мыши Hes1 экспрессируется в формирующихся хрусталиках, глазных пузырях и пигментированном эпителии и необходим для правильного роста, морфогенеза и дифференцировки этих тканей (Bao, Cepko, 1997; Lee et al., 2005). Активация Notch сигнального пути в эмбриональном развитии мыши приводит к гиперпролиферации и злокачественным новообразованиям в клетках РПЭ у взрослого животного (Schouwey et al., 2011).
In vitro блокирование передачи сигнала Notch ингибирует миграцию и пролиферацию клеток ARPE-19 и снижает уровни экспрессии генов-мишеней передачи сигналов Notch, включая HES1, С-MYC, HEY2 и SOX9 (Liu et al., 2013).
Как было отмечено ранее, передача сигналов Notch может перекрестно взаимодействовать как с каноническими Smad-зависимыми, так и с неканоническими путями передачи сигналов TGF-β в клетках РПЭ в течение ЭМП (Chen et al., 2014a). Кроме того, показано, что ключевые участники сигнального пути Notch, включая JAG1, NOTCH3, HES1 и HEY1, активируются в клетках РПЭ человека после воздействия TGF-β2, тогда как блокада этого пути с помощью DAPT полностью обращает TGF-β2-индуцированный ЭМП (Chen et al., 2014a).
Тесным союзником Notch является сигнальный путь Wnt, их взаимодействия происходят на многих уровнях, включая физическое взаимодействие между NotchICD и ключевыми регуляторами Wnt пути, а также фосфорилирование NotchICD с помощью GSK3β (Glazer et al., 2008; Siebel, Lendahl, 2017).
Notch сигнальный путь взаимодействует не только с TGF-β/BMP и Wnt, но существуют доказательства его совместной работы с другими путями, такими как Hh и NF-κB (Schouwey, Beermann, 2008).
Однако роль этой совместной работы в фенотипических изменениях РПЭ мало изучена. Нацеливание на передачу сигналов Notch может обеспечить новый подход к лечению офтальмологических заболеваний, связанных с клетками РПЭ.
ЗАКЛЮЧЕНИЕ
РПЭ выполняет ряд важных функций, необходимых для поддержания структурной целостности хориокапилляров и фоторецепторов. В результате разрыва сетчатки клетки РПЭ подвергаются действию сыворотки крови или стекловидного тела, которые содержат множество факторов роста, цитокинов и хемокинов, которые активируют клетки РПЭ, подвергая их ЭМП. ЭМП клеток РПЭ и функциональная дегенерация этих клеток способствуют развитию нескольких заболеваний сетчатки, включая ПВР и ВМД. Однако молекулярные механизмы, лежащие в основе ЭМП в клетках РПЭ, остаются неуловимыми. Поиск факторов, регулирующих дифференцировку РПЭ, несомненно, представляет фундаментальный и прикладной интерес. В этом обзоре сделан акцент на роли основных сигнальных путей, включая TGF-β/BMP, FGF2/FGFR, Wnt и Notch пути, в регуляции клеточных и молекулярных механизмов дедифференцировки РПЭ и ЭМП, которые были в значительной степени определены при изучении эффектов различных сигнальных молекул in vitro. Ряд исследований показал, что зрелые клетки РПЭ in vitro подвергаются дедифференцировке, они теряют межклеточный контакт и пигментацию, пролиферируют и экспрессируют маркеры, не характерные для РПЭ, что приводит к изменению фенотипа клеток. Экспрессия нейральных/ретинальных маркеров в нейроэпителиальных клетках РПЭ in vitro указывает на снижение клеточной дифференцировки. Важно отметить, что клетки РПЭ in vitro не теряют полностью своих эпителиальных свойств. Эта предполагаемая пластичность означает, что клетки могут задерживаться на промежуточных стадиях и что они могут подвергаться частичному ЭМП, отражая то, что происходит in vivo. Регуляция мезенхимальной пластичности и дедифференцировки клеток РПЭ при развитии пролиферативных витреоретинальных заболеваний и при трансплантации клеток РПЭ, полученных из ESCs и iPSCs, является важной задачей как для разработки специфической терапии ПВР, так и для широкомасштабного использования клеток РПЭ в регенеративной медицине.
Как следует из приведенных выше данных, значительное количество внеклеточных факторов и внутриклеточных медиаторов играет важную роль в ЭМП клеток РПЭ и может выступать в качестве потенциальных мишеней при лечении ПВР. Тем не менее, остаются серьезные вопросы об ЭМП в клетках РПЭ. Поскольку большинство экспериментов по ЭМП клеток РПЭ основано на клеточных моделях и, в частности, на ARPE-19 линии, все еще трудно проанализировать относительный вклад ЭМП клеток РПЭ при ПВР. Кроме того, требуется осторожность при экстраполяции результатов, полученных в культуральной модели in vitro, на сложную среду живой сетчатки. Помимо клеток РПЭ в патогенезе ПВР участвуют и другие типы клеток, например гиалоциты и глиальные клетки, которые также вносят вклад в производство матрикса и фиброз. Кроме того, клетки РПЭ и сетчатки имеют разные метаболические пути, поэтому фармакологическое ингибирование дедифференцировки и пролиферации клеток РПЭ, может оказаться неблагоприятным для нейральной сетчатки. В дополнение к этому, поскольку ЭМП является лишь одним из признаков патогенеза ПВР, другие патологические изменения, способствующие ПВР, также требуют внимания.
Изучение клеточных и молекулярных механизмов, лежащих в основе дедифференцировки клеток РПЭ, и путей их регуляции требует продолжения. Кроме того, интересно изучить и другие пути, которые участвуют в регенерации сетчатки, в том числе Shh. Это необходимо для более глубокого понимания этиопатогенеза патологий РПЭ и для определения новых мишеней, вовлеченных в процесс повреждения РПЭ.
Список литературы
Adijanto J., Castorino J.J., Wang Z.X. et al. Microphthalmia-associated transcription factor (MITF) promotes differentiation of human retinal pigment epithelium (RPE) by regulating microRNAs-204/211 expression // J. Biol. Chem. 2012. V. 287. № 24. P. 20491–20503.
Ambati J., Atkinson J.P., Gelfand B.D. Immunology of age-related macular degeneration // Nat. Rev. Immunol. 2013. V. 13. № 6. P. 438–451.
Ambati J., Fowler B.J. Mechanisms of age-related macular degeneration // Neuron. 2012. V. 75. № 1. P. 26–39.
Amemiya K., Haruta M., Takahashi M. et al. Adult human retinal pigment epithelial cells capable of differentiating into neurons // Biochem. Biophys. Res. Commun. 2004. V. 316. № 1. P. 1–5.
Amin R., Puklin J.E., Frank R.N. Growth factor localization in choroidal neovascular membranes of age-related macular degeneration // Invest. Ophthalmol. Vis. Sci. 1994. V. 35. № 8. P. 3178–3188.
Anderson D.H., Guerin C.J., Hageman G.S. et al. Distribution of transforming growth factor-β isoforms in the mammalian retina // J. Neurosci. Res. 1995. V. 42. № 1. P. 63–79.
Andersson E.R., Sandberg R., Lendahl U. Notch signaling: Simplicity in design, versatility in function // Development. 2011. V. 138. № 17. P. 3593–3612.
Angers S., Moon R.T. Proximal events in Wnt signal transduction // Nat. Rev. Mol. Cell Biol. 2009. V. 10. № 7. P. 468–477.
Arnaud E., Touriol C., Boutonnet C. et al. A new 34-kilodalton isoform of human fibroblast growth factor 2 is cap dependently synthesized by using a non-AUG start codon and behaves as a survival factor // Mol. Cell. Biol. 1999. V. 19. № 1. P. 505–514.
Bakiri L., MacHo-Maschler S., Custic I. et al. Fra-1/AP-1 induces EMT in mammary epithelial cells by modulating Zeb1/2 and TGFβ expression // Cell Death Differ. 2015. V. 22. № 2. P. 336–350.
Banerjee S., Savant V., Scott R.A.H. et al. Multiplex bead analysis of vitreous humor of patients with vitreoretinal disorders // Investig. Ophthalmol. Vis. Sci. 2007. V. 48. № 5. P. 2203–2207.
Bao Z.Z., Cepko C.L. The expression and function of Notch pathway genes in the developing rat eye // J. Neurosci. 1997. V. 17. № 4. P. 1425–1434.
Baudouin C., Fredj-Reygrobellet D., Brignole F. et al. Growth factors in vitreous and subretinal fluid cells from patients with proliferative vitreoretinopathy // Ophthalmic Res. 1993. V. 25. № 1. P. 52–59.
Bharti K., Nguyen M.-T.T., Skuntz S. et al. The other pigment cell: specification and development of the pigmented epithelium of the vertebrate eye // Pigment Cell Res. 2006. V. 19. № 5. P. 380–394.
Boles N.C., Fernandes M., Swigut T. et al. Epigenomic and transcriptomic changes during human RPE EMT in a stem cell model of epiretinal membrane pathogenesis and prevention by nicotinamide // Stem Cell Reports. 2020. V. 14. № 4. P. 631–647.
Bost L.M., Hjelmeland L.M. Cell density regulates differential production of bFGF transcripts // Growth Factors. 1993. V. 9. № 3. P. 195–203.
Boureux A., Vignal E., Faure S., Fort P. Evolution of the Rho family of Ras-like GTPases in eukaryotes // Mol. Biol. Evol. 2007. V. 24. № 1. P. 203–216.
Bovolenta P., Esteve P., Ruiz J.M. et al. Beyond Wnt inhibition: new functions of secreted Frizzled-related proteins in development and disease // J. Cell Sci. 2008. V. 121. № 6. P. 737–746.
Bragdon B., Moseychuk O., Saldanha S. et al. Bone morphogenetic proteins: a critical review // Cell. Signal. 2011. V. 23. № 4. P. 609–620.
Buchholz D.E., Pennington B.O., Croze R.H. et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium // Stem Cells Transl. Med. 2013. V. 2. № 5. P. 384–393.
Bustelo X.R., Sauzeau V., Berenjeno I.M. GTP-binding proteins of the Rho/Rac family: regulation, effectors and functions in vivo // BioEssays. 2007. V. 29. № 4. P. 356–370.
Bustos R., Kolen E.R., Braiterman L. et al. Synapsin I is expressed in epithelial cells: localization to a unique trans-Golgi compartment // J. Cell Sci. 2001. V. 114. № 20. P. 3695–3704.
Caputto B.L., Cardozo Gizzi A.M., Gil G.A. c-Fos: An AP-1 transcription factor with an additional cytoplasmic, non-genomic lipid synthesis activation capacity // Biochim. Biophys. Acta Mol. Cell Biol. Lipids. 2014. V. 1841. № 9. P. 1241–1246.
Carr A.J., Vugler A.A., Yu L. et al. The expression of retinal cell markers in human retinal pigment epithelial cells and their augmentation by the synthetic retinoid fenretinide // Mol. Vis. 2011. V. 17. P. 1701–1715.
Casco-Robles M.M., Islam M.R., Inami W. et al. Turning the fate of reprogramming cells from retinal disorder to regeneration by Pax6 in newts // Sci. Rep. 2016. V. 6.
Chen H.C., Zhu Y.T., Chen S.Y., Tseng S.C. Wnt signaling induces epithelial-mesenchymal transition with proliferation in ARPE-19 cells upon loss of contact inhibition // Lab. Investig. 2012a. V. 92. № 5. P. 676–687.
Chen H.C., Zhu Y.T., Chen S.Y., Tseng S.C.G. Selective activation of p120ctn-Kaiso signaling to unlock contact inhibition of ARPE-19 cells without epithelial-mesenchymal transition // PLoS One. 2012b. V. 7. № 5.
Chen S., Yuan M., Liu Y. et al. Landscape of microRNA in the aqueous humour of proliferative diabetic retinopathy as assessed by next-generation sequencing // Clin. Experiment. Ophthalmol. 2019. V. 47. № 7. P. 925–936.
Chen X., Whitney E.M., Gao S.Y., Yang V.W. Transcriptional profiling of Krüppel-like factor 4 reveals a function in cell cycle regulation and epithelial differentiation // J. Mol. Biol. 2003. V. 326. № 3. P. 665–677.
Chen X., Xiao W., Wang W. et al. The complex interplay between ERK1/2, TGFβ/Smad, and Jagged/Notch signaling pathways in the regulation of epithelial-mesenchymal transition in retinal pigment epithelium cells // PLoS One. 2014a. V. 9. № 5. P. e96365.
Chen X., Ye S., Xiao W. et al. Differentially expressed microRNAs in TGFβ2-induced epithelial-mesenchymal transition in retinal pigment epithelium cells // Int. J. Mol. Med. 2014b. V. 33. № 5. P. 1195–1200.
Chen Y.J., Tsai R.K., Wu W.C. et al. Enhanced PKCδ and ERK signaling mediate cell migration of retinal pigment epithelial cells synergistically induced by HGF and EGF // PLoS One. 2012c. V. 7. № 9. P. e44937.
Cheng H.-C., Ho T.-C., Chen S.-L. et al. Troglitazone suppresses transforming growth factor beta-mediated fibrogenesis in retinal pigment epithelial cells // Mol. Vis. 2008. V. 14. P. 95–104.
Chiba C. The retinal pigment epithelium: an important player of retinal disorders and regeneration // Exp. Eye Res. 2014. V. 123. P. 107–114.
Chiba C., Mitashov V. Cellular and molecular events in the adult newt retinal regeneration // Strategies for Retinal Tissue Repair and Regeneration in Vertebrates: From Fish to Human / Eds. Chiba C., Mitashov V. Trivandrum, India: Research Signpost, 2007. С. 15–33.
Chien H.W., Wang K., Chang Y.Y. et al. Kaempferol suppresses cell migration through the activation of the ERK signaling pathways in ARPE-19 cells // Environ. Toxicol. 2019. V. 34. № 3. P. 312–318.
Choudhary P., Dodsworth B.T., Sidders B. et al. A FOXM1 dependent mesenchymal-epithelial transition in retinal pigment epithelium cells // PLoS One. 2015. V. 10. № 6. P. e0130379.
Chung E.J., Chun J.N., Jung S.A. et al. TGF-β-stimulated aberrant expression of class III β-tubulin via the ERK signaling pathway in cultured retinal pigment epithelial cells // Biochem. Biophys. Res. Commun. 2011. V. 415. № 2. P. 367–372.
Connor T.B., Roberts A.B., Sporn M.B. et al. Correlation of fibrosis and transforming growth factor-β type 2 levels in the eye // J. Clin. Invest. 1989. V. 83. № 5. P. 1661–1666.
Cook B., Lewis G.P., Fisher S.K., Adler R. Apoptotic photoreceptor degeneration in experimental retinal detachment // Invest. Ophthalmol. Vis. Sci. 1995. V. 36. № 6. P. 990–996.
Corral R.D. del, Olivera-Martinez I., Goriely A. et al. Opposing FGF and retinoid pathways control ventral neural pattern, neuronal differentiation, and segmentation during body axis extension // Neuron. 2003. V. 40. № 1. P. 65–79.
Cui L., Lyu Y., Jin X. et al. miR-194 suppresses epithelial-mesenchymal transition of retinal pigment epithelial cells by directly targeting ZEB1 // Ann. Transl. Med. 2019. V. 7. № 23. P. 751.
Daulat A.M., Borg J.-P. Wnt/planar cell polarity signaling: new opportunities for cancer treatment // Trends in Cancer. 2017. V. 3. № 2. P. 113–125.
Deji Q.Z., Yan F., Zhaba W.D. et al. Cross-talk between microRNA-let7c and transforming growth factor-β2 during epithelial-to-mesenchymal transition of retinal pigment epithelial cells // Int. J. Ophthalmol. 2020. V. 13. № 5. P. 693–700.
Ding V.M.Y., Ling L., Natarajan S. et al. FGF-2 modulates Wnt signaling in undifferentiated hESC and iPS cells through activated PI3-K/GSK3β signaling // J. Cell. Physiol. 2010. V. 225. № 2. P. 417–428.
Donato L., Bramanti P., Scimone C. et al. miRNAexpression profile of retinal pigment epithelial cells under oxidative stress conditions // FEBS Open Bio. 2018. V. 8. № 2. P. 219–233.
Dudley A.T., Lyons K.M., Robertson E.J. A requirement for bone morphogenetic protein-7 during development of the mammalian kidney and eye // Genes Dev. 1995. V. 9. № 22. P. 2795–2807.
Dvashi Z., Goldberg M., Adir O. et al. TGF-β1 induced transdifferentiation of RPE cells is mediated by TAK1 // PLoS One. 2015. V. 10. № 4.
El-Ghrably I.A., Dua H.S., Orr G.M. et al. Intravitreal invading cells contribute to vitreal cytokine milieu in proliferative vitreoretinopathy // Br. J. Ophthalmol. 2001. V. 85. № 4. P. 461–470.
Engelhardt M., Bogdahn U., Aigner L. Adult retinal pigment epithelium cells express neural progenitor properties and the neuronal precursor protein doublecortin // Brain Res. 2005. V. 1040. № 1–2. P. 98–111.
Esser P., Weller M., Bresgen M. et al. The effects of basic fibroblast growth factor on bovine retinal pigment epithelium in vitro // Ger. J. Ophthalmol. 1992. V. 1. № 1. P. 58–61.
Esteve P., Trousse F., Rodríguez J., Bovolenta P. SFRP1 modulates retina cell differentiation through a β-catenin-independent mechanism // J. Cell Sci. 2003. V. 116. № 12. P. 2471–2481.
Evans P.M., Chen X., Zhang W., Liu C. KLF4 interacts with beta-catenin/TCF4 and blocks p300/CBP recruitment by beta-catenin. // Mol. Cell. Biol. 2010. V. 30. № 2. P. 372–381.
Falo-Sanjuan J., Bray S.J. Decoding the Notch signal // Dev. Growth Differ. 2020. V. 62. № 1. P. 4–14.
Fasler-Kan E., Wunderlich K., Hildebrand P. et al. Activated STAT3 in choroidal neovascular membranes of patients with age-related macular degeneration // Ophthalmologica. 2005. V. 219. № 4. P. 214–221.
Ferguson H.R., Smith M.P., Francavilla C. Fibroblast growth factor receptors (FGFRs) and noncanonical partners in cancer signaling // Cells. 2021. V. 10. № 5. P. 1201.
Finnemann S.C., Chang Y. Photoreceptor–RPE interactions // Visual Transduction and Non-Visual Light Perception.: Humana Press, 2008. P. 67–86.
Friedlander M. Fibrosis and diseases of the eye // J. Clin. Invest. 2007. V. 117. № 3. P. 576–586.
Fuchs H.R., Meister R., Lotke R., Framme C. The micro-RNAs miR-302d and miR-93 inhibit TGFB-mediated EMT and VEGFA secretion from ARPE-19 cells // Exp. Eye Res. 2020. V. 201. P. 108258.
Fuhrmann S., Zou C.J., Levine E.M. Retinal pigment epithelium development, plasticity, and tissue homeostasis // Exp. Eye Res. 2014. V. 123. P. 141–150.
Fujimura N., Taketo M.M., Mori M. et al. Spatial and temporal regulation of Wnt/beta-catenin signaling is essential for development of the retinal pigment epithelium // Dev. Biol. 2009. V. 334. № 1. P. 31–45.
Furuta Y., Hogan B.L.M. BMP4 is essential for lens induction in the mouse embryo // Genes Dev. 1998. V. 12. № 23. P. 3764–3775.
Galy A., Néron B., Planque N. et al. Activated MAPK/ERK kinase (MEK-1) induces transdifferentiation of pigmented epithelium into neural retina // Dev. Biol. 2002. V. 248. № 2. P. 251–264.
Ganti R., Hunt R.C., Parapuram S.K., Hunt D.M. Vitreous modulation of gene expression in low-passage human retinal pigment epithelial cells // Investig. Ophthalmol. Vis. Sci. 2007. V. 48. № 4. P. 1853–1863.
Garcia-Hoyos M., Cantalapiedra D., Arroyo C. et al. Evaluation of SFRP1 as a candidate for human retinal dystrophies // Mol. Vis. 2004. V. 10. P. 426–431.
Geller S.F., Lewis G.P., Fisher S.K. FGFR1, signaling, and AP-1 expression after retinal detachment: reactive Müller and RPE cells // Invest. Ophthalmol. Vis. Sci. 2001. V. 42. № 6. P. 1363–1369.
Ghosh S., Shang P., Terasaki H. et al. A role for βA3/A1-crystallin in type 2 EMT of RPE cells occurring in dry age-related macular degeneration // Investig. Ophthalmol. Vis. Sci. 2018. V. 59. № 4. P. AMD104–AMD113.
Glazer R.I., Wang X.Y., Yuan H., Yin Y. Musashil: a stem cell marker no longer in search of a function // Cell Cycle. 2008. V. 7. № 17. P. 2635–2639.
Go Y.M., Zhang J., Fernandes J. et al. MTOR-initiated metabolic switch and degeneration in the retinal pigment epithelium // FASEB J. 2020. V. 34. № 9. P. 12502–12520.
Gonzalez D.M., Medici D. Signaling mechanisms of the epithelial-mesenchymal transition // Sci. Signal. 2014. V. 7. № 344. P. re8.
Grisanti S., Guidry C. Transdifferentiation of retinal pigment epithelial cells from epithelial to mesenchymal phenotype // Invest. Ophthalmol. Vis. Sci. 1995. V. 36. № 2. P. 391–405.
Györfi A.H., Matei A.E., Distler J.H.W. Targeting TGF-β signaling for the treatment of fibrosis // Matrix Biol. 2018. V. 68–69. P. 8–27.
Hackam A.S. The Wnt signaling pathway in retinal degenerations // IUBMB Life. 2005. V. 57. № 6. P. 381–388.
Hageman G.S., Kirchoff-Rempe M.A., Lewis G.P. et al. Sequestration of basic fibroblast growth factor in the primate retinal interphotoreceptor matrix // Proc. Natl. Acad. Sci. 1991. V. 88. № 15. P. 6706–6710.
Hardwick C., Feist R., Morris R. et al. Tractional force generation by porcine Müller cells: stimulation by growth factors in human vitreous // Invest. Ophthalmol. Vis. Sci. 1997. V. 38. № 1. P. 2053–2063.
Hazim R.A., Volland S., Yen A. et al. Rapid differentiation of the human RPE cell line, ARPE-19, induced by nicotinamide // Exp. Eye Res. 2019. V. 179. P. 18–24.
Heij E.C. La, Waarenburg M.P.H. Van De, Blaauwgeers H.G.T. et al. Basic fibroblast growth factor, glutamine synthetase, and interleukin-6 in vitreous fluid from eyes with retinal detachment complicated by proliferative vitreoretinopathy // Am. J. Ophthalmol. 2002. V. 134. № 3. P. 367–375.
Hernández C., Burgos R., Cantón A. et al. Vitreous levels of vascular cell adhesion molecule and vascular endothelial growth factor in patients with proliferative diabetic retinopathy: A case-control study // Diabetes Care. 2001. V. 24. № 3. P. 516–521.
Horn Z., Papachristou P., Shariatmadari M. et al. Wnt7a overexpression delays beta-tubulin III expression in transgenic mouse embryos // Brain Res. 2007. V. 1130. № 1. P. 67–72.
Huang L., Zhang C., Su L., Song Z. GSK3β attenuates TGF-β1 induced epithelial–mesenchymal transition and metabolic alterations in ARPE-19 cells // Biochem. Biophys. Res. Commun. 2017. V. 486. № 3. P. 744–751.
Huang X., Wei Y., Ma H., Zhang S. Vitreous-induced cytoskeletal rearrangements via the Rac1 GTPase-dependent signaling pathway in human retinal pigment epithelial cells // Biochem. Biophys. Res. Commun. 2012. V. 419. № 2. P. 395–400.
Hunt D.M., Chen W.H., Hunt R.C. Vitreous treatment of retinal pigment epithelial cells results in decreased expression of FGF-2 // Invest. Ophthalmol. Vis. Sci. 1998. V. 39. № 11. P. 2111–2120.
Huynh L.K., Hipolito C.J., Dijke P. Ten. A perspective on the development of TGF-β inhibitors for cancer treatment // Biomolecules. 2019. V. 9. № 11.
Idelson M., Alper R., Obolensky A. et al. Directed differentiation of human embryonic stem cells into functional retinal pigment epithelium cells // Cell Stem Cell. 2009. V. 5. № 4. P. 396–408.
Ishikawa K., He S., Terasaki H. et al. Resveratrol inhibits epithelial-mesenchymal transition of retinal pigment epithelium and development of proliferative vitreoretinopathy // Sci. Rep. 2015. V. 5.
Iso T., Kedes L., Hamamori Y. HES and HERP families: multiple effectors of the Notch signaling pathway // J. Cell. Physiol. 2003. V. 194. № 3. P. 237–255.
Jaime-Soguero A. de, Abreu de Oliveira W., Lluis F. The pleiotropic effects of the canonical Wnt pathway in early development and pluripotency // Genes (Basel). 2018. V. 9. № 2. P. pii:E93.
Jayaram H., Phillips J.I., Lozano D.C. et al. Comparison of MicroRNA expression in aqueous humor of normal and primary open-angle glaucoma patients using PCR arrays: a pilot study // Investig. Opthalmology Vis. Sci. 2017. V. 58. № 7. P. 2884.
Jiang C., Xie P., Sun R. et al. C-Jun-mediated microRNA-302d-3p induces RPE dedifferentiation by targeting p21Waf1/Cip1 article // Cell Death Dis. 2018. V. 9. № 5.
Jones S.E., Jomary C., Grist J. et al. Modulated expression of secreted Frizzled-related proteins in human retinal degeneration // Neuroreport. 2000. V. 11. № 18. P. 3963–3967.
Jun J.H., Joo C.K. MicroRNA-124 controls transforming growth factor β1–induced epithelial–mesenchymal transition in the retinal pigment epithelium by targeting RHOG // Investig. Ophthalmol. Vis. Sci. 2016. V. 57. № 1. P. 12–20.
Kashani A.H., Lebkowski J.S., Rahhal F.M. et al. A bioengineered retinal pigment epithelial monolayer for advanced, dry age-related macular degeneration // Sci. Transl. Med. 2018. V. 10. № 435. P. eaao4097.
Katoh M., Katoh M. Cross-talk of WNT and FGF signaling pathways at GSK3beta to regulate beta-catenin and SNAIL signaling cascades // Cancer Biol. Ther. 2006. V. 5. № 9. P. 1059–1064.
Katsetos C.D., Herman M.M., Mörk S.J. Class III β-tubulin in human development and cancer // Cell Motil. Cytoskeleton. 2003. V. 55. № 2. P. 77–96.
Katsura Y., Okano T., Noritake M. et al. Hepatocyte growth factor in vitreous fluid of patients with proliferative diabetic retinopathy and other retinal disorders // Diabetes Care. 1998. V. 21. № 10. P. 1759–1763.
Kauppinen A., Paterno J.J., Blasiak J. et al. Inflammation and its role in age-related macular degeneration // Cell. Mol. Life Sci. 2016. V. 73. № 9. P. 1765–1786.
Khaliq A., Jarvis-Evans J., McLeod D., Boulton M. Oxygen modulates the response of the retinal pigment epithelium to basic fibroblast growth factor and epidermal growth factor by receptor regulation // Invest. Ophthalmol. Vis. Sci. 1996. V. 37. № 2. P. 436–443.
Khera S., Tiwari A., Srinivasan R. et al. Molecular and morphological evidence for cadaver vitreous-stimulated transformation of differentiation-competent retinal pigment epithelial cells into neuron-like cells // Curr. Eye Res. 2012. V. 37. № 7. P. 606–616.
Kim J.H., Park S., Chung H., Oh S. Wnt5a attenuates the pathogenic effects of the Wnt/β-catenin pathway in human retinal pigment epithelial cells via down-regulating β-catenin and Snail // BMB Rep. 2015. V. 48. № 9. P. 525–530.
Kim S.J., Kim Y.S., Kim J.H. et al. Activation of ERK1/2-mTORC1-NOX4 mediates TGF-β1-induced epithelial-mesenchymal transition and fibrosis in retinal pigment epithelial cells // Biochem. Biophys. Res. Commun. 2020. V. 529. № 3. P. 747–752.
Kita T., Hata Y., Arita R. et al. Role of TGF-β in proliferative vitreoretinal diseases and ROCK as a therapeutic target // Proc. Natl. Acad. Sci. U. S. A. 2008. V. 105. № 45. P. 17504–17509.
Kita T., Hata Y., Kano K. et al. Transforming growth factor-β2 and connective tissue growth factor in proliferative vitreoretinal diseases: Possible involvement of hyalocytes and therapeutic potential of rho kinase inhibitor // Diabetes. 2007a. V. 56. № 1. P. 231–238.
Kita T., Hata Y., Miura M. et al. Functional characteristics of connective tissue growth factor on vitreoretinal cells // Diabetes. 2007b. V. 56. № 5. P. 1421–1428.
Kole C., Klipfel L., Yang Y. et al. Otx2-genetically modified retinal pigment epithelial cells rescue photoreceptors after transplantation // Mol. Ther. 2018. V. 26. № 1. P. 219–237.
Komiya Y., Habas R. Wnt signal transduction pathways // Organogenesis. 2008. V. 4. № 2. P. 68–75.
Kutty R.K., Samuel W., Boyce K. et al. Proinflammatory cytokines decrease the expression of genes critical for RPE function // Mol. Vis. 2016. V. 22. P. 1156–1168.
Kuznetsova A., Aleksandrova M., Kurinov A. et al. Plasticity of adult human retinal pigment epithelial cells // Int. J. Clin. Exp. Med. 2016. V. 9. № 11. P. 20892–20906.
Kuznetsova A. V., Kurinov A.M., Aleksandrova M.A. Cell models to study regulation of cell transformation in pathologies of retinal pigment epithelium // J. Ophthalmol. 2014. V. 2014. P. 1–18.
Kuznetsova A.V., Kurinov A.M., Chentsova E.V. et al. Effect of hrWnt7a on human retinal pigment epithelial cells in vitro // Bull. Exp. Biol. Med. 2015. V. 159. № 4. P. 534–540.
Kuznetsova A.V., Kurinov A.M., Rzhanova L.A., Aleksandrova M.A. Mechanisms of dedifferentiation of adult human retinal pigment epithelial cells in vitro. Morphological and molecular genetic analysis // Cell Tissue Biol. 2019a. V. 13. № 2. P. 107–119.
Kuznetsova A.V., Rzhanova L.A., Kurinov A.M., Aleksandrova M.A. Effect of basic fibroblast growth factor on signaling pathways in adult human retinal pigment epithelial cells // Cell Tissue Biol. 2019b. V. 13. № 4. P. 292–304.
Kuznetsova A.V., Grigoryan E.N., Aleksandrova M.A. Human adult retinal pigment epithelial cells as potential cell source for retina recovery // Cell Tissue Biol. 2011. V. 5. № 5. P. 495–502.
Kvanta A. Expression and secretion of transforming growth factor-β in transformed and nontransformed retinal pigment epithelial cells // Ophthalmic Res. 1994. V. 26. № 6. P. 361–367.
Lad E.M., Cheshier S.H., Kalani M.Y.S. Wnt-signaling in retinal development and disease // Stem Cells Dev. 2009. V. 18. № 1. P. 7–16.
Lam J.K.W., Chow M.Y.T., Zhang Y., Leung S.W.S. siRNA versus miRNA as therapeutics for gene silencing // Mol. Ther. – Nucleic Acids. 2015. V. 4. № 9. P. e252.
Lee H., O’Meara S.J., O’Brien C., Kane R. The role of gremlin, a BMP antagonist, and epithelial-to-mesenchymal transition in proliferative vitreoretinopathy // Investig. Ophthalmol. Vis. Sci. 2007. V. 48. № 9. P. 4291–4299.
Lee H.Y., Wroblewski E., Philips G.T. et al. Multiple requirements for Hes 1 during early eye formation // Dev. Biol. 2005. V. 284. № 2. P. 464–478.
Lee J., Ko M., Joo C.-K. Rho plays a key role in TGF-beta1-induced cytoskeletal rearrangement in human retinal pigment epithelium // J. Cell. Physiol. 2008. V. 216. № 2. P. 520–526.
Lei H., Rheaume M.-A., Kazlauskas A. Recent developments in our understanding of how platelet-derived growth factor (PDGF) and its receptors contribute to proliferative vitreoretinopathy // Exp. Eye Res. 2010. V. 90. № 3. P. 376–381.
Li H., Wang H., Wang F. et al. Snail involves in the transforming growth factor β1-mediated epithelial-mesenchymal transition of retinal pigment epithelial cells // PLoS One. 2011. V. 6. № 8. P. e23322.
Li J., Zheng H., Yu F. et al. Deficiency of the Kruppel-like factor KLF4 correlates with increased cell proliferation and enhanced skin tumorigenesis // Carcinogenesis. 2012. V. 33. № 6. P. 1239–1246.
Li M., Li H., Liu X. et al. MicroRNA-29b regulates TGF-β1-mediated epithelial–mesenchymal transition of retinal pigment epithelial cells by targeting AKT2 // Exp. Cell Res. 2016. V. 345. № 2. P. 115–124.
Li X. The FGF metabolic axis // Front. Med. 2019. V. 13. № 5. P. 511–530.
Liang C.-M., Tai M.-C., Chang Y.-H. et al. Glucosamine inhibits epithelial-to-mesenchymal transition and migration of retinal pigment epithelium cells in culture and morphologic changes in a mouse model of proliferative vitreoretinopathy // Acta Ophthalmol. 2011. V. 89. № 6. P. e505–e514.
Liu W., Jin G., Long C. et al. Blockage of Notch signaling inhibits the migration and proliferation of retinal pigment epithelial cells // Sci. World J. 2013. V. 2013. P. 178708.
Liu X., Yun F., Shi L. et al. Roles of signaling pathways in the epithelial-mesenchymal transition in cancer // Asian Pacific J. Cancer Prev. 2015. V. 16. № 15. P. 6201–6206.
Liu Y., Cao G.F., Xue J. et al. Tumor necrosis factor-alpha (TNF-α)-mediated in vitro human retinal pigment epithelial (RPE) cell migration mainly requires Akt/mTOR complex 1 (mTORC1), but not mTOR complex 2 (mTORC2) signaling // Eur. J. Cell Biol. 2012. V. 91. № 9. P. 728–737.
Liu Y., Xin Y., Ye F. et al. Taz-tead1 links cell-cell contact to Zeb1 expression, proliferation, and dedifferentiation in retinal pigment epithelial cells // Investig. Ophthalmol. Vis. Sci. 2010. V. 51. № 7. P. 3372–3378.
Loda A., Turati M., Semeraro F. et al. Exploring the FGF/FGFR system in ocular tumors: new insights and perspectives // Int. J. Mol. Sci. 2022. V. 23. № 7.
Lu W., Schneider M., Neumann S. et al. Nesprin interchain associations control nuclear size // Cell. Mol. Life Sci. 2012. V. 69. № 20. P. 3493–3509.
Lueck K., Carr A.-J.F., Stampoulis D. et al. Regulation of retinal pigment epithelial cell phenotype by Annexin A8 // Sci. Rep. 2017. V. 7. № 1. P. 4638.
Lueck K., Carr A.-J.F., Yu L. et al. Annexin A8 regulates Wnt signaling to maintain the phenotypic plasticity of retinal pigment epithelial cells // Sci. Rep. 2020. V. 10. № 1. P. 1256.
Luo G., Hofmann C., Bronckers A.L. et al. BMP-7 is an inducer of nephrogenesis, and is also required for eye development and skeletal patterning // Genes Dev. 1995. V. 9. № 22. P. 2808–2820.
Luo M., Chen Y. Application of stem cell-derived retinal pigmented epithelium in retinal degenerative diseases: present and future // Int. J. Ophthalmol. 2018. V. 11. № 1. P. 150–159.
Luo X., Gu S., Zhang Y., Zhang J. Kinsenoside ameliorates oxidative stress-induced RPE cell apoptosis and inhibits angiogenesis via Erk/p38/NF-κB/VEGF signaling // Front. Pharmacol. 2018. V. 9. № 240.
Lutty G.A., Merges C., Threlkeld A.B. et al. Heterogeneity in localization of isoforms of TGF-beta in human retina, vitreous, and choroid // Invest. Ophthalmol. Vis. Sci. 1993. V. 34. № 3. P. 477–487.
Markitantova Y.V., Avdonin P.P., Grigoryan E.N. FGF2 signaling pathway components in tissues of the posterior eye sector in the adult newt Pleurodeles waltl // Biol. Bull. 2014. V. 41. № 4. P. 297–305.
Martínez-Morales J.R., Rodrigo I., Bovolenta P. Eye development: A view from the retina pigmented epithelium // BioEssays. 2004. V. 26. № 7. P. 766–777.
Martinez B., Peplow P. MicroRNAs as biomarkers of diabetic retinopathy and disease progression // Neural Regen. Res. 2019. V. 14. № 11. P. 1858.
Mathura J.R., Jafari N., Chang J.T. et al. Bone morphogenetic proteins-2 and -4: negative growth regulators in adult retinal pigmented epithelium // Invest. Ophthalmol. Vis. Sci. 2000. V. 41. № 2. P. 592–600.
Meng Y., Ren Z., Xu F. et al. Nicotinamide promotes cell survival and differentiation as kinase inhibitor in human pluripotent stem cells // Stem Cell Reports. 2018. V. 11. № 6. P. 1347–1356.
Milyushina L.A., Kuznetsova A. V., Grigoryan E.N., Aleksandrova M.A. Phenotypic plasticity of retinal pigment epithelial cells from adult human eye in vitro // Bull. Exp. Biol. Med. 2011. V. 151. № 4. P. 506–511.
Mitsuhiro M.R.K., Eguchi S., Yamashita H. Regulation mechanisms of retinal pigment epithelial cell migration by the TGF-β superfamily // Acta Ophthalmol. Scand. 2003. V. 81. № 6. P. 630–638.
Mitsuishi Y., Hasegawa H., Matsuo A. et al. Human CRB2 inhibits γ-secretase cleavage of amyloid precursor protein by binding to the presenilin complex // J. Biol. Chem. 2010. V. 285. № 20. P. 14920–14931.
Miyazono K., Shimanuki T. Bone morphogenetic protein receptors and actions // Principles of Bone Biology. Elsevier, 2008. P. 1177–1196.
Moon C.H., Cho H., Kim Y.K., Park T.K. Nestin expression in the adult mouse retina with pharmaceutically induced retinal degeneration // J. Korean Med. Sci. 2017a. V. 32. № 2. P. 343–351.
Moon K., Lee H.G., Baek W.K. et al. Bortezomib inhibits proliferation, migration, and TGF-β1-induced epithelial-mesenchymal transition of RPE cells // Mol. Vis. 2017b. V. 23. P. 1029–1038.
Müller F., Rohrer H., Vogel-Höpker A. Bone morphogenetic proteins specify the retinal pigment epithelium in the chick embryo // Development. 2007. V. 134. № 19. P. 3483–3493.
Nassar K., Grisanti S., Tura A. et al. A TGF-β receptor 1 inhibitor for prevention of proliferative vitreoretinopathy // Exp. Eye Res. 2014. V. 123. P. 72–86.
Nguyen T., Mège R.M. N-Cadherin and fibroblast growth factor receptors crosstalk in the control of developmental and cancer cell migrations // Eur. J. Cell Biol. 2016. V. 95. № 11. P. 415–426.
Nieto M.A., Huang R.Y.Y.J., Jackson R.A.A., Thiery J.P.P. EMT: 2016 // Cell. 2016. V. 166. № 1. P. 21–45.
Nishimoto S., Nishida E. MAPK signalling: ERK5 versus ERK1/2 // EMBO Rep. 2006. V. 7. № 8. P. 782–786.
Nugent M.A., Iozzo R.V. Fibroblast growth factor-2 // Int. J. Biochem. Cell Biol. 2000. V. 32. № 2. P. 115–120.
Nusse R., Clevers H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities // Cell. 2017. V. 169. № 6. P. 985–999.
Opas M., Dziak E. bFGF-induced transdifferentiation of RPE to neuronal progenitors is regulated by the mechanical properties of the substratum // Dev. Biol. 1994. V. 161. № 2. P. 440–454.
Ornitz D.M., Itoh N. The fibroblast growth factor signaling pathway // Wiley Interdiscip. Rev. Biol. 2015. P. 215–266.
Osumi N., Shinohara H., Numayama-Tsuruta K., Maekawa M. Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator // Stem Cells. 2008. V. 26. № 7. P. 1663–1672.
Parapuram S.K., Chang B., Li L. et al. Differential effects of TGFβ and vitreous on the transformation of retinal pigment epithelial cells // Investig. Ophthalmol. Vis. Sci. 2009. V. 50. № 12. P. 5965–5974.
Pellissier L.P., Alves C.H., Quinn P.M. et al. Targeted ablation of Crb1 and Crb2 in retinal progenitor cells mimics Leber congenital amaurosis // PLoS Genet. 2013. V. 9. № 12. P. e1003976.
Person F., Wilczak W., Hube-Magg C. et al. Prevalence of βIII-tubulin (TUBB3) expression in human normal tissues and cancers // Tumor Biol. 2017. V. 39. № 10. P. 1–11.
Petrou P.A., Cunningham D., Shimel K. et al. Intravitreal sirolimus for the treatment of geographic atrophy: results of a phase I/II clinical trial // Investig. Ophthalmol. Vis. Sci. 2014. V. 56. № 1. P. 330–338.
Pimiento J.M., Chen D.-T., Centeno B.A. et al. Annexin A8 is a prognostic marker and potential therapeutic target for pancreatic cancer // Pancreas. 2015. V. 44. № 1. P. 122–127.
Pittack C., Grunwald G.B., Reh T.A. Fibroblast growth factors are necessary for neural retina but not pigmented epithelium differentiation in chick embryos // Development. 1997. V. 124. № 4. P. 805–816.
Priglinger S.G., Alge C.S., Neubauer A.S. et al. TGF-β2-induced cell surface tissue transglutaminase increases adhesion and migration of RPE cells on fibronectin through the gelatin-binding domain // Investig. Ophthalmol. Vis. Sci. 2004. V. 45. № 3. P. 955–963.
Qian X., Anzovino A., Kim S. et al. N-cadherin/FGFR promotes metastasis through epithelial-to-mesenchymal transition and stem/progenitor cell-like properties // Oncogene. 2014. V. 33. № 26. P. 3411–3421.
Radeke M.J., Radeke C.M., Shih Y.-H. et al. Restoration of mesenchymal retinal pigmented epithelial cells by TGFβ pathway inhibitors: implications for age-related macular degeneration // Genome Med. 2015. V. 7. № 1. P. 58.
Rajendran R., Sudha D., Chidambaram S. et al. Retinoschisis and Norrie disease: a missing link // BMC Res. Notes. 2021. V. 14. № 1. P. 204.
Rak D.J., Hardy K.M., Jaffe G.J., McKay B.S. Ca++-switch induction of RPE differentiation // Exp. Eye Res. 2006. V. 82. № 4. P. 648–656.
Robertson I.B., Rifkin D.B. Regulation of the bioavailability of TGF-β and TGF-β-related proteins // Cold Spring Harb. Perspect. Biol. 2016. V. 8. № 6. P. a021907.
Rodriguez J., Esteve P., Weinl C. et al. SFRP1 regulates the growth of retinal ganglion cell axons through the Fz2 receptor // Nat. Neurosci. 2005. V. 8. № 10. P. 1301–1309.
Rosenthal R., Malek G., Salomon N. et al. The fibroblast growth factor receptors, FGFR-1 and FGFR-2, mediate two independent signalling pathways in human retinal pigment epithelial cells // Biochem. Biophys. Res. Commun. 2005. V. 337. № 1. P. 241–247.
Roybal C.N., Velez G., Toral M.A. et al. Personalized proteomics in proliferative vitreoretinopathy implicate hematopoietic cell recruitment and mTOR as a therapeutic target // Am. J. Ophthalmol. 2018. V. 186. P. 152–163.
Saika S., Yamanaka O., Ikeda K. et al. Inhibition of p38MAP kinase suppresses fibrotic reaction of retinal pigment epithelial cells // Lab. Investig. 2005. V. 85. № 7. P. 838–850.
Saini J.S., Corneo B., Miller J.D. et al. Nicotinamide ameliorates disease phenotypes in a human iPSC model of age-related macular degeneration // Cell Stem Cell. 2017. V. 20. № 5. P. 635–647. e7.
Sakai T., Kuno N., Takamatsu F. et al. Prolonged protective effect of basic fibroblast growth factor-impregnated nanoparticles in Royal College of Surgeons rats // Investig. Ophthalmol. Vis. Sci. 2007. V. 48. № 7. P. 3381–3387.
Salero E., Blenkinsop T.A., Corneo B. et al. Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives // Cell Stem Cell. 2012. V. 10. № 1. P. 88–95.
Salmaninejad A., Pourali G., Shahini A. et al. MicroRNA and exosome in retinal-related diseases: their roles in the pathogenesis and diagnosis // Comb. Chem. High Throughput Screen. 2022. V. 25. № 2. P. 211–228.
Samuel W., Jaworski C., Postnikova O.A. et al. Appropriately differentiated ARPE-19 cells regain phenotype and gene expression profiles similar to those of native RPE cells // Mol. Vis. 2017. V. 23. P. 60–89.
Sanford L.P., Ormsby I., Gittenberger-de Groot A.C. et al. TGFβ2 knockout mice have multiple developmental defects that are non-overlapping with other TGFβ knockout phenotypes // Development. 1997. V. 124. № 13. P. 2659–2670.
Saxton R.A., Sabatini D.M. mTOR signaling in growth, metabolism, and disease // Cell. 2017. V. 168. № 6. P. 960–976.
Schaller M.D. Cellular functions of FAK kinases: insight into molecular mechanisms and novel functions // J. Cell Sci. 2010. V. 123. № 7. P. 1007–1013.
Schouwey K., Aydin I.T., Radtke F., Beermann F. RBP-Jκ-dependent Notch signaling enhances retinal pigment epithelial cell proliferation in transgenic mice // Oncogene. 2011. V. 30. № 3. P. 313–322.
Schouwey K., Beermann F. The Notch pathway: hair graying and pigment cell homeostasis // Histol. Histopathol. 2008. V. 23. № 5. P. 609–619.
Schwartz S.D., Hubschman J.P., Heilwell G. et al. Embryonic stem cell trials for macular degeneration: a preliminary report // Lancet. 2012. V. 379. № 9817. P. 713–720.
Schwegler J.S., Knorz M.C., Akkoyun I., Liesenhoff H. Basic, not acidic fibroblast growth factor stimulates proliferation of cultured human retinal pigment epithelial cells // Mol. Vis. 1997. V. 3. P. 1–10.
Schweigerer L. Basic fibroblast growth factor as a wound healing hormone // Trends Pharmacol. Sci. 1988. V. 9. № 12. P. 427–428.
Senabouth A., Daniszewski M., Lidgerwood G.E. et al. Transcriptomic and proteomic retinal pigment epithelium signatures of age-related macular degeneration // Nat. Commun. 2022. V. 13. № 1. P. 4233.
Shahriari F., Satarian L., Moradi S. et al. MicroRNA profiling reveals important functions of miR-125b and let-7a during human retinal pigment epithelial cell differentiation // Exp. Eye Res. 2020. V. 190. P. 107883.
Sheridan C., Hiscott P., Grierson I. Retinal pigment epithelium differentiation and dedifferentiation // Essentials in Ophthalmology: Vitreo-Retinal Surgery / Eds. Kirchhof B., Wong D. Springer, 2005. P. 101–119.
Shu D.Y., Butcher E., Saint-Geniez M. EMT and ENDMT: Emerging roles in age-related macular degeneration // Int. J. Mol. Sci. 2020. V. 21. № 12. P. 1–26.
Siebel C., Lendahl U. Notch signaling in development, tissue homeostasis, and disease // Physiol. Rev. 2017. V. 97. № 4. P. 1235–1294.
Staal F.J.T. Wnt signalling meets epigenetics // Stem Cell Investig. 2016. V. 2016. № AUG. P. 38.
Steindl-Kuscher K., Krugluger W., Boulton M.E. et al. Activation of the β-catenin signaling pathway and its impact on RPE cell cycle // Investig. Ophthalmol. Vis. Sci. 2009. V. 50. № 9. P. 4471–4476.
Stepp M.A., Menko A.S. Immune responses to injury and their links to eye disease // Transl. Res. 2021. V. 236. P. 52–71.
Sternfeld M.D., Robertson J.E., Shipley G.D. et al. Cultured human retinal pigment epithelial cells express basic fibroblast growth factor and its receptor // Curr. Eye Res. 1989. V. 8. № 10. P. 1029–1037.
Strauss O. The retinal pigment epithelium in visual function // Physiol. Rev. 2005. V. 85. № 3. P. 845–881.
Suyama K., Shapiro I., Guttman M., Hazan R.B. A signaling pathway leading to metastasis is controlled by N-cadherin and the FGF receptor // Cancer Cell. 2002. V. 2. № 4. P. 301–314.
Takahashi E., Nagano O., Ishimoto T. et al. Tumor necrosis factor-alpha regulates transforming growth factor-beta-dependent epithelial-mesenchymal transition by promoting hyaluronan-CD44-moesin interaction // J. Biol. Chem. 2010. V. 285. № 6. P. 4060–4073.
Thiery J.P., Acloque H., Huang R.Y.J., Nieto M.A. Epithelial-mesenchymal transitions in development and disease // Cell. 2009. V. 139. № 5. P. 871–890.
Tien Y.T., Chang M.H., Chu P.Y. et al. Downregulation of the KLF4 transcription factor inhibits the proliferation and migration of canine mammary tumor cells // Vet. J. 2015. V. 205. № 2. P. 244–253.
Tosi G.M., Neri G., Caldi E. et al. TGF-β concentrations and activity are down-regulated in the aqueous humor of patients with neovascular age-related macular degeneration // Sci. Rep. 2018a. V. 8. № 1.
Tosi G.M., Orlandini M., Galvagni F. The controversial role of TGF-β in neovascular age-related macular degeneration pathogenesis // Int. J. Mol. Sci. 2018b. V. 19. № 11. P. 3363.
Tuo J., Wang Y., Cheng R. et al. Wnt signaling in age-related macular degeneration: human macular tissue and mouse model // J. Transl. Med. 2015. V. 13. № 1. P. 330.
Usui-Ouchi A., Ouchi Y., Kiyokawa M. et al. Upregulation of mir-21 levels in the vitreous humor is associated with development of proliferative vitreoretinal disease // PLoS One. 2016. V. 11. № 6.
Valtorta F., Benfenati F., Greengard P. Structure and function of the synapsins // J. Biol. Chem. 1992. V. 267. № 11. P. 7195–7198.
Vinores S.A., Derevjanik N.L., Mahlow J. et al. Class III beta-tubulin in human retinal pigment epithelial cells in culture and in epiretinal membranes // Exp. Eye Res. 1995. V. 60. № 4. P. 385–400.
Vinores S.A., Herman M.M., Hackett S.F., Campochiaro P.A. A morphological and immunohistochemical study of human retinal pigment epithelial cells, retinal glia, and fibroblasts grown on Gelfoam matrix in an organ culture system. A comparison of structural and nonstructural proteins and their application to cell // Graefes Arch. Clin. Exp. Ophthalmol. 1993. V. 231. № 5. P. 279–288.
Walsh N., Valter K., Stone J. Cellular and subcellular patterns of expression of bFGF and CNTF in the normal and light stressed adult rat retina // Exp. Eye Res. 2001. V. 72. № 5. P. 495–501.
Wang C., Cao G.F., Jiang Q., Yao J. TNF-α promotes human retinal pigment epithelial (RPE) cell migration by inducing matrix metallopeptidase 9 (MMP-9) expression through activation of Akt/mTORC1 signaling // Biochem. Biophys. Res. Commun. 2012. V. 425. № 1. P. 33–38.
Wang F.E., Zhang C., Maminishkis A. et al. MicroRNA-204/211 alters epithelial physiology // FASEB J. 2010. V. 24. № 5. P. 1552–1571.
Warzecha C.C., Sato T.K., Nabet B. et al. ESRP1 and ESRP2 are epithelial cell-type-specific regulators of FGFR2 splicing // Mol. Cell. 2009. V. 33. № 5. P. 591–601.
Wiedemann P. Growth factors in retinal diseases: proliferative vitreoretinopathy, proliferative diabetic retinopathy, and retinal degeneration // Surv. Ophthalmol. 1992. V. 36. № 5. P. 373–384.
Wordinger R.J., Clark A.F. Bone morphogenetic proteins and their receptors in the eye // Exp. Biol. Med. (Maywood). 2007. V. 232. № 8. P. 979–992.
Xie Y., Su N., Yang J. et al. FGF/FGFR signaling in health and disease // Signal Transduct. Target. Ther. 2020. V. 5. № 1.
Xu J., Lamouille S., Derynck R. TGF-β-induced epithelial to mesenchymal transition // Cell Res. 2009. V. 19. № 2. P. 156–172.
Xu J., Zhu D., He S. et al. Transcriptional regulation of bone morphogenetic protein 4 by tumor necrosis factor and its relationship with age-related macular degeneration // FASEB J. 2011. V. 25. № 7. P. 2221–2233.
Xu Q., Wang Y., Dabdoub A. et al. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair // Cell. 2004. V. 116. № 6. P. 883–895.
Xu W., Kimelman D. Mechanistic insights from structural studies of beta-catenin and its binding partners // J. Cell Sci. 2007. V. 120. № 19. P. 3337–3344.
Yafai Y., Iandiev I., Lange J. et al. Basic fibroblast growth factor contributes to a shift in the angioregulatory activity of retinal glial (müller) cells // PLoS One. 2013. V. 8. № 7. P. e68773.
Yang J., Shi P., Tu M. et al. Bone morphogenetic proteins: Relationship between molecular structure and their osteogenic activity // Food Sci. Hum. Wellness. 2014. V. 3. № 3–4. P. 127–135.
Yang L., Liu Z., Gong H. et al. Efficient delivery of NF-kB siRNA to human retinal pigment epithelial cells with hyperbranched cationic polysaccharide derivative-based nanoparticles // Int. J. Nanomedicine. 2015a. V. 10. № 1. P. 2735.
Yang S., Li H., Li M., Wang F. Mechanisms of epithelial-mesenchymal transition in proliferative vitreoretinopathy // Discov. Med. 2015b. V. 20. № 110. P. 207–217.
Yao H., Ge T., Zhang Y. et al. BMP7 antagonizes proliferative vitreoretinopathy through retinal pigment epithelial fibrosis in vivo and in vitro // FASEB J. 2019. V. 33. № 3. P. 3212–3224.
Yao H., Li H., Yang S. et al. Inhibitory effect of bone morphogenetic protein 4 in retinal pigment epithelial-mesenchymal transition // Sci. Rep. 2016. V. 6. P. 32182.
Yasumuro H., Sakurai K., Toyama F. et al. Implications of a multi-step trigger of retinal regeneration in the adult newt // Biomedicines. 2017. V. 5. № 2. P. 25.
Yue J., López J.M. Understanding MAPK signaling pathways in apoptosis // Int. J. Mol. Sci. 2020. V. 21. № 7. P. 2346.
Zhang C., Su L., Huang L., Song Z.Y. GSK3β inhibits epithelial-mesenchymal transition via the Wnt/β-catenin and PI3K/AKT pathways // Int. J. Ophthalmol. 2018. V. 11. № 7. P. 1120–1128.
Zhao C., Wang Q., Temple S. Stem cell therapies for retinal diseases: Recapitulating development to replace degenerated cells // Dev. 2017. V. 144. № 8. P. 1368–1381.
Zhao C., Yasumura D., Li X. et al. mTOR-mediated dedifferentiation of the retinal pigment epithelium initiates photoreceptor degeneration in mice // J. Clin. Invest. 2011. V. 121. № 1. P. 369–383.
Zheng G., Lyons J.G., Tan T.K. et al. Disruption of E-cadherin by matrix metalloproteinase directly mediates epithelial-mesenchymal transition downstream of transforming growth factor-β1 in renal tubular epithelial cells // Am. J. Pathol. 2009. V. 175. № 2. P. 580–591.
Zhou M., Geathers J.S., Grillo S.L. et al. Role of epithelial-mesenchymal transition in retinal pigment epithelium dysfunction // Front. Cell Dev. Biol. 2020. V. 8.
Zhu D., Deng X., Xu J., Hinton D.R. What determines the switch between atrophic and neovascular forms of age related macular degeneration? - the role of BMP4 induced senescence // Aging (Albany. NY). 2009a. V. 1. № 8. P. 740–745.
Zhu D., Wu J., Spee C. et al. BMP4 mediates oxidative stress-induced retinal pigment epithelial cell senescence and is overexpressed in age-related macular degeneration // J. Biol. Chem. 2009b. V. 284. № 14. P. 9529–9539.
Zhu J., Luz-Madrigal A., Haynes T. et al. β-Catenin inactivation is a pre-requisite for chick retina regeneration // PLoS One. 2014. V. 9. № 7. P. e101748.
Zhu J., Nguyen D., Ouyang H. et al. Inhibition of RhoA/Rho-kinase pathway suppresses the expression of extracellular matrix induced by CTGF or TGF-β in ARPE-19 // Int. J. Ophthalmol. 2013. V. 6. № 1. P. 8–14.
Zou H., Shan C., Ma L. et al. Polarity and epithelial-mesenchymal transition of retinal pigment epithelial cells in proliferative vitreoretinopathy // PeerJ. 2020. V. 8. P. e10136.
Дополнительные материалы отсутствуют.


