Онтогенез, 2023, T. 54, № 2, стр. 176-180
Консервативный белок RCC1 – новый компонент черных дисков политенных хромосом Drosophila melanogaster
Т. Ю. Зыкова a, *, М. В. Мальцева a, С. А. Демаков a, Г. В. Похолкова a, Ю. А. Веряскина a, О. И. Лаврик b, Т. Д. Колесникова a, И. Ф. Жимулев a
a Институт молекулярной и клеточной биологии СО РАН
630090 Новосибирск, просп. ак. Лаврентьева, 8/2, Россия
b Институт химической биологии и фундаментальной медицины СО РАН
630090 Новосибирск, просп. ак. Лаврентьева, 8, Россия
* E-mail: vatolina@mcb.nsc.ru
Поступила в редакцию 13.01.2023
После доработки 17.02.2023
Принята к публикации 02.03.2023
- EDN: XFQNTP
- DOI: 10.31857/S0475145023020076
Аннотация
Ранее был охарактеризован ген RCC1 (Regulator of Сhromosome Сondensation 1), который считается регулятором конденсации хромосом в клеточном цикле. Этот ген кодирует ядерный белок, последовательность аминокислот которого высоко консервативна среди всех эукариот и состоит из семи бета-спиралей, также известных как семь повторяющихся единиц. Мы показали, что все наиболее заметные черные диски политенных хромосом (260 дисков) и хромоцентр связывают антитела на этот белок. Мы обнаружили, что антитела на белок RCC1 ксенопуса специфически связываются с белком RCC1 дрозофилы и человека, при этом в линиях дрозофилы с подавлением недорепликации происходит увеличение относительного количества белка RCC1 по сравнению с диким типом.
ВВЕДЕНИЕ
В политенных хромосомах Drosopohila, как было показано на картах Н.К. Кольцова (1934) и Бриджеса (1938), выделяются такие структуры, как междиски, серые и черные диски. Известно, что у Drosophila melanogaster геном разделяется на две группы: гены “домашнего хозяйства” и гены развития (тканеспецифические гены). Оказалось, что первые занимают две структуры – междиск и серый диск, а вторые расположены в черных дисках. Ранее мы опубликовали модель 4-х состояний хроматина, которая позволяет характеризовать два типа дисков: черные и серые по белковому и генетическому составу (Zhimulev et al., 2014). Одним из перспективных биомаркеров канцерогенза является ген RCC1 (Regulator of Сhromosome Сondensation 1). Он кодирует ядерный белок, последовательность аминокислот которого высоко консервативна среди всех эукариот. Белок RCC1 является фактором нуклеотидного обмена для ядерного белка Ras-related nuclear protein (Ran), который представляет собой ГТФазу. RCC1 также играет важную роль в сборке веретен деления во время митоза, предотвращении множественной репликации S-фазы ДНК, транспортировки ядерного материала и реконструкции ядерной мембраны (Makde et al., 2010). Из литературных данных остается не до конца понятным в каких структурах политенных хромосом локализуется этот белок (Frasch, 1991). Кроме того, как оказалось ген RCC1 является онкогеном, от изменений активности которого зависит формирование опухолей. Недавно была изучена потенциальная роль RCC1 в 33 опухолевых образованиях на основе баз данных Cancer Genome Atlas, Genotype-Tissue Expression и Gene Expression Omnibus. Результаты показали, что ген RCC1 очень высоко экспрессируется в большинстве злокачественных новообразований человека в отличие от здоровых тканей (Wu et al., 2021).
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования
В качестве объекта исследования мы использовали плодовую мушку дрозофилу (Drosophila melanogaster). Мух выращивали на стандартной среде из кукурузной муки, дрожжей, агара и патоки при 18, 22 или 25°С. Линия Oregon R использовалась в качестве дикого типа. Линия Rif11 была любезно предоставлена Джаредом Нордманом, отдел биологических наук Вандербильтского университета, США. Линии w; ru h SuURES, X^YX^Y.X^Y yw; SuURES, Su(var)3-906 и X^YX^Y.X^Y yw; Rif11; SuURES, Su(var)3-906 были получены ранее в нашей лаборатории.
Иммуноокрашивание политенных хромосом
Для иммуноокрашивания препараты споласкивали в растворе PBST. Не допуская пересыхания препарата, наносили первичные антитела в блокирующем буфере (2% бычий сывороточный альбумин в PBST) и инкубировали во влажной камере в течение 2 ч при комнатной температуре. Далее препараты отмывали в растворе PBST и наносили раствор вторичных антител, конъюгированных с флуорохромом, в блокирующем буфере. Инкубировали в течение 1.5 ч, затем стекла вновь отмывали в растворе PBST (3 смены по 5 мин). Далее на подсушенные препараты капали по 8 мкл раствора (смесь DABCO и DAPI, Abcam) и накрывали покровным стеклом. Цитологический анализ и фотографирование проводили при помощи микроскопа Olimpus BX-50F. Каждый эксперимент повторялся не менее пяти раз, при этом во всех случаях характер окраски воспроизводился (Vatolina et al., 2011).
Вестерн-блот гибридизация
Для вестерн-блот гибридизации использовали слюнные железы дрозофилы (20 пар на одну дорожку) и культуру клеток человека HEK (около 105 клеток на одну дорожку). Все образцы были лизированы в буфере (50 мM Трис-HCl, 150 мM NaCl, 0.1% Triton X-100, 0.1% SDS, 1 мM PMSF) и экстракт тотальных белков был нанесен на поли-акриламидный гель. Электрофоретическое разделение белков в исследуемых образцах проводили в камере BioRad по стандартному протоколу в 10% SDS–полиакриламидном геле. После разделения на гель с образцом накладывали мембрану и проводили электроперенос в охлажденном буфере (0.2 М глицин, 0.025 М Трис и 20% метанол) в течение 1 ч при постоянном токе. Первичные антитела разводили в блокирующем растворе (поликлональные антитела кролика к белку RCC1 ксенопуса (Invitrogen) – 1 : 1000; моноклональные антитела мыши к гистону Н3 (Novus Biological) – 1 : 10 000. Мембрану помещали в разведенные первичные тела и инкубировали 1 ч при комнатной температуре на шейкере при 45–50 об./мин. Затем промывали в 1× PBST. Иммунодетекцию производили с помощью набора Novex ECL Chemiluminescent Substrate Reagent Kit (Invitrogen). Анализ результатов проводился при помощи топографа Amersham Imager 600 (GE Healthcare Life Sciences) и программы ImageJ (Thacker et al., 2021).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на то, что диски в политенных хромосом представляют только поперечные полосы, разные типы серых и черных дисков отличаются по генетическому составу, морфологии, репликационной активности, белковому составу и нуклеосомным модификациям (Zhimulev et al., 2014). В ходе нашей работы мы обнаружили, что антитела на белок RCC1 ксенопуса специфически связываются с белком RCC1 дрозофилы и человека (рис. 1). Мы максимально точно прокартировали локализацию RCC1 в структурах хромосомы. В политенных хромосомах антитела к белку RCC1 связываются исключительно с высоко компактизованными черными дисками, в которых расположены гены развития. Для контраста локализации одновременно картировали белок CHRIZ, который связывается с районами богатыми серыми дисками и междисками. В результате в хромосоме становились заметными протяженные участки междисков и тонких серых дисков без локализации белка RCC1, а вся метка на белок RCC1 приходилась на черные диски и прицентромерный гетерохроматин (рис. 1а). Мы обнаружили 260 районов связывания белка RCC1 в интерфазных политенных хромосомах дрозофилы (табл. 1). Во всех случаях это были черные диски и 75–100% из них демонстрировали наличие позднего завершения репликации. Таким образом, у нас появился хороший маркер как на гены развития, локализованные в черных дисках, так и на модель онкогенеза на дрозофиле.
Рис. 1.
Характеристика белка RCC1 дрозофилы при помощи иммуноокрашивания и вестерн-блот гибридизации. (а) Иммуоноокрашивание политенных хромосом на белки RCC1 и CHRIZ. Желтой стрелкой обозначен район 31A-F, содержащий около 36 серых дисков. (б) Морфология прицентромерного гетерохроматина дрозофилы между участками 80А-С и 81F третьей политенной хромосомы дикого типа и линий с мутациям, приводящих к политенизации данного участка: хромосомы линии Oregon (любезно предоставлено Т.Д. Колесниковой); хромосомы линии Oregon под электронным микроскопом (Semeshin et al., 2001); хромосомы линии с мутацией SuURES (Semeshin et al., 2001); хромосомы линии с мутацией SuURES и Su(var)3-906 (Andreyeva et al., 2007); хромосомы линии с мутацией Rif11; хромосомы линии с мутацией SuURES Su(var)3-906 Rif11 (любезно предоставлено Т.Д. Колесниковой). (в) Полуколичественная характеристика и определение размеров белка RCC1 дрозофилы и человека с помощью вестерн-блоттинга: 1 – культура клеток почек эмбриона человека (HEK 293); 2 – слюнные железы дрозофилы линии Oregon; 3 – слюнные железы дрозофилы линии SuURES Su(var)3-906; 4 – слюнные железы дрозофилы линии Rif11; 5 – слюнные железы дрозофилы линии SuURES Su(var)3-906 Rif11. (г) Анализ результатов вестерн-блот при помощи программы ImageJ, содержание дорожек 1–5 аналогично (в).
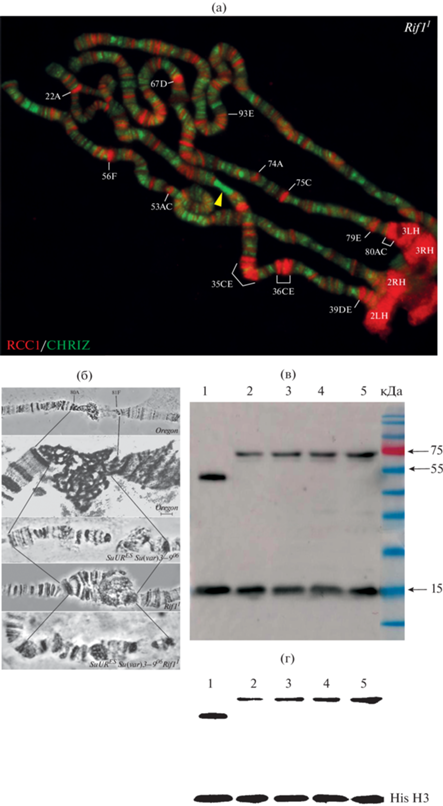
Таблица 1.
Локализация антител на белок RCC1 в политенных хромосомах D. melanogaster
| Хромосома | chr 4 | chr X | chr 2L | chr 2R | chr 3L | chr 3R | Всего |
|---|---|---|---|---|---|---|---|
| Районы связывания белка RCC1 (черные диски) | 2 | 53 | 51 | 43 | 48 | 63 | 260 |
| Сайты поздней репликации | 100% | 83% | 75% | 88% | 88% | 92% | Среднее значение 88% |
В работе М. Фраша было отмечено, что белок RCC1 локализуется во всех без исключения дисках политенных хромосом (Frasch, 1991). Но как следует из описанных выше результатов картирования белка RCC1, он характерен только для черных конденсированных дисков и прицентромерного гетерохроматина, из-за чего на хромосоме обозначены протяженные участки серых дисков без локализации белка RCC1 (желтая стрелка на рис. 1а). Подобные различия в связывании одного и того же белка могут говорить о разных механизмах активирования генов развития и генов “домашнего хозяйства”.
Известно, что черные диски часто испытывают неполную политенизацию (недорепликацию) в результате чего материал черных дисков в хромосомах нормальных линий недопредставлен (Zhimulev et al., 1982). Мы использовали Вестерн-блот гибридизацию для определения молекулярного веса и полуколичественного анализа белка RCC1 в линии Oregon и в линиях с разными дозами мутантных генов, приводящих к восстановлению недореплицированных районов хромосом дрозофилы (рис. 1б, 1в). С помощью программы ImagJ было показано, что в линиях с мутациями SuURES Su(var)3-906, Rif11 и SuURES Su(var)3-906Rif11 относительное количество белка RCC1 в клетках слюнных желез увеличивается в сравнении с диким типом более чем в три раза (рис. 1б, 1в, 1г). Интересно то, что после подавления недорепликации в прицентромерном гетерохроматине можно наблюдать характерную для плеч хромосом картину: белок RCC1 связывается с темными участками, а CHRIZ со светлыми участками хромосомы.
Список литературы
Andreyeva E.N., Kolesnikova T.D., Demakova O.V. et al. High-resolution analysis of Drosophila heterochromatin organization using SuUR Su(var)3-9 double mutants // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 12819–12824.
Bridges C.B. A revised map of the salivary gland X-chromosome of Drosophila melanogaster // J. Hered. 1938. V. 29. P. 11–13.
Frasch M. The maternally expressed Drosophila gene encoding the chromatin-binding protein BJ1 is a homolog of the vertebrate gene Regulator of Chromatin Condensation, RCC1 // EMBO J. 1991. V. 10. P. 1225–1236.
Koltzoff N.K. The structure of the chromosomes in the salivary glands of Drosophila // Science. 1934. V. 60. P. 312–313.
Makde R.D., England J.R., Yennawar H.P. et al. Structure of RCC1 chromatin factor bound to the nucleosome core particle // Nature. 2010. V. 467. P. 562–566.
Semeshin V.F., Belyaeva E.S., Zhimulev I.F. Electron microscope mapping of the pericentric and intercalary heterochromatic regions of the polytene chromosomes of the mutant Suppressor of underreplication in Drosophila melanogaster // Chromosoma. 2001. V. 110. P. 487–500.
Thacker J.S., Andersen D., Liang S. et al. Unlocking the brain: A new method for Western blot protein detection from fixed brain tissue // J. Neuroscience Methods. 2021. V. 348. P. 108995.
Vatolina T.Y., Boldyreva L.V., Demakova O.V et al. Identical functional organization of nonpolytene and polytene chromosomes in Drosophila melanogaster // PLoS One. 2011b. V. 6. P. e25960.
Wu C., Duan Y., Gong S. et al. Integrative and Comprehensive Pancancer Analysis of Regulator of Chromatin Condensation 1 (RCC1) // Int. J. Mol. Sci. 2021. V. 22. P. 7374.
Zhimulev I.F., Semeshin V.F., Kulichkov V.A. Intercalary heterochromatin in Drosophila // Chromosoma. 1982. V. 87. P. 197–228.
Zhimulev I.F., Zykova T.Yu., Goncharov F.P. et al. Genetic organization of polytene chromosome bands and interbands in Drosophila melanogaster // PLoS One. 2014. V. 9(7). P. e101631.
Дополнительные материалы отсутствуют.


