Палеонтологический журнал, 2019, № 3, стр. 97-104
Строение мозга и нейробиология панцирного динозавра Bissektipelta archibaldi (Ankylosauridae) из позднего мела Узбекистана
В. Р. Алифанов a, *, С. В. Савельев b, **
a Палеонтологический институт им. А.А. Борисяка РАН
Москва, Россия
b НИИ морфологии человека РАМН
Москва, Россия
* E-mail: valifan@paleo.ru
** E-mail: braincase@yandex.ru
Поступила в редакцию 29.12.2017
После доработки 02.04.2018
Принята к публикации 12.04.2018
Аннотация
В работе представлены результаты изучения искусственного отлива нейрокраниальной полости динозавра Bissektipelta archibaldi (Ankylosauridae) из позднего мела Узбекистана. Для этого вида предполагается развитое обоняние и совершенный вкусовой анализатор. По строению мозга биссектипельта занимает наиболее архаичное положение среди анкилозавров.
ВВЕДЕНИЕ
Настоящая работа является частью цикла, посвященного изучению мозга и реконструкции биологии динозавров по искусственным и естественным слепкам нейрокраниальной полости. Авторы ранее опубликовали соответствующие данные по тираннозавридам (Савельев, Алифанов, 2007), альваресзаврам (Алифанов, Савельев, 2011) и утконосым динозаврам (Савельев и др., 2012). Данная работа посвящена анкилозаврам.
Анкилозавры – одна из групп птицетазовых динозавров (Ornithischia). Ее расцвет пришелся на меловой период, а становление, предположительно, оформилось в течение юрского периода, о чем свидетельствует ряд находок соответствующего возраста в Китае (Dong, 1993, 2002). Распространение анкилозавров охватывало практически все континенты. Традиционно в их составе выделяют два семейства: Nodosauridae и Ankylosauridae. В литературе иногда фигурируют Polacanthidae, семейственный ранг которых пока не закрепился.
Для анкилозавров характерны небольшая голова, широкое туловище и относительно короткие конечности. Эти внешние характеристики сочетаются с преобразованным скелетом таза, обладающим крупными подвздошными костями, широким синсакрумом и редуцированными лобковыми костями. Для анкилозавров характерно развитие покровного окостенения (отсюда их второе название – панцирные динозавры). Краниальные остеодермы плотно расположены и сливаются с костями крыши черепа. На спине покровные костные образования формировали серию рядов. В плечевой области остеодермы часто объединялись в удлиненные поперечные спинные пластины – пояса. Входящие в них и отдельные остеодермы могли быть преобразованы в выступающие элементы: низкие или высокие, килеватые или шиповидные.
Считается, что анкилозавры вели малоподвижный образ жизни, чему соответствует их остеодермальный панцирь, игравший, как у черепах, роль пассивной защиты, в том числе от хищников. Орудием активной защиты служил хвост. Последний, видимо, исходно обладал способностью к хлещущим ударам. У анкилозаврид конец хвоста преобразован в так называемую палицу, или утяжеление в виде шишковидных остеодерм, в сочетании со срастанием серии терминальных хвостовых позвонков.
Зубы у анкилозавров мелкие, листовидные по форме и зазубренные по краю коронки. В силу этого для анкилозавров чаще предполагается питание растениями или их частями (Coombs, Maryańska, 1990; Vickaryous et al., 2004). Способы добывания корма и характер его обработки челюстями определить точно не представляется возможным. Основная переработка пищи, возможно, происходила в пищеварительном тракте. На состав пищевой массы отчасти указывает так называемый кололит (фоссилизированное содержимое кишечника), обнаруженный у австралийского анкилозавра Minmi (Molnar, Clifford, 2000). Содержимое кололита составляют разнообразные части растений: листья, стебли и семена. Не исключено также, что они являлись попутным компонентом, который сопровождал поглощение какой-то быстро перевариваемой составляющей в общей пищевой массе. Она могла иметь как растительное, так и животное происхождение.
При обсуждении биологии анкилозавров внимание уделяется сложной системе носовых полостей. Предположения в отношении их функционального значения разнообразны. Они, в частности, связывают наличие полостей с увеличением площади обонятельного эпителия, созданием резонирующих камер, для регуляции влажности и тепла носовой области, а также для оптимизации конструкционных свойств черепа.
Исследования нервной системы анкилозавров немногочисленны и начались относительно недавно. Данные по строению мозга интересны в свете проблемы его соответствия с реконструкцией образа жизни, установленной по особенностям строения скелета, черепа и зубной системы. Привлекательна также возможность установить церебральную специфичность разных видов и подгрупп панцирных динозавров в свете их довольно консервативной скелетной анатомии.
Одной из первых работ такого рода стала публикация У. Кумбса (Сoombs, 1978). В ней автор пытался сравнить анатомически мозг Euoplocephalus tutus (Lambe, 1902) из позднего мела Северной Америки с другими птицетазовыми динозаврами. Итоговым стал вывод об архаичности строения мозга анкилозавров. Работа Кумбса также проводилась по полному слепку нейрокраниальной полости, чего не удалось воспроизвести во многих других случаях (напр., Pereda Suberbiola, Galton, 1994; Norman, Faiers, 1996; Ősi et al., 2014). Почти все попытки изучения мозга анкилозавров указывают на его небольшие общие размеры в сравнении с другими динозаврами. По индексу энцефализации (отношение фактической массы мозга к массе тела) они превосходят лишь завропод (Hopson, 1979).
Современные работы, выполненные с помощью компьютерной томографии (КТ) дают представление только об общих деталях строения мозга у разных видов. Их общим недостатком является плохая передача деталей рельефа полости мозговой капсулы, которая возникает при сглаживании (аппроксимации) срезов условной поверхности реконструкции в связи с невысокой в целом разрешающей способностью применяемых томографов. Низкое разрешение при КТ сканировании современным авторам не позволяет обнаружить или точно оценить некоторые важные структуры. Например, признаки вомероназальной системы в таких исследованиях часто не выявляются, а сама система далее не обсуждается.
Для предметного изучения строения головного мозга, с нашей точки зрения, предпочтительными выглядят нейрокраниальные отливы, которые дают возможность направленного изучения мозговых полостей и реконструирования мозга с учетом мозговых оболочек, а также более точны в передаче мелких нейрокраниальных структур. Возможность изготовить такой отлив у анкилозавров предоставляет голотип Bissektipelta archibaldi (Averianov, 2002) из биссектинской свиты (средний–верхний турон) в Узбекистане (местонахождение Джаракудук). Изучение мозга этого панцирного динозавра лежит в основе настоящей работы.
Обсуждаемый вид описан по единственной находке: затылочной части черепа с практически полной мозговой коробкой. Первоначально он классифицировался в составе рода Amtosaurus (Averianov, 2002), типовой вид которого – A. magnus Kurzanov et Tumanova, 1978 – установлен по находке мозговой коробки из баинширэинской свиты (коньяк–сантон) в Монголии (местонахождение Амтгай, Восточно-Гобийский аймак). Новый род для A. archibaldi – Bissektipelta – был выделен позднее (Parish, Barret, 2004). Т.А. Туманова (2012) отмечает, что диагноз, указанный в первоописании A. archibaldi, соответствует родовому. В настоящее время B. archibaldi классифицируется в составе Ankylosauria fam. incertae sedis (Vickaryous et al., 2004; Parish, Barret, 2004), Ankylosauridae с неопределенными филогенетическими связями в его составе (Arbour, Currie, 2016) или в типовом подсемействе последнего семейства – Ankylosaurinae (Туманова, 2012).
Образец для изготовления отлива любезно предоставил А.О. Аверьянов. Авторы благодарят Т.А. Туманову за обсуждение результатов и ценные советы. Работа поддержана грантом РФФИ № 16-05-00408.
МАТЕРИАЛ И МЕТОДЫ
Отлив нейрокраниальной полости Bissektipelta archibaldi (Averianov, 2002) был изготовлен с помощью голотипа PH, № 1/16 (рис. 1). Слепочный материал (полиуретановая резина “Ласил-С”) заливался несколько раз для точного воспроизведения всех деталей внутренней поверхности мозговой капсулы как через окципитальное, так и через обонятельные отверстия. Из 13 зональных слепков был реконструирован полный отлив мозга (рис. 2, а–в), который и стал основой для приведенного ниже описания и последующих заключений.
Рис. 1.
Bissektipelta archibaldi (Averianov, 2002), голотип PH, № 1/16, затылочная часть крыши черепа и мозговая коробка: а – дорсально, б – вентрально, в – рострально, г – окципитально. Обозначения: Fm – окципитальное отверстие; O – выходы обонятельных нервов и луковиц. Масштабная линейка – 3 см.
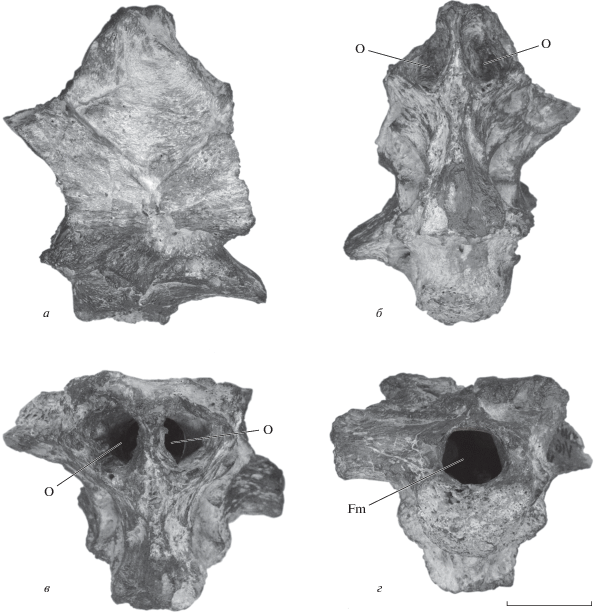
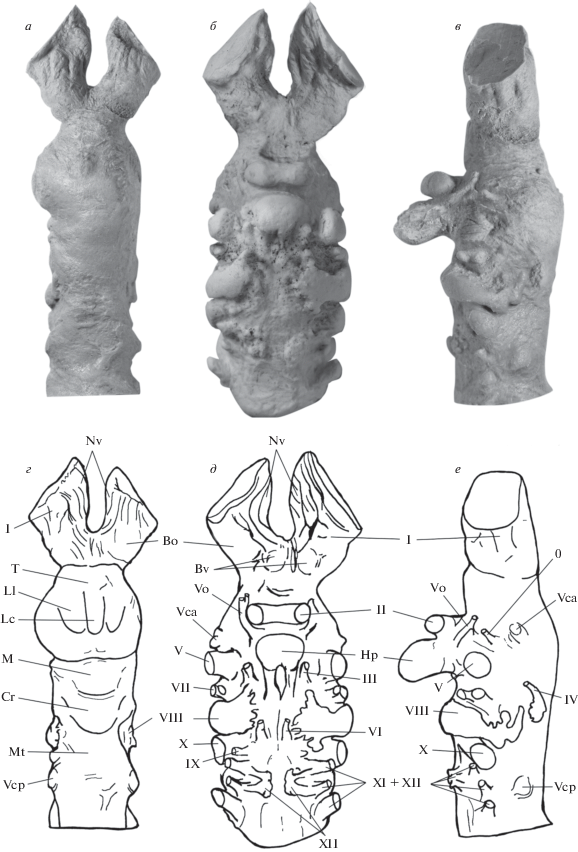
Рис. 2.
Искусственный отлив нейрокраниальной полости (а–в), выполненной по голотипу PH, № 1/16 Bissektipelta archibaldi (Averianov, 2002), и расшифровка деталей его строения (г–е): а, г – дорсально, б, д – вентрально, в, е – латерально. Обозначения: Bo – обонятельная луковица, Bv – вомероназальная луковица, Cr – мозжечок, Hp – гипофиз, Lc – центральная доля переднего мозга, Ll – левая латеральная доля переднего мозга, M – средний мозг, Mt – продолговатый и задний мозг, Nv – вомероназальный нерв, T – передний мозг, Vca – передняя мозговая вена, Vcp – задняя мозговая вена, Vo – глазничная мозговая вена; нервы: 0 – терминальный, I – обонятельный, II – зрительный нерв и хиазма, III – глазодвигательный, IV – блоковый, V – тройничный, VI – отводящий, VII – лицевой, VIII – слуховой, IX – языкоглоточный, X – блуждающий, XI – добавочный, XII – подъязычный. Масштабная линейка – 3 см.
В нейробиологическом анализе нами учитывался тот факт, что для тетрапод характерны устойчивые корреляции между диаметрами нервов и выраженностью выполняемой функции (Савельев и др., 2012). Это означает, что как при увеличении линейных размеров иннервируемой ткани или железы, так и при усложнении функций сенсорного органа диаметр обслуживающего его нерва пропорционально возрастает. Однако значение увеличения или уменьшения диаметра нерва можно оценить только после сравнительного анализа всего комплекса черепно-мозговых нервов. В анализе ключевую роль играют сопоставления монофункциональных нервов с размерами полифункциональных нервов. По изменению известного соотношения диаметров нервов можно говорить о возможном развитии или инволюции функции.
ОПИСАНИЕ
Длина эндокаста Bissektipelta archibaldi – 85 мм. Его максимальная ширина приходится на середину переднего мозга и составляет 35 мм. Наибольшую высоту – 34 см – мозг имеет в районе гипофизарной воронки. Высчитанный объем слепка составляет 82 см3. При этом масса мозга достигала приблизительно 90 г. Расчет производился, исходя из средней плотности нервной ткани у современных пресмыкающихся в 1.087 г/см3 и без учета объема желудочков и мозговых оболочек. Последние составляли примерно восьмую часть от объема мозговой капсулы.
Передний мозг (telencephalon) – крупнейший отдел всего головного мозга Bissektipelta archibaldi. Он короткий, а его длина практически равна ширине. Диаметр сечения переднего мозга в самой широкой части составляет примерно 33 мм. Анатомических признаков разделения переднего мозга на парные полушария не обнаружено. Вместе с тем на дорсальной поверхности этой части мозга видны три вытянутых продольно выпячивания, или доли (lobuli), имеющие четко выраженную структуру и разграничение бороздами (рис. 2, а, г). Центральная доля не имеет признаков углубления, соответствующих разделяющей полушария продольной борозде (fissura longitudinalis cerebry), в связи с чем возникает уверенность в ее отсутствии. Дорсальные выпячивания переднего мозга, как у биссектипельты, отмечаются у рыб, например, у скатов и некоторых видов акул (Савельев, 2001).
К переднему мозгу рострально примыкает сложный обонятельный комплекс (рис. 2, г, Nv, Bo). Он состоит из пучков вомероназальных нервов (n. vomeronasalis), которые начинаются от парных выступов, маркирующих вомероназальные луковицы (bulbus vomeronasalis). Нервы расположены ближе к медиальной оси с вентральной поверхности мозга. Латеральнее вомероназальных луковиц лежат обонятельные нервы (n. olfactorius, I). Они входят в массивные обонятельные луковицы (bulbus olfactorius). По диаметру основания вомероназально-обонятельный комплекс практически равен переднему мозгу.
Корешок терминального нерва (n. terminalis, 0) обнаружен дорсальнее передней мозговой вены (рис. 2, в, е). Этот черепно-мозговой нерв у большинства низших амниот рефлекторно контролирует движение воздуха и секреторную активность эпителия. По-видимому, в обонятельной системе у биссектипельты он выполнял аналогичные функции. Корешок нерва имеет крайне небольшие размеры, указывая на связь всей обонятельной системы с набором простейших функций. В частности, они не предполагают активный контроль движения воздушных потоков в носовых проходах. Кроме биссектипельты, терминальный нерв у других анкилозавров отметить не удалось, поскольку исследователи или его не видят, или смешивают с элементами системы кровоснабжения мозга. Для сравнения можно отметить, что у утконосых динозавров (Hadrosauridae) этот нерв крупный (Савельев и др., 2012).
Строение промежуточного мозга (diencephalon) на нейрокраниальном отливе биссектипельты можно оценить частично. С дорсальной стороны рельеф его поверхности не виден, а вентрально детали строения скрывает гипофиз, ассоциированный с венозным синусом.
Вентрально границу переднего и промежуточного мозга маркирует хиазма зрительных трактов (chiasma opticus), от которой начинаются парные и обычно крупные зрительные нервы. Поперечное сечение зрительных нервов (n. opticus, II) в области хиазмы на отливе мозга у биссектипельты составляет 4–4.5 мм (рис. 2, б, д). Это почти в 4 раза меньше, чем основание обонятельно-вомероназального комплекса.
Топографически с промежуточным мозгом связаны два крупных сосуда, представленные на отливе структурами в виде протяженных выступов. Это глазничная (venae orbitocerebellaris; рис. 2, б, д; Vo) и передняя мозговая (venae cerebrales anteriores; рис. 2, е, д; Vca) вены. Первая связана с кровоснабжением зрительной системы, а вторая – с обонятельной системой. Последняя вена визуально выглядит намного крупнее первой, что отражает приоритет кровоснабжения и уровень метаболизма каждой из систем анализаторов и согласуется с представлением о комплексе обонятельной рецепции как о ведущей системе афферентации.
Корешок глазодвигательного нерва (n. oculomotorius, III) у биссектипельты расположен сбоку от воронки гипофиза (рис. 2, б–e; Hp). Он имеет относительно небольшой диаметр, менее 1 мм, что указывает на слабую функциональную нагрузку на четыре из шести глазничных мышц (m. recti: superior, inferior, internus; m. obliquus inferior). Данный нерв у низших амниот обычно содержит автономные волокна, идущие к мускулатуре ресничного тела и радужины глаза, обеспечивающие зрачковые рефлексы и аккомодацию хрусталика.
Возможности управления глазными яблоками характеризуют также незначительные размеры корешка блокового нерва (n. trochlearis, IV). Его диаметр составляет меньше 1 мм. Этот нерв отвечает за работу верхней косой мышцы глаза (m. obliquus superior), управление которой у анкилозавра явно не носило сложного характера. Выход блокового нерва маркирует задний край крыши среднего мозга (рис. 2, д, е).
Корешок отводящего нерва (n. abducens, VI) расположен на вентральной поверхности заднего мозга, ближе к медиальной оси (рис. 2, д, е). Нерв отвечает за работу латеральной прямой мышцы (m. rectus lateralis), способной к отведению глазного яблока. Небольшой диаметр корешка (1 мм) согласуется со слабым развитием корешков других нервов, отвечающих за управление движением глаз (глазодвигательного и блокового), и с представлением о незначительной функциональной нагруженности зрительной системы.
Корешок тройничного нерва (n. trigeminus, V) очень крупный. Он имеет в сечении овальную форму, минимальный и максимальный диаметры которого составляют 6.5 и 8.5 мм. По размерам он примерно равен корешку блуждающего нерва, уступая только нервам обонятельной системы. Тройничный нерв обеспечивает соматическую чувствительность тканей головы и иннервирует челюстную мускулатуру. Учитывая размеры и функциональную специализацию тройничного нерва, следует отметить, что биссектипельта имела достаточно развитый вкусовой анализатор. В этом случае можно говорить о возможности сравнительно точного идентифицирования качества пищи: ее вкуса, состава и механических особенностей. Отмечаемая у всех тетрапод зависимость размера тройничного нерва со способностью оценивать качество пищи сформировалась через иннервацию ротовой полости и языка.
Задний (metencephalon), продолговатый (myelencephalon) мозг и мозжечок (cerebellum) у бессектипельты образуют единую морфологическую структуру, как у большинства низших тетрапод. Диаметр этого комплекса в самом широком месте составляет 22–23 мм, что на 10 мм меньше, чем у переднего мозга. Небольшой бугорок на месте мозжечка и расширение заднего и продолговатого мозга показывает (рис. 2, а, г; Cr, Mt), что сенсомоторные возможности у биссектипельты были ограничены так же, как и у современных черепах.
С задним и продолговатым мозгом связана серия нервов.
Корешок лицевого нерва (n. facialis, VII) расположен у биссектипельты между тройничным и слуховым нервами (рис. 2, б, д). Он представлен двумя обособленными и довольно крупными частями, диаметр которых составляет 2 и 3 мм. В целом крупный диаметр основного корешка лицевого нерва указывает на обильную иннервацию слизистой оболочки ротовой полости и вкусовых луковиц, согласуясь с отмеченным выше наблюдением о развитой системе распознавания качества пищи.
Корешок слухового нерва (n. vestibulocochlearis, VIII) расположен на латеральной части заднего мозга (рис. 2, а–е). Он крупный, но на искусственном отливе его разделение на обычные слуховой и вестибулярный компоненты установить не удается. Нерв переходит в слуховой ганглий, который хорошо заметен на отливе в виде протяженного бугорка, направленного в сторону вентральной поверхности мозга. Комплекс данных указывает на слабо развитый слух и несовершенный вестибулярный аппарат, что подтверждает представление об относительно пассивном образе жизни анкилозавров, сформированное на основании скелетных данных.
Корешок языкоглоточного нерва (n. glossopharyngeus, IX) на слепке биссектипельты расположен рядом с корешком блуждающего нерва, но ближе к медиальной линии комплекса продолговатого и заднего мозга (рис. 2, б, д). Его диаметр составляет 1.5 мм. Нерв содержит чувствующие и двигательные висцеральные волокна, которые иннервируют поперечнополосатую мускулатуру глотки, гортани, надгортанника и слюнных желез. Висцеральные чувствительные волокна языкоглоточного нерва рассеяны по всей ротовой полости и на языке, где они обслуживают вкусовые почки корня языка и рецепторную систему, направленную на определение механического состава пищи. У большинства современных рептилий языкоглоточный нерв интегрирован в общий корешок с блуждающим нервом. У биссектипельты этот нерв выходит самостоятельно, что предполагает его большую функциональную роль и согласуется с возникшим выше представлением о сложном подборе и дифференциации пищи.
Блуждающий нерв (n. vagus, X) расположен дорсальнее языкоглоточного нерва. Корешок имеет овальную форму с минимальным и максимальным диаметрами в 5 и 7.5 мм (рис. 2, б–е). Большой размер корешка указывает на крупные размеры блуждающего нерва. Он предполагает существование достаточно сложной рефлекторной системы центрального управления пищеварением, а также отвечает за развитость мускулатуры мягкого неба, гортани и сжимателей глотки. Это обстоятельство допускает предположение о возможности функционирования ротовой полости в качестве фильтрационного аппарата.
Добавочный (n. accessorius, XI) или подъязычный (n. hypoglossus, XII) черепно-мозговые нервы у биссектипельты выходят из мозга тремя смешанными корешками диаметром от 2 до 3.5 мм (рис. 2, б–е). Идентифицировать точно принадлежность каждого из них к тому или иному нерву нельзя, поскольку они могут содержать смешанные волокна, что часто бывает у современных рептилий. Однако возможно предположить, что у биссектипельты подъязычный нерв формирует два самостоятельных корешка, которые выходят из мозга ближе к средней линии вентральной поверхности ствола продолговатого мозга (рис. 2, б–д). Эти ветви выполняют двигательные функции. Судя по размеру (их диаметр составляет примерно 1 мм), можно говорить о наличии у биссектипельты крупного и подвижного языка, а также о развитой механорецепции дна ротовой полости.
ОБСУЖДЕНИЕ
Из литературных данных можно извлечь только некоторые самые общие сведения о строении мозга анкилозавров, поэтому провести детальное сравнение Bissektipelta archibaldi с другими видами трудно. Все же можно отметить, что передний мозг у ряда видов был заметно больше, чем у анкилозавра из Узбекистана. Не менее примечательно и то, что обонятельные луковицы и нервы у Kunbarrasaurus ieversi Leahey et al., 2015 из раннего мела Австралии не были обособлены друг от друга (Leahey et al., 2015), тогда как у Euoplocephalus tutus из позднего мела Северной Америки это разделение осуществлено, как у биссектипельты, но намного дальше от мозга (Miyashita et al., 2011). Нодозаврид Pawpawsaurus campbelli Lee, 1996 из раннего мела Северной Америки, как оказывается, обладал не только самой сложной организацией обонятельных трактов, луковиц и нервов, но и хорошо выраженными полушариями переднего мозга (Paulina-Carabajal et al., 2016). Более того, для кунбарразавра отмечается специализация вестибулярного аппарата и слуховой системы, которая выглядит совершеннее, чем, например, у Euoplocephalus tutus. Различия в зоне расположения обонятельного комплекса и переднего мозга разных видов анкилозавров говорят о том, что мозг в эволюции этой группы динозавров был подвержен прогрессивным изменениям, но в рамках характерного для пресмыкающихся архетипа.
Для архетипа мозга пресмыкающихся характерно развитие переднего мозга, первично связанного с обонятельной системой афферентации. Это коренное отличие пресмыкающихся от птиц, у современных представителей которых реализован тренд на развитие зрительной и вестибулярно-слуховой систем. Именно эти системы у динозавров на начальных и малоизвестных этапах их эволюции не играли существенной роли в поведении. На это же указывает опыт изучения мозга биссектипельты. Его примечательная архаичность наводит на представление о низком уровне организации центральной нервной системы динозавров на старте их дивергенции. Важно также учесть, что центральная нервная система тетрапод при смене направлений ее специализации не подвержена регрессивным или резким морфологическим изменениям (Савельев, 2001).
Архаичность мозга Bissektipelta archibaldi выражется в том, что он прямой и небольшой по размеру относительно размеров тела и головы. При этом биссектипельта отличалась небольшими размерами переднего мозга, а также не имела четкой анатомической выраженности отделов, которые говорили бы о специализации органов чувств за счет центральной нервной системы. Незначительный объем нервной ткани, необходимый для обонятельной системы, как ведущей системы афферентации, предполагает выполнение сравнительно простых обонятельных функций. При этом распознавание качества пищи и половых партнеров у биссектипельты, видимо, происходило благодаря развитому устройству периферического рецепторного аппарата. Аналогия такого рода усиления чувствительности отмечается у хрящевых рыб (Савельев, 2001). Наращиванию периферического рецепторного аппарата способствовала система носовых полостей, которая у анкилозавров несла как основной (обонятельный), так и вомероназальный (половой) рецепторный эпителий. Другие объяснения наличия этих полостей (о них кратко говорилось в начале статьи), в сравнении с обонятельной гипотезой, и не очевидны, и малоубедительны.
Хорошо выраженные корешки нервов, связанных с обслуживанием пищеварительной системы, указывает на то, что у биссектипельты существовала сложная система управления пищеварением. По-видимому, представители этого вида поедали как растительную, так и животную пищу, которой могли служить как мягкотелые, так и хитинизированные беспозвоночные. Смешанный тип питания реконструируется по обособлению выхода из мозга языкоглоточного нерва. Развитость мускулатуры мягкого неба, гортани и сжимателей глотки, устанавливаемая по развитости блуждающего нерва, не исключает возможность функционирования ротовой полости в качестве фильтрационного аппарата.
В целом представление об образе жизни анкилозавров по данным строения мозга позволяет говорить о том, что это были малоактивные животные, которые в пищедобывательном поведении и внутривидовых отношениях использовали, главным образом, органы обоняния, и руководствовались, как современные пресмыкающиеся, исключительно инстинктивными формами поведения.
Список литературы
Алифанов В.Р., Савельев С.В. Строение мозга и нейробиология альваресзавров (Dinosauria) на примере Ceratonykus oculatus (Parvicursoridae) из позднего мела Монголии // Палеонтол. журн. 2011. № 2. С. 61–69.
Савельев С.В. Сравнительная анатомия нервной системы позвоночных. М.: Гэотар-мед, 2001. 272 с.
Савельев С.В., Алифанов В.Р. Новое исследование мозга хищного динозавра Tarbosaurus bataar (Theropoda, Tyrannosauridae) // Палеонтол. журн. 2007. № 3. С. 47–55.
Савельев С.В., Алифанов В.Р., Болотский Ю.Л. Анатомия мозга Amurosaurus riabinini и некоторые особенности нейробиологии утконосых динозавров // Палеонтол. журн. 2012. № 1. С. 77–88.
Туманова Т.А. Инфраотряд Ankylosauria // Ископаемые позвоночные России и сопредельных стран. Ископаемые рептилии и птицы. Часть 2 / Ред. Курочкин Е.Н., Лопатин А.В. М: ГЕОС, 2012. С. 310–324.
Arbour V.M., Currie P.J. Systematics, phylogeny and paleobiogeography of the ankylosaurid dinosaurs // J. Syst. Palaeontol. 2016. V. 14. № 5. P. 385–444.
Averianov O.A. An ankylosaurid (Ornithischia: Ankylosauria) braincase from the Upper Cretaceous Bissekty Formation of Uzbekistan // Bull. Inst. Roy. Sci. Natur. Belg. 2002. V. 72. P. 97–110.
Coombs W.P. Jr. An endocranial cast of Euoplocephalus (Reptilia, Ornithischia) // Palaeontogr. Abt. A. 1978. Bd 161. № 4–6. P. 176–182.
Coombs W.P.Jr., Maryańska T. Ankylosauria // The Dinosauria / Eds. Weishampel D.B., Dodson P., Osmólska H. Berkeley: Univ. California Press, 1990. P. 456–483.
Dong Z. An ankylosaur (ornithischian dinosaur) from the Middle Jurassic of the Junggar Basin, China // Vertebr. PalAsiat. 1993. V. 31. № 4. P. 258–266.
Dong Z. A new armored dinosaur (Ankylosauria) from Beipiao Basin, Liaoning Province, Notheastern China // Vertebr. PalAsiat. 2002. V. 40. № 4. P. 276–285.
Hopson J.A. Paleoneurology // Biology of the Reptilia. V. IX: Neurology A / Eds. Gans C. N.Y.: Acad. Press, 1979. P. 39–146.
Leahey L., Molnar R., Carpenter K. et al. Cranial osteology of the ankylosaurian dinosaur formerly known as Minmi sp. (Ornithischia: Thyreophora) from the Lower Cretaceous Allaru Mudstone of Richmond, Queensland, Australia // PeerJ. 2015. V. 3. P. 1–47.
Miyashita T., Arbour V.M., Witmer L.M., Currie P.J. The internal cranial morphology of an armoured dinosaur Euoplocephalus corroborated by X-ray computed tomographic reconstruction // J. Anat. 2011. V. 219. № 6. P. 661–675.
Molnar R.E., Clifford H.T. Gut contents of a small ankylosaur // J. Vertebr. Paleontol. 2000. V. 20. № 1. P. 194–196.
Norman D.B., Faiers T. On the first partial skull of an ankylosaurian dinosaur from the Lower Cretaceous of the Isle of Wight, Southern England // Geol. Mag. 1996. V. 133. P. 299–310.
Ősi A., Pereda Suberbiola X., Földes T. Partial skull and endocranial cast of the ankylosaurian dinosaur Hungarosaurus from the Late Cretaceous of Hungary: implications for locomotion // Palaeontol. Electron. 2014. V. 17. № 1. P. 1–18.
Parish J.C., Barrett P.M. A reappraisal of the ornithischian dinosaur Amtosaurus magnus Kurzanov and Tumanova, 1978, with comments on the status of A. archibaldi Averianov, 2002 // Can. J. Earth Sci. 2004. V. 41. № 3. P. 299–306.
Paulina-Carabajal A., Lee Y., Jacobs L.L. Endocranial morphology of the primitive dinosaur Pawpawsaurus campbelli from the Early Cretaceous of North America // Plos ONE. 2016. V. 11. № 3. P. 1–22.
Pereda Suberbiola J., Galton P.M. Revision of the cranial features of the dinosaur Struthiosaurus austriacus Bunzel (Ornithischia: Ankylosauria) from the Late Cretaceous of Europe // N. Jb. Geol. Paläontol. Abh. 1994. Bd 191. P. 173–200.
Vickaryous M.K., Maryańska T., Weishampel D.B. Ankylosauria // The Dinosauria. 2nd ed. / Eds. Weishampel D.B., Dodson P., Osmólska H. Berkeley: Univ. California Press, 2004. P. 363–392.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


