Палеонтологический журнал, 2019, № 5, стр. 82-89
Длиннорылая колюшка Aulichthys miocaenicus sp. nov. из миоцена о. Сахалин (Россия) – первая достоверная находка ископаемого представителя семейства Aulorhynchidae
М. В. Назаркин *
Зоологический институт РАН
Санкт-Петербург, Россия
* E-mail: m_nazarkin@mail.ru
Поступила в редакцию 03.04.2018
После доработки 25.05.2018
Принята к публикации 25.05.2018
Аннотация
Вымерший вид длиннорылых колюшек современного рода Aulichthys, А. miocaenicus sp. nov., обнаружен в отложениях серравалия–тортона агневской свиты о. Сахалин. Это первая достоверная находка ископаемого представителя семейства. Миоценовый вид сходен с единственным современным сородичем в основных пропорциях и морфологических особенностях, но отличается сильно развитым костным вооружением: крупными туловищными щитками, а также длинными брюшной и анальной колючками. Особенностью миоценового вида является также интенсивная скульптура поверхности туловищных щитков и брюшной колючки. Присутствие длиннорылых колюшек в комплексе ископаемых агневской свиты свидетельствует о небольшой глубине обитания этого сообщества, а также о более теплых климатических условиях, существовавших в миоцене на широте этого местонахождения.
Cемейство длиннорылых колюшек Aulorhynchidae включает в себя два монотипических рода современных рыб, распространенных в северной части Тихого океана: Aulichthys japonicus Brevoort, 1862, населяет Японское море и тихоокеанское побережье о. Хонсю, а Aulorhynchus flavidus Gill, 1861 встречается у западного побережья Северной Америки от Аляски до Калифорнии (Gill, 1862; Clemens, Wilby, 1961; Линдберг, Легеза, 1965; Miller, Lea, 1972; Hart, 1973; Ida, 1984; Senou, 2002; Mecklenburg et al., 2002; Nelson, 2006; Nelson et al., 2016). Оба современных вида ведут стайный, придонно-пелагический образ жизни на покрытых водорослями прибрежных мелководьях до глубины 30 м (Ida, 1984; Mecklenburg et al., 2002; Senou, 2002).
Длиннорылые колюшки – небольшие рыбы, их стандартная длина (SL) не превышает 188 мм (Mecklenburg et al., 2002). Они обладают удлиненным телом, покрытым продольными рядами костных щитков, длинным трубковидным рылом, длинным и вертикально уплощенным хвостовым стеблем, вильчатым хвостовым плавником (Зюганов, 1991). В начале спинного плавника имеются 23–27 очень коротких изолированных колючек, второй спинной и анальный плавники треугольные и расположены супротивно. По одному короткому колючему лучу имеются в начале анального и в брюшном плавнике, членистых лучей брюшного плавника четыре. Несмотря на большое внешнее сходство, роды Aulorhynchidae существенно различаются некоторыми морфологическими особенностями. Японские колюшки Aulichthys japonicus отличается от американских Aulorhynchus flavidus длинной тазовой костью, отсутствием лишенных колючек птеригиофоров в начале спинного плавника, наличием плевральных ребер, шипов на пластинках боковой линии и другими признаками (Линдберг, Легеза, 1965; Nelson, 1971; Bowne, 1994).
Семейство длиннорылых колюшек традиционно помещалось в состав отряда Gasterosteiformes (Берг, 1955; Nelson, 1971, 1994, 2006; Johnson, Patterson, 1993; Bowne, 1994), объем и родственные связи которого разными авторами принимались неодинаково (см. обзор в: Keivany, Nelson, 2006). Большинство авторов рассматривало аулоринхид в качестве наиболее близкой, сестринской группы семейства колюшковых Gasterosteidae (Nelson, 1971; Bowne, 1994; Keivany, Nelson, 2006). Современные молекулярно-генетические исследования отвергают монофилию Gasterosteiformes в традиционном понимании (Gasterosteoidei + Syngnathoidei) (Kawahara et al., 2008, 2009; Near et al., 2013), и в настоящее время подотряд Gasterosteoidei в составе четырех семейств – Aulorhynchidae, Gasterosteidae, Hypoptychidae и Indostomidae – помещают в кладу, содержащую также часть семейств традиционных Perciformes и Scorpaeniformes (Nelson et al., 2016). При этом, как и при анализе морфологических признаков, семейства Aulorhynchidae и Gasterosteidae занимают сестринское положение по отношению друг к другу (Kawahara et al., 2008).
Ранее достоверные ископаемые остатки длиннорылых колюшек не были известны. Вымерший род и вид Protaulopsis bolcensis Woodward из раннего эоцена (ипр) Монте-Больки (Италия) изначально был отнесен к семейству Aulorhynchidae (Woodward, 1901). Позднее Ж. Бло (Blot, 1980), ревизовавший фауну рыб Монте-Больки, вывел эоценовый вид из состава этого семейства. В настоящее время P. bolcensis рассматривается в качестве Acanthopterygii incertae sedis (Bannikov, 2014; Carnevale et al., 2014).
Эоценовый Protosyngnathus sumatrensis von der Mark из озерных отложений Суматры – второй вымерший таксон, помещенный в семейство длиннорылых колюшек и отнесенный к роду Aulorhynchus А. Вудвардом (Woodward, 1901). Он отличается от Aulorhynchus наличием свободных ребер, а от семейства Aulorhynchidae в целом – увеличенным первым позвонком, что позволило Дж. Буланже (Boulenger, 1902) выделить для него отдельное семейство Protosyngnathidae, близкое к Aulorhynchidae. Выделение отдельного семейства для этого ископаемого таксона было поддержано Д. Джордэном (Jordan, 1963) и Л.С. Бергом (1955), а позднее К. Паттерсон (Patterson, 1993) высказал сомнение в принадлежности Protosyngnathus к семейству Aulorhynchidae. Таким образом, таксономическое положение P. sumatrensis все еще остается неопределенным.
Несколько неполных скелетов Aulorhynchidae были обнаружены в коллекции ископаемых из агневской свиты о. Сахалин (Назаркин, 2000). Результаты изучения показали, что эти остатки принадлежат вымершему виду длиннорылых колюшек, описание которого приведено ниже.
МАТЕРИАЛ И МЕТОДИКА
Материал происходит из тонкозернистых песчаников агневской свиты о. Сахалин (Кузина, Ратновский, 1970), и собран в местонахождении, расположенном в 1 км к северу от устья р. Агнево на западном побережье острова (Фотьянова, Серова, 1987). Образцы представлены четырьмя фрагментами посткраниального скелета различной степени полноты и сохранности. Материал депонирован в палеонтологической секции ихтиологической коллекции Зоологического ин-та РАН, Санкт-Петербург (ЗИН). Стандартная длина тела использована в качестве основного промера. Измерения выполнены штангенциркулем с точностью до 0.1 мм. Рисунки изготовлены по цифровым фотографиям. Очистка ископаемых образцов проводилась препаровальными иглами под стереомикроскопом. Строение скелета современных Aulichthys japonicus изучено по ализариновым препаратам двух не каталогизированных экземпляров 128.0–132.0 мм SL, а также по рентгеноснимкам следующих рыб из коллекции Зоологического ин-та: ЗИН 1412, 1 экз., 130.0 мм SL; ЗИН 12445, 1экз., 87.5 мм SL; ЗИН 22431, 2 экз., 107.0–117.0 мм SL; ЗИН 54140, 2 экз., 123.0–124.5 мм SL.
ПОДОТРЯД GASTEROSTEOIDEI
СЕМЕЙСТВО AULORHYNCHIDAE GILL, 1861
Род Aulichthys Brevoort, 1862
Aulichthys miocaenicus Nazarkin, sp. nov.
Название вида по миоценовому возрасту местонахождения.
Голотип – ЗИН № 139п, скелет без головы и грудного плавника, длина отпечатка 84.4 мм; Россия, Сахалинская обл., о-в Сахалин, Александровский р-н, береговой обрыв Татарского пролива в 1 км к северу от устья р. Агнево; средний-верхний миоцен (серравалий–тортон), агневская свита.
Описание (рис. 1; 2; 3, а; 4, б, в). Голотип представляет собой целиком сохранившийся посткраниальный скелет, без головы и грудного плавника. Тело низкое, сильно удлиненное (рис. 1). Наибольшая высота приходится на вертикаль начала анального плавника, и укладывается в длине сохранившегося фрагмента тела более 10 раз. Хвостовой стебель узкий и длинный, его высота более трех раз содержится в наибольшей высоте тела.
Рис. 1.
Aulichthys miocaenicus sp. nov., голотип ЗИН № 139п, фотография (а) и контурный рисунок скелета (б). Шкала 10 мм.

Позвонки симметричные, большей частью умеренно удлиненные – длина тела туловищного позвонка примерно в 1.5 раза превышает его высоту. Преуральные позвонки pu2–pu4 значительно укорочены и, как и у современного вида, их высота несколько больше длины. Точное число позвонков неизвестно. В передней части тела, перед первым птеригиофором анального плавника, различимы тела 24 туловищных позвонков. Тела еще семи позвонков видны над основанием анального плавника. Далее назад на всем протяжении хвостового стебля позвонки неразличимы, за исключением задних преуральных центров. На телах передних сохранившихся туловищных позвонков 14–21 имеются довольно длинные парапофизы, а ниже 10–23 позвонков различимы плевральные ребра, длина которых превосходит длину позвонка в три–четыре раза (рис. 2, а, б). Длинные и тонкие невральные отростки тел 23–26 позвонков слабо отклонены назад и глубоко внедряются между птеригиофорами спинного плавника.
Рис. 2.
Aulichthys miocaenicus sp. nov., голотип ЗИН № 139п, контурный рисунок скелета в области брюшного (а), спинного (б) и хвостового (в) плавников. Обозначения: as – анальная колючка; dp – спинные пластинки; ds – спинные колючки; llp – боковые пластинки; par – парапофизы; pel – тазовая кость; pl – ребра; pu2 – второй преуральный центр; v – позвонковый центр; vp – брюшные пластинки; vs – брюшная колючка. Шкала 5 мм.
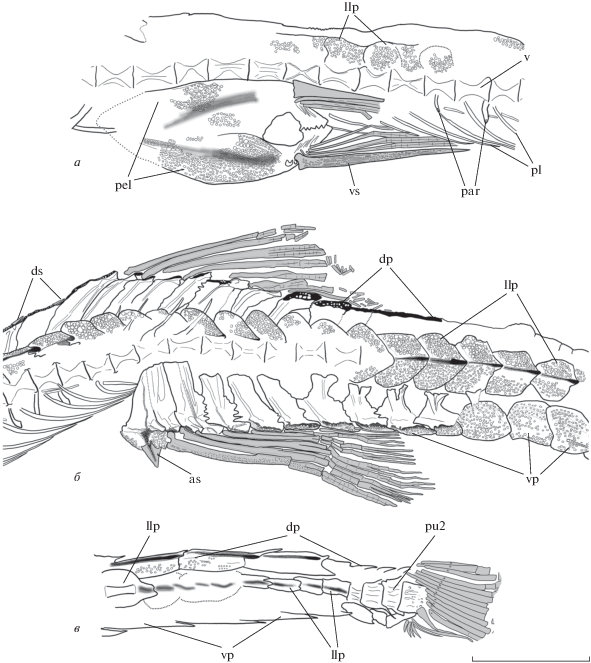
Спинной плавник в передней части содержит очень короткие гладкие изолированные колючие лучи. Две таких колючки сохранились у голотипа на двух птеригиофорах, предшествующих штатному птеригиофору первого членистого луча (рис. 2). Второй спинной плавник треугольный, состоит, как минимум, из семи членистых ветвистых лучей, высота которых значительно уменьшается кзади. По-видимому, самые задние членистые лучи, очень слабые и короткие у современного вида, не сохранились у ископаемого. Передний птеригиофор второго спинного плавника расположен, по-видимому, перед невральной дугой 21-го видимого позвонка. Дистально спинные птеригиофоры образуют широкую костную пластинку с интенсивно скульптированной поверхностью, отверстием для соединения с лучом и продольным желобком (рис. 3). Ширина такой пластинки 1.1–1.3 раза укладывается в ее длине. Проксимальные участки птеригиофоров спинного плавника расширены в сагиттальной плоскости; под вторым спинным плавником их края контактируют, иногда с образованием шва в форме зигзага (рис. 2). Позади заднего луча спинного плавника, на хвостовом стебле, ряд дорсальных птеригиофоров, лишенных лучей, но снабженных костными щитками, продолжается до основания хвостового плавника. Точное число щитков спинного ряда не удается установить.
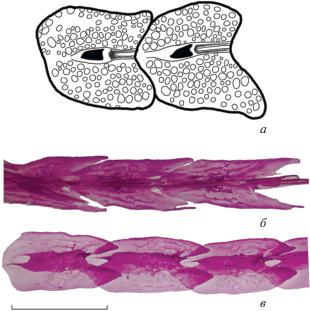
Рис. 3.
Костное вооружение длиннорылых колюшек: предорсальные пластинки спинного ряда Aulichthys miocaenicus sp. nov., экз. ЗИН № 141п (а) и современного A. japonicus, экз. ЗИН, не каталогизирован (б); латеральные пластинки современного A. japonicus, экз. ЗИН, не каталогизирован (в). Шкала 2 мм.
Анальный плавник треугольный, расположен супротивно второму спинному; основание его первого луча находится примерно на вертикали 24–25-го видимого позвонка. Имеется один колючий и, по крайней мере, восемь членистых ветвистых лучей, из которых второй самый высокий. Анальная колючка в 1.8 раза длиннее, а ее основание вчетверо шире основания спинных колючек. Задняя поверхность анальной колючки вогнута. Строение птеригиофоров анального плавника сходно с таковым дорсальных птеригиофоров. Передний анальный птеригиофор наиболее мощный, с широкой трапециевидной, интенсивно скульптированной дистальной пластинкой, к которой крепится колючий луч. Позади заднего луча анального плавника имеются лишенные лучей птеригиофоры, дистальные костные пластинки которых образуют вентральный ряд, достигающий основания хвостового плавника. Ширина пластинок вентрального ряда около 1.5 раза содержится в их длине и примерно равна высоте пластинок туловищного бокового ряда.
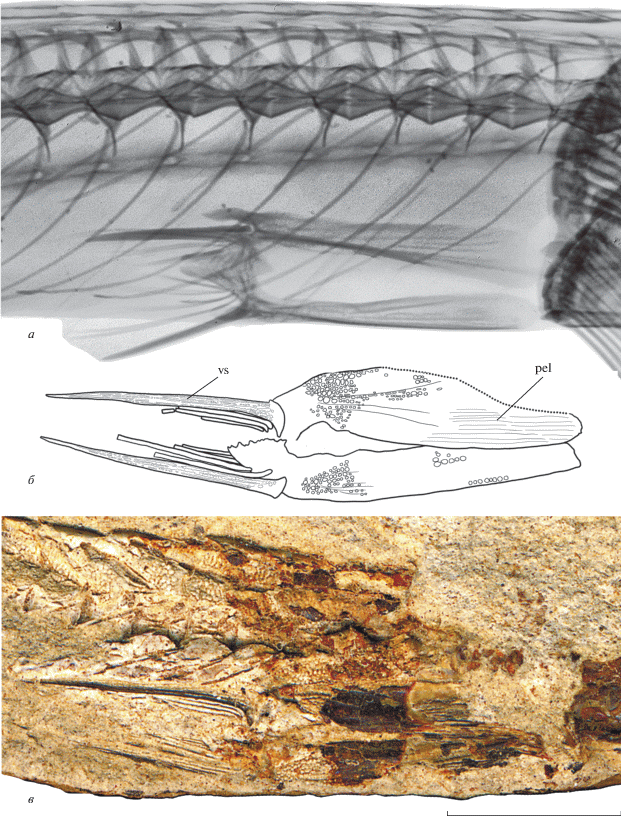
Брюшной плавник расположен в передней части тела, по-видимому, недалеко позади грудного плавника, как и у современного вида; основание его колючего луча находится на уровне 9–10-го позвонка голотипа. Тазовая кость широкая и длинная, ее длина соответствует длине 6.3–6.8 туловищных позвонков. Имеются короткий задний и длинный передний отростки этой кости (рис. 2, а; 4, б, в). Восходящий отросток, направленный преимущественно назад у современных длиннорылых колюшек, неразличим у миоценового вида. Задние отростки левого и правого os pelvis соединены друг с другом швом с взаимопроникновением, в то время как передние, по-видимому, свободны. Передние отростки широкие, по средней линии слабовогнутые, их наружная поверхность покрыта интенсивным ячеистым рельефом. В брюшном плавнике одна колючка и четыре членистых луча, из которых, по крайней мере, три внешних ветвистые. Брюшная колючка немного длиннее членистых лучей (рис. 2, а); ее длина 1.3–1.5 раза содержится в длине тазовой кости и соответствует длине 4.6–4.8 туловищных позвонков. Поверхность брюшной колючки от основания и почти до самого кончика гранулирована мелкими бугорками, образующими продольные ряды (рис. 2, а; 4, б, в).
Рис. 4.
Область брюшного плавника длиннорылых колюшек: а – рентгеноснимок современного Aulichthys japonicus, экз. ЗИН № 54140, 124.5 мм SL; б, в – A. miocaenicus sp. nov., экз. ЗИН № 448п: б – контурный рисунок скелета брюшного плавника, в – соответствующий фрагмент скелета. Изображение современного вида масштабировано так, чтобы длина тазовых костей была равна таковой у ископаемого. Обозначения как на рис. 2. Шкала 5 мм.
Хвостовой плавник с медиальной выемкой; состоит из 13 основных лучей, которые, вероятно, ветвятся. Вентральных укороченных лучей 7, дорсальные лучи не сохранились. Детали строения скелета хвостового плавника неизвестны, поскольку на всех имеющихся отпечатках он закрыт хвостовыми лучами.
На теле имеются два ряда боковых пластинок, протягивающихся до основания хвостового плавника. На большей части ряда пластинки высокие, овальные или сердцевидные. Их поверхность скульптирована рельефом в виде многочисленных тесно расположенных мелких ямок, аналогичным таковому на брюшных и спинных щитках, а также на тазовой кости (рис. 2). Передние пластинки налегают на последующие. Высота пластинок равна или немного меньше их длины. На каждой пластинке имеется направленный назад боковой шип. На некоторых передних пластинках видна вырезка отверстия туловищного сенсорного канала. На хвостовом стебле, ближе к основанию хвостового плавника, пластинки узкие, субпрямоугольные и, по-видимому, без рельефа. Наиболее полно боковые пластинки сохранились на голотипе. Здесь различимы пластины правого ряда: 11 перед началом анального плавника; 12 сразу позади вертикали основания анальной колючки; и далее, после перерыва, еще 8 пластин в задней части хвостового стебля (рис. 1, б). Боковые пластины отделены промежутком от спинного и брюшного рядов пластин, не смыкаясь с ними даже на хвостовом стебле.
Размеры голотипа в мм. Длина, восстановленная через пропорцию с современным видом относительно высоты тела у начала анального плавника, 119.0 мм SL. Высота тела на уровне начала анального плавника 7.8 мм; высота хвостового стебля 2.4 мм; высота спинного плавника >7.5 мм; высота анального плавника 10.6 мм; длина брюшной колючки 7.4 мм; длина хвостового плавника 7.9 мм; длина 10 туловищных позвонков 12.7 мм; расстояние между началом анального плавника и основанием хвостового плавника 46.0 мм; расстояние между основанием брюшного и началом второго спинного плавника 21.3 мм.
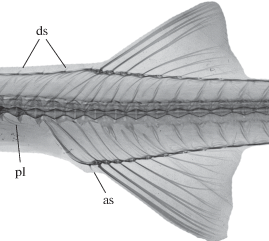
Сравнение. Aulichthys miocaenicus sp. nov. отличается от единственного современного вида рода более развитым костным вооружением. Длина брюшной колючки, выраженная в длине расположенных над ней позвонков, у миоценового вида колеблется в пределах 4.6–4.8 (vs. 1.7–2.9 у современного); аналогично выраженная длина тазовой кости у A. miocaenicus 6.3–6.8 (vs. 3.9–5.0); колючий луч брюшного плавника длиннее членистых (vs. короче членистых); брюшная колючка покрыта рельефом (vs. гладкая); анальная колючка в 1.8 раза длиннее спинных (vs. примерно равны; рис. 5); костные пластинки всех рядов широкие, их ширина содержится не более 1.5 раза в длине (vs. узкие, удлиненные, ширина не менее двух раз в длине) (рис. 3); пластинки всех рядов покрыты интенсивным ячеистым рельефом (vs. слабый рельеф в виде редких гребней и ямок).
Рис. 5.
Рентгеноснимок области спинного плавника современного Aulichthys japonicus, экз. ЗИН 54140, 123.0 мм SL. Обозначения как на рис. 2.
Замечания. Несмотря на то, что имеющийся по новому виду материал представлен неполными скелетами, некоторые важные особенности строения миоценовых длиннорылых колюшек на них легко различимы. Миоценовая колюшка обладает основными диагностическими признаками семейства: значительно удлиненное тело, покрытое боковыми костными пластинками; многочисленные равные по высоте колючки в передней части спинного плавника; передний отросток тазовой кости длиннее заднего; четыре членистых луча брюшного плавника; отчетливо раздвоенный хвостовой плавник (Nelson, 1971; Bowne, 1994; Keivany, Nelson, 2006). Современные длиннорылые колюшки характеризуются также сравнительно большим числом позвонков (50–56) и боковых туловищных пластинок (52–57) (Nelson, 1971; Senou, 2002). Вероятно, эти признаки у миоценового вида были близки к указанным значениям, поскольку его пропорции, в целом, совпадают с пропорциями современных видов, а на голотипе различимо не менее 35 позвонков и 31 боковой пластины. В то же время, от обоих современных представителей семейства миоценовая колюшка отличается более длинными брюшными колючками и более крупными костными пластинами туловищных рядов. Очевидно, редукция костного вооружения была одним из направлений послемиоценовой эволюции этого семейства. Наличие плевральных ребер и коротких шипов на туловищных боковых пластинках, а также удлиненный передний отросток тазовой кости миоценового вида отличают его от американского рода и свидетельствуют о его принадлежности к западно-тихоокеанскому роду Aulichthys (Nelson, 1971).
Материал. Помимо голотипа, ЗИН 140п, фрагмент хвостового стебля длиной 47.0 мм; ЗИН 141п, скелет хвостовой части тела с разрушенными спинным и анальным плавниками длиной 54.0 мм; ЗИН 448п, фрагмент центральной части туловища, включающий в себя брюшной и спинной плавники, длиной 47.3 мм; все из типового местонахождения.
* * *
Присутствие длиннорылых колюшек в комплексе ископаемых агневской свиты дает возможность реконструировать две важные экологические характеристики данной акватории в миоцене. Современные колюшки Aulichthys относительно теплолюбивы и, по-видимому, не встречаются севернее южного побережья о. Хоккайдо, то есть 42° с. ш. Агневское местонахождение миоценовых рыб расположено на 50-й параллели. Весьма вероятно, таким образом, что климатические условия в период формирования пород агневской свиты в миоцене были более теплыми, аналогичными современным на широте южного Хоккайдо. Современные длиннорылые колюшки не опускаются глубже 30 м (Mecklenburg et al., 2002), то есть не покидают фотической зоны. Вероятно, их миоценовые родственники, столь сходные морфологически, вели подобный образ жизни. Отсюда можно сделать вывод о том, что миоценовое сообщество рыб агневской свиты населяло относительно мелководный биотоп в фотической зоне.
Автор выражает глубокую признательность Г. Шинохара и Й. Таката (Gento Shinohara, Yohko Takata, National Museum of Nature and Science, Токио, Япония) за предоставленные материалы по современным длиннорылым колюшкам, а также П.В. Кияшко (ЗИН) за помощь в изготовлении фотографий современных рыб. Работа поддержана РФФИ (грант № 17-04-00596а).
Список литературы
Берг Л.С. Система рыбообразных и рыб, ныне живущих и ископаемых. Изд. 2-е // Тр. Зоол. ин-та АН СССР. 1955. Т. 20. 286 с.
Зюганов В.В. Семейство колюшковых (Gasterosteidae) мировой фауны. Л.: Наука, 1991. 260 с. (Фауна СССР. Рыбы. Т. V. Вып. 1).
Кузина И.Н., Ратновский И.И. Александровский район // Геология СССР. Том XXXIII. Остров Сахалин. Геологическое описание / Ред. Верещагин В.Н., Ковтунович Ю.М. М.: Недра, 1970. С. 153–157.
Линдберг Г.У., Легеза М.И. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 2. Teleostomi. XII. Acipenseriformes – XXVIII. Polynemiformes. М.-Л.: Наука, 1965. 391 с.
Назаркин М.В. Миоценовые рыбы из агневской свиты острова Сахалин: фауна, систематика и происхождение: Автореф. дис. … канд. биол. наук. СПб., 2000. 22 с.
Фотьянова Л.И., Серова М.Я. Позднемиоценовый климатический оптимум северо-запада Тихоокеанской провинции // Изв. АН СССР. Сер. геол. 1987. № 5. С. 38–51.
Bannikov A.F. The systematic composition of the Eocene actinopterygian fish fauna from Monte Bolca, northern Italy, as known to date // Studi e ricerche sui giacim. terz. di Bolca. Miscellanea paleontologica n. 12. 2014. V. 15. P. 23–34.
Blot J. La faune ichthyologique des gisements du Monte Bolca (Province de Vérone, Italy). Catalogue systématique présentat l’état actuel des recherches concernant cette faune // Bull. Mus. Nat. Hist. Natur. Paris. 1980. Sér. 4, Sect. C. T. 2. № 4. P. 339–396.
Boulenger G.A. Notes on the classification of teleostean fishes. III. On the systematic position of the genus Lampris, and on the limits and contents of the suborder Catosteomi // Ann. Mag. Natur. Hist. 7th ser. 1902. V.10. № 56. P. 147–152.
Bowne P.S. Systematics and morphology of the Gasterosteiformes // Evolutionary Biology of the Threespine Stickleback. Oxford: Oxford Univ. Press, 1994. P. 28–60.
Carnevale G., Bannikov A.F., Marramá G., Tyler J.C., Zorzin R. The Pesciara-Monte Postale Fossil-Lagerstätte: 2. Fishes and other vertebrates // The Bolca Fossil-Lagerstätten: A window into the Eocene World. Modena, 2014. P. 37–63 (Rend. Soc. Paleontol. Ital. № 4).
Clemens W.A., Wilby G.V. Fishes of the Pacific Coast of Canada // Bull. Fish. Res. Bd. Canada. 1961. V. 68. 443 p.
Gill T. On a new genus of fishes allied to Aulorhynchus and on the affinities of the family Aulorhynchidae, to which it belongs // Proc. Acad. Natur. Sci. Philad. 1862. P. 233–235.
Hart J.L. Pacific Fishes of Canada // Fish. Res. Board Canada. Bull. 1973. V. 180. 740 p.
Ida H. Family Aulorhynchidae, tubesnouts // The Fishes of the Japanese Archipelago / Eds. Masuda H., Amaoka K., Araga C. et al. Tokyo: Tokai Univ. Press, 1984. V. 1. 437 p.
Johnson G.D., Patterson C. Percomorph phylogeny: A survey of acanthomorphs and a new proposal // Bull. Mar. Sci. 1993. V. 52. P. 554–626.
Jordan D.S. The genera of fishes and a classification of fishes. Stanford: Stanford Univ. Press, 1963. 800 p.
Kawahara R., Miya M., Mabuchi K. et al. Interrelationships of the 11 gasterosteiform families (sticklebacks, pipefishes, and their relatives): A new perspective based on whole mitogenome sequences from 75 higher teleosts // Mol. Phylog. Evol. 2008. V. 46. P. 224–236.
Kawahara R., Miya M., Mabuchi K. et al. Stickleback phylogenies resolved: Evidence from mitochondrial genomes and 11 nuclear genes // Mol. Phylog. Evol. 2009. V. 50. P. 401–404.
Keivany Y., Nelson J.S. Interrelationships of Gasterosteiformes (Actinopterygii, Percomorpha) // J. Ichthyol. 2006. V. 46. Suppl. 1. P. S84–S96.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. Fishes of Alaska. Bethesda: Amer. Fisheries Soc., 2002. 1037 p.
Miller D.J., Lea R.N. Guide to the coastal marine fishes of California // Calif. Fish Bull. 1972. V. 157. P. 1–235.
Near T.J., Dornburg A., Eytan R.I. et al. Phylogeny and tempo of diversification in the super radiation of spiny-rayed fishes // Proc. Nat. Acad. Sci. USA. 2013. V. 110(31). P. 12738–12743.
Nelson J.S. Comparison of the pectoral and pelvic skeleton and of some other bones and their phylogenetic implications in the Aulorhynchidae and Gasterosteidae (Pisces) // J. Fish. Res. Board Can. 1971. V. 28. P. 427–442.
Nelson J.S. Fishes of the World. 3rd ed. N. Y.: John Wiley & Sons, 1994. 600 p.
Nelson J.S. Fishes of the World. 4th ed. Hoboken: John Wiley & Sons, 2006. 601 p.
Nelson J.S., Grande T.C., Wilson M.V.H. Fishes of the World. 5th ed. Hoboken: John Wiley & Sons, 2016. 707 p.
Patterson C. Osteichthyes. Teleostei // The Fossil Record 2 / Ed. Benton M.J. L.: Chapman & Hall, 1993. P. 621–656.
Senou H. 170. Aulorhynchidae, tubesnouts // Fishes of Japan With Pictorial Keys to the Species. English ed. / Ed. Nakabo T. Tokyo: Tokai Univ. Press, 2002. P. 512, 1503.
Woodward A.S. Catalogue of the fossil fishes in the British Museum (Natural History). V. IV. L.: Brit. Museum (Natur. Hist.), 1901. 638 p.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


