Палеонтологический журнал, 2020, № 3, стр. 5-10
Железобактерии Gallionella (?) в архее Индии
М. М. Астафьева *
Палеонтологический институт им. А.А. Борисяка РАН
Москва, Россия
* E-mail: astafieva@paleo.ru
Поступила в редакцию 17.06.2019
После доработки 12.07.2019
Принята к публикации 12.07.2019
Аннотация
Фоссилизированные волокна, похожие на волокна стебельков у современных Gallionella ferruginea Ehrenberg, 1838, впервые обнаружены в архейских полосчатых марганцевых кварцитах зеленокаменного пояса Читрадурга (2.8 млрд лет, Южная Индия). Делается вывод, что скопления и переплетения волокон стебельков следует рассматривать как косвенное доказательство бактериального присутствия и биогенного минералообразования, но не как собственно мкроорганизмы.
ВВЕДЕНИЕ
Роль бактерий в породообразовании широко обсуждается, но до сих пор остается дискуссионной. Роль биоты в образовании железистых кварцитов также неясна.
Настоящая статья посвящена обнаруженным в маркирующем горизонте полосчатых марганцевых кварцитов (2.8 млрд лет, Южная Индия, зеленокаменный пояс Читрадурга, субгруппа Дудгуни, средняя часть разреза кварцевых конгломератов) интересным образованиям, имеющим, по нашему мнению, биогенное происхождение. Образцы (IND-90 7/26) были отобраны в карьере и любезно переданы нам А.Б. Вревским (ИГГД РАН).
Бактериально-палеонтологические исследования пород проводили с помощью сканирующего электронного микроскопа Zeiss EVO 50 (“Carl Zeiss”, Германия) с рентгеновским микроанализатором Inca Oxford 350 (“Oxford Instruments”, Великобритания) при напряжении 20 кВ с применением EDX (энергодисперсионного рентгеновского микроанализа). Исследовались свежие сколы породы. Поверхность изучаемых образцов напыляли золотом.
РЕЗУЛЬТАТЫ
Характерной особенностью исследуемых пород явилось обилие многочисленных тонких переплетающихся нитей-волокон. Диаметр волокон намного меньше 0.1 мкм. Длина может существенно превышать 40 мкм. Иногда создается впечатление, что на концах волокон присутствуют небольшие ($ \ll $0.1 мкм) округлые образования (табл. I , фиг. 1, белые стрелки). О характере поверхности волокон из-за их мелкого размера судить трудно, но, по всей видимости, она отмечена небольшими узелками-гранулами. Волокна плавно изгибаются, переплетаются. Часто волокна, сплетаясь между собой, образуют своеобразные покровы или пленки, скорее всего, биопленки. Мощность пленок может достигать 1 мкм и даже больше (это при толщине волокон $ \ll $0.1 мкм). Волокна в пленках спрессованы, так что пленки достаточно плотные. Слагают они целые фрагменты образца (табл. I , фиг. 1). Частично образец наполнен хаотично расположенными переплетениями волокон, создавая впечатление, что вся порода буквально пронизана такими нитями. В некоторых случаях (табл. I , фиг. 2 ) (правый верхний и левый нижний углы снимка) нити могут быть спрессованы настолько сильно, что создается некое подобие породы, состоящей из многочисленных плотно уложенных нитей. Мощность таких образований может превышать 10 мкм.
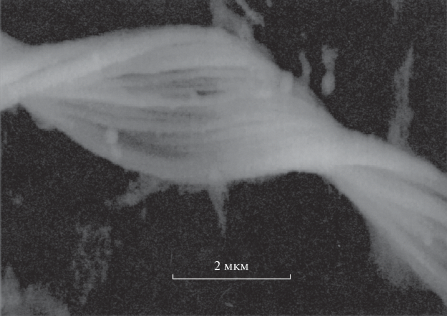
Рис. 1.
Стебелек Gallionella ferruginea, сложенный примерно 20 волокнами. По всей видимости, это более молодой сегмент стебелька, приближенный к месту его роста, где отложения железа рассеяны (редки). (Hallberg, Ferris, 2004, фиг. 1. Снимок опубликован с любезного разрешения авторов – Р. Халлберга и Г. Феррис).
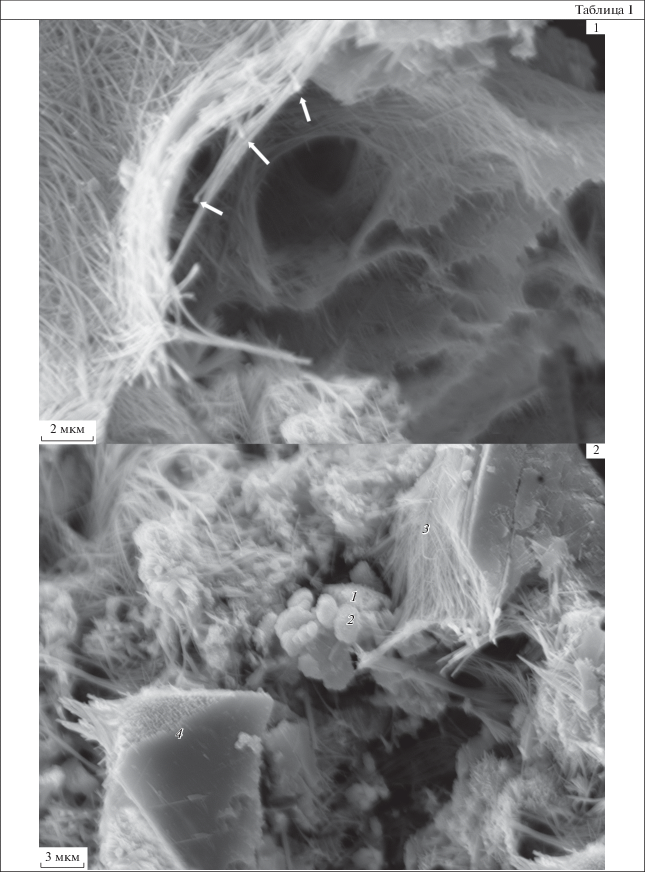
Объяснение к таблице I
Все изображенные экземпляры происходят из маркирующего горизонта полосчатых марганцевых кварцитов в аренитах, в средней части разреза кварцевых конгломератов, зеленокаменного пояса Читрадурга, субгруппы Дудгуни, Южной Индии. Образец 7/26 отобран в карьере. Возраст 2.8 млрд лет.
Фиг. 1. Тонкие переплетающиеся нити, образующие плотный покров. В центре снимка и в правой нижней его части видны отверстия, оставленные, по-видимому, микроорганизмами. Белыми стрелками указаны небольшие ($ \ll $0.1 мкм) округлые образования на концах волокон. Изображение на электронном микроскопе Zeiss № 8503 от 11 мая 2018 г.
Фиг. 2 . В центре снимка скопление округло-овальных форм (2.5–2.0 × 1.5–1.0 мкм). В левом верхнем углу – переплетение многочисленных нитей-волокон, расположенных довольно хаотично. Создается впечатление, что на снимке ближе к центральной его части волокна оплетают некие более мелкие (1.0 × 0.5 мкм) округло-овальные формы. В правом верхнем и левом нижнем углах – сильно спрессованные нити-волокна. Цифрами обозначены места проведения химических анализов. Изображение на электронном микроскопе Zeiss № 8511 от 11 мая 2018 г.
Подобные нити-волокна в архее обнаружены прежде не были. Поскольку переплетениями подобных нитей сложены целые фрагменты породы, говорить о контаминации не приходится. Все нити захоронены in situ. Химический элементный анализ показал, что нити-волокна содержат повышенное количество железа и марганца по сравнению с фоном. Таким образом, видно, что переплетения волокон способствуют накоплению металлов – железа и марганца.
Среди нитей иногда отмечаются удлиненно-овальные или бобовидные отверстия размером от 2.0–2.5 до 0.75–1.0 мкм, по всей видимости, оставленные микроорганизмами (табл. I , фиг. 1). Изредка встречаются небольшие скопления округло-овальных, скорее всего, бобовидных форм, размер которых соответствует размеру отверстий, о которых шла речь выше (табл. I , фиг. 2 ). Вероятно, это фоссилизированные остатки бактерий. Интересно, что в химическом составе бобовидных форм доминирует железо, а в составе спрессованных нитей – марганец (табл. I , фиг. 2 , табл. 1).
Таблица 1.
Элементный химический состав (в атомных %) фрагмента образца, изображенного на табл. I , фиг. 2 : спектры 1, 2 – бобовидно-овальных образований, предположительно бактерий; спектры 3, 4 – сильно спрессованных волокон. Изображение на электронном микроскопе Zeiss № 8511 от 11 мая 2018 г.
| Спектр | C | Mg | Al | Si | K | Mn | Fe | O |
|---|---|---|---|---|---|---|---|---|
| 1 | 16.3 | 0.7 | 1.9 | 4.3 | 17.6 | 59.2 | ||
| 2 | 9.8 | 2.2 | 9.0 | 23.0 | 56.0 | |||
| 3 | 8.8 | 3.1 | 0.4 | 23.3 | 8.5 | 55.9 | ||
| 4 | 23.3 | 1.1 | 0.7 | 13.0 | 0.6 | 61.5 |
ОБСУЖДЕНИЕ
От предположения, что волокна могут быть фоссилизированными остатками актиномицет, мы отказались. Мысль о минеральной природе этих образований также была отвергнута. Это подтвердили следы предполагаемых бактерий, находки округло-овальных или бобовидных, по всей видимости, биогенных форм, а также небольшие округлые образования на концах нитей.
Тонкие нити, обнаруженные нами, удивительно схожи с изображениями волокон, из которых состоят стебельки (так называют перекрученные пучки волокон, диаметр волокон около 2 нм – Ankrah, Søgaard, 2009) Gallionella ferruginea (Vatter, Wolfe, 1956, фиг. 1–14 ; Ridgway et al., 1981, фиг. 2 ; Lütters-Czekalla, 1990, фиг. 3 ; Hallberg, Ferris, 2004, фиг. 1; Suzuki et al., 2011, фиг. 1–4 ; 2012, фиг. 1) (рис. 1). Gallionella ferruginea – это бактерии бобовидной формы, процветающие в железистых водах. Зачастую они образуют смесь железистых осадков и стебельков, что вызывает дополнительные затруднения при поиске самих клеток (Hallbeck, Pedersen, 1990).
Клетки Gallionella ferruginea очень хрупкие, поэтому в естественных условиях сохраняются крайне редко. В большинстве случаев наблюдаются стебельки, лишенные клеток. Отделение клеток от стебельков наиболее четко выражено в старых колониях (Vatter, Wolfe, 1956). Довольно часто исследования, посвященные минерализации под воздействием Gallionella, проводятся исключительно на стебельках, поскольку обнаружить саму клетку Gallionella в естественных условиях очень трудно. Мало того, разделение на виды G. ferruginea и G. filamenta проводилось по числу волокон в стебельке: G. ferruginea может иметь >40 волокон, а G. filamenta – от 3 до 8 волокон (Hallberg, Ferris, 2004).
Gallionella относятся к железобактериям, которые осаждают растворенное железо из водных растворов. Присутствие закисного железа (Fe2+) стимулирует рост этих микроорганизмов. Однако бактерии встречаются с серьезной проблемой. Закисное железо является донором электронов, но если окисное железо (Fe3+) будет осаждаться на самих стенках клетки, оно станет препятствием для транспортировки метаболического материала через мембрану клетки. Существует два способа решения этой проблемы. По первому пути пошли Leptothrix. Эти бактерии продуцируют вокруг клеток слой экзополисахаридной слизи – гликокаликс. Железо осаждается на слое слизи, оставляя стенку клетки свободной от осадков. По другому пути пошли Gallionella. Они продуцируют внеклеточный материал в виде спирально закрученного стебелька. Минерализация начинается внутри волокон стебелька и контролируется не только органической природой стебелька, но и неорганическими процессами (Hallberg, Ferris, 2004). Интересно, что естественное (природное) органическое вещество менее подвержено разрушению, если оно адсорбирует окислы и гидроокислы железа, особенно слабо кристаллизованный материал, такой как ферригидрит (Chan et al., 2009). Значит, минерализованные, или фоссилизированные, волокна и стебельки Gallionella имеют хорошую сохранность, и наша находка не должна вызывать удивления.
В начале прошлого века именно перекрученные (витые) пучки волокон гидроксида окисного железа (Fe3+) описывались как живые организмы рода Gallionella. Позднее было показано, что в действительности эти перекрученные пучки волокон являются фрагментами инертных стебельков, выделяемых бобовидными клетками. Каждый стебелек может содержать примерно до 80 тонких волокон. При больших увеличениях (>×62 000) можно наблюдать сегментарное строение волокон (Vatter, Wolfe, 1956, фиг. 3–5 ).
Изучение поперечного сечения клетки Gallionella ferruginea показало, что волокна стебельков (и, соответственно, сами стебельки) происходят из вогнутой части клеточной стенки с низкой электронной плотностью (напоминаю – клетка имеет бобовидную форму) (Lütters-Czekalla, 1990, фиг. 3 ). Волокна чрезвычайно тонки в области их выхода из клетки, но на расстоянии около 500 нм утолщаются и продолжают рост уже с более-менее постоянной толщиной. Отчетливо линейная структура волокон предполагает, что внеклеточный полимерный материал, слагающий волокна, имеет достаточную вязкость, чтобы противостоять диффузии в окружающий раствор.
Средняя длина стебелька клетки при количестве клеток менее 6 × 105 мл–1 около 3 мкм. При увеличении количества клеток выше 6 × 105 мл–1 длина стебельков возрастает от 3 до 34 мкм. Максимальная длина стебельков достигает 60 мкм. Таким образом, длина стебельков возрастает с увеличением концентрации клеток в растворе. Длина нитей в наших образцах, как указывалось, существенно превышает 40 мкм (Hallbeck, Pedersen, 1990). Соответственно, логично предположить, что колония Gallionella ferruginea, которая могла бы оставить после себя многочисленные переплетающиеся фоссилизированные волокна, должна была быть достаточно крупной, с высокой плотностью бактерий.
Длина стебелька зависит и от рН раствора. При рН около 6 она составляет 4–2 мкм, увеличиваясь до 33 мкм при рН выше 6. Благоприятные значения рН для Gallionella находятся в диапазоне 6–7.6. В восстановительных условиях стебелек может и отсутствовать (Hallbeck, Pedersen, 1990; Ankrah, Søgaard, 2009). Соответственно, условия образования исследуемых пород не могли быть резко окислительными или резко восстановительными; т.к. длина многочисленных исследуемых волокон $ \gg $40 мкм, то pH среды их обитания должна превышать 6.
Оптимальная температура роста бактерий около 20°С. Однако Gallionella прекрасно себя чувствуют и при 5–10°С. Следует отметить, что при более высоких температурах увеличивается скорость образования стебельков. Формирование “колоний”, а точнее скоплений стебельков, начинается при 12°С, заканчивается при 30°С, максимально при 25°С (Hallbeck, Pedersen1990). Поскольку в исследуемых породах мы имеем колоссальные скопления стебельков, то говорить о высоких температурах в то время не представляется возможным. Следуя методу аналогии, температура в бассейне обитания должна быть порядка 20–25°С.
Биологическое окисление двухвалентных ионов Mn(II) и Fe(II) может осуществляться железоокисляющими и марганец окисляющими бактериями, и осаждать их в окисленной форме Fe(III) и Mn(IV). Некоторые группы бактерий, обычно относимых к железоокисляющим бактериям, такие как стебельковые Gallionella, покрытые чехлом Leptothrix и одноклеточные Siderocapsa, способны окислять не только железо, но также и марганец (Qin et al., 2009; Piazza et al., 2019). Однако ряд авторов, признавая за покрытыми чехлом Leptothrix и одноклеточными Siderocapsa способность окислять как марганец, так и железо, отрицают такую способность у стебельковых бактерий (Katsoyiannis, Zouboulis, 2004; Pacini et al., 2005). Другие же авторы, не сомневаясь в способности Gallionella ferruginea окислять марганец, пишут о них просто – Fe/Mn окисляющие бактерии (Suzuki et al., 2011). Результаты наших исследований также подтверждают возможность окисления галлионеллами не только железа, но и марганца.
Бактерии, окисляющие и железо и марганец, часто используются при очищении воды. Одно из таких исследований (Li et al., 2016) показало, что наибольший окислительный эффект достигается не при использовании бактериальных культур в чистом виде, а при смеси различных штаммов. Оптимальная температура роста культур около 20°С. Значит следует ожидать, что в исследуемых породах будут еще обнаружены представители других минерализованных микроорганизмов.
ЗАКЛЮЧЕНИЕ
Обнаруженные нами в архейских полосчатых марганцевых кварцитах зеленокаменного пояса Читрадурга (2.8 млрд лет, Ю. Индия) тончайшие переплетающиеся волокна, которые образуют настоящие покровы или, можно сказать, войлок, по всей видимости, представляют собой минерализованные стебельки железобактерии Gallionella. Жили эти бактерии, скорее всего, в крупных скоплениях. Температура в бассейне обитания этих бактерий, вероятно, должна была быть порядка 20–25°С, рН 6–7.6. Минерализация происходила по стебелькам Gallionella. Стебельки, по всей видимости, играли роль гликокаликса – внеклеточного полисахаридного вещества у других бактерий. Поэтому мы делаем вывод, что скопления и переплетения волокон стебельков следует рассматривать как опосредованное доказательство бактериального присутствия и биогенного минералообразования, но не как собственно микроорганизмы.
Автор признателен А.Ю. Розанову, Е.А. Жегалло, О.С. Самылиной, Г.Т. Ушатинской и всем, кто помогал в проведении этой работы и участвовал в обсуждении ее результатов. Особая благодарность – А.Б. Вревскому, передавшему образцы пород для изучения, и Л.В. Зайцевой за помощь при работе на электронном микроскопе Zeiss EVO 50.
Работа выполнена по Программе Президиума РАН № 17 “Эволюция органического мира. Роль и влияние планетарных процессов” (подпрограмма I “Развитие жизненных и биосферных процессов”), поддержана грантом РФФИ № 20-04-00043 и Министерством высшего образования и науки РФ.
Список литературы
Ankrah D.A., Søgaard E.G. A review of biological iron removal // Thirteenth International Water Technology Conference, IWTC 13 2009. Hurghada, Egypt. P. 999–1005.
Chan C.S., Fakra S.C., Edwards D.C. et al. Iron oxyhydroxide mineralization on microbial extracellular polysaccharides // Geochim. Cosmochim. Acta. 2009. V. 73. P. 3807–3818.
Hallberg R., Ferris F.G. Biomineralization by Gallionella // Geomicrobiol. J. 2004. V. 21. P. 325–330.
Hallbeck L., Pedersen K. Culture parameters regulating stalk formation and growth rate of Gallionella ferruginea // J. General Microbiology. 1990. V. 136. P. 1675–1680.
Katsoyiannis I.A., Zouboulis A.I. Biological treatment of Mn(II) and Fe(II) containing groundwater: kinetic considerations and product characterization // Water Research. 2004. V. 38. P. 1922–1932.
Li Ch., Wang Sh., Du X. et al. Immobilization of iron- and manganese-oxidizing bacteria with a diofilm-forming bacterium for the effective removal of iron and manganese from groundwater // Bioresource technol. 2016. V. 220. P. 76–84.
Lütters-Czekalla S. Lithoautotrophic growth of the iron bacterium Gallionella ferruginea with thiosulfate or sulfide as energy source // Microbiology. 1990. V. 154. P. 417–421.
Qin S., Ma F., Huang P., Yang J. Fe(II) and Mn(II) removal from drilled well water: a case study from a biological treatment unit in Harbin // Desalination. 2009. V. 245. P. 183–193.
Pacini V.A., Ingallinella A.M., Sanguinetti G. Removal of iron and manganese using biological roughing up flow filtration technology // Water Research. 2005. V. 39. P. 4463–4475.
Piazza A., Casalini L.C., Pacini V.A. et al. Environmental bacteria involved in manganese(II) oxidation and removal from ground water // Frontiers in microbiol. 2019. V. 10. Art. 119. P. 1–13.
Ridgway H.F., Means E.G., Olson B.H. Iron bacteria in drinking-water systems: Elemental analysis of Gallionella stalks, using X-ray energy-dispersive microanalysis // Applied and Environm. Microbiol. 1981. V. 41. № 1. P. 288–297.
Suzuki T., Hashimoto H., Matsumoto N. et al. Nanometer-scale visualization and structural analysis of the inorganic/organic hybrid structure of Gallionella ferruginea twisted stalks // Applied and Environm. Microbiol. 2011. V. 77. № 9. P. 2877–2881.
Suzuki T., Hashimoto H., Itadani A. et al. Silicon and phosphorus linkage with iron via oxygen in the amorphous matrix of Gallionella ferruginea stalks // Applied and Environm. Microbiol. 2012. V. 78. № 1. P. 236–241.
Vatter A.E., Wolfe R.S. Electron microscopy of Gallionella ferruginea // J. Bacteriol. 1956. V. 72. P. 248–252.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


