Палеонтологический журнал, 2022, № 3, стр. 105-116
Личинки червецов Mesophthirus (Homoptera Xylococcidae) на перьях в бирманском янтаре – перенос ветром или форезия на динозаврах?
Д. Е. Щербаков *
Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, Россия
* E-mail: dshh@narod.ru
Поступила в редакцию 21.10.2021
После доработки 15.12.2021
Принята к публикации 15.12.2021
- EDN: ZPOTQV
- DOI: 10.31857/S0031031X22030138
Аннотация
Mesophthirus engeli Gao et al., 2019 (Mesophthiridae incerti ordinis), описанный как пероядный паразит динозавров, был недавно переопределен как личинка раннего возраста примитивного червеца. У мезофтируса нет специфических признаков сходства с пухоедами, хотя обитание на перьях должно было наложить на паразитов сходный отпечаток. Изучение фотографий типовых экземпляров M. engeli позволяет отнести подсемейство Mesophthirinae stat. nov. к архаичному современному семейству Xylococcidae s.l. (известному с готерива) и сблизить с современными подсемействами Xylococcinae и Stigmacoccinae. Медвяная роса ксилококцид – важный пищевой ресурс для птиц и других древесных позвоночных. Подобно своим современным родичам, мезофтирины обитали под корой деревьев и выделяли обильную медвяную росу. Ею, как и самими червецами, вполне могли питаться ранние птицы и их предшественники – мелкие пернатые динозавры. Личинки 1-го возраста червецов приспособлены к переносу ветром и форезии на насекомых и позвоночных, так что попадание мезофтирусов на перья закономерно.
Т.-П. Гао и др. (Gao et al., 2019) описали Mesophthirus engeli Gao et al. (Mesophthiridae) как пероядного паразита динозавров, сходного с сеноедами и пухоедами, но неясного отрядного положения. Д. Гримальди и И. Веа (Grimaldi, Vea, 2021) показали, что мезофтирус – это нимфа раннего возраста (называемая бродяжкой, или просто личинкой) примитивных червецов.
Рассмотрим доводы в пользу первой и второй интерпретации, опираясь в том числе на оригинальные фото мезофтирусов, любезно предоставленные Тай-Пин Гао (Столичный педагогический ун-т, Пекин), оригинальные снимки и консультации по морфологии современных червецов, полученные от Р.А. Ракитова (Палеонтологический ин-т им. А.А. Борисяка РАН; ПИН) и Сан-Ан Ву (Пекинский ун-т лесного хозяйства), и консультации по перьям птиц и динозавров, полученные от Н.В. Зеленкова (ПИН РАН), за что я им весьма признателен.
Будем сравнивать мезофтируса, с одной стороны, с бродяжками, а с другой – с пухоедами, потомками сеноедов Liposcelididae, перешедшими к паразитизму на перьях и шерсти четвероногих. Паразитизм на перепонке крыла летучих мышей и птерозавров вызывает параллельные изменения в неродственных группах (Пономаренко, 1976; Щербаков, 2017). Обитание на перьях – не менее специфический вариант паразитизма, который тоже должен приводить к сходным преобразованиям у паразитов. Значит, если мезофтирусы перогрызущи, то должны быть хоть в чем-то похожи на пухоедов, даже не будучи прямыми их родственниками.
Нелишне напомнить, что пухоеды (Mallophaga) теперь включаются в состав отряда вшей (Phthiraptera), куда относятся и всем известные паразиты человека. Червецы образуют инфраотряд Coccomorpha (щитовками именуются представители одного из семейств этой группы) в подотряде Sternorrhyncha отряда равнокрылых (Homoptera, или более широкой группы – полужесткокрылых, Hemiptera). В старину стерноринх называли растительными вшами (Phytophthires; Мордвилко и др., 1910), по сходству этих малоподвижных паразитов растений со вшами настоящими. И те, и другие принадлежат к высшей группе Paraneoptera.
Мезофтирус был отнесен к эктопаразитам животных по таким признакам, как бескрылое и дорсовентрально уплощенное тело, маленькие глаза, короткие усики, и короткие ноги с одним коготком (Gao et al., 2019). Однако все эти черты присущи и червецам – паразитам растений (Grimaldi, Vea, 2021).
Размеры личинок мезофтируса чрезвычайно мелкие, длина тела всего 0.14–0.23 мм – это поистине живая пыль! Даже для бродяжек червецов это очень малые размеры (столь же мелкие бродяжки, например, у Steingelia Nasonov, 1908 из Xylococcidae s.l.). Сидячие или малоподвижные самки червецов производят обильное потомство, личинки отрождаются в больших количествах, очень мелкие, и у многих видов активно распространяются с токами воздуха (см. Обсуждение). Другое дело пухоеды: они приклеивают крупные яйца (гниды), длиной 0.5 мм и более (Благовещенский, 1959), к перьям или волосам хозяина, соответственно личинка вылупляется довольно крупной. У сеноедов (липосцелидид и им подобных) яйца тоже более крупные, длиной не менее 0.3 мм (Kučerova, 2002). Таким образом, размеры однозначно свидетельствуют в пользу кокцидной интерпретации (Grimaldi, Vea, 2021).
Ротовые части мезофтирусов были описаны как грызущие, с зазубренными мандибулами и членистыми максиллярными щупиками (Gao et al., 2019), но наличие таких мандибул и щупиков не подтвердилось (Grimaldi, Vea, 2021). У пухоедов ротовые органы грызущие, иногда колюще-сосущие, но короткие, при сохранении общей формы головы и тела (Clay, 1949). Если нет грызущих мандибул – то значит, нет и оснований предполагать для мезофтируса питание бородочками перьев. Вместо этого на голотипе и некоторых паратипах видны: 1) обширный клипеус (точнее, клипеолабрум – Koteja, Liniowska, 1976) между глазами и передними тазиками, 2) длинные тонкие колющие стилеты, заключенные в карман (крумену) и образующие петлю в груди и брюшке, и 3) небольшой лабиум (Grimaldi, Vea, 2021; рис. 1). Кроме того, у паратипа CNU-MA2016001 различимы 4) склеротизованный тенториум (внутренний скелет головы), две пары рук которого соединены с боковыми сторонами клипеолабрума, и 5) основания двух пар стилетов, мандибулярных и максиллярных, и, видимо, даже рычаги, на которых эти основания подвешены (рис. 2). У червецов клипеолабрум вместе с тенториумом, крыльями гипофаринкса и максиллярными пластинками образует жесткое коробчатое основание ротовых частей (тенториальную коробку; Foldi, 1997b), которое, несмотря на значительную редукцию краниума, обеспечивает надежную опору для пучка стилетов при проникновении его в ткани растения. У мезофтируса клипеолабрум большой и сильно склеротизован. Стилеты мезофтируса чрезвычайно длинные, примерно втрое длиннее тела, и во втянутом состоянии средняя часть пучка стилетов образует петлю, свернутую в спираль внутри крумены (у голотипа спираль с двумя витками расположена в горизонтальной плоскости, а у некоторых паратипов – почти в вертикальной). Все перечисленное вполне соответствует ротовому аппарату личинок и самок червецов (самцы их не питаются). Обнаруженное у мезофтируса строение сосущего ротового аппарата присуще только червецам, и уже оно одно, без анализа прочих признаков, однозначно свидетельствует о принадлежности данного рода к этой группе равнокрылых.
Рис. 1.
Mesophthirus engeli Gao et al., 2019, голотип CNU-MA2016009: а – исходное фото (оттенки серого; фото: Т.-П. Гао); б – повышены контраст и резкость; в – прорисованы пучок стилетов и (пунктиром) их основания; бирманский янтарь середины мела. Обозначения: cl – клипеолабрум, lb – лабиум. Длина масштабной линейки 50 мкм.
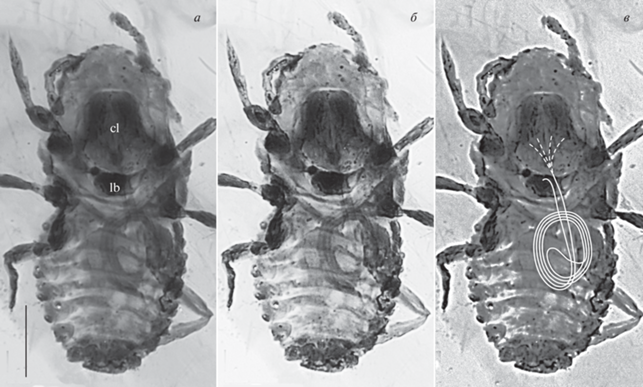
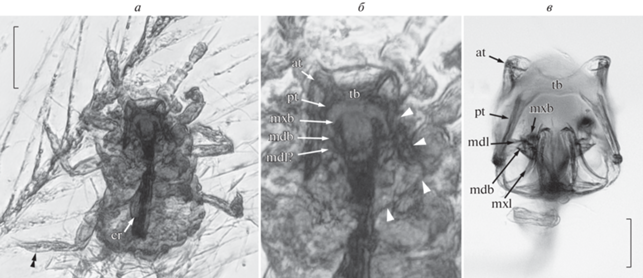
Рис. 2.
а, б – Mesophthirus engeli Gao et al., 2019, паратип CNU-MA2016001, бирманский янтарь середины мела (красный канал; фото: Т.-П. Гао): а – общий вид, б – ротовые части; в – Orthezia urticae (L., 1758), нимфа раннего возраста, современная, отпрепарированное основание ротовых частей, вид сзади (красный канал; фото: Р.А. Ракитов). Обозначения: короткие стрелки – границы клипеолабрума, двойная стрелка – темная линия поперек лапки; at – передняя рука тенториума, cr – крумена с петлей стилетов, mdb – основание мандибулярного стилета, mdl – мандибулярный рычаг, mxb – основание максиллярного стилета, mxl – максиллярный рычаг, pt – задняя рука тенториума, tb – мост тенториума. Длина масштабной линейки 50 (а), 100 мкм (в).
Форма тела. Тело у мезофтирусов дорсовентрально уплощено, продолговатое, со слабыми перетяжками между сегментами, несколько более сильными между головой, грудью и брюшком – однако эти перетяжки не всегда отчетливы (ср. напр., правую и левую стороны паратипа CNU-MA2016002; рис. 3, б), т.е. тело было довольно мягким. Грудь длинная и широкая, переднегрудь большая, пары ног расставлены, а брюшко короткое, так что задние тазики расположены далеко за серединой длины тела. У пухоедов и их предков, сеноедов липосцелидид, тело сужено в области груди (особенно переднегруди), пары ног сближены, брюшко длиннее и более или менее расширено, голова отделена от груди отчетливым сужением, а увеличенные виски вмещают жевательную мускулатуру. У червецов грудь остается широкой и переднегрудь велика, поскольку между передними ногами располагается главная часть сосущего ротового аппарата. Сама форма тела мезофтирусов говорит о том, что эти насекомые были сосущими. Соотношение отделов тела и расположение оснований ног вдоль его продольной оси постоянны, тогда как степень выраженности перетяжек между сегментами и отделами тела может меняться – например, в микропрепаратах прижатые покровным стеклом червецы становятся более округлыми, чем были при жизни, а при подготовке к СЭМ нимфы одного возраста ссыхаются в различной степени (рис. 4). По форме тела мезофтирусы более всего похожи на бродяжек из раннемелового ливанского янтаря, особенно на ?Palaeosteingelia Koteja et Azar, имеющую намек на шею и талию (Koteja, Azar, 2008).
Рис. 3.
Mesophthirus engeli Gao et al., 2019, паратипы (фото: Т.-П. Гао): а – CNU-MA2016005; б – CNU-MA2016002; в – CNU-MA2016003; стрелки: длинные – бедренные щетинки и головчатые щетинки при основании коготка, короткие – щетинки на вершине брюшка и на лапках, двойные – темная линия поперек лапки; бирманский янтарь середины мела. Длина масштабной линейки 50 мкм.

Рис. 4.
Orthezia urticae (L., 1758), нимфы раннего возраста, современные (собраны в спирт, очищены от воска ультразвуком, обезвожены в растворах этанола возрастающей концентрации вплоть до 100%, обработаны гексаметилдисилазаном, напылены золотом; фото: Р.А. Ракитов), СЭМ (SE): а, б – вид сверху, в – снизу. Длина масштабной линейки 200 мкм.

Глаза мезофтирусов из одного омматидия (Grimaldi, Vea, 2021), выступающие, как и у многих современных бродяжек.
Усики мезофтирусов довольно длинные (примерно равны ширине головы), из шести(?) члеников неравной длины; последний членик равен двум предыдущим, поперечно морщинистый и несет на вершине специализированные щетинки – две длинных и одну более короткую, как у некоторых червецов (Grimaldi, Vea, 2021). У пухоедов усики короче, их последний членик не столь удлинен, без длинных щетинок.
Ноги мезофтирусов довольно длинные (примерно 1/2 длины тела), без расширенных или иначе модифицированных члеников, оканчиваются единственным коготком, при основании которого отходит пара длинных головчатых щетинок, характерных для червецов (Grimaldi, Vea, 2021). Предполагалось, что эти щетинки вместе с щетинками антенн помогали мезофтирусам держаться на перьях (Gao et al., 2019). Пухоеды для фиксации на хозяине приобрели мощные мандибулярные или ножные зажимы, различного строения в разных группах; головчатых щетинок у пухоедов нет. Ноги пухоедов укорочены (много короче 1/2 длины тела), обычно с расширенными сегментами (хотя бы бедрами), цепкие, с 1- или 2‑члениковой лапкой и двумя коготками, а если коготок один, то он равен лапке по длине и прижимается к отросткам голени, или же укорочен и вся когтевидная лапка прижимается к вертлугу (Благовещенский, 1959).
Щетинки. Вопреки утверждению о том, что у мезофтирусов щетинки есть только на вершинах усиков и лапок (Gao et al., 2019), у них развиты также чрезвычайно длинные торчащие щетинки на дорсальной стороне бедра перед вершиной, равные по длине самому бедру, и довольно короткие щетинки в средней части лапки и на вершине брюшка, сидящие в отчетливых углублениях; эти углубления видны даже тогда, когда сами щетинки неразличимы (рис. 3). Эти щетинки также находят свои соответствия у червецов. Современные бродяжки путешествуют вместе с ветром, используя очень длинные щетинки на вершине брюшка (иногда еще и на усиках) или восковые нити (Hanks, Denno, 1998). Крошечные бродяжки мезофтируса могли использовать для этой цели шесть длиннющих бедренных щетинок, расставив их во все стороны подобно лучам снежинки.
Расчленение лапки мезофтируса интерпретировалось по-разному. Исходно лапка описана как 3-члениковая с длинным 1-м члеником (Gao et al., 2019), поскольку коготок голотипа был ошибочно принят за 3-й сегмент, а теперь авторы таксона считают лапку 2-члениковой (Гао и др., 2022; этот номер). Альтернативное мнение – все лапки 1-члениковые, как у червецов (Grimaldi, Vea, 2021). В действительности у многих самцов и некоторых самок червецов лапки 2-члениковые с очень коротким первым члеником (Lobdell, 1937). В литературе удалось обнаружить рисунки червецов, где изображены 2-члениковые лапки с неукороченным первым члеником: бродяжка Cyclolecanium hyperbaterum Morrison (Morrison, 1929, рис. 9 : передние и средние лапки, а задние при этом 1-члениковые) и самки Mesolecanium inquilinum Morrison, Saissetia auriculata Morrison (Morrison, 1929, рис. 2, 8 ), Acanthococcus azaleae (Comstock), Phenacoccus acericola King и Toumeyella liriodendri (Gmelin) (Dietz, Morrison, 1916, с. 223, 225, 250). Хотя в тексте эти отклонения от нормы не упомянуты и могут быть не более чем индивидуальными аберрациями, к данной информации надо отнестись со всем вниманием, поскольку Р. Снодграсс, превосходный рисовальщик и впоследствии великий морфолог насекомых, делавший рисунки для работы 1916 г., не стал бы изображать то, чего не видит. На некоторых лапках некоторых паратипов мезофтируса видна темная поперечная линия, делящая лапку примерно пополам (рис. 2, а; 3, а). Может быть, расчленение лапок в данном случае варьировало, как это иногда бывает у червецов. Возможно также, что за границу члеников лапки мы ошибочно принимаем щетинку, почти поперечно налегающую на лапку, подобно тому, как изображено для некоторых червецов (Борхсениус, 1957, рис. 71 ).
Дыхальца. У мезофтируса описаны дыхальца на средне- и заднегруди и брюшных сегментах (включая 1-й и 2-й; Gao et al., 2019). Альтернативное мнение – это не дыхальца, а маленькие щетинконосные склериты, развитые у многих червецов (Grimaldi, Vea, 2021). Более вероятно, что эти образования представляют собой дыхальца с увеличенным атриумом, несущим поры, как у бродяжек Xylococcinae (см. ниже; Morrison, 1928, рис. 5 ).
Изменчивость в типовой серии Mesophthirus engeli. 10 экз. мезофтируса при описании были разделены на две группы (отличающиеся по размерам, форме головы, последнего членика усиков и брюшка), интерпретированные как два последовательных нимфальных возраста (Gao et al., 2019). Различия между этими группами по большей части можно отнести на счет разного характера сохранности: брюшко и конечности вздуты или ссохлись, конец брюшка и голова выпячены или подогнуты. Особенно сильно вздут голотип, имеющий наибольшую длину: между сегментами брюшка видны широкие мембраны, а передние тазики отодвинуты от средних. Вероятно, две эти группы бродяжек представляют личинок одного и того же (1-го) возраста, но разного пола, при этом более мелкие и к тому же ссохшиеся экземпляры – это личинки самцов (см. ниже). Необычайно сильный половой диморфизм червецов (крылатые непитающиеся самцы и личинкоподобные самки) нередко начинает проявляться уже в 1-м возрасте, иногда затрагивая не только размеры, но и форму тела, относительную длину ног и усиков, развитие щетинок и специализированных кожных желез (Cook et al., 2000).
Возрастной состав типовой серии. Показательно, что все известные экземпляры мезофтируса – личинки 1-го возраста. Такой состав янтарной выборки хорошо согласуется с репродуктивной биологией червецов (массовый выход мелких личинок из многочисленных яиц в яйцевом мешке) и не вяжется с таковой пухоедов – при откладке крупных яиц поодиночке или небольшими группами должны были захораниваться вместе личинки разных возрастов, а уж если в янтарь попала целая группа молодых личинок, то почти наверняка на этом же пере должны были быть и яйца.
Таким, образом, все особенности мезофтируса говорят о том, что это личинка червеца 1-го возраста, и нет никаких специфических признаков сходства его с пухоедами – единственными насекомыми, живущими на перьях. А червецы паразитами животных не бывают.
Систематическое положение. Бродяжки редко привлекают внимание палеоэнтомологов и подробно описаны только в статьях Я. Котейи (Koteja, 1988a, 1988b, 1998, 2000, 2008; Koteja, Azar, 2008), хотя в янтарях они довольно многочисленны (более 10% экз. янтарных червецов: Koteja, 1998). Поэтому бродяжки недоучитываются в янтарных коллекциях, даже как сининклюзы, а одиночных мезофтирусов из-за их чрезвычайно мелких размеров могут просто не замечать. Видимые на фотографиях признаки позволяют уточнить систематическое положение и реконструировать образ жизни мезофтируса, объяснить попадание бродяжек на перья и выдвинуть интересные предположения относительно образа жизни мелких пернатых динозавров середины мела.
ОТРЯД HOMOPTERA
ИНФРАОТРЯД COCCOMORPHA
Coccidomorpha: Heslop-Harrison, 1952, с. 688.
Coccomorpha: Родендорф, 1962, с. 8.
НАДСЕМЕЙСТВО ORTHEZIOIDEA AMYOT ET SERVILLE, 1843 (=ARCHAEOCOCCOIDEA BODENHEIMER, 1952)
СЕМЕЙСТВО XYLOCOCCIDAE PERGANDE, 1898, S.L.
Состав. Подсемейства Xylococcinae Pergande, 1898; Kuwaniinae MacGillivray, 1921; Matsucoccinae Morrison, 1927; Steingeliinae Morrison, 1927; Stigmacoccinae Morrison, 1927; Pityococcinae McKenzie, 1942; Mesophthirinae Gao, Shih, Rasnitsyn et Ren, 2019, stat. nov. (см. Обсуждение).
ПОДСЕМЕЙСТВО MESOPHTHIRINAE GAO, SHIH, RASNITSYN ET REN, 2019, STAT. NOV.
Типовой род – Mesophthirus Gao, Shih, Rasnitsyn et Ren, 2019.
Пересмотренный диагноз. Личинка 1-го возраста. Усики длинные, последний членик удлинен. Бедро перед вершиной сверху с очень длинной щетинкой; при основании коготка две длинные головчатые щетинки. Хвостовые щетинки довольно короткие; анальное отверстие на вершине брюшка.
Состав. Типовой род.
Сравнение. Сходно с подсемейством Xylococcinae (включающим два современных рода, Xylococcus Loew, 1882 и Xylococculus Morrison, 1927, и раннемеловой род Baisococcus Koteja, 1989), отличается более длинными усиками с более вытянутым вершинным члеником и наличием чрезвычайно длинной щетинки на ноге дистальнее вертлуга. По этим признакам напоминает подсемейство Stigmacoccinae, однако у личинок последнего нет длинных головчатых щетинок при основании коготка, развита пара длинных хвостовых щетинок и анальное отверстие смещено на спинную сторону.
Род Mesophthirus Gao, Shih, Rasnitsyn et Ren, 2019
Mesophthirus: Gao et al., 2019, c. 2.
Типовой вид – Mesophthirus engeli Gao, Shih, Rasnitsyn et Ren, 2019; бирманский янтарь середины мела.
Пересмотренный диагноз. Личинки 1-го возраста. Очень мелкие, длина тела менее 0.25 мм. Тело продолговатое, с перетяжками между сегментами. Усики расставлены, длинные (длиннее ширины головы), 6-члениковые, последний членик удлинен (не короче двух предыдущих), поперечно морщинистый, на вершине с двумя длинными и одной более короткой щетинкой. Клипеолабрум с прилежащими структурами очень большой, более 1/2 ширины головы, заходит далеко за передние тазики. Стилеты очень длинные, примерно втрое длиннее тела, крумена заходит за середину брюшка, пучок стилетов в ней образует петлю, свернутую в плоскую спираль с несколькими витками. Лабиум очень короткий, отходит между средними тазиками, направлен вниз. Ноги длинные, длиннее ширины груди; бедро перед вершиной сверху с очень длинной торчащей щетинкой, равной бедру по длине; лапка примерно равна голени, 1-члениковая (у некоторых экземпляров на некоторых ногах выглядит 2-члениковой, но это может быть артефактом), с короткими щетинками; коготок простой, тонкий, изогнутый, примерно равен 1/2 лапки, при основании с двумя головчатыми щетинками, намного превышающими длину коготка. Брюшко короткое, два последних сегмента более склеротизованы, на вершине закруглено и с довольно короткими хвостовыми щетинками; анальное отверстие расположено апикально. Дыхальца развиты на 1–8-м брюшных сегментах, увеличены (вероятно, с порами в атриуме).
Видовой состав. Типовой вид.
ОБСУЖДЕНИЕ
Объем и систематическое положение семейства Xylococcidae. Подсемейство Xylococcinae было установлено в семействе Coccidae для родов Xylococcus Loew, 1882 и Coelostoma Maskell, 1880 (сейчас Coelostomidia Cockerell, 1900) (Hubbard, Pergande, 1898). Т. Кокерелл (Cockerell, 1899) рассматривал эту группу как трибу в Margarodinae s.str. и включал в нее Callipappus Guérin-Méneville, 1841. Затем подсемейство Xylococcinae было принято в расширенном объеме (включая трибы Stigmacoccini и Matsucoccini) в составе Margarodidae s.l. (Morrison, 1927). Впоследствии ранг подсемейства был повышен до семейства (Zahradník, 1959), как и у прочих подсемейств Margarodidae s.l. Эта точка зрения, поддержанная различиями в строении самцов, получила развитие в работах по ископаемым червецам (см. Vea, Grimaldi, 2015), так что Margarodidae s.l. были разбиты на 11 семейств, в основном олиготипных. И.А. Гаврилов-Зимин (Gavrilov-Zimin, 2018) восстановил Margarodidae s.l., объединив шесть из этих 11 семейств (в ранге триб) в подсемействе Xylococcinae s.l., и еще три – в Callipappinae s.l. В настоящей статье принят промежуточный вариант системы, с Xylococcidae s.l. и Callipappidae s.l. в ранге семейств. К семейству Xylococcidae s.l. следует отнести также Mesophthirinae и, вероятно, еще несколько ископаемых групп, известных по самцам.
Xylococcidae s.l. – одна из самых примитивных групп червецов. Подсемейства Xylococcinae и Matsucoccinae известны, начиная с раннего мела (по крылатым самцам; Vea, Grimaldi, 2015). Род Stigmacoccus Hempel, 1900 стоит первым по порядку в классификации маргародид Г. Моррисона (Morrison, 1928) и образует самую базальную ветвь на одной из кладограмм червецов (Foldi, 1997a).
Систематическое положение и ранг Mesophthirinae. По устройству сосущего ротового аппарата и всем остальным признакам Mesophthirus несомненно является личинкой (нимфой) червеца 1‑го возраста (см. выше). По полному набору брюшных дыхалец, отсутствию длинных хвостовых щетинок, длинным усикам и ногам этот род относится к археококкоидам (Orthezioidea). По строению глаз и усиков Mesophthirus напоминает Ortheziidae (Grimaldi, Vea, 2021), однако у личинок последних клипеолабрум короткий, стилеты гораздо короче, лабиум крепится между передними тазиками, длинная щетинка на вершине усика бывает только одна, а анальное отверстие сдвинуто на спинную сторону и окружено кольцом щетинок. Mesophthirus сходен с типовым подсемейством семейства Xylococcidae s.l. по очень длинному клипеолабруму, очень короткому лабиуму, отходящему между средними тазиками, очень длинным стилетам, петля которых свернута в несколько витков внутри тела, двум длинным щетинкам на вершине усика, длинным ногам, наличию при основании коготка двух головчатых щетинок, превосходящих его по длине, и восьми парам увеличенных брюшных дыхалец. Mesophthirus отличается от Xylococcinae только более длинными усиками с длинным вершинным члеником и наличием очень длинной щетинки на ноге дистальнее вертлуга, и по этим признакам напоминает близкое монотипное подсемейство Stigmacoccinae (хотя у Stigmacoccus щетинка развита не на вершине бедра, а на вершине голени). Хвостовые щетинки Mesophthirus на некоторых экземплярах выглядят очень короткими (три пары? – паратип CNU-MA2016004; Gao et al., 2019, suppl. fig. 2a ), как у Xylococculus macrocarpae (Coleman, 1908) (см. Gill, 1993) и у некоторых Kuwaniinae (Neosteingelia Morrison, 1927), у других они слегка удлинены (паратипы CNU-MA2016002, CNU-MA2016005; рис. 3, а, б), как у большинства Xylococcinae. У некоторых представителей близкого семейства Callipappidae s.l. (включая Coelostomidiinae Morrison, 1927 и Cryptokermesinae Foldi et Gullan, 2014, stat. nov.) тоже бывают очень короткие хвостовые щетинки (у Marchalina Vayssière, 1923, Coelostomidiinae) или длинная щетинка на бедре [при основании, у Platycoelostoma compressum (Maskell, 1892), Callipappinae]. Очень короткие хвостовые щетинки встречаются и у бродяжек неококкоидов, например, Puto Signoret, 1876 (подрод Ceroputo Šulc, 1898) (Leonardi, 1920). По признакам личинки семейство Mesophthiridae заслуживает не более чем ранга подсемейства в семействе Xylococcidae s.l., а незначительность отличий Mesophthirus от Xylococcus наводит на мысль о возможной синонимии соответствующих подсемейств.
Котейя (Koteja, 2008) объединял Xylococcidae s.str. и родственных им Matsucoccidae, Kuwaniidae, Callipappidae s.str., Margarodidae s.str., Ortheziidae и еще пять вымерших семейств, описанных им по самцам из эоценовых янтарей, в неформальную группу, для которой характерны фасеточные глаза и пучок восковых нитей на вершине брюшка самца. Среди меловых семейств такая комбинация признаков свойственна Jersicoccidae, Hammanococcidae и Kozariidae (Koteja, 2000; Koteja, Azar, 2008; Vea, Grimaldi, 2015). Из них только Kozariidae из бирманского янтаря напоминают ксилококцид (а именно Matsucoccinae) и сходны с Mesophthirus по чрезвычайно мелким размерам (длина тела самца 1.02–1.13 мм) и наличию двух длинных головчатых щетинок при основании коготка. Таким образом, подсемейство Mesophthirinae может оказаться синонимом Xylococcinae или Kozariidae.
Биология Xylococcidae, в том числе Mesophthirinae. Червецы почти всех семейств (кроме Diaspididae) питаются соком флоэмы и выделяют из анального отверстия медвяную росу (Kunkel, 1997). Питание медвяной росой червецов отмечено для разнообразных насекомых, а также пауков, птиц, ящериц, сумчатых, летучих мышей и грызунов, особенно в тропиках и южном полушарии (Grandi, 1951; Smith, 1982; Gaze, Clout, 1983; Roberts, Seabrook, 1989; Taylor, Foster 1996; Latta et al., 2001; Towns, 2002; Teixeira, Azevedo, 2013). Библейская манна, которой сорок лет питались сыны Израиля в пустыне – застывшая медвяная роса червецов (Shemesh, 2021). Хорошо известно питание муравьев медвяной росой тлей, но тли – преимущественно севернополушарная группа (Heie, 2013; Perkovsky, Wegierek, 2018), а в южном полушарии столь же обычны подобные взаимоотношения между червецами, с одной стороны, и насекомыми, птицами и прочими мелкими древесными позвоночными, с другой.
Особенно длинные стилеты бывают у бродяжек червецов, связанных с древесными растениями (Gullan, Cook, 2001). Чрезвычайно длинные стилеты Mesophthirus в несколько раз превышают длину тела, что свидетельствует о жизни на деревьях, но не на дереве-источнике бирманского янтаря (вероятно, Agathis из Araucariaceae; Poinar et al., 2007), поскольку мезофтирусы в бирмите довольно редки. Современные Xylococcidae и Coelostomidiinae связаны с древесными растениями, как хвойными, так и покрытосеменными, среди последних с такими древними, известными с мела группами как Nothofagus, Fagaceae, Betulaceae, Platanaceae, Fabaceae и др. (García Morales et al., 2016). Середина мела была временем бурной диверсификации цветковых и появления их современных семейств (Liu et al., 2018). В бирмите найдены цветки, отнесенные к Cunoniaceae, Rhamnaceae и близкие к Atherospermataceae (Poinar et al., 2020, 2021; Wang et al., 2021), а также хвойные семейства Cupressaceae (Shi et al., 2012) – с этими семействами связаны и некоторые современные целостомидиины и ксилококцины.
Сидячие питающиеся стадии развития Xylococcus, Stigmacoccus и подобных им червецов живут под корой и выделяют обильную медвяную росу через длинную восковую анальную трубочку, возвышающуюся над корой на несколько сантиметров. Эти червецы могут достигать очень высокой численности, и кора бывает покрыта их трубочками словно шерстью, так что индейцы должны были отправляться за 60 миль от оз. Верхнее за берестой для каноэ, поскольку вокруг озера береста вся была испорчена Xylococculus betulae (Hubbard, Pergande, 1898). Продукция медвяной росы такими червецами очень велика и у Stigmacoccus может достигать 70 тыс. л на гектар за год (Martins-Mansani et al., 2021). Избыток этой медвяной росы служит питательным субстратом для развития на коре деревьев сажистых грибков, которыми питаются некоторые жуки, например, мезозойские реликты Cyclaxyridae, известные из Новой Зеландии, и эоценовых и бирманского янтарей, что свидетельствует о меловом возрасте таких трофических ассоциаций (Gimmel et al., 2019).
Медвяная роса ксилококцид и целостомидиин, особенно в малокормный сезон, является критически важным пищевым ресурсом для гекконов и десятков видов птиц разного размера, от трехграммового колибри в Бразилии до полукилограммового новозеландского попугая (Köster, Stoewesand, 1973; Beggs, Wilson, 1991; Gardner-Gee, Beggs, 2010; Lara et al., 2011), и эти птицы защищают деревья, заселенные червецами (Reichholf, Reichholf, 1973; Greenberg et al., 1993; Gamper, Koptur, 2010). Некоторые птицы, например, дятлы, активно питаются также и самими ксилококцидами (Kilham, 1970). Поскольку Xylococcidae уже в мелу приобрели все характерные для них черты и должны были выделять обильную медвяную росу, надо полагать, что она представляла собой важный пищевой ресурс и для меловых птиц и их предшественников – разнообразных мелких пернатых динозавров, населявших бирманский янтарный лес (Xing et al., 2020).
Тафономия. Авторы рода Mesophthirus выдвигают как чуть ли не самый важный аргумент в пользу паразитизма этих насекомых нахождение их на перьях и рядом с перьями динозавров, причем в одном из двух кусков янтаря заключено девять экз. вместе с пером, имеющим микроскопические проедания (Gao et al., 2019). Сторонники кокцидной интерпретации объяснили это простым совпадением, а повреждение приписали личинкам кожеедов, погрызшим выпавшее перо на земле или в гнезде (Grimaldi, Vea, 2021). Тафономия порой укладывает в один кусок янтаря созданий, диаметрально противоположных по образу жизни, например, летающих насекомых вместе с водными и даже морскими беспозвоночными (Yu et al., 2019). Но в случае с личинками червецов, летающими по воздуху, в том числе и на птицах, нет нужды предполагать столь чудесное стечение обстоятельств.
Перенос ветром – наиболее вероятная причина попадания мезофтирусов вдевятером на одно перо. Самки почти всех червецов и некоторых семейств тлей ведут сидячий или малоподвижный образ жизни, а функция расселения перешла к их личинкам первого возраста, называемым бродяжками. Бродяжки многих видов червецов, в том числе Xylococcidae s.l., не найдя подходящего места для питания на родном растении, отправляются в путешествие с токами воздуха (Stephens, Aylor, 1978; Greathead, 1997). У видов червецов, практикующих воздухоплавание, бродяжки собираются на концах веточек и колючках и встают на задние лапки, чтобы быть унесенными ветром (Washburn, Washburn, 1984; Hanks, Denno, 1998). Крайне малые даже для бродяжек размеры личинок мезофтируса и чрезвычайно длинные бедренные щетинки были именно приспособлением для воздушного транспорта.
Мезофтирусы в янтарном лесу могли скучиться на зацепившемся за кору и трепещущем на ветру пере и потом путешествовать на нем от одного ствола к другому, как на ковре-самолете. После полета на прилипшем к натеку смолы пере некоторые бродяжки (в первую очередь, более мелкие личинки самцов) успели погибнуть от истощения и ссохлись, а остальные были залиты заживо следующим потоком смолы и сохранились в янтаре с брюшком естественной формы или даже вздутым, как у голотипа. Что же касается крошечных кружевных выгрызов (0.2–0.3 мм в поперечнике) на бородочках упомянутого пера, то столь филигранная работа не могла быть произведена на шустром теплокровном животном насекомыми, не имеющими надежных приспособлений для фиксации на его перьях. Напротив, перо, упавшее на землю или застрявшее в трещине коры, неспециализированные сапрофаги (напр., личинки жуков) могли не спеша выедать сколь угодно ажурным образом. Сам характер повреждений указывает на то, что они были нанесены на перо, потерянное хозяином.
Форезия. Помимо ветра, “большое значение в расселении кокцид имеют также… другие насекомые, птицы и прочие животные, переносящие личинок-бродяжек на своей поверхности” (Борхсениус, 1950, с. 13). Такая транспортировка называется форезией (Reynolds et al., 2015). Отмечен перенос бродяжек червецов и тлей-хермесов насекомыми, пауками, млекопитающими и птицами (Cockerell, Bueker, 1930; Stephens, Aylor, 1978; Washburn, Frankie, 1981; McClure, 1990; Poinar, 2004; Russo et al., 2016). Расширенные вершины головчатых щетинок лапки – это микроскопические присоски, такие же, как у клещиков, форезирующих на насекомых, а вставание на цыпочки бродяжек, готовящихся подняться в воздух, в точности соответствует позе этих клещиков, поджидающих переносчика (Magsig-Castillo et al., 2010).
Неспецифичность насекомого к позвоночному. Мезофтирусы были обнаружены на двух маленьких (12–14 мм) перьях различного строения, интерпретированных как принадлежащие двум разным группам пернатых динозавров (не-пеннарапторные целурозавры и пеннарапторные динозавры), поэтому для мезофтируса предполагался широкий круг хозяев (Gao et al., 2019). Это важное отличие от пухоедов (известных своей узкой специфичностью к хозяину), но оно хорошо согласуется с предположением о форезии, для которой существенны небольшие размеры и оперенность переносчика, а не его систематическое положение. Нужно добавить, что различать ранних птиц и близких к ним динозавров по перьям, если это не какие-то необычные виды перьев, пока не получается (Lefèvre et al., 2020; O’Connor, 2020; Н.В. Зеленков, личн. сообщ.).
Таким образом, находки бродяжек червецов-мезофтирусов на перьях неудивительны, хотя и не имеют ничего общего с паразитизмом. Перо с девятью бродяжками и ажурными повреждениями носил ветер, а перо с одной бродяжкой может оказаться свидетельством форезии личинок червецов на мелких древесных пернатых динозаврах или архаичных птицах. В случае питания медвяной росой и самими червецами-мезофтирусами динозавры и ранние птицы могли на своем оперении переносить бродяжек на еще не заселенные ими деревья. По всей видимости, несмотря на многочисленные различия в строении, некоторые нептичьи динозавры по своему образу жизни были не столь далеки от птиц, этих динозавров современности.
Список литературы
Благовещенский Д.И. Насекомые пухоеды (Mallophaga). М.–Л.: Изд-во АН СССР, 1959. 202 с. (Фауна СССР. № 72).
Борхсениус Н.С. Червецы и щитовки СССР (Coccoidea). М.–Л.: Изд-во АН СССР, 1950. 250 с. (Определители по фауне СССР. Вып. 32).
Борхсениус Н.С. Насекомые хоботные. Подотряд червецы и щитовки (Coccoidea). Семейство подушечницы и ложнощитовки (Coccidae). М.–Л.: Изд-во АН СССР, 1957. 494 с. (Фауна СССР. № 66).
Гао Т.-П., Йинь С.-Ч., Ших Ч.-К. и др. Ответ на публикации “Насекомые на перьях древних (100 млн лет) динозавров не эктопаразиты” и “Личинки червецов Mesophthirus (Homoptera, Xylococcidae) на перьях в бирманском янтаре – перенос ветром или форезия на динозаврах?” // Палеонтол. журн. 2022. № 3. С. 99–104.
Мордвилко А.А., Штейнгель Ф.Р., Шульц К. Инструкция для собирания и сохранения тлей (Aphidae), червецов (Coccidae), листовых блох (Psyllidae) и алейродид (Aleurodidae). С.Пб.: Наставления для собирания зоол. коллекций, издаваемые Зоол. музеем Имп. Акад. наук, 1910. 100 с.
Пономаренко А.Г. Новое насекомое из мела Забайкалья – возможный паразит летающих ящеров // Палеонтол. журн. 1976. № 3. С. 102–106.
Щербаков Д.Е. Меловые Saurophthiridae (Aphaniptera) – куклородные протоблохи ныряющих птерозавров // Палеонтол. журн. 2017. № 2. С. 73–75. https://doi.org/10.7868/S0031031X17020155
Beggs J.R., Wilson P.R. The kaka Nestor meridionalis, a New Zealand parrot endangered by introduced wasps and mammals // Biol. Conserv. 1991. V. 56. P. 23–38. https://doi.org/10.1016/0006-3207(91)90086-O
Clay T. Piercing mouth-parts in the biting lice (Mallophaga) // Nature. 1949. V. 164. P. 617. https://doi.org/10.1038/164617a0
Cockerell T.D.A. Tables for the determination of the genera of Coccidae // Can. Entomol. 1899. V. 31. P. 273–279, 330–333.
Cockerell T.D.A., Bueker E.D. Some geophilous mealy-bugs from Australia (Homoptera, Coccoidea) // Amer. Mus. Novit. 1930. № 441. P. 1–7.
Cook L.G., Gullan P.J., Stewart A.C. First-instar morphology and sexual dimorphism in the gall-inducing scale insect Apiomorpha Rubsaamen (Hemiptera: Coccoidea: Eriococcidae) // J. Natur. Hist. 2000. V. 34. P. 879–894. https://doi.org/10.1080/002229300299291
Dietz H.F., Morrison H. The Coccidae or scale insects of Indiana // Ann. Rep. State Entomol. Indiana. 1916. V. 8. P. 195–321.
Foldi I. Defense strategies in scale insects: phylogenetic inference and evolutionary scenarios (Hemiptera, Coccoidea) // Mém. Mus. nat. Hist. natur. (N.S.) Ser. A, Zool. 1997a. V. 173. P. 203–230.
Foldi I. Internal anatomy of the adult female // Soft Scale Insects: Their Biology, Natural Enemies and Control / Eds Ben-Dov Y., Hodgson C.J. Elsevier, 1997b. P. 73–90 (World Crop Pests. V. 7A). https://doi.org/10.1016/S1572-4379(97)80045-0
Gamper H.A., Koptur S. Honeydew foraging by birds in tropical montane forests and pastures of Mexico // J. Trop. Ecol. 2010. V. 26. P. 335–341. https://doi.org/10.1017/S0266467409990654
Gao T.P., Yin X.C., Shih C.K. et al. New insects feeding on dinosaur feathers in mid-Cretaceous amber // Nat. Commun. 2019. V. 10. № 5424. P. 1–7. https://doi.org/10.1038/s41467-019-13516-4
García Morales M., Denno B.D., Miller D.R. et al. ScaleNet: A literature-based model of scale insect biology and systematics. Database. 2016. https://doi.org/10.1093/database/bav118
Gardner-Gee R., Beggs J.R. Challenges in food-web restoration: an assessment of the restoration requirements of a honeydew-gecko trophic interaction in the Auckland region, New Zealand // Restor. Ecol. 2010. V. 18. P. 295–303. https://doi.org/10.1111/j.1526-100X.2010.00650.x
Gavrilov-Zimin I.A. Ontogenesis, morphology and higher classification of archaeococcids (Homoptera: Coccinea: Orthezioidea) // Zoosyst. Ross. 2018. Suppl. 2. P. 1–260.
Gaze P.D., Clout M.N. Honeydew and its importance to birds in beech forests of South Island, New Zealand // N. Zeal. J. Ecol. 1983. V. 6. P. 33–37.
Gimmel M.L., Szawaryn K., Cai C., Leschen R.A. Mesozoic sooty mould beetles as living relicts in New Zealand // Proc. R. Soc. B. 2019. V. 286. 20192176. https://doi.org/10.1098/rspb.2019.2176
Grandi G. Introduzione allo studio dell’entomologia. Organizzazione, sviluppo, vita. Apterigoti ed Esopterigoti. V. 1. Bologna: Edizioni agricole, 1951. xxiii+950 p.
Greathead D.J. Crawler behaviour and dispersal // Soft Scale Insects: Their Biology, Natural Enemies and Control / Eds Ben-Dov Y., Hodgson C.J. Elsevier, 1997. P. 339–342 (World Crop Pests. V. 7A). https://doi.org/10.1016/S1572-4379(97)80063-2
Greenberg R., Caballero C.M., Bichier P. Defense of homopteran honeydew by birds in the Mexican highlands and other warm temperate forests // Oikos. 1993. V. 68. P. 519–524. https://doi.org/10.2307/3544920
Grimaldi D.A., Vea I.M. Insects with 100 million-year-old dinosaur feathers are not ectoparasites // Nat. Commun. 2021. V. 12. № 1469. P. 1–3. https://doi.org/10.1038/s41467-021-21751-x
Gullan P.J., Cook L.G. Phenacoleachia Cockerell (Hemiptera: Coccoidea: Phenacoleachiidae) re-visited // Boll. Zool. Agrar. Bachic. 2001. V. 33. P. 163–173.
Hanks L.M., Denno R.F. Dispersal and adaptive deme formation in sedentary coccoid insects // Genetic Structure and Local Adaptation in Natural Insect Populations. Boston: Springer, 1998. P. 239–262. https://doi.org/10.1007/978-1-4757-0902-5_11
Heie O.E. Why are there so few aphid species in the temperate areas of the southern hemisphere? // Eur. J. Entomol. 2013. V. 91. P. 127–133.
Hubbard H.G., Pergande T. A new coccid on birch // USDA Entomol. Bull. (N.S.). 1898. № 18. P. 13–26.
Kilham L. Feeding behavior of downy woodpeckers. I. Preference for paper birches and sexual differences // Auk. 1970. V. 87. P. 544–556. https://doi.org/10.2307/4083797
Köster F., Stoewesand H. Schildläuse als Honigtaulieferanten für Kolibris und Insekten // Bonn. Zool. Beitr. 1973. Bd 24. S. 15–23.
Koteja J. Eriococcid crawlers (Homoptera, Coccinea) from Baltic amber // Pol. Pis. Entomol. 1988a. V. 58. P. 503–524.
Koteja J. Succinikermes kulickae gen. et sp. n. (Homoptera, Coccinea) from Baltic amber // Pol. Pis. Entomol. 1988b. V. 58. P. 525–535.
Koteja J. Essays on coccids (Homoptera): Sudden death in amber? // Pol. Pis. Entomol. 1998. V. 67. P. 185–218.
Koteja J. Scale insects (Homoptera, Coccinea) from Upper Cretaceous New Jersey amber // Studies on Fossils in Amber, with Particular Reference to the Cretaceous of New Jersey / Ed. Grimaldi D. Leiden: Backhuys, 2000. P. 147–229.
Koteja J. Xylococcidae and related groups (Hemiptera: Coccinea) from Baltic amber // Pr. Muz. Ziemi. 2008. V. 49. P. 19–56.
Koteja J., Azar D. Scale insects from Lower Cretaceous amber of Lebanon (Hemiptera: Sternorrhyncha: Coccinea) // Alavesia. 2008. V. 2. P. 133–167.
Koteja J., Liniowska E. The clypeolabral shield in the taxonomy of the Coccinea (Homoptera) // Pol. Pis. Entomol. 1976. V. 46. P. 653–681.
Kučerová Z. Stored product psocids (Psocoptera): External morphology of eggs // Eur. J. Entomol. 2002. V. 99. P. 491–503. https://doi.org/10.14411/eje.2002.066
Kunkel H. Scale insect honeydew as forage for honey production // Soft Scale Insects: Their Biology, Natural Enemies and Control / Eds Ben-Dov Y., Hodgson C.J. Elsevier, 1997. P. 291–302 (World Crop Pests. V. 7A). https://doi.org/10.1016/S1572-4379(97)80059-0
Lara C., Martínez-García V., Ortiz-Pulido R. et al. Temporal-spatial segregation among hummingbirds foraging on honeydew in a temperate forest in Mexico // Curr. Zool. 2011. V. 57. P. 56–62. https://doi.org/10.1093/czoolo/57.1.56
Latta S.C., Gamper H.A., Tietz J.R. Revising the convergence hypothesis of avian use of honeydew: evidence from Dominican subtropical dry forest // Oikos. 2001. V. 93. P. 250–259. https://doi.org/10.1034/j.1600-0706.2001.930208.x
Lefèvre U., Cau A., Hu D., Godefroit P. Feather evolution in Pennaraptora // The Evolution of Feathers: from Their Origin to the Present / Eds Foth C., Rauhut O. Cham: Springer, 2020. P. 103–118. https://doi.org/10.1007/978-3-030-27223-4_7
Leonardi G. Monografia delle Cocciniglie Italiane. Portici: Della Torre, 1920. 555 p.
Liu Z.J., Huang D., Cai C., Wang X. The core eudicot boom registered in Myanmar amber // Sci. Rep. 2018. V. 8. 16765. https://doi.org/10.1038/s41598-018-35100-4
Lobdell G.H. Two-segmented tarsi in coccids: other notes (Homoptera) // Ann. Entomol. Soc. Amer. 1937. V. 30. P. 75–80. https://doi.org/10.1093/aesa/30.1.75
Magsig-Castillo J., Morse J.G., Walker G.P. et al. Phoretic dispersal of armored scale crawlers (Hemiptera: Diaspididae) // J. Econ. Entomol. 2010. V. 103. P. 1172–1179. https://doi.org/10.1603/EC10030
Martins-Mansani M., Faita M.R., Orth A.I. et al. Production of honeydew by scale insects associated with bracatinga (Mimosa scabrella Benth) in Serra Catarinense, Southern Brazil // Rev. Bras. Entomol. 2021. V. 65. e20200072. https://doi.org/10.1590/1806-9665-RBENT-2020-0072
McClure M.S. Role of wind, birds, deer, and humans in the dispersal of hemlock woolly adelgid (Homoptera: Adelgidae) // Environ. Entomol. 1990. V. 19. P. 36–43. https://doi.org/10.1093/ee/19.1.36
Morrison H. Descriptions of new genera and species belonging to the coccid family Margarodidae // Proc. Biol. Soc. Wash. 1927. V. 40. P. 99–109.
Morrison H. A classification of the higher groups and genera of the coccid family Margarodidae // USDA Tech. Bull. 1928. V. 52. P. 1–239.
Morrison H. Some neotropical scale insects associated with ants (Hemiptera-Coccidae) // Ann. Entomol. Soc. Amer. 1929. V. 22. P. 33–60. https://doi.org/10.1093/aesa/22.1.33
O’Connor J. The plumage of basal birds // The Evolution of Feathers: from Their Origin to the Present / Eds Foth C., Rauhut O. Cham: Springer, 2020. P. 147–172. https://doi.org/10.1007/978-3-030-27223-4_9
Perkovsky E., Wegierek P. Aphid–Buchnera–Ant symbiosis; or why are aphids rare in the tropics and very rare further south? // Earth Environ. Sci. Trans. R. Soc. Edinb. 2018. V. 107. P. 297–310. https://doi.org/10.1017/S1755691017000147
Poinar G.O. Jr. Fossil evidence of scale phoresy on spiders // Beitr. Araneol. 2004. V. 3. P. 1878–1880.
Poinar G.O. Jr., Chambers K.L., Vega F.E. Tropidogyne euthystyla sp. nov., a new small-flowered addition to the genus from mid-Cretaceous Myanmar amber // J. Bot. Res. Inst. Texas. 2021. V. 15. P. 113–119. https://doi.org/10.17348/jbrit.v15.i1.1053
Poinar G.O. Jr., Iwaniec U.T., Chambers K.L., Vega F.E. Valviloculus pleristaminis gen. et sp. nov., a Lauralean fossil flower with valvate anthers from mid-Cretaceous Myanmar amber // J. Bot. Res. Inst. Texas. 2020. V. 14. P. 359–366. https://doi.org/10.17348/jbrit.v14.i2.1014
Poinar G.O. Jr., Lambert J.B., Wu Y. Araucarian source of fossiliferous Burmese amber: spectroscopic and anatomical evidence // J. Bot. Res. Inst. Texas. 2007. V. 1. P. 449–455.
Reichholf H., Reichholf J. “Honigtau” der Bracaatinga-Schildlaus als Winternahrung von Kolibris (Trochilida) in Süd-Brasilien // Bonn. Zool. Beitr. 1973. Bd 24. S. 7–14.
Reynolds D.R., Reynolds A.M., Chapman J.W. Non-volant modes of migration in terrestrial arthropods // Anim. Migr. 2015. V. 2. P. 8–28. https://doi.org/10.2478/ami-2014-0002
Roberts P., Seabrook W.A. A relationship between black rats (Rattus rattus), Seychelles fruit bats (Pteropus seychellensis aldabrensis) and the coccoid (Icerya seychellarum) (Insecta, Homoptera) on Aldabra Atoll, Seychelles // J. Zool. 1989. V. 218. P. 332–334. https://doi.org/10.1111/j.1469-7998.1989.tb02543.x
Russo N.J., Cheah C.A.J., Tingley M.W. Experimental evidence for branch-to-bird transfer as a mechanism for avian dispersal of the hemlock woolly adelgid (Hemiptera: Adelgidae) // Environ. Entomol. 2016. V. 45. P. 1107–1114. https://doi.org/10.1093/ee/nvw083
Shemesh A.O. ‘He said that the manna is that called taranjebin’: Ibn Ezra against Hiwi al-Balkhi’s interpretation of the biblical story of the manna // HTS Theol. Stud. 2021. V. 77. № 4. P. 1–8. https://doi.org/10.4102/hts.v77i4.6342
Shi G., Grimaldi D.A., Harlow G.E. et al. Age constraint on Burmese amber based on U–Pb dating of zircons // Cret. Res. 2012. V. 37. P. 155–163. https://doi.org/10.1016/j.cretres.2012.03.014
Smith A.P. Diet and feeding strategies of the marsupial sugar glider in temperate Australia // J. Anim. Ecol. 1982. V. 51. P. 149–166. https://doi.org/10.2307/4316
Stephens G.R., Aylor D.E. Aerial dispersal of red pine scale, Matsucoccus resinosae (Homoptera: Margarodidae) // Environ. Entomol. 1978. V. 7. P. 556–563. https://doi.org/10.1093/ee/7.4.556
Taylor R.M., Foster W.A. Spider nectarivory // Amer. Entomol. 1996. V. 42. P. 82–86. https://doi.org/10.1093/ae/42.2.82
Teixeira F.D., Azevedo F.C.C. de. Honeydew foraging by birds in an Atlantic Forest fragment of Minas Gerais State, Brazil // Biota Neotrop. 2013. V. 13. P. 391–394. https://doi.org/10.1590/S1676-06032013000400035
Towns D.R. Interactions between geckos, honeydew scale insects and host plants revealed on islands in northern New Zealand, following eradication of introduced rats and rabbits // Turning the Tide: The Eradication of Invasive Species. Proc. Intern. Conf. on eradication of island invasives / Eds Veitch C.R., Clout M.N. Gland–Cambridge: IUCN, 2002. P. 329–335.
Vea I.M., Grimaldi D.A. Diverse new scale insects (Hemiptera: Coccoidea) in amber from the Cretaceous and Eocene with a phylogenetic framework for fossil Coccoidea // Amer. Mus. Novit. 2015. № 3823. P. 1–15. https://doi.org/10.1206/3823.1
Wang S., Shi C., Cai H.H. et al. Cretaceous fire-resistant angiosperms. Preprint // Res. Sq. 2021. https://doi.org/10.21203/rs.3.rs-494355/v1
Washburn J.O., Frankie G.W. Dispersal of a scale insect, Pulvinariella mesembryanthemi (Homoptera: Coccoidea) on iceplant in California // Environ. Entomol. 1981. V. 10. P. 724–727. https://doi.org/10.1093/ee/10.5.724
Washburn J.O., Washburn L. Active aerial dispersal of minute wingless arthropods: exploitation of boundary-layer velocity gradients // Science. 1984. V. 223. P. 1088–1089. https://doi.org/10.1126/science.223.4640.1088
Xing L., Cockx P., McKellar R.C. Disassociated feathers in Burmese amber shed new light on mid-Cretaceous dinosaurs and avifauna // Gondwana Res. 2020. V. 82. P. 241–253. https://doi.org/10.1016/j.gr.2019.12.017
Yu T., Kelly R., Mu L. et al. An ammonite trapped in Burmese amber // PNAS. 2019. V. 116. P. 11345–11350. https://doi.org/10.1073/pnas.1821292116
Zahradník J. Scale insects – Coccinea // Klíč zvířeny ČSR. 1959. V. 3. P. 527–552. [In Czech].
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


