Петрология, 2021, T. 29, № 1, стр. 90-103
Термодинамическая модель флюидной системы H2O–CO2–NaCl при P-T параметрах средней и нижней коры
М. В. Иванов a, *, С. А. Бушмин a
a Институт геологии и геохронологии докембрия РАН
Санкт-Петербург, Россия
* E-mail: m.v.ivanov@ipgg.ru
Поступила в редакцию 05.02.2020
После доработки 30.04.2020
Принята к публикации 21.05.2020
Аннотация
Предложена численная термодинамическая модель для одной из важнейших геологических флюидных систем – тройной системы H2O–CO2–NaCl при P-T условиях средней и нижней коры и границы кора–мантия (до P = 20 кбар и до T = 1400°C). Модель аналогична по форме с ранее разработанной для флюидной системы H2O–CO2–CaCl2. Модель основана на уравнении для избыточной свободной энергии Гиббса для флюида H2O–CO2–NaCl, включающего также слагаемые, отвечающие взаимодействию флюида с твердой фазой NaCl. Модель позволяет предсказывать физико-химические свойства флюида, принимающего участие в большинстве процессов глубинного петрогенеза: фазовое состояние системы (гомогенный или многофазный флюид, наличие или отсутствие твердого NaCl), химические активности компонентов, плотности флюидных фаз и концентрации компонентов в сосуществующих фазах. P-T зависимости коэффициентов уравнения для избыточной свободной энергии Гиббса выражены через мольные объемы воды и CO2 при соответствующем давлении и температуре. Численные параметры модели получены из условия наилучшего соответствия экспериментальным данным по фазовому состоянию флюидной системы в диапазоне давлений 1–9 кбар и в диапазоне температур 500–930°C. Использованная нами параметризация P-T зависимостей обеспечивает возможность применения модели за пределами экспериментальной области, а именно до P = 20 кбар и до T = 1400°C. Применимость представленной модели выше указанных Р‑Т параметров в основном ограничена справедливостью использованного в ней термодинамического описания углекислого газа.
ВВЕДЕНИЕ
Знание физико-химических свойств глубинных флюидов является важнейшим инструментом для исследования метаморфического, метасоматического и магматического петрогенезиса, особенностей проявления и развития этих глобальных геологических процессов. Типичным результатом изменения внешних физических параметров, таких как температура и давление, является распад гомогенного флюида на несмесимые и контрастные по физико-химическим свойствам флюидные фазы, либо слияние этих фаз при существенном повышении давления, выпадение твердого вещества из флюида, либо растворение этого вещества во флюиде. Эти процессы сопровождаются изменением важнейших физико-химических параметров флюидов: химических активностей компонентов флюидов, степени диссоциации растворенных электролитов, степени кислотности флюида. Эти обстоятельства делают актуальным теоретическое исследование термодинамики природных флюидов. Глубинные флюиды, содержащие H2O, CO2 и соли (хлориды щелочных и щелочноземельных металлов), играют важную роль в магматическом, метаморфическом и метасоматическом петрогенезисе, рудообразовании, в переносе вещества на разные уровни земной коры (например, Trommsdorff et al., 1985; Markl, Bucher, 1998; Manning, Aranovich, 2014; Manning 2018 и ссылки в ней; Аранович, 2017; Harlov, Aranovich, 2018; Newton et al., 2019; Бушмин и др., 2020; Hsu et al., 2019). Знание количественных характеристик глубинных флюидов не менее важно и для решения проблем геодинамики, имеющих важнейшее прикладное значение в отношении предсказания землетрясений (например, Леонов и др., 2006; Киссин, 2009; Родкин, Рундквист, 2017; Manning, 2018). Солевая компонента таких флюидов обычно является смесью нескольких солей. Однако весьма частым является преобладание NaCl в составе солевой части флюида. Природная распространенность таких флюидов, а также значительная теоретическая изученность водных растворов NaCl сделали теоретическое изучение термодинамики системы H2O–CO2–NaCl при типичных для земной коры высоких температурах и давлениях достаточно популярным. Наряду с ранними термодинамическими моделями (Duan et al., 1995; Joyce, Holloway, 1993) сравнительно недавно были созданы модели этой системы с достаточной точностью воспроизводящие экспериментальные данные при повышенных P-T параметрах (Sun, Dubessy, 2012; Dubacq et al., 2013). Однако эти модели ограничены сравнительно низкими температурами и давлениями: температура до 300°C и давление до 1 кбар в (Sun, Dubessy, 2012) и температура до 380°C и давление до 3.5 кбар в (Dubacq et al., 2013). Для системы H2O–CO2–NaCl при более высоких температурах и давлениях в настоящее время имеется термодинамическая модель, представленная в (Аранович и др., 2010). Модель опирается на экспериментальные данные до T = 800°C и до P = 9 кбар и допускает экстраполяцию до 10–11 кбар.
В работе (Иванов, Бушмин, 2019) нами была разработана численная термодинамическая модель системы H2O–CO2–CaCl2, применимая до давлений 20 кбар и температур до 1400°C, благодаря использованию параметризации P-T зависимостей через мольные объемы воды и углекислого газа. Целью настоящей работы является создание аналогичной модели для флюидной системы H2O–CO2–NaCl.
ТЕОРЕТИЧЕСКИЙ МЕТОД
Свободная энергия Гиббса
В настоящей работе мы представляем термодинамическую модель системы H2O–CO2–NaCl для высоких давлений и температур, развитую на основе уравнения для избыточной свободной энергии Гиббса. Форма зависимости свободной энергии Гиббса смешения ${{G}^{{{\text{mix}}}}}$ (Дж/моль) от концентрации компонентов совпадает с предложенной для тройной системы в (Аранович и др., 2010) и примененной нами ранее для построения термодинамической модели флюидной системы H2O–CO2–CaCl2 (Иванов, Бушмин, 2019). Для температуры ($T{\kern 1pt} $), давления ($P$) и мольных долей компонентов ${{x}_{1}} = {{x}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}},$ ${{x}_{2}} = {{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}},$ ${{x}_{3}} = {{x}_{{{\text{NaCl}}}}}$ свободная энергия Гиббса имеет вид:
(2)
${{G}^{{{\text{id}}}}} = RT({{x}_{1}}\ln {{x}_{1}} + {{x}_{2}}\ln {{x}_{2}} + {{x}_{3}}\ln {{x}_{3}}),$(3)
$\begin{gathered} {{G}_{{\alpha }}} = - {{x}_{1}}RT\ln [{{1 + \alpha {{x}_{3}}} \mathord{\left/ {\vphantom {{1 + \alpha {{x}_{3}}} {({{x}_{1}} + {{x}_{3}})}}} \right. \kern-0em} {({{x}_{1}} + {{x}_{3}})}}] + \\ + \,\,{{x}_{3}}\{ (1 + \alpha )RT\ln (1 + \alpha ) + \alpha RT\ln [{{{{x}_{3}}} \mathord{\left/ {\vphantom {{{{x}_{3}}} {({{x}_{1}} + {{x}_{3}})}}} \right. \kern-0em} {({{x}_{1}} + {{x}_{3}})}}] - \\ - \,\,(1 + \alpha )RT\ln [{{1 + \alpha {{x}_{3}}} \mathord{\left/ {\vphantom {{1 + \alpha {{x}_{3}}} {({{x}_{1}} + {{x}_{3}})}}} \right. \kern-0em} {({{x}_{1}} + {{x}_{3}})}}]\} , \\ \end{gathered} $(4)
$\begin{gathered} {{G}^{{{\text{ex}}}}} = {{x}_{1}}{{x}_{2}}{{W}_{1}}(P,T){{\rho }_{{12}}}({{x}_{1}},{{x}_{2}}) + {{x}_{1}}{{x}_{3}}{{W}_{2}}(P,T) + \\ + \,\,{{{{x}_{2}}{{x}_{3}}[{{x}_{2}}{{W}_{3}}(P,T) + {{x}_{3}}{{W}_{4}}(P,T)]} \mathord{\left/ {\vphantom {{{{x}_{2}}{{x}_{3}}[{{x}_{2}}{{W}_{3}}(P,T) + {{x}_{3}}{{W}_{4}}(P,T)]} {({{x}_{2}} + {{x}_{3}})}}} \right. \kern-0em} {({{x}_{2}} + {{x}_{3}})}} + \\ + \,\,{{x}_{1}}{{x}_{2}}{{x}_{3}}{{W}_{5}}(P,T). \\ \end{gathered} $В этих и остальных формулах статьи, где не указано иное, мы используем единицы системы СИ. Однако для удобства обсуждения результатов на графиках и в тексте давление приводится в килобарах, а температура в градусах Цельсия. Слагаемое ${{G}^{{{\text{id}}}}}$ в (1), (2) представляет собой вклад в свободную энергию энтропии смешения трех компонентов системы (Aranovich, Newton, 1996, 1997). Слагаемое ${{G}_{{\alpha }}}$ представляет вклад дополнительной энтропии, возникающей вследствие диссоциации молекул NaCl. $\alpha $ – степень диссоциации (среднее дополнительное число частиц, появившееся в результате диссоциации одной молекулы NaCl). Полной диссоциации соответствует $\alpha $ = ${{\alpha }_{0}} = 1.$ Следует отметить, что за исключением предельных случаев крайне сильного электролита, когда при любой концентрации раствора происходит полная диссоциация, и полного отсутствия электролитических свойств, когда диссоциация вообще не происходит, степень диссоциации зависит от концентрации раствора электролита. Однако в нашей модели мы упрощенно предполагаем, что величина $\alpha $ зависит от температуры и давления, но не зависит от мольной доли NaCl. Таким образом, строго говоря, в нашей модели $\alpha $ является усредненной по концентрации степенью диссоциации NaCl.
Слагаемое с коэффициентом ${{W}_{1}}$ описывает взаимодействие молекул воды и CO2. Это слагаемое совпадает с таковым из (Аранович и др., 2010; Аранович, 2013).
(5)
$\begin{gathered} {{W}_{1}} = 0.202046\,\,{{{\text{Дж}} \cdot {{{\text{м}}}^{{\text{3}}}}} \mathord{\left/ {\vphantom {{{\text{Дж}} \cdot {{{\text{м}}}^{{\text{3}}}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\text{,}} \\ \rho ({{x}_{1}},{{x}_{2}}) = {{({{x}_{1}} + {{x}_{2}})} \mathord{\left/ {\vphantom {{({{x}_{1}} + {{x}_{2}})} {({{V}_{1}}{{x}_{1}} + {{V}_{2}}{{x}_{2}})}}} \right. \kern-0em} {({{V}_{1}}{{x}_{1}} + {{V}_{2}}{{x}_{2}})}}. \\ \end{gathered} $Производные термодинамические величины
Наша модель системы H2O–CO2–NaCl основана на уравнениях для свободной энергии Гиббса, что позволяет вычислять многочисленные термодинамические величины, характеризующие систему. Расчеты активностей компонентов и плотности системы в нашей модели рассмотрены в (Иванов, Бушмин, 2019). Необходимый для расчета плотности системы H2O–CO2–NaCl мольный объем NaCl (cм3/моль) в зависимости от T (°C) и P (бар) был получен на основе формулы (Driesner, 2007):
где
Опорные экспериментальные данные
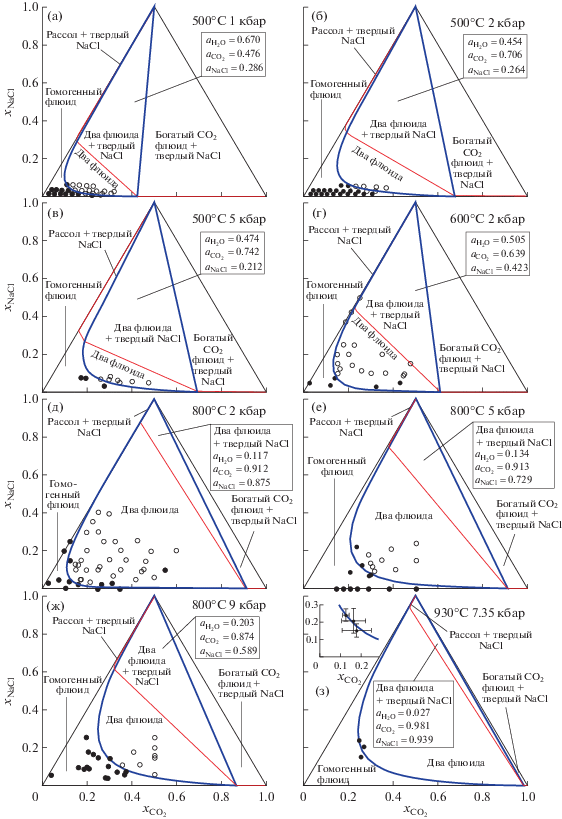
Численные параметры термодинамической модели для флюидной системы H2O–CO2–NaCl были получены нами на базе двух имеющихся в литературе наборов экспериментальных данных. Прежде всего, это экспериментальные данные по фазовому состоянию системы H2O–CO2–NaCl в работах (Frantz et al., 1992; Shmulovich, Graham, 1999, 2004; Котельников, Котельникова, 1990; Johnson, 1991). Результаты этих работ, отвечающие диапазону температур от 500 до 930°C и диапазону давлений от 1 до 9 кбар, представлены на рис. 1. За исключением работы (Johnson, 1991) экспериментальными данными являются концентрации компонентов, при которых в системе присутствует гомогенный флюид или две сосуществующие флюидные фазы. На рис. 1а–1ж точки, соответствующие гомогенному флюиду, отмечены залитыми кружками. Точки, в которых было зафиксировано наличие двух сосуществующих флюидных фаз, отмечены незалитыми кружками. В работе (Johnson, 1991) для T ≈ 930°C и P ≈ 7.35 кбар были получены три точки, лежащие на границе разделяющей области гомогенного и двухфазного флюида – сольвусе, или бинодали (Diamond, 2003; Heinrich, 2007). Эти точки с полученными в (Johnson, 1991) погрешностями представлены на врезке к рис. 1з.
Рис. 1.
Фазовые диаграммы системы H2O–CO2–NaCl. Экспериментальные точки и результаты по нашей термодинамической модели (линии). Незалитые кружки – двухфазный флюид, залитые кружки – гомогенный флюид, синяя жирная сплошная линия – граница области сосуществования двух флюидных фаз (сольвус), красная тонкая сплошная линия – граница области существования твердой фазы NaCl. Экспериментальные данные: (а), (б) – (Frantz et al., 1992), (в), (е) – (Shmulovich, Graham, 2004), (г), (д) – (Котельников, Котельникова, 1990), (ж) – (Shmulovich, Graham, 1999), (з) – (Johnson, 1991). На врезке к рис. (з) сольвус и экспериментальные точки с погрешностями в прямоугольных координатах $({{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}},{{x}_{{{\text{NaCl}}}}})$. Минимальные значения активности воды в области сосуществования двух флюидных фаз имеют те же значения, что и ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ в области “Два флюида + твердый NaCl”. Максимальные значения активности воды в области сосуществования двух флюидных фаз: (а) – 0.828, (б) – 0.686, (в) – 0.648, (г) – 0.770, (д) – 0.800, (е) – 0.557, (ж) – 0.490, (з) – 0.484.
Вторым, использованным нами набором экспериментальных данных были полученные в (Aranovich, Newton, 1996) значения активности воды в бинарной подсистеме H2O–NaCl при температурах от 600 до 800°C, давлениях 2 и 10 кбар и преимущественно при высоких концентрациях NaCl. Эти данные, приведенные в табл. 1, дают важную информацию о поведении исследуемой нами системы в области высокой концентрации NaCl и низкой концентрации CO2, в которой имеется наименьшее количество данных по фазовому состоянию системы.
Таблица 1.
Согласование модели с экспериментальными данными по активности воды в системе H2O–NaCl
| P, кбар | T, °C | ${{x}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(e)}}$ | ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(A)}}$ | ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(A)}} - {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(e)}}$ | ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(I)}}$ | ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(I)}} - {{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(e)}}$ |
|---|---|---|---|---|---|---|---|
| 2 | 600 | 0.644 | 0.637 | 0.6290 | –0.0080 | 0.6123 | –0.0247 |
| 620 | 0.741 | 0.746 | 0.7368 | –0.0092 | 0.7281 | –0.0179 | |
| 640 | 0.876 | 0.868 | 0.8774 | 0.0094 | 0.8723 | 0.0043 | |
| 10 | 680 | 0.610 | 0.421 | 0.4280 | 0.0070 | 0.4283 | 0.0073 |
| 700 | 0.660 | 0.475 | 0.4859 | 0.0109 | 0.4847 | 0.0097 | |
| 720 | 0.690 | 0.535 | 0.5248 | –0.0102 | 0.5206 | –0.0144 | |
| 740 | 0.753 | 0.600 | 0.6063 | 0.0063 | 0.6008 | 0.0008 | |
| 755 | 0.782 | 0.651 | 0.6476 | –0.0034 | 0.6403 | –0.0107 | |
| 780 | 0.860 | 0.749 | 0.7631 | 0.0141 | 0.7552 | 0.0062 | |
| 800 | 0.907 | 0.828 | 0.8391 | 0.0111 | 0.8314 | 0.0034 |
Примечание. ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(e)}}$ – экспериментальные данные (Aranovich, Newton, 1996); ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(A)}}$ – наш расчет по модели (Аранович и др., 2010); ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}{\text{(I)}}$ – расчет по модели настоящей работы.
Численные параметры, определяющие зависимости от температуры и давления величин $\alpha $ и ${{W}_{2}}, \ldots ,{{W}_{5}}$ подбирались таким образом, чтобы вычисляемые из модели положения сольвуса и химическая активность воды наилучшим образом соответствовали экспериментальным данным.
Аппроксимация P-T зависимостей и численный подбор параметров
Выбор формы P-T зависимостей величин $\alpha $ и ${{W}_{2}}, \ldots ,{{W}_{5}}$ аналогичен таковому в работе (Иванов, Бушмин, 2019). Зависимость усредненной по концентрации степени диссоциации NaCl от температуры и давления выражается через мольный объем воды по формуле:
(6)
$\alpha = \frac{{{{\alpha }_{0}}}}{{1 + {{a}^{2}}\left[ {\sqrt {{{{({{V}_{{\text{1}}}} - {{V}_{0}})}}^{2}} + {{q}^{2}}} + {{V}_{{\text{1}}}} - {{V}_{0}}} \right]}}$с численными параметрами a, ${{V}_{0}}$ и q, подбираемыми на базе экспериментальных данных. Зависимость коэффициентов ${{W}_{2}}, \ldots ,{{W}_{5}}$ от температуры и давления выражается через мольный объем воды при соответствующих температуре и давлении и предполагается линейной
(7)
${{W}_{i}}(P,T) = {{u}_{{i0}}} + {{u}_{{i{\text{1}}}}}{{V}_{{\text{1}}}}(P,T),\,\,\,\,i = 2, \ldots ,5$и зависящей от восьми численных параметров uij.
Определение значений одиннадцати численных параметров a, ${{V}_{0}},$ q, uij осуществлялось путем минимизации целевой функции, описывающей отклонение даваемых моделью результатов от экспериментальных данных. Для результатов работ (Frantz et al., 1992; Shmulovich, Graham, 1999, 2004; Котельников, Котельникова, 1990) вклад экспериментальных данных в целевую функцию определяется сходным с работой (Иванов, Бушмин, 2019) образом как сумма квадратов расстояний от расчетной линии сольвуса до экспериментальных точек, попадающих при заданных значениях параметров в “неправильные” области. Для результатов (Johnson, 1991), представляющих состав флюида непосредственно на сольвусе, этот вклад является суммой квадратов отклонений экспериментальных точек от расчетного сольвуса с весами, учитывающими экспериментальные погрешности. Аналогичным образом вычислялся вклад в целевую функцию отклонений активности воды от ее экспериментальных значений.
Твердая и расплавленная фазы NaCl
При некоторых количественных соотношениях компонентов в системе H2O–CO2–NaCl помимо флюидных фаз может появляться твердая фаза NaCl. Зависимость температуры плавления NaCl от давления экспериментально исследована в (Pistorius, 1966). Полученная в этой работе экспериментальная зависимость температуры плавления от давления Tm(P) охватывает диапазон давлений 0–39 кбар и с высокой точностью аппроксимируется уравнением Саймона (Simon, Glatzel, 1929; Pistorius, 1966):
где P0 может быть принято равным нулю, а T0 является температурой плавления при атмосферном давлении. Значения параметров A и c для NaCl равны 15 кбар и 2.969 соответственно. Для получения полного выражения для свободной энергии Гиббса ниже точки плавления NaCl необходимо знание величины изменения химического потенциала NaCl при переходе из твердой в жидкую фазу $\Delta \mu (T).$ Эта величина, в частности, определяет наличие или отсутствие кристаллической фазы NaCl в равновесии с его водным раствором. Для атмосферного давления эта величина как функция температуры может быть получена из термодинамических таблиц, представленных в (Chase, 1988). Для более высоких давлений мы использовали эту же функцию с модифицированной температурой $\Delta \mu (T - {{T}_{m}} + {{T}_{0}}).$
РЕЗУЛЬТАТЫ
Модельные фазовые диаграммы и экспериментальные данные
Значения параметров, подобранные на основе экспериментальных результатов (Frantz et al., 1992; Shmulovich, Graham, 1999, 2004; Котельников, Котельникова, 1990; Johnson, 1991; Aranovich, Newton, 1996) приведены в табл. 2. Фазовые диаграммы, рассчитанные с этими параметрами по термодинамической модели (1)–(7) представлены на рис. 1. В пределах точности представленных экспериментальных результатов видно хорошее согласие с ними построенных по нашей модели сольвусов. Экспериментальные положения точек на сольвусе с соответствующими погрешностями приводятся в работе (Johnson, 1991). На врезке к рис. 1з видно соотношение между этими экспериментальными данными и предсказаниями нашей термодинамической модели.
Таблица 2.
Численные параметры модели системы H2O–CO2–NaCl, согласно уравнениям (1)–(7)
| a | 3.49645110E+00 | моль1/2/см3/2 |
| V0 | 3.01537773E+01 | см3/моль |
| q | 2.64240294E-01 | см3/моль |
| u20 | –2.85474618E+03 | Дж/моль |
| u21 | 5.32843070E+01 | Дж/см3 |
| u30 | –7.60618066E+03 | Дж/моль |
| u31 | 4.00753499E+03 | Дж/см3 |
| u40 | 9.98340706E+03 | Дж/моль |
| u41 | 2.83005917E+03 | Дж/см3 |
| u50 | –3.65710567E+04 | Дж/моль |
| u51 | –2.36367927E+02 | Дж/см3 |
Следует отметить, что все экспериментальные точки (за исключение одной малоинформативной точки на рис. 1г) лежат либо в области (поле) гомогенного флюида, либо в области сосуществования двух флюидных фаз. Для весьма значительной по размеру области сосуществования флюидных фаз и твердого NaCl экспериментальные данные отсутствуют. Область сосуществования двух флюидных фаз и твердой фазы NaCl примечательна тем, что в ней значения активности всех трех компонентов флюида постоянны. Кроме того, химическая активность воды в этой области принимает свое минимальное значение, совместимое с наличием двух сосуществующих флюидных фаз (подробнее см. ниже).
Как видно из табл. 1, экспериментальные значения активности воды в системе H2O–NaCl (Aranovich, Newton, 1996) также с высокой точностью воспроизводятся в нашей модели.
Сравнение предсказаний нашей термодинамической модели для флюидной системы H2O–CO2–NaCl и модели (Аранович и др., 2010) для этой же системы представлено на рис. 2. Для использованных в (Аранович и др., 2010) экспериментальных комбинаций температуры и давления наши результаты по положению сольвуса и коннод, отвечающих одной и той же активности воды, сравнительно близки к получаемым из модели (Аранович и др., 2010). Однако наша термодинамическая модель предсказывает несколько более узкую область сосуществования двух флюидных фаз и, соответственно, меньшую активность воды в критической точке. Эта величина ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ одновременно является максимально возможной для области двух сосуществующих флюидных фаз. Для представленной на рис. 2а. фазовой диаграммы при P = 9 кбар и T = 800°C эти предельные значения активности равны 0.498 и 0.547 соответственно. На рис. 2а для двух сравниваемых моделей также представлены конноды, соответствующие ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.4.$ По положению они довольно близки между собой, хотя в нашей модели коннода ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.4$ более пологая.
Рис. 2.
(а) Фазовые диаграммы для системы H2O–CO2–NaCl по нашей модели (1) и по (Аранович и др., 2010) – (2). Жирные линии – границы области сосуществования двух флюидных фаз, тонкие линии – границы области существования твердого NaCl. Пунктирные линии – конноды, соответствующие ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.4.$ (б) Активность NaCl в зависимости от мольной доли NaCl при ${{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.$
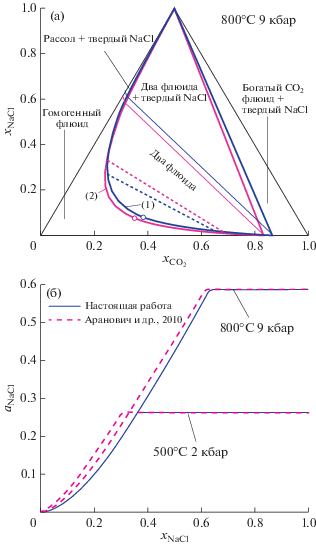
На рис. 2б для двух комбинаций температуры и давления, представленных в (Аранович и др., 2010), приведено сравнение зависимости активности NaCl от концентрации соли в системе, не содержащей CO2. В области относительно низких концентраций NaCl (отсутствие твердой соли) видны небольшие различия кривых ${{a}_{{{\text{NaCl}}}}}({{x}_{{{\text{NaCl}}}}}).$ При больших концентрациях NaCl, отвечающих равновесному сосуществованию флюида и твердого NaCl (горизонтальные части кривых на рис. 2б), концентрация и активность NaCl во флюиде не зависят от полного количества NaCl в системе. В этой области наши значения ${{a}_{{{\text{NaCl}}}}}({{x}_{{{\text{NaCl}}}}})$ практически совпадают с полученными по модели (Аранович и др., 2010).
Активность компонентов
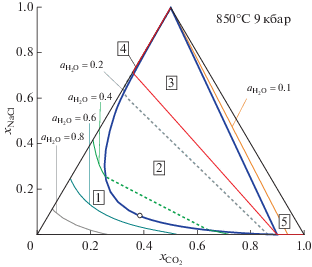
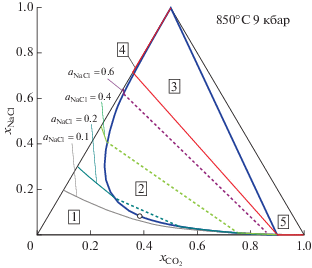
На рис. 3 представлены значения активности воды в зависимости от состава флюидной системы H2O–CO2–NaCl при P = 9 кбар и T = 850°C. В области-1 (поле гомогенного флюида) даны изолинии активности для нескольких ее значений. В области-2 (поле бинарного флюида) активность воды в сосуществующих флюидах определяется коннодами, соединяющими точки пересечения изолиний активности с сольвусом. Значения активности воды в области-2 изменяется от ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.476$ в критической точке (${{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.3429,$ ${{x}_{{{\text{NaCl}}}}} = 0.0832$) до ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.148$ на границе с областью-3. В этой области (две флюидные фазы плюс твердый NaCl) активность воды при заданных температуре и давлении имеет постоянное значение ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.148.$ Составы двух флюидных фаз, сосуществующих в этой области с твердым NaCl также постоянны: ${{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.8988,$ ${{x}_{{{\text{NaCl}}}}} = 0.0038$ и ${{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.0076,$ ${{x}_{{{\text{NaCl}}}}} = 0.7072.$ Активности CO2 и NaCl во флюидных фазах в этой области составов постоянны и имеют значения ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.906,$ ${{a}_{{{\text{NaCl}}}}} = 0.690$ соотвественно. Это же значение активности NaCl сохраняется в области-5 (богатая CO2 флюидная фаза, равновесная с твердым NaCl). Активность воды в этой области принимает значения от 0.148 до 0. Изолиния для ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.1,$ проходящая в этой области, представлена на рис. 3. В области-4 (рассол плюс твердый NaCl) активность воды изменяется (вдоль линии ${{x}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0$) в пределах от нуля до ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.152.$
Рис. 3.
Изолинии активности H2O в поле гомогенного флюида и соответствующие конноды для системы H2O–CO2–NaCl. Тонкие сплошные кривые – изолинии активности в области гомогенного флюида, пунктирные прямые линии – конноды. Цифры в рамках обозначают области (поля) различного фазового состава: 1 – гомогенный флюид; 2 – две сосуществующие флюидные фазы; 3 – две флюидные фазы, сосуществующие с твердым NaCl; 4 – рассол, сосуществующий с твердым NaCl; 5 – богатый CO2 флюид, сосуществующий с твердым NaCl. Незалитым кружком обозначена критическая точка в области-2.
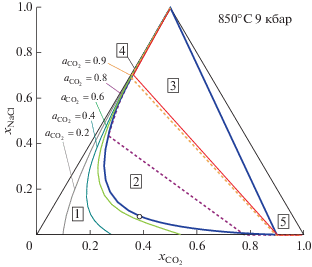
Для тех же значений температуры и давления (T = 850°C и P = 9 кбар) изолинии активности и конноды для CO2 представлены на рис. 4. Изолинии ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.2,$ ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.4$ и ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.6$ полностью лежат в области гомогенного флюида. Коннода ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.8$ соединяет концы двух участков изолинии ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.8.$ Верхний участок изолинии практически совпадает с сольвусом. Короткий нижний участок лежит в области гомогенного флюида, бедного NaCl и богатого CO2. В области сосуществования двух флюидных фаз активность CO2 возрастает от значения ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.626$ в критической точке до ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.906$ на границе с областью-3. Коннода, соединяющая точки пересечения верхнего и нижнего участков изолинии ${{a}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = 0.9$ с сольвусом, лежит вблизи границы области двухфазного флюида и области-3 (двухфазный флюид, сосуществующий с твердым NaCl), в которой активность CO2 имеет значение 0.906. Дальнейшее повышение активности CO2 происходит в области-5, преимущественно углекислотного флюида, сосуществующего с твердым NaCl.
Рис. 4.
Изолинии активности CO2 в поле гомогенного флюида и соответствующие конноды для системы H2O–CO2–NaCl. Условные обозначения см. на рис. 3.
Изолинии значений активности NaCl и соответствующие конноды при P = 9 кбар и T = 850°C представлены на рис. 5. Изолиния ${{a}_{{{\text{NaCl}}}}} = 0.1$ полностью лежит в области гомогенного флюида. Точки пересечения изолиний ${{a}_{{{\text{NaCl}}}}} = 0.2,$ ${{a}_{{{\text{NaCl}}}}} = 0.4$ и ${{a}_{{{\text{NaCl}}}}} = 0.6$ с сольвусом являются концами соответствующих коннод. В области-2 (сосуществование двух флюидных фаз) активность NaCl возрастает от значения ${{a}_{{{\text{NaCl}}}}} = 0.167$ в критической точке до ${{a}_{{{\text{NaCl}}}}} = 0.690$ на границе с областью-3. Активность NaCl во всем поле наличия его твердой фазы (цифры на рисунке 3–4–5) постоянна и при данных температуре и давлении имеет значение ${{a}_{{{\text{NaCl}}}}} = 0.690.$
Рис. 5.
Изолинии активности NaCl в поле гомогенного флюида и соответствующие конноды для системы H2O–CO2–NaCl. Условные обозначения см. на рис. 3.
Плотность флюида
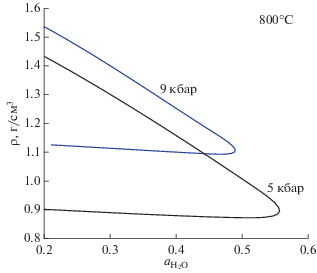
Плотность флюида является важнейшей характеристикой, определяющей его физико-химические и транспортные свойства. Возможности нашей термодинамической модели по вычислению плотности флюида H2O–CO2–NaCl представлены на рис. 6 и 7. На фазовой диаграмме рис. 6 даны изолинии плотности гомогенного флюида при P = 9 кбар и T = 850°C. Значения плотности чистых фаз при этих температуре и давлении составляют 0.835, 1.132 и 1.768 г/см3 для H2O, CO2 и NaCl соответственно. Вода при данных P и T является наименее плотным компонентом. На рис. 6 хорошо прослеживается увеличение плотности гомогенного флюида по мере замены воды на более плотные компоненты CO2 и NaCl. Значения плотности, как и составы, сосуществующих флюидных фаз в области-2 совпадают с таковыми для гомогенного флюида на сольвусе. На рис. 7 дана зависимость плотности флюида на сольвусе от активности воды. Каждая кривая на этом рисунке состоит из двух ветвей, сходящихся при активности воды, соответствующей критической точке. Нижняя ветвь кривой отвечает флюидной фазе преимущественно водно-углекислотного состава с малым содержанием NaCl. Верхняя ветвь кривой дает плотность флюидной фазы с высоким содержанием NaCl. Любая вертикальная линия, проведенная на этом рисунке и пересекающая в двух точках кривую $\rho ({{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}),$ соответствует конноде, а точки пересечения дают соответствующие значения плотности сосуществующих флюидных фаз. Для двух показанных на рис. 7 зависимостей плотности фазы с высоким содержанием NaCl сравнительно близки. В противоположность этому плотность водно-углекислотного флюида достаточно сильно зависит от давления и уменьшается при его снижении. В конечном счете, при достаточно малых давлениях это приводит к разделению флюида на условно газовую фазу, состоящую из воды и углекислого газа, и много более плотный рассол, практически не содержащий CO2. Возможность расчета плотности флюида в зависимости от давления позволяет также рассчитывать его сжимаемость, что представляет интерес для практических приложений в области сейсмологии (см. например, Родкин, Рундквист, 2017).
Рис. 6.
Изолинии плотности (г/см3) гомогенного флюида H2O–CO2–NaCl в зависимости от концентрации его компонентов. Обозначения фазовых полей см. на рис. 3.
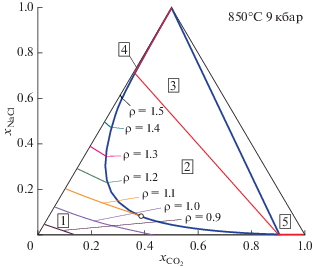
Рис. 7.
Значения плотности флюида на сольвусе в зависимости от активности воды. Точки на верхней и нижней ветвях кривых, отвечающие одной и той же активности воды, соответствуют плотностям сосуществующих флюидных фаз. Верхняя ветвь каждой кривой – плотность флюида с высоким содержанием соли. Нижняя ветвь – преимущественно водно-углекислотный флюид с малым содержанием NaCl.
Возможность экстраполяции в область более высоких P-T параметров
Представленная выше термодинамическая модель флюидной системы H2O–CO2–NaCl основана на уравнении для свободной энергии Гиббса, сходном с использованным нами для системы H2O–CO2–CaCl2 (Иванов, Бушмин, 2019). В обоих случаях используется параметризация P-T зависимостей коэффициентов свободной энергии Гиббса через величины мольного объема воды и CO2. Экспериментальные данные для обеих тройных систем покрывают практически совпадающие диапазоны температур 500–900 и 500–930°C и диапазон значений давления 1–9 кбар. Выход за пределы этого диапазона в сторону более высоких давлений ведет к изменению мольных объемов в заметно меньших масштабах по сравнению с их изменением внутри экспериментального диапазона (Иванов, Бушмин, 2019). Еще меньшим делает это изменение увеличение температуры. Таким образом, при $P > 9$ кбар сравнительно малое повышение температуры (выше экспериментальных значений) возвращает величины мольных объемов к их значениям в экспериментальном диапазоне. Эти обстоятельства позволяют предположить, так же как в случае системы H2O–CO2–CaCl2, что представленная модель может применяться при температурах до 1300–1400°C и давлениях до 20 кбар. При более высоких P-T параметрах применимость модели может ограничиваться свойствами использованных нами термодинамических моделей воды и углекислого газа. Проверка нашей модели при температурах и давлениях, выходящих за пределы экспериментально исследованной области, показала отсутствие проблем в ее использовании в указанных пределах.
Эволюция фазового поведения при увеличении давления
Примененное нами термодинамическое описание фазы твердой соли основано на экспериментах (Pistorius, 1966), доведенных для NaCl до давления 39 кбар. Эти экспериментальные данные свидетельствуют о быстром повышении температуры плавления NaCl с повышением давления. При фиксированной температуре это означает увеличение скачка химического потенциала NaCl при переходе из твердой в жидкую фазу $\Delta \mu $. Результатом этого является снижение растворимости NaCl в воде. Снижение растворимости NaCl при увеличении давления графически означает опускание линии сосуществования твердого NaCl с флюидом. Одновременно, увеличение давления ведет к подъему положения сольвуса на фазовой диаграмме. Именно так происходит расширение области гомогенного флюида. Сочетание этих двух процессов ведет к сжиманию областей составов, в которых возможно сосуществование двух флюидных фаз. Для температуры 600°C эти изменения иллюстрирует рис. 8. С прикладной точки зрения, важным следствием сжатия области сосуществования двух флюидных фаз является сокращение диапазона значений активности воды, в котором возможно существование расслоенного флюида.
Рис. 8.
Изменение размеров фазовых полей с повышением давления. Сплошные линии – P = 3 кбар, пунктирные линии – P = 20 кбар, T = 600°C. Обозначения фазовых полей см. на рис. 3.

Для двух значений температуры зависимости от давления минимальной и максимальной активности воды в области сосуществования двух флюидных фаз представлены на рис. 9а. Для обоих значений температуры при давлениях выше 4 кбар (850°C) и 3 кбар (600°C) увеличение давления приводит к монотонному сближению минимальных и максимальных значений ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}.$ Для данных величин давления представленные на рис. 9б зависимости $\alpha (P)$ показывают практически полную диссоциацию молекул NaCl. Однако при минимальных величинах давления, представленных на рис. 9б, степень диссоциации NaCl близка к нулю. Резкий переход от режима слабого к режиму сильного электролита происходит при P ≈ 2 кбар для T = 600°C и при P ≈ 4 кбар для T = 850°C. Это резкое изменение свойств бинарной подсистемы H2O–NaCl служит причиной особенностей, видимых на кривых рис. 9а.
Рис. 9.
(а) Минимальное и максимальное значения активности воды в области сосуществования двух флюидных фаз в зависимости от давления для двух значений температуры. (б) Усредненная степень диссоциации NaCl в зависимости от давления для температур на рис. 9а. (в) Зависимость усредненной степени диссоциации NaCl от мольного объема воды в соответствии с уравнением (6).
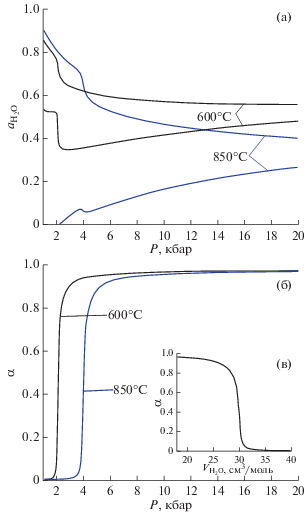
В рамках нашей модели величина усредненной степени диссоциации NaCl определяется мольным объемом воды согласно уравнению (6). Эта зависимость представлена на рис. 9в. Параметры нашей модели, определяющие резкое изменение $\alpha ({{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}})$ при ${{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \approx 30$ см3/моль, получены на основе экспериментальных данных (Aranovich, Newton, 1996) по активности воды в растворе H2O–NaCl при T = 600–640°C и давлении 2 кбар и T = 680–800°C и давлении 10 кбар. Проведенный в этой работе анализ полученных данных приводит к выводу о пренебрежимо малой степени диссоциации в первом случае и диссоциации, близкой к 100%, во втором. Последнее полностью согласуется с рис. 9б.
Поведение флюидной системы H2O–CO2–NaCl, рассмотренное при анализе рис. 8, 9а, связано со значительным снижением растворимости NaCl с ростом давления и со сравнительно хорошей растворимостью углекислого газа в рассоле H2O–NaCl, приводящей к появлению на фазовой диаграмме значительной по размеру области гомогенного флюида H2O–CO2–NaCl. В противоположность этому для рассмотренной нами ранее системы H2O–CO2–CaCl2 (Иванов, Бушмин, 2019) характерна значительно лучшая растворимость CaCl2 в воде при высоких температурах и давлениях и более низкое расположение сольвуса. Поэтому рассмотренные эффекты должны быть менее выражены для системы H2O–CO2–CaCl2.
Обобщая сказанное, можно предположить, что для других солей в системе вода–неполярный газ–соль хорошая растворимость соли предполагает наличие достаточно широкой области двухфазного флюида. Однако для слаборастворимых солей такая область либо узка, либо может отсутствовать.
Флюид в реальной геологической системе
Предельно возможная для гетерофазной области активность воды в модельной системе является важной реперной характеристикой при анализе фазового состояния флюида как на основе данных по составу флюидных включений, так и результатов расчета активности воды по минеральным равновесиям. В работе (Иванов, Бушмин, 2019) было проведено сравнение максимально возможных значений активности воды в поле расслоенного флюида для систем H2O–CO2–CaCl2 и H2O–CO2–NaCl при P-T параметрах HP-гранулитов и сингранулитовых метасоматитов Лапландского гранулитового пояса Фенноскандинавского щита (Бушмин и др., 2017, 2018, 2020). Величины активности воды для системы H2O–CO2–CaCl2 были получены по нашей модели (Иванов, Бушмин, 2019), в то время как для получения активности воды во флюидной системе H2O–CO2–NaCl использовалась термодинамическая модель (Аранович и др., 2010). В частности, для температуры 900°C и давления 10 кбар предельное значение активности воды в гетерофазной области для системы H2O–CO2–CaCl2 составляет ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.547,$ в то время как в системе H2O–CO2–NaCl соответствующее максимальное значение по модели (Аранович и др., 2010) – ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.498.$ Для тех же P-T параметров представленная в настоящей статье термодинамическая модель дает максимальное значение активности воды ${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = 0.451$ в гетерофазной области флюида H2O–CO2–NaCl. Таким образом, различие в термодинамическом поведении флюидов H2O–CO2–CaCl2 и H2O–CO2–NaCl при указанных выше P-T параметрах оказывается даже несколько большим по сравнению с анализом, проведенным в (Иванов, Бушмин, 2019). Таким образом, подтверждается сделанный в работе (Бушмин и др., 2020) вывод о существовании в диапазоне P-T параметров HP-гранулитов обширной области составов водных флюидов с различным содержанием CO2 и хлоридов натрия и кальция, в которой гомогенный флюид распадается на контрастные по химическому составу и свойствам несмесимые флюидные фазы, и эта область значительно расширяется с увеличением содержания CaCl2.
ЗАКЛЮЧЕНИЕ
В настоящей работе создана численная термодинамическая модель флюидной системы H2O–CO2–NaCl для высоких P-T параметров от средней коры до границы кора–мантия. Модель основана на формуле для свободной энергии Гиббса и параметризации ее зависимости от температуры и давления, аналогичных использованным ранее (Иванов, Бушмин, 2019) для построения термодинамической модели системы H2O–CO2–CaCl2. Модель воспроизводит существующие экспериментальные данные (Frantz et al., 1992; Shmulovich, Graham, 1999, 2004; Котельников, Котельникова, 1990) по фазовому состоянию (гомогенному или двухфазному) системы H2O–CO2–NaCl в диапазоне давлений 1–9 кбар и в диапазоне температур 500–930°C, а также экспериментальные данные (Aranovich, Newton, 1996) по активности воды в растворе H2O–NaCl при T = 600–640°C и давлении 2 кбар и T = 600–800°C и давлении 10 кбар. Структура модели позволяет экстраполировать полученные P-T зависимости до P = 20 кбар и до T = 1400°C, т. е. до условий, соответствующих границе кора–мантия. Модель позволяет определять фазовое состояние системы (гомогенный или двухфазный флюид, наличие или отсутствие твердого NaCl), вычислять значения активности компонентов и плотности флюида. Построены фазовые диаграммы системы для различных значений температуры и давления, исследованы зависимости активностей компонентов и плотности флюида от его состава.
Наличие представленной в настоящей работе термодинамической модели тройной системы H2O–CO2–NaCl, наряду с разработанной ранее аналогичной термодинамической моделью системы H2O–CO2–CaCl2 (Иванов, Бушмин, 2019) и моделями водно-солевых флюидов H2O–NaCl и H2O–CaCl2 для P-T условий ниже критической точки воды (Иванов, Бушмин, Аранович, 2018а, 2018б) открывает возможность сравнения свойств этих систем как в отношении их фазового состояния, так и сравнения ряда их свойств, таких как активностей компонентов плотности и сжимаемости флюидов.
Благодарности. Авторы выражают благодарность Л.Я. Арановичу за продуктивное обсуждение и полезные замечания.
Финансовые источники. Работа выполнена в рамках научно-исследовательской темы лаборатории флюидных процессов ИГГД РАН. Компьютерное оборудование, на котором выполнена вычислительная часть работы (графическая компьютерная станция), а также оборудование, использованное для исследования флюидных микровключений в минералах при определении параметров флюида в реальной геологической обстановке (рамановский спектральный анализатор с микроскопом РамМикс М532), было приобретено ИГГД РАН по программе “Обновление приборной базы ведущих организаций, выполняющих научные исследования и разработки, академического сектора науки” в рамках национального проекта “Наука”.
Список литературы
Аранович Л.Я. Флюидно-минеральные равновесия и термодинамические свойства смешения флюидных систем // Петрология. 2013. Т. 21. № 6. С. 588–599.
Аранович Л.Я. Роль рассолов в высокотемпературном метаморфизме и гранитизации // Петрология. 2017. Т. 25. № 5. С. 491–503.
Аранович Л.Я., Закиров И.В., Сретенская Н.Г., Геря Е.В. Тройная система H2O–CO2–NaCl при высоких T-P параметрах: Эмпирическая модель смешения // Геохимия. 2010. № 5. С. 1–10.
Бушмин С.А., Вапник Е.А., Иванов М.В. и др. Флюиды гранулитов высоких давлений: Лапландский гранулитовый пояс (Фенноскандинавский щит) // Геодинамические обстановки и термодинамические условия регионального метаморфизма в докембрии и фанерозое. СПб.: ИГГД РАН, 2017. С. 40–43.
Бушмин С.А., Иванов М.В., Вапник Е.А. Флюиды HP-гранулитов: фазовое состояние и геохимические следствия // Современные проблемы магматизма, метаморфизма и геодинамики (Конференция, посвященная 85-летию со дня рождения Л.Л. Перчука, 23–24 ноября 2018 г.). М.: ИЭМ РАН, 2018. С. 24–25.
Бушмин С.А., Вапник Е.А., Иванов М.В. и др. Флюиды гранулитов высоких давлений // Петрология. 2020. Т. 28. № 1. С. 23–54.
Иванов М.В. Бушмин С.А. Уравнение состояния флюидной системы H2O–CO2–CaCl2 и свойства флюидных фаз при P-T параметрах средней и нижней коры // Петрология. 2019. Т. 27. № 4. С. 431–445.
Иванов М.В., Бушмин С.А., Аранович Л.Я. Эмпирическая модель свободной энергии Гиббса для растворов NaCl и CaCl2 произвольной концентрации при температурах 423.15–623.15 K и давлении насыщенного пара // Докл. АН. 2018a. Т. 479. № 5. С. 556–560.
Иванов М.В., Бушмин С.А., Аранович Л.Я. Уравнения состояния для растворов NaCl и CaCl2 произвольной концентрации при температурах 423.15–623.15 K и давлении до 5 кбар // Докл. АН. 2018б. Т. 481. № 6. С. 74–78.
Киссин И.Г. Флюиды в земной коре: геофизические и тектонические аспекты. М.: Наука, 2009. 328 с.
Котельников А.Р., Котельникова З.А. Экспериментальное изучение фазового состояния системы H2O–CO2–NaCl методом синтетических флюидных включений в кварце // Геохимия. 1990. № 4. С. 526–537.
Леонов Ю.Г., Киссин И.Г., Русинов В.Л. (Ред.). Флюиды и геодинамика. М.: Наука, 2006. 283 с.
Родкин М.В., Рундквист Д.В. Геофлюидогеодинамика. Приложение к сейсмологии, тектонике, процессам рудо- и нефтегенеза. Долгопрудный: Издательский дом “Интеллект”, 2017. 288 с.
Aranovich L.Y., Newton R.C. H2O activity in concentrated NaCl solutions at high pressures and temperatures measured by the brucite – periclase equilibrium // Contrib. Mineral. Petrol. 1996. V. 125. P. 200–212.
Aranovich L.Y., Newton R.C. H2O activity in concentrated KCl and KCl–NaCl solutions at high temperatures and pressures measured by the brucite-periclase equilibrium // Contrib. Mineral. Petrol. 1997. V. 127. P. 261–271.
Chase M.W. Jr. NIST-JANAF thermochemical tables // J. Phys. Chem. Ref. Data. Monograph № 9. 1988. P. 1–1951.
Diamond L.W. Introduction to gas-bearing, aqueous fluid inclusions // Eds. I. Samson, A. Anderson, D. Marshall. Fluid inclusions: Analysis and interpretation. Mineralogical Association of Canad. Short Course Series. 2003. V. 32. P. 101–158.
Driesner T. The system H2O–NaCl. Part II: Correlations for molar volume, enthalpy, and isobaric heat capacity from 0 to 1000°C, 1 to 5000 bar, and 0 to 1 XNaCl // Geochim. Cosmochim. Acta. 2007. V. 71. P. 4902–4919.
Duan Z., Møller N., Weare J.H. Equation of state for the NaCl–H2O–CO2 system: prediction of phase equilibria and volumetric properties // Geochim. Cosmochim. Acta. 1995. V. 59. P. 2869–2882.
Dubacq B., Bickle M.J., Evans K.A. An activity model for phase equilibria in the H2O–CO2–NaCl system // Geochim. Cosmochim. Acta. 2013. V. 110. P. 229–252.
Frantz J.D., Popp R.K., Hoering T.C. The compositional limits of fluid immiscibility in the system H2O–CO2–NaCl as determined with the use of synthetic fluid inclusions in conjunction with mass spectrometry // Chem. Geol. 1992. V. 98. P. 237–255.
Harlov D.E., Aranovich L. (Eds.) The Role of Halogens in Terrestrial and Extraterrestrial Geochemical Processes. Surface, Crust, and Mantle. Springer Geochemistry. Cham: Springer International Publishing, 2018. 1030 p.
Heinrich W. Fluid immiscibility in metamorphic rocks // Rev. Mineral. Geochem. 2007. V. 65. P. 389–430.
Hsu Y.-J., Zajacz Z., Ulmer P., Heinrich C.A. Chlorine partitioning between granitic melt and H2O–CO2–NaCl fluids in the Earth’s upper crust and implications for magmatic hydrothermal ore genesis // Geochim. Cosmochim. Acta. 2019. V. 261. P. 171–190.
Johnson E.L. Experimentally determined limits for H2O–CO2–NaCl immiscibility in granulites // Geology. 1991. V. 19. P. 925–928.
Joyce D.B., Holloway J.R. An experimental determination of the thermodynamic properties of H2O–CO2–NaCI fluids at high temperatures and pressures // Geochim. Cosmochim. Acta. 1993. V. 57. P. 733–746.
Manning C.E. Fluids of the Lower Crust: Deep Is Different // Annu. Rev. Earth Planet. Sci. 2018. V. 46. P. 67–97.
Manning C.E., Aranovich L.Y. Brines at high pressure and temperature: thermodynamic, petrologic and geochemical effects // Precambr. Res. 2014. V. 253. P. 6–16.
Markl G., Bucher K. Composition of fluids in the lower crust inferred from metamorphic salt in lower crustal rocks // Nature. 1998. V. 391. P. 781–783.
Newton R.C., Aranovich L.Ya., Touret J.L.R. Streaming of saline fluids through Archean crust: Another view of charnokite-granite relations in southern India // Lithos. 2019. V. 346–347. 105157. P. 1–10.
Pistorius C.W.F.T. Effect of Pressure on the Melting Points of the Sodium Halides // J. Chem. Phys. 1966. V. 45. P. 3513–3519.
Shmulovich K.I., Graham C.M. An experimental study of phase equilibria in the system H2O–CO2–NaCl at 800°C and 9 kbar // Contrib. Mineral. Petrol. 1999. V. 136. P. 247–257.
Shmulovich K.I., Graham C.M. An experimental study of phase equilibria in the systems H2O–CO2–CaCl2 and H2O–CO2–NaCl at high pressures and temperatures (500–800°C, 0.5–0.9 GPa): geological and geophysical applications // Contrib. Mineral. Petrol. 2004. V. 146. P. 450–462.
Simon F.E., Glatzel G. Bemerkungen zur Schmelzdruckkurve // Z. Anorg. Allgem. Chem. 1929. Bd. 178. S. 309–316.
Span R., Wagner W. A new equation of state for carbon dioxide covering the fluid region from the triple-point temperature to 1100 K at pressures up to 800 MPa // J. Phys. Chem. Ref. Data. 1966. V. 25. P. 1509–1596.
Sun R., Dubessy J. Prediction of vapor–liquid equilibrium and PVTx properties of geological fluid system with SAFT-LJ EOS including multi-polar contribution. Part II: Application to H2O–NaCl and CO2–H2O–NaCl system // Geochim. Cosmochim. Acta. 2012. V. 88. P. 130–145.
Trommsdorff V., Skippen G., Ulmer P. Halite and sylvite as solid inclusions in high-grade metamorphic rocks // Contrib. Mineral. Petrol. 1985. V. 89. P. 24–29.
Wagner W., Pruß A. The IAPWS formulation 1995 for the thermodynamic properties of ordinary water substance for general and scientific use // J. Phys. Chem. Ref. Data. 2002. V. 31. P. 387–535.
Дополнительные материалы отсутствуют.


