Петрология, 2021, T. 29, № 1, стр. 104-109
Форма выделений металлического железа в экспериментальных стеклах: не верь глазам своим?
А. А. Борисов *
Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
Москва, Россия
* E-mail: aborisov@igem.ru
Поступила в редакцию 25.02.2020
После доработки 15.03.2020
Принята к публикации 21.05.2020
Аннотация
При температуре 1400°С и общем давлении 1 атм. проведено экспериментальное исследование форм выделения металлического железа, выпадающего из расплава при резком уменьшении fO2. Летучесть кислорода в опытах задавалась газовой смесью СО/СО2. Показано, что первоначально металлическое железо представлено хорошо ограненными кристаллами, большей частью связанными в “сетку”, расположенную вблизи поверхности расплава. При увеличении длительности опыта железо теряет четко выраженную кристаллическую форму. Скопления железа при большом увеличении создают полную иллюзию того, что исходное железо до закалки было расплавленным, хотя температура опытов поддерживалась на 140°С ниже точки плавления чистого железа. Рассмотрены экспериментальные работы с похожими результатами.
ВВЕДЕНИЕ
Взаимное расположение фаз и их габитус в магматических породах несут информацию о порядке кристаллизации и, частично, о температуре кристаллизации минералов из расплава. Принято считать, что если кристалл фазы А образует включение в кристалле фазы В, то А кристаллизовался раньше В. Если фаза С (металл, сульфид) образует каплевидные выделения в окружающем стекле/породе, то температура, с которой произошла закалка расплава, предполагается выше точки плавления С. Аналогично, если фаза С имеет четко выраженные кристаллические формы, то мы можем предположить, что температура расплава была ниже точки плавления С.
Представленные ниже экспериментальные факты и фотографии призваны показать, что к наблюдаемым взаимоотношениям фаз в породе (текстурно-структурным) не всегда применима стандартная интерпретация.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
Эксперименты выполнены в вертикальной трубчатой печи с регулированием летучести кислорода в Институте геологии и минералогии Кельнского Университета (Кельн, Германия). Для задания необходимого значения fO2 была использована газовая смесь CO/CO2 и для определения температуры в рабочей зоне печи – термопара типа ТПР. Погрешности в определении температуры и lgfO2 не превышали ±2°C и ±0.2 соответственно.
Эксперименты выполнены методом петли, т.е. путем насыщения железом исходного расплава, висящего внутри железной петли диаметром около 2.5 мм. Петли были изготовлены из узких полос (1–1.5 мм) фольги толщиной 0.1 мм (чистота металла (Fe) не хуже 99.95%, производство Chempure®).
В качестве базового модельного силиката использовался расплав состава эвтектики в системе диопсид–анортит (DA). Этот состав был ранее использован в экспериментах (Borisov et al., 2006), поэтому растворимость железа в нем хорошо известна. Напомним, что температура плавления чистого железа составляет 1538°С, температура плавления состава DA – около 1274°С.
Исходная задача – определение времени достижения равновесия методом подхода с двух сторон. Эксперименты были выполнены следующим образом. Два образца состава DA на железных петлях были выдержаны при 1400°С и 10–11.8 атм. в течение 4 ч и закалены. Мы не анализировали содержание железа в данных стеклах, однако аналогичный состав при сходных условиях, исследованный в работе (Borisov et al., 2006), содержит 6.54 мас. % FeO. В дальнейшем эти образцы использовались для опытов при той же температуре 1400°С, но существенно более низкой летучести кислорода (10–12.6 атм.), где ожидаемая растворимость железа составляет около 3 мас. % FeO. Иными словам, данные образцы с исходно более высоким содержанием железа обеспечивали подход к равновесию сверху (обратимые опыты). В паре с исходно высокожелезистыми образцами в экспериментах был использован исходно безжелезистый состав, обеспечивая подход к равновесию снизу (прямые опыты). Одна пара (DAFe-62 и DAFeR-62) выдержана в течение двух часов, другая пара (DAFe-60 и DAFeR-60) – при тех же условиях, но в течение 16 ч. Дополнительно проведено два прямых опыта длительностью 1 и 4 ч. Закаленные образцы представляют собой стеклянные таблетки диаметром 2.5 мм и толщиной 1–1.5 мм, обернутые железной фольгой по всему диаметру. Таблетки образцов плашмя уложены в шашку, залиты эпоксидной смолой, отполированы и приготовлены для анализа.
Анализ выполнен на микрозонде JEOL Superprobe (Институт геологии и минералогии Кельнского Университета, Кельн, Германия), при этом природный альбит, корунд и диопсид, а также металлическое железо были использованы в качестве стандартов. Ускоряющее напряжение составляло 15 кВ, ток зонда 15 нА и время счета 40 с. От 7 до 10 точек было проанализировано в каждом образце, усредненные данные наряду с условиями опытов приведены в табл. 1.
Таблица 1.
Экспериментальные условия и составы экспериментальных стекол (мас. %)
| Образец | Выд. | SiO2 | Al2O3 | FeO | s.d. | MgO | CaO | Сумма |
|---|---|---|---|---|---|---|---|---|
| DAFe-63 | 1.0 | 50.22 | 15.08 | 2.02 | 0.03 | 10.40 | 23.20 | 100.93 |
| DAFe-62 | 2.0 | 49.65 | 14.87 | 2.43 | 0.02 | 10.29 | 22.99 | 100.23 |
| DAFeR-62 | То же | 49.73 | 14.73 | 3.55 | 0.04 | 10.11 | 22.76 | 100.87 |
| DAFe-61 | 4.0 | 49.32 | 14.82 | 2.79 | 0.03 | 10.31 | 22.92 | 100.16 |
| DAFe-60 | 16.0 | 49.05 | 14.91 | 3.08 | 0.02 | 10.35 | 23.07 | 100.46 |
| DAFeR-60 | То же | 49.03 | 14.91 | 3.23 | 0.03 | 10.28 | 23.03 | 100.48 |
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ИХ ОБСУЖДЕНИЕ
Время достижения равновесия металл/расплав
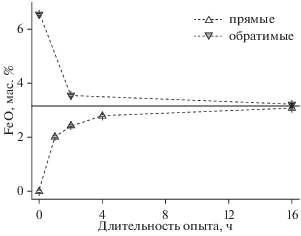
На рис. 1 представлены результаты опытов по растворимости железа в зависимости от времени выдержки. Как видно из рис. 1, для достижения равновесия в гаплобазальтовом расплаве DA при температуре 1400°C требуется минимум 8 ч. Для этой выдержки среднее содержание FeO (3.16 мас. %) близко к таковому в прямом (3.08 ± 0.02%) и обратимом (3.23 ± 0.03%) опытах, хотя и несколько выходит за пределы ошибки анализа. Интересно, что для опытов с длительностью 2 ч подход сверху дает “более равновесные” результаты (избыток FeO относительно равновесного содержания составляет 0.39%), чем подход снизу (дефицит FeO относительно равновесного содержания составляет 0.73%).
Формы выделения металлического железа в обратимых опытах
Принимая вес экспериментальных стекол за 15–20 мг, можно подсчитать, что из расплава, предварительно наплавленного при 10–11.8 атм., в ходе обратимых экспериментов при 10–12.6 атм. выпало 0.3–0.5 мг железа в виде металла. Содержание FeO в данных стеклах не превышает 3.6 мас. %, при этом доля Fe2O3 пренебрежимо мала (рассчитанное по модели (Borisov et al., 2018) соотношение Fe3+/Fetot < < 0.009). Экспериментальные стекла прозрачные, бледно-голубого цвета. Выпавшее металлическое железо в стеклах может быть изучено с помощью оптического микроскопа. Общий вид образцов DAFeR-62 и DAFeR-60 показан на рис. 2. Поскольку выпадение железа в ходе обратимых опытов начиналось с поверхности расплава, висящего в петле, в закаленных образцах оно должно быть сконцентрировано вблизи поверхности стеклянной таблетки. Одна поверхность таблетки отполирована, но выделения металлического железа, сконцентрированные на другой поверхности, хорошо видны сквозь прозрачное стекло образцов.
Рис. 2.
Общий вид образцов DAFeR-62 (a) и DAFeR-60 (б). Размер петель – около 2.5 мм. Выделения металлического железа, сконцентрированные на поверхности, хорошо видны сквозь прозрачное стекло образцов.

Из рис. 2 видно, что опыты с длительностью 2 и 16 ч резко отличаются. В образце DAFeR-62 кристаллы железа размером около 15 мкм четко выражены и связаны в своеобразную “сеть”, покрывающую почти всю поверхность стекла. В образце DAFeR-60 “сеть” сильно разрушена, а выделения железа потеряли кристаллический габитус. Разница между образцами еще более заметна при большом увеличении (рис. 3). В образце DAFeR-62 не вызывает сомнения кристаллическая природа выделений железа. Напротив, в образце DAFeR-60 форма скоплений железа создает полную иллюзию того, что исходное железо до закалки было расплавленным. Еще раз подчеркнем, что температура опытов (1400°С) поддерживалась примерно на 140°С ниже точки плавления чистого железа.
Рис. 3.
Вид образцов DAFeR-62 (а) и DAFeR-60 (б) при большом увеличении. Возрастание выдержки с 2 до 16 ч приводит к потере железом кристаллической формы. Скопления металла приобретают “псевдорасплавную” форму.

Состав железа на зонде не анализировался, и мы не можем сказать, насколько чистым является данный металл. В данной серии единственной потенциально опасной микропримесью является углерод. В соответствие с фазовой диаграммой Fe–C (например, Okamoto, 1992) при 1400°С уже 1.7 мас. % С в сплаве достаточно для его полного плавления. Содержание углерода в металле на солидусе аустенит + расплав еще ниже, около 0.7 мас. %.
Содержание углерода в жидких и твердых сплавах представляет большой интерес для металлургии чугуна и стали, потому многократно исследовалось. Мы воспользовались первичными данными (Ban-ya et al., 1970) по растворимости углерода в твердом железе в равновесии с газовой фазой СО-СО2 в температурном интервале 900–1400°С. Авторы предположили, что насыщение железа углеродом из газовой фазы протекает в соответствии с реакцией:
(1)
${\text{C}}{{{\text{O}}}_{2}}\left( {\text{g}} \right) + {\text{C}}\left( {{\text{in}}\,\,\gamma {\text{ - Fe}}} \right) = 2{\text{CO}}\left( {\text{g}} \right).$Тогда константа реакции (1) равна:
(3)
${{X}_{{\text{C}}}} = {{\left( {{{p_{{{\text{CO}}}}^{2}} \mathord{\left/ {\vphantom {{p_{{{\text{CO}}}}^{2}} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{p_{{{\text{CO}}}}^{2}} \mathord{\left/ {\vphantom {{p_{{{\text{CO}}}}^{2}} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right)} {\left( {K{{\gamma }_{{\text{C}}}}} \right)}}} \right. \kern-0em} {\left( {K{{\gamma }_{{\text{C}}}}} \right)}}.$(4)
${{{\text{С}}\left( {{\text{мас}}{\text{.}}\,\,\% } \right) = 0.000865p_{{{\text{CO}}}}^{2}} \mathord{\left/ {\vphantom {{{\text{С}}\left( {{\text{мас}}{\text{.}}\,\,\% } \right) = 0.000865p_{{{\text{CO}}}}^{2}} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}} + 0.026.$В соответствие с уравнением (4) солидус аустенит + + расплав (С ≈ 0.7 мас. %) будет достигнут в опытах, где в газовой фазе соотношение ${{p_{{{\text{CO}}}}^{2}} \mathord{\left/ {\vphantom {{p_{{{\text{CO}}}}^{2}} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}$ = 780. Для наших опытов (${{p_{{{\text{CO}}}}^{2}} \mathord{\left/ {\vphantom {{p_{{{\text{CO}}}}^{2}} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}$ = 99) ожидаемое содержание углерода в железе составляет лишь 0.112 мас. %. Таким образом, вхождение углерода в железо не может являться причиной плавления исходных кристаллов железа. Да и сами опыты, напоминаем, выполнены в железных петлях. В случае существенного вхождения углерода в металлические петли они бы разрушились, и эксперименты были бы утеряны.
Какова причина образования расплавоподобных форм выделения металлического железа в длительных опытах?
У нас нет однозначного ответа на этот вопрос. Скорее всего, работает механизм коалесценции, описанный для пересыщенных растворов, т.е. рост более крупных зерен за счет растворения мелких (Лифшиц, Питаевский, 1979, §100). Известно также, что, несмотря на малый размер петель и практически полное отсутствие температурного градиента в рабочей зоне печи, в металлических петлях наблюдается конвекция расплава (Borisov, 2001). Иными словами, в нашем случае конвекция помогает диффузии в процессе поглощения мелких кристаллов железа более крупными образованиями. Вероятно, в экспериментах с существенно более длительной выдержкой мы бы увидели одно или несколько крупных каплевидных скоплений железа. Возможно также, что для кристаллов существенно меньшего размера, чем наши (15 мкм), время приобретения ими “псевдорасплавной” формы значительно уменьшается.
Расплавоподобные скопления металла, полученные ниже точки его плавления, известны в экспериментальной практике, хотя авторы работ зачастую не акцентируют на этом внимание. В начале 90-х годов прошлого столетия, в интересах будущих поселений человека на Луне, разрабатывались методы производства кислорода из местных лунных материалов (Taylor, Carrier, 1992). Было показано, что наиболее перспективным является процесс высокотемпературного восстановления лунных пород и минералов водородом. Поскольку реакция восстановления:
(5)
${\text{FeO}}\left( {{\text{ильменит, реголит, лунное стекло и т}}{\text{.п}}{\text{.}}} \right) + {{{\text{H}}}_{2}} = {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{Fe}}\left( {{\text{металл}}} \right)$сопровождается образованием металлического железа, эти работы представляют интерес для данного обсуждения. М. Гибсон с соавторами (Gibson et al., 1994) проводил эксперименты в температурном интервале 900–1050°С по восстановлению водородом толченого лунного базальта (обр. 70035), состоящего преимущественно из плагиоклаза, клинопироксена и ильменита. Интересно, что выделения железа на поверхности ильменита при большом увеличении (см. Fig. 5 in Gibson et al., 1994) имеют каплевидную (диаметром 1–3 мкм) и червеобразную (длинной до 20 мкм) форму и в чем-то напоминают выделения железа на рис. 3б в настоящей статье). С. Аллен с соавторами (Allen et al., 1994) провел аналогичные эксперименты с высокотитанистой лунной почвой (фракция с размером зерен <250 мкм) и высокожелезистым лунным вулканическим стеклом (средний размер зерен 40 мкм) в интервале температур 900–1100°С. После восстановления водородом на поверхностях фаз также наблюдались субмикронные выделения металлического железа каплевидной формы.
Наиболее интересный пример, найденный нами в литературе, описан в (Roedder, Weiblen, 1971) и включен ими в раздел “Нерешенные проблемы”. Авторы исследовали расплавные включения размером 5–50 мкм в лунных (Аполлон 11 и Аполлон 12) и земных (Гавайи) оливинах. В некоторых включениях после нагрева они обнаружили шарики почти чистого железа, хотя температура гомогенизации была как минимум на 300°С ниже точки плавления железа. Позднее М. Сато (Sato, 1976) предположил, что проблема, поставленная в (Roedder, Weiblen, 1971), может быть решена, если допустить, что ликвидусный оливин захватывал чешуйки графита, стабильного при высоких давлениях. При гомогенизации такого включения при нормальном давлении графит восстанавливает железо в виде жидкого сплава Fe-C. При дальнейшем росте эти шарики становятся все менее и менее насыщены углеродом, приближаясь к почти чистому железу. Мы не отрицаем возможную роль углерода в восстановлении FeO в расплаве включения до металла, хотя и иные восстановители (по крайней мере, для лунных пород) широко обсуждаются в литературе и подробно рассмотрены в статье (Sato, 1976). Заметим только, что наши наблюдения показывают, что железо (неважно, каким образом полученное) изначально вполне может иметь вид четко выраженных кристаллов. Однако в ходе высокотемпературной выдержки микронные и субмикронные кристаллы могут быстро приобретать “псевдорасплавную” форму.
ЗАКЛЮЧЕНИЕ
На установке с регулируемой летучестью кислорода при 1400°С проведено экспериментальное исследование форм выделения металлического железа, выпадающего из расплава при резком уменьшении летучести кислорода.
Показано, что первоначально металлическое железо представлено хорошо ограненными кристаллами, большей частью связанными в “сетку”, расположенную на поверхности расплава. При увеличении длительности опыта железо теряет четко выраженную кристаллическую форму. Скопления железа при большом увеличении создают полную иллюзию того, что исходное железо до закалки было расплавленным, хотя температура опытов поддерживалась на 140°С ниже точки плавления железа.
Благодарности. Автор благодарен И.П. Солововой за помощь с фотографиями образцов и А.В. Гирнису за критические замечания, способствовавшие улучшению данной статьи.
Список литературы
Лифшиц Е.М., Питаевский Л.П. Физическая кинетика. М.: Наука. Гл. ред. физ.-мат. лит., 1979. Т. X. 528 с.
Allen C.C, Morris R.V., McKay D.S. Experimental reduction of lunar mare soil and volcanic glass // Journal of Geophysi-cal Research. 1994. V. 99. P. 23173–23185.
Ban-ya S., Elliott J.F., Chipman J. Thermodynamics of austenitic Fe–C alloys // Metallurgical and Material Transactions. 1970. V. 1. P. 1313–1320.
Borisov A. Loop technique: dynamic of metal/melt equilibration // Mineralogy and Petrology. 2001. V. 71. P. 87–94.
Borisov A., Lahaye Y., Palme H. The effect of sodium on the solubilities of metals in silicate melts // American Mineralo-gist. 2006. V. 91. P. 762–771.
Borisov A., Behrens H., Holtz F. Ferric/ferrous ratio in silicate melts, a new model for 1 atm data with special emphasis on the effects of melt composition // Contribution to Mineralogy and Petrology. 2018. V. 173. Article 98.
Gibson M.A., Knudsen C.W., Brueneman D.J. et al. Reduction of lunar basalt 70035: Oxygen yield and reaction pro-duct analysis // Journal of Geophysical Research. 1994. V. 99. P. 10887–10897.
Okamoto H. The C-Fe (Carbon-Iron) System // Journal of Phase Equilibria. 1992. V. 13. P. 543–564.
Roedder E., Weiblen P.W. Petrology of silicate melt inclusions, Apollo 11 and Apollo 12 and terrestrial equivalents // Lunar Science Conference Proceedings. 1971. V. 2. P. 507–528.
Sato M. Oxygen fugacity and other thermochemical parame-ters of Apollo 17 high-Ti basalts and their implications on the reduction mechanism // Lunar Science Conference Proceedings. 1976. V. 7. P. 1323–1344.
Taylor L.A., Carrier III W.D. The feasibility of processes for the production of oxygen on the Moon // Eds. W.Z. Sadeh, S. Sture, R.J. Miller. Engineering, Construction and Operations in Space III, American Society of Civil Engineers. N.Y., 1992. P. 752–762.
Дополнительные материалы отсутствуют.